水溶液中的离子平衡图像分析题
- 格式:docx
- 大小:549.62 KB
- 文档页数:34

目夺市安危阳光实验学校微考点67 难溶电解质溶度积常数及图像1.如图所示表示的是难溶氢氧化物在不同pH 下的溶解度[S /mol·L -1]。
下列说法正确的是( )A .pH =3时溶液中铁元素的主要存在形式是Fe3+B .若Ni(NO 3)2溶液中含有少量的Co 2+杂质,可通过调节溶液pH 的方法来除去 C .若分离溶液中的Fe 3+和Cu 2+,可调节溶液的pH 在4左右D .若在含有等物质的量浓度的Cu 2+和Ni 2+的溶液中加入烧碱,Ni(OH)2优先沉淀2.(2019·广东仲元中学模拟)已知:①t ℃时AgCl 的K sp 为2×10-10;②在t ℃时,Ag 2CrO 4在水中的沉淀溶解平衡曲线如图所示。
下列说法正确的是( )A .t ℃时,Ag 2CrO 4的K sp 为1×10-9B .在饱和Ag 2CrO 4溶液中加入K 2CrO 4可使溶液由Y 点到X 点C .t ℃时,反应Ag 2CrO 4(s)+2Cl -(aq)2AgCl(s)+CrO 2-4(aq)的平衡常数K=2.5×107D .t ℃时,用0.01mol·L -1AgNO 3溶液滴定20mL0.01mol·L -1KCl 和0.01mol·L-1的K 2CrO 4的混合溶液,CrO 2-4先沉淀3.(2019·宁德质量检测)常温下将0.1000mol·L -1的AgNO 3溶液分别滴加到20mL 浓度均为0.1000mol·L -1的NaCl 和NaBr 溶液中,混合溶液的pAg[-lgc (Ag +)]与滴定百分数(滴定所用溶液体积相对于滴定终点时所用溶液体积的百分数)的变化关系如图所示。
下列叙述错误的是( ) A .曲线a 代表滴定NaBr 溶液 B .K sp (AgCl)=1×10-9.5C .滴定至50%时,NaCl 溶液中c (Na +)>c (NO -3)>c (Ag +)>c (H +) D .滴定至100%时,NaBr 溶液中c (H +)+c (Ag +)=c (Br -)+c (OH -)4.(2019·宜宾模拟)t ℃时,AgCl(s)与AgI(s) 分别在溶液中达到沉淀溶解平衡,相关离子浓度的关系如图所示。

定额市鞍钢阳光实验学校专题16 水溶液中的离子平衡1.【高考海南卷】向含有MgCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是()A.c(CO32−)B.c(Mg2+) C.c(H+) D.K sp(MgCO3)【答案】A考点:考查难溶电解质的溶解平衡及K sp【名师点睛】难溶电解质的溶解平衡是这几年高考的热点,掌握难溶电解质的溶解平衡及溶解平衡的应用,并运用平衡移动原理分析、解决沉淀的溶解和沉淀的转化问题,既考查了学生的知识迁移能力、动手实验的能力,又考查了学生实验探究的能力和逻辑推理能力。
本题较基础,只需把握平衡移动原理即可得到结论。
2.【高考江苏卷】下列图示与对应的叙述不相符合....的是()A.图甲表示燃料燃烧反应的能量变化B.图乙表示酶催化反应的反应速率随反应温度的变化C.图丙表示弱电解质在水中建立电离平衡的过程D.图丁表示强碱滴定强酸的滴定曲线【答案】A【考点定位】本题主要是考查化学图像分析,热化学,化学反应速率,溶液中的离子平衡等有关判断【名师点晴】掌握有关的化学反应原理,明确图像中曲线的变化趋势是解答的关键。
注意酶的催化效率与温度的关系,温度太高或太低都不利于酶的催化。
注意电离平衡也是一种动态平衡,当溶液的温度、浓度以及离子浓度改变时,电离平衡都会发生移动,符合勒·夏特列原理。
3.【高考上海卷】能证明乙酸是弱酸的实验事实是()A.CH3COOH溶液与Zn反应放出H2B.0.1mol/L CH3COONa溶液的pH大于7C.CH3COOH溶液与NaCO3反应生成CO2D.0.1 mol/L CH3COOH溶液可使紫色石蕊变红【答案】B【解析】试题分析:A.只能证明乙酸具有酸性,不能证明其酸性强弱,错误;B.该盐水溶液显碱性,由于NaOH是强碱,故可以证明乙酸是弱酸,正确;C.可以证明乙酸的酸性比碳酸强,但是不能证明其酸性强弱,错误;D.可以证明乙酸具有酸性,但是不能证明其酸性强弱,错误。




水溶液中的离子平衡图像分析题考试范围:xxx;考试时间:100分钟;命题人:xxx注意事项:1.答题前填写好自己的姓名、班级、考号等信息2.请将答案正确填写在答题卡上第Ⅰ卷选择题请点击修改第I卷的文字说明评卷人得分一.选择题共40小题1.常温下;将0.10mol•L﹣1盐酸慢慢加入到20.00mL浓度为0.10 mol•L﹣1 CH3COONa溶液中;所得溶液pH变化曲线如图所示忽略体积变化..下列说法不正确的是A.点①所示溶液中由水电离产生的cOH﹣=10﹣5.5 mol•L﹣1B.点②所示溶液中:cNa+=cCl﹣+cCH3COO﹣C.点③所示溶液中:cNa+>cCl﹣>cCH3COO﹣=cCH3COOHD.点④所示溶液中:cNa++cCH3COOH+cH+>0.10 mol•L﹣1第1页(共37页)第2页(共37页)2.常温下;100mL 0.1mol/L的H2A溶液中滴加0.1mol/L NaOH溶液;含A元素相关微粒物质的量随pH的变化如图所示;下列说法正确的是A.H2A在水中的电离方程式是:H2A=H++HA﹣;HA﹣⇌H+A2﹣B.等体积等浓度的NaOH溶液与H2A溶液混合后;其溶液中水的电离程度比纯水大C.Y点溶液中存在以下关系:cNa+>cHA﹣=cA2﹣>cOH﹣>cH+D.X点溶液中含A元素相关离子:cH2A+cHA﹣+cA2﹣=0.1mol/L3.常温下将NaOH溶液添加到己二酸H2X;为二元弱酸溶液中;混合溶液的pH与离子浓度变化的关系如图所示..下列叙述正确的是A.己二酸电离常数Ka1H2X约为10﹣4.4B.曲线M表示pH与lg的变化关系C.当溶液中cX2﹣=cHX﹣时;溶液为碱性D.当混合溶液呈中性时;cNa+>cHX﹣>cX2﹣>cOH﹣=cH+第3页(共37页)第4页(共37页)4.已知:pBa2+=﹣lgcBa2+;pK a=﹣lgK a.向20mL0.1 mol/L BaCl2溶液中滴加0.2mol/LNa2CO3溶液的滴定曲线如图所示;下列描述错误的是常温下;H2CO3的电离常数pK a1=6.4;pk a2=10.3:K sp BaSO4=1.1×10﹣10A.在碳酸钠溶液中;K h1CO32﹣=10×10﹣3.7B.根据曲线数据计算可知K sp BaCO3的数量级为10﹣9C.相同条件下;若改为0.15 mol/L BaCl2溶液;反应终点F移到K点D.相同条件下;若改为0.2 mol/L Na2SO4溶液;反应终点F移向H方向移动5.在25℃时;甘氨酸在水溶液中解离方程式如下:当调节溶液的pH使甘氨酸所带的净电荷为零;此时溶液的pH叫等电点..其物质的量分数α随溶液pH变化的关系如图所示..下列说法中正确的是A.K2=10﹣2.34;且K2对应的解离基团为﹣NH3+B.甘氨酸的等电点pH约为6;且存在cA±=cA+=cA﹣C.pH=7;cA±>cA+>cA﹣D.甘氨酸晶体熔点较高;主要是因为晶体中羧基与氨基之间形成内盐第5页(共37页)6.在25℃时;向20mL 0.2mol•L﹣1的氢氟酸中滴加0.2 mol•L﹣1的NaOH溶液时;溶液的pH变化如图所示..已知:H+aq+OH﹣aq=H2Ol△H=﹣a kJ•mol﹣1;HFaq=H+aq+F﹣ag△H=+b kJ•mol﹣1..下列说法不正确的是A.氢氟酸是一种弱酸B.在A处溶液中:cF﹣+cHF>0.1mol•L﹣1C.OH﹣aq+HFaq=H2Ol+F﹣aq△H=﹣a﹣bkJ•mol﹣1D.A点时水的电离程度大于B点时水的电离程度7.常温下;用0.01000 mol•L﹣1的盐酸滴定0.01000 mol•L﹣1 NaA溶液20.00mL.滴定曲线如图所示;下列说法正确的是A.a点到d点的过程中;等式cHA+cA﹣=0.01000 mol•L﹣1恒成立B.b点时;溶液中微粒浓度大小关系为:cA﹣>cCl﹣>cHA>cOH﹣>cH+第6页(共37页)C.c点时;溶液中微粒浓度存在关系:cNa++cH+=cHA+cOH﹣+2cA﹣D.d点时;溶液中微粒浓度存在关系:cOH﹣+cA﹣=cH+8.298K时;用0.1000mol•L﹣1盐酸滴定20.00mL0.1000mol•L﹣1ROH溶液;所得溶液的pH与lg的关系如图所示..下列说法正确的是A.298K时;ROH的电离常数K b=1.0×10﹣9.3B.本实验宜选用酚酞溶液作指示剂C.Z点为滴定终点D.Y点溶液中cCl﹣<cR+第7页(共37页)9.H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数平衡时某物种的浓度占各物种浓度之和的分数与pH 的关系分别如图1和图2所示:下列说法正确的是A.H3AsO3的pK a1=9.2pK a1=﹣lgK a1B.NaH2AsO3溶液中:cOH﹣=cH++cH3AsO3C.NaH2AsO4溶液中:cH+>cOH﹣D.H3AsO4溶液中滴入NaOH溶液至pH>11.5时;cAsO43﹣>H2AsO4﹣>c HAsO42﹣10.25℃时;向Na2CO3溶液中滴入盐酸;混合溶液的pH与离子浓度变化的关系如图所示..已知:lgX=lg或lg;下列叙述正确的是A.曲线m表示与pH与的变化关系B.NaHCO3溶液中cCO32﹣>cH2CO3C.当溶液呈中性时;cNa+=cHCO3﹣+2cCO32﹣D.25℃时;HCO3﹣+H2O⇌H2CO3+OH﹣的平衡常数为1.0×10﹣7.6第8页(共37页)第9页(共37页)11.常温下;向20mL0.2 mol•L﹣1H2A溶液中滴加0.2 mol•L﹣1 NaOH溶液;含A元素的有关微粒物质的量变化如图所示..根据图示判断;下列说法正确的是A.H2A在水中的电离方程式H2A=H++HA﹣;HA⇌H++A2﹣B.当VNaOH溶液=20mL时;溶液中各粒子浓度的大小顺序:cNa+>cHA﹣>cH+>cOH﹣C.当VNaOH溶液=30mL时;溶液中存在以下关系:2cH++cHA﹣+2cH2A=cA2﹣+2cOH﹣D.等体积等浓度的NaOH溶液与H2A溶液混合后;其溶液中水的电离程度比纯水大12.某温度下;HA和HB的电离常数分别为5.0×10﹣4和1.7×10﹣5.将pH和体积均相同的两种酸溶液分别稀释;其pH随加水体积的变化如图所示..下列叙述正确的是A.曲线Ⅰ对应的溶液中存在:HB═H++B﹣B.溶液中水的电离程度:b点>c点C.从c点到d点;溶液中保持不变第10页(共37页)D.相同体积a点的两溶液分别与NaOH恰好中和后;溶液中nNa+相同第11页(共37页)13.AlPO4的沉淀溶解平衡曲线如图所示..下列说法不正确的A.T1>T2B.AlPO4在b点对应的溶解度大于c点C.图中四个点的K sp:a=c=d<bD.T1温度下;在AlPO4的饱和溶液中加入ACl3可使溶液由c点变到a点14.室温下;向10mL0.1000mol•L﹣1NaOH溶液中逐滴加入0.1000mol•L﹣1的某一元酸HX;溶液pH变化曲线如图..下列说法不正确的是A.等浓度的HX、NaX混合溶液中;HX的电离程度大于X﹣的水解程度B.c点所示溶液中存在:2cH+﹣2cOH﹣=cX﹣﹣cHEC.a、b、c点所示溶液中;由水电离出的cH+•cOH﹣值不变第12页(共37页)D.a→c点所示溶液中;cX﹣+cHX+cNa+=0.1000mol•L﹣1始终成立第13页(共37页)15.常温下;向20.00mL 0.1mol•L﹣1的甲胺CH3NH2溶液中滴加0.1 mol•L﹣1的盐酸;混合溶液的pH与相关微粒浓度比值的对数关系如图所示..下列说法不正确的是A.滴加盐酸10.00mL时;CH3NH2•H2O的电离程度大于CH3NH3+的水解程度B.滴定过程中水的电离程度先增加后减小C.滴加盐酸20.00mL时;cCl﹣>cCH3NH3+>cCH3NH2•H2O>cH+>cOH﹣D.常温下;CH3NH2•H2O的电离常数为K b;则pK b=﹣1 g K b=3.416.H2C2O4为二元弱酸..20℃时;配制一组cH2C2O4+cHC2O4﹣+cC2O42﹣=0.100mol•L﹣1的H2C2O4和NaOH混合溶液;溶液中部分微粒的物质的量浓度随PH的变化曲线如图所示下列指定溶液中微粒的物质的量浓度关系一定正确的是A.K2H2C2O4的数量级为10﹣4B.cNa+=0.100mol•L﹣1的溶液中cH++cH2C2O4=cOH﹣+cC2O42﹣第14页(共37页)C.cHC2O4﹣=cC2O42﹣的溶液中c Na+>0.100 mol•L﹣1+cHC2O4﹣D.PH=7.0的溶液中:cNa+=2cC2O42﹣第15页(共37页)17.常温时;100mL 0.10 mol•L﹣1H2A溶液用0.10mol•L﹣1的NaOH溶液滴定;滴定曲线如图所示..已知:pK a =﹣lgK a.下列说法不正确的是A.可用酚酞作滴定指示剂B.NaHA溶液呈酸性C.反应H2A+A2﹣⇌2HA﹣的平衡常数K=105.6D.Y点溶液中:cNa+=cOH﹣+3cHA﹣﹣cH+18.室温下两种一元弱酸中分子的物质的量分数δδHA=随pH的变化关系如图所示..下列判断正确的是A.水的电离程度:M=NB.HX的电离常数K;HX=1.0×10﹣5.5C.P点溶液中存在:cHX>cOH﹣>cX﹣第16页(共37页)D.等浓度的HY和NaY混合溶液中存在:cH+>cOH﹣第17页(共37页)19.常温下;将NaOH溶液滴入某一元酸HA溶液中;测得混合溶液的pH与离子浓度变化关系如图所示已知p=﹣lg.下列叙述不正确的是A.K a HA的数量级为10﹣5B.滴加NaOH溶液的过程中;保持不变C.m点所示溶液中cH++cNa+=cHA+cOH﹣D.n点所示溶液中:cNa+=cA﹣+cHA20.室温下;将0.01mo•L﹣1的一元酸HA溶液逐滴滴入10mL 0.01mol•L﹣1 NaOH溶液中;测得溶液pH与所加HA溶液体积的关系如图所示..下列说法正确的是A.a点溶液中由水电离出的cOH﹣=1.0×10﹣2mol•L﹣1B.b点所示溶液中:cNa+=cA﹣+cHA=0.01mol•L﹣1C.c点所示溶液中:cA﹣>cNa+>cH+>cOH﹣D.水的电离程度c>b>a第18页(共37页)第19页(共37页)21.常温下;在25mL氢氧化钠溶液中逐滴加入0.2mol•L﹣1醋酸溶液;滴定曲线如图所示下列说法正确的是A.该氢氧化钠溶液的物质的量浓度为0.2 mol•L﹣1B.B点对应的醋酸溶液体积为12.5mLC.D点的溶液中cCH3COO﹣>cNa+>cH+>cOH﹣D.二者恰好完全反应的点位于曲线B、C之间的某点22.常温下向20mL 0.1mol•L﹣1 Na2CO3溶液中逐滴加入0.1mol•L﹣1 HCl溶液40mL;溶液中含碳元素的各种微粒CO2因逸出未画出物质的量分数纵轴随溶液pH变化的部分情况如图所示..下列说法正确的是A.在同一溶液中;H2CO3、HCO3﹣、CO32﹣不能大量共存B.当pH=7时;溶液中各种离子CO32﹣除外的物质的量浓度的大小关系为:cCl﹣>cNa+>cHCO3﹣>cH+=cOH﹣C.0.1mol/L Na2CO3溶液中cOH﹣﹣cH+=cH2CO3+cHCO3﹣D.当pH=8时;NaHCO3溶液的物质的量浓度为0.1mol/L第20页(共37页)23.在25℃时;甘氨酸在水溶液中解离情况如图:改变溶液pH值;三种甘氨酸相关离子的分布分数α;平衡时某物种的浓度占各物种浓度之和的分数变化如图所示..当调节溶液的pH值使甘氨酸所带的净电荷为零;此时溶液的pH叫等电点..下列说法正确的是A.曲线Ⅰ、Ⅱ、Ⅲ分别代表的微粒为A﹣、A±、A+B.K2=10﹣2.34;且K2对应的解离基团为﹣NH3+C.在pH=9.60的溶液中加盐酸;αA±+αA++αA﹣保持不变D.甘氨酸的等电点pH约为6;且存在cA±=cA+=cA﹣24.25℃时;用浓度为0.1000mol•L﹣1的NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L﹣1的HX、HY 溶液;溶液pH随NaOH溶液体积的变化关系如图..下列说法正确的是A.K a HY的数量级为10﹣6第21页(共37页)B.a点时:cY﹣+cHY=0.1000mol•L﹣1C.b点时:cHX>cNa+>cX﹣>cOH﹣>cH+D.当VNaOH=20.00mL时;将所得两溶液混合;则cX ﹣+cY﹣+cOH﹣=cH++2 cNa+第22页(共37页)25.常温下;pH均为2、体积均为V0的HA、HB、HC溶液;分别加水稀释至体积为V;溶液pH随lg的变化关系如图所示;下列叙述错误的是A.常温下:K a HB>K a HCB.HC的电离度:a点<b点C.当lg=4时;三种溶液同时升高温度;减小D.当lg=5时;HA溶液的pH为726.常温下;取三份浓度均为0.1mol/L;体积均为1L的醋酸钠溶液中分别加入氯化铵固体、醋酸铵固体、氯化氢气体后所得溶液pH变化曲线如图溶液体积变化忽略不计;下列说法不正确的是A.曲线a、b、c分别代表加入醋酸铵、氯化铵、氯化氢B.A点处CNa+>cCH3COO﹣>cNH4+>cOH﹣>cH+C.由B点可知KaCH3COOH=KbNH3•H2O第23页(共37页)D.C点处cCH3COO﹣+CCl﹣+cOH﹣>0.1mol/L第24页(共37页)27.25℃时;分别向等体积、等物质的量浓度的NaBr、Na2CrO4溶液中滴加0.01mol•L﹣1 AgNO3溶液;根据溶液中平衡时相关离子浓度的关系图;下列说法错误的是A.AgNO3溶液中;cH+>cOH﹣B.K sp AgBr的数量级为10﹣12C.若向物质的量浓度均为0.01mol•L﹣1的NaBr和Na2CrO4混合溶液中滴加0.01mol•L﹣1 AgNO3溶液;先产生AgBr沉淀D.Ag2CrO4s+2Br﹣aq⇌2AgBrs+CrO42﹣aq平衡常数很大;故该反应趋于完全28.t°C时;已知:K sp AgCl=10﹣10;Ag2CrO4的沉淀溶解平衡曲线如图所示;则下列说法正确的是A.t℃时;Ag2CrO4的K sp数量级为10﹣9B.无法计算Y点与Z点的K spC.Ag2CrO4s+2Cl﹣ag⇌2AgCls+CrO42﹣aq的平衡常数:K=108D.在饱和Ag2CrO4溶液中加入K2CrO4;可使溶液由Y点变到X点最终变到Z点第25页(共37页)第26页(共37页)29.常温下;向20mL0.1mol•L﹣1HA溶液中滴加0.1mol•L﹣1的氨水;溶液的pH随氨水的体积关系如图所示..下列说法不正确的是A.HA的电离方程式为HA=H++A﹣B.B点时加入HA和氨水恰好完全反应C.A点所示溶液中cA﹣=2cNH4++2cNH3•H2OD.C点所示溶液中:cNH4+>cA﹣>cNH3•H2O30.已知:常温下;1K a1H2CO3=4.3×10﹣7;K a2H2CO3=5.6×10﹣11;2H2R及其钠盐的溶液中;H2R、HR﹣、R2﹣分别在三者中所占的物质的量分数α随溶液pH的变化关系如图所示..下列叙述错误的是A.在pH=1.3的溶液中:cNa+<cH2R+2cR2﹣B.等体积等浓度的NaOH溶液与H2R溶液混合后;溶液中水的电离程度比纯水小C.在pH=2的溶液中存在=10﹣3D.向Na2CO3溶液中加入过量H2R溶液;发生反应:CO32﹣+H2R═HCO3﹣+HR﹣第27页(共37页)31.某温度下;向50 mL CuCl悬浊液中慢慢加入NaI固体并搅拌;溶液中cCu+随cI﹣的变化关系曲线如图忽略溶液体积变化;已知:K sp CuI=1.0×l0﹣12;则下列说法正确的是A.CuCl悬浊液中加入NaI固体立即有CuI生成B.x=l0﹣6C.CuI悬浊液中加入淀粉会出现蓝色D.若c点CuCl未完全溶解;则曲线bc段内;cCl﹣:cI﹣=10632.25℃时;将浓度均为0.1mol L、体积分别为V a和V b的HX溶液与NH3•H2O溶液按不同体积比混合;保持V a+V b=100mL;V a、V b与混合液的PH的关系如图所示..下列说法正确的是A.K a HX>K b NH3•H2OB.b点时cNH4+>cHX>cOH﹣=cH+C.a、b、d几点中;水的电离程度d>b>a第28页(共37页)D.a→b点过程中;可能存在cX﹣<cNH4+第29页(共37页)33.常温时;1mol•L﹣1的CH3NH2和1mol•L﹣1的NH2OHNH2OH+H2O⇌NH3OH++OHˉ两种碱溶液;起始时的体积均为10mL;分别向两溶液中加水进行稀释;所得曲线如图所示V表示溶液的体积;pOH=﹣lgcOH﹣..下列说法不正确的是A.NH2OH的电离常数K的数量级为10﹣9B.CH3NH3Cl盐溶液中水解离子方程式为:CH3NH2+H2O⇌CH3NH3++OH﹣C.当两溶液均稀释至lg=4时;溶液中水的电离程度:NH2OH>CH3NH2D.浓度相同的CH3NH3Cl和NH3OHCl的混合溶液中离子浓度大小关系:NH3OH+<cCH3NH3+ 34.25℃时;用0.1 mol•L﹣1NaOH溶液分别滴定10 mL 0.1 mol•L﹣1的一元酸HX和HY;滴定时溶液的pH随加入NaOH溶液体积的变化曲线如图所示..下列说法正确的是A.HX、HY均为弱酸;且K a HX<K a HYB.M、Q、N三点中水的电离:N>Q>MC.P点溶液中存在:cNa+>cY﹣>cHY>cOH﹣第30页(共37页)D.25℃时;Y﹣的水解常数的数量级为10﹣9第31页(共37页)35.已知:pc表示物质的量浓度的负对数..常温下;将amol一元弱酸HA与一定量盐酸或NaOH溶液混合;配制成100mL溶液;所得溶液pH与pcHA、pcA﹣的关系如图所示..下列叙述错误的是A.K a HA=10﹣5B.曲线L1;代表pH与pcA﹣的关系C.水的电离程度:X<Y<ZD.Y点为等物质的量浓度的HA和NaA的混合溶液36.25℃时;甲胺CH3NH2的电离常数pK b=3.38.甲胺是一元弱碱;碱性比NH3•H2O略强;在水中的电离方程式为CH3NH2+H2O⇌CH3NH3++OH﹣.25℃时;向20.0mLx mol﹣1稀硫酸中滴加0.10mol•L﹣1甲胺溶液;混合溶液中水电离的cH+与甲胺溶液体积之间的关系如图所示..下列说法正确的是A.x=0.10、V0=40.0第32页(共37页)B.25℃时;CH3NH32SO4的水解常数pK h=10.62C.N点对应的溶液中cCH3NH3+=2cSO42﹣D.Q点对应的溶液呈碱性第33页(共37页)37.水的电离平衡曲线如图所示;下列说法正确的是A.图中五点K W间的关系:B>C>A=D=EB.若从A点到D点;可采用在水中加入少量NaOH的方法C.若从A点到C点;可采用温度不变时在水中加入适量H2SO4 的方法D.若处在B点时;将pH=2的硫酸与pH=12的KOH等体积混合后;溶液显中性38.已知二元弱碱BOH2在水中存在如下电离平衡:BOH2 ⇌BOH++OH﹣;K b1=10﹣3.75;BOH+⇌B2++OH﹣;K b2=10﹣7.62.常温下;用0.1mol/L盐酸滴定25mL 0.1mol/L的BOH2溶液;得到如图所示的滴定曲线..下列说法不正确的是A.a点所得的溶液中:cBOH2=cBOH+B.b点所得的溶液中:cBOH2+cOH﹣=cB2++cH+C.c点所得的溶液中:cCl﹣<3cBOH+第34页(共37页)D.d点所得的溶液中:cB2+>cBOH+>cBOH2第35页(共37页)39.室温时;向100mL0.1mol/L NH4HSO4溶液中逐滴滴加0.1mol/L NaOH溶液;得到溶液pH与NaOH溶液体积的关系曲线如图所示假设溶液的体积有加和性..下列分析正确的是A.ab段和bc段发生的离子反应一定不同B.水的电离程度最大的是c点C.b点溶液中各离子浓度由大到小的排列顺序是:cNa+>cNH4+>cSO42﹣>cH+=cOH﹣D.NH4+的水解常数K b的能量级为10﹣1040.甲胺CH3NH2是一种一元弱碱;其电离方程式为:CH3NH2+H2O⇌CH3NH3++OH﹣常温下;向20.0mL0.10mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸;混合溶液的pH与相关微粒浓度的关系如图所示..下列说法中错误的是A.b点对应加入盐酸的体积V<20.00mLB.常温下;根据a点可知甲胺的电离平衡常数Kb=10﹣3.4C.b点可能存在关系:cCl﹣>cCH3NH3+>cH+=cOH﹣第36页(共37页)D.V=20.00mL时;溶液呈弱酸性第37页(共37页)。
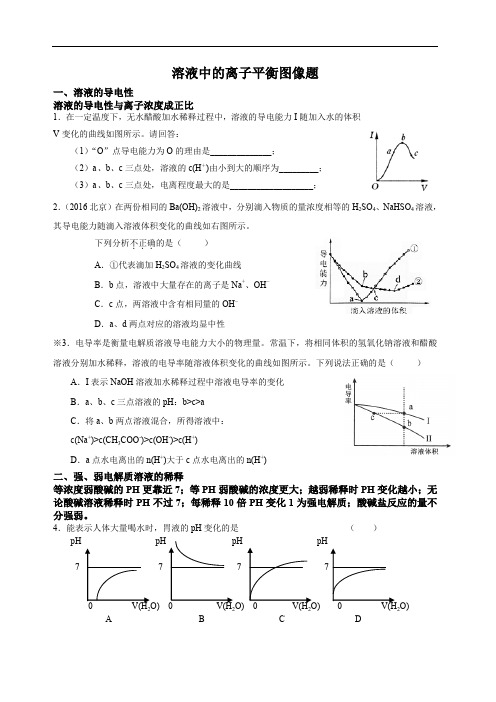
溶液中的离子平衡图像题一、溶液的导电性溶液的导电性与离子浓度成正比1.在一定温度下,无水醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。
请回答:(1)“O”点导电能力为O的理由是______________;(2)a、b、c三点处,溶液的c(H+)由小到大的顺序为_________;(3)a、b、c三点处,电离程度最大的是___________________;2.(2016北京)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如右图所示。
下列分析不正确...的是()A.①代表滴加H2SO4溶液的变化曲线B.b点,溶液中大量存在的离子是Na+、OH–C.c点,两溶液中含有相同量的OH–D.a、d两点对应的溶液均显中性※3.电导率是衡量电解质溶液导电能力大小的物理量。
常温下,将相同体积的氢氧化钠溶液和醋酸溶液分别加水稀释,溶液的电导率随溶液体积变化的曲线如图所示。
下列说法正确的是()A.I表示NaOH溶液加水稀释过程中溶液电导率的变化B.a、b、c三点溶液的pH:b>c>aC.将a、b两点溶液混合,所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)D.a点水电离出的n(H+)大于c点水电离出的n(H+)二、强、弱电解质溶液的稀释等浓度弱酸碱的PH更靠近7;等PH弱酸碱的浓度更大;越弱稀释时PH变化越小;无论酸碱溶液稀释时PH不过7;每稀释10倍PH变化1为强电解质;酸碱盐反应的量不分强弱。
4.能表示人体大量喝水时,胃液的pH变化的是()7 7 7O)2222A B C D5.0.1 mol·L -1的醋酸与0.1 mol·L -1的盐酸,分别稀释相同的倍数,随着水的加入,溶液中c (H +)的变化曲线(如下图)正确的是( )6.某温度下,相同pH 值的盐酸和醋酸溶液分别加水稀释,平衡pH 值随溶液体积变化的曲线如图所示。

易错专题14水溶液中离子平衡图像聚焦易错点:►易错点一稀释图像►易错点二滴定曲线►易错点三K W 、K sp 的图像►易错点四分布系数图像易错点一稀释图像【易错典例】例1(2023·浙江温州·三模)在一定温度下,冰醋酸稀释过程中溶液的导电能力与pH 的变化如图。
下列有关说法中正确的是A .a 点3CH COOH 溶液未达到电离平衡状态B .离子总浓度越大,溶液导电能力越强C .向a 、b 两点溶液中分别滴入同一NaOH 溶液至中性,溶液中的()3n CH COO -相同D .b 点后,溶液中加水稀释,所有离子浓度均减小B 【详解】A .加水稀释过程中,a 点、b 点都达到了电离平衡,故A 错误;B .导电能力与离子浓度和所带电荷数有关,因此离子总浓度越大,溶液导电能力越强,故B 正确;C .根据电荷守恒3n(CH COO )n(OH )n(Na )n(H )--+++=+,溶液呈中性,3n(CH COO )n(Na )-+=,a 点醋酸浓度大,向a 、b两点溶液中分别滴入同一NaOH 溶液至中性,a 点消耗的氢氧化钠溶液比b 点消耗的氢氧化钠溶液多,因此溶液中的()3n CH COO -是a 点大于b 点,故C 错误;D .b 点后,溶液中加水稀释,醋酸根、氢离子浓度减小,氢氧根浓度增大,故D 错误。
【解题必备】稀释图像(pH 与稀释倍数的线性关系)①HY为强酸、HX为弱酸②a、b两点的溶液中:c(X-)=c(Y-)③水的电离程度:d>c>a=b ①MOH为强碱、ROH为弱碱②c(ROH)>c(MOH)③水的电离程度:a>b【变式突破】1.(2023·北京房山·一模)某温度下,将pH和体积均相同的HCl和3CH COOH溶液分别加水稀释,其pH随加水体积的变化如图所示。
下列叙述不正确的是A.稀释前溶液的浓度:()()3HCl CH COOHc c<B.溶液中水的电离程度:b点<c点C.从b点到d点,溶液中()()c H c OH+-⋅逐渐增大D.在d点和e点均存在:()H c c+>(酸根阴离子)C【详解】A.稀释前两溶液的pH值相等,由于醋酸是部分电离,因此溶液的浓度:c(HCl)<c(CH3COOH),故A正确;B.b点pH值小于c点pH值,说明c点酸性弱,抑制水的电离程度小,水的电离程度大,因此溶液中水的电离程度:b点<c点,故B正确;C.从b点到d点,由于溶液的温度不变,因此溶液中c(H+)·c(OH-)不变,故C错误;D.在d点和e点均存在电荷守恒即c(H+)=c(酸根阴离子)+c(OH-),因此存在:c(H+)>c(酸根阴离子),故D正确。

专题09 图形题中水溶液中的离子平衡专题1.常温下,在体积均为20mL 、浓度均为0.1mol·L -1的HX 溶液、HY 溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H +)表示为pH 水=-lgc(H +)水。
pH 水与滴加氢氧化钠溶液体积的关系如图所示。
下列推断正确的是A .HX 的电离方程式为HX =H ++X -B .T 点时c(Na +)=c(Y -)>c(H +)=c(OH -)C .常温下用蒸馏水分别稀释N 、P 点溶液,pH 都降低D .常温下,HY 的电离常数a 7x K =(20-x)10⨯ 【答案】D【解析】A 项,依题意,HX 和HY 是两种一元酸。
由图象知,加入氢氧化钠溶液,水电离程度增大,溶液由酸性逐渐变为中性,当恰好完全反应时溶液呈碱性且水电离程度达到最大值。
HX 为弱酸,故A 错误;B 项,T 、P 点对应的溶液都呈碱性,故B 错误;C 项,N 点呈中性,加入蒸馏水稀释中性溶液,稀释后溶液仍然呈中性,故C 错误;D 项,取M 点计算电离常数,c(H +)=c(OH -)=1×10-7mol·L -1,混合溶液中1x (Na )(Y )0.1mol L 20+x c c +--==⨯⋅,120-x (HY)0.1mol L 20+x c -=⨯⋅,+-a 7c(H )c(Y )x K ==c(HY)(20-x)10⨯,故D 正确。
故选D 。
2.常温时,把浓度为0.1 mol•L -1盐酸分别滴加到浓度为0.1 mol•L -1的MOH 和NOH 两种一元碱,所得到滴定曲线如图所示,下列说法正确的是A .K b (NOH)≈10-21B.碱性:MOH>NOH,且两次滴定时均可用酚酞作为指示剂C.滴定NOH,当加入盐酸体积为10mL时,溶液中必有:c(Cl-)+c(H+)=c(OH-)+c(NOH)D.当两溶液均恰好滴定完全时,两溶液中的离子总数相等【答案】C【解析】A项,由起始时pH值的大小可知,NOH一定为弱碱,MOH可能是强碱也可能是弱碱,由起始得,NOH溶液中c(OH―)=10-3mol•L-1,故K b(NOH)≈10-5,A错误;B项,用强酸滴定时,对于NOH来说,滴定终点为强酸弱碱盐,溶液呈酸性,对MOH来说,终点可能是酸性也可能是中性,故均可选用甲基橙作为指示剂,不宜用酚酞,B项不正确;C项,当滴定到加入HCl为10mL时,由电荷守恒:c(N+)+c(H+)=c(Cl―)+c(OH―),由物料守恒:2c(Cl―)=c(N+)+c(NOH),两式相加得:c(Cl―)+c(H+)=c(OH―) +c(NOH),C项正确;D项,滴定至恰好完全反应时,均消耗盐酸20mL,两溶液中由电荷守恒均有c(R+)+c(H+)=c(Cl―)+c(OH―)(R为N或M),两溶液中c(Cl―)相等,但c(OH―)不相等,所以离子总浓度不相等,离子总数也不相等,D错误。

水溶液中的电离平衡【原卷】1.(2021·江西高三二模)常温下,向1 L 浓度为0.4 mol·L -1的乙醇酸[CH 2(OH)COOH]溶液中加入8 g NaOH 固体得到X 溶液,将X 溶液平均分成两等份,一份通入HCl 气体,得到溶液Y ,另一份加入NaOH 固体得到溶液Z ,溶液Y 、Z 的pH 随所加物质的物质的量的变化情况如图所示(体积变化忽略不计)。
下列说法不正确的是( )A .c 点对应曲线代表的是加入HCl 的曲线B .溶液中水的电离程度:b >cC .a 点:c [CH 2(OH)COO -]>c (Na +)>c (H +)>c (OH - )D .稀释Y 溶液后,溶液中[]-2-2CH (OH)COO CH (OH)COOH (OH )c c c ⎡⎤⎣⎦⨯变大2.(2021·安徽马鞍山市·高三一模)室温下,体积均为20mL 、浓度均为0.1mol·L -1的HX 溶液、HY 溶液中分别滴加同浓度的NaOH 溶液,反应后溶液中水电离的c(H +)水的负对数[–lgc(H +)水]与滴加氢氧化钠溶液体积的关系如图所示。
下列说法正确的是( )A .室温时,Ka(HX)=10-6B .a 、b 、c 三点溶液均显中性C .b 、d 两点溶液的离子总浓度不同D .c 点溶液中c(X -)+c(HX)=0.1mol·L -13.(2021·山东潍坊市·高三一模)常温下,向含少量盐酸的0.1mol/L 的CrCl 3溶液中逐滴滴加NaOH 溶液,所加NaOH 溶液的体积与溶液pH 变化如图所示。
已知:Cr(OH)3为灰绿色的沉淀,当Cr 3+浓度为10-5mol/L 时,可认为沉淀完全,碱过量时生成[Cr(OH)4]-离子。
下列说法正确的是( )A .AB 段发生反应的离子方程式为:33Cr 3OH Cr(OH)+-+=↓B .A 到D 过程中,溶液中水的电离程度先减小后增大C .当溶液pH=5时,()3 3.81c Cr 110mol L +--=⨯⋅D .D 点溶液中()()()()4c Cl c Na c Cr(OH)c OH c H -+--+⎡⎤>>>>⎣⎦4.(2021·河北高三二模)常温下,向10.10mol L -⋅的二元弱酸2H A 溶液中滴加相同浓度的烧碱溶液,溶液中的22H A HA A --、、的物质的量分数(X)δ随pH 的变化如图所示[已知()()()22c(X)(X)c H A c HA c A δ--=++],下列说法错误的是( )A .()a22K H A 的数量级为510-B .常温下,10.1mol L -⋅的NaHA 溶液显酸性C .NaHA 溶液中:()()()()22OH A H H A c c c c --++=+D .pH 从1.2变化至4.2的过程中,()()22c H A c A -先增大后减小5.(2021·广东汕头市·高三一模)室温下,向 100mL 饱和 H 2S 溶液中通入 SO 2气体(气体体积换算成标准状况),发生反应: 222=2H S SO 3S 2H O +↓+,测得溶液 pH与通入 SO 2的关系如图。

押全国卷理综第12题水溶液中的离子平衡高考频度:★★★★★难易程度:★★★★☆“水溶液中的离子平衡”是化学平衡移动原理的重要应用,是高考中的必考知识点,主要考查:溶液中的各种平衡、微粒浓度大小的比较、各种图像问题的分析等。
化学核心素养中的变化观念与平衡思想在这里得到充分的体现和应用。
综合性强,有一定难度,往往是选择题中的压轴题。
考点分布7 Ksp一、试题导图二、试题图解实例:室温下,向20 mL 0.1 mol·L-1 HA溶液中逐滴加入0.1 mol·L-1 NaOH溶液,溶液pH的变化如图所示:1.(2021年全国甲卷)已知相同温度下,()()3sp 4sp BaSO <BaCO K K 。
某温度下,饱和溶液中()2-4-lg SO c ⎡⎤⎣⎦、()2-3-lg CO c ⎡⎤⎣⎦、与()2+-lg Ba c ⎡⎤⎣⎦的关系如图所示。
下列说法正确的是A .曲线①代表3BaCO 的沉淀溶解曲线B .该温度下4BaSO 的()sp 4BaSO K 值为-101.010⨯C .加适量2BaCl 固体可使溶液由a 点变到b 点D .()2+5.1Ba=10c -时两溶液中()()212-4y y 2-3SO =10COc c -2.(2021年全国乙卷)HA 是一元弱酸,难溶盐MA 的饱和溶液中2c (M )+随c(H +)而变化,M +不发生水解。
实验发现,298K 时+2+c (M -c(H ))为线性关系,如下图中实线所示。
下列叙述错误的是A .溶液pH 4=时,-4-1c(M )<3.010mol L +⨯⋅B .MA 的溶度积-8sp K (MA)=5.010⨯C .溶液pH=7时,+--+c(M +c(H =c(A +c ))(OH ))D .HA 的电离常数4a -K (HA) 2.010≈⨯3.(2020年全国1卷)以酚酞为指示剂,用0.1000 mol·L −1的NaOH 溶液滴定20.00 mL 未知浓度的二元酸H 2A 溶液。

技法点拨摘要:水溶液中的离子平衡图像题是近几年高考的热点,它充分考查学生“宏观辨识与微观探析”“变化观念与平衡思想”“证据推理与模型认知”的化学学科核心素养。
本文依据高考考点,结合典型例题,对离子平衡图像题中常见的曲线进行归类解析,总结方法,完善思路。
关键词:水溶液;离子平衡;图像;归类;解析离子平衡图像题是近几年高考的热点,它综合性强、难度较大,其中融合了弱电解质的电离、盐类的水解、沉淀溶解平衡及其相互关系等基本原理,不仅考查学生定性与定量结合分析问题的思想,而且考查数形结合识图、用图的能力,还要求学生能深入微观世界认识各种化学过程来解决比较微粒浓度大小的问题,即考查学生“宏观辨识与微观探析”“变化观念与平衡思想”“证据推理与模型认知”的化学学科核心素养。
在高考中,离子平衡图像题常见的考点有:判断强弱电解质、判断溶液的酸碱性、比较微粒浓度的大小、判断水的电离程度、判断三大守恒(电荷守恒、物料守恒和质子守恒)式、计算三大平衡(电离平衡、水解平衡、沉淀溶解平衡)常数等。
常见以下四种曲线。
一、酸碱中和滴定曲线1.充分利用特殊点(起点、一半点、中性点、中和点、过量点等),准确判断这些点的溶质及其量的关系,以便快速把握三大平衡(电离平衡、水解平衡、溶解平衡)、解决判断强弱电解质、求三大常数(电离常数、水解常数和溶度积常数)、列三大守恒式、比较微粒浓度大小的问题。
2.明确:弱电解质的电离和盐类的水解是微弱的。
3.对于弱酸的酸式盐(如NaHCO3等)或类似弱酸HX及其盐NaX的混合溶液,可通过观察图像信息或根据电离和水解的常数的相对大小判断溶液的酸碱性。
典例1:常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1HX溶液所得滴定曲线如图。
下列说法正确的是()A.由图可知HX是强酸B.点②所示溶液中:c(Na+)=c(HX)+c(X-)C.水的电离程度:①>②>③D.点①所示溶液中:c(X-)>c(Na+)>c(HX)>c(H+)> c(OH-)解析:答案为D。


“水溶液中离子平衡”图像及分析
作者:***
来源:《中学化学》2024年第07期
“水溶液中離子平衡”图像题作为选择题的压轴题,是每年高考的必考题,以水的电离、弱电解质的电离、盐类的水解以及沉淀溶解平衡和酸碱中和滴定为载体,考查计算Ka、Kb和Ksp、化学平衡常数K的计算、沉淀先后的计算、离子浓度大小的比较、曲线含义的判断、微粒存在形式的判断、水的电离程度的比较、溶液中三大守恒规律的运用等化学学科核心素养。
现举例解析各种图像的有关知识,建立解题思维模型,突破水溶液中离子平衡图像题,以期对高三复习有些许启发。

专题跟踪检测(十五) 有关水溶液中离子平衡的图像分析1.某温度下,HNO 2和CH 3×10-4×10-5。
将pH 和体积均相同的两种酸溶液分别稀释,其pH 随加水体积的变化如图所示。
下列叙述正确的是( )A .曲线Ⅰ代表HNO 2溶液B .溶液中水的电离程度:b 点>c 点C .从c 点到d 点,溶液中c (HA )·c (OH -)c (A -)保持不变(其中HA 、A -分别代表相应的酸和酸根离子)D .相同体积a 点的两溶液分别与NaOH 恰好中和后,溶液中n (Na +)相同解析:选C 由K a (HNO 2)>K a (CH 3COOH)可知,酸性HNO 2>CH 3COOH 。
A 错:pH 相同的两种酸稀释相同倍数时,酸性强的酸pH 变化大,所以曲线Ⅱ为HNO 2。
B 错:b 、c 两点处,b 点酸性强,对水的电离抑制程度大,所以水的电离程度:c 点>b 点。
C 对:从c点到d 点,c (HA )·c (OH -)c (A -)=c (HA )·c (OH -)·c (H +)c (A -)·c (H +)=K W K a ,K W 和K a 是两个常数,只要温度不变,比值也不变。
D 错:a 点pH 相同,则CH 3COOH 的浓度大,恰好中和时消耗的NaOH 多,所以溶液中n (Na +)多。
2.电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点。
如图是某同学用0.1 mol·L-1 KOH 溶液分别滴定体积均为20 mL 、浓度均为0.1 mol·L -1的HCl 和CH 3COOH 溶液滴定曲线示意图(混合溶液体积变化忽略不计)。
下列有关判断不正确的是( )A .曲线①代表0.1 mol·L -1 KOH 溶液滴定CH 3COOH 溶液的滴定曲线,曲线②代表0.1 mol·L -1 KOH 溶液滴定HCl 溶液的滴定曲线B .在相同温度下,C 点水电离的c (H +)大于A 点水电离的c (H +)C .在A 点的溶液中有:c (CH 3COO -)+c (OH -)-c (H +)=0.05 mol·L -1D .在B 点的溶液中有:c (K +)>c (OH -)>c (CH 3COO -)>c (H +)解析:选B 由图像中A 、C 两点分别表示KOH 与CH 3COOH 、KOH 与HCl 恰好完全反应,由于CH 3COOK 水解使溶液呈碱性,促进了水的电离,而KCl 不水解,溶液呈中性,所以C 点水电离的c (H +)小于A 点水电离的c (H +),故B 错误。

分布系数图像1.柠檬酸(用H 3R 表示)可用作酸洗剂。
常温下,向0.1mol ·L -1H 3R 溶液中加入少量NaOH 固体(忽略溶液体积的变化),H 3R 、H 2R -、HR 2-和R 3-的含量与pH 的关系如图所示。
下列叙述正确的是( )。
A .图中b 曲线表示HR 2-的变化B .HR 2-的电离常数为K a3=1×10-6C .pH =7时,c (Na +)=c (HR 2-)+c (H 2R -)+c (R 3-)D .pH =5时,c (HR 2-)+c (H 2R -)+c (R 3-)=0.1mol ·L -1【解析】选B 。
A 项,H 3R 溶液中加入NaOH ,先反应生成NaH 2R ,再生成Na 2HR ,最后生成Na 3R ,则图中曲线a 、b 、c 、d 分别代表H 3R 、H 2R -、HR 2-和R 3-,错误;B 项,HR 2-的电离常数K a3=)()()(--23HR R H c c c ⨯+,由图可知,HR 2-和R 3-的含量相等时,溶液的pH =6,则有K a3=c (H +)=1×10-6,正确;C 项,常温下,pH =7时,溶液呈中性,则有c (H +)=c (OH -),结合电荷守恒推知,c (Na +)=2c (HR 2-)+c (H 2R -)+3c (R 3-),错误;D 项,由图可知,pH =5时溶液中存在H 3R 、H 2R -、HR 2-和R 3-,据物料守恒可得c (HR 2-)+c (H 2R-)+c(R3-)+c(H3R)=0.1mol·L-1,错误。
2.(2020·滨州二模)柠檬酸(用H3R表示)是一种高效除垢剂。
常温时,用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的物质的量百分数随pH的变化如图所示。
下列说法正确的是()。
A.由a点判断H3R的第一步电离常数K a1(H3R)的数量级为10-3B.若b点溶液中金属阳离子只有Na+,则有c(Na+)=c(R3-)+c(HR2-)+c(H2R-)+c(H3R)C.pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)D.反应2H2R-H3R+HR2-在该温度下的平衡常数K=10x-y【解析】选CD。