糖类的化学性质
- 格式:ppt
- 大小:31.50 KB
- 文档页数:11

引言:糖类是一类无色结晶固体,可溶于水,具有甜味的有机化合物。
它们在生物体内广泛存在,并在能量转化、生理功能和食品工业中扮演着重要角色。
本文将探讨糖类的化学性质,介绍其结构和性质,并对其在食品工业中的应用进行详细阐述。
概述:糖类是一类碳水化合物,由碳、氢、氧原子构成。
它们的基本化学式为(CnH2O)n,其中n代表糖分子中含有的碳原子数目。
糖类可分为单糖、双糖和多糖三大类。
单糖是糖类中最简单的单元,包括葡萄糖、果糖和半乳糖等;双糖由两个单糖分子通过酯或糖苷键相连,例如蔗糖和乳糖;多糖则由多个单糖分子经过缩合反应而形成,如淀粉和纤维素。
糖类具有多样的化学性质,包括酸碱性、还原性和缩合反应等。
正文内容:1.酸碱性糖类是含有羟基的化合物,可与酸或碱反应形成相应的盐。
它们能够与强酸和强碱反应,在适当条件下失去或获得羟基,形成盐。
此外,糖类还可以通过酸催化或酶催化反应形成酯。
1.1单糖的酸碱性单糖的酸碱性取决于其官能团和溶液pH值。
以葡萄糖为例,它具有一个羟基和一个醛基,可在强碱条件下脱去羟基,生成相应的醛盐。
1.2双糖和多糖的酸碱性双糖和多糖的酸碱性较弱,与其结构和分子量有关。
通常情况下,它们需要较高的酸碱浓度和温度才能进行反应。
2.还原性糖类具有还原性,即能够与氧化剂反应,发生氧化反应,自身被氧化并使氧化剂还原。
还原性来源于糖类分子中的羟基或醛基。
葡萄糖是一种典型的还原性糖,它能够与氧化剂如硝酸银反应,生成还原产物。
2.1还原糖呈阳性反应的糖被称为还原糖,如葡萄糖、果糖和半乳糖。
它们的结构中含有醛基或酮基。
2.2非还原糖呈阴性反应的糖被称为非还原糖,如蔗糖和乳糖。
它们的结构中的醛基或酮基被缩合反应所消耗。
3.缩合反应糖类分子中的羟基与醛基或酮基发生缩合反应,形成糖苷键。
缩合反应是糖类合成、降解和转化的重要反应。
例如,葡萄糖分子间的缩合反应形成淀粉分子。
3.1单糖缩合反应单糖的缩合反应一般在酸或酶催化下进行,生成双糖或多糖。

一、实训目的通过本次实训,使学生掌握糖类的基本概念、分类、性质及用途,了解糖类在日常生活和工业生产中的应用,提高学生的动手操作能力和实验技能。
二、实训内容1. 糖类的分类糖类分为单糖、双糖和多糖三种。
单糖包括葡萄糖、果糖、半乳糖等;双糖包括蔗糖、麦芽糖、乳糖等;多糖包括淀粉、纤维素、糖原等。
2. 糖类的化学性质(1)还原性还原性是糖类的一个重要性质。
具有还原性的糖类在加热或催化条件下,可以与某些氧化剂发生反应,生成相应的糖醛或糖酮。
常见的还原性糖有葡萄糖、果糖、乳糖等。
(2)非还原性非还原性糖类在加热或催化条件下,不能与氧化剂发生反应。
常见的非还原性糖有蔗糖、淀粉、纤维素等。
(3)糖苷键的形成与断裂糖苷键是糖类分子中糖基与糖基或糖基与非糖基之间的共价键。
在酸性或碱性条件下,糖苷键可以发生断裂,形成苷元和糖基。
(4)糖类的酸碱性质糖类具有酸碱性质,但一般较弱。
单糖具有酸性,双糖和多糖具有碱性。
3. 糖类的应用(1)食品工业糖类是食品工业的重要原料,如糖果、糕点、饮料等。
(2)医药工业糖类在医药工业中具有重要作用,如葡萄糖用于输液、糖原用于糖尿病治疗等。
(3)纺织工业糖类在纺织工业中用于染料、助剂等。
(4)生物工程糖类在生物工程中具有重要作用,如利用糖类生产生物降解塑料、生物燃料等。
三、实训步骤1. 实验器材:试管、酒精灯、烧杯、玻璃棒、滴管、石棉网、加热器、蒸馏装置、显微镜等。
2. 实验药品:葡萄糖、果糖、蔗糖、淀粉、纤维素、乳糖、氯化钠、碘液、银氨溶液、氢氧化钠、硫酸铜、无水乙醇等。
3. 实验步骤:(1)观察糖类的物理性质,如颜色、溶解性等。
(2)进行糖类的还原性实验,观察葡萄糖、果糖、乳糖与银氨溶液的反应。
(3)进行糖类的非还原性实验,观察蔗糖、淀粉、纤维素与碘液的反应。
(4)进行糖苷键的形成与断裂实验,观察淀粉在酸性、碱性条件下的水解。
(5)进行糖类的酸碱性质实验,观察葡萄糖、蔗糖、淀粉的酸碱反应。

化学糖类的知识点总结一、糖类的基本概念糖类是一类含有可溶性羟基的碳水化合物,它们通常是由碳、氢、氧三种元素组成的,化学式一般为(CH2O)n,其中 n 为大于或等于 3 的整数。
糖类在自然界中广泛存在,包括蜂蜜、水果、蔬菜、奶制品等食物中,在生物体内则广泛存在于细胞膜、核酸、蛋白质等生物大分子中。
根据其分子结构和性质,糖类可以分为以下几类:1. 单糖:是由一个具有多个羟基的碳链所组成的糖类,最简单的单糖是三碳的甘油醛(Glyceraldehyde)和四碳的醣醇(Erythrose);2. 双糖:是由两个单糖分子通过糖苷键连接而成的化合物,如蔗糖(麦芽糖、大葡萄糖)、乳糖等;3. 多糖:是由多个单糖分子通过糖苷键连接而成的多聚糖,如淀粉、纤维素、糖原等。
在糖类中,单糖是最基本的单位,其他复杂的糖类都是由单糖经过酶催化反应而形成。
同时,单糖也是生物体内最重要的糖类之一,如葡萄糖、果糖、半乳糖等,它们是细胞内能量的重要来源,也是构成生物大分子如核酸、蛋白质等的基本结构单元。
二、糖类的结构特点糖类的结构特点主要体现在其碳骨架、立体构型和环结构上。
1. 碳骨架:糖类的碳骨架通常是由连续的碳原子所组成的,每个碳原子上都含有一个羟基和一个醛基或酮基,由于羟基和醛基/酮基的特性,糖类具有较强的亲水性,因此可以在水溶液中自发形成环状结构。
2. 立体构型:糖类分子的碳原子上的羟基与醛基或酮基之间的空间排列方式不同,导致糖类分子具有不同的立体构型,常见的有 D 型和 L 型两种构型,它们之间的转化是通过酶的催化反应来完成的。
3. 环结构:糖类在水溶液中通常以环状结构存在,环状结构常见的有六元环和五元环两种类型,其中六元环的糖称为吡喃糖,五元环的糖称为呋喃糖。
糖类的结构特点决定了它们的生物学功能和化学性质,同时也为糖类的合成、分离和分析提供了重要的依据。
三、糖类的代谢途径糖类在生物体内主要通过糖酵解、糖异生和糖原合成三种途径进行代谢。

糖类、蛋白质、氨基酸的结构特点及主要化学性质糖类、蛋白质均为食物中重要的营养素,是维持人体物质组成和生理机能不可缺少的要素,也是生命活动的物质基础,它们的结构特点及主要化学性质如下:一、糖类的组成、结构和分类:糖类由C 、H 、O 三种元素组成,多数糖类可用通式Cm(H 2O)n 来表示(m 和n 可以相同,也可以不同);从结构上看,糖类是多羟基醛或多羟基酮或水解后可生成多羟基醛或多羟基酮的化合物。
根据能否水解以及水解后的产物,糖类可分为单糖、二糖和多糖。
单糖是不能水解的糖,一般为多羟基醛或多羟基酮,葡萄糖是一种重要的单糖,它是一种多羟基醛;二糖和多糖均可水解,常见的二糖有麦芽糖、蔗糖;常见的多糖有淀粉、纤维素,它们是天然高分子化合物。
二、糖类的化学性质:糖类物质主要含羟基和羰基两种官能团,可发生以下几种反应。
1、氧化反应①与氧气反应 如C 6H 12O 6 (s)+ 6O 2(g) →6CO 2(g) + 6H 2O(l) △H =-2804kJ/ mol②被银氨溶液或新制的Cu(OH)2氧化:分子中含醛基的糖(如葡萄糖、麦芽糖)有还原性,均可发生此反应。
如 CH 2OH(CHOH)4CHO + 2Cu(OH)2 →CH 2OH(CHOH)4COOH + Cu 2O ↓ +2 H 2OCH 2OH(CHOH)4CHO + 2[Ag(NH 3)2]OH →CH 2OH(CHOH)4COO NH 4 +2Ag ↓+H 2O +3NH 32、酯化反应:糖类分子中含羟基,故可发生酯化反应,如葡萄糖与乙酸作用生成葡萄糖五乙酸酯、纤维素与硝酸作用生成纤维素硝酸酯。
3、加成反应:糖中含羰基,能与氢氰酸、氨及氨的衍生物、醇等发生加成反应。
4、水解反应:二糖和多糖均可水解。
(C 6H 10O 5)n + nH 2O → n C 6H 12O 6 (催化剂:硫酸)淀粉 (葡萄糖)5、淀粉的特性:遇碘单质变蓝色。
三、氨基酸的结构和性质1、氨基酸的结构:氨基酸是羧酸分子中H 原子被—NH 2取代得到的衍生物,分子中含有氨基—NH 2和羧基—COOH 两种官能团。

糖化学知识点总结糖化学是研究糖类化合物的性质、结构、合成及在生物体内部的生物功能的一门科学。
糖类化合物广泛存在于自然界中,是生命的重要组成部分,对于人类的健康和生活有着重要的影响。
本文将从糖的结构、分类、性质和应用等方面进行总结。
一、糖的结构糖是一类碳水化合物,其分子结构主要由碳、氢和氧组成。
糖的一般化学式为Cn(H2O)m,其中n和m分别为正整数。
糖分为单糖、双糖和多糖三类。
1. 单糖单糖是由单个糖分子组成的简单碳水化合物,是构成多糖和双糖的基本单位。
单糖的分子结构一般为一个或多个碳骨架,每个碳原子上连接有一个羟基(-OH)和一个醛基(CHO)或酮基(C=O)。
常见的单糖有葡萄糖、果糖、半乳糖等。
2. 双糖双糖是由两个单糖分子经过缩合反应而形成的碳水化合物,分子结构包括两个单糖分子通过一个糖苷键连接在一起。
常见的双糖有蔗糖(由葡萄糖和果糖组成)、乳糖(由葡萄糖和半乳糖组成)等。
3. 多糖多糖是由多个单糖分子通过糖苷键连接在一起形成的长链状的碳水化合物,常见的多糖包括淀粉、纤维素和半乳聚糖等。
二、糖类化合物的分类根据单糖分子结构的不同,糖类化合物可以分为醛糖和酮糖两类。
1. 醛糖醛糖的分子中含有一个醛基(CHO),根据碳原子上的羟基和醛基的位置,醛糖可以分为三种不同的立体异构体:D型、L型和α/β型。
2. 酮糖酮糖的分子中含有一个酮基(C=O),酮糖也包括D型、L型和α/β型的立体异构体。
三、糖类化合物的性质糖类化合物是生物体内的重要能源来源和组织结构的基本材料,具有多种重要性质。
1. 甜度糖类化合物有甜味,常见的甜度依次为蔗糖>葡萄糖>果糖>乳糖>半乳糖。
这主要与糖分子结构的不同有关。
2. 溶解性糖类化合物在水中具有良好的溶解性,随着溶解度增加,糖的甜度也会增加。
3. 还原性糖类化合物中的醛基和酮基具有还原性,可以与银镜反应,因而称为还原糖。
4. 保水性多糖具有良好的保水性,能够在水中形成胶状物质,具有较强的保水性能。

一、实验目的1. 了解糖类物质的化学性质,包括还原性、非还原性、与酸碱反应等。
2. 掌握糖类物质的鉴定方法,如银镜反应、费林试剂反应等。
3. 比较不同糖类物质的化学性质差异。
二、实验原理糖类物质是一类多羟基醛或酮化合物,在水解后能变成多羟基醛或多羟基酮。
糖类物质在化学上具有醛的性质,可以与某些试剂发生特定的反应。
本实验主要研究糖类物质的还原性、非还原性、与酸碱反应等性质。
三、实验材料1. 实验药品:葡萄糖、果糖、蔗糖、麦芽糖、氯化钠、硫酸铜、氢氧化钠、硫酸、银氨溶液、新制氢氧化铜悬浊液等。
2. 实验仪器:试管、试管夹、胶头滴管、酒精灯、烧杯、玻璃棒等。
四、实验步骤1. 还原性实验(1)取少量葡萄糖溶液于试管中,加入新制氢氧化铜悬浊液,加热,观察现象。
(2)重复步骤(1),分别用果糖、蔗糖、麦芽糖溶液进行实验。
2. 非还原性实验(1)取少量葡萄糖溶液于试管中,加入氯化钠溶液,观察现象。
(2)重复步骤(1),分别用果糖、蔗糖、麦芽糖溶液进行实验。
3. 与酸碱反应实验(1)取少量葡萄糖溶液于试管中,加入硫酸铜溶液,观察现象。
(2)取少量葡萄糖溶液于试管中,加入氢氧化钠溶液,观察现象。
(3)重复步骤(1)和(2),分别用果糖、蔗糖、麦芽糖溶液进行实验。
4. 银镜反应实验(1)取少量葡萄糖溶液于试管中,加入银氨溶液,加热,观察现象。
(2)重复步骤(1),分别用果糖、蔗糖、麦芽糖溶液进行实验。
五、实验结果与分析1. 还原性实验:葡萄糖、果糖、麦芽糖溶液与新制氢氧化铜悬浊液反应,产生红色沉淀;蔗糖溶液不发生反应。
2. 非还原性实验:葡萄糖、果糖、麦芽糖溶液与氯化钠溶液不发生反应;蔗糖溶液与氯化钠溶液不发生反应。
3. 与酸碱反应实验:葡萄糖溶液与硫酸铜溶液反应,产生蓝色沉淀;葡萄糖溶液与氢氧化钠溶液反应,产生白色沉淀。
果糖、蔗糖、麦芽糖溶液与硫酸铜溶液和氢氧化钠溶液反应现象与葡萄糖溶液相同。
4. 银镜反应实验:葡萄糖、果糖、麦芽糖溶液与银氨溶液反应,产生银镜;蔗糖溶液与银氨溶液不发生反应。


糖类化学知识点总结糖类是一类重要的有机化合物,其化学结构和性质的研究对于生物学和食品工业具有重要的意义。
糖类包括单糖、双糖、多糖等多种类型,它们具有不同的分子结构和特性。
本文将对糖类的化学结构、命名方法、性质以及在生物体内和食品工业中的应用进行系统的总结和阐述。
一、单糖的化学结构和命名方法1. 单糖的分类单糖是由碳、氢、氧三种元素组成的糖类化合物,它们的分子结构中含有一个或多个羟基和一个或多个醛基或酮基。
根据它们的化学结构,单糖可分为醛糖和酮糖两类。
醛糖的分子中含有一个醛基,酮糖的分子中含有一个酮基。
2. 单糖的化学结构单糖的化学结构可以用希尔德-奥斯特公式来表示,其中n代表碳原子数,希尔德-奥斯特公式的结构为(CH2O)n。
单糖的分子结构包括直链结构和环状结构两种形式。
直链结构是单糖分子直接相连形成的链状结构,而环状结构是由直链结构转变而来的,其中含有环氧醇化合物。
3. 单糖的命名方法根据单糖分子中羟基的位置不同,可以分为各种不同的单糖,比如葡萄糖、果糖、半乳糖等,并且还可以根据立体构型的不同将它们分为L-型和D-型两种立体异构体。
二、双糖和多糖的化学结构和性质1. 双糖的化学结构和性质双糖是由两个单糖分子通过糖苷键连接而成的化合物,根据单糖分子的组成不同,双糖可分为蔗糖、麦芽糖、乳糖等多种类型。
双糖具有不同的甜度和溶解度,它们在食品工业中具有广泛的应用。
2. 多糖的化学结构和性质多糖是由多个单糖分子通过糖苷键连接而成的化合物,它们的分子结构复杂,包括淀粉、纤维素、半乳聚糖等多种类型。
多糖在生物体内具有重要的功能,如淀粉是植物体内储存能量的重要物质,而纤维素是植物细胞壁结构的主要组成部分。
三、糖的生物合成和降解1. 糖的生物合成糖类在生物体内是通过一系列酶促反应进行合成的,主要包括糖异生和糖原合成两个过程。
糖异生是指通过葡萄糖及其衍生物的代谢途径来合成其他单糖,而糖原合成是指通过多糖合成反应来合成淀粉和糖原。

化学初三下糖类知识点归纳总结糖类是一类重要的有机化合物,广泛存在于自然界中,是人类生活中不可或缺的能量来源。
在化学初三下学期的学习中,我们系统地学习了糖类的结构、分类、性质以及相关实验。
下面,将对这一部分的知识点进行归纳总结。
一、糖类的基本结构糖类是由碳、氢和氧组成的有机化合物,通式为(CH2O)n。
糖类分为单糖、双糖和多糖三类。
单糖是由3至7个碳原子构成的糖类,如葡萄糖、果糖等;双糖由两个单糖分子通过缩合反应形成,如蔗糖、麦芽糖等;多糖则由许多单糖分子缩合而成,如淀粉、纤维素等。
二、糖类的分类1. 单糖:根据单糖的化学式和结构,可以将单糖分为三类,即三碳糖、五碳糖和六碳糖。
常见的三碳糖有甘露糖,五碳糖有核糖和脱氧核糖,六碳糖中的葡萄糖、果糖最为常见。
2. 双糖:根据缩合的单糖种类以及缩合方式,双糖可分为苷糖和异糖两类。
苷糖是由脱氧核糖和脱氧核糖的苷闻基缩合而成的,如蔗糖、乳糖等;异糖常见的有麦芽糖。
3. 多糖:多糖是由多个单糖分子缩合而成的。
根据缩合方式和组成结构,多糖分为淀粉、糖原、纤维素和壳聚糖等。
淀粉和糖原是由α-葡聚糖分子缩合而成的,纤维素和壳聚糖则是由β-葡聚糖分子缩合而成的。
三、糖类的性质1. 糖类的溶解性:大多数单糖和双糖在水中具有良好的溶解性,而多糖则需要经过水解反应后才能溶解。
2. 醇类性质:糖类具有醇类和醛酮类的性质。
例如,单糖可以发生还原反应,还原性强的单糖又称为还原糖。
3. 甘甜性:糖类具有甘甜的味道,不同的糖类具有不同的甘甜程度。
4. 沸点和燃点:糖类的沸点较高,而燃点较低。
在燃烧过程中,糖类会失去水分,产生焦炭。
5. 餐前血糖:人体食用含糖食物后,血液中的葡萄糖浓度会升高,形成餐前血糖。
血糖过高或过低都会对身体造成不良影响。
四、实验示例1. 确定糖的类型:利用苏丹红胺的染色反应,蔗糖呈现红橙色,麦芽糖呈现深红色,葡萄糖和果糖则不发生着色反应。
2. 测定还原糖的含量:利用费林试剂,可以将还原糖氧化成蓝色溶液,并通过比色计测定吸光度,进而推算还原糖的含量。

化学糖类知识点总结一、基本概念糖是指含有醛基或酮基的碳水化合物。
它们通常是多元醇,也就是含有多个羟基的化合物。
根据碳水化合物的结构特点,糖类可分为单糖、双糖、寡糖和多糖四大类。
1. 单糖单糖是由3-7个碳原子组成的简单碳水化合物,通式为(CH2O)n。
根据其醛基或酮基的位置和数量,单糖又可分为醛糖和酮糖两类。
常见的单糖包括葡萄糖、果糖、半乳糖等。
2. 双糖双糖是由两个单糖分子经由缩合反应形成的碳水化合物,通常由α-1,4-糖苷键或β-1,4-糖苷键连接。
蔗糖、乳糖、麦芽糖等均为常见的双糖。
3. 寡糖寡糖是由3-10个单糖分子经由糖苷键连接而成的碳水化合物,它们具有较复杂的结构和多样的生物活性。
低聚果糖、低聚葡萄糖等都是寡糖的代表。
4. 多糖多糖是由数十至上百个单糖分子经由糖苷键连接而成的碳水化合物,是生物体内最广泛的一类糖类。
淀粉、纤维素、糖原等都属于多糖。
二、分类根据单糖的类型和数量,糖类可分为脱氧糖、醛糖和酮糖三大类。
1. 脱氧糖脱氧糖是指在单糖分子中某些羟基被氢或其他基团所取代,从而形成一种脱氧的糖类。
常见的脱氧糖包括脱氧核糖、脱氧賖和氨基葡萄糖等。
2. 醛糖醛糖是指单糖分子中含有醛基的糖类,通常以醛基为末端。
葡萄糖、半乳糖等都属于醛糖。
3. 酮糖酮糖是指单糖分子中含有酮基的糖类,通常以酮基为末端。
果糖就是一种典型的酮糖。
三、生物学功能糖类在生物体内具有多种重要的生物学功能,主要包括提供能量、构建细胞壁、储存能量和作为通讯信号等。
1. 提供能量糖类是生物体内主要的能量来源之一。
通过细胞代谢途径,单糖分子可以氧化分解成ATP,从而为细胞提供能量。
葡萄糖是最重要的能量来源之一,它在有氧条件下可以完全被氧化分解,释放出大量的能量。
2. 构建细胞壁在植物细胞和真菌细胞中,糖类起着构建细胞壁的重要作用。
纤维素是由葡萄糖分子通过β-1,4-糖苷键连接而成的多糖,在细胞壁中起着支撑和保护细胞的作用。
3. 储存能量动物体内的肝脏和肌肉组织中可以储存糖原,植物体内的叶绿器中可以储存淀粉。


糖类的化学性质糖是一种广泛存在于自然界的重要有机化合物,它们的化学性质与其结构密切相关。
糖包含羟基、醛基、酮基等官能团,因此在化学反应中极易发生氧化、还原、酸碱水解、缩合等反应。
本文将从这些方面来探讨糖的化学性质。
一、氧化还原反应糖具有重要的还原性质。
在存在比它们还原性更强的还原剂时,糖可以发生氧化反应,同时还原剂被还原成较弱的物质。
对于单糖来说,它们可以在碱性条件下与空气中的氧气发生氧化反应,生成羧酸和醛。
例如,葡萄糖在碱性条件下可被氧化为葡萄糖酸,下面是反应式:C6H12O6 + O2 → C6H10O7 + H2O另一方面,糖还具有重要的还原性质,可以被强氧化剂还原为醇或糖醇。
例如,葡萄糖在浓硝酸的作用下可以被还原为甘露醇:C6H12O6 + 6 HNO3 → C6H14O6 + 6 NO2 + 3 H2O二、酸碱水解糖在弱酸或弱碱条件下可以发生水解反应。
这种水解反应被称为糖水解或糖分解。
在酸性条件下,糖分解产生分子量较小的产物,如果糖和葡萄糖。
在碱性条件下分解,产物主要是己糖和戊糖。
下面是葡萄糖的酸性水解反应:C6H12O6 + H2O → C5H10O5 + C6H12O6在碱性条件下,葡萄糖的水解反应的产物为:C6H12O6 + 2 NaOH → C6H10O5Na2 + 2 H2O三、缩合反应糖分子的羟基和醛基在缩合反应中可以发挥重要作用。
缩合反应是一种重要的糖化学反应,它可以合成二糖、三糖、多糖等复杂化合物。
常见的缩合反应有糖醛基在酸性条件下与羟基缩合形成的糖苷键和异构糖在碱性条件下与羟基缩合形成的糖苷键等。
下面是葡萄糖和果糖缩合形成蔗糖的反应:C6H12O6 + C6H12O6 → C12H22O11 + H2O四、其他反应除以上三类反应之外,还有一些其他的反应也体现了糖的化学性质。
例如,在存在酸催化剂下,葡萄糖和果糖可以发生环化反应,形成半乳糖、伊莫球碱、凝集素等化合物。
此外,还可以通过糖转移酶催化的反应,形成糖链分子,构成多种多样的糖蛋白和糖类化合物。

糖类的性质实验报告糖类是一类常见的有机化合物,其性质和用途在日常生活中都具有重要意义。
本实验旨在通过对糖类的一系列实验,探究其性质特点,为进一步的研究和应用提供参考。
首先,我们进行了对糖的溶解性实验。
我们选取了蔗糖、葡萄糖和果糖三种常见的糖类,分别加入到水中,观察其溶解情况。
实验结果表明,葡萄糖和果糖在水中的溶解度较高,而蔗糖的溶解度较低。
这是因为葡萄糖和果糖都是单糖,分子较小,易于溶解;而蔗糖是双糖,分子较大,溶解度相对较低。
其次,我们进行了对糖的还原性实验。
我们将蔗糖、葡萄糖和果糖分别与硫酸铜溶液混合,观察其在加热的情况下是否发生还原反应。
实验结果显示,蔗糖在加热后未发生还原反应,而葡萄糖和果糖则发生了还原反应,生成了红色沉淀。
这说明葡萄糖和果糖具有还原性,而蔗糖则不具备这一性质。
接着,我们进行了对糖的发酵性实验。
我们将葡萄糖和果糖与酵母混合,观察其在一定条件下是否发生发酵反应。
实验结果表明,葡萄糖和果糖均能够与酵母发生发酵反应,产生了气泡和香味。
这说明葡萄糖和果糖具有发酵性,可以成为酵母的发酵底物。
最后,我们进行了对糖的燃烧性实验。
我们将蔗糖、葡萄糖和果糖分别加热至高温,观察其在燃烧过程中的表现。
实验结果显示,葡萄糖和果糖在加热后发生了燃烧,产生了火焰和气体,而蔗糖在加热后未发生燃烧。
这说明葡萄糖和果糖具有燃烧性,而蔗糖则不具备这一性质。
综上所述,通过本次实验,我们对糖类的性质有了更深入的了解。
糖类的溶解性、还原性、发酵性和燃烧性都是其重要的性质特点,这些性质不仅对于化学研究具有重要意义,也在食品加工、生物发酵等领域有着广泛的应用价值。
希望本实验能为相关领域的研究和实践提供一定的参考和借鉴。

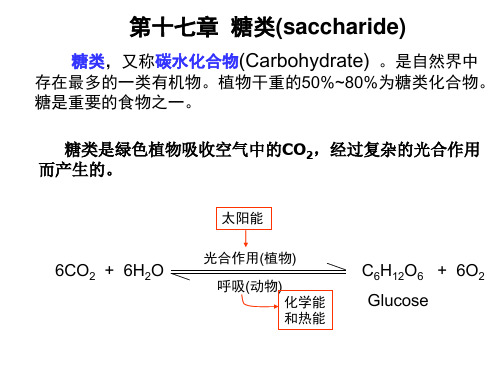

初中化学知识点归纳糖类与多糖的性质与应用糖类与多糖是初中化学课程中重要的知识点之一。
本文将对糖类与多糖的性质与应用进行归纳与总结。
一、糖类的性质糖类是一种碳水化合物,分为单糖、双糖和多糖三种。
其中,单糖是由3-7个碳原子组成的简单糖,如葡萄糖、果糖等。
双糖由两个单糖分子通过缩合反应形成,如蔗糖、乳糖等。
多糖则是由多个单糖分子缩合而成,如淀粉、纤维素等。
1. 甜味性:糖类具有甜味,可以用于调味或制作甜食。
常见的糖类有蔗糖、果糖等。
2. 溶解性:糖类在水中具有良好的溶解性,可以溶解成胶体溶液,形成糖水。
3. 还原性:糖类中存在还原糖和非还原糖两种,其中只有还原糖可以进行还原反应,如葡萄糖。
二、多糖的性质多糖是由多个单糖分子通过缩合反应形成的大分子化合物,具有以下性质。
1. 长链性:多糖分子由大量单糖分子缩合而成,形成长链状结构。
2. 分子量大:由于多糖分子包含大量单糖分子,因此分子量较大。
3. 不溶性:多糖在水中不溶解,形成胶体状物质。
三、糖类与多糖的应用糖类与多糖在生活中有着广泛的应用。
1. 食品工业中的应用:糖类是糕点、零食等食品中重要的添加剂,能够增加食品的口感和甜味。
2. 医药工业中的应用:多糖在医药领域具有广泛的应用,例如海藻多糖能增强人体免疫力,胶原蛋白可以用于医用敷料等。
3. 材料科学中的应用:多糖是一种重要的生物材料,可以用于制备高分子材料、纳米材料等。
4. 生物能源中的应用:葡萄糖是光合作用产生的主要产物之一,可以用作生物能源的原料。
5. 纤维素的应用:纤维素是自然界中含量最多的多糖之一,可以作为纤维素纸、纤维素乳胶等产业的原料。
综上所述,糖类与多糖具有较高的溶解性、还原性等特点。
在食品工业、医药领域、材料科学和生物能源等方面有广泛的应用。
初中化学学习中,我们应该重点理解糖类与多糖的性质与应用,以便更好地掌握化学的基础知识。

糖类的化学性质及生物作用研究糖类是一类重要的生物大分子,不仅在人类的生活中扮演着重要的角色,而且在生物体的代谢过程中也具有极其重要的作用。
本文主要探讨糖类的化学性质及其在生物体中的生物作用。
一、糖的化学性质1. 分类糖类分为单糖、双糖、多糖三类。
单糖是指由一个具有五碳结构的单元组成的糖分子,如葡萄糖、果糖等;双糖是由两个单糖分子通过缩合反应而形成的糖,如蔗糖、乳糖等;多糖则由多个单糖分子通过缩合反应形成的糖,如淀粉、纤维素等。
2. 结构糖类的基本结构是由碳、氢、氧三种元素构成的,其中氢和氧的比例为2:1,分子式为Cm(H2O)n。
在单糖分子中,碳原子的数量为5个,因此也叫做“五碳糖”,如图1所示。
图1 糖类分子基本结构3. 化学性质糖类具有许多典型的化学性质,如还原性、缩合反应、水解反应等。
(1)还原性糖分子具有还原性,也就是说它们能够还原其他物质。
当单糖被氧化时,它们能够减少铜离子到铜离子的反应中,因此被称为“还原糖”。
而双糖、多糖由于分子中有非还原糖基团,因此不具有还原性。
(2)缩合反应糖类分子在一定条件下能够发生缩合反应,使得两个单糖分子结合形成一种双糖。
双糖分子还能发生缩合反应,形成多糖,如淀粉分子就是由不同长度的葡萄糖分子缩合而成的。
(3)水解反应糖类分子也能够发生水解反应,也就是通过加水来断裂它们之间的化学键。
酶是促进糖类水解反应的重要催化剂。
二、糖类在生物体内的生物作用1. 能量来源糖类是生物体内最重要的能量来源之一。
人体中通过食入食物而获得的葡萄糖,可以通过糖解途径产生能量。
在糖酵解过程中,葡萄糖分子转化为乳酸或丙酮酸,同时产生能量。
也就是说,糖酵解是将葡萄糖转化为生物能量的过程。
2. 在细胞外出发免疫反应糖类还能够调节人体免疫系统。
在一些细菌、寄生虫等病原体的表面上覆盖有一层多糖葡萄糖胞外多糖(LPS),可提供抗原性,通过免疫细胞与之结合,引发免疫反应,这种反应有效地清除或减轻感染。

糖类物质的化学性质一、实验目的1、验证糖类物质的主要化学性质;2、熟悉糖类物质的鉴定方法。
二、实验原理糖通常分为单糖、低聚糖和多糖,又可分为还原糖和非还原糖。
还原糖含有半缩醛(酮)的结构,能被托伦(T ollen)试剂、斐林试剂(Fehling)和本尼地(Benidict)试剂氧化,具有还原性。
非还原性糖不能被以上试剂氧化,没有还原性。
鉴别糖类物质的定性反应是Molish(莫利许)反应,即在浓硫酸作用下,糖与α-萘酚缩合生成紫色环。
酮糖能与间苯二酚/浓盐酸作用而很快显色,醛糖无此性质,故可用这一反应鉴别醛糖和酮糖。
淀粉的碘试验是鉴定淀粉的一个很灵敏的方法。
此外,用糖脎生成的时间、晶形以及糖类物质的比旋光度等鉴定糖类物质都具一定的意义。
多糖是由很多个单糖缩合而成的,它不具有单糖的性质,但经彻底水解后,就具有单糖的性质。
三、实验步骤1、Molish试验——α-萘酚试验检出糖试样:5%葡萄糖、果糖、麦芽糖、蔗糖、淀粉溶液。
2、间苯二酚试验样品:5%果糖、葡萄糖、麦芽糖、蔗糖。
3、Fehling试剂、Benidict试剂和T ollen试剂检出还原糖试样:5%葡萄糖、果糖、麦芽糖、乳糖、蔗糖、淀粉溶液。
4、糖脎的生成、晶形的观察和生成时间试样:5%葡萄糖、果糖、乳糖、麦芽糖、蔗糖溶液。
5、糖类物质的水解(1)蔗糖的水解(2)淀粉的水解和碘试验6、纤维素的性质试验7、实验记录要求四、注意事项莫利许实验中,加浓硫酸时切勿摇动试管。
五、思考题(1)哪些糖具有还原性?为什么?(2)莫利许环生成的原因是什么?(3)在糖类的还原性试验中,蔗糖与Tollon试剂等长时间加热时,有时也得阳性反应,如何解释这一现象?。

糖的化学性质实验报告总结糖是一种普遍存在的有机化合物,它们在生活中扮演着重要的角色。
有许多不同的类型的糖,每种类型的糖都有自己的化学性质。
本文将重点介绍糖的化学性质,并且以最近完成的化学实验报告为依据,进行总结。
首先,糖的化学性质包括它的结构、形态和其他一些物理性质。
结构方面,糖是由若干糖原子组成的聚糖,它们是一种水溶性有机物,具有一定的特定形状。
该类物质形态不定,但多为粉末状或液体状。
此外,糖具有独特的味道,有时有甜味或涩味。
糖有一些物理性质,其中最显著的是溶解性。
糖在水中很容易溶解,但在其他溶剂中溶解性就不那么好了,比如油,乙醇等。
还有一些较弱的电性质,对化学反应有一定的影响。
接下来介绍的是实验报告的内容。
首先,利用水溶液测定糖的溶解性,在水溶液中加入糖,测量溶解的数量。
结果表明,在1000ml的水中加入100g的糖,最终溶解的量为96g,溶解度达到96%。
其次,测定糖的形状,人们发现糖是粉末状,正常情况下,糖粒子形状是类圆柱体形,各个糖粒子大小不一,但概率分布在1-3毫米左右,还有少量长条状或纤维状的糖粒子。
最后进行的是酸碱反应的实验,结果表明,糖在弱酸性或弱碱性溶液中发生反应,并且溶液的pH值会相应增加或减少,说明糖具有一定程度的弱电性质,能与酸碱发生反应。
综上所述,糖及其各种类型都具有独特的物理性质和化学性质,其测试结果与前述性质一致。
糖具有较高的溶解性,呈现粉末形态,中性或弱酸性溶液中具有若干弱电性质。
该结论可以作为制作食品、制药、工业生产等的参考。
本文对于糖的化学性质的实验报告进行了介绍和总结,分析结果表明,糖具有较高的溶解性,呈现粉末形态,中性或弱酸性溶液中具有若干弱电性质,可以为后续的研究和应用提供参考。
此外,由于实验结果的误差可能会影响最终的总结,因此在实验过程中应注意准确性,以获得最精确的结果。