高中化学第三章自然界中的元素第3节硫的转化第1课时学案鲁科版必修1
- 格式:doc
- 大小:10.49 MB
- 文档页数:5

第3节 硫的转化1.自然界中的硫(1)自然界中不同价态硫元素间的转化在自然界里,硫既有游离态,又有化合态,游离态的硫存在于火山喷口附近或地壳的岩层里。
以化合态存在的硫分布很广,主要是硫化物和硫酸盐,如黄铁矿(FeS 2)、石膏(CaSO 4·2H 2O)、芒硝(Na 2SO 4·10H 2O)等。
硫的化合物也常存在于火山喷出的气体中和矿泉水里。
硫还是某些蛋白质的组成元素,人体内平均含有0.2%的硫。
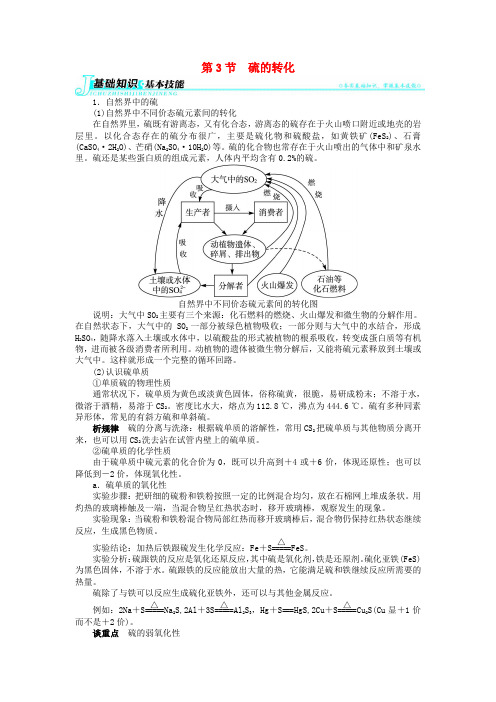
自然界中不同价态硫元素间的转化图说明:大气中SO 2主要有三个来源:化石燃料的燃烧、火山爆发和微生物的分解作用。
在自然状态下,大气中的SO 2一部分被绿色植物吸收;一部分则与大气中的水结合,形成H 2SO 4,随降水落入土壤或水体中,以硫酸盐的形式被植物的根系吸收,转变成蛋白质等有机物,进而被各级消费者所利用。
动植物的遗体被微生物分解后,又能将硫元素释放到土壤或大气中。
这样就形成一个完整的循环回路。
(2)认识硫单质①单质硫的物理性质通常状况下,硫单质为黄色或淡黄色固体,俗称硫黄,很脆,易研成粉末;不溶于水,微溶于酒精,易溶于CS 2。
密度比水大,熔点为112.8 ℃,沸点为444.6 ℃。
硫有多种同素异形体,常见的有斜方硫和单斜硫。
析规律 硫的分离与洗涤:根据硫单质的溶解性,常用CS 2把硫单质与其他物质分离开来,也可以用CS 2洗去沾在试管内壁上的硫单质。
②硫单质的化学性质由于硫单质中硫元素的化合价为0,既可以升高到+4或+6价,体现还原性;也可以降低到-2价,体现氧化性。
a .硫单质的氧化性实验步骤:把研细的硫粉和铁粉按照一定的比例混合均匀,放在石棉网上堆成条状。
用灼热的玻璃棒触及一端,当混合物呈红热状态时,移开玻璃棒,观察发生的现象。
实验现象:当硫粉和铁粉混合物局部红热而移开玻璃棒后,混合物仍保持红热状态继续反应,生成黑色物质。
实验结论:加热后铁跟硫发生化学反应:Fe +S=====△FeS 。

第3节硫的转化 第1课时 自然界中的硫—————————————————————————————————————[课标要求]1.了解硫元素在自然界中的转化、含硫元素的物质在自然界中的存在以及含硫物质的主要来源。
2.掌握硫单质的物理性质和化学性质。
,1.几种重要含硫化合物:黄铁矿(FeS 2)、石膏(CaSO 4·2H 2O)、芒硝(Na 2SO 4·10H 2O)。
2.自然界中的硫单质主要存在于火山口处。
3.硫黄是一种淡黄色固体,易溶于CS 2,微溶于酒精,不溶于水。
洗涤试管壁上残留的硫黄用CS 2或NaOH 溶液。
4.硫黄既有氧化性又有还原性,主要反应为Fe +S=====△ FeS ,S +O 2=====点燃SO 2。
5.硫黄在空气中燃烧产生淡蓝色火焰,在O 2中燃烧产生蓝紫色火焰。
自然界中硫的转化1.硫元素在自然界中的存在2.自然界中不同价态硫元素之间的转化[特别提醒] 硫元素的常见价态:-2、0、+4、+6;-2价硫元素只有还原性,+6价硫元素只有氧化性。
1.下列含硫物质中,硫元素只能表现还原性的是( )A .H 2SB .SO 2C .SD .H 2SO 4解析:选A H 2S -2中S 元素只有还原性;S +4O 2、S 0中S 元素为中间价态,既有氧化性又有还原性;H 2S +6O 4中S 元素为最高价态,只有氧化性。
2.用短线连接Ⅰ和Ⅱ中相关内容。
答案:①—C ②—D ③—A ④—A ⑤—B ⑥—B ⑦—D认识硫单质1.物理性质,二硫化碳微溶,酒精中不溶;溶解性:水中固体;俗名:硫黄;状态:淡黄色颜色:。
较低;熔、沸点:易溶中)2(CS[特别提醒](1)硫黄是中学阶段唯一呈黄色的固态非金属单质。
(2)实验室可用CS 2洗涤附着在试管壁上的硫黄;撒落金属汞时,可用硫黄粉除去。
2.硫的同素异形体。
单斜硫和斜方硫常见的有 3.化学性质(1)与非金属的反应一定条件下,S 能与O 2等非金属反应,化学方程式为S +O 2=====点燃SO 2,反应中硫的化合价。

鲁科版必修1:第三章自然界中的元素第三节硫的转化预习学案第一课时设计人:莱芜四中吕荣海20009.12.7学习目标:1.了解硫元素在自然界中的转化。
含硫物质在自然界的存在以及主要来源。
2.认识单质硫的物理性质和化学性质。
学习重点:单质硫的氧化性、还原性(与Fe,O2的反应)学习过程:一、自然界中的硫1.自然界中不同价态硫元素间的转化【阅读】:教材85页和86页图3-3-2问题:1.硫元素常见的化合价有哪些?2.火山爆发后地表中不同价态的硫是如何转化?(画出转化关系图)3.火山爆发后地下中不同价态的硫是如何转化?(画出转化关系图)2.单质硫错误!未找到引用源。
、物理性质【观察思考】溶解性颜色状态硬度熔沸点水中酒精中CS2中错误!未找到引用源。
化学性质:【预测】:1、S元素常见的化合价有-2,0,+4,+6,从化合价角度预测硫有性和性。
2.硫属于一种非金属单质,从物质分类的角度预测硫可以与哪些类别的物质反应?【实验探究】实验记录:实验现象解释或化学方程式结论与O2反应与Fe反应【问题】:1.Fe与S反应实验中,只加热混合物一端就能继续反应,这是为什么?2.铁与硫的生成物中铁是(+2价还是+3价)如何验证?(生成物不溶入水而溶于稀盐酸)3.写出Fe与氯气反应方程式,说明硫氧化性比氯气的氧化性(强或弱),理由[3]用途:自读课本了解硫用途。
黑火药爆炸所发生的主要反应得化学方程式为:S+2KNO3+3C==K2S+3CO2↑+N2↑,在此反应中硫表现什么性质?。
小结:硫的物理性质:硫的化学性质:错误!未找到引用源。
还原性反应方程式:错误!未找到引用源。
氧化性反应方程式:。
因硫不如氯气氧化性强,硫与变价金属反应,一般生成(填高或低)价金属化合物。
巩固练习:1.下列关于叙述正确的是()A.硫单质为淡黄色的晶体,不溶于水,易溶于酒精B.硫单质质脆易粉碎,易溶二硫化碳,加热易熔化C.只能以化合态存在于自然界中D.硫的熔沸点都高2.下列化合物中,不能由单质直接化合而成的是()A.FeSB.FeCl2C.SO2D.NO3.Cl2的氧化性比S的氧化性强,最主要的事实是()A.通常情况下硫为浅黄色固体,而氯气为黄绿色气体B.硫不溶于水,而氯气能溶于水C.与金属或氯气反应时,硫被还原为—2价而氯被还原成—1价D.与同一种金属反应时,金属被硫氧化成低价态,被氯气氧化成高价态4.实验室常用热的NaOH溶液洗去试管口的沾有的S,其反应如下6NaOH+3S=2Na2S+Na2SO3+3H2O 在此反应中硫表现的是()A.氧化性 B.还原性.C.既有氧化性又有还原性D.既无氧化性又无还原性。

第3节 硫的转化第1课时 自然界中的硫 二氧化硫[目标导航] 1.了解硫在自然界的存在,认识硫单质的主要性质和用途。
2.了解二氧化硫的物理性质,掌握二氧化硫的化学性质。
一、硫1.硫元素的存在硫元素在自然界中主要存在于海洋、大气、地壳中。
2.自然界中不同价态的硫元素间的转化 3.物理性质(2)硫与金属反应规律:①硫在一定条件下与大多数金属反应生成相应的硫化物。
②硫与变价金属反应生成低价态金属硫化物。
二、二氧化硫 1.物理性质2.(1)酸性氧化物的通性:①与水反应:向紫色石蕊试液中通入SO 2,溶液变红色,微热,溶液变紫色。
二氧化硫与水反应的化学方程式为H 2O +SO 2H 2SO 3。
②与碱反应:二氧化硫与NaOH 溶液反应的化学方程式为 2NaOH +SO 2===Na 2SO 3+H 2O(碱过量)或NaOH +SO 2===NaHSO 3(SO 2过量)。
③与碱性氧化物反应:二氧化硫与氧化钙反应的化学方程式为 CaO +SO 2=====△CaSO 3。
(2)漂白性:①向品红溶液中通入二氧化硫,振荡后溶液退色,再加热后,溶液颜色恢复红色。
②SO 2与某些有色物质生成不稳定的无色物质,这种无色物质易分解而使有色物质可恢复到原来的颜色。
(3)还原性:二氧化硫与氧气反应的化学方程式为2SO 2+O 2催化剂△2SO 3。
(4)氧化性:二氧化硫与硫化氢反应的化学方程式为SO 2+2H 2S===3S ↓+2H 2O 【练一练】1.下列说法正确的是________(填序号)。
(1)硫的非金属性较强,所以只以化合态存在于自然界中。
(2)分离黑火药中的硝酸钾、木炭、硫黄要用到二硫化碳、水及过滤操作。
(3)硫与金属或非金属反应时均作氧化剂。
(4)硫在空气中燃烧产物只是SO 2。
(5)不能由单质直接化合而制得CuS 、CuCl 2、Fe 2S 3、FeCl 2。
(6)用蒸馏水清洗试管内壁残留的硫。
第3节 硫的转化1.自然界中的硫(1)自然界中不同价态硫元素间的转化在自然界里,硫既有游离态,又有化合态,游离态的硫存在于火山喷口附近或地壳的岩层里。
以化合态存在的硫分布很广,主要是硫化物和硫酸盐,如黄铁矿(FeS 2)、石膏(CaSO 4·2H 2O)、芒硝(Na 2SO 4·10H 2O)等。
硫的化合物也常存在于火山喷出的气体中和矿泉水里。
硫还是某些蛋白质的组成元素,人体内平均含有0.2%的硫。
自然界中不同价态硫元素间的转化图说明:大气中SO 2主要有三个来源:化石燃料的燃烧、火山爆发和微生物的分解作用。
在自然状态下,大气中的SO 2一部分被绿色植物吸收;一部分则与大气中的水结合,形成H 2SO 4,随降水落入土壤或水体中,以硫酸盐的形式被植物的根系吸收,转变成蛋白质等有机物,进而被各级消费者所利用。
动植物的遗体被微生物分解后,又能将硫元素释放到土壤或大气中。
这样就形成一个完整的循环回路。
(2)认识硫单质①单质硫的物理性质通常状况下,硫单质为黄色或淡黄色固体,俗称硫黄,很脆,易研成粉末;不溶于水,微溶于酒精,易溶于CS 2。
密度比水大,熔点为112.8 ℃,沸点为444.6 ℃。
硫有多种同素异形体,常见的有斜方硫和单斜硫。
析规律 硫的分离与洗涤:根据硫单质的溶解性,常用CS 2把硫单质与其他物质分离开来,也可以用CS 2洗去沾在试管内壁上的硫单质。
②硫单质的化学性质由于硫单质中硫元素的化合价为0,既可以升高到+4或+6价,体现还原性;也可以降低到-2价,体现氧化性。
a .硫单质的氧化性实验步骤:把研细的硫粉和铁粉按照一定的比例混合均匀,放在石棉网上堆成条状。
用灼热的玻璃棒触及一端,当混合物呈红热状态时,移开玻璃棒,观察发生的现象。
实验现象:当硫粉和铁粉混合物局部红热而移开玻璃棒后,混合物仍保持红热状态继续反应,生成黑色物质。
实验结论:加热后铁跟硫发生化学反应:Fe +S=====△FeS 。

第1课时 自然界中的硫一、自然界中的硫1.硫的存在2.硫的转化预习交流1.硫在自然界中只能以化合态的形式存在吗?2.黄铁矿(FeS 2)中铁元素和硫元素的化合价是多少? 二、硫单质预习交流如何除去试管内壁上残留的硫粉?答案:一、1.FeS 2 Na 2SO 4·10H 2O CaSO 4·2H 2O2.H 2SO 3 H 2SO 4 FeS 2 As 4S 4 HgS As 2S 3 CaSO 4·2H 2O Na 2SO 4·10H 2O 预习交流:1.答案:不是,在火山喷口和地壳岩层中也存在游离态的硫单质。
2.答案:黄铁矿(FeS 2)中铁元素和硫元素的化合价分别是+2、-1。
二、硫黄 斜方硫 单斜硫 黄 淡黄 不 微溶 易溶 还原 S +O 2=====点燃SO 2 氧化 S +Fe=====△FeS 预习交流:答案:可以用CS 2洗去试管内壁上残留的硫粉。
一、硫的化学性质1.交流与研讨(1)从元素化合价的角度,预测硫单质可能具有什么化学性质? (2)从物质类别的角度,预测硫单质可能与哪几类物质反应? 2.实验设计1.通过什么现象说明铁粉与硫粉反应了? 2.移开玻璃棒后仍能剧烈反应说明什么?3.如何检验产物中铁元素的化合价为+2,还是+3? 4.硫在过量的氧气中燃烧时能生成SO 3吗?硫的性质(1)还原性:S 与O 2的反应;(2)氧化性:S 和H 2、Fe 、Cu 、Hg 等物质的反应;(3)既表现氧化性又表现还原性:6NaOH +3S △ 2Na 2S +Na 2SO 3+3H 2O 。
二、硫单质的氧化性强弱判断请同学们讨论并完成以下内容:(1)分别写出氯气、硫与铁反应的化学方程式。
(2)与氯气和铁的反应相比,硫与铁的反应产物有何特点?这说明了什么? (3)依据上述分析,分别写出氯气、硫和铜反应的化学方程式。
能够说明硫的氧化性比氯弱的事实有( )。

2019-2020年高中化学第三章第3节硫的转化第1课时自然界中的硫教案鲁科版必修1一. 教材分析:硫单质及其化合物的氧化性和还原性是本节的核心知识,不同价态硫元素间的转化能充分体现各种含硫物质的氧化性和还原性。
教材从硫元素在自然界中的存在和转化、实验室探究不同价态硫元素间的转化、生产生活中不同价态硫元素间的转化三个角度多层面分析硫的转化。
本节教材利用氧化还原反应的价态分析知识和实验设计来学习理解硫及其化合物,既是对新物质性质的学习又是对氧化还原反应、氧化剂和还原剂等理论的应用和进一步的理解与巩固。
二. 教学目标:【知识与技能】1.初步了解自然界中硫元素的存在形式及硫元素的氧化与还原。
2. 初步掌握硫、二氧化硫和浓硫酸的物理性质、化学性质及其用途。
3.进一步巩固研究物质化学性质的方法和思路。
学会从元素价态高低的比较分析认识物质的氧化性和还原性;从物质所含元素价态的变化分析物质的性质,设计实验验证物质性质。
4. 通过质疑和问题讨论培养学生分析问题的能力和总结、概括知识的能力。
【过程与方法】1.通过对自然界中硫的观察及其价态分析,得出其可能的化学性质。
2. 以硫的价态变化为中心,探究含硫物质的氧化性、还原性及用途。
3.掌握研究物质的方法――推测可能的性质、设计实验、观察现象、分析现象、得出结论,再辩证地分析结论适用的范围(如浓硫酸有强氧化性,通常被还原为二氧化硫,但也可能被还原为硫或硫化氢)。
【情感、态度与价值观】1.结合硫的化合价的变化及其组成、性质关系的教学,对学生进行物质组成结构决定物质性质,物质的性质决定物质的变化和应用的学科观点教育。
2.了解科学--技术--环境的关系,增强学生的社会责任感,通过收集资料,了解环境污染的现状,增强学生保护环境的意识。
教学重点:硫单质、二氧化硫和浓硫酸的性质。
教学难点:1.硫单质、二氧化硫和浓硫酸的氧化还原反应和配平,培养提高化学反应方程式书写的基本能力。
2.培养学生通过实验现象分析物质性质的能力。

第3节硫的转化互动课堂疏导引导一、硫1.硫的物理性质单质硫俗称硫磺,是黄色或淡黄色固体;很脆;不溶于水,微溶于酒精,易溶于二硫化碳;熔沸点较低。
记忆要诀硫的物理性质硫磺熔点沸点低,微溶酒精不溶水,二硫化碳作溶剂,质脆硫磺溶不微。
2.硫在自然界的存在硫在自然界既有游离态又有化合态;硫有多种同素异形体,常见的有斜方硫和单斜硫。
3.硫的化学性质硫有弱的氧化性和弱的还原性。
(1)与非金属反应H2+S点燃H2SS+O2点燃SO2(2)与金属反应2Na+S====Na2S2Cu+S====Cu2SFe+S====FeS方法点拨硫的化学性质的学习方法对于硫的化学性质的掌握,应抓住硫的化合价的变化这条主线,形成知识网络。
误区警示Fe粉和S粉的反应在空气中加热Fe粉和S粉的混合物,不要以为只是Fe与S进行反应,实际上除Fe与S进行反应外,Fe与O2、S与O2也发生了副反应。
知识拓展硫与金属反应硫与金属反应表现氧化性,S的氧化性比Cl2弱,通常使变价金属显低价。
但Hg与S的反应较特殊:不加热反应就能进行,且生成高价Hg。
水银洒落地面,可撒些硫磺与其反应,以防汞蒸气中毒。
案例1可以用两种单质直接化合而制得的物质是()A.Cu2S B.FeCl2C.FeS【剖析】单质硫和铜化合生成Cu2S,与铁反应生成FeS,氯气与铁化合生成FeCl3。
【答案】【借题发挥】氯气的氧化性比单质硫强,与变价金属反应时,氯气使变价金属显高价,而单质硫使变价金属显低价。
二、二氧化硫1.物理性质无色有刺激性气味的有毒气体,易溶于水,易液化,是一种大气污染物。
2.化学性质(1)SO2具有酸酐的通性:SO 2+ H2O H2SO3(易被氧化)2H2SO3+O2====2H2SO4(2)氧化性:SO2+2H2S====3S+2H2O(3)强还原性:2SO2+O22SO3(硫酸的酸酐)SO3+H2O====H2SO4SO2+Cl2+2H2O====H2SO4+2HCl要点剖析SO2的氧化性和还原性SO2中S的化合价为+4,处于中间价态,所以SO2既有氧化性又有还原性。

第3章第3节硫的转化(第1课时)【学习目标】1.熟练掌握硫和SO2的性质,能列举出自然界中不同价态硫元素之间的转化。
2.独立思考,小组合作,应用研究物质性质的程序,实验探究硫和SO2的化学性质。
3. 激情投入,了解硫及其化合物在生产、生活中的应用,树立环保意识。
【使用说明与学法指导】1.认真阅读教材P85-87,划出重要知识,明确自然界中硫的存在,常见含硫化合物。
所有同学都必须规范完成学案自主学习部分,并记熟基础知识。
2.结合课本和所学知识独立思考,用红笔标记或写出自学过程没能解决的问题或新生的疑问,准备课上讨论或质疑。
3.C层规范完成预习案并掌握课本相关的基础知识,AB层在掌握预习案基础上进一步完成探究案和针对训练。
标有★的训练题目C层不做。
预习案1.回顾总结学过的同素异形体有哪些?2. 根据硫的溶解性,如何除去试管内壁附着的硫?3. SO2如何引起的酸雨?用化学方程式表示。
【预习自测】1.下列说法不正确的是()A.硫是一种淡黄色的不溶于水的晶体B.硫的化合物常存在于火山喷出的气体中和矿泉水C.试管壁粘有硫粉可用二硫化碳洗涤D.硫在空气中的燃烧产物是二氧化硫,在纯氧中燃烧产物是三氧化硫【我的疑问】对课本预习内容,你还有什么疑问?探究案探究点:硫及二氧化硫的性质(育人立意:通过实验,提高动手操作能力、观察能力和主动探究能力。
)【化学与生活】硫及其化合物是我们日常生产生活中常见物质,在现代工业生产中扮演着重要角色。
你知道自然界中哪里存在硫单质吗?硫都能与那些物质反应?SO2对环境有哪些影响?如何造成的?它还有哪一些性质?【方法导引】可从运用观察、分类、实验、比较的方法来预测硝酸的化学性质,然后设计实验进行预测。
课题一:硫单质的性质实验操作实验现象结论及化学方程式实验1 取少量硫粉,放在试管中,观察它的颜色、状态;加入少量水,观察现象。
另取少量硫粉,放在试管中,加入少量二硫化碳,观察现象。
实验2 把研细的硫粉和铁粉按照一定的比例混合均匀,放在石棉网上堆成条状。

第3章第3节硫的转化【本讲教育信息】一. 教学内容:第3章第3节硫的转化二. 教学目的1、掌握硫单质的性质和用途2、掌握二氧化硫的性质和用途3、认识浓硫酸的强氧化性4、了解酸雨的成因、危害和防护措施三. 教学重点、难点二氧化硫及浓硫酸的性质四. 知识分析(一)自然界中的硫1、自然界中不同价态硫元素间的转化(1)硫元素在自然界中的存在硫元素广泛存在于自然界中,在火山口附近有硫单质存在,其余主要以化合态存在于海洋、大气、地壳及动植物体内。
(2)自然界中不同价态硫元素的转化火山喷发时,部分硫转化为硫化氢气体,部分硫转化为二氧化硫和三氧化硫气体,二氧化硫在大气中易被氧化为三氧化硫,二氧化硫和三氧化硫溶于水,分别生成亚硫酸和硫酸,一些微生物又继续将酸转化为硫或硫化氢。
此外,火山喷发时还有部分硫与含有铁、砷、汞等元素的物质反应,形成矿物,而暴露于地面的多种含硫矿物,受氧气和水蒸气作用又生成新的物质,如石膏、芒硝等。
2、认识硫单质(1)物理性质:通过实验认识和探究硫的物理性质通常硫是一种黄色或淡黄色的固体,很脆,易研成粉末。
不溶于水,微溶于酒精,易溶于二硫化碳,熔点和沸点较低。
硫有多种同素异形体,常见的有斜方硫和单斜硫。
(2)化学性质:分析:硫元素的化合价有-2、0、+2、+4、+6,硫单质0价,居于中间价态,既有氧化性又有还原性。
①氧化性与金属:Fe +S ∆FeS 2Cu +S ∆Cu2S 2Na +S =Na2S (研磨)Hg +S ∆HgS与非金属:H2+S ∆H2S 2S +C ∆CS2黑火药的爆炸:S +2KNO3+3C点燃K2S +3CO2 ↑+N2↑说明:比较硫与氯气分别与变价金属如铁、铜的反应可知,氯气的氧化性大于硫。
②还原性硫在空气中燃烧,发出淡蓝色的火焰,在纯氧中燃烧剧烈,发出蓝紫色火焰,产物都是二氧化硫。
S +O2点燃SO2思考:下列反应表现了硫的什么性质:3S + 6 NaOH △2Na2S +Na2SO3+3H2O结合硫的其他性质分析,如果洗去沾在试管壁上的硫,用什么方法?(解答:此反应表现了硫的氧化性和还原性;可以用CS2洗涤或用热碱液洗涤。

第 3 节硫的转变第1课时学习目标:1. 认识不一样价态硫元素在自然界中的转变、含硫元素的物质在自然界中的存在以及含硫物质的主要本源。
2.认识硫单质的物理性质和化学性质。
知识点一自然界中不一样价态硫元素间的转变【研究活动】火山喷发时熔岩喷涌、浓烟滔滔,不但开释出巨大的能量,并且产生好多含硫元素的物质。
思虑: (1) 火山口周边的黄色物质可能是什么?(2)火山喷发时有含硫的气体产生,含硫的气体可能有哪些?你认识这些气体的性质吗?(3)自然界中还有哪些含硫化合物?它们在自然界中是如何产生和存在的?思虑以上问题,完成以下填空:1.自然界中的硫存在硫元素在自然界中主要存在于_____________________________________________ ________________ 。
2.自然界中硫的转变【学以致用】1.考古科学家在大洋的小岛下钻井取堆积层样品解析,发此刻公元前1200年及公元600年的堆积样中的硫酸盐的含量大大超出其余年份的堆积样。
由此推测这些年月中,有较屡次的火山喷发活动,为何可以这样推测?请说明原由并写出必需的化学方程式。
________________________________________________________________________知识点二认识硫单质【研究活动】1.实验(1)分别取一些硫黄加入三支试管中,编号为 1、 2、 3。
观察试管中硫黄的颜色、状态;而后在 1、 2、 3号试管中分别加入 2 mL水、乙醇、二硫化碳,振荡,静置,观察现象;(2) 从 2号试管中取一滴管上层清液,加适当水,观察现象,比较硫在水和乙醇中的溶解度。
(3)将试管中的硫粉加热,观察现象。
(4)由以上实验归纳硫单质的物理性质。
2.颜色状态溶解性熔、沸点不溶于 ____,微溶于 ______,易溶于 ______都不高把研细的硫粉和铁粉依据必定的比率( 铁粉过分 ) 混杂平均,放在石棉网上堆成条状俗名硫黄( 或字母形状 ) ,用灼热的玻璃棒涉及一端。

第3章自然界中的元素第3节 硫的转化第1课时导学案1【学习目标】1.了解含硫元素的物质在自然界中的存在以及含硫物质的主要来源。
2.掌握硫单质和二氧化硫的性质,会依据酸性氧化物的通性及硫元素的化合价分析理解硫的氧化物的性质。
【学习过程】 一、硫的存在和性质1.硫在自然界中的存在形态有游离态,存在于________________或______________;有化合态,主要是__________________。
火山喷出物中含有大量的______________,如H 2S 、SO 2、SO 3等,化石燃料如____________等也含有硫元素,硫还是组成某些__________的生命元素。
2.硫单质俗称________,常见的同素异形体有__________、__________。
单质硫是______色或________色固体,很脆,________溶于水,________溶于酒精,________溶于二硫化碳。
3.硫是较活泼的非金属单质,能与许多金属单质、非金属单质发生反应。
请写出硫分别与①Fe 、②Cu 、③H 2、④O 2反应的化学方程式,并指明各反应的氧化剂和还原剂。
①______________________________________________________________________; ②______________________________________________________________________; ③______________________________________________________________________; ④______________________________________________________________________。
二、归纳总结】硫单质中硫元素化合价为0,在化学反应中,化合价既可以升高又可以降低,表现出________________。

第3节硫的转化第1课时自然界中的硫二氧化硫[目标导航] 1.了解硫在自然界的存在,认识硫单质的主要性质和用途。
2.了解二氧化硫的物理性质,掌握二氧化硫的化学性质。
一、硫1.硫元素的存在硫元素在自然界中主要存在于海洋、大气、地壳中。
2.自然界中不同价态的硫元素间的转化3.物理性质(2)硫与金属反应规律:①硫在一定条件下与大多数金属反应生成相应的硫化物。
②硫与变价金属反应生成低价态金属硫化物。
二、二氧化硫1.物理性质2(1)酸性氧化物的通性:①与水反应:向紫色石蕊试液中通入SO 2,溶液变红色,微热,溶液变紫色。
二氧化硫与水反应的化学方程式为H 2O +SO 2H 2SO 3。
②与碱反应:二氧化硫与NaOH 溶液反应的化学方程式为 2NaOH +SO 2===Na 2SO 3+H 2O(碱过量)或NaOH +SO 2===NaHSO 3(SO 2过量)。
③与碱性氧化物反应:二氧化硫与氧化钙反应的化学方程式为CaO +SO 2=====△CaSO 3。
(2)漂白性:①向品红溶液中通入二氧化硫,振荡后溶液退色,再加热后,溶液颜色恢复红色。
②SO 2与某些有色物质生成不稳定的无色物质,这种无色物质易分解而使有色物质可恢复到原来的颜色。
(3)还原性:二氧化硫与氧气反应的化学方程式为2SO 2+O 2催化剂△2SO 3。
(4)氧化性:二氧化硫与硫化氢反应的化学方程式为SO 2+2H 2S===3S↓+2H 2O【练一练】1.下列说法正确的是________(填序号)。
(1)硫的非金属性较强,所以只以化合态存在于自然界中。
(2)分离黑火药中的硝酸钾、木炭、硫黄要用到二硫化碳、水及过滤操作。
(3)硫与金属或非金属反应时均作氧化剂。
(4)硫在空气中燃烧产物只是SO 2。
(5)不能由单质直接化合而制得CuS 、CuCl 2、Fe 2S 3、FeCl 2。
(6)用蒸馏水清洗试管内壁残留的硫。
答案 (2)(4)解析 (1)不正确,元素在自然界中的存在形式虽然与化学活泼性有关,但不能把非金属性强弱作为唯一判断依据。
第1课时 自然界中的硫
一、自然界中的硫
1.硫的存在
2.硫的转化
预习交流
1.硫在自然界中只能以化合态的形式存在吗?
2.黄铁矿(FeS 2)中铁元素和硫元素的化合价是多少?
二、硫单质
预习交流
如何除去试管内壁上残留的硫粉?
答案:一、1.FeS 2 Na 2SO 4·10H 2O CaSO 4·2H 2O
2.H 2SO 3 H 2SO 4 FeS 2 As 4S 4 HgS As 2S 3 CaSO 4·2H 2O Na 2SO 4·10H 2O
预习交流:
1.答案:不是,在火山喷口和地壳岩层中也存在游离态的硫单质。
2.答案:黄铁矿(FeS 2)中铁元素和硫元素的化合价分别是+2、-1。
二、硫黄 斜方硫 单斜硫 黄 淡黄 不 微溶 易溶 还原 S +O 2=====点燃SO 2 氧化
S +Fe=====△FeS
预习交流:答案:可以用CS 2洗去试管内壁上残留的硫粉。
一、硫的化学性质
1.交流与研讨
(1)从元素化合价的角度,预测硫单质可能具有什么化学性质?
(2)从物质类别的角度,预测硫单质可能与哪几类物质反应?
2
1.通过什么现象说明铁粉与硫粉反应了?
2.移开玻璃棒后仍能剧烈反应说明什么?
3.如何检验产物中铁元素的化合价为+2,还是+3?
4.硫在过量的氧气中燃烧时能生成SO 3吗?
硫的性质
(1)还原性:S 与O 2的反应;
(2)氧化性:S 和H 2、Fe 、Cu 、Hg 等物质的反应;
(3)既表现氧化性又表现还原性:6NaOH +3S △ 2Na 2S +Na 2SO 3+3H 2O 。
二、硫单质的氧化性强弱判断
请同学们讨论并完成以下内容:
(1)分别写出氯气、硫与铁反应的化学方程式。
(2)与氯气和铁的反应相比,硫与铁的反应产物有何特点?这说明了什么?
(3)依据上述分析,分别写出氯气、硫和铜反应的化学方程式。
能够说明硫的氧化性比氯弱的事实有( )。
①通常状况下硫为固体,氯气为气体
②与金属单质反应,硫被还原为-2价,氯被还原为-1价
③Cl 2与铁反应生成FeCl 3,S 与铁反应生成FeS
④将Cl 2通入氢硫酸(H 2S )中可置换出硫
A .①②③ B.②④ C.②③④ D.③④
1.硫单质的氧化性较弱,与Fe 、Cu 等变价金属反应时,产物均为低价态的金属硫化物。
2.反应2Al +3S △ Al 2S 3是制备Al 2S 3的唯一方法。
3.S 与金属Hg 在常温下即可发生反应生成HgS ,因此当水银洒落到地面上时,可撒些硫粉吸收,以防止汞中毒。
答案:活动与探究1:
1.答案:(1)硫单质中硫元素的化合价为0,处于中间价态,发生化学反应时,硫元素的化合价可以升高,表现还原性;硫元素的化合价可以降低,表现氧化性。
(2)硫单质属于非金属单质,应该具有与Cl 2等非金属单质相似的性质,可以与金属单质和非金属单质反应。
2.混合物呈红热状态,有火星产生,移开玻璃棒后反应仍然进行,小磁铁落下 氧化
性 S +Fe=====△FeS 熔化 燃烧 微弱的淡蓝色 无色有刺激性气味的气体 还原性 S
+O 2=====点燃SO 2 明亮的蓝紫色 S +O 2=====点燃SO 2
思考与交流:
1.答案:通过小磁铁的掉落可以说明铁粉与硫粉发生了化学反应。
2.答案:移开玻璃棒后仍能剧烈反应说明该反应是放热反应。
3.答案:取反应后的生成物少许于试管中,加入适量的稀盐酸溶解后,滴加KSCN 溶液,若溶液不变红色,则说明产物中铁元素的化合价为+2;若溶液变红色,则产物中铁元素的化合价为+3。
4.答案:硫在氧气中燃烧只能生成SO 2,不能生成SO 3。
活动与探究2:答案:(1)2Fe +3Cl 2=====点燃2FeCl 3 Fe +S=====△FeS
(2)硫与金属反应生成低价态的金属硫化物,这说明了硫单质的氧化性较弱,氯气的氧化性强于硫的氧化性。
(3)Cu +Cl 2=====点燃CuCl 2 2Cu +S=====△Cu 2S
迁移与应用:D 解析:①为物理性质,不正确;氧化性强弱是指得电子能力的强弱,
氧化性强弱与得电子多少无直接关系,②不正确;③④均能说明Cl 2得电子能力比S 强,③④正确。
1.下列化合物能用相应元素的单质直接化合生成的是( )。
①CuS ②FeS ③Al 2S 3 ④Fe 2S 3 ⑤Cu 2S ⑥FeCl 2⑦H 2S ⑧FeCl 3
A .②③⑤⑦⑧ B.①④⑥⑦ C .②③⑤⑥⑦ D.④⑥⑦⑧
2.关于硫的叙述正确的是( )。
①1 mol Fe 分别与足量的Cl 2、S 反应消耗a mol Cl 2、b mol S ,且a =b ②分离黑火药中的硝酸钾、炭、硫要用到二硫化碳、水以及过滤操作 ③硫与金属或非金属反应均作氧化剂 ④1.6 g 硫与6.4 g 铜反应得到8.0 g 纯净硫化物
A .①③ B.②④ C.①④ D.②③
3.实验室常用热的NaOH 溶液洗去试管上沾有的硫,其反应如下:6NaOH +3S △ 2Na 2S +Na 2SO 3+3H 2O ,在此反应中,氧化剂与还原剂的质量之比是( )。
A .2∶1 B.1∶2 C.5∶6 D.6∶5
4.(1)黑火药爆炸时发生的反应是S +2KNO 3+3C 点燃 K 2S +3CO 2↑+N 2↑,反应中的氧化剂是________,每生成1 mol CO 2转移__________ mol 电子。
(2)在空气中加热S 粉和Fe 粉的混合物,可观察到下列现象,请写出有关反应方程式。
①有淡蓝色火焰,且生成刺激性气味的气体____________________。
②混合粉末变红,放出热量,最后变为黑色固体__________________。
③不时有火星从混合物中射出________________________________________________。
答案:1.A 解析:硫与具有可变化合价的金属反应时,只能将其氧化至较低价态,所以金属Fe 和Cu 在加热条件下与硫单质反应时,只能生成FeS 和Cu 2S ,而不是Fe 2S 3和CuS 。
而氯气的氧化性很强,在与Fe 反应时可将其氧化为高价态,故反应产物为FeCl 3,而不是FeCl 2。
硫在与其他非金属反应时,若该元素的非金属性弱于硫,则硫表现出氧化性,在生
成物中硫为-2价,如H 2+S=====点燃H 2S ;若该元素的非金属性强于硫,则硫将被氧化,表现出
还原性,在生成物中硫显正价,如S 与氧气点燃时生成二氧化硫。
2.B 解析:Fe 与Cl 2、S 反应的化学方程式为:2Fe +3Cl 2=====点燃2FeCl 3、Fe +S=====△FeS ,
故1 mol Fe 分别与足量的Cl 2、S 反应消耗1.5 mol Cl 2、1 mol S ,故a >b ,①不正确;分离黑火药中的三组分可利用它们溶解性的差异:先用CS 2处理,使硫溶解,滤渣再用水处理,溶解硝酸钾,过滤,滤渣为炭粉。
滤液蒸发、浓缩、结晶,得到硝酸钾,②正确;当硫单质
与金属反应时,硫作氧化剂;与非金属反应时应具体分析硫的价态变化,如在S +O 2=====点燃SO 2
中S 作还原剂,在S +H 2=====点燃H 2S 中S 作氧化剂,③不正确;Cu 与S 反应时
2Cu + S=====△Cu 2S
2×64 32 160
6.4 g 1.6 g 8.0 g
所以1.6 g 硫与6.4 g 铜反应得到8.0 g 纯净硫化物,④正确。
3.A 解析:氧化剂是指反应中化合价降低的物质,还原剂是指反应中化合价升高的物质。
从化学方程式看,反应中只有硫元素的化合价发生变化,且氧化剂与还原剂的质量之比为2∶1。
4.答案:(1)S 、KNO 3 4
(2)①S+O 2=====点燃SO 2
②Fe+S=====△FeS
③3Fe+2O 2=====点燃Fe 3O 4
解析:(1)该反应中S 元素和KNO 3中的N 元素化合价降低,所以单质S 和KNO 3是氧化剂;C 元素化合价由0升高到+4,因此每生成1 mol CO 2转移4 mol 电子。
(2)S 在空气中燃烧产生淡蓝色火焰,生成SO 2;混合粉末变红并放热是因为Fe 与S 反应生成FeS ;有火星放出是因为Fe 与O 2反应。