离子反应1
- 格式:ppt
- 大小:1.81 MB
- 文档页数:84


编号NO. 武安市第十中学高一化学(苏教版)必修—第二专题第二单元主备:姜亚妮主审:曹俊彦离子反应(第一课时)学习目标1.理解强电解质和弱电解质的概念。
2.学会书写常见强电解质和弱电解质的电离方程式。
重点难点强、弱电解质有关概念的辨析,弱电解质电离方程式的书写。
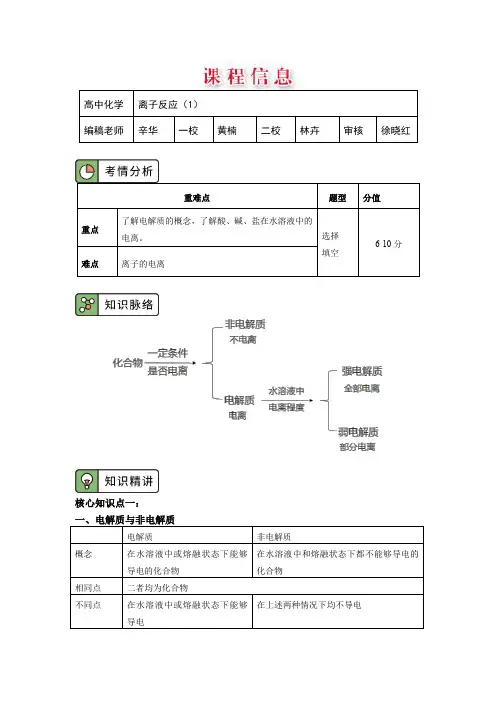
学习过程复习:1.电解质:在里或状态下能够导电的化合物。
如:氯化钠、硝酸钾、氢氧化钠等。
非电解质:在水溶液或熔融状态下都不的化合物。
如:CO2、SO2、SO3、NH3、蔗糖、酒精等。
2. 电离:电解质在水溶液中或熔化状态下产生自由移动离子的过程。
注意:单质既不是电解质也不是非电解质。
练习1:根据有关概念回答下列问题:①Cu ②CuSO4晶体③熔化的KNO3 ④CO2⑤盐酸⑥NaCl溶液判断上述物质中:能够导电的是;属于电解质的是;属于非电解质的是。
练习2:电离方程式的书写Ba(OH)2NaClNa2SO4NaHCO3NaHSO4(水溶液中)【自主探究】一、强电解质和弱电解质1、强电解质:在水溶液中能的电解质。
常见物质:强酸—、、、HBr、HI、HClO4等。
强碱—、、Ca(OH)2、Ba(OH)2等。
大多数盐—NaCl、KNO3、AgCl、BaSO4、CaCO3等。
2、弱电解质:在水溶液中的电解质。
常见物质:弱酸—、、、H2SO3、H2S。
弱碱—、Fe(OH)3、Cu(OH)2、Mg(OH)2。
水二、弱电解质的电离CH3COOH HClONH3•H2O H2O【互动交流】强调:1、电解质的强弱与溶解度无关。
2、强电解质的导电性不一定比弱电解质强。
3、溶液的导电性取决于离子的浓度和离子所带的电荷数有关。
【课堂展示】【达标检测】1、下列物质既不是电解质,又不是非电解质的是()A.食盐水B.H2OC. NaHSO4D. Ca(OH)22、下列物质能够导电又是强电解质的是()A . NaCl晶体B.液态氯化氢C.熔融的KNO3 D. NH3·H2O3、下列物质的水溶液能导电,且属于非电解质的是()A . CH3COOH B. SO2C. NaHCO3D. NaOH4、下列电离方程式错误的是( ) A.NaHCO3=Na++HCO3-B.NaHSO4=Na++H++SO42-C.H2SO4=2H++SO42-D.KClO3=K++Cl-+3O2-5、下列电离方程式错误的是()A .Ba(OH)2=Ba2+ + 2 OH-B. NaHSO4(熔融)=Na+ + H ++ SO42-C.MgCl2=Mg2+ + 2 Cl-D. H2SO4=2H+ + SO42-。
核心知识点一:注意:(1)电解质、非电解质均应是化合物。
金属属于单质,故既不是电解质,也不是非电解质。
(2)电解质导电必须有外界条件:水溶液或熔融状态。
(3)电解质应是一定条件下本身电离而导电的化合物;CO2、SO2、SO3、NH3溶于水后也导电,却是与水反应生成新物质后电离而导电的,不是本身电离导电的,故属于非电解质。
(4)能导电的物质并不一定是电解质,如铜、铝、石墨能导电,但因其为单质,故不属于电解质(也不属于非电解质);食盐水能导电,但其为混合物,不属于电解质。
溶于水不能导电的物质可能是电解质,如BaSO4难溶于水,但其溶于水的部分是完全电离的,属于电解质。
核心知识点二:强电解质与弱电解质强电解质——在水中能够完全电离的电解质;如强酸(H2SO4、HNO3、HCl、HBr、HI)、强碱(KOH、NaOH、Ba(OH)2、Ca(OH)2)和大多数盐。
弱电解质——在水中不能够完全电离的电解质;如纯水,弱酸(HF、HClO、CH3COOH、H2SO3、H2CO3、H2SiO4,H3PO4)、弱碱(NH3·H2O、Fe(OH)3、Mg(OH)2等)、个别盐(醋酸铅)三、电离1. 溶液的导电性溶液导电是有条件的:有自由移动的电子或者阴阳离子;而电解质水溶液里或熔融状态下一般可产生自由移动的阴阳离子。
强碱和盐等离子化合物在固态时,固体内虽然存在阴、阳离子,但是不能自由移动,所以不能导电;在熔融状态或水溶液里能电离出自由移动的离子,故能导电。
酸在固态或液态(熔融状态)时只有分子,没有自由移动的离子,因而也不导电,如液态HCl、H2SO4等不能导电;但是在水溶液里受水分子的作用,电离产生自由移动的离子,因而能够导电。
电解质溶液的导电能力影响因素:①溶液中离子浓度②离子所带电荷多少。
即离子浓度越大,离子所带电荷越多,溶液导电能力越强。
所以,溶液导电能力的强弱与该溶液是强电解质溶液还是弱电解质溶液无关,即盐酸溶液的导电性不一定比醋酸溶液强。