ELISA、MAIA、CLIA和TRFIA试剂盒质量标准探讨
- 格式:pdf
- 大小:410.35 KB
- 文档页数:5

ELISA技术的质量控制标签:ELISA 分类:临床工作2007-07—25 15:15ELISA简介:酶联免疫吸附试验(Enzyme Linked ImmunoSorbent Assay,ELISA)于1971年分别由瑞典学者和荷兰学者报道,开创了运用酶标记免疫技术进行液体标本中微量物质测定的实验方法.基本原理是把抗原或抗体在不损坏其免疫活性的条件下预先结合到某种固相载体表面,测定时,将受检样品(含待测抗体或抗原)和酶标抗原或抗体按一定程序与结合在固相载体上的抗原或抗体起反应形成抗原或抗体复合物,经洗涤去除反应液中其他物质,加入酶反应底物后,在酶的催化下变为有色物质,最后通过定性或定量分析有色产物量即可确定样品中被测物质量。
此方法具有高度的敏感性和特异性,酶标试剂比较稳定,且易于自动化,因此应用非常广泛,几乎所有的可溶性抗原抗体系统均可使用,我室开展的肝炎病原学检测、HIV抗体检测、梅毒抗体检测等都使用ELISA方法。
ELISA质量保证是一个复杂的过程,许多重要的环节都影响到检测的质量。
一、方法学的影响ELISA测定模式包括以下几种:双抗体夹心法、间接法、双抗原夹心法、IgM抗体捕捉法、竞争抑制法,其中竞争抑制法(HBeAb,HBcAb 等采用)因受操作时差所引起的不公平竞争等因素的影响,结果重复性较差,质量较难控制。
二、试剂因素不同批次的ELISA试剂在制作过程中很难保证质量完全一致,即使是通过批批检的项目其检测结果也存在差异,因此必须选择和订购长批号的试剂,并保证保存条件。
严格执行这一标准可以避免因试剂批号改变而重新建立质控体系及重新评估试剂的复杂过程,并且能够保证结果的稳定性;对于效期短、使用率低的试剂,应当小量分装,每次使用则取分装部分即可,避免反复冻融造成试剂的失效。
试剂使用前必须平衡至室温,否则会影响检测下限。
未用完的室内质控品及本次不需使用的试剂应密封并及时放回冰箱保存。
三、样本因素标本干扰因素包括内源性干扰因素和外源性干扰因素,前者包括类风湿因子、补体、异嗜性抗体、自身抗体、溶菌酶等,后者包括标本溶血、标本被细菌污染、标本贮存时间过长、标本凝固不全、冷冻标本的反复冻融等.其中外源性干扰因素是我们在检测过程中可以避免也是必须避免的因素,而避免内源性因素的干扰则主要通过选择合适的试剂盒。

不同方法学检测乙型肝炎血清标志物结果的评价分析【中图分类号】r446【文献标识码】a【文章编号】1672-3783(2011)06-0275-01【摘要】目的:探讨酶联免疫吸附试验(elisa)、时间分辨免疫荧光法(trfia)、化学发光法(clia)三种乙型肝炎血清标志物检测方法的精密度和检测灵敏度。
方法:用酶联免疫吸附试验、时间分辨免疫荧光法、化学发光法分别测定经乙型肝炎病毒dna定量检测阳性患者的hbsag水平,分析三种方法的检测灵敏度和和精密度。
结果:化学发光法测定灵敏度较酶联免疫吸附试验法和时间分辨免疫荧光法测定灵敏度高,三种方法用于低浓度hbsag检测时,化学发光法的阳性检出率较酶联免疫吸附试验和时间分辨免疫荧光法均高,差异明显,p<0.05,差异具有统计学意义。
结论:化学发光法法具有检测灵敏度高、对hbsag阳性检出率高的特点,其优势尤其在检测低浓度hbsag时体现更充分,值得临床作为低浓度hbsag 检测时推广应用。
【关键词】乙型肝炎血清标志物;酶联免疫吸附试验(elisa);时间分辨免疫荧光法(trfia);化学发光法(clia)临床上常用乙肝血清标志物作为诊断乙肝病毒感染与否的诊断标准,本资料采用elisa(酶联免疫吸附试验)、 (trfia)、 (clia)三种方法对经乙型肝炎病毒(hbv)dna定量检测的阳性患者的hbsag 水平进行检测,分析三种方法的检测灵敏度和精密度。
1 对象和方法1.1对象临床样本先经乙肝病毒 dna定量聚合酶链反应方法进行检测呈阳性,然后采用电化学光反应检测方法遴选下列模式: 1~50hbsag coi临床样本30例, 小于1hbsag coi的临床样本30例,其中男26例,女34例,患者年龄从18岁至55岁不等。
1.2检验方法按照试剂盒说明书进行酶联免疫吸附试验测定,按照elecsys2010全自动电化学发光仪和配套试、酶标仪等仪器设备使用说明书及检验科相关准操作程序进行样品检测。

乙型肝炎病毒血清学检验中 CLIA与ELISA的应用及准确性分析摘要:目的:分析乙型肝炎病毒(HBV)血清学检验中化学发光免疫分析技术(CLIA)与酶联免疫吸附试验(ELISA)的应用及准确性。
方法:研究对象时本院患者,选取时间为2020年2月~2021年2月,研究中所选患者均接受HBV血清学检验,患者例数50。
本组患者分别进行CLIA与ELISA,分析两种方法的应用价值和准确性。
结果:CLIA法HBsAg、HBeAb、HBeAg检出率高于ELISA法;CLIA法0.06~0.10、0.11~0.50IU/ml水平检出率高于ELISA法(P<0.05);CLIA法敏感性、准确性高于ELISA法。
结论:对于感染HBV患者,病毒血清检验工作属于首选诊断方式,CLIA法相比于ELISA法准确性更高,应用价值明显。
关键词:乙型肝炎病毒;血清学检验;CLIA;ELISA乙型肝炎属于临床常见传染疾病,病因通常是感染乙型肝炎病毒(HBV),当患者机体携带过多的相关病毒,其中隐藏的HBV病毒就会被激活,产生明显破坏效果,患者因此也会发生乙肝疾病[1]。
乙肝疾病需要积极规范治疗,伴随疾病进展,疾病会逐渐演变成肝硬化,肝癌以及肝脏衰竭,严重影响患者身心健康和生存质量,病死率较高。
当出现病毒感染后,人体中免疫系统会对此产生特异性免疫反应,进行血清学检验能够了解患者机体中病毒含量,从而诊断疾病,指导治疗方案,评估预后等。
1资料与方法1.1临床资料研究对象时本院患者,选取时间为2020年2月~2021年2月,研究中所选患者均接受HBV血清学检验,患者例数50。
本组患者中,男性29例,占比58%,女性21例,占比42%。
年龄范围在25~74岁之间,年龄均值为(52.34±6.38)岁。
本研究所选患者均在了解检查内容后自愿参与研究,同时签署医学研究协议,研究中各操作符合伦理会标准。
1.2方法1.2.1仪器与试剂全自动化学发光免疫分析仪(罗氏cobas e 801);酶联免疫检测仪(赛默飞Thermo Scientific MK3);CLIA试剂盒(深圳迈瑞生物医疗电子股份有限公司);ELISA试剂盒(上海玉博生物科技有限公司)。

CLIA和ELISA检测血清HBsAg及HBsAb的结果比较许文;邝琳;张振林【摘要】目的:比较化学发光免疫分析(CLIA)和酶联免疫吸附试验(ELISA)检测血清HBsAg及HBsAb的结果。
方法采用CLIA法和ELISA法测定定值血清中的HBsAg和HBsAb,并对两种结果进行比较和分析。
结果测定HBsAg时,ELISA法的批内CV:1IU/ml为9.6%,2IU/ml为7.3%,批间CV:1IU /ml为17.8%,2IU/ml为15.1%,灵敏度为0.25IU/ml,CLIA法的批内CV:1IU/ml为2.33%,2IU /ml为1.07%,批间CV:1IU /ml为6.57%,2IU/ml为3.78%,灵敏度为0.063IU/ml。
HBsAb测定时,ELISA法的批内CV:10mIU/ml为11.8%,20mIU/ml为8.7%,批间CV:10mIU/ml为18.6%,20mIU/ml为15.9%,灵敏度为10mIU/ml,CLIA法的批内CV:10mIU/ml为4.79%,20mIU/ml为3.52%,批间CV:10mIU/ml为7.58%,20mIU/ml为6.13%,灵敏度为2.5mIU/ml。
结论 ELISA法敏感度相对低,精密度差;CLIA法灵敏度高,精密度好,且自动化程度高,检测更快速,更适合于临床。
【期刊名称】《现代诊断与治疗》【年(卷),期】2014(000)007【总页数】2页(P1467-1468)【关键词】乙肝表面抗原;乙肝表面抗体;酶联免疫吸附试验;化学发光免疫分析【作者】许文;邝琳;张振林【作者单位】珠海市人民医院检验科,广东珠海519000;珠海市人民医院检验科,广东珠海 519000;珠海市人民医院检验科,广东珠海 519000【正文语种】中文【中图分类】R446.1目前,我国大多数医院采用ELISA法检测血清HBsAb和HBsAg,该法虽简便,但ELISA法重复性差,灵敏度低,且当标本中的HBsAg浓度太低时,因灵敏度低而出现假阴性,容易造成漏检,当浓度过高时会因钩状效应(Hook effect)出现假阴性,因此正有逐步被新方法所取代的趋势。


ELISA检测试剂的评价方法共3篇ELISA检测试剂的评价方法1ELISA检测是一种常见的生化实验技术,在医药、生物科技、食品安全等领域具有广泛的应用。
为了确保检测结果的准确性和可重复性,评价ELISA检测试剂的质量至关重要。
本文将介绍ELISA检测试剂的评价方法。
ELISA检测技术是一种通过特异性结合测定物质的抗体来检测一种特定分子的技术。
ELISA检测用于蛋白质检测的技术最为常见,该技术可用于定量和定性检测,同时还可用于特定抗体的筛选。
ELISA检测中使用的试剂通常包括抗体、标记物、溶液、底物等,这些试剂的质量直接影响ELISA检测的准确性和可重复性。
以下是ELISA检测试剂的评价方法:一、抗体质量评价ELISA检测中使用的抗体质量直接影响试剂的稳定性、灵敏度、准确性和特异性。
评价抗体质量的方法包括:1. 抗体中和试验:将阴性样本加入含有一定浓度规格的抗体试剂中,观察是否能够完全中和抗体活性,以确定抗体的含量和活性。
2. 交叉反应检测:检测抗体与其他物质的交叉反应,以确保其特异性。
3. 敏感度评价:使用正样本连续稀释,评价抗体的灵敏度。
二、标记物质质量评价ELISA检测中的标记物质通常为酶、放射性同位素、荧光染料等。
标记物质的质量评价包括:1. 活性评价:采用试剂盒相同的操作步骤,使用标准浓度的标记物测试,观察标记物质的活性。
2. 稳定性检测:测定标记物的稳定性和保存期限,以确定其适宜使用的时间。
三、溶液质量评价ELISA检测中使用的溶液包括缓冲液、洗涤液、稀释液等。
溶液质量评价包括:1. pH值测定:测定缓冲液的pH值,以确保其适当的pH值范围。
2. 无菌性检测:对洗涤液和其他溶液进行无菌性检测,以确保检测结果的准确性。
3. 稳定性检测:测定溶液的稳定性和保存期限,以确定其适宜使用的时间。
四、保存和运输质量评价保存和运输过程中的温度和湿度等环境因素会影响试剂盒的质量。
评价保存和运输质量的方法包括:1. 温度和湿度的监测:检测温度和湿度等环境因素,以保证试剂盒在保存和运输过程中的质量。

ELISA实验的质量控制酶联免疫吸附试验(ELISA)是目前应用最广泛、最基础的实验项目之一,可用于甲肝、乙肝、丙肝、甲状腺功能、肿瘤标志物等多种项目的检测。
随着医疗体制改革的不断深入和“举证责任倒置”的实施,患者对医疗质量的关注不断加大,检验报告作为“证据”,无论是对患者、对医院、还是对检验人员自身,都起着至关重要的作用。
因此,检验结果的质量保证就显得尤为重要。
质量保证的核心是质量控制,它不仅包括分析中严格遵守操作规程,严格质量控制,而且包括分析前质量控制和分析后质量控制。
1 分析前质量控制1.1申请单的书写名字清楚、项目齐全,临床诊断最重要,这也是分析后质控所需要的。
1.2病人的准备为避免一些生理因素如年龄、性别、妊娠、月经期等因素对实验结果的错误解释,应要求病人如实反映实际情况,积极配合;采集标本前要求病人处于休息状态,剧烈运动后可使标本中某些成分升高;要求病人空腹采血,以避免饮食对实验结果的影响;尽量在治疗前或停药2天后采集标本,以避免药物的干扰。
1.3标本的采集和处理分析前质量控制的核心是标本的质量。
首先要严格执行标本查对制度,避免标本的采集错误;采血时避免溶血,采血后注明时间,2~8℃保存2天,-20℃保存1个月;轻度溶血、中度脂血的标本不影响检测,而含有纤维蛋白的标本,重度溶血、脂血、黄疸的标本可影响结果;血清标本一定要离心充分,避免纤维蛋白对实验结果的影响,血清标本还要避免反复冻融。
2 分析中质量控制2.1加样要求使用正确的加样技术,使移液器的吸头稍高于孔的平面,不能触及微孔板或孔中的液体,以避免从一孔带至另一孔。
加完标本再加酶试剂时避免溅出孔外。
2.2孵育孵育时要贴封片或放入含水湿孵育盒内,避免液体蒸发及样本和试剂干附于孔壁,难于彻底清洗。
孵育时间要准确,时间过短,特异性结合不够,得值偏低;时间过长,非特异性结合物紧附于反应孔,难以清洗干净,得值偏高。
2.3洗板聚苯乙烯微孔板的彻底清洗是ELISA实验的关键。

不同方法学检测乙型肝炎血清标志物结果的评价探讨目的探讨不同方法学及试剂检测乙型肝炎血清标志物的一致性。
方法选取笔者所在医院经罗氏ECLIA检测证实的100例乙型肝炎病毒(HBV)感染者以及50例健康体检者的血清,选用ELISA、TRFIA和ECLIA三种方法对乙型肝炎血清标志物进行检测。
结果在检测乙型肝炎血清标志物方面三种方法的结果具有高度以上的一致性,且ECLIA法在检测中敏感性最高。
结论当前实验室使用的乙型肝炎血清标志物检测方法均具有较高的一致性,有利于实验室之间进行结果互认。
标签:乙型肝炎;血清标志物;检测;评价当前我国乙型肝炎病毒表面抗原(HBsAg)的携带率约为10%左右,临床上用于乙型肝炎病毒血清免疫学标志物(HBV-M)检测的方法很多,国内传统检测手段主要使用酶联免疫吸附法(ELISA),近年来诸如时间分辨荧光分析法(TRFIA)、微粒子酶免疫分析法(MEIA)以及电化学发光法(ECLIA)等新式检测手段也逐渐应用于实验室检测中。
本次试验选用ELISA、TRFIA和ECLIA 三种方法对乙型肝炎血清标志物进行检测,旨在对不同方法学检测结果之间的一致性进行评价。
1 资料与方法1.1 研究对象选取笔者所在医院经罗氏ECLIA检测证实的100例乙型肝炎病毒(HBV)感染者的血清,患者均符合慢性乙型肝炎诊断标准[1],其中男65例,女35例;年龄16~50岁;另选取50例健康体检者的血清。
1.2 方法1.2.1 仪器试剂ELISA检测选用ALISEI全自动酶标仪(意大利)以及科华生物试剂盒(上海);TRFIA检测选用WALLAC DELFIA-1235时间分辨免疫荧光分析仪(芬兰)和新波生物试剂盒(上海);ECLIA检测选用罗氏E601电化学发光免疫分析仪(德国)及其标准配置试剂。
1.2.2 检测方法检测操作均按照仪器操作说明书以及试剂盒说明书进行。
本组待检血清样本均用3种方法进行检测,每次检测时均带阴、阳性质控(质控来源为上海市临床检验中心以及罗氏公司)。

elisa 评估标准
ELISA试剂盒评估标准如下:
1.稳定性:指在规定条件下经过一段时间的保存,仍能达到相应的性能指标。
2.反应灵敏度:指单位浓度的测定物反应所产生的反应度,反应度越高,灵敏度越大。
3.精密度:指结果间相互符合的一致程度。
4.准确度:指与参考测度程序结果的一致性。
5.线性范围:指在规定的重复性和线性偏差下,测得浓度或活性值之间比例的关系。
6.基质效应:指样品中被分析物以外的组分,常常对分析物的测定过程有显著干扰,还会影响分析结果的
准确性。
1。

ELISA质量控制ELISA质量控制1. 引言2. ELISA质控的重要性ELISA的质控是确保实验结果准确和可靠的关键步骤之一。
质控可以帮助识别实验操作中的问题,并提供一种可比较的标准,以评估不同实验批次和实验室之间的结果差异。
质控还可以提供实验结果的稳定性和可重复性的保证,从而提高ELISA技术的可靠性和科学价值。
3. ELISA质控方法3.1 内部质控品内部质控品是一种已知含量的标准物质,可以在ELISA实验中与待测样品进行检测,以评估实验的准确性和稳定性。
内部质控品应具备与待测物相似的特性和性质,例如抗原、抗体或代表性的样品。
通过与内部质控品的比较,可以判断得到的结果是否在可接受的范围内。
3.2 外部质控参考品外部质控参考品是一种验证试剂,由国际或国家标准机构制备和分发。
通过与外部参考品的比较,可以评估实验结果的准确性和可靠性,并与其他实验室的数据进行比较。
外部质控参考品通常具有广泛应用和良好验证的特点,可以用作日常实验和质控结果的基准。
3.3 稳定性试验稳定性试验是为了验证质控品在一定条件下的稳定性和可靠性。
通过不间和存储条件下的重复实验,可以评估质控品在实验过程中的稳定性和寿命。
稳定性试验通常包括温度、湿度和光照等因素的考量,以确定最佳的存储和使用条件。
4. ELISA质控结果的分析和判定ELISA质控结果的分析和判定需要依据一定的标准和指标。
常用的分析方法包括均值、标准差、变异系数和回归分析等。
通过与质控结果的比较,可以判断实验结果的准确性、可靠性和可比性,并根据实验要求调整实验条件和纠正偏差。
5.ELISA质量控制是确保实验结果准确和可靠的重要步骤。
通过内部质控品、外部质控参考品和稳定性试验等方法的应用,可以评估实验的准确性、稳定性和可重复性,并提供可靠的实验结果和科学价值。
质控结果的分析和判定可以帮助优化实验条件和纠正偏差,从而提高ELISA技术的可靠性和重复性。

ELISA质量控制1. 引言ELISA(酶联免疫吸附测定)是一种常用的生物化学分析技术,常用于测定特定蛋白质或其他分子的浓度。
在ELISA实验中,准确的质量控制是确保实验结果准确可靠的关键。
2. ELISA质量控制的重要性ELISA质量控制的目的是评估实验的准确性和可靠性。
通过引入质控样品,我们可以监控实验的变异性,并验证实验结果的可信度。
如果质控实验结果符合预期,我们可以相对确信实验的准确性。
3. ELISA质量控制的常用方法3.1. 内部质控内部质控是使用已知浓度的标准品来验证实验的准确性。
通常,我们在ELISA实验中使用多个标准品,这些标准品具有已知的浓度范围,可以帮助我们标准曲线。
通过比较实验结果与标准曲线,我们可以计算出未知样本的浓度。
3.2. 外部质控外部质控是通过与其他实验室或机构进行比较来验证实验的准确性和可靠性。
目前有多个外部质控程序可以参加,例如美国职业健康与安全协会(HA)实验质控项目,这些程序能够提供参考实验室的浓度范围和实验结果。
4. ELISA质量控制的注意事项4.1. 样本处理在进行ELISA实验之前,必须对样本进行适当的处理。
这包括样本的稀释、加入适当的缓冲液等。
在进行样本处理之前,确保所有操作符合实验室的标准操作程序(SOP)。
4.2. 实验操作在进行ELISA实验时,操作者应严格遵循实验协议。
确保按照准确的时间、温度和步骤进行操作。
在操作过程中,注意防止交叉污染,保持实验环境的洁净。
4.3. 设备校准ELISA实验所使用的设备(如酶标仪、洗板机等)应定期进行校准和维护,以确保它们的准确性和可靠性。
4.4. 数据分析在ELISA实验中,对结果进行准确的数据分析非常重要。
使用适当的分析软件,根据标准曲线计算未知样本的浓度。
进行统计学分析和结果解释。
5.ELISA质量控制是确保实验结果准确可靠的关键。
通过适当的内部和外部质控措施,合理的样本处理,准确的实验操作和数据分析,我们可以获得可信的ELISA实验结果,并为相关研究和临床应用提供有效的数据依据。
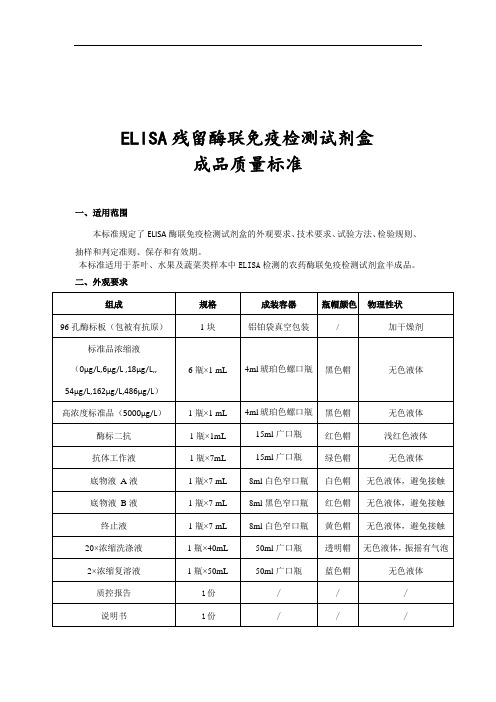
ELISA残留酶联免疫检测试剂盒成品质量标准一、适用范围本标准规定了ELISA酶联免疫检测试剂盒的外观要求、技术要求、试验方法、检验规则、抽样和判定准则、保存和有效期。
本标准适用于茶叶、水果及蔬菜类样本中ELISA检测的农药酶联免疫检测试剂盒半成品。
二、外观要求要求:试剂盒外观完整,密封,无漏液,内装试剂齐全。
三、技术要求 1.灵敏度 1.1 IC 50IC 50范围在1.1-2.8μg/L 之间。
1.2 相关系数标准曲线的相关系数应在0.9930以上。
1.3 抑制率范围标准品1 OD 值/标准品2 OD 值的抑制率范围在69-85%之间。
1.4 曲线拐点数 应≤2个拐点。
1.5 0ppb 标准品的OD 值 应在1.5~2.1范围内。
2.精密度3.标准曲线标准品工作液浓度为0μg/L、0.6μg/L 和1.8μg/L 的变异系数小于6%;4.烟叶样本添加浓度为100μg/kg 、300μg/kg ,的变异系数应小于20%。
5.检测限对烟叶样品的检测限不大于100μg/kg 。
6.准确度对样本进行不同浓度的药物添加,各点添加回收率范围如下:5.稳定性将半成品进行老化试验,各周期测得参数满足以下要求:6.特异性对ELISA交叉反应率为100%。
四、试验方法1.试剂和材料1.1ELISA残留酶联免疫检测试剂盒1.2试剂:去离子水、乙醇2.溶液配制依据本试剂盒说明书中“七、溶液的配制”进行各溶液的配制。
3.样品前处理依据本试剂盒说明书中“八、样本前处理步骤”进行样本的前处理。
4.测定依据本试剂盒说明书中“九、检测步骤”进行样本的检测。
5 结果判定5.1百分吸光率的计算标准品或样本的百分吸光率等于标准品或样本的平均吸光度值(双孔)除以第一个标准品(0 标准)的平均吸光度值,再乘以100%,即:百分吸光率(%)=B / B0×100%B—标准品或样本溶液的平均吸光度值B0—0μg/L标准溶液的平均吸光度值5.2标准曲线的绘制与计算以标准品百分吸光率为纵坐标,以标准品浓度(μg/L)的对数为横坐标,绘制标准曲线图。

ELISA试剂的选用和质检引言酶联免疫吸附实验(ELISA)是一种常用的生物化学分析方法。
其基本原理是利用抗原与特异性抗体的结合反应,通过酶-底物反应来测定样品中目标物的浓度。
在进行ELISA实验时,试剂的选用和质检是保证实验可靠性和结果准确性的重要步骤。
ELISA试剂的选用在进行ELISA实验时,试剂的选用至关重要。
试剂的质量和适用性直接影响实验结果的准确性和可靠性。
下面介绍ELISA实验中常用的试剂及其选用要点:1. 抗体在ELISA实验中,抗体是至关重要的试剂之一。
选择适合的抗体可以提高实验结果的敏感性和特异性。
在选择抗体时,需要注意以下几个要点: - 抗体的特异性:抗体必须能够与目标物特异性结合,不与其他非特异性蛋白发生反应。
- 抗体的纯度:纯度越高,干扰因素越少,对实验结果的影响越小。
- 抗体的来源:根据实验需求,可以选择兔抗、鼠抗等不同动物来源的抗体。
- 抗体的浓度和稀释倍数:需要根据样品浓度和实验要求进行合理的抗体稀释。
2. 基质ELISA实验中,基质主要用于稀释样品和试剂、洗涤样品等操作。
选择适合的基质可以提高实验的灵敏度和准确性。
常用的基质有PBS、TBST、BSA等,选择基质的要点如下: - 对抗体和目标物无特异性反应。
- 对试剂和样品无干扰。
- pH值和浓度适宜。
3. 酶标记物ELISA实验中的酶标记物用于与抗体结合,通过酶-底物反应产生可测量的信号。
选择合适的酶标记物可以提高实验信号的灵敏度和稳定性。
常用的酶标记物有HRP(过氧化物酶标记物)和AP(碱性磷酸酶标记物)等。
4. 底物底物在ELISA实验中被酶标记物催化后,会发生可观察的颜色变化或荧光发射。
合适的底物选择可以提高实验结果的灵敏度和稳定性。
选择底物时需要考虑以下几个要点: - 底物与酶标记物的反应条件适宜。
- 底物的选择要与酶标记物的使用条件相匹配,如使用HRP标记物需要选择适合HRP反应的底物。
ELISA试剂的质检为了保证ELISA实验的可靠性,试剂的质检是必不可少的。

ELISA质量控制ELISA质量控制引言ELISA(酶联免疫吸附法)是一种常用的免疫学实验技术,用于定量测定生物样本中特定抗原或抗体的含量。
ELISA广泛应用于医学诊断、生物学研究和药物开发等领域。
为了确保ELISA实验结果的准确性和可靠性,进行质量控制是非常重要的。
本文将介绍ELISA质量控制的基本原则和常用方法。
实验前质量控制在进行ELISA实验之前,需要进行一系列的质量控制步骤,以确保实验条件和试剂的稳定性和可靠性。
以下是实验前常用的质量控制措施:1. 试剂质量控制- 检查试剂的保存条件和有效期限,并根据相关要求存储和使用。
- 检查试剂的外观和溶解情况,如有异常应及时更换。
- 使用新开瓶的溶液前,进行适当的试剂稀释,并进行试剂批内和批间的比对实验。
2. 设计和验证实验方案- 确定实验的目的和假设,并设计相应的对照组和实验组。
- 根据实验要求,制定详细的实验步骤和操作规范。
- 参考文献和实验室经验,确定样本处理和测量的适当方法和参数。
3. 样本质量控制- 选择适当的样本来源和处理方法,并确保样本的质量不受损。
- 进行样本预处理前,确保样本标识和记录的准确性。
- 选择合适的阴性对照标本,并进行质量控制样本的添加和处理。
实验中质量控制在ELISA实验过程中,可以采取多种方式进行质量控制,以保证实验的准确性和可重复性。
以下是常用的质量控制方法:1. 阳性和阴性对照- 每个ELISA板中应包含阳性和阴性对照样本,用于验证试剂和实验过程的准确性。
- 通过对照样本的测量值,判断实验结果的可靠性和准确性。
2. 标准曲线- 建立标准曲线是ELISA定量分析的基础,通过测量不同浓度的标准样品,绘制标准曲线,以定量测定未知样本。
- 每个ELISA板中应包含标准曲线的各个浓度点位,用于质量控制及计算未知样本的浓度。
3. 内部质控- 在每个ELISA板中设置内部质控样本,作为实验的可靠性和重复性的判断标准。
- 内部质控样本应具有适当的变异程度,以确定实验的精确度和重复性。

癌胚抗原检测方法学评价及其在胃癌诊断中的意义
王恩兰;李涛
【期刊名称】《标记免疫分析与临床》
【年(卷),期】2005(012)004
【摘要】为比较临床常用CEA检测方法的特异性和敏感性,探讨CEA在胃癌诊断中的意义,用ELISA、时间分辨荧光免疫法(TRFIA)、RIA、化学发光免疫法(CLIA)检测36例病理确诊胃癌患者血清CEA水平,同时检测20名健康体检者血清CEA 水平.结果显示,四种方法的特异性均为100%,ELISA敏感性最低,为19.4%,CLIA的敏感性最高,为44.4%.结论是ELISA检测CEA的敏感性有待提高,CEA检测不能作为胃癌诊断的指标,可以作为部分胃癌患者疗效观察的指标.
【总页数】3页(P235-236,234)
【作者】王恩兰;李涛
【作者单位】安徽医科大学第一附属医院检验科,安徽,合肥,230022;安徽医科大学第一附属医院检验科,安徽,合肥,230022
【正文语种】中文
【中图分类】R735.2
【相关文献】
1.血清癌胚抗原糖抗原50在胃癌诊断中的意义 [J], 胡乃中;章礼久
2.癌胚抗原联合血管生成素样蛋白2检测对胃癌诊断的临床意义 [J], 龚大彩;徐革;袁婕
3.血清胃蛋白酶原癌胚抗原在胃癌诊断中的临床意义 [J], 付小国;周明辉;王燕华;石国辉;汪玉
4.血清癌胚抗原在胃癌诊断中的意义 [J], 江悦琴;王瑞年
5.血清胃蛋白酶原和癌胚抗原以及糖类抗原19-9联合检测在胃癌诊断中的应用[J], 邹月华
因版权原因,仅展示原文概要,查看原文内容请购买。

美国CLIA88质量要求美国CLIA’88能力比对检验的分析质量要求分析物或试验可接受范围常规临床化学谷丙转氨酶靶值±20%白蛋白靶值±10%碱性磷酸酶靶值±30%淀粉酶靶值±30%谷草转氨酶靶值±20%胆红素靶值±6.84mmol/L(0.4mg/dL)或±血气PO2靶值±3s血气PCO2靶值±5mmHg或±8%(取大者)血气PH靶值±0.04钙,总靶值±0.250mmol/L(1.0mg/dL)氯靶值±5%胆固醇靶值±10%高密度脂蛋白胆固醇靶值±30%肌酸激酶靶值±30%肌酸激酶同功酶MB升高(存在或不存在)或靶值±3s肌酐靶值±0.265umol/L(0.3mg/dL)或±葡萄糖靶值±0.33mmol/L(6mg/dL)或±铁靶值±20%乳酸脱氢酶靶值±20%LD同功酶LD1/LD2(+或-)或靶值±30%镁靶值±25%钾靶值±0.5mmol/L钠靶值±4mmol/L总蛋白靶值±10%甘油三酯靶值±25%尿素氮靶值±0.71mmol/L尿素(2mg/dL尿素尿酸靶值±17%内分泌皮质醇靶值±25%游离的甲状腺素靶值±3s人绒毛膜促性腺激素(HCG)靶值±3s或(阳性或阴性)T3 uptake靶值±3s(方法)三碘甲状腺素原氨酸靶值±3s促甲状腺激素靶值±3s甲状腺素靶值±20%或12.9%(1.0ug/dL)(取大毒理学酒精,血靶值±25%血铅靶值±10%或±酰氨咪嗪(carbamazepine)靶值±25%地高辛(digoxin)靶值±20%或0.2ug/dL(更大)乙琥胺(ethosuximide)靶值±20%庆大霉素靶值±25%锂靶值±0.3mmol/L或±20%(更大)苯巴比妥(Phenobarbital)靶值±20%苯妥英(phenytion)靶值±25%扑痫酮(primidone)靶值±25%普鲁卡因酰氨(procainamid)(及代谢物) 靶值±25%奎尼丁(quinidine)靶值±25%茶碱(theophylline)靶值±25%妥布霉素(tobramycin)靶值±25%丙戊酸靶值±25%血液学细胞识别在分类上90%或更大的一致白细胞分类靶值±在不同类型白细胞百分数上红细胞计数靶值±6%血细胞容积靶值±6%血红蛋白靶值±7%白细胞计数靶值±15%血小板计数靶值±25%纤维蛋白原靶值±20%激活部分凝血酶时间靶值±15%凝血酶原时间靶值±15%一般免疫学1—抗胰蛋白酶靶值±3s抗核抗体靶值±2个稀释或(阳或阴)抗-HIV反应或不反应补体3靶值±3s补体4靶值±3s—甲胎蛋白靶值±3s肝炎(HBsAg,anti-HBc,HBeAg)反应(阳性)或不反应(阴性)IgA靶值±3sIgE靶值±3sIgG靶值±25%IgM靶值±3s传染性单核细胞增多(症)靶值±2个稀释或(阳性或阴性) 类风湿因子靶值±2个稀释或(阳性或阴性) 风疹(Rubella)靶值±2个稀释或(阳性或阴性)。

四种不同检测方法测定乙型肝炎病毒五项指标的对比李宝昌;于宝坤【期刊名称】《疾病监测与控制杂志》【年(卷),期】2008(002)009【摘要】目的探讨四种不同检测方法测定乙型肝炎病毒五项指标的差异,进而选择出先进、科学实用的乙型肝炎病毒五项指标检测方法。
方法对同一血清样本分别采用标准的Abbot药盒和临床常用的放射免疫法(RIA法)、酶标法(ELISA)、化学发光法(CLIA法)、时间分辨荧光免疫法(TRFIA法)检测乙型肝炎五项指标,分别计算RIA法、ELISA法、CLIA法、TRFIAFA法同标准的Abbot药盒法检测结果的符合率、灵敏度和特异度。
结果R1A法、ELISA法、CLIA法、TRF法四种方法同标准的Abbot药盒法的符合率分别为85%、75%、89%、和94%,灵敏度分别为89%、85%、86%和93%;特异度分别乃90%、92%、89%和96%。
结论时间分辨荧光免疫法是日前临床应用中较为灵敏、特异、准确的乙型肝炎五项指标检测方法。
【总页数】2页(P539-540)【作者】李宝昌;于宝坤【作者单位】哈尔滨铁路疾病预防控制所绥化驻在组,黑龙江绥化152073【正文语种】中文【中图分类】R446【相关文献】1.乙肝五项指标不同检测方法的比较研究 [J], 贾印峰;高娟;贾东辉;孙卓祥;孔令斌2.时间分辨荧光免疫分析技术定量测定乙型肝炎病毒五项指标的应用评价 [J], 杨凤爱;林丽兰;梁健3.两种方法检测乙型肝炎病毒五项指标的结果对比 [J], 龙青文;何建军;马家驹;何秀琳;肖金平4.血清标本保存温度对乙型肝炎病毒五项指标定量测定的影响 [J], 韩来红;韩敏;焦湃;钟奇峰5.采用四种不同方法测定植物中氮含量的检测方法对比 [J], 苏丽梅;韦晓艳;梁引连;顾克潇;马学敏;梁群清;黄芳;刘守廷因版权原因,仅展示原文概要,查看原文内容请购买。

ELISA质量控制质量控制是ELISA实验的重要环节,通过对质量控制的严格监测,可以确保实验结果的准确性和可靠性。
本文档将详细介绍ELISA实验的质量控制步骤和注意事项。
⒈质量控制的目的和意义⑴目的质量控制的目的是评估实验的准确性和可靠性,确保实验结果的稳定性,并及时发现和解决潜在的问题。
⑵意义质量控制可以提高实验数据的可比性和可靠性,减少批次间的变异性,同时也可以帮助实验人员发现实验中存在的系统性误差并进行纠正。
⒉质量控制步骤⑴样本质控⒉⑴阳性质控选择已知含有目标物质的阳性样本,将其作为质控样本,在每次实验中进行测试,用于评估实验的准确性。
⒉⑵阴性质控选择不含有目标物质的阴性样本,将其作为质控样本,用于排除假阳性结果的可能性,评估实验的特异性和背景噪音等因素。
⑵标准曲线质控使用已知浓度的标准物质(多点标准曲线)来绘制标准曲线,在每次实验中进行测试,用于评估实验的灵敏度和线性范围。
⑶反应质控每次实验中应加入反应质控组,包括已知值的阳性和阴性质控样本,用于评估实验的准确性和稳定性。
⒊质量控制的注意事项⑴实验环境的控制确保实验室环境的温度、湿度和洁净度符合要求,避免外界因素对质控结果产生干扰。
⑵质控样本的管理正确储存质控样本,避免重复冻融导致样本质量的变化,严禁使用过期或异常的质控样本。
⑶标准物质和试剂的选择和储存选择质量稳定、纯度高的标准物质和试剂,并按照要求正确储存,避免质量变化对结果的影响。
⑷实验仪器的维护和校准定期对实验仪器进行维护和校准,确保其正常运行和测量准确性。
附件:⒈质量控制样本记录表⒉实验室环境监测记录表⒊标准物质和试剂管理记录表法律名词及注释:⒈标准物质:一般指用于测定、校准和质量控制的物质,具有一定的准确度和可追溯性。
⒉线性范围:指实验方法在一定浓度范围内的线性关系,用于评估实验方法的测量范围和灵敏度。
⒊潜在问题:指在实验过程中可能出现的但尚未被察觉的问题,可能对实验结果产生潜在影响。