3 釜式反应器
- 格式:doc
- 大小:323.50 KB
- 文档页数:21

3 釜式反应器3。
1在等温间歇反应器中进行乙酸乙酯皂化反应:该反应对乙酸乙酯及氢氧化钠均为一级。
反应开始时乙酸乙酯及氢氧化钠的浓度均为0。
02mol/l,反应速率常数等于5.6l/mol。
min。
要求最终转化率达到95%.试问:(1) (1)当反应器的反应体积为1m3时,需要多长的反应时间?(2)(2)若反应器的反应体积为2m3,,所需的反应时间又是多少?解:(1)(2)因为间歇反应器的反应时间与反应器的大小无关,所以反应时间仍为2.83h。
3。
2拟在等温间歇反应器中进行氯乙醇的皂化反应:水溶液及30%(重量)以生产乙二醇,产量为20㎏/h,使用15%(重量)的NaHCO3的氯乙醇水溶液作原料,反应器装料中氯乙醇和碳酸氢钠的摩尔比为1:1,混合液的比重为1。
02。
该反应对氯乙醇和碳酸氢钠均为一级,在反应温度下反应速率常数等于5.2l/mol.h,要求转化率达到95%。
(1)(1)若辅助时间为0。
5h,试计算反应器的有效体积;(2) (2)若装填系数取0。
75,试计算反应器的实际体积。
解:氯乙醇,碳酸氢钠,和乙二醇的分子量分别为80.5,84 和 62kg/kmol,每小时产乙二醇:20/62=0。
3226 kmol/h每小时需氯乙醇:每小时需碳酸氢钠:原料体积流量:氯乙醇初始浓度:反应时间:反应体积:(2)(2)反应器的实际体积:3.3丙酸钠与盐酸的反应:为二级可逆反应(对丙酸钠和盐酸均为一级),在实验室中用间歇反应器于50℃等温下进行该反应的实验。
反应开始时两反应物的摩尔比为1,为了确定反应进行的程度,在不同的反应时间下取出10ml反应液用0。
515N的NaOH溶液滴定,且丙酸钠的转化率要达到平衡转化率的90%。
试计算反应器的反应体积。
假定(1)原料装入以及加热至反应温度(50℃)所需的时间为20min,且在加热过程中不进行反应;(2)卸料及清洗时间为10min;(3)反应过程中反应物密度恒定。



反应器选型与设计一、反应器类型反应器设备种类很多,按结构型式分,大致可分为釜式反应器、管式反应器、塔式反应器、固定床反应器、流化床反应器等。
1.1釜式反应器:反应器中物料浓度和温度处处相等,并且等于反应器出口物料的浓度和温度。
物料质点在反应器内停留时间有长有短,存在不同停留时间物料的混合,即返混程度最大。
应器内物料所有参数,如浓度、温度等都不随时间变化,从而不存在时间这个自变量。
优点:适用范围广泛,投资少,投产容易,可以方便地改变反应内容。
缺点:换热面积小,反应温度不易控制,停留时间不一致。
绝大多数用于有液相参与的反应,如:液液、液固、气液、气液固反应等。
1.2 管式反应器①由于反应物的分子在反应器内停留时间相等,所以在反应器内任何一点上的反应物浓度和化学反应速度都不随时间而变化,只随管长变化。
②管式反应器具有容积小、比表面大、单位容积的传热面积大,特别适用于热效应较大的反应。
③由于反应物在管式反应器中反应速度快、流速快,所以它的生产能力高。
④管式反应器适用于大型化和连续化的化工生产。
⑤和釜式反应器相比较,其返混较小,在流速较低的情况下,其管内流体流型接近与理想流体。
⑥管式反应器既适用于液相反应,又适用于气相反应。
用于加压反应尤为合适。
1.3 固定床反应器固定床反应器的优点是:①返混小,流体同催化剂可进行有效接触,当反应伴有串联副反应时可得较高选择性。
②催化剂机械损耗小。
③结构简单。
固定床反应器的缺点是:①传热差,反应放热量很大时,即使是列管式反应器也可能出现飞温(反应温度失去控制,急剧上升,超过允许范围)。
②操作过程中催化剂不能更换,催化剂需要频繁再生的反应一般不宜使用,常代之以流化床反应器或移动床反应器。
固定床反应器中的催化剂不限于颗粒状,网状催化剂早已应用于工业上。
目前,蜂窝状、纤维状催化剂也已被广泛使用。
1. 4 流化床反应器(1)流化床反应器的优点①由于可采用细粉颗粒,并在悬浮状态下与流体接触,流固相界面积大(可16400m2/m3),有利于非均相反应的进行,提高了催化剂的利用率。


3釜式反应器在等温间歇反应器中进行乙酸乙酯皂化反应:该反应对乙酸乙酯及氢氧化钠均为一级。
反应开始时乙酸乙酯及氢氧化钠的浓度均为 l ,反应速率常数等于。
要求最终转化率达到 95%。
试问:3( 1)( 1)当反应器的反应体积为1m 时,需要多长的反应时间?3,( 2)( 2)若反应器的反应体积为2m ,所需的反应时间又是多少?解:( 1)(2)因为间歇反应器的反应时间与反应器的大小无关,所以反应时间仍为。
拟在等温间歇反应器中进行氯乙醇的皂化反应:以生产乙二醇,产量为20 ㎏/h ,使用 15%(重量)的 NaHCO3水溶液及 30%(重量)的氯乙醇水溶液作原料,反应器装料中氯乙醇和碳酸氢钠的摩尔比为 1:1,混合液的比重为。
该反应对氯乙醇和碳酸氢钠均为一级,在反应温度下反应速率常数等于,要求转化率达到 95%。
(1)( 1)若辅助时间为,试计算反应器的有效体积;(2)( 2)若装填系数取,试计算反应器的实际体积。
62kg/kmol,每小时产解:氯乙醇,碳酸氢钠,和乙二醇的分子量分别为,84和乙二醇: 20/62= kmol/h每小时需氯乙醇:每小时需碳酸氢钠:原料体积流量:氯乙醇初始浓度:反应时间:反应体积:(2)( 2)反应器的实际体积:丙酸钠与盐酸的反应:为二级可逆反应(对丙酸钠和盐酸均为一级),在实验室中用间歇反应器于 50℃等温下进行该反应的实验。
反应开始时两反应物的摩尔比为 1,为了确定反应进行的程度,在不同的反应时间下取出10ml 反应液用的NaOH溶液滴定,以确定未反应盐酸浓度。
不同反应时间下,NaOH溶液用量如下表所示:时间, min0 10 20 30 50∝NaOH用量, ml现拟用与实验室反应条件相同的间歇反应器生产丙酸,产量为500kg/h ,且丙酸钠的转化率要达到平衡转化率的 90%。
试计算反应器的反应体积。
假定( 1)原料装入以及加热至反应温度( 50℃)所需的时间为 20min,且在加热过程中不进行反应;(2)卸料及清洗时间为 10min;(3)反应过程中反应物密度恒定。

3 釜式反应器在等温间歇反应器中进行乙酸乙酯皂化反应:该反应对乙酸乙酯及氢氧化钠均为一级。
反应开始时乙酸乙酯及氢氧化钠的浓度均为l,反应速率常数等于。
要求最终转化率达到95%。
试问:(1)(1)当反应器的反应体积为1m3时,需要多长的反应时间?(2)(2)若反应器的反应体积为2m3,,所需的反应时间又是多少?解:(1)(2) 因为间歇反应器的反应时间与反应器的大小无关,所以反应时间仍为。
拟在等温间歇反应器中进行氯乙醇的皂化反应:以生产乙二醇,产量为20㎏/h,使用15%(重量)的NaHCO水溶液及30%(重3量)的氯乙醇水溶液作原料,反应器装料中氯乙醇和碳酸氢钠的摩尔比为1:1,混合液的比重为。
该反应对氯乙醇和碳酸氢钠均为一级,在反应温度下反应速率常数等于,要求转化率达到95%。
(1)(1)若辅助时间为,试计算反应器的有效体积;(2)(2)若装填系数取,试计算反应器的实际体积。
解:氯乙醇,碳酸氢钠,和乙二醇的分子量分别为,84 和 62kg/kmol,每小时产乙二醇:20/62= kmol/h每小时需氯乙醇:每小时需碳酸氢钠:原料体积流量:氯乙醇初始浓度:反应时间:反应体积:(2)(2)反应器的实际体积:丙酸钠与盐酸的反应:为二级可逆反应(对丙酸钠和盐酸均为一级),在实验室中用间歇反应器于50℃等温下进行该反应的实验。
反应开始时两反应物的摩尔比为1,为了确定反应进行的程度,在不同的反应时间下取出10ml反应液用的NaOH溶液滴定,以确定500kg/h,且丙酸钠的转化率要达到平衡转化率的90%。
试计算反应器的反应体积。
假定(1)原料装入以及加热至反应温度(50℃)所需的时间为20min,且在加热过程中不进行反应;(2)卸料及清洗时间为10min;(3)反应过程中反应物密度恒定。
解:用A,B,R,S分别表示反应方程式中的四种物质,利用当量关系可求出任一时刻盐酸的浓度(也就是丙酸钠的浓度,因为其计量比和投量比均为1:1)为:于是可求出A的平衡转化率:现以丙酸浓度对时间作图:由上图,当CA=×l时,所对应的反应时间为48min。





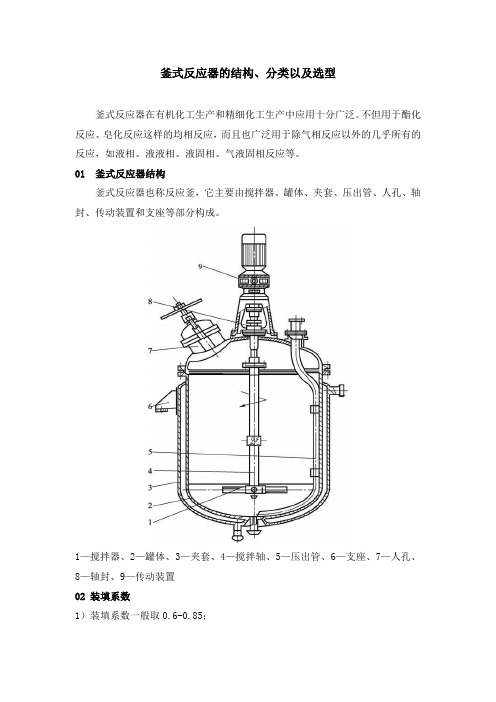
釜式反应器的结构、分类以及选型釜式反应器在有机化工生产和精细化工生产中应用十分广泛。
不但用于酯化反应、皂化反应这样的均相反应,而且也广泛用于除气相反应以外的几乎所有的反应,如液相、液液相、液固相、气液固相反应等。
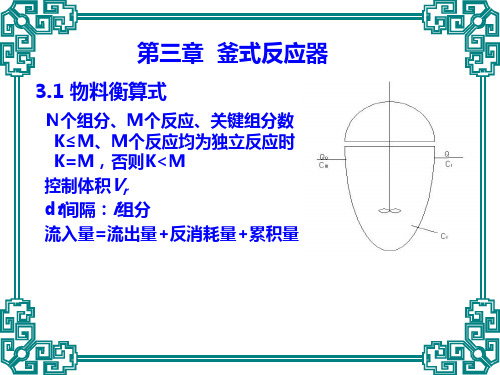
01 釜式反应器结构釜式反应器也称反应釜,它主要由搅拌器、罐体、夹套、压出管、人孔、轴封、传动装置和支座等部分构成。
1—搅拌器、2—罐体、3—夹套、4—搅拌轴、5—压出管、6—支座、7—人孔、8—轴封、9—传动装置02 装填系数1)装填系数一般取0.6-0.85;2)如物料在反应过程中呈泡沫或沸腾状态,取0.6-0.7;3)如物料在反应过程中比较平稳,取0.8-0.85。
03 搅拌器的作用和分类1)混合:体系中的不同物质混合均匀。
2)搅动:物料强烈流动,提高传热、传质速率。
3)悬浮:细小颗粒在液体中均匀悬浮,防止沉降、加速溶解等。
4)分散:气体或液体充分分散成细小气泡或液滴,促进传质和反应,控制粒度。
反应釜搅拌类型根据不同的搅拌方式和搅拌结构可以分为多种类型。
以下是一些常见的反应釜搅拌类型:按搅拌方式分:1)锚式搅拌:通过在反应釜内壁上固定锚形或刮板形的搅拌器,使反应物料在反应釜内壁上形成循环流动,从而实现搅拌效果。
2)桨叶式搅拌:通过安装在反应釜顶部或底部的桨叶形搅拌器,使反应物料在釜内形成强烈的涡流和对流,从而实现搅拌混合效果。
3)框架式搅拌:通过安装在反应釜壁上的框架形搅拌器,使反应物料在框架内形成循环流动,从而实现搅拌效果。
4)螺带式搅拌:螺旋叶片通过旋转将物料向上提升,然后再自由落下,从而实现了充分混合和均匀分布。
5)螺旋式搅拌:通过在反应釜内部安装螺旋形搅拌器,使反应物料在螺旋叶片的推动下实现循环流动和搅拌混合。
按加热/冷却方式分类1)水加热反应釜当对温度要求不高时,可采用这种加热方式。
其加热系统有敞开式和密闭式两种。
敞开式较简单,它由循环泵、水槽、管道及控制阀门的调节器组成。


3 釜式反应器3.1在等温间歇反应器中进行乙酸乙酯皂化反应:325325+→+CH COOC H NaOH CH COONa C H OH该反应对乙酸乙酯及氢氧化钠均为一级。
反应开始时乙酸乙酯及氢氧化钠的浓度均为0.02mol/l ,反应速率常数等于5.6l/mol.min 。
要求最终转化率达到95%。
试问:(1) (1) 当反应器的反应体积为1m 3时,需要多长的反应时间? (2) (2) 若反应器的反应体积为2m 3,,所需的反应时间又是多少?解:(1)00222000001()(1)110.95169.6min(2.83)5.60.0210.95===⨯---=⨯=⨯-⎰⎰AfAf X X A A AA A A A A A A A dX dX X t C C R k C X kC X h(2) 因为间歇反应器的反应时间与反应器的大小无关,所以反应时间仍为2.83h 。
3.2拟在等温间歇反应器中进行氯乙醇的皂化反应: 223222+→++CH ClCH OH NaHCO CH OHCH OH NaCl CO以生产乙二醇,产量为20㎏/h ,使用15%(重量)的NaHCO 3水溶液及30%(重量)的氯乙醇水溶液作原料,反应器装料中氯乙醇和碳酸氢钠的摩尔比为1:1,混合液的比重为1.02。
该反应对氯乙醇和碳酸氢钠均为一级,在反应温度下反应速率常数等于5.2l/mol.h ,要求转化率达到95%。
(1) (1) 若辅助时间为0.5h ,试计算反应器的有效体积; (2) (2) 若装填系数取0.75,试计算反应器的实际体积。
解:氯乙醇,碳酸氢钠,和乙二醇的分子量分别为80.5,84 和 62kg/kmol,每小时产乙二醇:20/62=0.3226 kmol/h每小时需氯乙醇:0.326680.591.11/0.9530%⨯=⨯kg h每小时需碳酸氢钠:0.326684190.2/0.9515%⨯=⨯kg h原料体积流量:091.11190.2275.8/1.02+==Q l h氯乙醇初始浓度:00.32661000 1.231/0.95275.8⨯==⨯A C mol l反应时间:02000110.952.968(1) 5.2 1.23110.95===⨯=-⨯-⎰⎰AfAf X X A A A A B A A dX dX t C h kC C kC X 反应体积:0(')275.8(2.9680.5)956.5=+=⨯+=r V Q t t l(2) (2) 反应器的实际体积:956.512750.75===r V V l f3.3丙酸钠与盐酸的反应:2525+⇔+C H COONa HCl C H COOH NaCl为二级可逆反应(对丙酸钠和盐酸均为一级),在实验室中用间歇反应器于50℃等温下进行该反应的实验。
反应开始时两反应物的摩尔比为1,为了确定反应进行的程度,在不同的反应时间下取出10ml 反应液用0.515N 的NaOH 溶液滴定,,且丙酸钠的转化率要达到平衡转化率的90%。
试计算反应器的反应体积。
假定(1)原料装入以及加热至反应温度(50℃)所需的时间为20min ,且在加热过程中不进行反应;(2)卸料及清洗时间为10min ;(3)反应过程中反应物密度恒定。
解:用A,B,R,S 分别表示反应方程式中的四种物质,利用当量关系可求出任一时刻盐酸的浓度(也就是丙酸钠的浓度,因为其计量比和投量比均为1:1)为:0.515/10==⨯A B NaOH C C V mol l于是可求出A 的平衡转化率:00052.510.50.852.590%0.890%0.720.515(1)52.5(10.72)0.051514.7/10--====⨯=⨯==-=⨯⨯-=⨯A Ae AeA A Ae A A A C C X C X X C C X mol l现以丙酸浓度对时间作图:由上图,当C A =0.0515×14.7mol/l 时,所对应的反应时间为48min 。
由于在同样条件下,间歇反应器的反应时间与反应器的大小无关,所以该生产规模反应器的反应时间也是48min 。
丙酸的产量为:500kg/h=112.6mol/min 。
所需丙酸钠的量为:112.6/0.72=156.4mol/min 。
原料处理量为:000/156.4/(0.051552.5)57.84/min ==+=A A Q F C l 反应器体积:00()57.84(182010)4512=+=⨯++=r V Q t t l 实际反应体积:4512/0.85640=l3.4在间歇反应器中,在绝热条件下进行液相反应:+→A B R其反应速率方程为:143110001.110exp()/.=⨯-A A B r C C kmol m hT式中组分A 及B 的浓度C A 及C B 以kmol/m 3为单位,温度T 的单位为K 。
该反应的热效应等于-4000kJ/kmol 。
反应开始时溶液不含R ,组分A 和B 的浓度均等于0.04kmol/m 3,反应混合物的平均热容按4.102kJ/m 3.K 计算。
反应开始时反应混合物的温度为50℃。
(1) (1) 试计算A 的转化率达85%时所需的反应时间及此时的反应温度。
(2) (2) 如果要求全部反应物都转化为产物R ,是否可能?为什么? 解:(1)[]00000.04(4000)()()32332339.014.102⨯---∆=+-=+=+A r A A A AF C H T T X X X X C0000014220()91.32110001.110exp()(1)32339.01==-==⨯--+⎰⎰⎰Af Af X X AA A A A AB AA A AAdX dX t C C R kC C dX C hC X X(由数值积分得出)32339.010.85356.2=+⨯=T K(2)若A 全部转化为R,即X A =1.0,则由上面的积分式知,t →∝,这显然是不可能的。
3.5在间歇反应器中进行液相反应:12+→=+→=A A B D C B A B C r k C C C B Dr k C CA 的初始浓度为0.1kmol/m 3,C ,D 的初始浓度为零,B 过量,反应时间为t 1时,C A =0.055kmol/m 3,C C =0.038 kmol/m 3,而反应时间为t 2时,C A =0.01 kmol/m 3,C C =0.042kmol/m 3,试求: (1) (1) k 2/k 1;(2) (2) 产物C 的最大浓度;(3) (3) 对应C 的最大浓度时A 的转化率。
解:(1)因为B 过量,所以: ''''1212,,===-=-A A D C C A D A C r k C r k C r r r k C k C恒容时:'1-=A AdC k C dt (A ) ''12-=-C A CdC k C k C dt (B)(B )式除以(A )式得:'2'11-=-C C A A dC k C dC k C解此微分方程得:'2'10'200'11⎡⎤⎛⎫⎢⎥=- ⎪⎢⎥⎝⎭⎢⎥-⎣⎦k k A A A C A A C C C C k C C k (C )将t 1,C A ,C C 及t 2,C A ,C C 数据代入(C )式化简得: 0.420.550.380.10.420.550.380.1⨯-⨯=⨯-⨯x x解之得:'22'110.525===k k x k k(2)先求出最大转化率:21111,max21()0.7425-=-=k k A k X k(3)产物C 的最大收率:()()21,max211110.49051⎡⎤=---=⎢⎥⎣⎦-k k C A A Y X X k k产物C 的最大浓度:3,max 0,max 0.10.49050.0491/==⨯=C A C C C Y kmol m3.6 在等温间歇反应器中进行液相反应31123⇔←−→−−→k k A A A初始的反应物料中不含A 2和A 3,A 1的浓度为2mol/l ,在反应温度下k 1=4.0min -1,k 2=3.6min -1,k 3=1.5min -1。
试求:(1) (1) 反应时间为1.0min 时,反应物系的组成。
(2) (2) 反应时间无限延长时,反应物系的组成。
(3) (3) 将上述反应改为31123−−→⇔←−→k k A A A 反应时间无限延长时,反应物系的组成。
解:根据题中给的两种反应情况,可分别列出微分方程,然后进行求解。
但仔细分析这两种情况,其实质是下述反应的特例:12123←−→←−→k k A A A (A)当'20=k 时,(A )式变为123⇔→A A A (B) 当'10=k 时,(A )式变为123→⇔A A A (C) 当''120,0==k k 时,(A )式变为123→→A A A (D)其中式(D )即为书讲的一级不可逆连串反应。
可见只要得到(A )式的解,则可容易化简得到(B ),(C)及(D)式的解。
对于(A)式,可列出如下微分方程组:'11111-=-dC k C k C dt (1)''211231222=+--dC k C k C k C k C dt (2) '32223=-dC k C k C dt (3)由题意知初始条件为:11023(0),(0)(0)0===C C C C (4)联立求解此微分方程组可得:'''''21112211011()()()()⎧⎫⎡⎤++⎪⎪=+-⎨⎬⎢⎥-++⎪⎪⎣⎦⎩⎭t t k k k k k e k e C C k k αβαβαβαβααββ (5)'''12122210()()⎧⎫⎡⎤++⎪⎪=+-⎨⎬⎢⎥-⎪⎪⎣⎦⎩⎭t t k k k k e k e C C αβαβαβαβαβ (6) 1212310⎧⎫⎡⎤⎪⎪=+-⎨⎬⎢⎥-⎪⎪⎣⎦⎩⎭t t k k k k e e C C αβαβαβαβ (7)式中,,αβ由如下式确定:'''121221=++k k k k k k αβ (8) ''1122()+=-+++k k k k αβ (9)现在可用上述结果对本题进行计算:(1)1'11'11224.0min , 3.6min , 1.5min ,0,1min ---=====k k k k t 由(5)~(9)式得1230.5592/0.5098/0.931/===A A A C mol l C mol lC mol l(2)当t →∝时,由(5)~(9)式得1230 2.0/==→A A A C C C mol l(3)此时为'10=k 的情况,当t →∝时,由114.0min ,-=k 1'1221.5min , 3.6min --==k k 得:12301.412/0.588/===A A A C C mol lC mol l3.7拟设计一反应装置等温进行下列液相反应:212222+→=+→=R A B S A B A B R r k C C A B Sr k C C目的产物为R ,B 的价格远较A 贵且不易回收,试问:(1) (1) 如何选择原料配比?(2) (2) 若采用多段全混流反应器串联,何种加料方式最好? (3) (3) 若用半间歇反应器,加料方式又如何?解:(1)212221211221===++A R A B AB A A B A B B r kC C S k C R k C C k C C k C νν 由上式知,欲使S 增加,需使C A 低,C B 高,但由于B 的价格高且不易回收,故应按主反应的计量比投料为好。