化学一轮规范特训 化学平衡常数 化学反应进行的方向 含解析
- 格式:docx
- 大小:150.67 KB
- 文档页数:21

高三化学一轮复习 化学平衡常数 化学反应进行的方向真正的失败不是你没做成事,而是你甘心于失败。
——斯坦福大学校训一、化学平衡常数1、定义:在一定温度下,当一个可逆反应达到_______________时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数,用符号K 表示。
2、表达式:对于一般的可逆反应:mA(g)+nB(g)pC(g)+qD(g)当在一定温度下达到化学平衡时,该反应的平衡常数为:要点提示① c(A)、c(B)、c(C)、c(D)均为平衡时的浓度;② 当反应混合物中有固体或纯液体时,它们的浓度看作是一个常数,不写入平衡常数的表达式中,例如,反应在高温下,Fe 3O 4(s)+4H 23Fe(s)+4H 2O(g)的平衡常数表达式为:K=______________________;③ 平衡常数K 的表达式与化学方程式的书写方式有关,例如: N 2+3H 22NH 3K 1=1/2N 2+3/2H 2NH 3 K 2=但K 1、K 2表示的含义是相同的。
④ 同一条件下,正、逆反应的平衡常数______________关系。
⑤ 化学平衡常数只与________有关,与反应物或生成物的浓度无关,与是否使用催化剂也无关,只要反应方程式给定,温度不变,K 不变。
3、意义(1)平衡常数表明在一定条件下反应进行的程度(2)判断可逆反应进行的方向。
对于可逆反应:mA(g)+nB(g)pC(g)+qD(g),如果知道在一定温度下的平衡常数,并且知道某个时刻反应物和生成物的浓度,就可以判断该反应是否达到平衡状态,如果没有达到平衡状态,则可判断反应进行的方向。
将某一时刻的生成物的浓度用化学方程式中相应的化学计量数为指数的乘积,与某一时刻的反应物的浓度用化学方程式中相应的化学计量数为指数的乘积之比值,叫做浓度商,用Q 表示。
即nm qp B c A c D c C c )]([)]([)]([)]([••=Q当Q =K 时,反应_____________状态; 当Q <K 时,反应_____________方向进行; 当Q >K 时,则反应___________方向进行。

精品文档,欢迎下载如果你喜欢这份文档,欢迎下载,另祝您成绩进步,学习愉快!第3讲化学平衡常数化学反应进行的方向1.(湖南省株洲一中2019届期末)只改变一个影响化学平衡的因素,平衡常数K与化学平衡移动的关系叙述不正确的是( )A.K不变,平衡可能移动B.平衡向右移动时,K不一定变化C.K有变化,平衡一定移动D.相同条件下,同一个反应的方程式的化学计量数增大2倍,K也增大2倍【答案】D【解析】因改变压强或浓度引起化学平衡移动时,K不变,A项和B项均正确;K只与温度有关,K发生了变化,说明体系的温度改变,则平衡一定移动,C项正确;相同条件下,同一个反应的方程式的化学计量数增大2倍,化学平衡常数应为K2,D项错误。
2.(辽宁省锦州一中2019届期中)下列说法不正确的是( )A.焓变是一个与反应能否自发进行有关的因素,多数能自发进行的反应是放热反应B.在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大C.一个反应能否自发进行取决于该反应是放热还是吸热D.一个反应能否自发进行,与焓变和熵变的共同影响有关【答案】C【解析】一个反应能否自发进行应由该反应的熵变和焓变共同判断,C项错误。
3.(河北省保定一中2019届期末)下列关于化学平衡常数的说法中,正确的是( ) A.在任何条件下,化学平衡常数都是一个定值B.化学平衡常数K可以推断一个可逆反应进行的程度C.化学平衡常数K只与温度、反应物浓度、体系的压强有关D.当改变反应物的浓度时,化学平衡常数会发生改变【答案】B【解析】A.在给定的反应方程式中,化学平衡常数只受温度的影响,温度改变则化学平衡常数改变,故错误;B.任何时刻Q c>K,说明平衡向逆反应方向进行,Q c<K,说明平衡向正反应方向进行,Q c=K,说明反应达到平衡,故正确;C.化学平衡常数只受温度影响,故错误;D.根据选项C 分析,故错误。
4.(山西省阳泉一中2019届期中)在体积恒定的密闭容器中,一定量的SO 2与1.25 mol O 2在催化剂作用下加热到600 ℃发生反应: 2SO 2(g)+O 2(g)催化剂加热 2SO 3(g) ΔH <0。
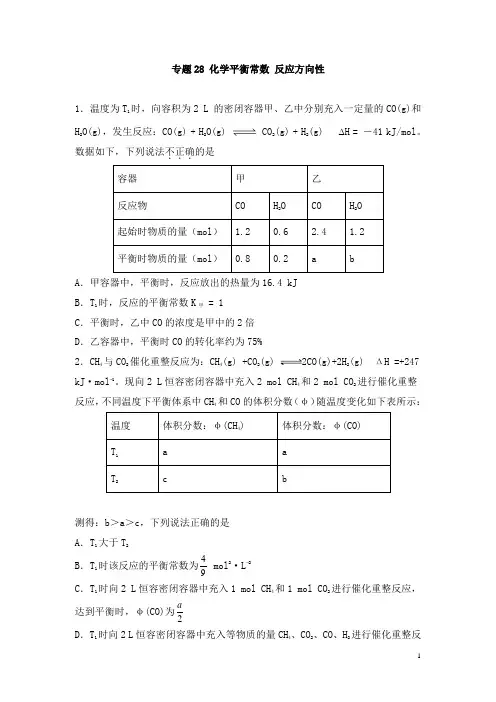
专题28 化学平衡常数反应方向性1.温度为T1时,向容积为2 L 的密闭容器甲、乙中分别充入一定量的CO(g)和H 2O(g),发生反应:CO(g) + H2O(g) CO2(g) + H2(g) ∆H = -41 kJ/mol。
数据如下,下列说法不正确...的是容器甲乙反应物CO H2O CO H2O起始时物质的量(mol) 1.2 0.6 2.4 1.2平衡时物质的量(mol)0.8 0.2 a b A.甲容器中,平衡时,反应放出的热量为16.4 kJB.T1时,反应的平衡常数K甲= 1C.平衡时,乙中CO的浓度是甲中的2倍D.乙容器中,平衡时CO的转化率约为75%2.CH4与CO2催化重整反应为:CH4(g) +CO2(g) 2CO(g)+2H2(g) ΔH =+247kJ·mol−1。
现向2 L恒容密闭容器中充入2 mol CH4和2 mol CO2进行催化重整反应,不同温度下平衡体系中CH4和CO的体积分数(φ)随温度变化如下表所示:温度体积分数:φ(CH4) 体积分数:φ(CO)T1a aT2c b测得:b>a>c,下列说法正确的是A.T1大于T2B.T1时该反应的平衡常数为49mol2·L−2C.T1时向2 L恒容密闭容器中充入1 mol CH4和1 mol CO2进行催化重整反应,达到平衡时,φ(CO)为2aD.T1时向2 L恒容密闭容器中充入等物质的量CH4、CO2、CO、H2进行催化重整反应,此时反应一定正向移动3.一定温度下,将0.16 mol X和0.16 mol Y加入10 L的恒容密闭容器中,发生反应X(s)+2Y(g)2Z(g) ΔH<0,一段时间后达到平衡。
反应过程中测定的数据如表:t/min 2 4 7 9n(Y)/mol 0.12 0.11 0.10 0.10下列说法正确的是( )A.温度升高,此反应的化学平衡常数K>0.36B.当容器内气体的密度不变时,反应达到化学平衡状态C.反应前2 min的平均反应速率v(Z)=4.0×10-3mol·L-1·min-1D.其他条件不变,再充入0.6 mol Z,平衡时Z的体积分数增大4.I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)I3-(aq)。

考点24化学平衡常数化学反应进行的方向一、选择题1.关于平衡常数,下列说法不正确的是()A.平衡常数不随反应物或生成物浓度的改变而改变B.平衡常数随温度的改变而改变C.平衡常数不随压强的改变而改变D.使用催化剂能使平衡常数增大答案 D解析化学平衡常数只随温度的改变而改变。
只要温度不变,对同一可逆反应来说,K 值不变。
2.已知反应①:CO(g)+CuO(s)CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数为K。
则下列说法正确的是()A.反应①的平衡常数K1=c(CO2)·c(Cu)c(CO)·c(CuO)B.反应③的平衡常数K=K1 K2C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小答案 B解析在书写平衡常数表达式时,纯固体不能表示在平衡常数表达式中,A错误;由于反应③=反应①-反应②,因此平衡常数K=K1K2,B正确;反应③中,温度升高,H2浓度减小,则平衡左移,即逆反应为吸热反应,正反应为放热反应,因此ΔH<0,C错误;对于反应③,在恒温恒容下,若充入惰性气体使压强增大,则平衡不移动,H2的浓度不变,D错误。
3.恒温、恒压下,将1 mol O2和2 mol SO2气体充入一体积可变的容器中(状态Ⅰ),发生反应:2SO2(g)+O2(g)2SO3(g),状态Ⅱ时达平衡,则O2的转化率为()A.60% B.40% C.80% D.90%答案 A解析 恒温、恒压下,气体的体积之比等于物质的量之比。
设O 2的转化率为x ,则: 2SO2(g)+O 2(g)2SO 3(g)n (始)/(mol): 2 1 0 n (变)/(mol): 2x x 2x n (平)/(mol): 2-2x 1-x 2x(2-2x )+(1-x )+2x =3×1.62,解得x =0.6。

1.关于平衡常数,下列说法不正确的是( )A.平衡常数不随反应物或生成物浓度的改变而改变B.平衡常数随温度的改变而改变C.平衡常数不随压强的改变而改变D.使用催化剂能使平衡常数增大答案 D解析化学平衡常数只随温度的改变而改变。
只要温度不变,对同一可逆反应来说,K值不变。
2.已知反应①:CO(g)+CuO(s)CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数为K。
则下列说法正确的是( )A.反应①的平衡常数K1=c CO2c Cu c CO c CuOB.反应③的平衡常数K=K1K2C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小答案 B解析在书写平衡常数表达式时,纯固体不能表示在平衡常数表达式中,A错误;由于反应③=反应①-反应②,因此平衡常数K=K1K2,B正确;反应③中,温度升高,H2浓度减小,则平衡左移,即逆反应为吸热反应,正反应为放热反应,因此ΔH<0,C错误;对于反应③,在恒温恒容下,增大压强,若充入惰性气体,则平衡不移动,H2的浓度不变,D错误。
3.恒温、恒压下,将1 mol O2和2 mol SO2气体充入一体积可变的容器中(状态Ⅰ),发生反应:2SO2(g)+O2(g)2SO3(g),状态Ⅱ时达平衡,则O2的转化率为( )A.60% B.40%C.80% D.90%答案 A解析恒温、恒压下,气体的体积之比等于物质的量之比。
设O2的转化率为x,则:2SO2(g)+O2(g)2SO3(g)n(始)/(mol): 2 1 0n(变)/(mol): 2x x 2xn(平)/(mol): 2-2x 1-x 2x(2-2x)+(1-x)+2x=3×1.62,解得x=0.6。

化学平衡常数化学反应进行的方向一、选择题(本题包括4小题,每题8分,共32分)1.(双选)(2020·青岛模拟改编)下列说法中正确的是( )A.生成物的总能量大于反应物的总能量时,ΔH<0B.已知反应H2(g)+I2(g)2HI(g)的平衡常数为K,则2H2(g)+2I2(g)4HI(g)的平衡常数为K2C.ΔH<0、ΔS>0的反应在温度低时不能自发进行D.在其他外界条件不变的情况下,使用催化剂,不能改变化学反应进行的方向【解析】选B、D。
ΔH=生成物总能量-反应物总能量,当生成物的总能量大于反应物的总能量时,ΔH>0,A项错误;因为相同温度下,化学计量数变为原来的n倍,则化学平衡常数为原来的n次方,所以反应2H2(g)+2I2(g)4HI(g)的平衡常数为K2,B项正确;根据ΔG=ΔH-TΔS 判断,对于ΔH<0、ΔS>0的反应,在温度低时ΔG<0,反应能自发进行,C项错误;催化剂只改变反应速率,不改变化学反应进行的方向,D项正确。
2.(2020·武汉模拟)已知可逆反应3X(g)+2Y(s)n C(g) ΔH。
若p1<p2,根据表中的数据判断下列说法错误的是(注明:表格中数据为X的转化率)( )p1MPa p2MPa400℃99.6 99.7500℃96.9 97.8A.其他条件不变,升高温度,ΔH减小B.n可能等于2、1C.200 ℃的平衡常数大于600 ℃的平衡常数D.加入高效催化剂,不改变C的体积分数【解析】选A。
化学反应的焓变与化学计量数有关,与反应温度无关,A错误;Y为固体,增大压强时X的转化率增大,说明n<3,n=1或2,B正确;温度升高,X的转化率降低,说明正反应是放热反应,所以,温度升高,平衡常数减小,C正确;加入催化剂,只改变反应速率,能缩短达到平衡所需的时间,但平衡不发生移动,C的体积分数不变,D正确。

化学平衡常数化学反应进行的方向1.对于处于化学平衡状态的反应CO+H2O(g) CO2+H2,K正反应代表正反应的平衡常数,K逆反应代表逆反应的平衡常数,下列有关说法正确的是( )A.K正反应=K逆反应B.K正反应>K逆反应C.K正反应<K逆反应D.K正反应×K逆反应=11.答案 D 对于处于化学平衡状态的反应CO+H2O(g) CO2+H2,K正反应=c(CO2)·c(H2)/c(CO)·c(H2O),K逆反应=c(CO)·c(H2O)/c(CO2)·c(H2),故K正反应×K逆反应=1。
2.将BaO2放入密闭真空容器中,反应2BaO2(s) 2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )A.平衡常数减小B.BaO量不变C.氧气压强不变D.BaO2量减少2.答案 C 化学平衡常数只与温度有关,温度不变,平衡常数不变,故A错误;缩小容器体积,压强增大,平衡向逆反应方向移动,则BaO的量减小,故B错误;温度不变,平衡常数不变,由K=c(O2)知氧气浓度不变,其压强不变,故C正确;平衡向逆反应方向移动,则BaO2量增加,故D 错误。
3.反应Fe(s)+CO2 (g)FeO(s)+CO(g),700 ℃时平衡常数为1.47,900 ℃时平衡常数为2.15。
下列说法正确的是( )A.升高温度该反应的正反应速率增大,逆反应速率减小B.该反应的化学平衡常数表达式为K=c(FeO)·c(CO)c(Fe)·c(CO2)C.绝热容器中进行该反应,温度不再变化,则达到化学平衡状态D.该反应的正反应是放热反应3.答案 C 升高温度,正、逆反应速率都增大,故A错误;反应过程中,固体物质的浓度不发生变化,所以平衡常数表达式中不应该写固体,故B错误;反应过程中,伴随着能量变化,温度不变时,说明正、逆反应速率相等,反应达到平衡状态,故C正确;温度升高,平衡常数增大,平衡右移,说明正反应是吸热反应,故D错误。

化学平衡常数化学反应进行的方向一、选择题(共14题)1.实验证明,多数能自发进行的反应都是放热反应。
对此说法的理解正确的是()A.所有的放热反应都是自发进行的B.所有的自发反应都是放热的C.焓变是影响反应是否具有自发性的一种重要因素D.焓变是决定反应是否具有自发性的唯一判据2.下列关于平衡常数的说法正确的是()A.在平衡常数表达式中,反应物浓度用起始浓度,生成物浓度用平衡浓度B.在任何条件下,化学平衡常数是一个恒定值C.平衡常数的大小与温度、浓度、压强、催化剂等无关D.从平衡常数的大小可以推断一个反应进行的程度3.t℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为K=c2(Y)c(Z)·c(W)。
有关该平衡体系的说法正确的是()A.当混合气体的平均相对分子质量保持不变时,反应达到平衡B.增大压强,各物质的浓度不变C.升高温度,平衡常数K增大D.增加X的量,平衡既可能正向移动,也可能逆向移动4.在一定条件下,甲醇发生脱氢反应生成甲醛:CH3OH(g)HCHO(g)+H2(g),甲醇的平衡转化率随温度的变化曲线如图所示。
下列有关说法正确的是()A.甲醇脱氢反应的焓变ΔH<0B.600 K时,Y点甲醇的v正<v逆C.从Y点到Z点可通过增大压强D.在T1K时,该反应的平衡常数为8.15.在一定条件下,已达平衡的可逆反应:2A(g)+B(g)2C(g),下列说法中正确的是()A.平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=c2(C)c2(A)·c(B)B.改变条件后,该反应的平衡常数K一定不变C.如果改变压强并加入催化剂,平衡常数会随之变化D.若平衡时增加A和B的浓度,则平衡常数会减小6.将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)I-3(aq)。
该平衡体系中,I-3的物质的量浓度与温度(T)的关系如图所示(曲线上的任何一点都代表平衡状态)。

目夺市安危阳光实验学校课时跟踪检测(三十)化学平衡常数 化学反应进行的方向1.关于反应H 2(g)+12O 2(g)===H 2O(l),下列说法不正确的是( )A .焓变ΔH <0,熵变ΔS <0B .可以把反应设计成原电池,实现能量的转化C .一定条件下,若观察不到水的生成,说明该条件下反应不能自发进行D .选用合适的催化剂,有可能使反应在常温常压下以较快的速率进行 解析:选C 氢气在氧气中燃烧生成液态水的反应是一个放热且熵减的反应,A 项正确;该反应是一个自发的氧化还原反应,可以将该反应设计成原电池,将化学能转化为电能,B 项正确;是否能观察到有水生成除了与反应能否自发进行有关外,还与反应的速率有关,观察不到有水生成,不能说明该条件下反应不能自发进行,C 项错误;使用合适的催化剂,有可能使氢气和氧气在常温常压下快速反应,D 项正确。
2.(2020·郴州质检)对于可逆反应SiO 2(s)+C(s)+N 2(g)――→高温 Si 3N 4(s)+CO(g)(未配平) ΔH <0。
下列叙述正确的是( )A .增加焦炭的用量,生成氮化硅的反应速率增大B .增加SiO 2的用量,焦炭的转化率增大C .增大压强,正反应速率增大,逆反应速率减小D .反应的平衡常数可表示为K =c 6COc 2N 2,升高温度,平衡常数K 减小解析:选D 焦炭是固体,增加焦炭的用量,反应速率不变,A 错误。
增加SiO 2的用量,平衡不移动,焦炭的转化率不变,B 错误。
增大压强,正、逆反应速率均增大,C 错误。
配平反应方程式可得:3SiO 2(s)+6C(s)+2N 2(g)=====高温Si 3N 4(s)+6CO(g),则平衡常数可表示为K =c 6COc 2N 2;该反应的正反应为放热反应,升高温度,平衡逆向移动,平衡常数K 减小,D 正确。
3.(2020·黄石模拟)已知“凡气体分子总数增多的反应一定是熵增大的反应”。

第三节化学平稳常数化学反映进行的方向1.理解化学平衡常数的含义,能够利用化学平衡常数进行简单的计算。
(高频)2.了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。
(中频)3.了解化学反应进行方向的判断方法。
化学平稳常数以m A(g)+n B(g) p C(g)+q D(g)为例1.表达式:K=c p(C)·c q(D)c m(A)·c n(B)。
2.影响因素K仅与温度有关,与反映物或生成物的浓度无关。
3.意义4.注意事项(1)反映物或生成物中有固体和液态水存在时,由于其浓度可看做“常数”而不代入公式。
(2)化学平稳常数是指某一具体反映方程式的平稳常数。
假设反映方向改变,那么平稳常数改变。
假设方程式中各物质的化学计量数等倍扩大或缩小,尽管是同一反映,平稳常数也会改变,但意义不变。
化学反映进行的方向1.自发进程(1)含义:在必然条件下,不需要借助外力作用就能够自动进行的进程。
(2)特点:①体系趋向于从高能状态转变成低能状态(体系对外部做功或释放热量)。
②在密闭条件下,体系有从有序转变成无序的偏向性(无序体系加倍稳固)。
2.化学反映方向的判据3.复合判据——自由能ΔG断据ΔG=ΔH-TΔS(1)当ΔH<0,ΔS>0时反映自发进行。
(2)当ΔH>0,ΔS<0时反映不自发进行。
(3)当ΔH>0,ΔS>0时,高温下可能自发进行。
(4)当ΔH<0,ΔS<0时,低温下可能自发进行。
1.易误诊断(正确的打“√”,错误的打“×”)。
(1)C(s)+H2O(g)CO(g)+H2(g)的平稳常数表达式为K=c(CO)·c(H2)c(C)·c(H2O)( )(2)关于N2(g)+3H2(g)2NH3(g)达到平稳,在温度不变、容积不变的密闭容器中充入N2,化学平稳常数不变( )(3)化学平稳移动,化学平稳常数必然改变( )(4)对某一可逆反映,升高温度那么化学平稳常数必然变大( )(5)增大反映物的浓度,平稳正向移动,化学平稳常数增大( )(6)化学平稳常数和转化率都能表现反映进行的程度( )(7)焓变和熵变都能够独立的作为判定化学反应进行的方向的判据( )(8)ΔH<0的反映必然能自发进行( )(9)相同温度下,可逆反映的两方向平稳常数互为倒数( )【答案】(1)×(2)√(3)×(4)×(5)×(6)√(7)×(8)×(9)√2.(选修4P 32T 2,改编)已知反映A(g)+3B(g)2C(g)在必然温度下达到平稳,各物质的平稳浓度别离为c (A)= mol/L 、c (B)= mol/L 、c (C)= mol/L 。

学习资料课后限时集训(二十三)(建议用时:40分钟)1.下列说法不正确的是( )A.ΔH〈0、ΔS〉0的反应在任何温度下都能自发进行B.NH4HCO3(s)===NH3(g)+H2O(g)+CO2(g) ΔH=+185。
57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据D.在其他外界条件不变的情况下,使用催化剂可以改变化学反应进行的速率[答案] C2.某恒温密闭容器中发生可逆反应Z(?)+W(?)X(g)+Y(?)ΔH,在t 1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法正确的是()A.Z和W在该条件下至少有一个为气体B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等C.若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等D.若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大D[根据图像变化可知,正反应速率不随反应时间和压强改变而改变,逆反应速率随时间和压强的改变而变化,所以反应物Z和W都不是气体,A错误;若只有X为气体,则两时间段反应体系中气体的平均摩尔质量相等,B错误;化学平衡常数只与温度有关,该温度下平衡常数的表达式K=c(X),只要温度不变,K不变,则c(X)不变,t1~t2时间段与t3时刻后的X 浓度相等,C错误;该反应在温度为T0以上时才能自发进行,反应的ΔS>0,根据ΔG=ΔH-TΔS<0,反应的ΔH〉0,该反应是吸热反应,升高温度平衡向正反应方向移动,平衡常数增大,D正确。
]3.反应2CrO错误!(黄色,aq)+2H+(aq)Cr 2O错误!(橙色,aq)+H2O(l) ΔH =-c kJ·mol-1(c>0),某温度下,平衡常数K=9。
2021届高三化学一轮复习——化学平衡常数 化学反应进行的方向(有答案和详细解析)一、选择题1.只改变一个影响因素,平衡常数K 与化学平衡移动的关系叙述错误的是( ) A .K 值不变,平衡可能移动 B .K 值变化,平衡一定移动 C .平衡移动,K 值可能不变 D .平衡移动,K 值一定变化答案 D解析 平衡常数只与温度有关系,温度不变平衡也可能发生移动,则K 值不变,平衡可能移动,A 正确;K 值变化,说明反应的温度一定发生了变化,因此平衡一定移动,B 正确;平衡移动,温度可能不变,因此K 值可能不变,C 正确;平衡移动,温度可能不变,因此K 值不一定变化,D 不正确。
2.水煤气的主要成分为CO 和H 2,工业上常利用CH 4和H 2O 来制备水煤气,原理为CH 4(g)+H 2O(g)===CO(g)+3H 2(g) ΔH >0。
对于该反应的下列判断正确的是( ) A .ΔS <0B .在热力学上趋势很大C .任何温度下均能自发进行D .在ΔG <0时能自发进行 答案 D解析 该反应为气体物质的量增大的熵增反应,A 项错误;该反应为吸热反应,在热力学上趋势不大,B 项错误;该反应的ΔH >0,ΔS >0,所以在高温下才能自发进行,C 项错误,根据ΔG =ΔH -T ΔS ,在ΔG <0时反应能自发进行,D 项正确。
3.下列反应在常温下均为非自发反应,在高温下仍为非自发反应的是( ) A .Ag 2O(s)===2Ag(s)+12O 2(g)B .Fe 2O 3(s)+32C(s)===2Fe(s)+32CO 2(g)C .N 2O 4(g)===2NO 2(g)D .6C(s)+6H 2O(l)===C 6H 12O 6(s) 答案 D解析 Ag 2O(s)===2Ag(s)+12O 2(g) 反应的ΔH >0、ΔS >0,高温下ΔH -T ΔS <0,反应能自发进行,故A 错误;Fe 2O 3(s)+32C(s)===2Fe(s)+32CO 2(g) 反应的ΔH >0、ΔS >0,高温下ΔH -T ΔS <0,反应能自发进行,故B 错误;N 2O 4(g)===2NO 2(g)反应的ΔH >0、ΔS >0,高温下ΔH -T ΔS <0,反应能自发进行,故C 错误;6C(s)+6H 2O(l)===C 6H 12O 6(s)反应的ΔH <0、ΔS <0,高温下ΔH -T ΔS >0,反应不能自发进行,故D 正确。
2017化学一轮规范特训:8-3-化学平衡常数-化学反应进行的方向-Word版含解析板块四限时·规范·特训时间:45分钟满分:100分一、选择题(每题6分,共66分)1.[2015·苏北四市一模]恒温恒容下,向2 L密闭容器中加入MgSO4(s)和CO(g),发生反应:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g)。
反应过程中测定的部分数据见下表:反应时间/min n(MgSO4)/mol n(CO)/mol n(CO2)/mol0 2.00 2.00020.804 1.20A.反应在0~2 min内的平均速率为v(SO2)=0.6 mol·L-1·min-1 B.反应在2~4 min内容器内气体的密度没有变化C.若升高温度,反应的平衡常数变为1.00,则正反应为放热反应D.保持其他条件不变,起始时向容器中充入1.00 mol MgSO4和1.00 mol CO,达到平衡时n(CO2)<0.60 mol答案B解析在0~2 min内,v(SO2)=v(CO)=2.00 mol-0.80 mol2 L×2 min=0.3mol·L-1·min-1,A错误;反应进行到2 min时,n生(CO2)=n消(CO)=1.20 mol;4 min时,n(CO2)=1.20 mol,说明反应进行到2 min时已经达到平衡,在2~4 min内容器内气体的物质的量没有变化,密度没有变化,B正确;平衡时,K=0.6×0.60.4=0.9,若升高温度,反应的平衡常数变为1.00,则平衡正向移动,正反应为吸热反应,C错误;保持其他条件不变,起始时向容器中充入1.00 mol MgSO4和1.00mol CO,达到平衡时n(CO2)>0.60 mol,D项错误。
2.[2015·黄冈中学月考]某温度下气体反应达到化学平衡,平衡常数K=c(A)·c2(B)/[c2(E)·c(F)],恒容时,若温度适当降低,F的浓度增加。
〖第3讲化学平衡常数化学反应进行的方向〗之小船创作1.了解化学反应的方向与焓变和熵变的关系;能够利用焓变和熵变判断化学反应的方向。
2.了解化学平衡常数的含义,能够利用化学平衡常数进行相关计算。
知识点一化学平衡常数一、化学平衡常数的概念及应用1.化学平衡常数在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,用符号K表示。
2.表达式(1)对于反应m A(g)+n B(g) p C(g)+q D(g),K=c p C·c q D(计算K利用的是物质的平衡浓度,而不是c m A·c n B任意时刻浓度,也不能用物质的量。
固体和纯液体物质的浓度视为常数,通常不计入平衡常数表达式中)。
(2)化学平衡常数是指某一具体反应的平衡常数,化学反应方向改变或化学计量数改变,化学平衡常数均发生改变。
举例如下:化学方程式 平衡常数 关系式 N 2(g)+3H 2(g) 2NH 3(g) K 1=c 2?NH 3?c ?N 2?·c 3?H 2?K 2=K 1 K 3=1K 1 12N 2(g)+32H 2(g) NH 3(g)K 2=c ?NH 3?c 12N 2?·c 32H 2? 2NH 3(g) N 2(g)+3H 2(g) K 3=c ?N 2?·c 3?H 2?c 2?NH 3?3.注意事项(1)K 值越大,反应物的转化率越高,正反应进行的程度越大。
(2)K 只受温度影响,与反应物或生成物的浓度变化无关。
(3)催化剂能加快化学反应速率,但对化学平衡常数无影响。
4.应用(1)判断可逆反应进行的程度K 值大,说明反应进行的程度大,反应物的转化率高;K 值小,说明反应进行的程度小,反应物的转化率低。
K<10-5 10-5~105 >105反应程度 很难进行 反应可逆 反应可接近完全 (2)判断化学反应进行的方向对于可逆反应a A(g)+b B(g) c C(g)+d D(g),在一定温度下的任意时刻,反应物与生成物浓度有如下关系:Q=c c C·c d Dc a A·c b B,称为浓度商。
冠夺市安全阳光实验学校【金版教程】高考化学一轮复习第九章第3节化学平衡常数化学平衡计算化学反应进行的方向限时规范特训新人教版1. 在一密闭容器中,发生反应:A(g)+B(g)C(g)+D(g),其化学平衡常数K随温度变化的关系如下表所示,则下列有关判断正确的是( )T/℃800 850 1000 1200K 0.9 1.0 1.7 2.4A. 若A的浓度增加到原平衡的2倍,则平衡一定正向移动B. 该反应的ΔH>0C. 在850℃时,反应达到平衡,容器中各物质的浓度一定相等D. A的转化率越大,平衡常数越大答案:B解析:A项,若是通过加压的方式增大A的浓度,则平衡不移动,A错误;B项,从表中可知,温度升高时,K值增大,说明升温平衡正向移动,故此反应的正反应为吸热反应,即ΔH>0,B正确;850℃时的K=1.0,不一定能推出此时容器中各物质的浓度一定相等,C错误;D项,A的转化率增大,可通过增大B的浓度实现,但平衡常数不变,D错误。
2.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)NH3(g)+HI(g);②2HI(g)H2(g)+I2(g),c(HI)=4 mol·L -1,c(H2)=0.5 mol·L-1,则此温度下反应①的平衡常数为( )A. 9B. 16C. 20D. 25答案:C解析:达到平衡时,c(H2)=0.5 mol·L-1,所以反应②消耗c(HI)=2c(H2)=1 mol·L-1,共生成c(HI)=(1+4) mol·L-1=5 mol·L-1,生成c(NH3)=5 mol·L-1,达到平衡后容器中c(HI)=4 mol·L-1、c(NH3)=5 mol·L -1,K=4×5=20。
3. 已知298 K下反应2Al2O3(s)+3C(s)===4Al(s)+3CO2(g) ΔH=+2171 kJ/mol,ΔS=+635.5 J/( mol·K),则下列说法正确的是( )A. 由题给ΔH值可知,该反应是一个放热反应B. ΔS >0表明该反应是一个熵增加的反应C. 该反应在室温下可能自发D. 不能确定该反应能否自发进行答案:B解析:本题主要考查了化学反应进行的方向,意在考查考生的判断能力。
第三节化学平衡常数 化学反应进行的方向考点(一) 化学平衡常数 转化率 【点多面广精细研】1.化学平衡常数 (1)概念在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,称为化学平衡常数(简称平衡常数),用符号K 表示。
(2)表达式①对于反应m A(g)+n B(g)p C(g)+q D(g),K =c p (C)·c q (D)c m (A)·c n (B)(固体和纯液体的浓度视为常数,通常不计入平衡常数表达式中)。
②K 值越大,反应物的转化率越大,正反应进行的程度越大。
(3)实例(g)2NH)(g)NH N (5)K 值与可逆反应进行程度的关系2.对于上例反应中A(g)的平衡转化率可表示为α(A)=c 平(A)c 0(A)×100%[c 0(A)代表A 的初始浓度,c 平(A)代表A 的平衡浓度]。
[小题练微点]1.判断下列说法的正误(正确的打“√”,错误的打“×”)。
(1)平衡常数表达式中,物质的浓度可以是任一时刻的浓度( ) (2)可逆反应2A(s)+B(g)2C(g)+3D(g)的平衡常数为K =c 2(C)·c 3(D)c 2(A)·c (B)( )(3)化学平衡发生移动,平衡常数一定改变( ) (4)对于反应2SO 2(g)+O 2(g)2SO 3(g),升高温度,K 值减小,则ΔH <0( )(5)平衡常数大的可逆反应的反应物的转化率一定大( ) 答案:(1)× (2)× (3)× (4)√ (5)× 2.已知反应A(g)+3B(g)3C(g)在一定温度下达到平衡,该反应的平衡常数表达式为____________。
若各物质的平衡浓度分别为c (A)=2.0 mol·L -1、c (B)=2.0 mol·L-1、c (C)=1.0 mol·L -1,则K =________。
第3讲化学平衡常数、化学反应进行的方向[考纲要求] 1.理解化学平衡常数的定义并能进行简单计算。
2.了解化学反应的方向与化学反应的焓变与熵变的关系。
3.掌握化学反应在一定条件下能否自发进行的判断依据,能够利用化学反应的焓变和熵变判断化学反应的方向。
考点一化学平衡常数1.概念在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,用符号K表示。
2.表达式对于反应m A(g)+n B(g) p C(g)+q D(g),K=c p C ·c q Dc m A ·c n B(固体和纯液体的浓度视为常数,通常不计入平衡常数表达式中)。
3.意义(1)K值越大,反应物的转化率越大,正反应进行的程度越大。
(2)K只受温度影响,与反应物或生成物的浓度变化无关。
(3)化学平衡常数是指某一具体反应的平衡常数。
深度思考1.对于给定反应,正逆反应的化学平衡常数一样吗?是什么关系?答案正逆反应的化学平衡常数不一样,互为倒数关系。
2.化学平衡常数只受温度的影响,温度升高,化学平衡常数是增大还是减少?答案温度升高化学平衡常数的变化要视反应而定,若正反应是吸热反应,则温度升高K值增大,反之则减小。
3.对于一个可逆反应,化学计量数扩大或缩小,化学平衡常数表达式是否改变?是什么关系?转化率是否相同?试举例说明。
答案对于一个可逆反应,化学计量数不一样,化学平衡常数表达式也就不一样,但对应物质的转化率相同。
例如:(1)a A(g)+b B(g) c C(g) K 1=c c Cc a A ·c b B(2)na A(g)+nb B(g) nc C(g)K 2=c nc C c na A ·c nbB=K n1或K 1=n K 2 无论(1)还是(2),A 或B 的转化率是相同的。
题组一 化学平衡常数及其影响因素1.温度为t ℃时,在体积为10 L 的真空容器中通入1.00 mol 氢气和1.00 mol 碘蒸气,20 min 后,反应达到平衡,此时测得碘蒸气的浓度为0.020 mol·L -1。
板块四限时·规范·特训时间:45分钟满分:100分一、选择题(每题6分,共66分)1.[2015·苏北四市一模]恒温恒容下,向2 L密闭容器中加入MgSO4(s)和CO(g),发生反应:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g)。
反应过程中测定的部分数据见下表:下列说法正确的是( )A.反应在0~2 min内的平均速率为v(SO2)=mol·L-1·min-1B.反应在2~4 min内容器内气体的密度没有变化C.若升高温度,反应的平衡常数变为,则正反应为放热反应D.保持其他条件不变,起始时向容器中充入mol MgSO4和mol CO,达到平衡时n(CO2)< mol答案B解析在0~2 min内,v(SO2)=v(CO)=错误!=mol·L-1·min-1,A 错误;反应进行到2 min时,n生(CO2)=n消(CO)=mol;4 min时,n(CO2)=mol,说明反应进行到2 min时已经达到平衡,在2~4 min内容器内气体的物质的量没有变化,密度没有变化,B正确;平衡时,K=错误!=,若升高温度,反应的平衡常数变为,则平衡正向移动,正反应为吸热反应,C错误;保持其他条件不变,起始时向容器中充入mol MgSO4和mol CO,达到平衡时n(CO2)> mol,D项错误。
2.[2015·黄冈中学月考]某温度下气体反应达到化学平衡,平衡常数K=c(A)·c2(B)/[c2(E)·c(F)],恒容时,若温度适当降低,F的浓度增加。
下列说法中正确的是( )A.增大c(A)、c(B),K增大B.降低温度,正反应速率增大C.该反应的焓变为负值D.该反应的化学方程式为2E(g)+F(g)A(g)+2B(g)答案D解析平衡常数K只随温度的变化而变化,与浓度变化无关,A错;降低温度,正、逆反应速率均减小,B错;降温时,F的浓度增大,说明平衡逆向移动,正反应是吸热反应,则焓变为正值,C错;根据化学平衡常数表达式可知A、B是生成物,E、F为反应物,且对应指数为其化学方程式中物质前的化学计量数,D正确。
3.[2015·南昌零模]某恒定温度下,在一个2 L的密闭容器中充入A 气体,B气体,测得其浓度为2 mol/L和 1 mol/L;且发生如下反应:3A(g)+2B(g)4C(?)+2D(?)已知“?”代表C、D状态未确定;反应一段时间后达到平衡,测得生成mol C,且反应前后压强比为5∶4,则下列说法中正确的是( )①该反应的化学平衡常数表达式为K=c4?C?·c2?D? c3?A?·c2?B?②此时B的转化率为35%③增大该体系压强,平衡向右移动,但化学平衡常数不变④增加C的量,A、B转化率不变A.①②B.②③C.①④D.③④答案D解析3A(g)+2B(g)4C(?)+2D(?)开始(mol/L): 2 1 0 0转化(mol/L):平衡(mol/L):设平衡时气体总的物质的量浓度为x mol/L,根据压强之比等于物质的量之比可得:p前p后=n1n2,又n1n2=3x,故54=3x,可得x=,从而可知C为固体或液体,D为气体。
故化学平衡常数的表达式为K=c2?D?c3?A?·c2?B?,①错误;B的转化率为40%,②错误;该反应是一个反应后气体分子数减小的反应,增大压强,平衡向右移动,平衡常数只与温度有关,温度不变平衡常数不变,③正确;由于C为固体或液体,增加C的量,平衡不发生移动,A、B 的转化率不变,④正确。
本题选D。
4.[2015·重庆联考]放热反应CO(g)+H2O(g)CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=mol·L-1,其平衡常数为K1。
升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( )A.K2和K1的单位均为mol·L-1B.K2>K1C.c2(CO)=c2(H2O)D.c1(CO)>c2(CO)答案C解析温度升高平衡向逆反应方向移动,平衡常数为K2<K1,单位为1,c1(CO)<c2(CO),C正确。
5.下列说法或解释不正确的是 ( )A.“NO2球”浸泡在冷水中,颜色变浅是因为发生:2NO2(g)N2O4(g) ΔH<0(红棕色) (无色)B.常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH>0C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率D.对于反应N2H4(l)===N2(g)+2H2(g) ΔH=-kJ·mol-1,它在任何温度下都是自发的答案C解析ΔH<0,降低温度,平衡右移,c(NO2)减小,A正确;因ΔS>0,若ΔH<0,则ΔH-TΔS<0,反应一定自发进行,B正确;催化剂只能缩短可逆反应到达平衡的时间而不改变平衡转化率,C错;ΔS>0,ΔH<0,则ΔH-TΔS<0,反应自发进行,D正确。
6.已知298 K下反应2Al2O3(s)+3C(s)===4Al(s)+3CO2(g) ΔH =+2171 kJ·mol-1,ΔS=+J·( mol·K)-1,则下列说法正确的是( )A.由题给ΔH值可知,该反应是一个放热反应B.ΔS >0表明该反应是一个熵增加的反应C.该反应在室温下可能自发进行D.不能确定该反应能否自发进行答案B解析本题主要考查了化学反应进行的方向,意在考查考生的判断能力。
A项,ΔH>0,该反应是吸热反应;由ΔG=ΔH-TΔS=+2171 kJ·mol -1-298 K× kJ·(mol·K)-1>0知,该反应在室温下不能自发进行。
7.[2015·绵阳二诊]一定温度下,在密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如表所示,下列说法不正确的是( )初始浓度/mol·L-100平衡浓度/mol·L-1A.反应达到平衡时,X的体积分数为10%B.该温度下反应的平衡常数K=16C.保持温度不变增大压强,反应速率加快,平衡向正反应方向移动D.若X、Y的初始浓度均为mol·L-1,则相同条件下达到平衡,W的浓度为mol·L-1答案C解析本题考查了化学平衡知识,意在考查考生的判断能力和计算能力。
根据表中所给数据,可得反应方程式为X(g)+Y(g)Z(g)+W(g),反应达到平衡时,X的体积分数为错误!×100%=10%,A选项正确;K=错误!=16,B选项正确;这是一个反应前后气体分子数不变的反应,增大压强正、逆反应速率都增大,但平衡不移动,C选项错误;设达平衡时W的浓度为c mol·L-1(0<c<,则16=c2?-c?×?-c?,解得c=,D选项正确。
8.一定温度下,在四个容积均为2 L的密闭容器中发生下列反应:2SO2(g)+O2(g)2SO3(g),起始的物质的量如下表所示,甲中反应在10min时达到平衡,此时SO2的平衡转化率为80%。
下列判断中正确的是( )A.前10 min的平均速率:v(SO3)甲=mol·L-1·min-1B.乙容器中SO2的平衡转化率大于80%C.丙容器中,反应达平衡前:v逆<v正D.丁容器中,平衡时SO2的浓度小于甲容器中平衡时SO2的浓度的两倍答案D解析甲中SO2的起始量为mol,SO2的平衡转化率为80%,则平衡时消耗SO2mol,生成SO3mol,v(SO3)甲=错误!=mol·L-1·min-1,A错;甲、乙容器中,O2的起始量相同,乙中SO2的起始量比甲中的大,则乙中SO2的平衡转化率比甲中的小,B错;根据甲中数据求得该反应的平衡常数K=400,丙容器中,Q c=错误!=>K=400,故反应逆向进行,反应达平衡前:v正<v逆,C错;丁容器中各物质的起始量是甲中的两倍,当丁容器是甲容器体积的两倍时,达平衡时两容器中SO2的浓度相等,将此两倍容器压缩到与甲同体积,平衡不移动时,SO2的浓度是甲容器中平衡时SO2浓度的两倍,但平衡正向移动,即平衡时丁容器中SO2的浓度小于两倍的甲容器的,D正确。
9.[2015·达州模拟]某恒温密闭容器中发生可逆反应Z(?)+W(?)X(g)+Y(?) ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。
下列有关说法中不正确的有( )A.Z和W在该条件下一定不是气态B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等C.若在该温度下此反应的平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后X的浓度相等D.若该反应只在高于某温度T0时能自发进行,则该反应的平衡常数K随温度升高而增大答案B解析t2时刻缩小容器体积,v正不变,则Z和W一定不是气态,A对;若Y不是气态,则体系中气体的平均摩尔质量不变,B错;根据K=c(X),则体系中只有X为气态,由于温度不变,K值不变,则c(X)不变,C对;由于该反应的ΔS>0,根据该反应只在温度高于T0时能自发进行,则ΔH>0(若ΔH<0,则反应在任何温度下都能自发进行),因此温度升高,平衡向正反应方向移动,平衡常数K增大,D对。
10.化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:2NO(g)N2(g)+O2(g) K1=1×10302H2(g)+O2(g)2H2O(g) K2=2×10812CO2(g)2CO(g)+O2(g) K3=4×10-92以下说法正确的是( )A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80C.常温下,NO、H2O、CO2三种物质分解放出O2的倾向由大到小的顺序为NO>H2O>CO2D.以上说法都不正确答案C解析A项应为K1=[c(N2)·c(O2)]/[c2(NO)],故错;B项应为5×10-82,故错;C项正确。
11.合成氨反应为N2(g)+3H2(g)2NH3(g)。
图1表示在一定的温度下此反应过程中的能量的变化。