高中化学符号大全
- 格式:pdf
- 大小:281.47 KB
- 文档页数:2

化学常用符号与图标一、化学式氢气式H 2 水式 H 2O 氯化氢式 HCl 硝酸式 HNO 3 次氯酸式 HClO 硫亚酸式 H 2SO 3 硫酸式 H 2SO 4 磷酸式 H 3PO 4 碳酸式 H 2CO 3 硫化氢式 H 2S 磷化氢式 PH 3 氨式 NH 3 甲烷式 CH 4 硅烷式 SiH 4 水双氧式 H 2O 2 偏硅酸式 硅酸式 H 2SiO 3 硅原酸式 H 4SiO 4 氯气式 Cl 2 溴单式Br 2 碘单式 I 2 氧化钠式 Na 2O 氧过化钠式 Na 2O 2氧化镁式 MgO 氧化铝式 Al 2O 3氧化铁式 Fe 2O 3氧亚铁式 FeO 四氧化三铁式 Fe 3O 4氧化钙式 CaO 二氧化硫式 SO 2三氧化硫式 SO 3四氧化二氮式 N 2O 4二氧化氮式 NO 2一氧化氮式NO氧化铜式 CuO 氧化银式 Ag 2O 二氧化碳式 CO 2一氧化碳式 CO 氢离子式 H + 钠离子式 Na +钾离子式 K + 银离子式 Ag + 铵离子式 NH +4二氨银式 [Ag(NH 3)2]+钙离子式 Ca 2+镁离子式 Mg 2+铜离子式 Cu 2+钡离子式 Ba 2+铁亚离子式 Fe 2+ 锌离子式 Zn 2+ 铁离子式Fe 3+铝离子式 Al 3+ 氟离子式 F - 氯离子式 Cl - 溴离子式 Br - 碘离子式 I - 硝酸根式NO -3硫氢根式 HS - 碳酸氢根式 HCO -3 硫亚氢根式 HSO -3 硫酸氢根式 HSO -4 乙酸根式 CH 3COO -偏铝酸根式 AlO -2 次氯酸根式 ClO -3 碘酸根式 IO -3 氯次酸根式 ClO - 氢氧根式 OH - 硫亚酸根式 SO 2-3 碳酸根式 CO 2-3 硫酸根式SO 2-4 硅酸根式 SiO 2-3 磷酸根式PO 3-4 PO 2-3硫离子式 S 2- 硅原酸根式 SiO 3-4 氧氢化钠式 氢氧钠式 NaOH 氯钠式 NaCl 溴钠式 NaBr 碘钠式 NaI 硝酸钠式 NaNO 3 乙酸钠式CH 3COONa 硫氢钠式 NaHS 亚硫钠式NaHSO 3 碳酸氢钠式 NaHCO 3 偏铝酸钠式 NaAlO 2次氯酸钠式 NaClO 氯酸钠式 NaClO 3 硫酸氢钠式 NaHSO 4 碘酸钠式 NaIO 3 硫酸钠式 Na 2SO 4 硫亚酸钠式Na 2SO 3 硅酸钠式 Na 2SiO 3 碳酸钠式 Na 2CO 3 硫化钠式 Na 2S 硅原酸钠式Na 3SiO 4磷酸钠式Na 3PO 4 氧氢化钾式 氢氧钾式 KOH 氯化钾式 KCl 溴化钾式 KBr 碘化钾式 KI碘酸钾式KNO 3 乙酸钾式CH 3COOK 硫氢钾式KHS 亚硫钾式 KHSO 3 碳酸氢钾式 KHCO 3 偏铝酸钾式 KAlO 2 次氯酸钾式 KClO 氯酸钾式KClO 3 硫酸氢钾式 KHSO 4 硫酸钾式K 2SO 4硫亚酸钾式 K 2SO 3 硅酸钾式 K 2SiO 3 碳酸钾式 K 2CO 3 硫化钾式K 2S 硅原酸钾式 K 3SiO 4 磷酸钾式 K 3PO 4 氯化银式 AgCl 氯化银沉淀式 AgCl ↓ 溴化银式 AgBr 碘化银式 AgI 硝酸氨银 Ag(NH 3)2(NO 3)2 氯化铵式 NH 4Cl溴化铵式 NH 4Br 碘化铵式NH 4I 一水合氨式 NH 3·H 2O 硝酸铵式NH 4NO 3磷酸铵式 (NH 4)3PO 4 氧氢化钙式 Ca(OH)2 氯化钙式 CaCl 2 CaBr 2 碘化钙式 CaI 2碳酸钙式 CaCO 3钙盐: CaSO 3CaSO 4 CaSiO 3 Ca 3(AlO 3)2 Ca(HCO 3)2 Ca(HSO 3)2 Ca(HSO 4)2 Ca(ClO)2 CaSO 4 Ca 3(PO 4)2 CaHPO 4 Ca(H 2PO 4)2镁盐: MgCl 2、MgI 2、Mg(NO 3)2、MgSiO 3、Mg(HSO 3)2、Mg 3(PO 4)2、Mg(H 2PO 4)2、Mg 3N 2 Fe(OH)3FeCl 3FeBr 3Fe(NO 3)3硫酸铁式Fe 2(SO 4)3Al(OH)3AlCl 3AlBr 3Al(NO 3)3硫酸铝式Al 2(SO 4)3 188O二、符号单等 —— 加热等 △—— 一定条件等 一定条件═══ 浓硫酸等 浓硫酸═══ 催化剂等 催化剂═══浓加等 浓硫酸═══加热 高高催等 高温高压═══催化剂 二氧化锰等 二氧化锰═══ 二氧化锰加热等 二氧化锰═══△高温等高温═══ 催加等催化剂═══△ 闪电══单号─→ 加热号△─→ 浓硫酸号浓硫酸───→ 一定条件号一定条件───→ 催化剂号催化剂───→浓加号浓硫酸───→△制乙烯号浓硫酸───→170℃ 制乙醚号浓硫酸───→140℃ 二氧化锰号二氧化锰───→ 催化剂───→加压、加热 燃烧═══燃烧══ 电解══ 一定条件逆催化剂逆 浓硫酸逆 高高逆 可逆号 加热逆催加逆催化剂△浓加逆浓硫酸△高高加逆高温高压△期望产物的总质量 ───────生成物的总质量高高催逆高温高压催化剂H 2OH 2OH 2OH 2O 高温══ 高温─→ 点燃─→ 光照─→单逆号 ←─前聚合号——[后聚合号——] n 双键号 C —C叁键号 C ——C 侧二甲苯 ─CH 3─CH 3三甲苯 H 3C ─ ─CH 3| CH 3 三硝基甲苯 ∣CH 3O 2N ─ ─NO 2 | NO 2右斜甲苯CH3╱ CH3╱ CH3╱ CH3╱ H3C ╲H3C ╲左斜甲苯H3C ╲竖二甲苯 OH ||CH3羰基式 —O ‖C — 醛基式 —O ‖C —H 羟基式 —OH 羧基式 —O ‖C —OH三、电子式镁电子式 ·Mg · 铝电子式 ··Al · 碳电子式 ··C ·· 氮电子式 · ·· N ·· 氧电子式 · ··O ·· ·氯右电子式 :·· Cl ·· · 氯左电子式 ··· Cl ·· :八电子结构 :··Cl ··: 氨电子式H ·· H :N·· :H :·· Cl ·· :·· Cl ·· : H :·· Cl ·· : 氢左电子式 ·H 氢右电子式 H ·C12 12C C60 12C C 60 碳六十式 C612 126C 碳十二式 沉淀淀↓ 气体体↑ 二氧化碳电子式 :·· O ·· ::C ::·· O ·· : 氧化钠电子式 Na +[: ·· O·· :]2-Na + 过化钠电子式Na +[: ·· O ·· : ·· O·· :]2-Na +氮气电子式 :N ······N : :·· O ·· ::C ::·· O ·· :Na +[: ·· O ·· :]2-Na + Na +[: ·· O ·· : ·· O ·· :]2-Na+ Na +[: ·· O ·· :H]-Na +[:·· Cl ·· :]-H : ·· O ·· :H :·· Cl ·· ::·· Cl ·· :C :··Cl ··::·· Cl ·· : H 2OH 2OH 2OH 2OH 2OH 2OH 2OH 2OH 2O氧氢化钠电式 Na +[: ·· O ·· : H]- 氯化钠电子式 Na +[:·· Cl ·· :]- 水电H ∶‥O ‥∶ HH ∶‥O ‥∶ H四氯化碳电式:·· Cl ·· ::·· Cl ·· :C :·· Cl ··::·· Cl ·· : 左电子转移号 ·+ · 右电子转移号 · + · 氨电式 H ..H:N ..:H 铵根电式H ·· [H :N ·· :H]+H [:·· Cl ··:]- H | [H -N| -H]+HF ╲F ╱C -F ·H H · Na · K · ·Mg ··Ca ···Al ···C ····Si ·· ‥·O · ‥ ···S ·· · ··N ..· ··· Cl ·· : ·· :Cl ···Na ·+ ··· Cl ·· :─→ Na +[:·· Cl ·· :]- 氯钠生式·· Br ·· ·· I ·· ·· O ·· Na ·+ ··· Br ·· : ─→ Na +[:·· Br ··:]- K · + ··· Cl ·· : ─→ K +[:··Cl ·· :]- 氯钠生式K · + ··· Br ·· : ─→ K +[:··Br ·· :]-K · + ··· I ·· :─→ K +[:··I ··:]-K · + ‥·O · ‥ +·K ─→ K +[:·· O ·· :]2-K +K · + · ·· S ·· · +·K ─→ K +[: ·· S ·· :]2-K + H · +··· Cl ·· : ─→ H :··Cl ·· :H · +··· Br ·· : ─→ H :··Br ·· :H · +··· I ·· : ─→ H :··I ··:H · +‥·O · ‥+·H ─→ H :·· O ·· : H:·· Cl ·· ·+·Mg ·+··· Cl ·· :─→ [:·· Cl ·· :]-Mg 2+ [:·· Cl ·· :]- [:·· Cl ·· :]-Mg 2+ [:·· Cl ·· :]- :·· I ·· ·+·Mg ·+··· I ·· :─→ [:·· I ·· :]-Mg 2+ [:··I ·· :]- :·· Br ·· ·+·Mg ·+··· Br ·· :─→ [:·· Br ·· :]-Mg 2+ [:··Br ·· :]- :·· Cl ·· ·+·Ca ·+··· Cl ·· :─→ [:·· Cl ·· :]-Ca 2+ [:··Cl ··:]- C:·· I ·· ·+·Ca ·+··· I ·· :─→ [:·· I ·· :]-Ca 2+ [:··I ·· :]- :·· Br ·· ·+·Ca ·+··· Br ·· :─→ [:·· Br ·· :]-Ca 2+ [:··Br ··:]- 氯气电式 :·· Cl ·· :·· Cl ·· : :·· Br ·· :·· Br ·· :溴单电式 :·· Br ·· :·· Br ·· : 碘单电式 :·· I ·· :··I ·· : 氮气电式 :N ······N : 氢气电式 H :H Cl 2氯化氢电式 H :·· Cl ·· : H ..H:N ..:H H .. [H :N ..:H]+H 甲烷电式 H ..H :C ..:H H H ..H :Si ..:H HH ·· H :N ·· :H H ··[H :N ·· :H]+H电子转移式 2e —∣─────────────↓S + O 2 ═ SO 2 电子转移式2e —∣─────────────↓ S + O 2 ═ SO 2一层结构○+1 )1 ) 二层结构○+1 )2 ))8 ) ○+1 )1 ) ○+1 )2 ))8 ) —CH —∣NH 2CH 2-∣OH ∣CH 2-OH 上CH 2-∣OH∣CH 2-OH 三、 有机域上结构 CH 3—CH —COOH ∣NH 2 —CH —∣NH 2 下结构 CH 2-∣OH CH 2-∣OH CH 2-∣OH CH 2-∣OH上下构结 CH -∣OH ∣NH 2 CH -∣OH ∣NH 2CH -∣OH ∣NH 2CH -∣OH ∣NH 2CH -∣OH ∣NH 2CH -∣OH ∣NH 2中结构 ∣CH 2-OH ∣CH 2-OH ∣CH 2-OH ∣CH 2-OH署名结构 (C 6H 10O 5)n 纤维素 (C 6H 10O 5)n 淀粉 (C 6H 12O 6)n 葡萄糖 (C 6H 12O 6)n 果糖 (C 12H 22O 11)n 麦芽糖 (C 12H 22O 11)n蔗糖(C 6H 10O 5)n 纤维素分子式结构 HNO 3 C 2H 5O —NO 2硝酸乙酯C 2H 5O —NO 2硝酸乙酯C 2H 5O —NO 2硝酸乙酯C 2H 5O —NO 2硝酸乙酯C 2H 5O —NO 2硝酸乙酯分子结构 CH —ONO 2∣CH 2—ONO 2∣CH 2—ONO 2三层结构 CH —ONO 2∣CH 2—ONO 2∣CH 2—ONO 2反应示意图结构 H 2O ⎩⎪⎨⎪⎧CO 2叶绿素A 酶B O 2催化剂C O2D B H +ENa 2O 2⎩⎨⎧→G 过量CO 2白色沉淀H→F S 点燃I H 2SO 4△水解液NaOH 溶液中和液⎩⎨⎧银氨溶液微热生成银镜碘水无现象 C 6H 5— HO —CH —NH —C ‖O —C 6H 5CH -COOH ∣+H 2O 无机酸C 6H 5— HO —CH —NH 2CH -COOH∣羟基酸羟基酯结构 CH 3CH ╱╲COO╲OOC╱CHCH 3 CH 3CH ╱╲COO ╲OOC ╱CHCH 3CH 3CH ╱╲COO ╲OOC ╱CHCH 3双键结构 H 3C ╲H 3C ╱C =C ╱CH 3╲CH 3 H 3C ╲H 3C ╱C = C ╱╲ C ╱╲ CH 3CH 3 C ╱CH 3╲CH 3横上苯 -- 横下苯-- 竖右苯竖左苯对二甲苯 CH 3- -CH 3 CH 3- -CH 3竖苯酚 -OH 横苯酚 -OH 竖苯酚 竖方程组结构 竖甲苯竖苯酚 OH | 竖苯甲酸 COOH | 竖甲苯 CH 3| 上甲基 CH3| 下甲基 | CH3 右斜甲苯CH3╱ CH3╱ CH3╱ CH3╱ ╱H3C H3C ╲ H3C ╲竖对二苯基 OH || CH3横对二苯基 ——-CH 3-CH 3平二苯基H 3C ──CH 3-CH 3-CH 3 侧二苯基-3-3 三苯基 H 3C ──CH 3| CH3三硝基甲苯 CH3|O 2N ─ ─NO 2 | NO2白藜芦醇 HO - -CH =CH - ╱CH 3╲3横右三甲苯CH - ╱CH 3╲3横左三甲苯 H3C ╲ ╱H3C-CH 3 CHH3C ╲ ╱H3C竖三甲苯 CH3H 3C CH 3 三溴苯酚Br ──Br| Br双键号 —— 叁键号——合成结构四、方程组结构 ytxs 同醛基式 -O ║C —H双尖前域⎩⎪⎨⎪⎧x +y ═x +y ═双尖后域⎭⎪⎬⎪⎫x +y ═x +y ═ 3、⎩⎨⎧x +y ═x +y ═x +y ═4、⎩⎪⎨⎪⎧x +y ═x +y ═x +y ═x +y ═x +y ═双平前域⎣⎢⎡x +y ═x +y ═双平后域⎦⎥⎤x +y ═x +y ═前聚合号——[ 后聚合号 ——] n 聚合号 ——[——] n左合右号 ――――――⎦⎥⎤――― 左分右号 ――――⎣⎢⎡-→-→ HO - -CH =CH - ╱CH 3╲3白黎芦醇 HO - CH =CH - ╱CH 3╲3环氧乙烷O╱ ╲H 2C ――CH 2有机结构域应用 [—]—n CH —OH ∣CH 2—OH ∣CH 2—OH —C — ∣CH 3 ∣ CH 3中间结构 CH —OH ∣CH 2—OOCCH 3∣CH 2—OH 和CH —OOCCH 3∣CH 2—OH ∣CH 2—OH(C 6H 7O 2)—ONO 2OHOH n (C 6H 7O 2)—ONO ONO 2ONOn10 g2 0003 g ·mol—1∶12 g 1002 g ·mol —1═ ①CHOOCC 15H 31∣CH 2OOCC 15H 31∣CH 2OOCC 15H 31 ②CH 2∣CH 2OOCC 17H 35∣CH 2OOCC 17H 35 ③CH —ONO 2∣CH 2—ONO 2∣CH 2—ONO 2—C ‖O —R 被 -P -O ‖O ∣OH 1230 ⎩⎨⎧加碘水溶液变蓝色加C 溶液单质沉淀 加A 溶液△ H -C -H |H ∣HH 2N —CH ∣R 1—C ‖O —N ∣H —CH ∣R 2—C ‖O —N ∣H —CH ∣R 3—C ‖O —N ∣H —CH ∣R 4—C ‖O—OH ,—C ‖O —N ∣H —⎩⎪⎨⎪⎧2x +3y +9z +5m ═555x +7y +11z +9m ═882×(x +y +z +2m )═28 x +y +z +m ═10 解得⎩⎪⎨⎪⎧x ═1y ═2z ═3m ═4R -CH —C ‖O —OH ∣NH 2+HNO 2R -CH —C ‖O —OH ∣OH +N 2↑+H 2CH 2—COOH ∣NH 2、CH 3—CH —COOH ∣NH 2、 C. D. (C 6H 7O 2)—ONO 2ONO 2OH②CHOOCC 15H 31∣CH 2OOCC 15H 31∣CH 2OOCC 15H 31+HO -P -OH ‖O∣OH CHOOCC 15H 31∣CH 2O -P -OH‖O ∣OH∣CH 2OOCC 15H 31+C 15H 31COOH ③CHOOCC 15H 31∣CH 2O -P -OH‖O∣OH∣CH 2OOCC 15H 31+2NaOH CHOOCC 15H 31∣CH 2O -P -ONa‖O ∣ONa∣CH 2OOCC 15H 31+2H 2O (C 6H 7O 2)—ONO 2ONO 2OH n(说明:-P -O ‖O ∣OH H 也可代替CHOOCC 15H 31∣CH 2OOCC 15H 31∣CH 2OOCC 15H 31中间的—C ‖O —C 15H 31基团。

化学常用符号与图标一、化学式氢气式水式氯化氢式硝酸式次氯酸式硫亚酸式硫酸式磷酸式碳酸式硫化氢式磷化氢式氨式甲烷式硅烷式水双氧式偏硅酸式硅酸式硅原酸式氯气式溴单式碘单式氧化钠式氧过化钠式氧化镁式氧化铝式氧化铁式氧亚铁式四氧化三铁式氧化钙式二氧化硫式三氧化硫式四氧化二氮式二氧化氮式一氧化氮式O浓加等高高催等二氧化锰等二氧化锰加热等高温等催加等单号加热号浓硫酸号一定条件号催化剂号浓加号制乙烯号制乙醚号二氧化锰号一定条件逆催化剂逆浓硫酸逆高高逆加热逆催加逆浓加逆高高加逆高高催逆单逆号←─前聚合号双键号CC叁键号CC侧二甲苯─CH3,─CH3) 三甲苯CH3),)三硝基甲苯),O2N─NO2,)右斜甲苯左斜甲苯竖二甲苯羰基式—),C)—醛基式—),C)—H羟基式—OH羧基式—),C)—OH三、电子式镁电子式·Mg·铝电子式··碳电子式··氮电子式··氧电子式···HH),),K·+·K·+·K·+·K·++K·+H·+·H·+·H·+·H·++:·+:·+:·+·Mg·+·:[::]-Mg2+[::]-:·+·Ca·+·:[::]-Ca2+[::]-:·+·Ca·+·:[::]-Ca2+[::]-:·+·Ca·+·:[::]-Ca2+[::]-氯气电式::::::溴单电式:::碘单电式:::氮气电式:NN:氢气电式H:H氯化氢电式H::),H::H)),[H::H]+,H )甲烷电式),H::H,H)),H::H,H)),H::H)),[H::H]+,H)电子转移式),S+O2═SO2,)电子转移式),S+O2═SO2,)一层结构二层结构上三、有机域上结构下结构上下构结中结构署名结构分子式结构—,硝酸乙酯)—,硝酸乙酯)—,硝酸乙酯)—,硝酸乙酯)—,硝酸乙酯)分子结构三层结构反应示意图结构A BCDE,白色沉淀H,→F I))))水解液中和液生成银镜,无现象))))—─CH四、方程组结构ytxs同醛基式-),C,)—H双尖前域双尖后域)3、4、双平前域)))双平后域)前聚合号后聚合号聚合号左合右号)―――左分右号)HO-CH=CH-白黎芦醇CH=CH-环氧乙烷有机结构域应用n)中间结构和)∶,2)═①②③—,)R被溶液变蓝色,单质沉淀))25.⑴丙:饱和氯化钠溶液;D:氢氧化钠溶液;C:氢气;E:氯气⑵取代;不能;其组成和数量均发生了变化⑶①2NaCl+2H2O,电解,)2NaOH+↑+↑②CH3COOH+ClCH2COOH+HCl26.⑴缩聚⑵+n H2O n⑶CH2—n,∣,COOH),水解,);;;;╱╱。

必考知识点:化学符号及含义!
1.若⼲个原⼦:
在元素符号前加数字,“1”省略
S表⽰1个硫原⼦,硫元素,硫单质
2Ca 表⽰2个钙原⼦
2.若⼲个分⼦:
化学式前加数字(单个的元素符号除外)
①2H2O 2个⽔分⼦
②2N2 2个氮分⼦
③nSO2 n个⼆氧化硫分⼦
3.若⼲个离⼦:
离⼦符号前加数字(离⼦的电荷数标在右上⾓,电荷的数值等于它的化合价)
①2S2- 2个硫离⼦
②2Ca2+2个钙离⼦
③2SO4 2- 2个硫酸根离⼦
④nOH- n个氢氧根离⼦
⑤2Fe3+2个铁离⼦
⑥3Fe2+ 3个亚铁离⼦
4.元素的化合价:
标在元素符号的正上⽅
+2
Ca +2价的钙元素
-2
O-2价的氧元素
+1
H2O ⽔中氢元素的化合价+1价
5.“2”的含义
2Ca2+前2:表⽰2个钙离⼦,后2:每个钙离⼦带2个单位正电荷
2H2O 前2:表⽰2个⽔分⼦,后2:每个⽔分⼦中有2个氢原⼦
+2
CaO 氧化钙中钙元素的化合价是 2价。
微信号搜索:czsjz100 即可加⼊我们
初中⽣家长公众号:致⼒于服务初中各年级家长,每天下午5点—6点准时为⼤家分享专业的家庭教育理念、初中各年级学习资料,学习⽅法,教育经验等等。
孩⼦健康成长的路上,我们与您同⾏.。

化学常用符号与图标一、化学式氢气式H2水式H2O 氯化氢式HCl 硝酸式HNO3次氯酸式HClO 硫亚酸式H2SO3硫酸式H2SO4磷酸式H3PO4碳酸式H2CO3硫化氢式H2S 磷化氢式PH3氨式NH3甲烷式CH4硅烷式SiH4水双氧式H2O2偏硅酸式硅酸式H2SiO3硅原酸式H4SiO4氯气式Cl2溴单式Br2碘单式I2氧化钠式Na2O氧过化钠式Na2O2氧化镁式MgO氧化铝式Al2O3氧化铁式Fe2O3氧亚铁式FeO四氧化三铁式Fe3O4氧化钙式CaO二氧化硫式SO2三氧化硫式SO3四氧化二氮式N2O4二氧化氮式NO2一氧化氮式NO氧化铜式CuO氧化银式Ag2O二氧化碳式CO2一氧化碳式CO氢离子式H+钠离子式Na+钾离子式K+银离子式Ag+铵离子式NH+4二氨银式[Ag(NH3)2]+钙离子式Ca2+镁离子式Mg2+铜离子式Cu2+钡离子式Ba2+铁亚离子式Fe2+锌离子式Zn2+铁离子式Fe3+铝离子式Al3+氟离子式F-氯离子式Cl-溴离子式Br-碘离子式I-硝酸根式NO-3硫氢根式HS-碳酸氢根式HCO-3硫亚氢根式HSO-3 硫酸氢根式HSO-4乙酸根式CH3COO-偏铝酸根式AlO-2次氯酸根式ClO-3碘酸根式IO-3氯次酸根式ClO-氢氧根式OH-硫亚酸根式SO2-3 碳酸根式CO2-3 硫酸根式SO2-4 硅酸根式SiO2-3 磷酸根式PO3-4 PO2-3硫离子式S2-硅原酸根式SiO3-4 氧氢化钠式氢氧钠式NaOH 氯钠式NaCl 溴钠式NaBr 碘钠式NaI 硝酸钠式NaNO3乙酸钠式CH3COONa 硫氢钠式NaHS 亚硫钠式NaHSO3碳酸氢钠式NaHCO3偏铝酸钠式NaAlO2次氯酸钠式NaClO 氯酸钠式NaClO3硫酸氢钠式NaHSO4碘酸钠式NaIO3硫酸钠式Na2SO4硫亚酸钠式Na2SO3硅酸钠式Na2SiO3碳酸钠式Na2CO3硫化钠式Na2S 硅原酸钠式Na3SiO4磷酸钠式Na3PO4氧氢化钾式氢氧钾式KOH 氯化钾式KCl 溴化钾式KBr 碘化钾式KI 碘酸钾式KNO3乙酸钾式CH3COOK 硫氢钾式KHS 亚硫钾式KHSO3碳酸氢钾式KHCO3偏铝酸钾式KAlO2次氯酸钾式KClO 氯酸钾式KClO3硫酸氢钾式KHSO4硫酸钾式K2SO4硫亚酸钾式K2SO3硅酸钾式K2SiO3碳酸钾式K2CO3硫化钾式K2S硅原酸钾式K3SiO4磷酸钾式K3PO4氯化银式AgCl 氯化银沉淀式AgCl↓溴化银式AgBr碘化银式AgI 硝酸氨银Ag(NH3)2(NO3)2氯化铵式NH4Cl溴化铵式NH4Br 碘化铵式NH4I 一水合氨式NH3·H2O 硝酸铵式NH4NO3磷酸铵式(NH4)3PO4氧氢化钙式Ca(OH)2氯化钙式CaCl2CaBr2碘化钙式CaI2碳酸钙式CaCO3钙盐:CaSO3CaSO4CaSiO3Ca3(AlO3)2Ca(HCO3)2Ca(HSO3)2Ca(HSO4)2Ca(ClO)2CaSO4 Ca3(PO4)2CaHPO4Ca(H2PO4)2镁盐:MgCl2、MgI2、Mg(NO3)2、MgSiO3、Mg(HSO3)2、Mg3(PO4)2、Mg(H2PO4)2、Mg3N2Cu(OH)2CuCl2CuBr2CuI2CuCO3Cu(NO3)2CuSO3Cu2(OH)2(CO3)2CuSO4Ba(OH)2BaCl2BaBr2BaI2BaCO3Ba(NO3)2BaSO3BaSO4BaSiO3Ba(HCO3)2Ba(HSO3)2Ba(HSO4)2 Ba3(PO4)2BaHPO4Ba(H2PO4)2Fe(OH)2FeCl2FeBr2FeI2Fe(NO3)2FeSO4Zn(OH)2ZnCl2ZnBr2ZnI2ZnCO3ZnSO4Zn(NO3)2Fe(OH)3FeCl3FeBr3Fe(NO3)3硫酸铁式Fe2(SO4)3Al(OH)3AlCl3AlBr3Al(NO3)3硫酸铝式Al2(SO4)3188O二、符号单等 —— 加热等 △—— 一定条件等 一定条件═══ 浓硫酸等 浓硫酸═══ 催化剂等 催化剂═══浓加等 浓硫酸═══加热 高高催等 高温高压═══催化剂 二氧化锰等 二氧化锰═══ 二氧化锰加热等 二氧化锰═══△高温等高温═══ 催加等催化剂═══△ 闪电══单号─→ 加热号△─→ 浓硫酸号浓硫酸───→ 一定条件号一定条件───→ 催化剂号催化剂───→ 浓加号浓硫酸───→△制乙烯号浓硫酸───→170℃ 制乙醚号浓硫酸───→140℃ 二氧化锰号二氧化锰───→ 催化剂───→加压、加热 燃烧═══燃烧══ 电解══ 一定条件逆催化剂逆浓硫酸逆高高逆可逆号浓硫酸△催化剂△ 高温高压△ 高温高压催化剂加热逆 催加逆催化剂△ 浓加逆浓硫酸△ 高高加逆高温高压△期望产物的总质量 ───────生成物的总质量高高催逆 高温高压催化剂H 2OH 2OH 2OH 2O 高温══ 高温─→ 点燃─→ 光照─→ 单逆号 ←─前聚合号——[ 后聚合号——] n 双键号 C —C 叁键号 C ——C 侧二甲苯 ─CH 3─CH 3三甲苯 H 3C ─ ─CH 3| CH 3 三硝基甲苯 ∣CH 3O 2N ─ ─NO 2 | NO 2右斜甲苯 CH3╱ CH3╱ CH3╱ CH3╱ H3C╲H3C ╲左斜甲苯H3C ╲ 竖二甲苯 OH | | CH3羰基式 —O ‖C — 醛基式 —O ‖C —H 羟基式 —OH 羧基式 —O ‖C —OH三、电子式镁电子式 ·Mg · 铝电子式 ··Al · 碳电子式 ··C ·· 氮电子式 · ·· N ·· 氧电子式 · ··O ·· ·氯右电子式 :·· Cl ·· · 氯左电子式 ··· Cl ·· :八电子结构 :··Cl ··: 氨电子式H ·· H :N·· :H :·· Cl ·· :·· Cl ·· : H :·· Cl ·· : 氢左电子式 ·H 氢右电子式 H ·C12 12C C60 12C C 60 碳六十式 C612 126C 碳十二式 沉淀淀↓ 气体体↑二氧化碳电子式 :·· O ·· ::C ::·· O ·· : 氧化钠电子式 Na +[: ·· O·· :]2-Na + 过化钠电子式Na +[: ·· O ·· : ·· O·· :]2-Na +氮气电子式 :N ······N : :·· O ·· ::C ::·· O ·· :Na +[: ·· O ·· :]2-Na + Na +[: ·· O ·· : ·· O ·· :]2-Na+ Na +[: ·· O ·· :H]-Na +[:·· Cl ·· :]-H : ·· O ·· :H :·· Cl ·· ::·· Cl ·· :C :··Cl ··::·· Cl ·· : H 2OH 2OH 2OH 2OH 2OH 2OH 2OH 2OH 2O氧氢化钠电式 Na +[: ·· O ·· : H]- 氯化钠电子式 Na +[:·· Cl ·· :]- 水电H ∶‥O ‥∶ HH ∶‥O ‥∶ H:·· Cl ·· ::·· Cl ·· :C :·· Cl ··::··Cl ·· : 四氯化碳电式:·· Cl ·· ::·· Cl ·· :C :·· Cl ··::·· Cl ·· : 左电子转移号 ·+ · 右电子转移号 · + · 氨电式 H ..H:N ..:H 铵根电式H ·· [H :N ·· :H]+H [:·· Cl ··:]- H | [H -N| -H]+HF ╲F ╱C -F·H H · Na · K · ·Mg ··Ca ···Al ···C ····Si ·· ‥·O · ‥ ···S ·· · ··N ..· ··· Cl ·· : ·· :Cl ···Na ·+ ··· Cl ·· :─→ Na +[:·· Cl ·· :]- 氯钠生式·· Br ·· ·· I ·· ·· O ·· Na ·+ ··· Br ·· : ─→ Na +[:·· Br ··:]- Na · + ··· I ·· : ─→ Na +[:·· I ··:]- CNa · + · ·· O ·· · + ·Na ─→ Na +[:·· O ·· :]2-Na +Na · + · ·· S ·· · + ·Na ─→ Na +[: ·· S ·· :]2-Na +H ·+··· Cl ·· : ─→ H :·· Cl ·· :H · +‥·O · ‥+·H ─→ H :·· O ··: H:·· Cl ·· · + ·Mg · + ··· Cl ·· :─→ [:·· Cl ·· :]-Mg 2+ [:·· Cl ·· :]-H 2OH 2OH 2O·+ · · + · K · + ··· Cl ·· : ─→ K +[:··Cl ·· :]- 氯钠生式K · + ··· Br ·· : ─→ K +[:··Br ·· :]-K · + ··· I ·· :─→ K +[:··I ··:]-K · + ‥·O · ‥ +·K ─→ K +[:·· O ·· :]2-K +K · + · ·· S ·· · +·K ─→ K +[: ·· S ·· :]2-K + H · +··· Cl ·· : ─→ H :··Cl ·· :H · +··· Br ·· : ─→ H :··Br ·· :H · +··· I ·· : ─→ H :··I ··:H · +‥·O · ‥+·H ─→ H :·· O ··: H:·· Cl ·· ·+·Mg ·+··· Cl ·· :─→ [:·· Cl ·· :]-Mg 2+ [:·· Cl ·· :]- [:·· Cl ·· :]-Mg 2+ [:·· Cl ·· :]- :·· I ·· ·+·Mg ·+··· I ·· :─→ [:·· I ·· :]-Mg 2+ [:··I ·· :]- :·· Br ·· ·+·Mg ·+··· Br ·· :─→ [:·· Br ·· :]-Mg 2+ [:··Br ·· :]- :·· Cl ·· ·+·Ca ·+··· Cl ·· :─→ [:·· Cl ·· :]-Ca 2+ [:··Cl ··:]-:·· I ·· ·+·Ca ·+··· I ·· :─→ [:·· I ·· :]-Ca 2+ [:··I ·· :]- :·· Br ·· ·+·Ca ·+··· Br ·· :─→ [:·· Br ·· :]-Ca 2+ [:··Br ·· :]-氯气电式 :·· Cl ·· :·· Cl ·· : :·· Br ·· :·· Br ·· :溴单电式 :·· Br ·· :·· Br ·· : 碘单电式 :·· I ·· :··I ·· : 氮气电式 :N ······N : 氢气电式 H :H Cl 2氯化氢电式 H :·· Cl ·· : H ..H:N ..:H H .. [H :N ..:H]+H 甲烷电式 H ..H :C ..:H H H ..H :Si ..:H HH ·· H :N ·· :H H ·· [H :N ·· :H]+HH ·· H :N ··:H H ·· [H :N ·· :H]+HH | [H -O -H]+电子转移式 2e —∣─────────────↓S + O 2 ═ SO 2 电子转移式2e —∣─────────────↓ S + O 2 ═ SO 2一层结构○+1 )1 ) 二层结构○+1 )2 ))8 ) ○+1 )1 ) ○+1 )2 ))8 ) —CH —∣NH 2CH 2-∣OH ∣CH 2-OH 上CH 2-∣OH∣CH 2-OH 三、 有机域上结构 CH 3—CH —COOH ∣NH 2 —CH —∣NH 2下结构 CH 2-∣OH CH 2-∣OH CH 2-∣OH CH 2-∣OH上下构结 CH -∣OH ∣NH 2 CH -∣OH ∣NH 2CH -∣OH ∣NH 2CH -∣OH ∣NH 2CH -∣OH ∣NH 2CH -∣OH∣NH 2中结构 ∣CH 2-OH ∣CH 2-OH ∣CH 2-OH ∣CH 2-OH署名结构 (C 6H 10O 5)n 纤维素 (C 6H 10O 5)n 淀粉 (C 6H 12O 6)n 葡萄糖 (C 6H 12O 6)n 果糖 (C 12H 22O 11)n 麦芽糖 (C 12H 22O 11)n蔗糖(C 6H 10O 5)n 纤维素分子式结构 HNO 3 C 2H 5O —NO 2硝酸乙酯C 2H 5O —NO 2硝酸乙酯C 2H 5O —NO 2硝酸乙酯C 2H 5O —NO 2硝酸乙酯C 2H 5O —NO 2硝酸乙酯分子结构 CH —ONO 2∣CH 2—ONO 2∣CH 2—ONO 2三层结构 CH —ONO 2∣CH 2—ONO 2∣CH 2—ONO 2反应示意图结构 H 2O ⎩⎪⎨⎪⎧CO 2叶绿素A 酶B O 2催化剂C O2D B H +ENa 2O 2⎩⎨⎧→G 过量CO 2白色沉淀H→F S 点燃I H 2SO 4△水解液NaOH 溶液中和液⎩⎨⎧银氨溶液微热生成银镜碘水无现象 C 6H 5— HO —CH —NH —C ‖O —C 6H 5CH -COOH ∣+H 2O 无机酸C 6H 5— HO —CH —NH 2CH -COOH ∣羟基酸羟基酯结构 CH 3CH ╱╲COO╲OOC╱CHCH 3 CH 3CH ╱╲COO ╲OOC ╱CHCH 3CH 3CH ╱╲COO ╲OOC╱CHCH 3双键结构 H 3C ╲H 3C ╱C =C ╱CH 3╲CH 3 H 3C ╲H 3C ╱C = C ╱╲ C ╱╲ CH 3CH 3 C ╱CH 3╲CH 3横上苯 - 横下苯- - 竖右苯竖左苯对二甲苯 CH 3 -CH 3 CH 3- -CH 3竖苯酚 OH 横苯酚 OH 竖苯酚 竖方程组结构 竖甲苯竖苯酚 OH |竖苯甲酸COOH|竖甲苯 CH 3|上甲基 CH3| 下甲基 | CH3 右斜甲苯CH3╱ CH3╱ CH3╱ CH3╱ ╱H3C H3C ╲ H3C ╲竖对二苯基 OH || CH3横对二苯基 ——-CH 3-CH 3平二苯基H 3C ──CH 3-CH 3-CH 3 侧二苯基-CH 3-CH 3 三苯基 H 3C ──CH 3| CH3三硝基甲苯 CH3|O 2N ─ ─NO 2 | NO2白藜芦醇 HO - -CH =CH - ╱CH 3╲CH 3横右三甲苯CH - ╱CH 3╲CH 3横左三甲苯 H3C ╲ ╱H3C-CH 3 CHH3C ╲ ╱H3C竖三甲苯 CH3| H 3C ──CH 3 三溴苯酚 Br ─ ─Br | Br双键号 —— 叁键号——合成结构(C 6H 10O 2N 2)C 适当条件CH 3-CH -COOH ∣NH 2↓Na ↓HClA BHNO 2D 浓硫酸(C 6H 8O 4)E四、方程组结构 ytxs⎩⎪⎨⎪⎧x ═1y ═2z ═3m ═4 ⎩⎪⎨⎪⎧2x +3y +9z +5m ═555x +7y +11z +9m ═882×(x +y +z +2m )═28 x +y +z +m ═10⎩⎪⎨⎪⎧2x +3y +9z +5m ═55……………………①2×(x +y +z +2m )═28……………………② ⎩⎪⎨⎪⎧x ═ 1y ═ 2⎩⎨⎧银氨溶液微热生成银镜碘水无现象⎩⎨⎧银氨溶液微热生成银镜碘水无现象 银氨溶液微热生成银镜碘水无现象⎩⎨⎧银氨溶液微热生成银镜碘水无现象 同醛基式 -O ║C —H双尖前域⎩⎪⎨⎪⎧x +y ═x +y ═双尖后域⎭⎪⎬⎪⎫x +y ═x +y ═3、⎩⎨⎧x +y ═x +y ═x +y ═4、⎩⎪⎨⎪⎧x +y ═x +y ═x +y ═x +y ═x +y ═双平前域⎣⎢⎡x +y ═x +y ═双平后域⎦⎥⎤x +y ═x +y ═前聚合号——[ 后聚合号 ——] n 聚合号 ——[——] n左合右号 ――――――⎦⎥⎤――― 左分右号 ――――⎣⎢⎡-→-→HO — —∣OH CH 2CH -∣NH 2O -O ║C —HHO - -CH =CH - ╱CH 3╲CH 3 白黎芦醇 HO - -CH =CH - ╱CH 3╲CH 3环氧乙烷O╱ ╲H 2C ――CH 2有机结构域应用 [—]—n C ‖O —NHCH 3CH ╱╲COO ╲OOC╱CHCH 3CHOOCR'∣CH 2OOCR ∣CH 2OOCR'' CHOOCR ∣CH 2OOCR ∣CH 2OOCR CHOOCC 17H 31∣CH 2OOCC 17H 31∣CH 2OOCC 17H 31 催化剂加热、加压CHOOCC 17H 35∣CH 2OOCC 17H 35∣CH 2OOCC 17H 35HO —NO 2硝酸浓硫酸C 2H 5O —NO 2硝酸乙酯227×15.86%12 227×(100%-15.86%-2.20%-18.50%)16CH —ONO 2∣CH 2—ONO 2∣CH 2—ONO 2CH —OH ∣CH 2—OH ∣CH 2—OH —C — ∣CH 3 ∣ CH 3中间结构CH —O —C ‖O—R 2∣CH 2—O —C ‖O —R 1∣CH 2—O —C ‖O —R 3H 2SO 4 CH —OH ∣CH 2—OH ∣CH 2—OHCH —OH ∣CH 2—OOCCH 3∣CH 2—OH 和CH —OOCCH 3∣CH 2—OH ∣CH 2—OH10 g2 0003 g ·mol —1∶12 g 1002 g ·mol —1═①CHOOCC 15H 31∣CH 2OOCC 15H 31∣CH 2OOCC 15H 31 ②CH 2∣CH 2OOCC 17H 35∣CH 2OOCC 17H 35 ③CH —ONO 2∣CH 2—ONO 2∣CH 2—ONO 2Cu(OH)2 KMnO 4 I 2 mol ·L -1 C 17H 35CHOOCC 17H 35∣CH 2OOCC 17H 31∣CH 2OOCC 17H 35 B.CHOOCC 17H 33∣CH 2OOCC 17H 33∣CH 2OOCC 17H 35 C.CHOOCC 17H 33∣CH 2OOCC 17H 33∣CH 2OOCC 17H 31 D.CHOOCC 15H 31∣CH 2OOCC 15H 29∣CH 2OOCC 15H 29—C ‖O —R 被 -P -O ‖O ∣OH 1230 ⎩⎨⎧加碘水溶液变蓝色加C 溶液单质沉淀 加A 溶液△ H -C -H |H ∣H⎩⎨⎧银氨溶液微热生成银镜碘水无现象 ONO 2ONO 2OH⎩⎪⎨⎪⎧→D→C(密度最小的单质)→EC 6H 5— HO —CH —NH —C ‖O —C 6H 5CH -COOH ∣C 6H 5— HO —CH —NH 2CH -COOH ∣H 2N —CH ∣R 1—C ‖O —N ∣H —CH ∣R 2—C ‖O —N ∣H —CH ∣R 3—C ‖O —N ∣H —CH ∣R 4—C ‖O—OH甘氨酸(C 2H 5NO 2)CH 2—COOH NH 2∣ 丙氨酸(C 3H 7NO 2)CH 3—CH —COOH∣NH 2,—C ‖O —N ∣H —谷氨酸(C 5H 9NO 4)HOOC —CH 2—CH 2—CH —COOH∣NH 2 ⎩⎪⎨⎪⎧2x +3y +9z +5m ═555x +7y +11z +9m ═882×(x +y +z +2m )═28 x +y +z +m ═10 解得⎩⎪⎨⎪⎧x ═1y ═2z ═3m ═4(C 6H 7O 2)—ONO 2ONO 2OHn—NH -↓A CH ∣R -↓B C ‖O -↓C NH -CH ∣R'—C -‖→DOR -CH —C ‖O —OH ∣NH 2+HNO 2R -CH —C ‖O —OH ∣OH+N 2↑+H 2(C 6H 10O 2N 2)C 适当条件CH 3-CH -COOH ∣NH 2↓Na ↓HClA BHNO 2D 浓硫酸(C 6H 8O 4)EHS -CH 2—CH —COOH ∣NH 2 HS -CH 2—CH —C ‖O —O -S -CH 2—CH —COOH ∣NH 2∣NH 2 HS -CH 2—CH —COONH 4∣NH 2A.H -C -∣H ∣OH C -∣H ∣OH C -∣H ∣OH C -∣H ∣OH C —C ‖O —H ∣H ∣OHB.H -C -∣H ∣NH 2C -∣H ∣NH 2C -∣H ∣NH 2C -∣H ∣NH 2C —C ‖O —H ∣H ∣NH 2C.H -C -∣H ∣NH 2C -∣H ∣NH 2C -∣H ∣NH 2C -∣H ∣NH 2C —C —‖NH H ∣H ∣NH 2D.H -C -∣H ∣OH C -∣H ∣OH C -∣H ∣OH C -∣H ∣OH C —C —‖NH H ∣H ∣OHCH 2—COOH ∣NH 2、CH 3—CH —COOH ∣NH 2、CH 3—CH 2-CH —COOH ∣NH 2A. CH 2—COOH ∣NH 2B.CH 3—CH —COOH ∣NH 2╲C ‖O ╱ ╲C ‖O ╱ CH 2-CH 2∣ C ——∣H N ∣ CH 2CH 2∣(C 6H 7O 2)—ONO 2OHOH n (C 6H 7O 2)—ONO ONO 2ONOnC.D.HOOC —CH 2—CH 2—CH —COOH ∣NH 2B. C. D. (C 6H 7O 2)—ONO 2ONO 2OHCH 2-∣OH CH -∣OH CH -∣OH CH -∣OH CH -∣OHCHO 甲CH 2-∣OH CH —CH -∣OH CH -∣OH CH -∣OH CH ∣OH乙H 2O ⎩⎪⎨⎪⎧CO 2叶绿素A 酶B O 2催化剂C O2DBH +E Na 2O 2⎩⎨⎧→G 过量CO 2白色沉淀H→F S 点燃I[— [—CH —∣CH 3CH ]—n ∣COOH②CHOOCC 15H 31∣CH 2OOCC 15H 31∣CH 2OOCC 15H 31+HO -P -OH ‖O ∣OH CHOOCC 15H 31∣CH 2O -P -OH‖O ∣OH∣CH 2OOCC 15H 31+C 15H 31COOH ③CHOOCC 15H 31∣CH 2O -P -OH‖O∣OH∣CH 2OOCC 15H 31+2NaOH CHOOCC 15H 31∣CH 2O -P -ONa‖O ∣ONa∣CH 2OOCC 15H 31+2H 2O (说明:-P -O ‖O ∣OH H 也可代替CHOOCC 15H 31∣CH 2OOCC 15H 31∣CH 2OOCC 15H 31中间的—C ‖O —C 15H 31基团。
![化学称号及符号[大全]](https://img.taocdn.com/s1/m/37618e07a31614791711cc7931b765ce05087a25.png)
化学名称及符号水银汞 Hg白金铂 Pt硫磺硫 S金刚石、石墨、木炭碳 C白磷、红磷、黄磷磷 P盐酸、盐镪水氢氯酸 HCl硝镪水硝酸 HNO3硫镪水硫酸 H2SO4王水浓硝酸、浓盐酸(1:3) HNO3,HCl双氧水过氧化氢 H2O2铅丹、红丹、红铅四氧化三铅 Pb3O4砒霜、信石、白砒、砷华三氧化二砷 As2O3升汞、高汞氯化汞 HgCl2朱砂、辰砂、丹砂、银朱硫化汞 HgS烧碱、火碱、苛性钠氢氧化钠 NaOH苛性钾氢氧化钾 KOH消石灰、熟石灰氢氧化钙 Ca(OH)2碱石灰、钠碱石灰氢氧化钠、氧化钙混合 NaOH,CaO碳铵碳酸氢铵 NH4HCO3盐脑、电气药粉氯化铵 NH4Cl硫铵硫酸铵 (NH4)2SO4碳酸气、干冰二氧化碳 CO2笑气氧化二氮 N2O硅石、石英、水晶、玛瑙砂子二氧化硅 SiO2矾土、刚玉氧化铝 Al2O3生石灰、煅烧石灰氧化钙 CaO锌白、锌氧粉氧化锌 ZnO苫土、烧苫土氧化镁 MgO苏打、纯碱碳酸铵 Na2SO4小苏打、重碱碳酸氢钠 NaHCO3大苏打、海波硫代硫酸钠 Na2S2O3.5H2O褐铁矿 2Fe2O3.3H2O芒硝、皮硝、马牙硝结晶硫酸钠 Na2SO4.10H2O泻盐、苦盐硫酸镁 MgSO4.7H2O口碱结晶碳酸钠 NaCO3.10H2O明矾硫酸铝钾 KAl(SO4)2.12H2O皓矾硫酸锌 ZnSO4.7H2O胆矾硫酸铜 CuSO4.5H2O红矾重铬酸钾 K2Cr2O7无水芒硝、元明粉硫酸钠 Na2SO4水玻璃、泡花碱硅酸钠 NaSiO3硫化碱、臭碱硫化钠 Na2S钾碱、草碱、草木灰碳酸钾 K2CO3硝石、火硝、土硝硝酸钾 KNO3灰锰氧、PP粉高锰酸钾 KMnO4冰晶石氟铝酸钠 Na3AlF6大理石、方解石、石灰石白垩碳酸钙 CaCO3萤石、氟石氟化钙 CaF2钙硝石、挪威硝石硝酸钙 Ca(NO3)2电石碳化钙 CaC2铜绿、孔雀石碱式碳酸铜 CU2(OH)2CO3重晶石、钡白硫酸钡 BaSO4钠硝石、智利硝石硝酸钠 NaNO3生石膏、石膏硫酸钙 CaSO4.2H2O熟石膏、烧石膏硫酸钙 2CaSO4.H2O普钙、过磷酸钙磷酸二氢钙、硫酸钙 Ca(H2PO4)2,CaSO4重钙磷酸二氢钙 Ca(H2PO4)2漂白粉次氯酸钙 Ca(ClO)2氯仿、绿仿三氯甲烷 CHCl3木精甲醇 CH3OH甘油丙三醇 C2H5(OH)3石炭酸苯酚 C6H5OH蚁酸甲酸 HCOOH草酸乙二酸 HOOC-COOH福尔马林甲醛溶液(30%~40%) HCHO尿素碳酰胺 CO(NH2)安息香酸苯甲酸 C6H5COOH赤铜矿氧化亚铜 Cu2O软锰矿二氧化锰 MnO2菱铁矿碳酸亚铁 FeCO3辉铜矿硫化亚铜 Cu2S愚人金硫化亚铁 FeS2铁丹、铁红、赭石、赤铁矿三氧化二铁 Fe2O3磁铁矿、铁黑四氧化三铁 Fe3O4绿矾七水合硫酸亚铁 FeSO4.7H2O保险粉连二亚硫酸钠 Na2S2O4醋酸乙酸 CH3COOH常见物质颜色汇总1.红色 Fe(SCN)]2+ (血红色); Cu2O(砖红色); Fe2O3(红棕色); 红磷(红棕色); 液溴(深红棕色); Fe(OH)3 (红褐色); I2的CCl4溶液 (紫红色); MnO4-(紫红色); Cu(紫红色); 在空气中久置的苯酚(粉红色).2.橙色: 溴水; K2Cr2O7溶液.3.黄色: AgI(黄色); AgBr(浅黄色); K2CrO4(黄色); Na2O2(淡黄色); S(黄色); FeS2(黄色); 久置浓HNO3(溶有NO2); 工业浓盐酸(含Fe3+); Fe3+水溶液(黄色); 久置的KI溶液(被氧化成I2)4.绿色: Cu2(OH)2CO3; Fe2+的水溶液; FeSO4.7H2O; Cl2(黄绿色);F2(淡黄绿色); Cr2O35.蓝色: Cu(OH)2; CuSO4.5H2O; Cu2+的水溶液; I2与淀粉的混合物.6.紫色: KMnO4(紫黑色); I2(紫黑色); 石蕊(pH=8--10); Fe3+与苯酚的混合物.7.黑色: FeO, Fe3O4, FeS, CuS, Cu2S, Ag2S, PbS, CuO, MnO2, C粉.8.白色: Fe(OH)2, AgOH, 无水CuSO4, Na2O, Na2CO3, NaHCO3, AgCl, BaSO4, CaCO3, CaSO3 ,Mg(OH)2, Al(OH)3, 三溴苯酚, MgO, MgCO3, 绝大部分金属等.说明:①元素基本上按周期表的族序数排列;②物质基本上按单质、氢化物、氧化物及其水化物、盐、有机物的顺序排列;③许多物质晶状为无色,粉末状为白色,晶型不同可能有不同颜色;④硫化物和过渡元素化合物颜色较丰富。

请浏览后下载,资料供参考,期待您的好评与关注!化学文档中常见符号集锦说明:将符号复制、粘贴到需要得文档就可。
一、数字顺序:①②③④⑤⑥⑦⑧⑨⑩⑪⑫⑬⑭⑮⑯⑰⑱⑲⑳二、罗马数字:I II III IV V VI VII VIII IX IX三、物理量:焓 ∆H 平均值 -M平均摩尔质量 -r M 平均相对分子质量 -rA 摩尔质量 M ()相对分子质量 M r 相对原子质量 A r 速率v 计量系数ν 密度 ρ 转化率 α体积分数 ϕ 物质的量分数 x 质量分数 w ()四、常见符号 NH 3·H 2O黑点 ● " ´ ° 加热 △ ℃ ≥ ≤ > < 比号 : ÷ × Ω ⋅η ü ℃ 单键 — 双键= 三键 ≡ ~五、希腊字母φ σ ρ π v μ λ ε ∆ δ γ β α六、上下标七、转移电子 4HCl +MnO 2 = MnCl 2+Cl 2↑+2H 2O 2e -MnO 2+4HCl = MnCl 2+Cl 2↑+2H 2O 2e -22↑+2H 2O 得2e -,升2价,被还原八、反应符号: △ 电解 △ 2 2光 △ 点燃 高温 放电 电解 Cu催化剂 催化剂△ 浓硫酸 浓硫酸△浓硫酸140 ℃浓硫酸170 ℃△乙醇一定条件请浏览后下载,资料供参考,期待您的好评与关注!光△高温催化剂高温、高压充电放电+OH -九、其它反应符号常温熔融℃~252电解36微热微热或不加热浓硫酸NaOH平衡时常温灼烧 沸水 熔融 高温煅烧 灼热的Cu水浴加热微生物光合作用水化 酸化 稀盐酸 盐酸酸化 硝酸酸化 浓硝酸 澄清石灰水石灰乳稀氨水 NaOH 溶液 Br 2的CCl 4溶液 AgNO 3溶液 Na 2SO 3溶液 氯水Fe 、水 稀H 2SO 4△△NaOH△Cu(OH)2OH - H +HClNaOHO 2Cl 2I 22 Cl -Br -I -S -Ⅰ Ⅱ常温沸水浓硫酸催化剂△V 2O 5催化剂T 12。

化学常用符号与及图标域的应用一、化学式氢气式H 2 水式 H 2O 氯化氢式 HCl 硝酸式 HNO 3 次氯酸式 HClO 硫亚酸式 H 2SO 3 硫酸式 H 2SO 4磷酸式 H 3PO 4 碳酸式 H 2CO 3 硫化氢式 H 2S 磷化氢式 PH 3 氨式 NH 3 甲烷式 CH 4 硅烷式 SiH 4水双氧式 H 2O 2 偏硅酸式 硅酸式 H 2SiO 3 硅原酸式 H 4SiO 4 硅酸式 氯气式 Cl 2 溴单式Br 2 碘单式 I 2氧化钠式 Na 2O 氧过化钠式 Na 2O 2氧化镁式 MgO 氧化铝式 Al 2O 3氧化铁式 Fe 2O 3氧亚铁式 FeO四氧化三铁式 Fe 3O 4氧化钙式 CaO 二氧化硫式 SO 2三氧化硫式 SO 3四氧化二氮式N 2O 4二氧化氮式 NO 2一氧化氮式NO 氧化铜式 CuO 氧化银式 Ag 2O 二氧化碳式 CO 2一氧化碳式 CO 氢离子式 H + 钠离子式 Na +钾离子式 K + 银离子式 Ag + 铵离子式 NH +4二氨银式 [Ag(NH 3)2]+钙离子式 Ca 2+镁离子式 Mg 2+铜离子式 Cu 2+钡离子式 Ba 2+铁亚离子式 Fe 2+ 锌离子式 Zn 2+铁离子式Fe 3+ 铝离子式 Al 3+氟离子式 F - 氯离子式 Cl - 溴离子式 Br - 碘离子式 I - 硝酸根式NO -3 硫氢根式HS - 碳酸氢根式 HCO -3 硫亚氢根式 HSO -3 硫酸氢根式 HSO -4 乙酸根式 CH 3COO -偏铝酸根式 AlO -2 次氯酸根式 ClO -3 碘酸根式 IO -3 氯次酸根式 ClO - 氢氧根式OH - 硫亚酸根式 SO 2-3 碳酸根式 CO 2-3 硫酸根式SO 2-4 硅酸根式 SiO 2-3磷酸根式PO 3-4 PO 2-3 硫离子式 S 2- 硅原酸根式 SiO 3-4氧氢化钠式 氢氧钠式 NaOH 氯钠式 NaCl 溴钠式 NaBr 碘钠式 NaI 硝酸钠式NaNO 3乙酸钠式CH 3COONa 硫氢钠式 NaHS 亚硫钠式NaHSO 3 碳酸氢钠式 NaHCO 3 偏铝酸钠式 NaAlO 2次氯酸钠式 NaClO 氯酸钠式 NaClO 3 硫酸氢钠式 NaHSO 4 碘酸钠式 NaIO 3 硫酸钠式 Na 2SO 4硫亚酸钠式Na 2SO 3 硅酸钠式 Na 2SiO 3 碳酸钠式 Na 2CO 3 硫化钠式 Na 2S 硅原酸钠式Na 3SiO 4 磷酸钠式Na 3PO 4氧氢化钾式 氢氧钾式 KOH 氯化钾式 KCl 溴化钾式 KBr 碘化钾式 KI 碘酸钾式KNO 3 乙酸钾式CH 3COOK 硫氢钾式KHS 亚硫钾式 KHSO 3 碳酸氢钾式 KHCO 3 偏铝酸钾式 KAlO 2 次氯酸钾式 KClO 氯酸钾式KClO 3 硫酸氢钾式 KHSO 4硫酸钾式K 2SO 4硫亚酸钾式 K 2SO 3 硅酸钾式 K 2SiO 3 碳酸钾式 K 2CO 3 硫化钾式K 2S 硅原酸钾式 K 3SiO 4 磷酸钾式 K 3PO 4氯化银式 AgCl 氯化银沉淀式 AgCl ↓ 溴化银式 AgBr 碘化银式 AgI 硝酸氨银 Ag(NH 3)2(NO 3)2 氯化铵式 NH 4Cl 溴化铵式 NH 4Br 碘化铵式NH 4I 一水合氨式 NH 3·H 2O 硝酸铵式NH 4NO 3磷酸铵式 (NH 4)3PO 4氧氢化钙式 Ca(OH)2 氯化钙式 CaCl 2 CaBr 2 碘化钙式 CaI 2碳酸钙式 CaCO 3 Ca(NO 3)2 CaSO 3CaSO 4 CaSiO 3 Ca 3(AlO 3)2 Ca(HCO 3)2 Ca(HSO 3)2 Ca(HSO 4)2 Ca(ClO)2 CaSO 4 Ca 3(PO 4)2 CaHPO 4 Ca(H 2PO 4)2Mg(OH)2 MgCl 2MgBr 2MgI 2MgCO 3Mg(NO 3)2MgSO 3MgSiO 3Mg(HCO 3)2Mg(HSO 3)2Mg(HSO 4)2Mg 3(PO 4)2MgHPO 4Mg(H 2PO 4)2MgSO 4Mg 3N 2Cu(OH)2CuCl 2CuBr 2CuI 2CuCO 3Cu(NO 3)2CuSO 3Cu 2(OH)2(CO 3)2CuSO 4Ba(OH)2BaCl 2BaBr 2BaI 2BaCO 3Ba(NO 3)2BaSO 3BaSO 4BaSiO 3Ba(HCO 3)2Ba(HSO 3)2Ba(HSO 4)2Ba 3(PO 4)2BaHPO 4Ba(H 2PO 4)2Fe(OH)2FeCl 2FeBr 2FeI 2Fe(NO 3)2FeSO 4Zn(OH)2ZnCl 2ZnBr 2ZnI 2ZnCO 3ZnSO 4Zn(NO 3)2Fe(OH)3FeCl 3FeBr 3Fe(NO 3)3硫酸铁式Fe 2(SO 4)3Al(OH)3AlCl 3AlBr 3Al(NO 3)3硫酸铝式Al 2(SO 4)3 188O二、符号单等 —— 加热等 △—— 一定条件等 一定条件═══ 浓硫酸等 浓硫酸═══ 催化剂等 催化剂═══浓加等 浓硫酸═══加热 高高催等 高温高压═══催化剂 二氧化锰等 二氧化锰═══ 二氧化锰加热等 二氧化锰═══△高温等高温═══ 催加等催化剂═══△ 闪电══单号─→ 加热号△─→ 浓硫酸号浓硫酸───→ 一定条件号一定条件───→ 催化剂号催化剂───→ 浓加号浓硫酸───→△制乙烯号浓硫酸───→170℃ 制乙醚号浓硫酸───→140℃ 二氧化锰号二氧化锰───→ 催化剂───→加压、加热燃烧═══ 燃烧══ 电解══ 一定条件逆 催化剂逆 浓硫酸逆 高高逆 可逆号浓硫酸△ 催化剂△ 高温高压△ 高温高压催化剂加热逆 催加逆催化剂△ 浓加逆浓硫酸△ 高高加逆高温高压△ 期望产物的总质量 ───────生成物的总质量高高催逆 高温高压催化剂 H 2OH 2OH 2OH 2O 高温══ 高温─→ 点燃─→光照─→ 单逆号 ←─前聚合号——[ 后聚合号——] n 双键号 C —C 叁键号 C ——C 侧二甲苯─CH 3 ─CH 3三甲苯 H 3C ─ ─CH 3| CH 3 三硝基甲苯 ∣CH 3O 2N ─ ─NO 2 | NO 2右斜甲苯CH3╱ CH3╱ CH3╱ CH3╱ H3C ╲H3C ╲左斜甲苯H3C ╲竖二甲苯 OH ||CH3羰基式 —O ‖C — 醛基式 —O ‖C —H 羟基式 —OH 羧基式 —O ‖C —OH三、电子式镁电子式 ·Mg · 铝电子式 ··Al · 碳电子式 ··C ·· 氮电子式 · ·· N ·· 氧电子式 · ·· O ·· · 氯右电子式 :·· Cl ·· · 氯左电子式 ··· Cl ·· :八电子结构 :··Cl ·· : 氨电子式 H ·· H :N ·· :H :·· Cl ·· :·· Cl ·· : H :·· Cl ··: 氢左电子式 ·H 氢右电子式 H ·C12 12C C60 12C C 60 碳六十式 C612 126C 碳十二式 沉淀淀↓ 气体体↑二氧化碳电子式 :·· O ·· ::C::·· O ·· : 氧化钠电子式 Na +[: ·· O ·· :]2-Na + 过化钠电子式Na +[: ·· O ·· : ·· O ··:]2-Na +氮气电子式 :N ······N : :·· O ·· ::C::·· O ·· :Na +[: ·· O ··:]2-Na + Na +[: ·· O ·· : ·· O ·· :]2-Na + Na +[: ·· O ·· :H]-Na +[:·· Cl ··:]-H : ·· O ·· :H :·· Cl ·· ::·· Cl ·· :C :·· Cl ··::··Cl ·· : H 2OH 2OH 2OH 2OH 2OH 2OH 2OH 2OH 2O 氧氢化钠电式 Na +[: ·· O ·· : H]- 氯化钠电子式 Na +[:·· Cl ··:]- 水电H ∶‥O ‥∶ H H ∶‥O ‥∶ H :·· Cl ·· ::·· Cl ·· :C :·· Cl ··::··Cl ·· : 四氯化碳电式:·· Cl ·· ::·· Cl ·· :C :·· Cl ··::·· Cl ·· : 左电子转移号 ·+ · 右电子转移号 ·+ · 氨电式 H ..H:N ..:H 铵根电式H ·· [H :N ·· :H]+H [:·· Cl ·· :]- H | [H -N | -H]+H F ╲F ╱C -F·HH · Na · K · ·Mg ··Ca ···Al ···C ····Si ·· ‥·O · ‥ ··· S ·· · ··N ..· ··· Cl ··: ·· :Cl ···Na · + ··· Cl ·· :─→ Na +[:·· Cl ·· :]- 氯钠生式·· Br ·· ·· I ·· ·· O ·· Na · + ··· Br ·· : ─→ Na +[:·· Br ·· :]- Na · + ··· I ·· : ─→ Na +[:·· I ··:]- Na · + · ·· O ·· · + ·Na ─→ Na +[:·· O ··:]2-Na + Na · + · ·· S ·· · + ·Na ─→ Na +[: ·· S ··:]2-Na +H ·+··· Cl ·· : ─→ H :·· Cl ··:H · +‥·O · ‥+·H ─→ H :··O ··: H:·· Cl ·· · + ·Mg · + ··· Cl ·· :─→ [:·· Cl ·· :]-Mg 2+ [:·· Cl ·· :]-H 2OH 2OH 2O·+ · · + · K · + ··· Cl ·· : ─→ K +[:·· Cl ·· :]- 氯钠生式K · + ··· Br ·· : ─→ K +[:··Br ·· :]-K · + ··· I ·· :─→ K +[:··I ··:]-K · + ‥·O · ‥ +·K ─→ K +[:·· O ·· :]2-K +K · + · ·· S ·· · +·K ─→ K +[: ·· S ·· :]2-K + H · +··· Cl ·· : ─→ H :··Cl ·· :H · +··· Br ·· : ─→ H :··Br ··:CH · +··· I ·· : ─→ H :··I ··:H · +‥·O · ‥+·H ─→ H :·· O ··: H:·· Cl ·· ·+·Mg ·+··· Cl ·· :─→ [:·· Cl ·· :]-Mg 2+ [:··Cl ·· :]-[:·· Cl ·· :]-Mg 2+ [:·· Cl ·· :]- :·· I ·· ·+·Mg ·+··· I ·· :─→ [:·· I ·· :]-Mg 2+ [:··I ·· :]- :·· Br ·· ·+·Mg ·+··· Br ·· :─→ [:·· Br ·· :]-Mg 2+ [:··Br ·· :]- :·· Cl ·· ·+·Ca ·+··· Cl ·· :─→ [:·· Cl ·· :]-Ca 2+ [:··Cl ·· :]- :·· I ·· ·+·Ca ·+··· I ·· :─→ [:·· I ·· :]-Ca 2+ [:··I ·· :]- :·· Br ·· ·+·Ca ·+··· Br ·· :─→ [:·· Br ·· :]-Ca 2+ [:··Br ·· :]-氯气电式 :·· Cl ·· :·· Cl ·· : :·· Br ·· :·· Br ·· :溴单电式 :·· Br ·· :··Br ·· : 碘单电式 :·· I ·· :·· I ··: 氮气电式 :N ······N: 氢气电式 H:H Cl 2氯化氢电式 H :·· Cl ·· : H ..H:N ..:H H .. [H :N ..:H]+H 甲烷电式 H ..H :C ..:H H H ..H :Si ..:H HH ·· H :N ·· :H H ·· [H :N ·· :H]+HH ·· H :N ·· :H H ·· [H :N ·· :H]+HH | [H -O -H]+电子转移式 2e —∣─────────────↓ S + O 2 ═ SO 2电子转移式2e —∣─────────────↓ S + O 2 ═ SO 2一层结构○+1 )1 ) 二层结构○+1 )2 ))8 ) ○+1 )1 ) ○+1 )2 ))8 ) —CH —∣NH 2 CH 2-∣OH ∣CH 2-OH 上CH 2-∣OH∣CH 2-OH 三、 有机域上结构 CH 3—CH —COOH ∣NH 2 —CH —∣NH 2下结构 CH 2-∣OH CH 2-∣OH CH 2-∣OH CH 2-∣OH上下构结 CH -∣OH ∣NH 2 CH -∣OH ∣NH 2CH -∣OH ∣NH 2CH -∣OH ∣NH 2CH -∣OH ∣NH 2CH -∣OH∣NH 2中结构 ∣CH 2-OH ∣CH 2-OH ∣CH 2-OH ∣CH 2-OH署名结构 (C 6H 10O 5)n 纤维素 (C 6H 10O 5)n 淀粉 (C 6H 12O 6)n 葡萄糖 (C 6H 12O 6)n 果糖 (C 12H 22O 11)n 麦芽糖 (C 12H 22O 11)n蔗糖(C 6H 10O 5)n 纤维素分子式结构 HNO 3 C 2H 5O —NO 2硝酸乙酯C 2H 5O —NO 2硝酸乙酯C 2H 5O —NO 2硝酸乙酯C 2H 5O —NO 2硝酸乙酯C 2H 5O —NO 2硝酸乙酯分子结构CH —ONO 2∣CH 2—ONO 2∣CH 2—ONO 2三层结构 CH —ONO 2∣CH 2—ONO 2∣CH 2—ONO 2反应示意图结构 H 2O ⎩⎪⎨⎪⎧CO 2叶绿素A 酶B O 2催化剂C O 2D B H +E Na 2O 2⎩⎪⎨⎪⎧→G 过量CO 2白色沉淀H →F S 点燃I H 2SO 4△水解液NaOH 溶液中和液⎩⎪⎨⎪⎧银氨溶液微热生成银镜碘水无现象C 6H 5— HO —CH —NH —C ‖O—C 6H 5CH -COOH ∣+H 2O 无机酸C 6H 5— HO —CH —NH 2CH -COOH ∣羟基酸羟基酯结构 CH 3CH ╱╲COO ╲OOC╱CHCH 3 CH 3CH ╱╲COO ╲OOC ╱CHCH 3 CH 3CH ╱╲COO ╲OOC╱CHCH 3双键结构 H 3C ╲H 3C ╱C =C ╱CH 3╲CH 3 H 3C ╲H 3C ╱C = C ╱╲ C ╱╲ CH 3CH 3 C ╱CH 3╲CH 3横上苯 - - 横下苯- - 竖右苯 竖左苯对二甲苯 CH 3- -CH 3 CH 3- -CH 3竖苯酚 -OH 横苯酚 -OH 竖苯酚 竖方程组结构 竖甲苯竖苯酚 OH | 竖苯甲酸 COOH | 竖甲苯 CH 3| 上甲基 CH3| 下甲基 | CH3 右斜甲苯 CH3╱ CH3╱ CH3╱ CH3╱ ╱H3C H3C╲ H3C ╲ 竖对二苯基OH ||CH3横对二苯基 ——CH 3CH 3平二苯基H 3C ─ ─CH 3 -CH 3-CH 3侧二苯基 -CH 3-CH 3 三苯基 H 3C ─ ─CH 3| CH3 三硝基甲苯 CH3| O 2N ─ ─NO 2 | NO2白藜芦醇 HO - -CH =CH - ╱CH 3╲CH 3横右三甲苯CH - ╱CH 3╲CH 3横左三甲苯 H3C ╲ ╱H3C-CH 3 CHH3C ╲╱H3C竖三甲苯 CH3| H 3C ─ ─CH 3 三溴苯酚 Br ─ ─Br| Br双键号 —— 叁键号——合成结构(C 6H 10O 2N 2)C 适当条件CH 3-CH -COOH ∣NH 2↓Na ↓HCl A B HH HNO 2D 浓硫酸(C 6H 8O 4)E四、方程组结构 ytxs⎩⎨⎧x ═1y ═2z ═3m ═4 ⎩⎨⎧2x +3y +9z +5m ═555x +7y +11z +9m ═882×(x +y +z +2m )═28 x +y +z +m ═10⎩⎨⎧2x +3y +9z +5m ═55……………………①2×(x +y +z +2m )═28……………………② ⎩⎨⎧x ═ 1y ═ 2⎩⎪⎨⎪⎧银氨溶液微热生成银镜碘水无现象⎩⎪⎨⎪⎧银氨溶液微热生成银镜碘水无现象 银氨溶液微热生成银镜碘水无现象⎩⎪⎨⎪⎧银氨溶液微热生成银镜碘水无现象 同醛基式 -O ║C —H双尖前域⎩⎨⎧x +y ═x +y ═双尖后域⎭⎬⎫x +y ═x +y ═3、⎩⎪⎨⎪⎧x +y ═x +y ═x +y ═4、⎩⎪⎨⎪⎧x +y ═x +y ═x +y ═x +y ═x +y ═双平前域⎣⎢⎡x +y ═x +y ═双平后域⎦⎥⎤x +y ═x +y ═前聚合号——[ 后聚合号 ——] n 聚合号 ——[——] n左合右号 ――――――⎦⎥⎤――― 左分右号 ――――⎣⎢⎡-→-→HO — —∣OH CH 2CH -∣NH 2O -O ║C —HHO - -CH =CH - ╱CH 3╲CH 3白黎芦醇HO - CH =CH - ╱CH 3╲CH 3环氧乙烷O╱ ╲H 2C ――CH 2有机结构域应用 [—]—n C ‖O —NHCH 3CH ╱╲COO ╲OOC╱CHCH 3CHOOCR'∣CH 2OOCR ∣CH 2OOCR'' CHOOCR ∣CH 2OOCR ∣CH 2OOCR CHOOCC 17H 31∣CH 2OOCC 17H 31∣CH 2OOCC 17H 31 催化剂加热、加压CHOOCC 17H 35∣CH 2OOCC 17H 35∣CH 2OOCC 17H 35HO —NO 2硝酸浓硫酸C 2H 5O —NO 2硝酸乙酯227×15.86%12 227×(100%-15.86%-2.20%-18.50%)16CH —ONO 2∣CH 2—ONO 2∣CH 2—ONO 2CH —OH ∣CH 2—OH ∣CH 2—OH —C — ∣CH 3 ∣ CH 3中间结构CH —O —C ‖O —R 2∣CH 2—O —C ‖O —R 1∣CH 2—O —C ‖O —R 3H 2SO 4 CH —OH ∣CH 2—OH ∣CH 2—OHCH —OH ∣CH 2—OOCCH 3∣CH 2—OH 和CH —OOCCH 3∣CH 2—OH ∣CH 2—OH10 g2 0003g·mol—1∶12 g1002 g·mol—1═①CHOOCC15H31∣CH2OOCC15H31∣CH2OOCC15H 31②CH2∣CH2OOCC17H35∣CH2OOCC17H35③CH—ONO2∣CH2—ONO2∣CH2—ONO2Cu(OH)2KMnO4 I2 mol·L-1 C17H35CHOOCC17H35∣CH2OOCC17H31∣CH2OOCC17H35B.CHOOCC17H33∣CH2OOCC17H33∣CH2OOCC17H35C.CHOOCC17H33∣CH2OOCC17H33∣CH2OOCC17H31D.CHOOCC15H31∣CH2OOCC15H29∣CH2OOCC15H29—C‖O—R被-P-O‖O∣OH1230⎩⎨⎧加碘水溶液变蓝色加C溶液单质沉淀加A溶液△H-C-H|H∣H ⎩⎪⎨⎪⎧银氨溶液微热生成银镜碘水无现象ONO2ONO2OH(C6H7O2)—ONO2ONO2OH n⎩⎨⎧→D→C(密度最小的单质)→EC 6H 5— HO —CH —NH —C ‖O —C 6H 5CH -COOH ∣C 6H 5— HO —CH —NH 2CH -COOH ∣H 2N —CH ∣R 1—C ‖O —N ∣H —CH ∣R 2—C ‖O —N ∣H —CH ∣R 3—C ‖O —N ∣H —CH ∣R 4—C ‖O —OH甘氨酸(C 2H 5NO 2)CH 2—COOH ∣NH 2 丙氨酸(C 3H 7NO 2)CH 3—CH —COOH ∣NH 2,—C ‖O —N ∣H —谷氨酸(C 5H 9NO 4)HOOC —CH 2—CH 2—CH —COOH∣NH 2 ⎩⎨⎧2x +3y +9z +5m ═555x +7y +11z +9m ═882×(x +y +z +2m )═28 x +y +z +m ═10 解得⎩⎨⎧x ═1y ═2z ═3m ═4—NH -↓A CH ∣R -↓B C ‖O -↓C NH -CH ∣R'—C -‖→D OR -CH —C ‖O —OH ∣NH 2+HNO 2R -CH —C ‖O —OH ∣OH+N 2↑+H 2(C 6H 10O 2N 2)C 适当条件CH 3-CH -COOH ∣NH 2↓Na ↓HCl A B HH HNO 2D 浓硫酸(C 6H 8O 4)EHS -CH 2—CH —COOH ∣NH 2HS -CH 2—CH —C ‖O —O -S -CH 2—CH —COOH ∣NH 2∣NH 2HS -CH 2—CH —COONH 4∣NH 2A.H -C -∣H ∣OH C -∣H ∣OH C -∣H ∣OH C -∣H ∣OH C —C ‖O —H ∣H ∣OHB.H -C -∣H ∣NH 2C -∣H ∣NH 2C -∣H ∣NH 2C -∣H ∣NH 2C —C ‖O —H ∣H ∣NH 2C.H -C -∣H ∣NH 2C -∣H ∣NH 2C -∣H ∣NH 2C -∣H ∣NH 2C —C —‖NH H ∣H ∣NH 2D.H -C -∣H ∣OH C -∣H ∣OH C -∣H ∣OH C -∣H ∣OH C —C —‖NH H ∣H ∣OHCH 2—COOH ∣NH 2、CH 3—CH —COOH ∣NH 2、CH 3—CH 2-CH —COOH ∣NH 2A. CH 2—COOH ∣NH 2B.CH 3—CH —COOH ∣NH 2C. D.HOOC —CH 2—CH 2—CH —COOH ∣NH 2B.╲C ‖O ╱ ╲C ‖O╱CH 2-CH 2∣ C ——∣H N ∣ CH 2CH 2∣(C 6H 7O 2)—ONO 2OH OH n(C 6H 7O 2)—ONO ONO 2ONO nC. ——D. (C 6H 7O 2)—ONO 2ONO 2OHCH 2-∣OH CH -∣OH CH -∣OH CH -∣OH CH -∣OH CHO 甲CH 2-∣OH CH —CH -∣OH CH -∣OH CH -∣OH CH ∣OH乙H 2O ⎩⎪⎨⎪⎧CO 2叶绿素A 酶B O 2催化剂C O 2D B H +E Na 2O 2⎩⎪⎨⎪⎧→G 过量CO 2白色沉淀H →F S 点燃I[— [—CH —∣CH 3CH ]—n ∣COOH②CHOOCC 15H 31∣CH 2OOCC 15H 31∣CH 2OOCC 15H 31+HO -P -OH ‖O ∣OH CHOOCC 15H 31∣CH 2O -P -OH‖O ∣OH ∣CH 2OOCC 15H 31+C 15H 31COOH③CHOOCC 15H 31∣CH 2O -P -OH ‖O ∣OH ∣CH 2OOCC 15H 31+2NaOH CHOOCC 15H 31∣CH 2O -P -ONa‖O∣ONa ∣CH 2OOCC 15H 31+2H 2O (说明:-P -O ‖O ∣OH H 也可代替CHOOCC 15H 31∣CH 2OOCC 15H 31∣CH 2OOCC 15H 31中间的—C ‖O—C 15H 31基团。

高中化学符号汇总常见的化学符号:1、元素符号含义:①表示一种元素②表示该元素的一个原子注:对于由原子构成的物质元素符号有三层含义:如Cu:可表示铜由铜元素组成;一个铜原子;铜这种物质。
由原子构成的物质:金属如Fe(铁)、Cu(铜)、Zn(锌)、Ag(银)、Ba(钡)、Hg (汞)、Mn(锰)等。
稀有气体:He(氦)、Ne(氖)、Ar(氩)、Kr(氪)、Xe(氙)一些固态非金属:如石墨、金刚石、P(磷)、S(硫)、Si(硅)等2、元素符号周围数字的意义:如:2O:表示两个氧原子O2:表示氧气分子,表示1个氧分子由两个氧原子构成。
: 氧元素的化合价为-2价:两个氧分子3、必须背熟的元素符号1~20号元素及常见金属,分别如下:H He Li Be B C N OF Ne氢氦锂铍硼碳氮氧氟氖Na Mg Al Si P S Cl ArK Ca钠镁铝硅磷硫氯氩钾钙Fe Cu Zn Ag BaHg Mn铁铜锌银钡汞锰4、必须背熟的离子:阳离子:K+ (钾离子)、Ca2+(钙离子)、Na+ (钠离子)、Mg2+(镁离子)、Zn2+(锌离子)、Al3+(铝离子)、Fe3+(铁离子)、Fe2+(亚铁离子)、Ag+(银离子)、H+(氢离子)、NH(铵根离子)阴离子:Cl-(氯离子)、O2-(氧离子)、S2-(硫离子)、SO42-(硫酸根离子)、NO3-(硝酸根离子)、CO32-(碳酸根离子)、OH-(氢氧根离子)、PO43-(磷酸根离子)等。
对于常见的原子团,其化合价你应该记住,甚至式量,特别是以下六个原子团:(磷酸根离子)(实验现象:黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体,冶炼金属)3.水蒸气通过灼热碳层:H2O + C 高温H2+ CO4.焦炭还原氧化铁:3C + 2Fe2O3高温4Fe + 3CO2↑5.甲烷在空气中燃烧:CH4+ 2O2点燃CO2+ 2H2O6.酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2+ 3H2O7.一氧化碳还原氧化铁:3CO + Fe2O3高温2Fe + 3CO28.二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+ CO2==CaCO3↓+ H2O9.氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2== Na2CO3+ H2O10.石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3+ 2HCl === CaCl2+ H2O + CO2↑12.Fe2O3+ 3H2△2Fe + 3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性。

化学符号大全化学符号是化学元素的标识,它们是化学式和方程式的基础,也是化学理论和实验的基础。
化学符号的使用使得化学家们能够更加简洁和准确地表达化学概念和化学实验结果。
下面我们将介绍一些常见的化学符号,希望能够帮助大家更好地理解化学元素和化学反应。
1. 氢(Hydrogen)。
符号,H。
原子序数,1。
氢是最简单的元素,也是宇宙中含量最丰富的元素之一。
在化学反应中,氢气通常以H2的形式出现。
2. 氦(Helium)。
符号,He。
原子序数,2。
氦是一种稀有气体,常用于充气球和气球中。
它是地球上唯一一种不会在常温下凝固成固体的元素。
3. 钠(Sodium)。
符号,Na。
原子序数,11。
钠是一种常见的金属元素,它在自然界中以氯化钠的形式存在,即食盐。
钠在化学反应中通常以Na+的形式出现。
4. 氧(Oxygen)。
符号,O。
原子序数,8。
氧气是生物呼吸的必需气体,也是许多燃烧反应的必需气体。
在化学式中,氧通常以O2的形式出现。
5. 氮(Nitrogen)。
符号,N。
原子序数,7。
氮气是大气中的主要成分之一,也是许多化合物的组成部分。
在化学式中,氮通常以N2的形式出现。
6. 碳(Carbon)。
符号,C。
原子序数,6。
碳是生命的基础元素,它是有机化合物的主要组成部分。
在化学式中,碳通常以C的形式出现。
7. 铁(Iron)。
符号,Fe。
原子序数,26。
铁是一种常见的金属元素,它在地壳中含量丰富。
在化学反应中,铁通常以Fe2+或Fe3+的形式出现。
8. 铜(Copper)。
符号,Cu。
原子序数,29。
铜是一种重要的工业金属,它具有良好的导电性和导热性。
在化学反应中,铜通常以Cu+或Cu2+的形式出现。
9. 锌(Zinc)。
符号,Zn。
原子序数,30。
锌是一种重要的合金元素,它常用于镀锌和合金制备。
在化学反应中,锌通常以Zn2+的形式出现。
10. 氟(Fluorine)。
符号,F。
原子序数,9。
氟是一种非常活泼的卤素元素,它在自然界中以氟化物的形式存在。

化学符号含义汇总化学符号是化学中用于表示化学元素和化合物的简洁标识。
它们有助于化学家们理解化学方程式、式子和反应过程。
下面是一些常用的化学符号及其含义的汇总。
1.化学元素符号:化学元素符号是在元素周期表中每个元素的化学符号。
它由一个或两个字母组成,如H表示氢、C表示碳、Na表示钠等。
这些符号用于表示元素的属性和性质。
2.反应条件符号:-(s)表示固态,例如CaCO3(s)表示固态的碳酸钙。
-(l)表示液态,例如H2O(l)表示液态的水。
-(g)表示气态,例如CO2(g)表示气态的二氧化碳。
- (aq) 表示溶于水中的化合物,例如NaCl(aq)表示溶于水中的氯化钠。
3.物质状态符号:- ↓ 表示沉淀形成,例如AgNO3(aq) + NaCl(aq) → AgCl↓ + NaNO3(aq),其中AgCl↓表示白色沉淀物。
- ↑ 表示气体释放,例如2H2O2(aq) → 2H2O(l) + O2(g),其中O2↑表示氧气气体的释放。
-→或箭头表示反应方向,例如2H2(g)+O2(g)→2H2O(l),表示氢气和氧气生成水。
-⇌或双箭头表示平衡反应,例如N2(g)+3H2(g)⇌2NH3(g),表示氮气和氢气生成氨气的可逆反应。
4.离子符号:-+表示阳离子,例如Na+表示钠离子。
--表示阴离子,例如Cl-表示氯离子。
-2+表示双正离子,例如Cu2+表示铜离子的二价形式。
5.反应速率符号:-Δ表示温度,例如ΔH表示反应的热变化。
-→表示反应速率,例如A→B表示物质A转变为物质B的反应速率。
6.能量符号:-E表示能量,例如ΔE表示能量的变化。
-h表示普朗克常数,用于计算能量单位。
-γ表示光子,用于描述光的行为和相互作用过程。
7.离子化程度符号:- aq 表示水溶液中的离子,例如NaCl(aq)表示溶于水中的氯化钠。
8.其他符号:-℃表示温度,例如25℃表示摄氏温度25度。
- atm 表示压强,例如1 atm表示标准大气压。

化学常用符号与图标一、化学式氢气式H 2 水式 H 2O 氯化氢式 HCl 硝酸式 HNO 3 次氯酸式 HClO 硫亚酸式 H 2SO 3 硫酸式 H 2SO 4 磷酸式 H 3PO 4 碳酸式 H 2CO 3 硫化氢式 H 2S 磷化氢式 PH 3 氨式 NH 3 甲烷式 CH 4 硅烷式 SiH 4 水双氧式 H 2O 2 偏硅酸式 硅酸式 H 2SiO 3 硅原酸式 H 4SiO 4 氯气式 Cl 2 溴单式Br 2 碘单式 I 2 氧化钠式 Na 2O 氧过化钠式 Na 2O 2氧化镁式 MgO 氧化铝式 Al 2O 3氧化铁式 Fe 2O 3氧亚铁式 FeO 四氧化三铁式 Fe 3O 4氧化钙式 CaO 二氧化硫式 SO 2三氧化硫式 SO 3四氧化二氮式 N 2O 4二氧化氮式 NO 2一氧化氮式NO氧化铜式 CuO 氧化银式 Ag 2O 二氧化碳式 CO 2一氧化碳式 CO 氢离子式 H + 钠离子式 Na +钾离子式 K + 银离子式 Ag + 铵离子式 NH +4二氨银式 [Ag(NH 3)2]+钙离子式 Ca 2+镁离子式 Mg 2+铜离子式 Cu 2+钡离子式 Ba 2+铁亚离子式 Fe 2+ 锌离子式 Zn 2+ 铁离子式Fe 3+ 铝离子式 Al 3+ 氟离子式 F - 氯离子式 Cl - 溴离子式 Br - 碘离子式 I - 硝酸根式NO -3硫氢根式 HS - 碳酸氢根式 HCO -3 硫亚氢根式 HSO -3 硫酸氢根式 HSO -4 乙酸根式 CH 3COO - 偏铝酸根式 AlO -2 次氯酸根式 ClO -3 碘酸根式 IO -3 氯次酸根式 ClO - 氢氧根式 OH -硫亚酸根式 SO 2-3 碳酸根式 CO 2-3 硫酸根式SO 2-4 硅酸根式 SiO 2-3 磷酸根式PO 3-4 PO 2-3 硫离子式 S 2- 硅原酸根式 SiO 3-4 氧氢化钠式 氢氧钠式 NaOH 氯钠式 NaCl 溴钠式 NaBr 碘钠式 NaI 硝酸钠式 NaNO 3 乙酸钠式CH 3COONa 硫氢钠式 NaHS 亚硫钠式NaHSO 3 碳酸氢钠式 NaHCO 3 偏铝酸钠式 NaAlO 2次氯酸钠式 NaClO 氯酸钠式 NaClO 3 硫酸氢钠式 NaHSO 4 碘酸钠式 NaIO 3 硫酸钠式 Na 2SO 4 硫亚酸钠式Na 2SO 3 硅酸钠式 Na 2SiO 3 碳酸钠式 Na 2CO 3 硫化钠式 Na 2S 硅原酸钠式Na 3SiO 4磷酸钠式Na 3PO 4 氧氢化钾式 氢氧钾式 KOH 氯化钾式 KCl 溴化钾式 KBr 碘化钾式 KI 碘酸钾式KNO 3 乙酸钾式CH 3COOK 硫氢钾式KHS 亚硫钾式 KHSO 3 碳酸氢钾式 KHCO 3 偏铝酸钾式 KAlO 2 次氯酸钾式 KClO 氯酸钾式KClO 3 硫酸氢钾式 KHSO 4硫酸钾式K 2SO 4硫亚酸钾式 K 2SO 3 硅酸钾式 K 2SiO 3 碳酸钾式 K 2CO 3 硫化钾式K 2S 硅原酸钾式 K 3SiO 4 磷酸钾式 K 3PO 4 氯化银式 AgCl 氯化银沉淀式 AgCl ↓ 溴化银式 AgBr 碘化银式 AgI 硝酸氨银 Ag(NH 3)2(NO 3)2 氯化铵式 NH 4Cl溴化铵式 NH 4Br 碘化铵式NH 4I 一水合氨式 NH 3·H 2O 硝酸铵式NH 4NO 3磷酸铵式 (NH 4)3PO 4 氧氢化钙式 Ca(OH)2 氯化钙式 CaCl 2 CaBr 2 碘化钙式 CaI 2碳酸钙式 CaCO 3钙盐: CaSO 3CaSO 4 CaSiO 3 Ca 3(AlO 3)2 Ca(HCO 3)2 Ca(HSO 3)2 Ca(HSO 4)2 Ca(ClO)2 CaSO 4 Ca 3(PO 4)2 CaHPO 4 Ca(H 2PO 4)2镁盐: MgCl 2、MgI 2、Mg(NO 3)2、MgSiO 3、Mg(HSO 3)2、Mg 3(PO 4)2、Mg(H 2PO 4)2、Mg 3N 2 Cu(OH)2CuCl 2CuBr 2CuI 2CuCO 3Cu(NO 3)2CuSO 3Cu 2(OH)2(CO 3)2CuSO 4Ba(OH)2BaCl 2BaBr 2BaI 2BaCO 3Ba(NO 3)2BaSO 3BaSO 4BaSiO 3Ba(HCO 3)2Ba(HSO 3)2Ba(HSO 4)2Ba 3(PO 4)2BaHPO 4Ba(H 2PO 4)2Fe(OH)2FeCl 2FeBr 2FeI 2Fe(NO 3)2FeSO 4Zn(OH)2ZnCl 2ZnBr 2ZnI 2ZnCO 3ZnSO 4Zn(NO 3)2Fe(OH)3FeCl 3FeBr 3Fe(NO 3)3硫酸铁式Fe 2(SO 4)3Al(OH)3AlCl 3AlBr 3Al(NO 3)3硫酸铝式Al 2(SO 4)3 188O二、符号单等 —— 加热等 △—— 一定条件等 一定条件═══ 浓硫酸等 浓硫酸═══ 催化剂等 催化剂═══浓加等 浓硫酸═══加热 高高催等 高温高压═══催化剂 二氧化锰等 二氧化锰═══ 二氧化锰加热等 二氧化锰═══△高温等高温═══ 催加等催化剂═══△ 闪电══单号─→ 加热号△─→ 浓硫酸号浓硫酸───→ 一定条件号一定条件───→ 催化剂号催化剂───→ 浓加号浓硫酸───→△制乙烯号浓硫酸───→170℃ 制乙醚号浓硫酸───→140℃ 二氧化锰号二氧化锰───→ 催化剂───→加压、加热 燃烧═══燃烧══ 电解══ 一定条件逆催化剂逆浓硫酸逆高高逆可逆号浓硫酸△ 催化剂△ 高温高压△ 高温高压催化剂加热逆 催加逆催化剂△ 浓加逆浓硫酸△ 高高加逆高温高压△期望产物的总质量 ───────生成物的总质量高高催逆 高温高压催化剂 H 2OH 2OH 2OH 2O 高温══ 高温─→ 点燃─→ 光照─→ 单逆号 ←─前聚合号——[ 后聚合号——] n 双键号 C —C 叁键号 C ——C 侧二甲苯 ─CH 3─CH 3三甲苯 H 3C ─ CH 3| CH 3 三硝基甲苯 ∣CH 3O 2N ─ NO 2 | NO 2右斜甲苯 CH3╱ CH3╱ CH3╱ CH3╱ H3C╲H3C ╲左斜甲苯H3C ╲ 竖二甲苯 OH || CH3羰基式 —O ‖C — 醛基式 —O ‖C —H 羟基式 —OH 羧基式 —O ‖C —OH三、电子式镁电子式 ·Mg · 铝电子式 ··Al · 碳电子式 ··C ·· 氮电子式 · ·· N ·· 氧电子式 · ··O·· ·氯右电子式 :·· Cl ·· · 氯左电子式 ··· Cl ·· :八电子结构 :··Cl ··: 氨电子式H ·· H :N ··:H :·· Cl ·· :·· Cl ·· : H :·· Cl ·· : 氢左电子式 ·H 氢右电子式 H ·C12 12C C60 12C C 60 碳六十式 C612 126C 碳十二式 沉淀淀↓ 气体体↑二氧化碳电子式 :·· O ·· ::C::·· O ·· : 氧化钠电子式 Na +[: ·· O·· :]2-Na + 过化钠电子式Na +[: ·· O ·· : ·· O·· :]2-Na +氮气电子式 :N ······N : :·· O ·· ::C::·· O ·· :Na +[: ·· O ·· :]2-Na+ Na +[: ·· O ·· : ·· O ·· :]2-Na + Na +[: ·· O ·· :H]-Na +[:·· Cl ·· :]-H : ·· O·· :H :·· Cl ·· ::·· Cl ·· :C :·· Cl ··::··Cl ·· : H 2OH 2OH 2OH 2OH 2OH 2OH 2OH 2OH 2O 氧氢化钠电式 Na +[: ·· O ·· : H]- 氯化钠电子式 Na +[:·· Cl ·· :]- 水电H ∶‥O ‥∶ HH ∶‥O ‥∶ H:·· Cl ·· ::·· Cl ·· :C :·· Cl ··::··Cl ·· : 四氯化碳电式:·· Cl ·· ::·· Cl ·· :C :·· Cl ··::·· Cl ·· : 左电子转移号 ·+ · 右电子转移号 · + · 氨电式 H ..H:N ..:H 铵根电式H ·· [H :N ·· :H]+H [:·· Cl ·· :]- H | [H -N | -H]+HF ╲F ╱C -F·H H · Na · K · ·Mg ··Ca ···Al ···C ····Si ·· ‥·O · ‥ ···S ·· · ··N ..· ··· Cl ··:·· :Cl ···Na · + ··· Cl ·· :─→ Na +[:·· Cl ·· :]- 氯钠生式·· Br ·· ·· I ·· ·· O ··Na ·+ ··· Br ·· : ─→ Na +[:·· Br ·· :]- Na · + ··· I ·· : ─→ Na +[:·· I ··:]- Na · + · ·· O ·· · + ·Na ─→ Na +[:·· O ·· :]2-Na + Na · + · ·· S ·· · + ·Na ─→ Na +[: ·· S ·· :]2-Na +H ·+··· Cl ·· : ─→ H :··Cl ·· :H · +‥·O · ‥+·H ─→ H :·· O ··: H:·· Cl ·· · + ·Mg · + ··· Cl ·· :─→ [:·· Cl ·· :]-Mg 2+ [:·· Cl ·· :]-H 2OH 2OH 2O·+ · · + · K · + ··· Cl ·· : ─→ K +[:··Cl ·· :]- 氯钠生式K · + ··· Br ·· : ─→ K +[:··Br ·· :]-K · + ··· I ·· :─→ K +[:··I ··:]-K · + ‥·O · ‥ +·K ─→ K +[:·· O ·· :]2-K +K · + · ·· S ·· · +·K ─→ K +[: ·· S·· :]2-K + H · +··· Cl ·· : ─→ H :··Cl ·· :H · +··· Br ·· : ─→ H :··Br ··:CH · +··· I ·· : ─→ H :··I ··:H · +‥·O · ‥+·H ─→ H :·· O ··: H:·· Cl ·· ·+·Mg ·+··· Cl ·· :─→ [:·· Cl ·· :]-Mg 2+ [:·· Cl ·· :]- [:·· Cl ·· :]-Mg 2+ [:·· Cl ·· :]- :·· I ·· ·+·Mg ·+··· I ·· :─→ [:·· I ·· :]-Mg 2+ [:··I ·· :]- :·· Br ·· ·+·Mg ·+··· Br ·· :─→ [:·· Br ·· :]-Mg 2+ [:··Br ·· :]- :·· Cl ·· ·+·Ca ·+··· Cl ·· :─→ [:·· Cl ·· :]-Ca 2+ [:··Cl ·· :]- :·· I ·· ·+·Ca ·+··· I ·· :─→ [:·· I ·· :]-Ca 2+ [:··I ·· :]- :·· Br ·· ·+·Ca ·+··· Br ·· :─→ [:·· Br ·· :]-Ca 2+ [:··Br ·· :]-氯气电式 :·· Cl ·· :·· Cl ·· : :·· Br ·· :·· Br ·· :溴单电式 :·· Br ·· :··Br ··: 碘单电式 :·· I ·· :·· I ··: 氮气电式 :N ······N: 氢气电式 H:H Cl 2氯化氢电式 H :·· Cl ·· : H ..H:N ..:H H .. [H :N ..:H]+H 甲烷电式 H ..H :C ..:H H H ..H :Si ..:H HH ·· H :N ··:HH ·· [H :N ·· :H]+HH ·· H :N ··:H H ·· [H :N ·· :H]+HH | [H -O -H]+电子转移式 2e —∣─────────────↓S + O 2 ═ SO 2 电子转移式2e —∣─────────────↓ S + O 2 ═ SO 2一层结构○+1 )1 ) 二层结构○+1 )2 ))8 ) ○+1 )1 ) ○+1 )2 ))8 ) —CH —∣NH 2CH 2-∣OH ∣CH 2-OH 上CH 2-∣OH∣CH 2-OH 三、 有机域上结构 CH 3—CH —COOH ∣NH 2 —CH —∣NH 2下结构 CH 2-∣OH CH 2-∣OH CH 2-∣OH CH 2-∣OH上下构结 CH -∣OH ∣NH 2 CH -∣OH ∣NH 2CH -∣OH ∣NH 2CH -∣OH ∣NH 2CH -∣OH ∣NH 2CH -∣OH∣NH 2中结构 ∣CH 2-OH ∣CH 2-OH ∣CH 2-OH ∣CH 2-OH署名结构 (C 6H 10O 5)n 纤维素 (C 6H 10O 5)n 淀粉 (C 6H 12O 6)n 葡萄糖 (C 6H 12O 6)n 果糖 (C 12H 22O 11)n 麦芽糖 (C 12H 22O 11)n 蔗糖(C 6H 10O 5)n 纤维素分子式结构 HNO 3 C 2H 5O —NO 2硝酸乙酯C 2H 5O —NO 2硝酸乙酯C 2H 5O —NO 2硝酸乙酯C 2H 5O —NO 2硝酸乙酯C 2H 5O —NO 2硝酸乙酯分子结构 CH —ONO 2∣CH 2—ONO 2∣CH 2—ONO 2三层结构 CH —ONO 2∣CH 2—ONO 2∣CH 2—ONO 2反应示意图结构 H 2O ⎩⎪⎨⎪⎧CO 2叶绿素A 酶B O 2催化剂C O2D B H +ENa 2O 2⎩⎨⎧→G 过量CO 2白色沉淀H→FS 点燃IH 2SO 4△水解液NaOH 溶液中和液⎩⎨⎧银氨溶液微热生成银镜碘水无现象 C 6H 5— HO —CH —NH —C ‖O —C 6H 5CH -COOH ∣+H 2O 无机酸C 6H 5— HO —CH —NH 2CH -COOH ∣羟基酸羟基酯结构 CH 3CH╱╲COO╲OOC╱CHCH 3 CH 3CH ╱╲COO ╲OOC ╱CHCH 3 CH 3CH ╱╲COO ╲OOC ╱CHCH 3双键结构 H 3C ╲H 3C ╱C =C ╱CH 3╲CH 3 H 3C ╲H 3C ╱C = C ╱╲ C ╱╲ CH 3CH 3 C ╱CH 3╲CH 3横上苯 - - 横下苯- - 竖右苯竖左苯对二甲苯 CH 3- -CH 3 CH 3- -CH 3竖苯酚 -OH 横苯酚 -OH 竖苯酚 竖方程组结构 竖甲苯竖苯酚 OH | 竖苯甲酸 COOH | 竖甲苯 CH 3| 上甲基 CH3| 下甲基 | CH3 右斜甲苯CH3╱ CH3╱ CH3╱ CH3╱ ╱H3C H3C ╲ H3C ╲ 竖对二苯基 OH || CH3横对二苯基——CH 3CH 3平二苯基H 3C ─ CH 3-CH 3-CH 3侧二苯基 -CH 3-CH 3 三苯基 H 3C ─ ─CH 3| CH3 三硝基甲苯 CH3| O 2N ─ ─NO 2 | NO2白藜芦醇 HO -CH =CH - ╱CH 3╲CH 3横右三甲苯CH - ╱CH 3╲CH 3横左三甲苯 H3C ╲ ╱H3C-CH 3 CHH3C ╲╱H3C竖三甲苯 CH3| H 3C ─CH 3 三溴苯酚 Br ─ ─Br| Br双键号 —— 叁键号——合成结构(C 6H 10O 2N 2)C 适当条件CH 3-CH -COOH∣NH 2↓Na ↓HClA B HHHNO 2D 浓硫酸(C 6H 8O 4)E四、方程组结构 ytxs⎩⎪⎨⎪⎧x ═1y ═2z ═3m ═4 ⎩⎪⎨⎪⎧2x +3y +9z +5m ═555x +7y +11z +9m ═882×(x +y +z +2m )═28 x +y +z +m ═10 ⎩⎪⎨⎪⎧2x +3y +9z +5m ═55……………………①2×(x +y +z +2m )═28……………………② ⎩⎪⎨⎪⎧x ═ 1y ═ 2⎩⎨⎧银氨溶液微热生成银镜碘水无现象⎩⎨⎧银氨溶液微热生成银镜碘水无现象 银氨溶液微热生成银镜碘水无现象⎩⎨⎧银氨溶液微热生成银镜碘水无现象 同醛基式 -O ║C —H双尖前域⎩⎪⎨⎪⎧x +y ═x +y ═双尖后域⎭⎪⎬⎪⎫x +y ═x +y ═3、⎩⎪⎨⎪⎧x +y ═x +y ═x +y ═4、⎩⎪⎨⎪⎧x +y ═x +y ═x +y ═x +y ═x +y ═双平前域⎣⎢⎡x +y ═x +y ═双平后域⎦⎥⎤x +y ═x +y ═前聚合号——[ 后聚合号 ——] n 聚合号 ——[——] n左合右号 ――――――⎦⎥⎤――― 左分右号 ――――⎣⎢⎡-→-→HO — —∣OH CH 2CH -∣NH 2O -O ║C —HHO - -CH =CH - ╱CH 3╲CH 3 白黎芦醇 HO - CH =CH - ╱CH 3╲CH 3环氧乙烷O╱ ╲H 2C ――CH 2有机结构域应用 [—]—n C ‖O —NHCH 3CH ╱╲COO ╲OOC╱CHCH 3CHOOCR'∣CH 2OOCR ∣CH 2OOCR'' CHOOCR ∣CH 2OOCR ∣CH 2OOCR CHOOCC 17H 31∣CH 2OOCC 17H 31∣CH 2OOCC 17H 31 催化剂加热、加压CHOOCC 17H 35∣CH 2OOCC 17H 35∣CH 2OOCC 17H 35HO —NO 2硝酸浓硫酸C 2H 5O —NO 2硝酸乙酯227×15.86%12 227×(100%-15.86%-2.20%-18.50%)16CH —ONO 2∣CH 2—ONO 2∣CH 2—ONO 2CH —OH ∣CH 2—OH ∣CH 2—OH —C — ∣CH 3 ∣ CH 3中间结构CH —O —C ‖O—R 2∣CH 2—O —C ‖O —R 1∣CH 2—O —C ‖O —R 3H 2SO 4 CH —OH ∣CH 2—OH ∣CH 2—OHCH —OH ∣CH 2—OOCCH 3∣CH 2—OH 和CH —OOCCH 3∣CH 2—OH ∣CH 2—OH10 g 2 0003 g ·mol —1∶12 g1002 g ·mol —1═①CHOOCC 15H 31∣CH 2OOCC 15H 31∣CH 2OOCC 15H 31 ②CH 2∣CH 2OOCC 17H 35∣CH 2OOCC 17H 35 ③CH —ONO 2∣CH 2—ONO 2∣CH 2—ONO 2Cu(OH)2 KMnO 4 I 2 mol ·L -1 C 17H 35CHOOCC 17H 35∣CH 2OOCC 17H 31∣CH 2OOCC 17H 35 B.CHOOCC 17H 33∣CH 2OOCC 17H 33∣CH 2OOCC 17H 35C.CHOOCC 17H 33∣CH 2OOCC 17H 33∣CH 2OOCC 17H 31D.CHOOCC 15H 31∣CH 2OOCC 15H 29∣CH 2OOCC 15H 29 —C ‖O —R 被 -P -O ‖O ∣OH 1230 ⎩⎨⎧加碘水溶液变蓝色加C 溶液单质沉淀 加A 溶液△ H -C -H |H ∣H⎩⎨⎧银氨溶液微热生成银镜碘水无现象 ONO 2ONO 2OH⎩⎪⎨⎪⎧→D→C(密度最小的单质)→E(C 6H 7O 2)—ONO 2ONO 2OH nC 6H 5— HO —CH —NH —C ‖O —C 6H 5CH -COOH ∣C 6H 5— HO —CH —NH 2CH -COOH ∣H 2N —CH ∣R 1—C ‖O —N ∣H —CH ∣R 2—C ‖O —N ∣H —CH ∣R 3—C ‖O —N ∣H —CH ∣R 4—C ‖O —OH甘氨酸(C 2H 5NO 2)CH 2—COOH NH 2∣ 丙氨酸(C 3H 7NO 2)CH 3—CH —COOH ∣NH 2,—C ‖O —N ∣H —谷氨酸(C 5H 9NO 4)HOOC —CH 2—CH 2—CH —COOH∣NH 2 ⎩⎪⎨⎪⎧2x +3y +9z +5m ═555x +7y +11z +9m ═882×(x +y +z +2m )═28 x +y +z +m ═10 解得⎩⎪⎨⎪⎧x ═1y ═2z ═3m ═4—NH -↓A CH ∣R -↓B C ‖O -↓C NH -CH ∣R'—C -‖→DOR -CH —C ‖O —OH ∣NH 2+HNO 2R -CH —C ‖O —OH ∣OH+N 2↑+H 2(C 6H 10O 2N 2)C 适当条件CH 3-CH -COOH∣NH 2↓Na ↓HClA B HHHNO 2D浓硫酸(C 6H 8O 4)E(C 6H 7O 2)—ONO 2OHOH n(C 6H 7O 2)—ONO ONO 2ONOnHS -CH 2—CH —COOH ∣NH 2 HS -CH 2—CH —C ‖O —O -S -CH 2—CH —COOH ∣NH 2∣NH 2 HS -CH 2—CH —COONH 4∣NH 2A.H -C -∣H ∣OH C -∣H ∣OH C -∣H ∣OH C -∣H ∣OH C —C ‖O —H ∣H ∣OHB.H -C -∣H ∣NH 2C -∣H ∣NH 2C -∣H ∣NH 2C -∣H ∣NH 2C —C ‖O —H ∣H ∣NH 2C.H -C -∣H ∣NH 2C -∣H ∣NH 2C -∣H ∣NH 2C -∣H ∣NH 2C —C —‖NH H ∣H ∣NH 2D.H -C -∣H ∣OH C -∣H ∣OH C -∣H ∣OH C -∣H ∣OH C —C —‖NH H ∣H ∣OHCH 2—COOH ∣NH 2、CH 3—CH —COOH ∣NH 2、CH 3—CH 2-CH —COOH ∣NH 2A. CH 2—COOH ∣NH 2B.CH 3—CH —COOH ∣NH 2C. D.HOOC —CH 2—CH 2—CH —COOH ∣NH 2B.C. ——HHD.(C 6H 7O 2)—ONO 2ONO 2OHCH 2-∣OH CH -∣OH CH -∣OH CH -∣OH CH -∣OHCHO 甲CH 2-∣OH CH —CH -∣OH CH -∣OH CH -∣OH CH ∣OH乙╲C ‖O ╱ ╲C ‖O ╱CH 2-CH 2∣ C ——∣H N ∣ CH 2CH 2∣H 2O ⎩⎪⎨⎪⎧CO 2叶绿素A 酶B O 2催化剂C O2DB H +E Na 2O 2⎩⎨⎧→G 过量CO 2白色沉淀H →FS 点燃I[— [—CH —∣CH 3CH ]—n ∣COOH②CHOOCC 15H 31∣CH 2OOCC 15H 31∣CH 2OOCC 15H 31+HO -P -OH ‖O ∣OH CHOOCC 15H 31∣CH 2O -P -OH‖O ∣OH∣CH 2OOCC 15H 31+C 15H 31COOH ③CHOOCC 15H 31∣CH 2O -P -OH‖O∣OH∣CH 2OOCC 15H 31+2NaOH CHOOCC 15H 31∣CH 2O -P -ONa‖O ∣ONa∣CH 2OOCC 15H 31+2H 2O (说明:-P -O ‖O ∣OH H 也可代替CHOOCC 15H 31∣CH 2OOCC 15H 31∣CH 2OOCC 15H 31中间的—C ‖O —C 15H 31基团。

化学常见符号大全The Standardization Office was revised on the afternoon of December 13, 2020化学文档中常见符号集锦说明:将符号复制、粘贴到需要得文档就可。
一、数字顺序:①②③④⑤⑥⑦⑧⑨⑩⑪⑫⑬⑭⑮⑯⑰⑱⑲⑳二、罗马数字:I II III IV V VI VII VIII IX IX三、物理量: 焓∆H 平均值 -M平均摩尔质量 -r M 平均相对分子质量 -r A 摩尔质量 M () 相对分子质量 M r 相对原子质量 A r 速率v 计量系数ν 密度 ρ 转化率 α体积分数 ϕ 物质的量分数 x 质量分数 w ()四、常见符号 NH 3·H 2O黑点 " ´ ° 加热 △ ℃ ≥ ≤ > < 比号 : ÷ × Ω ⋅η ü ℃ 单键 — 双键= 三键 ≡ ~五、希腊字母φ σ ρ π v μ λ ε ∆ δ γ β α 六、上下标七、转移电子 4HCl +MnO 2 = MnCl 2+Cl 2↑+2H 2O 2e -MnO 2+4HCl = MnCl 2+Cl 2↑+2H 2O2e -22↑+2H 2O 得2e -,升2价,被还原八、反应符号:△高温放电电解催化剂△22△光△点燃高温放电电解△Cu催化剂催化剂△浓硫酸浓硫酸△浓硫酸140 ℃浓硫酸170 ℃△乙醇一定条件光△高温催化剂高温、高压充电放电+OH -九、其它反应符号常温沸水400℃~500252电解1000 ℃ Na 3AlF 6点燃或光照微热微热或不加热浓硫酸NaOH 平衡时常温灼烧沸水熔融高温煅烧灼热的Cu水浴加热微生物光合作用水化酸化稀盐酸盐酸酸化硝酸酸化浓硝酸澄清石灰水石灰乳稀氨水NaOH 溶液Br 2的CCl 4溶液AgNO 3溶液Na 2SO 3氯水Fe 、水稀H 2SO 4△△NaOH△Cu(OH)2OH - H HClNaOHO 2Cl 2I 2水H 2OCl -Br -I -SⅠⅡ常温沸水浓硫酸△催化剂V 2O 5催化剂T 1T 2。

可复制、编制,期待你的好评与关注!化学文档中常见符号集锦说明:将符号复制、粘贴到需要得文档就可。
一、数字顺序:①②③④⑤⑥⑦⑧⑨⑩⑪⑫⑬⑭⑮⑯⑰⑱⑲⑳二、罗马数字:I II III IV V VI VII VIII IX IX三、物理量:焓 H 平均值 -M平均摩尔质量 -r M 平均相对分子质量 -r A 摩尔质量 M () 相对分子质量 M r 相对原子质量 A r 速率v 计量系数 密度 转化率体积分数 物质的量分数 x 质量分数 w ()四、常见符号 NH 3·H 2O黑点 ● " ´ ° 加热 △ ℃ ≥ ≤ > < 比号 : ÷ × Ω ⋅η ü ℃ 单键 — 双键= 三键 ≡ ~五、希腊字母v 六、上下标七、转移电子 4HCl +MnO 2 = MnCl 2+Cl 2↑+2H 2O 2e -MnO 2+4HCl = MnCl 2+Cl 2↑+2H 2O 2e -MnO 2+4HCl = MnCl 2+Cl 2↑+2H 2O 得2e -,升2价,被还原八、反应符号: △ 电解 催化剂△ 2 2△ 光 △ 点燃 高温 放电 电解 △Cu 催化剂 催化剂△ 浓硫酸浓硫酸△浓硫酸140 ℃浓硫酸170 ℃△乙醇一定条件光△高温催化剂高温、高压充电放电+OH -九、其它反应符号常温熔融400℃~500℃252电解36点燃或光照微热浓硫酸NaOH常温灼烧沸水熔融高温煅烧灼热的Cu水浴加热微生物光合作用水化酸化稀盐酸盐酸酸化硝酸酸化浓硝酸澄清石灰水石灰乳稀氨水NaOH溶液Br2的CCl4溶液AgNO3溶液Na2SO3溶液氯水Fe、水稀H2SO4△NaOH△Cu(OH)2OH-H HCl NaOH O2Cl2I2H2O Cl-Br-I-SⅠⅡ常温沸水浓硫酸催化剂V2O5催化剂T1T2(注:文档可能无法思考全面,请浏览后下载,供参考。

一、单质的的化学式氦气He、氖气Ne、氩气Ar、氪气Kr、氙气Xe、氡气Rn金Au、银Ag 、铜Cu、铁Fe、铝Al 、钙Ca 、钠Na、钾K碳C、磷P 、硫S、硅Si、硼B、砷As、氢气H2、氧气O2、氮气N2、氟气F2、氯气Cl2、溴水Br2、碘I2臭氧O3 、白磷P4二、氧化物的化学式一氧化碳CO 、二氧化碳CO2 、二氧化硫SO2、三氧化硫SO3水H2O 、双氧水H2O2、五氧化二磷P2O5、一氧化氮NO、二氧化氮NO2氧化钠Na2O 、氧化钾K2O、氧化银Ag2O氧化汞HgO 、氧化铜CuO、氧化镁MgO、氧化钙CaO、氧化锌ZnO、氧化亚铁FeO 氧化铁Fe2O3、氧化铝Al2O3二氧化钛TiO2、二氧化锰MnO2四氧化三铁Fe3O4三、酸的化学式盐酸HCl 、硝酸HNO3氢硫酸H2S、亚硫酸H2SO3、硫酸H2SO4 、碳酸H2CO3、磷酸H3PO4乙酸(醋酸)CH3COOH四、碱的化学式氢氧化钾KOH、氢氧化钠NaOH 、氨水NH3·H2O氢氧化钙Ca(OH)2、氢氧化钡Ba(OH)2 、氢氧化铜Cu(OH)2↓、氢氧化镁Mg(OH)2↓、氢氧化亚铁Fe(OH)2↓氢氧化铁Fe(OH)3↓、氢氧化铝Al(OH)3↓五、盐的化学式氯化银AgCl↓、氯化钾KCl 、氯化钠NaCl氯化铜CuCl2、氯化镁MgCl2、氯化钙CaCl2、氯化锌ZnCl2、氯化钡BaCl2、氯化亚铁FeCl2氯化铁FeCl3、氯化铝AlCl3、氯化钴CoCl3硫酸钠Na2SO4 、硫酸钾K2SO4硫酸钡BaSO4↓、硫酸铜CuSO4、硫酸锌ZnSO4 、硫酸钙CaSO4、硫酸镁MgSO4、硫酸亚铁FeSO4硫酸铁Fe2(SO4)3、硫酸铝Al2(SO4)3碳酸钠Na2CO3、碳酸钾K2CO3、碳酸铵(NH4)2CO3碳酸钙CaCO3↓、碳酸镁MgCO3、碳酸钡BaCO3↓、碳酸铜CuCO3↓、碳酸锌ZnCO3↓、碳酸亚铁FeCO3碳酸铁Fe2(CO3)3、碳酸铝Al2(CO3)3硝酸钠NaNO3、硝酸银AgNO3、硝酸钾KNO3硝酸铜Cu(NO3)2、硝酸镁Mg(NO3)2、硝酸钙Ca(NO3)2、硝酸锌Zn(NO3)2、硝酸钡Ba(NO3)2硝酸铁Fe(NO3)3、硝酸铝Al(NO3)3氯化铵NH4Cl、硝酸铵NH4NO3、碳酸铵(NH4)2CO3、硫酸铵(NH4)2SO4 硫化钠Na2S、硫化亚铜Cu2S、碘化钾KI 、溴化锌ZnBr、氯酸钾KClO3、高锰酸钾KMnO4 、锰酸钾K2MnO4、甲烷(天然气)CH4、乙醇(酒精) C2H5OH铜锈Cu2(OH)2CO3、铁锈Fe2O3.nH2O氧气O2氢气H2氮气N2氯气Cl2氧化镁MgO二氧化碳CO2氯化氢HCl氢氧化钠NaOH碳酸钙CaCO3硫酸铜CuSO4硝酸银AgNO3氯化钠NaCl三氧化铝AlCl3碳酸氢钠NaHCO3碳酸氢铵NH4HCO3高锰酸钾KMnO4二氧化锰MnO2甲烷CH4乙醇C2H水H2O一、硫酸盐类:1.皓矾:ZnSO4.7H2O2.钡餐,重晶石:BaSO43.绿矾,皂矾,青矾:FeSO4.7H2O4.芒硝,朴硝,皮硝:Na2SO4.10H2O5.明矾:KAl(SO4)2.12H2O6.生石膏:CaSO4.2H2O 熟石膏:2CaSO4.H2O7.胆矾、蓝矾:CuSO4.5H2O8.莫尔盐:(NH4)2SO4.FeSO4.6H2O二、矿石类:1.莹石:CaF22.光卤石:KCl.MgCl2.6H2O3.黄铜矿:CuFeS24.矾土:Al2O3.H2O、Al2O3.3H2O和少量Fe2O3 、SiO25.磁铁矿石:Fe3O46.赤铁矿石:Fe2O37.褐铁矿石:2Fe2O3.3H2O8.菱铁矿石:Fe2CO39.镁铁矿石:Mg2SiO410.苏口铁:碳以片状石墨形式存在11.白口铁:碳以FeC3形式存在12.高岭石:Al2(Si2O5)(OH)4 或(Al2O3.2SiO2.2H2O)13.正长石:KAlSi3O814.石英:SiO215.硼砂:Na2B4O7.10H2O16.脉石:SiO217.刚玉(蓝宝石.红宝石):天然产的无色氧化铝晶体18.黄铁矿(愚人金):FeS219.炉甘石:ZnCO320.智利硝石:NaNO321.滑石:3MgO.4SiO2.H2O22.大理石(方解石、石灰石):CaCO323.孔雀石:CuCO3.Cu(OH)224.白云石:MgCO3.CaCO325.冰晶石:Na3AlF626.高岭土:Al2O3.2SiO2.2H2O27.锡石:SnO228.辉铜矿:Cu2S三、气体类:1.高炉煤气:CO,CO2等混合气体2.水煤气:CO,H23.天然气(沼气):CH44.液化石油气:C3H8,C4H10为主5.焦炉气:CH4,CO,H2,C2H4为主6.裂解气:C2H4为主7.爆鸣气:H2和O28.笑气:N2O9.裂化气:C1~C4的烷烃、烯烃10.电石气:C2H2(通常含H2S、PH3等)四、有机类:1.福尔马林(蚁醛):HCHO2.蚁酸:HCOOH3.尿素:(NH4CNO)或CO(NH2)24.氯仿:CCl45.木精(工业酒精):CH3OH6.甘油:CH2OH-CHOH- CH2OH7.硬脂酸:C17H35COOH8.软脂酸:C15H31COOH9.油酸:C17H33OH10.肥皂:C17H35COONa11.银氨溶液:[Ag(NH3)2]+12.乳酸:CH3-CHOH-COOH13.葡萄糖:C6H12O614.蔗糖:C12H22O1115.核糖:CH2OH-(CHOH)3CHO16.脱氧核糖:CH2OH-(CHOH)2CH2-CH317.淀粉:(C6H10O5)n18.火棉,胶棉:主要成份都是[(C6H7O2)-(ONO2)3]n 只是前者含N量高19.尿素:CO(NH2)2 NH4CNO为氰酸铵(互为同分异构体)20.氯仿:CHCl321.油酸:C17H33COOH22.银氨溶液:[Ag(NH3)2]OH23.脱氧核糖:CH2OH-(CHOH)2CH2-CHO五、其他类:1.白垩:CaCO32.石灰乳、熟石灰:Ca(OH)23.熟石膏:2CaSO4.H2O4.足球烯:C605.铜绿:Cu2(OH)2CO36.纯碱(碱面):Na2CO37.王水:HCl,HNO3 (3:1)8.水玻璃(泡火碱) :Na2SiO39.小苏打:NaHCO310.苏打:Na2CO311.大苏打(海波):Na2S2O312.盐卤:MgCl2.6H2O13.雌黄:As2S314.雄黄:As4S415.朱砂:HgS16.石棉:CaO.3MgO.4SiO217.砒霜:As2O318.泻盐:MgSO4.7H2O19.波尔多液:CuSO4+Ca(OH)220.钛白粉:TiO2。

化学字母公式符号大全
在化学中,有许多用于表示元素、化合物和化学反应的符号和公式。
以下是化学字母公式符号的一些常见示例:
1.元素符号:
-H:氢
-He:氦
-Li:锂
-Be:铍
-B:硼
-C:碳
-N:氮
-O:氧
-F:氟
-Ne:氖
-Na:钠
-Mg:镁
-Al:铝
-Si:硅
-P:磷
-S:硫
-Cl:氯
-K:钾
-Ca:钙
-Fe:铁
-Cu:铜
-Zn:锌
-Ag:银
-Au:金
2.化合物和离子:
-H2O:水
-CO2:二氧化碳
-NH3:氨
-NaCl:氯化钠
-CaCO3:碳酸钙
-HCl:盐酸
-CH4:甲烷
-C6H12O6:葡萄糖
-NO3-:硝酸根离子
-SO42-:硫酸根离子
-OH-:羟基离子
3.化学反应方程式:
-H2+O2→H2O:氢气加氧气生成水
-CH4+2O2→CO2+2H2O:甲烷燃烧生成二氧化碳和水
-2H2O→2H2+O2:水分解生成氢气和氧气
这只是一些常见的化学字母公式符号示例,化学中还有更多的符号和公式表示法。
根据不同的化合物和化学反应类型,符号和公式可能会有许多不同的组合和表示方法。

化学符号大全化学符号是化学元素的标识,它们是用来代表元素的简写形式,通常由一个或两个拉丁字母组成。
化学符号是化学元素的独特标识,它们在化学方程式、化学式和其他化学公式中起着重要的作用。
下面将介绍一些常见的化学符号,以便大家更好地了解和掌握化学知识。
1. 氢(Hydrogen)的化学符号是H,它是地球上最丰富的元素之一,也是化合物中最常见的元素之一。
氢气是一种无色、无味、无毒的气体,它在自然界中广泛存在,是水和许多有机化合物的组成部分。
2. 氦(Helium)的化学符号是He,它是一种无色、无味、无毒的惰性气体,常用于充气球和气球中。
氦气是地壳中第二丰富的元素,但由于其轻量和不活泼的特性,它通常以气态形式存在于大气中。
3. 锂(Lithium)的化学符号是Li,它是一种银白色的金属元素,常用于制造锂电池和合金。
锂在自然界中较为稀有,主要存在于矿石中。
4. 氮(Nitrogen)的化学符号是N,它是地球大气中最丰富的元素之一,占据大气中78%的体积比例。
氮气是一种无色、无味、无毒的气体,广泛用于制造氮肥和氮化合物。
5. 氧(Oxygen)的化学符号是O,它是生命中不可或缺的元素之一,是维持生命的重要物质。
氧气是一种无色、无味、无毒的气体,它能够支持燃烧和呼吸,是地球上最常见的元素之一。
6. 钠(Sodium)的化学符号是Na,它是一种银白色的金属元素,常用于制造食盐和碱金属化合物。
钠在自然界中广泛存在,主要以盐矿的形式存在。
7. 镁(Magnesium)的化学符号是Mg,它是一种银白色的金属元素,常用于制造轻合金和防腐蚀材料。
镁在自然界中较为丰富,主要存在于矿石和盐湖中。
8. 铝(Aluminum)的化学符号是Al,它是一种银白色的轻金属元素,常用于制造铝合金和包装材料。
铝是地壳中第三丰富的元素,主要存在于矿石中。
9. 硅(Silicon)的化学符号是Si,它是一种灰白色的半金属元素,常用于制造硅片和半导体材料。
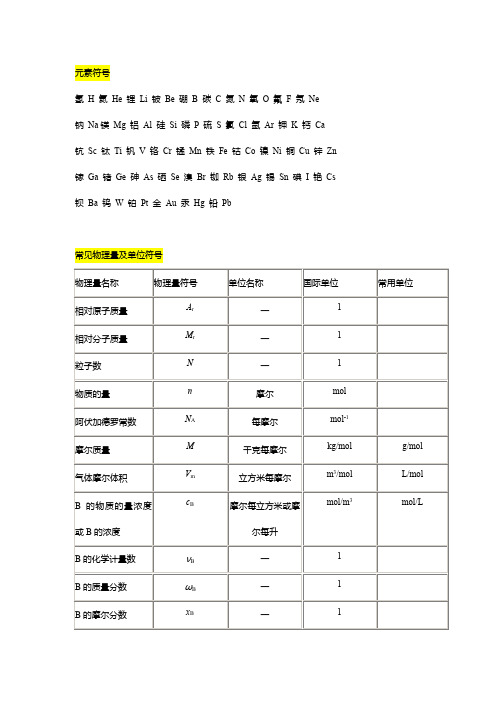
元素符号
氢H 氦He 锂Li 铍Be 硼B 碳C 氮N 氧O 氟F 氖Ne
钠Na镁Mg 铝Al 硅Si 磷P 硫S 氯Cl 氩Ar 钾K 钙Ca 钪Sc 钛Ti 钒V 铬Cr 锰Mn 铁Fe 钴Co 镍Ni 铜Cu 锌Zn 镓Ga 锗Ge 砷As 硒Se 溴Br 铷Rb 银Ag 锡Sn 碘I 铯Cs 钡Ba 钨W 铂Pt 金Au 汞Hg 铅Pb
常见物理量及单位符号
常见反应条件
点燃、△、高温、电解、催化剂、一定条件、放电、光、浓H2SO4、稀H2SO4…
常见物质名称及化学式
稀有气体:He、Ne、Ar等
单质金属:Mg、Al、Zn、Fe、Cu、Hg
非金属:气体:H2、O2、N2、Cl2
液体:Br2
固体:C、S、P、碘:I2
盐:
常见有机物化学式
甲烷:CH4乙烷:C2H6丙烷:C3H8 n烷:C n H2n+2苯:C6H6乙烯:C2H4乙炔:C2H2丙烯:C3H6甲醇:CH3OH 乙醇:C2H5OH 丙醇:C3H7OH
丙三醇甘油:C3H8O3苯酚:C6H5OH 甲酸:HCOOH
乙酸:CH3COOH 乙酸乙酯:CH3COOC2H5 苯甲酸:C6H5COOH
甲醛:HCHO 乙醛:CH3CHO 一氯甲烷:CH3Cl 二氯甲烷:CH2Cl2
三氯甲烷氯仿:CHCl4 四氯化碳:CCl4
葡萄糖果糖:C6H12O6蔗糖:C12H22O11纤维素淀粉:C6H10O5n
常见的离子:
能级符号s、p、d、f
常见杂化:sp、sp2、sp3、sp3d、sp3d2原子结构示意图。

精心整理化学常用符号与图标一、化学式氢气式水式氯化氢式硝酸式次氯酸式硫亚酸式硫酸式磷酸式碳酸式硫化氢式磷化氢式氨式甲烷式硅烷式水双氧式偏硅酸式硅酸式硅原酸式氯气式溴单式碘单式氧化钠式氧过化钠式氧化镁式氧化铝式氧化铁式氧亚铁式四氧化三铁式氧化钙式二氧化硫式三氧化硫式四氧化二氮式二氧化氮式一氧化氮式氧化铜式氧化银式二氧化碳式一氧化碳式氢离子式钠离子式钙盐:O浓加等高高催等二氧化锰等二氧化锰加热等高温等催加等单号加热号浓硫酸号一定条件号催化剂号浓加号制乙烯号制乙醚号二氧化锰号一定条件逆催化剂逆浓硫酸逆高高逆加热逆催加逆浓加逆高高加逆高高催逆单逆号←─前聚合号双键号CC叁键号CC侧二甲苯─CH3,─CH)3三甲苯 CH 3),)三硝基甲苯),O 2N ─ ─NO 2,) 右斜甲苯 左斜甲苯 竖二甲苯羰基式—),C )—醛基式—),C )—H 羟基式—OH羧基式—),C )—OH三、电子式镁电子式·Mg ·铝电子式··碳电子式··氮电子式··氧电子式··氯右电子式:·氯左电子式·:八电子结构::氨电子式),H ::H ):::H ::氢左电子式·H 氢右电子式H ·C12C60C 60碳六十式C612碳十二式沉淀淀↓气体体↑·HH ),· ),·K ·+·:K ·+·:K ·+·:K ·++·K ·+H ·+·:H ·+·:H ·+·:H ·++·:·+·:·+·:·+·:·+·Ca ·+·:[::]-Ca 2+[::]-:·+·Ca ·+·:[::]-Ca 2+[::]-:·+·Ca ·+·:[::]-Ca 2+[::]-氯气电式::::::溴单电式:::碘单电式:::氮气电式:NN :氢气电式H :H氯化氢电式H ::),H::H )),[H ::H]+,H )甲烷电式),H ::H ,H )),H ::H ,H )),H ::H )),[H ::H]+,H)电子转移式),S+O 2═SO 2,)电子转移式),S+O 2═SO 2,)一层结构二层结构上三、有机域上结构下结构上下构结中结构署名结构分子式结构—,硝酸乙酯)—,硝酸乙酯)—,硝酸乙酯)—,硝酸乙酯)—,硝酸乙酯)分子结构三层结构反应示意图结构ABCDE,白色沉淀H,→FI))))水解液中和液生成银镜,无现象))))—,)C6H5),)+H2O))))羟基酸羟基酯结构横对二苯基——平二苯基─,)三苯基同醛基式-),C,)—H双尖前域双尖后域)3、4、双平前域)))双平后域)前聚合号后聚合号聚合号左合右号)―――左分右号)HO-CH=CH-白黎芦醇CH=CH-环氧乙烷有机结构域应用n )中间结构和)∶,2)═①②③—,)R 被溶液变蓝色,单质沉淀))H 2N ——,)——,)——,)——,)OH ,—,)—解得⑵取代;不能;其组成和数量均发生了变化⑶①2NaCl +2H 2O,电解,)2NaOH +↑+↑ ②CH 3COOH +ClCH 2COOH +HCl26.⑴缩聚⑵+n H 2O n (C 6H 7O 2)— n⑶CH2—n,∣,COOH),水解,);;;;╱╱。