化学键以及电子式
- 格式:docx
- 大小:222.23 KB
- 文档页数:17
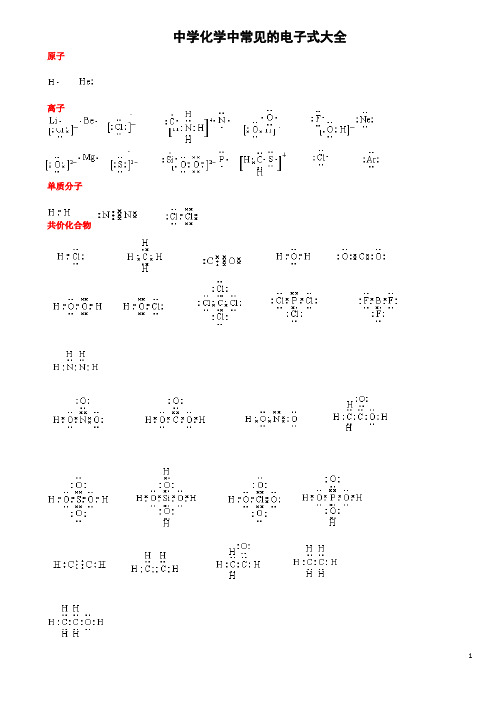
中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程1、 原子的电子式:H 、C 、N 、O 、Na 、Mg 、Al 、S 、Cl 。
2、 离子的电子式:O 2-、O -22、S 2-、Cl -、Na +、Mg 2+、Al 3+。
[ ]2-[ ]2-[ ]2-[ ]- Na + Mg 2+ Al 3+4、“根” 的电子式:OH - 、ClO - 、HCOO - 、CH 3COO - 、NH +4。
H H [ ]-[ ]-[ ]-[ ]-[ ]+ H H 5、单质分子的电子式:H 2 、Cl 2 、N 2。
H· ·· ·C· ····N· ·····O·Na· ·Mg· · ·Al· ···· ·S· ·····Cl ∶·· ·· ∶O ∶ ·· ···· ··∶O ∶O ∶ ·· ·· ∶S ∶ ····∶Cl ∶ ···· ∶O ∶H ·· ···· ·· ∶Cl ∶O ∶ ·· ····H∶C ∶O ∶ ·· ∶O ∶ ···· H ∶N ∶HH ∶H ·· ···· ··∶Cl ∶Cl ∶· ·∶N ∶∶N ∶·· ·· ···· ··H ∶C ∶C ∶O ∶·· ∶O ∶6、共价化合物的电子式:(1) 氢化物:HCl 、H 2O 、NH 3。

化学键要点一、离子键1.定义:带相反电荷离子之间的相互作用称为离子键。
要点诠释:原子在参加化学反应时,都有通过得失电子或形成共用电子对使自己的结构变成稳定结构的倾向。
例如Na 与Cl2反应过程中,当钠原子和氯原子相遇时,钠原子的最外电子层的1个电子转移到氯原子的最外电子层上,使钠原子和氯原子分别形成了带正电荷的钠离子和带负电荷的氯离子。
这两种带有相反电荷的离子通过静电作用,形成了稳定的化合物。
我们把带相反电荷离子之间的相互作用称为离子键。
2.成键的粒子:阴阳离子。
3.成键的性质:静电作用。
阴阳离子间的相互作用(静电作用)包括:①阳离子与阴离子之间的吸引作用;②原子核与原子核之间的排斥作用;③核外电子与核外电子之间的作用。
4.成键原因:通过电子得失形成阴阳离子。
5.成键条件:(1)活泼金属与活泼的非金属化合时,一般都能形成离子键。
如IA、ⅡA族的金属元素(如Li、Na、K、Mg、Ca等)与ⅥA、ⅦA族的非金属元素(如O、S、F、Cl、Br、I等)之间化合。
(2)金属阳离子(或铵根离子)与某些带负电荷的原子团之间(如Na+与OH-、SO42-等)含有离子键。
6.存在离子键的物质:强碱、低价态金属氧化物和大部分盐等离子化合物。
7.离子键的形成过程的表示:要点二、共价键1.定义:原子间通过共用电子对所形成的相互作用称为共价键。
要点诠释:从氯原子和氢原子的结构分析,由于氯和氢都是非金属元素,这两种元素的原子获得电子难易的程度相差不大,原子相互作用的结果是双方各以最外层的一个电子组成一个电子对,电子对为两个原子所共用,在两个原子核外的空间运动,从而使双方最外层都达到稳定结构,这种电子对,就是共用电子对。
共用电子对受两个核的共同吸引,使两个原子结合在一起。
我们把这种原子间通过共用电子对所形成的相互作用称为共价键。
2.成键元素:一般存在于非金属元素原子之间。
要点诠释:某些不活泼的金属和非金属元素原子(如AlCl3)之间也存在共价键。

化学键学习目标1、电子式 的书写。
2、化学键 定义/分类。
3、离子键。
4、共价键。
原子:阴、阳离子:Cl Na NaO 2-NaCl Mg 2ClHOCl Mg Na 离子化合物: Mg 2ClO2-Na 1.定义:在元素符号周围用小点(或×)来表示原 子的最外层电子,这种式子叫电子式。
(1)阳离子的电子式:不要求画出离子最外层电子数,简单阳离子的电子式就是它的离子符号。
除 NH4+。
(2)阴离子的电子式: 不但要画出最外层电子数,而且还应用于括号“[ ]”括起来,并在右上角标出“n-”电荷字样。
Cl O2-离子化合物的电子式: 由阴、阳离子的电子式组成,相同离子不能合并AB 型AB2型A 2B 型[ F ]- ·· ··::Ca 2+[ F ]- ·· ··::练习定义 / 分类定义:原子原子强烈Ø不是Ø氢键分类:阴阳离子共用电子对金属阳离子自由电子孤电子对空轨道阴阳离子吸引排斥Na+Cl-静电相互吸引电子与电子排斥原子核与原子核排斥形成本质离子化合物形成本质:得失电子离子化合物:含离子键含金属元素的化合物AlCl3BeCl2一定有离子键可能有共价键2个Na+1个O22-只有共价键形成过程 (重点)NaOHNa2O2⑴ 用电子式表示氧化镁的形成过程⑵ 用电子式表示硫化钾的形成过程 · O · ·· ··[ O ]2- ·· ··: :· Mg ·+→Mg 2+· S · ·· ··2K·+→K +[ S ]2- ·· ··: :K +箭头左方相同的微粒可以合并,箭头右方相同的微粒不可以合并。


化学键与分子结构一、化学键相邻的两个或多个原子之间强烈的相互作用,通常叫做化学键。
例如:水的结构式为,H-O之间存在着强烈的相互作用,而H、H之间相互作用非常弱,没有形成化学键离子键化学键极性共价键共价键非极性共价键2、离子键定义:说明:①成键元素:活泼金属(如:K、Na、Ca、Ba等)和活泼非金属(如:F、Cl、Br、O等)相互结合时形成离子键。
②成键原因:活泼金属原子容易失去电子而形成阳离子,活泼非金属原子容易得到电子形成阴离子。
当活泼金属遇到活泼非金属时,电子发生转移,分别形成阳、阴离子,再通过静电作用形成离子键。
③离子键构成离子化合物。
3、用电子式表示离子键的形成过程4、电子式的几种表示形式(1)离子单核阳离子符号,即为阳离子的电子式,如H+、K+、Na+、Mg2+;原子团的阳离子:单核阴离子:原子团的阴离子:(2)化合物二、共价键定义:说明:①成键元素:通常为非金属元素的原子间。
②成键原因:同种或不同种元素的原子之间结合成分子时并不发生电子的完全得失,而是通过共用电子对而结合的。
③共价键可以形成单质也可化合物。
(1)用电子式表示共价键的形成过程(2)几点说明1.离子键和共价键的关系:无确定的界限2.共价化合物和离子化合物的关系:只有离子键的化合物一定是离子化合物;既有离子键又有共价键的化合物是离子化合物;只有共价键的化合物才是共价化合物;3.非金属元素的原子间可形成离子化合物。
如:NH4Cl、NH4NO3、NH4HCO3等。
(3)非极性共价键与极性共价键同种元素的原子之间形成的共价键称非极性共价键,简称非极性键;不同元素的原子之间形成的共价键称配位键:配位键属于共价键,它是由一方提供孤对电子,另一方提供空轨道所形成的共价键例如:NH4+的形成在NH4+中,虽然有一个N-H键形成过程与其它3个N-H键形成过程不同,但是一旦形成之后,4个共价键就完全相同。
(HF、HCl、HBr、HI分子中:X原子半径:F<Cl<Br<IH-X键键长:H-F<H-Cl<H-Br<H-IH-X键键能:HF>HCl>HBr>HIH-X分子稳定性:HF>HCl>HBr>HI(例A 化学键存在于原子之间,也存在于分子之间B 两个原子之间的相互作用叫做化学键C 离子键是阴、阳离子之间的吸引力D 化学键通常指的是相邻的两个或多个原子之间强烈的相互作用二、分子间作用力1、分子间作用力把分子聚集在一起的作用力叫分子间作用力,又称范德华力。

化学键一、化学键1、概念:化学键是指使离子或原子之间结合的作用。
或者说,相邻的原子或原子团强烈的相互作用叫化学键。
注意:不是所有的物质都是通过化学键结合而成。
惰性气体就不存在化学键。
2、分类:金属键、离子键、共价键。
3、意义:①解释绝大部分单质和化合物的形成:绝大部分单质和化合物都是离子或者原子通过化学键的作用形成的。
②解释化学变化的本质:化学变化的本质就是反应物化学键的断裂和生成物化学键的形成过程。
原子重新组合就是通过反应物原子间化学键的断裂,然后又重新形成新的化学键的过程。
二、离子键:带相反电荷离子间的相互作用称为离子键。
1、概念:使阴阳离子结合成化合物的静电作用,叫做离子键。
2、成键微粒:阴阳离子3、本质:静电作用4、成键过程:阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。
5、成键条件:活泼金属(IA IIA)与活泼非金属(VIA VIIA)之间的化合物。
6、结果:形成离子化合物。
离子化合物就是阴阳离子通过离子键而形成的化合物。
离子晶体就是阴阳离子通过离子键而形成的晶体。
7、范围:典型的金属与典型的非金属之间容易形成离子键。
特别是位于元素周期表中左下方的金属与右上方的非金属元素之间。
例如:氧化钾、氟化钙、氢氧化钠、硝酸钾、氯化钾三、共价键:1、概念:原子通过共用电子对形成的相互作用。
2、本质:静电作用3、方式:原子间通过共用电子对形成静电作用。
4、条件:非金属元素的原子之间容易形成共价键。
5、结果:形成共价单质或共价化合物。
共价单质是指同种元素的原子通过共价键所形成的单质。
共价化合物是由不同种元素的原子通过共价键所形成的化合物。
6、范围:共价单质有H2、B、C、N2、O2、O3、F2、Si、P、S、Cl2、Br2、I2.共价化合物主要有非金属氢化物、非金属的氧化物、酸、非金属的氯化物。
7、类型:极性键:共用电子对发生偏移的共价键。
主要存在于不同元素的原子之间所形成的共价键。

化学键—离子键、共价键1.化学键:相邻______________之间强烈的相互作用。
化学键包括_________、_________、________。
2.离子键:以NaCl的形成为例,(1)阴、阳离子之间的相互作用称为离子键。
(2)离子键的实质是_____________(包括静电引力和静电斥力)。
(3)离子键的强弱与_____________、_____________有关。
3.离子化合物:含有____________的化合物叫做离子化合物,如大多数金属化合物和____________。
注意:AlCl3不是离子化合物,而是共价化合物。
4.共价键:以HCl的形成为例,(1)形成HCl的过程是双方原子各提供一个单电子形成共用电子对,为两原子所共有,从而使双方均达到稳定结构。
(2)原子间通过_____________所形成的相互作用,叫做共价键。
(3)共价键的成键元素一般为非金属元素与非金属元素。
(4)共价键既存在于存在于共价化合物中,也可存在于离子化合物中,如NH4Cl、NaOH等。
(5)共价键的强弱和键长有关,键长越短,键能越大,共价键越强;而键长与原子半径有关,原子半径越大,键长就越长,形成的共价键就越弱。
5.共价化合物:______________________的化合物叫做共价化合物,如绝大多数非金属化合物。
6.电子式的书写:(1)原子的电子式:如C和N的电子式分别为___________、_____________。
(2)阳离子的电子式:如Na 和NH4+的电子式分别为___________、_____________。
(3)阴离子的电子式:如Cl—和OH—的电子式分别为___________、_____________。
(4)离子化合物的电子式:分别写出阴、阳离子的电子式,然后相邻地放在一起,尽量写成对称形式。
如NaCl和MgBr2的电子式分别为___________、_____________。

高中化学备考资料:化学键必考的基础知识(内附电子式以及结构式)化学考试中常考各种化学键,离子键、共价键、氢键等等,那么,各种化学键怎么区分?有哪些规律?化学姐为大家总结了这部分知识,有需要的转走哦!一、离子键部分1、带相反电荷离子之间的相互作用称为离子键,也就是说,成键的微粒为阴、阳离子且均是稳定的离子,阴、阳离子间的排斥和吸引处于平衡状态。
2、离子键存在于所有强碱、大多数盐、与活泼金属氧化物之中。
如果选择题其中某个选项选项写出个弱碱啊或是其他什么的然后死气白咧的非要说这化合物里有离子键的话,你可以客气的在旁边写上“You are 脑残”(放心写吧,选择题的卷子不收~)3、最脑残的话莫过于“活泼金属(一般指第一二主族元素)与活泼非金属(一般指六七主族元素)形成的化合物一定是离子化合物”了。
例如氯化铍和氯化铝都是共价化合物而不是离子化合物,这两种物质就是证明说这话的人是脑残体的最好例子。
另外补充一个知识点,从上述概念可以看出,含有金属元素的化合物不一定是离子化合物。
4、需要特殊记忆的阳离子是铵根离子,与酸根(或酸式根)形成的盐也是离子化合物。
从这条知识可以看出,不含金属元素的化合物可能也是离子化合物。
5、只要含有离子键的化合物一定是离子化合物,同样的,离子化合物一定含有离子键。
6、离子化合物的判断方法不只局限于化学性质上,用物理性质也可以判断。
熔融状态下能导电的化合物是离子化合物,熔沸点较高(必须熔、沸点同时较高,只有其中一项较高时不能作为判断依据。
而且这种判断方法只局限于离子化合物与共价化合物之间的判断)的化合物为离子化合物。
7、离子化合物只有电子式没有结构式(共价化合物有结构式,下面会说到~)二、共价键部分1、只由共价键形成的化合物称为共价化合物2、离子化合物可能含有共价键,共价化合物一定不含离子键。
这句话可以结合离子化合物和共价化合物的概念去理解。
3、原子间通过共用电子对所形成的相互作用,叫做共价键。



第1讲化学键网络课程内部讲义化学键教师:刘廷阁“在线名师”→ 资料室免费资料任你下载化学键知识结构:(一)离子键1.称为离子键。
成键微粒:。
举例哪些物质能提供阴、阳离子:、、。
2.电子式:的式子。
原子电子式:H Cl S Ar Mg离子电子式:Na+Mg2+OH-NH4+3.用电子式表示出离子化合物的形成过程。
用电子式表示MgO、K2S形成过程:注意:(1)首先考虑箭号左方原子的摆放,并写出它们的电子式。
(2)箭号右方写离子化合物的电子式。
写时要注意二标:标正负电荷、阴离子标[]。
(3)箭号右方相同的微粒不可以合并写。
(4)在标正负电荷时,特别要注意正负电荷总数相等。
(二)共价键1、概念:____________叫共价键。
2.用电子式表示共价分子的形成过程。
用电子式表示I2、2CO、H2O的形成过程:I2:____________;2CO:____________;H2O:______3.非极性键与极性键(1)非极性键:_____________________,存在于______。
(2)极性键:______________________,存在于______。
4.分子间作用力:分子间作用力存在于________之间。
化学键存在于________原子之间。
氢键是一种分子间作用力,影响物质的____,如H2O由于分子间氢键的形成,分子间作用力骤然增强,从而改变了Te—S氢化物熔沸点降低的趋势而猛然升高,卤族中的HF和氮族中的NH3也有类似情况。
键能折开1mol共价键所吸收的能量或形成1mol共价键所放出的能量,这个键能就叫键能。
键能越大,键越牢固,分子越稳定。
键长两成键原子核之间的平均距离叫键长。
键越短、键能较大,键越牢固,分子越稳定。
键参数键角分子中相邻的键和键之间的夹角叫键角。
它决定分子的空间构型和分子的极性。
“在线名师”→答疑室随时随地提问互动(三)总结:化学键:使离子相结合或原子相结合的作用。


中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程1、 原子的电子式:H 、C 、N 、O 、Na 、Mg 、Al 、S 、Cl 。
2、 离子的电子式:O 2-、O -22、S 2-、Cl -、Na +、Mg 2+、Al 3+。
[ ]2-[ ]2-[ ]2-[ ]- Na + Mg 2+ Al 3+4、“根” 的电子式:OH - 、ClO - 、HCOO - 、CH 3COO - 、NH +4。
H H [ ]-[ ]-[ ]-[ ]-[ ]+ H H 5、单质分子的电子式:H 2 、Cl 2 、N 2。
H· ·· ·C· ····N· ·····O·Na· ·Mg· · ·Al· ···· ·S· ·····Cl ∶·· ·· ∶O ∶ ·· ···· ··∶O ∶O ∶ ·· ·· ∶S ∶ ····∶Cl ∶ ···· ∶O ∶H ·· ···· ·· ∶Cl ∶O ∶ ·· ····H∶C ∶O ∶ ·· ∶O ∶ ···· H ∶N ∶HH ∶H ·· ···· ··∶Cl ∶Cl ∶· ·∶N ∶∶N ∶·· ·· ···· ··H ∶C ∶C ∶O ∶·· ∶O ∶6、共价化合物的电子式:(1) 氢化物:HCl 、H 2O 、NH 3。


初中化学知识点归纳化学式结构式和电子式的表示方法初中化学知识点归纳:化学式、结构式和电子式的表示方法化学是一门研究物质的变化及其性质的科学。
在化学研究中,我们经常需要用化学式、结构式和电子式来表示化学物质的组成和结构。
本文将介绍初中化学中常用的化学式、结构式和电子式的表示方法。
一、化学式化学式是用化学符号和数字表示化学物质的组成。
根据化学元素的原子数目,化学式分为分子式和离子式。
1. 分子式分子式用化学元素的符号和数字表示化学物质中原子的种类和数目。
以H2O(水)为例,其中H表示氢元素,O表示氧元素,数字2表示氢原子的个数。
2. 离子式离子式描述的是离子键的组成和比例关系。
以NaCl(氯化钠)为例,其中Na+表示钠离子,Cl-表示氯离子。
离子式中,阳离子在前,阴离子在后。
二、结构式结构式用线条和原子符号表示物质内部的原子结构和原子间的化学键。
不同的物质由于原子间的连接方式不同,结构式也不同。
1. 电键线式电键线式适用于表示有机物的结构。
一根实线表示共价键(电键),两根实线表示双键,三根实线表示三键。
原子间连接关系由线条的位置表示。
2. 简化式简化式常用于表达常见的有机物结构,使用简化的线条表示共价键的连接关系,原子符号只标注在关键位置,并省略了其他部分的结构。
三、电子式电子式用化学元素符号和点(.)表示原子外层电子。
电子式适用于描述电子的分布和原子间的化学键。
1. 电子轨道式电子轨道式用圆圈表示原子的各个电子层和轨道,用点表示轨道上的电子。
2. 电子点式电子点式用点表示原子的外层电子,电子点的位置表示电子所在轨道。
例如氯气(Cl2)的电子点式为:•Cl-Cl•综上所述,化学式、结构式和电子式是初中化学中重要的表示方法。
化学式用于表示化学物质的组成,结构式用于表示原子的连接方式,电子式用于描述电子分布。
通过这些表示方法,我们可以更加直观地了解和研究化学物质的性质和变化规律。
化学键以及电子式 Company number:【WTUT-WT88Y-W8BBGB-BWYTT-19998】化学键考点一离子键和共价键1.离子键和共价键的比较离子键共价键概念带相反电荷离子之间的相互作用原子间通过共用电子对形成的相互作用成键粒子阴、阳离子原子成键实质静电作用:包括阴、阳离子之间的静电吸引作用,电子与电子之间以及原子核与原子核之间的静电排斥作用静电作用:包括共用电子对与两核之间的静电吸引作用,电子与电子之间以及原子核与原子核之间的静电排斥作用形成条件活泼金属与活泼非金属化合一般是非金属与非金属化合(1)非极性共价键:同种元素的原子间形成的共价键,共用电子对不偏向任何一个原子,各原子都不显电性,简称非极性键。
(2)极性共价键:不同元素的原子间形成共价键时,电子对偏向非金属性强的一方,两种原子,一方略显正电性,一方略显负电性,简称极性键。
3.离子键的表示方法(1)用电子式表示离子化合物的形成过程①Na2S:;②CaCl2:(2)写出下列物质的电子式①MgCl2:;②Na2O2:③NaOH:④NH4Cl:4.共价键的表示方法(1)用电子式表示共价化合物的形成过程①CH4··+4H·―→;②CO2··+2··―→(2)写出下列物质的电子式①Cl2:;②N2:③H2O2:④CO2:⑤HClO:⑥CCl4:(3)写出下列物质的结构式①N2:N≡N;②H2O:③CO2:1.(1)形成离子键的静电作用指的是阴、阳离子间的静电吸引吗(2)形成离子键的元素一定是金属元素和非金属元素吗仅由非金属元素组成的物质中一定不含离子键吗(3)金属元素和非金属元素形成的化学键一定是离子键吗(4)含有离子键的化合物中,一个阴离子可同时与几个阳离子形成静电作用吗2.(1)共价键仅存在于共价化合物中吗3.判断正误,正确的划“√”,错误的划“×”(1)形成离子键的阴、阳离子间只存在静电吸引力()(2)全部由非金属元素形成的化合物一定是共价化合物()(3)某些金属与非金属原子间能形成共价键()(4)分子中只有共价键的化合物一定是共价化合物()(5)某元素的原子最外层只有一个电子,它跟卤素结合时,所形成的化学键一定是离子键(6)在水溶液中能导电的化合物一定是离子化合物()(7)离子化合物在任何状态下都能导电()1.下列电子式书写正确的是()2.氯水中存在多种微粒,下列有关粒子的表示方法正确的是()A.氯气的电子式:B.氢氧根离子的电子式:C.次氯酸分子的结构式:H—O—ClD.HClO的电子式:电子式书写时常见的错(1)漏写未参与成键的电子,如:N2:NN,应写为NN。
(2)化合物类型不清楚,漏写或多写[]及错写电荷数,如:NaCl:;HF:,应写为NaCl:;HF:。
(3)书写不规范,错写共用电子对,如:N2的电子式为,不能写成,更不能写成或。
(4)不考虑原子间的结合顺序,如HClO的结构式为H—O—Cl而非H—Cl—O。
(5)不考虑原子最外层有几个电子,均写成8电子结构,如CH的电子式为而非。
(6)不考虑AB2型离子化合物中2个B是分开写还是一起写。
如:CaBr2、CaC2的电子式分别为、。
题组二8电子结构的判断3.含有极性键且分子中各原子都满足8电子稳定结构的化合物是()A.CH4B.CH2===CH2C.CO2D.N24.下列物质中所有原子均满足最外层8电子稳定结构的化合物是()A.PCl5B.P4C.CCl4D.NH3判断分子中各原子是否达到8电子的稳定结构,主要方法有两种:(1)经验规律法:凡符合最外层电子数+|化合价|=8的皆为8电子结构。
(2)试写结构法判断某化合物中的某元素最外层是否达到8电子稳定结构,应从其结构式或电子式结合原子最外层电子数进行判断,如:①H2O,O原子最外层有6个电子,H2O中每个O原子又与两个H原子形成两个共价键,所以H2O中的O原子最外层有6+2=8个电子,但H2O中的H原子最外层有2个电子;②N2,N原子最外层有5个电子,N与N之间形成三个共价键,所以N2中的N原子最外层达到8电子稳定结构。
考点二化学键与化学反应、物质类别1.化学键概念2.相邻原子间强烈的相互作用。
2.化学键与化学反应旧化学键的断裂和新化学键的形成是化学反应的本质,是反应中能量变化的根本。
3.物质的溶解或熔化与化学键变化(1)离子化合物的溶解或熔化过程离子化合物溶于水或熔化后均电离成自由移动的阴、阳离子,离子键被破坏。
(2)共价化合物的溶解过程①有些共价化合物溶于水后,能与水反应,其分子内共价键被破坏,如CO2和SO2等。
②有些共价化合物溶于水后,与水分子作用形成水合离子,从而发生电离,形成阴、阳离子,其分子内的共价键被破坏,如HCl、H2SO4等。
③某些共价化合物溶于水后,其分子内的共价键不被破坏,如蔗糖(C12H22O11)、酒精(C2H5OH)等。
(3)单质的溶解过程某些活泼的非金属单质溶于水后,能与水反应,其分子内的共价键被破坏,如Cl2、F2等。
4.化学键对物质性质的影响(1)对物理性质的影响金刚石、晶体硅、石英、金刚砂等物质硬度大、熔点高,就是因为其中的共价键很强,破坏时需消耗很多的能量。
NaCl等部分离子化合物,也有很强的离子键,故熔点也较高。
(2)对化学性质的影响N2分子中有很强的共价键,故在通常状况下,N2很稳定,H2S、HI等分子中的共价键较弱,故它们受热时易分解。
5.化学键与物质类别(1)化学键的存在(2)化学键与物质的类别除稀有气体内部无化学键外,其他物质内部都存在化学键。
:1.仅由非金属元素形成的离子化合物,如NH4Cl、NH4NO3等。
2.金属元素和非金属元素间可能存在共价键,如AlCl3等。
(3)离子化合物和共价化合物的判断方法①根据化学键的类型判断凡含有离子键的化合物,一定是离子化合物;只含有共价键的化合物,是共价化合物。
②根据化合物的类型来判断大多数碱性氧化物、强碱和盐都属于离子化合物;非金属氢化物、非金属氧化物、含氧酸都属于共价化合物。
③根据化合物的性质来判断一般熔点、沸点较低的化合物是共价化合物。
熔融状态下能导电的化合物是离子化合物,如NaCl;不能导电的化合物是共价化合物,如HCl。
深度思考有化学键的断裂或形成就一定是化学反应吗(电离结晶)题组一化学键的断裂与形成1.下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是() A.NH4ClNH3↑+HCl↑B.NH3+CO2+H2O===NH4HCO3C.2NaOH+Cl2===NaCl+NaClO+H2OD.2Na2O2+2CO2===2Na2CO3+O22.在下列变化过程中,既有离子键被破坏又有共价键被破坏的是()A.将SO2通入水中B.烧碱溶于水C.将HCl通入水中D.硫酸氢钠溶于水3.从化学键的观点看,化学反应的实质是“旧键的断裂,新键的形成”,据此你认为下列变化属于化学变化的是()①对空气进行降温加压②金刚石变成石墨③NaCl熔化④碘溶于CCl4中⑤HCl溶于水电离出H+和Cl-⑥电解熔融的Al2O3制取AlA.②③⑤B.②⑤⑥C.②⑥D.②③⑤⑥题组二化学键与物质类别4.有以下9种物质:①Ne;②NH4Cl;③KNO3;④NaOH;⑤Cl2;⑥SO2;⑦H2S;⑧Na2O2;⑨MgCl2。
请用上述物质的数字序号填空:(1)只存在离子键的是_________________________________________________。
(2)只存在共价键的是_________________________________________________。
(3)只存在共价键的电解质是___________________________________________。
(4)既存在离子键又存在共价键的是_____________________________________。
(5)不存在化学键的是__________________________________________________。
5.短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。
下列化合物中同时存在极性和非极性共价键的是() A.Z2Y B.X2Y2C.Z2Y2D.ZYX6.下列化合物中,既有离子键,又有共价键且是非极性共价键的是()A.NaOH B.Na2O2C.KHSO4D.NH4Cl考点三分子间作用力和氢键1.分子间作用力(1)定义:把分子聚集在一起的作用力,又称范德华力。
(2)特点①分子间作用力比化学键弱得多,它主要影响物质的熔点、沸点等物理性质,而化学键主要影响物质的化学性质。
②分子间作用力存在于由共价键形成的多数共价化合物和绝大多数气态、液态、固态非金属单质分子之间。
但像二氧化硅、金刚石等由共价键形成的物质,微粒之间不存在分子间作用力。
(3)变化规律一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点也越高。
例如,熔、沸点:I2>Br2>Cl2>F2。
2.氢键(1)定义:分子间存在的一种比分子间作用力稍强的相互作用。
(2)形成条件除H外,形成氢键的原子通常是O、F、N。
(3)存在氢键存在广泛,如蛋白质分子、醇、羧酸分子、H2O、NH3、HF等分子之间。
分子间氢键会使物质的熔点和沸点升高。
特别提醒(1)氢键不是化学键,是介于分子间作用力和化学键之间的一种作用力。
(2)氢键、分子间作用力的大小主要影响物质的物理性质,如熔点、沸点等。
深度思考1.右图中每条折线表示元素周期表中第ⅣA~ⅦA族中的某一族元素氢化物的沸点变化。
每个小黑点代表一种氢化物,其中a点代表的是()A.H2S B.HClC.PH3D.SiH42.下列现象与氢键有关的是()①NH3的熔、沸点比ⅤA族其他元素氢化物的高②小分子的醇、羧酸可以和水以任意比互溶③冰的密度比液态水的密度小④水分子高温下很稳定A.①②③④B.①②③C.①②D.①③1.判断正误,正确的划“√”,错误的划“×”(1)NH4Br的电子式:()(2)次氯酸的电子式()(3)Na2O2的电子式为()(4)H2O的电子式为()(5)N2的电子式:()(6)MgSO4晶体中只存在离子键()2.(2012·大纲全国卷,6)下列有关化学键的叙述,正确的是()A.离子化合物中一定含有离子键B.单质分子中均不存在化学键C.含有极性键的分子一定是极性分子D.含有共价键的化合物一定是共价化合物3.[2010·上海,23(3)]某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径________(填“大”或“小”),该元素和铝元素的最高价氧化物的水化物之间发生反应的离子方程式为___________________________________。