初三化学常见物质的化学式
- 格式:doc
- 大小:55.00 KB
- 文档页数:4

初中常见物质化学公式一、离子、原子式1. 氯气:Cl₂2. 水:H₂O3. 硫酸:H₂SO₄4. 纯碱:NaOH5. 硝酸:HNO₃6. 氨气:NH₃7. 氧气:O₂8. 氢气:H₂9. 氮气:N₂10. 二氧化碳:CO₂11. 亚硫酸:H₂SO₃12. 硝酸银:AgNO₃13. 碳酸氢钠:NaHCO₃14. 氯化钠:NaCl15. 硫化氢:H₂S二、摩尔比1. 摩尔质量:M = n/m,其中n为物质的物质量,单位为mol;m为物质的质量,单位为g。
2. 摩尔占比:X = n/M,其中n为物质的物质量,单位为mol;M为物质的摩尔质量,单位为g/mol。
三、反应式1. 酸和碱的中和反应:酸 + 碱→ 盐 + 水2. 碳酸酸解反应:碳酸 + 酸→ 盐 + 水 + 二氧化碳3. 金属与酸反应:金属 + 酸→ 盐 + 氢气4. 物质燃烧反应:物质 + 氧气→ 二氧化物5. 物质与酸和金属反应:物质 + 金属→ 盐 + 氢气6. 物质与氢气反应:物质 + 氢气→ 化合物7. 燃烧反应:物质 + 氧气→ 二氧化物四、质量关系1. 反应质量平衡法则:质量守恒定律,反应前后质量不变。
2. 物质质量比:m₁:n₁ = m₂:n₂3. 反应的最大产物质量:从化学方程式知道反应物的物质量,按照化学比转换成制造物的物质量,取最小者即为反应的最大产物质量。
五、分子式1. 分子式表示分子中元素的种类和数目。
2. 示例如下:- 水的分子式为H₂O,表示一个水分子中有2个氢原子和1个氧原子。
- 二氧化碳的分子式为CO₂,表示一个二氧化碳分子中有1个碳原子和2个氧原子。
六、离子式1. 离子式用来表示离子的种类。
2. 示例如下:- 氯离子的离子式为Cl⁻,表示一个氯离子带有1个负电荷。
- 钠离子的离子式为Na⁺,表示一个钠离子带有1个正电荷。
七、化学方程式的平衡1. 化学反应的配平:通过调整反应物和生成物的系数,使得化学方程式中的原子数目相等。

初三化学常见物质的化学式固态:干冰Hg汞Fe铁Cu铜P氮气C碳磷S硫1、单质:H氢气O氧气N222苛性钠、火石灰石、大碳酸钙Ca CONaOH氢氧化钠2、化合物3理石碱、烧碱(1)氧化物:HO水CO二氧化碳CO一氧化碳SO三氧化硫二氧化硫SO3222NaCO碳酸钠纯碱、苏打CuSO·5HO硫酸铜晶体胆矾、蓝矾2324PO五氧化二磷FeO 氧化铁Fe氧化镁CaO氧化钙MgOO四氧化三铁423235碳酸氢钠、小苏打NaCl 氯化钠NaHCO食盐钠NaO氧化锰亚CuO氧化铜FeO氧化铁MnO二氧化322酸式碳酸钠KOH氢氧化钠CO(2)酸:HCl盐酸HSO硫酸HNO硝酸H碳酸(3)碱:NaOH醋酸32324乙酸 CHCOOH CHOH 乙醇酒精352氯氯化钙NaCl氢氧化钾Ca(OH)氢氧化钙(4)盐:氯化钠NaCO碳酸钠CaCl KCl2322HCl氢氯酸盐酸 HO 过氧化氢双氧水22化钾铜绿、孔雀(OH)CO 碱式碳酸铜 HO 氧化氢Cu 水FeSO硫酸亚铁氯化亚铁FeCl硫酸铜CuSO AgCl氯化银氯化铁FeCl22234342石高KClO 硫酸锌CaCO碳酸钙BaSO硫酸钡氯酸钾KMnO硫酸铁(SO Fe)ZnSO44433342CH 甲烷沼气、坑气 FeO 氧化铁铁红324锰酸钾锰酸钾KMnO42硫酸铝钾晶.)12HO明矾KAl(SOCO一氧化碳煤气葡萄糖:乙酸(醋酸)COCOOHOH C)有机物:(5CH甲烷H 乙醇(酒精)CH2243452体COH6126三、物质的溶解性:一、常见物质的颜色的状态1、气体:溶的:CO、HCl、SO、NH等。
322;铁、镁、无水CO、Ca(OH)NaOHCaOO、白色固体:1P、、、、KClONa、NaClCuSO4325232不溶(或不易溶):O、H、CH为银白色(汞为银白色液态)、CO、N等。
2422 OMnOCuO:石墨、炭粉、铁粉、、、Fe 为紫黑色KMnO▲黑色固体2、2、金属氧化物:除CaO、NaO、KO、BaO溶外,大多数不溶443222、:3、红色固体Cu FeO CuCO(OH)为绿色、红磷▲硫:淡黄色▲、HgO323223、酸:大多数溶2+溶:凡含、4溶液的颜色Cu的溶液呈CuClCu(NO溶液、)溶液、CuSO蓝色(如:22342+溶液);凡)溶液、FeCl溶液、(如:Fe液);凡含的溶液呈浅绿色FeSOFe (NO4、碱:除氢氧化钡、氢氧化钾、氢氧化钙、氢氧化钠和氨水溶外,其他碱不溶于水22343+溶液),其余溶溶液、)(Fe黄色含Fe的溶液呈棕(如:SO溶液、Fe (NOFeCl)-的盐只有AgCl含有钾、钠、硝酸根、铵根的盐都溶于水,含Cl不溶于水,5、盐:33433222液一般为无色。

初中常见物质的化学式(大全)1、非金属单质氢气碳氮气氧气磷硫氯气H2CN2O2PSCl22、金属单质钠镁铝钾钙铁锌铜NaMgAlKCaFeZnCu汞钡钨HgBaW3、常见氧化物水一氧化碳二氧化碳五氧化二磷二氧化锰二氧化氮二氧化硅H2OCOCO2P2O5MnO2NO2SiO2二氧化硫三氧化硫一氧化氮氧化镁氧化铜氧化钡氧化亚铜SO2SO3NOMgOCuOBaOCu2O氧化亚铁三氧化二铁四氧化三铁三氧化二铝FeOFe2O3Fe3O4Al2O34、氯化物/盐酸盐氯化钾氯化钠氯化镁氯化钙氯化铜氯化锌氯化钡氯化铝氯化银KClNaClMgCl2CaCl2CuCl2ZnCl2BaCl2AlCl3AgCl氯化铁氯化亚铁FeCl3FeCl25、常见的酸硫酸亚硫酸盐酸硝酸碳酸硫化氢H2SO4H2SO3HClHNO3H2CO3H2S6、常见的盐硫酸铜硫酸钡硫酸钙硫酸钾硫酸镁硫酸亚铁硫酸铁CuSO4BaSO4CaSO4K2SO4MgSO4FeSO4Fe2(SO4)3硫酸铝硫酸钠硫酸钾亚硫酸钠硝酸钠硝酸钾硝酸银Al2(SO4)3Na2SO4K2SO4Na2SO3NaNO3KNO3AgNO3硝酸镁硝酸铜硝酸钙亚硝酸钠碳酸钠碳酸钙碳酸镁MgNO3Cu(NO3)2Ca(NO3)2NaNO3Na2CO3CaCO3MgCO3碳酸钾K2CO37、常见的碱氢氧化钠氢氧化钙氢氧化钡氢氧化镁氢氧化铜氢氧化钾氢氧化铝NaOHCa(OH)2Ba(OH)2Mg(OH)2Cu(OH)2KOHAl(OH)3氢氧化铁氢氧化亚铁Fe(OH)3Fe(OH)28、常见有机物甲烷乙炔甲醇乙醇【酒精】乙酸【醋酸】CH4C2H2CH3OHC2H5OHCH3COOH9、常见结晶水合物碱式碳酸铜石膏蓝矾明矾绿矾Cu2(OH)2CO3CaSO4•2H2OCuSO4•5H2OKAl(SO4)2•12H2OFeSO4•7 H2O10、常见化肥尿素硝酸铵硫酸铵碳酸氢铵磷酸二氢钾CO(NH2)2NH4NO3(NH4)2SO4NH4HCO3KH2PO411、沉淀微溶于水淡黄色沉淀浅绿色沉淀红褐色絮状沉淀蓝色絮状沉淀Ca(OH)2,CaSO4SFe(OH)2Fe(OH)3Cu(OH)2白色沉淀Mg(OH)2、CaCO3、BaCO3、AgCl、BaSO4 (其中BaSO4、AgCl是不溶于HNO3的白色沉淀, Mg(OH)2、CaCO3 、BaCO3是溶于HNO3的白色沉淀)当我们难以前进的时候,不要忘记先退一步,再往前闯,或者变更方法前进。

初三化学常有物质的化学式1、单质: H2氢气 O2氧气 N2氮气 C 碳 P 磷 S 硫 Fe 铁 Cu 铜 Hg 汞2、化合物( 1)氧化物: H2O 水 CO2二氧化碳CO 一氧化碳SO2二氧化硫SO3三氧化硫P2O5五氧化二磷Fe2O3氧化铁 Fe3O4四氧化三铁CaO 氧化钙 MgO 氧化镁CuO 氧化铜FeO 氧化亚铁MnO 2二氧化锰Na2O 氧化钠(2)酸: HCl 盐酸 H2SO4硫酸 HNO3硝酸 H2 CO3碳酸(3)碱: NaOH 氢氧化钠 KOH 氢氧化钾 Ca(OH)2氢氧化钙(4)盐: NaCl 氯化钠 Na2CO3碳酸钠 CaCl2氯化钙 KCl 氯化钾CuSO 硫酸铜 AgCl 氯化银 FeCl 氯化铁 FeCl 氯化亚铁 FeSO 硫酸亚铁4 3 2 4Fe (SO ) 硫酸铁 ZnSO 硫酸锌 CaCO 碳酸钙 BaSO 硫酸钡 KClO 氯酸钾 KMnO2 434 3 4 3 4高锰酸钾 K2 MnO 4锰酸钾( 5)有机物: CH4甲烷 2 5乙醇(酒精) 3COOH 乙酸(醋酸)CO 葡萄糖:CHOH CHC6H12O6一、常有物质的颜色的状态1、白色固体: P2O5、CaO、 NaOH、Ca(OH)2、 KClO3、Na2CO3、NaCl、无水 CuSO4;铁、镁为银白色(汞为银白色液态)2、黑色固体:石墨、炭粉、铁粉、 CuO、MnO、Fe O▲ KMnO为紫黑色2 3 4 43、红色固体:Cu、Fe2 O3 、HgO、红磷▲硫:淡黄色▲Cu2 (OH)2CO3为绿色4、溶液的颜色:凡含 Cu2+的溶液呈蓝色(如: CuSO4溶液、 CuCl2溶液、 Cu(NO3) 2溶液);2+ 溶液、 Fe (NO) 3+凡含 Fe 的溶液呈浅绿色(如: FeSO溶液、 FeCl 溶液);凡含 Fe 的溶4 2 3 2液呈棕黄色(如: Fe2( SO4)3溶液、 FeCl3溶液、 Fe (NO3) 3溶液),其余溶液一般为无色。

常见物质的化学式一、单质(一)金属单质:铜:Cu 铁:Fe 铝:Al 锌:Zn 镁:Mg 钙:Ca 钠:Na 钾:K(二)非金属固体单质:硫:S磷:P碳:C(三)稀有气体单质:氦气:He 氖气:Ne 氩气:Ar(四)非金属气体单质氧气:O2氢气:H2氮气:N2氯气:Cl2二、化合物(一)氧化物:1.非金属氧化物水:H2O一氧化碳:CO二氧化碳:CO2五氧化二磷:P2O5二氧化硫:SO2 2.金属氧化物氧化铜:CuO二氧化锰:MnO2四氧化三铁:Fe3O4氧化铁(三氧化二铁):Fe2O3氧化亚铁:FeO 氧化铝:Al2O3氧化钙:(生石灰)CaO(二)酸、碱和盐1.酸:硫酸:H2SO4盐酸(氯化氢):HCl 硝酸:HNO3碳酸:H2CO3磷酸:H3PO42.碱:氢氧化钠:NaOH氢氧化钾:KOH氢氧化钙(熟石灰):Ca(OH)2氢氧化铁:Fe(OH)3氢氧化亚铁:Fe(OH)2氢氧化铜:Cu(OH)2氢氧化镁:Mg(OH)2氢氧化铝:Al(OH)33.盐:氯化钠:NaCl 氯化铁:FeCl3氯化亚铁:FeCl2氯化铝:AlCl3硫酸钠:Na2SO4硫酸铁:Fe2(SO4)3硫酸亚铁:FeSO4硫酸铜:CuSO4硫酸钡:BaSO4硝酸钠:NaNO3硝酸铜:Cu(NO3)2硝酸铝:Al(NO3)3 硝酸银:AgNO3碳酸钠:Na2CO3碳酸钙:CaCO3碳酸钡:BaCO3三、其他:氯酸钾:KClO3高锰酸钾:KMnO4锰酸钾:K2MnO4碱式碳酸铜:(铜绿)Cu2(OH)2CO3胆矾:CuSO4·5H2O钾钠银氢正一价,氟氯溴碘负一价,钙镁钡锌铜二价,二三铁,二二四碳,通常氧硫负二价。
负一硝酸氢氧根,负二硫酸碳酸根。

初中常见化学物质的化学式、名称、俗称1.Al(OH)3:氢氧化铝、胃舒平的主要成分;2.BaSO4:硫酸钡、钡餐、重晶石3.C:碳、金刚石、石墨、木炭、活性炭、焦炭、煤的主要成分;4.Ca(ClO)2和CaCl2:次氯酸钙和氯化钙混合物、漂白粉(有效成分为.Ca(ClO)2)5.CaO:氧化钙、生石灰;6.CaO、NaOH:氧化钙和氢氧化钠混合物、碱石灰;7.Ca(OH)2: 氢氧化钙、消石灰、熟石灰;石灰浆、石灰乳、石灰水的主要成分;8.CaCO3:碳酸钙、大理石、石灰石的主要成分;9.CaSO4.2H2O : 硫酸钙晶体、(生)石膏;10. (CaSO4)2.H2O:硫酸钙晶体、熟石膏;11.CH4:甲烷、天然气、瓦斯、沼气的主要成分;12.C2H5OH :乙醇、酒精;13.CH3COOH:乙酸、醋酸;14.C6H12O6:葡萄糖;15.CO2:二氧化碳、碳酸气、干冰;—17.CO(NH2)2:尿素;18.CuSO4•5H2O:硫酸铜晶体、胆矾、蓝矾;19. Cu2(OH)2CO3:碱式碳酸铜、铜绿、铜绿、孔雀石、铜锈;20. Cu SO4和Ca(OH)2:波尔多液21.FeSO4•7H2O:硫酸亚铁晶体、绿矾;22.Fe2O3:氧化铁、铁锈和赤铁矿主要成分;23.Fe3O4:四氧化三铁、磁铁矿、烤蓝、烤黑;24.Hg: 汞、水银;25.HCl:氢氯酸、盐酸、胃酸的主要成分;26.H2O2:过氧化氢、双氧水;27.H2和O2混合气:爆鸣气;28.KAl(SO4)2.12H2O:十二水硫酸铝钾、明矾;29.K2CO3:碳酸钾、草木灰主要成分;30.KOH:氢氧化钾、苛性钾;31.NaOH:氢氧化钠、苛性钠、烧碱,火碱;32.Na2CO3:碳酸钠、纯碱、苏打;33.NaHCO3:碳酸氢钠、小苏打34.Na2CO3.10H2O:纯碱晶体、石碱、口碱;35.Na2SiO3:硅酸钠、水玻璃;—36.NaCl:氯化钠、食盐;37.Na2S2O3:硫代硫酸钠、大苏打、海波;38.NH4HCO3:碳酸氢铵、碳铵;39.(NH4)2SO4:硫酸铵、硫铵;40.NH4NO3:硝酸铵、硝铵;41.NH3•H2O:一水合氨、氨水;42.P:磷、白磷、红磷、黄磷;43.S :硫、硫磺;44.SiO2:二氧化硅、石英、石英砂、水晶;45. Fe:生铁、钢、不锈钢的主要成分。

初中化学常见物质名称及化学式金属单质:非金属单质:氢气 氧气 氮气 氯气 臭氧 液溴 碘 碳 硅 硫 磷H 2 O 2 N 2 Cl 2 O 3 Br 2 I 2 C Si S P稀有气体:氦气 氖气 氩气He Ne Ar金属氧化物:氧化镁 氧化钙(生石灰) 氧化铝 氧化铜 氧化钠MgO CaO Al 2O 3 CuO Na 2O氧化铁(三氧化二铁) 氧化亚铁 四氧化三铁 二氧化锰Fe 2O 3 FeO Fe 3O 4 MnO 2非金属氧化物:水 双氧水(过氧化氢) 二氧化碳 一氧化碳 二氧化硫 五氧化二磷H 2O H 2O 2 CO 2 CO SO 2 P 2O 5酸:盐酸 硫酸 碳酸 硝酸 亚硫酸 磷酸HCl H 2SO 4 H 2CO 3 HNO 3 H 2SO 3 H 3PO 4碱:氢氧化钠 氢氧化钙 氢氧化铜 氢氧化镁 氢氧化铁 氢氧化亚铁 氢氧化钡 一水合氨 氨气 NaOH Ca(OH)2 Cu(OH)2 Mg(OH)2 Fe(OH)3 Fe(OH)2 Ba(OH)2 NH 3·H 2O NH 3 盐酸盐:氯化钠 氯化钾 氯化银 氯化钙 氯化铜 氯化铁 氯化亚铁NaCl KCl AgCl CaCl 2 CuCl 2 FeCl 3 FeCl 2硝酸盐:硝酸钠 硝酸钾 硝酸银 硝酸钡 硝酸铜NaNO 3 KNO 3 AgNO 3 Ba(NO 3)2 Cu(NO 3)2碳酸盐:碳酸钠 碳酸钾 碳酸钙 碳酸钡Na 2CO 3 K 2CO 3 CaCO 3 BaCO 3硫酸盐:硫酸钠 硫酸钾 硫酸钡 硫酸钙 硫酸铜 五水合硫酸铜Na 2SO 4 K 2SO 4 BaSO 4 CaSO 4 CuSO 4 CuSO 4·5H 2O其他盐:氯酸钾 锰酸钾 高锰酸钾KClO 3 K 2MnO 4 KMnO 4常见元素和原子团的化合价• +1价:K 、Na 、Ag 、H 、NH 4• +2价:Ca 、Mg 、Ba 、Zn 、Cu• +3价:Al• +2、+3价 :Fe• -1价:F 、Cl 、OH 、NO3• -2价:O 、S 、CO3、SO4• -3价:PO4钾 钙 钠 镁 铝 锌 铁 锡 铅 铜 汞 银 铂 金 钡 锰K Ca Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt Au Ba Mn化学式表示的意义宏观:①表示一种物质②表示该物质的元素组成微观:①物质的一个分子②物质的分子构成如:CO2表示•①二氧化碳这种物质•②二氧化碳由碳元素和氧元素组成•③一个二氧化碳分子•④一个二氧化碳分子由一个碳原子和两个氧原子构成说明下列符号表示的意义H:表示氢元素或一个氢原子。

初三化学式大全化学是一门研究物质组成、性质和变化规律的学科,其中化学式是表达物质组成的符号表示法。
在初三化学学习中,准确掌握化学式的知识是非常重要的。
下面将为大家整理一份初三化学式大全,帮助大家更好地学习和理解化学式。
I. 元素符号化学式中的元素符号是一种简写方式,用来表示元素的英文名称的首字母或首字母与其后的小写字母。
以下是常见元素的符号:1. 氧气:O2. 氢气:H3. 硫磺:S4. 氮气:N5. 碳:CII. 原子与化合物的化学式1. 原子原子是构成物质的最小单位,化学式可以表示一个或多个原子。
以下是常见元素的化学式:1. 氢原子:H2. 氧原子:O3. 氮原子:N4. 碳原子:C5. 锌原子:Zn2. 化合物化合物是由两种或更多种元素以一定比例结合而成的物质。
以下是一些常见化合物的化学式:1. 水:H2O2. 二氧化碳:CO23. 甲烷:CH44. 铁氧体:Fe3O45. 硫酸:H2SO4III. 离子化学式离子是带电的原子或原子团,化学式可以表示离子的化合物。
以下是一些常见离子的化学式:1. 氢离子:H+2. 氧离子:O2-3. 氯离子:Cl-4. 铵离子:NH4+5. 碳酸根离子:CO32-IV. 反应式反应式表示化学反应前后物质的变化过程。
以下是一些常见反应式的化学式:1. 氢气与氧气生成水:2H2 + O2 -> 2H2O2. 镁与硫酸发生反应生成镁硫酸:Mg + H2SO4 -> MgSO4 + H23. 碳酸氢铵分解产生氨气和水:NH4HCO3 -> NH3 + H2O + CO2V. 储存和使用注意事项1. 存放化学品储存应遵循安全规范,避免与其他物质接触和混合,防止火灾和爆炸的发生。
2. 使用在使用化学品时,应该佩戴防护眼镜、手套、实验室大衣等个人防护装备,严格按照实验流程和操作规范进行,避免产生危险和事故。
总之,初三化学式大全是帮助学生更好地理解和掌握化学式的重要工具。

常见物质的化学式总结
一、单质:
氢气氧气氮气氯气碘碳硅磷硫钠镁铝钾钙锰铁铜锌银汞氦气氖气氩气
二、氧化物
水过氧化氢二氧化碳一氧化碳二氧化氮二氧化硅五氧化二磷氧化钙氧化镁氧化铝二氧化锰氧化亚铁氧化铁四氧化三铁
氧化铜氧化汞
三、氯化物
氯化氢氯化钠氯化镁氯化铝氯化钾氯化钙氯化亚铁氯化铁氯化铜氯化锌氯化银氯化钡氯化铵
四、硝酸及硝酸盐
硝酸硝酸钠硝酸镁硝酸铝硝酸钾硝酸钙硝酸亚铁硝酸铁硝酸铜硝酸锌硝酸银硝酸钡
硝酸铵
五、硫酸及硫酸盐
硫酸硫酸钠硫酸镁硫酸铝硫酸钾硫酸钙硫酸亚铁硫酸铁硫酸铜硫酸锌硫酸银硫酸钡硫酸铵
七、碳酸及碳酸盐
碳酸碳酸钠碳酸钾碳酸钙碳酸钡碳酸氢钠碳酸氢钾碳酸氢钙碳酸氢铵
八、氢氧化物(碱)
氢氧化钠氢氧化钾氢氧化钙氢氧化钡氢氧化铝氢氧化亚铁氢氧化铁氢氧化铜
氨水
九、其他
高锰酸钾锰酸钾氯酸钾甲烷乙醇。

4-- 3---+精心整理常用物质的化学名称、化学式及反应的化学方程式:一、 单质:1、常见气体:氧气: O 2 氢气: H 2 氯气: Cl 2 氮气: N 22、稀有气体:氦气: He 氖气: Ne 氩气: Ar3、金属和非金属单质(1)金属单质:锂: Li 铍: Be 钠: Na 镁: Mg 铝: Al 钾: K 钙: Ca 铜: Cu 铁: Fe 锌: Zn 钡: Ba 银: Ag 汞: Hg(2)非金属单质:碳: C 硅: Si 磷: P 硫: S 二、化合物1、氧化物一氧化碳: CO 氧化铜: CuO 二氧化硅: SiO 2 二氧化碳: CO 2 氧化铁: Fe 2O 3 二氧化锰: MnO 2 二氧化硫: SO 2 氧化钠: Na 2O 氧化亚铁: FeO 三氧化硫 SO 3 氧化镁: MgO 三氧化二铝: Al 2O 3 一氧化氮: NO 氧化钙: CaO 四氧化三铁: Fe 3O 4 二氧化氮: NO 2 过氧化钠: Na 2O 2 五氧化二磷: P 2O 5 2、酸(强酸)硫酸: H 2SO 4(中强酸)亚硫酸: H 2SO 3 (弱酸)碳酸: H 2CO 3盐酸: HCl 磷酸: H 3PO 4 醋酸: CH 3COOH 硝酸: HNO 3 硅酸: H 2SiO 3氢氟酸: HF 3、碱(强碱)氢氧化钠: NaOH (弱碱)氢氧化镁: Mg(OH) 2氢氧化钙: Ca(OH)2 氢氧化铝: Al(OH) 3 氢氧化钾: KOH 氢氧化亚铁: Fe(OH)2 氢氧化钡: Ba(OH)2 氢氧化铁: Fe(OH)3 氢氧化铜: Cu(OH)24、盐氯酸钾: KClO 3 高锰酸钾: KMnO 4 锰酸钾: K 2MnO 4 氯化铵: NH 4Cl 硫酸铵: (NH 4)2SO 4 碳酸氢铵: NH 4HCO 3 硝酸铵: NH 4NO 3离子名称 离子符号 所带电荷数-氢氧根离子 OH -1 硫酸根离子 SO 2--2 硝酸根离子 NO 3-1 碳酸根离子 CO 32-2 碳酸氢根离子 HCO 3 -1 铵根离子 NH 4 +1 亚硫酸根离子 SO 2--2 3-磷酸根离子 PO 4-3 氯酸根离子 ClO 3-1 高锰酸根离子 MnO 4-1 钾钠钙镁氢 氧 化 钾 : 氢 氧 化 钠 : 氢 氧 化 钙 : 氢 氧 化 镁 :精心整理精心整理KOH硝酸钾:KNO 3氯化钾:KCl 硫酸钾:K 2SO4碳酸钾:K 2CO3氧化钾:K 2O NaOH硝酸钠:NaNO3氯化钠:NaCl硫酸钠:Na2SO4亚硫酸钠:Na2SO3碳酸钠:Na2CO3碳酸氢钠:NaHCO3氧化钠:Na2O过氧化钠:Na2O2Ca(OH)2硝酸钙:Ca(NO3)2氯化钙:CaCl2硫酸钙:CaSO4亚硫酸钙:CaSO3碳酸钙:CaCO3氧化钙:CaO 过氧化钙:CaO2Mg(OH) 2硝酸镁:Mg(NO 3)2氯化镁:MgCl 2硫酸镁:MgSO4亚硫酸镁:MgSO3碳酸镁:MgCO 3氧化镁:MgO铝铁铜钡氢氧化铝:Al(OH) 3硝酸铝:Al(NO 3)3 氯化铝:AlCl 3硫酸铝:Al 2(SO4)3氧化铝:Al 2O3氢氧化铁:Fe(OH)3氢氧化亚铁:Fe(OH)2硝酸铁:Fe(NO3)3硝酸亚铁:Fe(NO3)2硫酸铁:Fe2(SO4)3亚硫酸铁:FeSO4氧化铁:Fe2O3 氧化亚铁:FeO 氯化铁:FeCl3 氯化亚铁:FeCl2三氧化二铁:Fe2O3四氧化三铁:Fe3O4氢氧化铜:Cu(OH)2硝酸铜:Cu(NO3 )2氯化铜:CuCl2硫酸铜:CuSO4氧化铜:CuO 碱式碳酸铜:Cu2(OH)2CO3氢氧化钡:Ba(OH) 2硝酸钡:Ba(NO3)2氯化钡:BaCl2 硫酸钡:BaSO4 碳酸钡:BaCO3锌银硝酸锌:Zn(NO 3)2 氯化锌:ZnCl 2硫酸锌:ZnSO4—-硝酸银:AgNO3氯化银:AgCl2--氯离子(Cl 盐酸:HCl )氢氧根(OH氢氧化钾:KOH)硫酸根(SO4硫酸:H2SO4)硝酸根(NO3 )硝酸:HNO 3氯化钠:NaCl 氯化钾:KCl氯化钙:CaCl2 氯化镁:MgCl 2 氯化铝:AlCl 3氯化铁:FeCl3 氯化亚铁:FeCl2氢氧化钠:NaOH氢氧化钙:Ca(OH)2氢氧化镁:Mg(OH) 2氢氧化铝:Al(OH) 3氢氧化铜:Cu(OH)2氢氧化铁:Fe(OH)3氢氧化亚铁:Fe(OH)2氢氧化钡:Ba(OH)2硫酸钾:K 2 SO4硫酸钠:Na2SO4硫酸钙:CaSO4硫酸镁:MgSO4硫酸铝:Al 2 (SO4)3硫酸铜:CuSO4硫酸铁:硝酸钾:KNO 3硝酸钠:NaNO3硝酸钙:Ca(NO3)2硝酸镁Mg(NO 3)2硝酸铝:Al(NO 3)3精心整理精心整理氯化钡: BaCl 2 氯化铜: CuCl 2 氯化锌: ZnCl 2 氯化银: AgCl 氯化铵: NH 4Cl2-Fe 2(SO 4)3硫酸亚铁: FeSO 4 硫酸锌: ZnSO 4 硫酸钡: BaSO 4 硫 酸 铵 : (NH 4)2SO 4+ -硝 酸 铜 : Cu(NO 3)2硝 酸 铁 : Fe(NO 3)3硝 酸 亚 铁 : Fe(NO 3)2硝 酸 锌 : Zn(NO 3)2硝 酸 钡 : Ba(NO 3)2硝酸银:AgNO 3 硝 酸 铵 :NH 4NO 3碳酸根(CO 3 )铵根( NH 4 )碳酸氢根( HCO 3 ) 碳酸: H 2CO 3碳酸钾: K 2CO 3 氯化铵: NH 硝酸铵: NH4Cl碳酸氢钠: NaHCO 3 碳酸氢钙: CaHCO 3碳 酸 钠 : Na 2CO 3碳酸钙: CaCO 3碳酸镁:MgCO 34NO 3碳 酸 铵 :(NH 4)2CO 3碳 酸 氢 铵 :碳酸氢铵: NH 4HCO 3碳酸钡: BaCO 3 碳 酸 铵 :NH 4HCO 3硫 酸 铵 :(NH 4)2CO 3(NH 4)2 S O 4常用的化学反应方程式: 一、单质在空气中燃烧:点燃1、硫在空气中燃烧: S+O 2=====SO 2点燃2、碳在空气中燃烧: C+O 2=====CO 2(完全燃烧)点燃2C+O 2 =====2CO (不完全燃烧)点燃3、氢气在空气中燃烧: 2H 2+O 2=====2H 2O点燃4、磷在空气中燃烧: 4P+5O 2 =====2P 2O 5点燃5、铝在空气中燃烧: 4Al+3O 2=====2Al 2O 3点燃6、镁在空气中燃烧: 2Mg+O 2=====2MgO点燃7、铁在空气中燃烧: 3Fe+2O 2=====Fe 3O 4点燃8、铜在空气中加热: 2Cu+O 2 =====2CuO二、制取气体的化学方程式:1、制取氧气的四个化学反应方程式:MnO 2(1)2KClO 3=====△=2KCl+3O 2↑△(2)2KMnO 4======K 2MnO 4+MnO 2+O 2↑MnO 2(3)2H 2O 2=====2H 2O+O 2↑电解精心整理精心整理(4)2H2O======2H 2↑+O2↑2、关于碳的四个化学反应方程式:点燃(1)C+O (完全燃烧)2=====CO2点燃(2)2C+O2=====2CO(不完全燃烧)点燃点燃(3)2CO+O2=====2CO2高温(4)C+CO2 =====2CO3、制取氢气的化学方程式:(1)镁、铝、铁、锌与稀盐酸反应制取H2:Mg+2HCl=MgCl 2+H2↑2Al +6HCl =2AlCl 3+3H2↑Fe+2HCl =FeCl2+H2↑Zn+2HCl=ZnCl 2+H2↑(2)镁、铝、铁、锌与稀硫酸反应制取H2:Mg+H2SO4=MgSO4+H2↑2Al+3H2 SO4 =2Al 2(SO4)3+3H2↑Fe+H2SO4=FeSO4+H2↑Zn+H2SO4=ZnSO4+H2↑4、制取二氧化碳的化学方程式:(1)实验室用石灰石(CaCO3)和稀盐酸(HCl)制取CO2 气体。

完整版)初三化学方程式大全化学资料以下是常见的化学元素和化合物的化学式:1.镁Mg、铁Fe、铜Cu、锌Zn、汞Hg;氦气He、氖气Ne、氩气Ar;氢气H2、氧气O2、氮气N2、氯气Cl2、臭氧O3、碳C、磷P、硫S2.水H2O、过氧化氢H2O2、一氧化碳CO、二氧化碳CO2、五氧化二磷P2O5、氧化钠Na2O、氧化镁MgO、氧化钙CaO、氧化铝Al2O3、二氧化锰MnO2、氧化铁Fe2O3、四氧化三铁Fe3O4、氧化亚铁FeO、氧化铜CuO、氧化汞HgO3.氯酸钾KClO3、高锰酸钾KMnO4、锰酸钾K2MnO4、氯化钠NaCl、硫酸H2SO4、硝酸HNO3、盐酸HCl、硫酸铜CuSO4、硫酸亚铁FeSO4、碳酸钠Na2CO3、硫酸钠Na2SO4、氢氧化铜Cu(OH)2、氢氧化钠NaOH化合价口诀和根的化合价:化合价口诀:一价氯氢钾钠银,二价氧钙镁钡锌,三铝四硅五价磷,一二铜汞二三铁,二四六硫二四碳,单质化合价为零。
根的化合价:铵根离子NH4+、碳酸根离子CO32-、高锰酸根离子MnO4-、锰酸根离子MnO42-、硝酸根离子NO3-、氯酸根离子ClO3-、硫酸根离子SO42-、氢氧根离子OH-金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au酸、碱和盐溶液组成、指示剂和pH:组成:酸H+ + 酸根离子、碱金属离子 + OH-、盐金属离子 + 酸根离子指示剂:酸溶液能使紫色石蕊溶液变红色,碱溶液能使紫色石蕊溶液变蓝色;酸溶液能使无色酚酞溶液不变色,碱溶液能使无色酚酞溶液变红色。
pH:酸性溶液的pH<7,中性溶液的pH=7,碱性溶液的pH>7.酸、碱和盐的溶解性:可溶于水的物质:NH4OH(挥发性)、KOH、NaOH、Ba(OH)2、Ca(OH)2、Mg(OH)2、Al(OH)3、Mn(OH)2、Zn(OH)2、Fe(OH)2、Fe(OH)3、Cu(OH)2不易溶于水的物质:OH-、NH4+、CO32-、PO43-、SO42-、ClO3-、MnO4-、FeSO4、CuSO4、Na2SO4、Na2CO3以上是化学中常见的元素、化合物和相关知识点。

初中化学常见物质的化学式1、单质:2H 氢气 2O 氧气 2N 氮气 C 碳 P 磷 S 硫 Fe 铁 Cu 铜 Hg 汞2、化合物(1)氧化物:O H 2水 2CO 二氧化碳 CO 一氧化碳 2SO 二氧化硫 3SO 三氧化硫 52O P 五氧化二磷 32O Fe 氧化铁 43O Fe 四氧化三铁 CaO 氧化钙 MgO 氧化镁CuO 氧化铜 ZnO 氧化锌 FeO 氧化亚铁 2MnO 二氧化锰 O Na 2氧化钠 (2)酸:HCl 盐酸 42SO H 硫酸 3HNO 硝酸 43PO H 磷酸 32CO H 碳酸 32SO H 亚硫酸 (3)碱:NaOH 氢氧化钠 KOH 氢氧化钾 Ca(OH)2氢氧化钙 Ba(OH)2氢氧化钡 Cu(OH)2氢氧化铜 Fe(OH)3氢氧化铁 Fe(OH)2氢氧化亚铁 Al(OH)3氢氧化铝 Mg(OH)2氢氧化镁(4)盐:NaCl 氯化钠 Na 2CO 3碳酸钠 ZnCl 2氯化锌 CaCl 2氯化钙 KCl 氯化钾42SO Na 硫酸钠4CuSO 硫酸铜 AgCl 氯化银 3FeCl 氯化铁 2FeCl 氯化亚铁 3AlCl 氯化铝 4FeSO 硫酸亚铁342)(SO Fe 硫酸铁 4ZnSO 硫酸锌 3CaCO 碳酸钙 2BaCl 氯化钡 4BaSO 硫酸钡3KClO 氯酸钾 4KMnO 高锰酸钾 42MnO K 锰酸钾 3KNO 硝酸钾 23)(NO Cu 硝酸铜 23)(NO Hg 硝酸汞 Cl NH 4氯化铵 34NO NH 硝酸铵 424)(SO NH 硫酸铵 34HCO NH 碳酸氢铵 3NaHCO 碳酸氢钠 322)(CO OH Cu 碱式碳酸铜(5)有机物:4CH 甲烷 OH H C 52乙醇(酒精) OH CH 3甲醇 COOH CH 3乙酸(醋酸)22)(NH CO 尿素,葡萄糖:6126O H C 淀粉:n O H C )(510628. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑31. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑32. 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg(3)碱性氧化物 +酸 -------- 盐 + 水37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物 +碱 -------- 盐 + 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O 44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O 45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O 46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3↓+ H2O(5)酸 + 碱 -------- 盐 + 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O 54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸 + 盐 -------- 另一种酸 + 另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑ 60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑ 61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑ 62.盐酸和硝酸银溶液反应:HCl + AgNO3=== AgCl↓ + HNO363.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4↓+ 2HCl (7)碱 + 盐 -------- 另一种碱 + 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4 66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl 67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH (8)盐 + 盐 ----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3==== AgCl↓ + NaNO3 71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl 五.其它反应:72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH75.三氧化硫溶于水:SO3 + H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 + 5H2O77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O。

☺常见物质的化学式
☺单质
(1)稀有气体
氦气氖气氩气
(2)固态的非金属
木炭(金刚石、石墨)硅硫磺白磷(红磷)(3)金属
钠镁铝钙铁铜钾
(4)双原子分子
氟气氯气氢气氮气氧气溴水碘
(5)臭氧
☺常见的化合物
读
一氧化碳二氧化碳水双氧水
二氧化硫三氧化硫二氧化锰二氧化氮五氧化二磷
氧化钾氧化钠氧化铝氧化镁氧化钙氧化铜
氧化铁四氧化三铁氧化亚铁
四氯化碳硫化锌
氢氧化钙氢氧化钡氢氧化钠氢氧化钾氢氧化铜氢氧化铁氢氧化铝
盐酸氯化钠氯化银氯化钾氯化钙氯化亚铁氯化铁氯化铵氯化锌
☆读
碳酸碳酸钡碳酸钾碳酸氢钠
硫酸硫酸钠硫酸铜硫酸钡硫酸钾
硝酸硝酸钠硝酸银硝酸钡硝酸钾硝酸铵
高锰酸钾锰酸钾氯酸钾甲烷。

初中阶bai段常用的化学式如下图:一、常见单质二、化合物化学式是用元素符du号表示纯净物组成及原子个数zhi的式子。
dao分子晶体的化学式叫做分子式,可以表示这种物质的分子构成。
纯净物都有一定的组成,都可用一个相应的化学式来表示其组成(每种纯净物质的组成是固定不变的,所以表示每种物质组成的化学式只有一个)。
有些化学式还能表示这种物质的分子构成,这种化学式也叫作分子式。
化学式仅表示纯净物,混合物没有化学式。
扩展资料:化学式的书写规则:一、单质化学式的写法:首先写出组成单质的元素符号,再在元素符号右下角用数字写出构成一个单质分子的原子个数。
稀有气体是由原子直接构成的,通常就用元素符号来表示它们的化学式。
金属单质和固态非金属单质的结构比较复杂,习惯上也用元素符号来表示它们的化学式。
二、化合物化学式的写法:首先按正前负后的顺序写出组成化合物的所有元素符号,然后在每种元素符号的右下角用数字写出每个化合物分子中该元素的原子个数。
一定顺序通常是指:氧元素与另一元素组成的化合物,一般要把氧元素符号写在右边。
氢元素与另一元素组成的化合物,一般要把氢元素符号写在左边;金属元素、氢元素与非金属元素组成的化合物,一般要把非金属元素符号写在右边。
直接由离子构成的化合物,其化学式常用其离子最简单整数比表示。
注意:当某组成元素原子个数比是1时,1省略不写;氧化物化学式的书写,一般把氧的元素符号写在右方,另一种元素的符号写在左方,如CO2;由金属元素与非金属元素组成的化合物,书写其化学式时,一般把金属元素符号写在左方,非金属元素符号写在右方,如NaCl。
正负化合价代数和为零。

常见物质的化学式单质O2:氧气O3:臭氧N2 :氮气H2:氢气Ne:氖气Ar:氩气Cl2:氯气C:碳单质(金刚石、石墨、活性炭、焦炭、炭黑、碳60、碳纳米管等);S:硫P:磷Si:硅Na:钠Mg:镁Al:铝Fe:铁Ca:钙Cu:铜Zn:锌Ba:钡Au:金Hg:汞Pb:铅Ag:银氧化物H2O:水(蒸馏水、冰水混合物等) H2O2:双氧水、过氧化氢CO:一氧化碳CO2:二氧化碳SO2:二氧化硫SO3:三氧化硫NO:一氧化氮NO2:二氧化氮P205:五氧化二硫MgO:氧化镁Fe3O4:四氧化三铁CuO:氧化铜CaO:氧化钙、生石灰MnO2:二氧化锰HgO:氧化汞Fe2O3:三氧化二铁、氧化铁Al2O3:三氧化二铝、氧化铝酸HCl:盐酸H2SO3:亚硫酸H2SO4:硫酸H2CO3:碳酸HNO3:硝酸碱NaOH:氢氧化钠、烧碱、火碱、苛性钠Ca(OH)2:氢氧化钙、熟石灰、消石灰Mg(OH)2:氢氧化镁KOH:氢氧化钾Al(OH)3:氢氧化铝Cu(OH)2:氢氧化铜Fe(OH)2:氢氧化亚铁Fe(OH)3:氢氧化铁Ba(OH)2:氢氧化钡盐NaCl:氯化钠Na2SO3:亚硫酸钠Na2SO4:硫酸钠Na2CO3:碳酸钠NaNO3:硝酸钠NaHCO3:碳酸氢钠KCl:氯化钾K2CO3:碳酸钾K2SO4:硫酸钾KNO3:硝酸钾CaCO3:碳酸钙、大理石、石灰石CaCl2:氯化钙CaSO4:硫酸钙Ca(NO3)2:硝酸钙MgCl2:氯化镁MgCO3:碳酸镁MgSO4:硫酸镁Mg(NO3)2:硝酸镁AlCl3:氯化铝Al2(SO4)3:硫酸铝Al(NO3)3:硝酸铝BaCl2:氯化钡BaSO4:硫酸钡BaCO3:碳酸钡Ba(NO3)2:硝酸钡ZnCl2:氯化锌Zn(NO3)2:硝酸锌CuCl2:氯化铜ZnSO4:硫酸锌AgCl:氯化银CuSO4:硫酸铜蓝色溶液AgNO3:硝酸银Cu(NO3)2:硝酸铜KMnO4:高锰酸钾FeCl2:氯化亚铁K2MnO4:锰酸钾FeSO4:硫酸亚铁浅绿色液体KClO3:氯酸钾Fe(NO3)2:硝酸亚铁Fe(NO3)3:硝酸铁FeCl3:氯化铁黄色液体Fe2(SO4)3:硫酸铁。
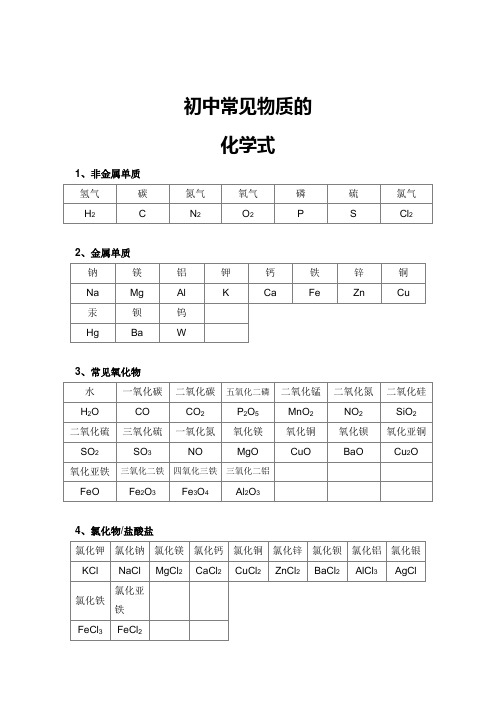
初三化学常见物质的化学式
1、单质:H2氢气O2氧气N2氮气C碳P磷S硫Fe铁Cu铜Hg汞
2、化合物
(1)氧化物:H2O水CO2二氧化碳CO一氧化碳SO2二氧化硫SO3三氧化硫
P2O5五氧化二磷Fe2O3氧化铁Fe3O4四氧化三铁CaO氧化钙MgO氧化镁
CuO氧化铜ZnO氧化锌FeO氧化亚铁MnO2二氧化锰 Na2O氧化钠
(2)酸:HCl盐酸H2SO4硫酸HNO3硝酸H3PO4磷酸H2CO3碳酸H2SO3亚硫酸
(3)碱:NaOH氢氧化钠KOH氢氧化钾Ca(OH)2氢氧化钙Ba(OH)2氢氧化钡Cu(OH)2氢氧化铜Fe(OH)3氢氧化铁Fe(OH)2氢氧化亚铁Al(OH)3氢氧化铝Mg(OH)2氢氧化镁(4)盐:NaCl氯化钠Na2CO3碳酸钠ZnCl2氯化锌CaCl2氯化钙KCl氯化钾Na2SO4硫酸钠
CuSO4硫酸铜AgCl氯化银FeCl3氯化铁FeCl2氯化亚铁AlCl3氯化铝FeSO4硫酸亚铁Fe2(SO4)3硫酸铁ZnSO4硫酸锌CaCO3碳酸钙BaCl2氯化钡BaSO4硫酸钡KClO3氯酸钾KMnO4高锰酸钾K2MnO4锰酸钾KNO3硝酸钾Cu(NO3)2硝酸铜Hg(NO3)2硝酸汞NH4Cl 氯化铵NH4NO3
硝酸铵(NH4)2SO4硫酸铵NH4HCO3碳酸氢铵NaHCO3碳酸氢钠Cu2(OH)2CO3碱式碳酸铜
(5)有机物:CH4甲烷C2H5OH乙醇(酒精)CH3OH甲醇CH3COOH乙酸(醋酸)CO(NH2)2
尿素,葡萄糖:C6H12O6淀粉:(C6H10O5)n
初三化学必需的记忆性知识
一、常见物质的颜色的状态
1、白色固体:MgO、P2O5、CaO、 NaOH、Ca(OH)
2、KClO
3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)
2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色
3、红色固体:Cu、Fe2O3、HgO、红磷▲硫:淡黄色▲ Cu2(OH)2CO3为绿色
4、溶液的颜色:凡含Cu2+的溶液呈蓝色(如:CuSO4溶液、CuCl2溶液、Cu(NO3)2溶液);凡含Fe2+的溶液呈浅绿色(如:FeSO4溶液、FeCl2溶液、Fe (NO3)2溶液);凡含Fe3+的溶液呈棕黄色(如:Fe2(SO4)3溶液、FeCl3溶液、Fe (NO3)3溶液),其余溶液一般为无色。
(高锰酸钾溶液为紫红色)
5、沉淀(即不溶于水的盐和碱):①盐:白色↓:CaCO3、BaCO3(溶于酸) AgCl、BaSO4(也不溶于稀HNO3) 等②碱:蓝色↓:Cu(OH)2红褐色↓:Fe(OH)3白色↓:其余不溶性碱为白色。
二、常见物质的学名、俗名及化学式
三、物质的溶解性:
1、气体:溶的:CO
2、HCl、SO2、NH3等。
不溶(或不易溶):O2、H2、CH4、CO、N2等。
2、金属氧化物:除CaO、Na2O、K2O、BaO溶外,大多数不溶
3、酸:大多数溶
4、碱:除氢氧化钡、氢氧化钾、氢氧化钙、氢氧化钠和氨水溶外,其他碱不溶于水
5、盐:含有钾、钠、硝酸根、铵根的盐都溶于水,含Cl-的盐只有AgCl不溶于水,其他都溶于水;含SO42-的盐只有BaSO4 不溶于水,其他都溶于水;含CO32-的盐只有含K+、Na+、NH4+溶于水,其他都不溶于水。
6、沉淀物中只有AgCl和BaSO4不溶于稀硝酸,Fe(OH)3是红褐色沉淀,Cu(OH)2是蓝色沉淀,其他沉淀是白色(包括Fe(OH)2)有以下常见的沉淀:Mg(OH)2 、Al(OH)3 CaCO3
BaCO3、Ag2 CO
等都溶于酸。
在推断题中,往沉淀物加稀硝酸:若讲沉淀不溶解,则沉3
淀中一定有AgCl或BaSO4 ;若讲沉淀全部溶解,则沉淀中一定没有AgCl或BaSO4 ;若讲沉淀部分溶解,则沉淀中一定有AgCl或BaSO4 中的一种,且还有另一种可溶于稀硝酸的沉淀。
四、初中化学常见物质的性质归类:
(一)、初中化学中有毒的物质
1、有毒的固体:亚硝酸钠(NaNO2),乙酸铅等;
2、有毒的液体:汞,硫酸铜溶液,甲醇,含Ba2+的溶液(除BaSO4);
3、有毒的气体:CO,氮的氧化物,硫的氧化物。
(二)、初中化学敞口置于空气中质量改变的
1、质量增加的
(1)、由于吸水而增加的:氢氧化钠固体,氯化钙,氯化镁,浓硫酸;
(2)、由于跟水反应而增加的:氧化钙、氧化钡、氧化钾、氧化钠,硫酸铜;
(3)、由于跟二氧化碳反应而增加的:氢氧化钠,氢氧化钾,氢氧化钡,氢氧化钙;
2、质量减少的
(1)、由于挥发而减少的:浓盐酸,浓硝酸,酒精,汽油,浓氨水;
(2)、由于风化而减少的:碳酸钠晶体。
*露置在空气中质量减少或变质的东西应密封保存
*凡在空气中易吸水的物质,可作干燥剂,常用的有NaOH、浓H2SO4、CaO、无水CaCl2。
无水CuSO4检测液体是否含H2O。
3、金属+酸→盐+H2↑中:
①等质量金属跟足量酸反应,放出氢气由多至少的顺序:Al>Mg>Fe>Zn
②等质量的不同酸跟足量的金属反应,酸的相对分子质量越小放出氢气越多。
③等质量的同种酸跟足量的不同金属反应,放出的氢气一样多。
④在金属+酸→盐+H2↑反应后,溶液质量变重,金属变轻。
4、金属+盐溶液→新金属+新盐中:
①金属的相对原子质量>新金属的相对原子质量时,反应后溶液的质量变重,金属变轻。
②金属的相对原子质量<新金属的相对原子质量时,反应后溶液的质量变轻,金属变重。
(三)、物质放入水中的热效应:
1、放入水中放热的有:氧化钙、氢氧化钠固体、浓硫酸
2、放入水中吸热的有:铵盐、干冰
(四)、其它
1.具有还原性的物质有:C、H2、CO。
2.具有氧化性的物质有:O2、CO2、浓硫酸、硝酸。
3.具有可燃性的物质有:C、H2、CO、CH4、C2H5OH、CH3OH。
4.具有吸水性的物质有:固体NaOH、CaO、碱石灰、固体CaCl2、固体MgCl2、无水CuSO4、
浓硫酸,因此它们都能作干燥剂。
但不能与被干燥的物质反应。
5.具有挥发性的物质有:盐酸、硝酸、乙醇(酒精)、醋酸、浓氨水。
6.既不溶于水,又不溶于酸的物质有:AgCl、BaSO4。
五、理论中的记忆性知识:
1、常见元素的化合价:
一价钾钠氢与银,二价钙镁钡与锌,三价金属元素铝;一五七变价氯,二四五氮,硫四六,三五有磷,二四碳;一二铜,二三铁,二四六七锰特别。
(正价)
*任何化合物中各元素的化合价代数和为0。
*单质中元素的化合价为0。
2、常见原子团的化合价:
SO 42-、CO 32-、NO 3-、OH -、ClO 3-、PO 43-、NH 4+ 3、金属活动性顺序:
金属活动性顺序由强至弱:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au (按顺序背诵)
钾钙钠镁铝 锌铁锡铅(氢) 铜汞银铂金
4、实验中的规律:
①凡用固体加热制取气体的都选用高锰酸钾制O 2装置(固固加热型);
凡用固体与液体反应且不需加热制气体的都选用双氧水制O 2装置(固液不加热型)。
②凡是给试管固体加热,都要先预热,试管口都应略向下倾斜。
③凡是生成的气体难溶于水(不与水反应)的,都可用排水法收集。
凡是生成的气体密度比空气大的,都可用向上排空气法收集。
凡是生成的气体密度比空气小的,都可用向下排空气法收集。
④凡是制气体实验时,先要检查装置的气密性,导管应露出橡皮塞1-2ml ,铁夹应夹在距管口1/3处。
⑤凡是用长颈漏斗制气体实验时,长颈漏斗的末端管口应插入液面下。
⑥凡是点燃可燃性气体时,一定先要检验它的纯度。
⑦凡是使用有毒气体做实验时,最后一定要处理尾气。
⑧凡是使用还原性气体还原金属氧化物时,一定是“一通、二点、三灭、四停” 5、化学实验基本操作口诀:
固体需匙或纸槽,一送二竖三弹弹;块固还是镊子好,一横二放三慢竖。
液体应盛细口瓶,手贴标签再倾倒。
读数要与切面平,仰视偏低俯视高。
滴管滴加捏胶头,垂直悬空不玷污,不平不倒不乱放,用完清洗莫忘记。
托盘天平须放平,游码旋螺针对中;左放物来右放码,镊子夹大后夹小; 试纸测液先剪小,玻棒沾液测最好。
试纸测气先湿润,粘在棒上向气靠。
酒灯加热用外焰,三分之二为界限。
硫酸入水搅不停,慢慢注入防沸溅。
实验先查气密性,隔网加热杯和瓶。
排水集气完毕后,先撤导管后移灯。
6、初中化学溶液的酸碱度和酸碱性: PH : 223②显碱性的溶液PH 》7:碱溶液和CaO、Na2O、K2O、BaO、NH3等水溶液及碳酸钠、碳酸氢钠溶液
③显中性的溶液PH =7:水和大多数的盐溶液 7.有沉淀生成的反应有:
① B a2++SO 42-=B aSO 4↓ ②Ag ++Cl -=AgCl ↓ ③除K+、Na+外的金属离子+CO3-
=难溶性碳酸盐↓
④除K+、Na+、Ca+、Ba+外的金属离子+OH-
=难溶性碱↓。