化学平衡常数学案
- 格式:doc
- 大小:112.50 KB
- 文档页数:4

第4课时 化学平衡常数[核心素养发展目标] 1.证据推理:通过化学平衡状态时的浓度数据分析,认识化学平衡常数的概念,并能分析推测其相关应用。
2.模型认知:构建化学平衡常数相关计算的思维模型(三段式法),理清计算的思路,灵活解答各类问题。
一、化学平衡常数1.化学平衡常数的概念在一定温度下,当一个可逆反应达到化学平衡时,生成物 与反应物 的比值是一个常数(简称 ),用符号K 表示。
2.化学平衡常数的表达式对于一般的可逆反应,m A(g)+n B(g)⇌p C(g)+q D(g),当在一定温度下达到平衡时,K = 。
注意:化学平衡常数表达式中各物质的浓度必须是平衡时的浓度,且不出现固体或纯液体的浓度。
3.化学平衡常数的意义平衡常数的大小反映了化学反应进行的 (也叫 )。
K 值越大,表示反应进行得越 ,反应物转化率越 ; K 值越小,表示反应进行得越 ,反应物转化率越 。
4.化学平衡常数的影响因素在化学方程式一定的情况下,K 只受温度影响。
(1)对于可逆反应,改变外界条件使平衡向正反应方向移动,平衡常数一定增大( ) (2)K 值越大,表明可逆反应正向进行的程度越大( ) (3)K 值越大,该可逆反应的速率越快( )(4)对于一个可逆反应达到平衡状态后,改变条件使K 值改变,平衡一定发生移动( ) (5)化学方程式中的固态或纯液态物质的浓度不能代入平衡常数表达式( )1.写出下列反应的化学平衡常数表达式。
N 2(g)+3H 2(g)2NH 3(g) K 1=______________;12N 2(g)+32H 2(g)NH 3(g) K 2=_____________________________________________;2NH 3(g)N 2(g)+3H 2(g) K 3=______________;由K 1、K 3可知,同一可逆反应的正向反应和逆向反应的平衡常数________________,由K 1、K 2可知化学方程式的化学计量数变为原来的12倍,化学平衡常数__________________。

化学平衡常数(一课时)班级:姓名:小组:。
【学习目标】1.学生结合P28-29,记忆平衡常数定义,能根据表达式书写方法,正确书写给定方程式表达式。
2.学生结合表达式与方程式关系,找出反应方程式中影响K的因素并利用规律进行K计算。
3.学生结合P29记忆能影响K的因素,说出完全反应时K的大小,并利用K判断转化率大小。
4.学生结合P30例1,利用三段式及K的表达式及计算过程能规范书写计算步骤。
【重点难点】重点:记忆化学平衡常数表达式,影响因素并进行计算。
难点:利用化学平衡常数只与温度有关进行计算。
【导学流程】一、基础感知1. 结合P28-29,完成以下内容:1)默背平衡常数定义、符号及表达式书写方法。
思考:定义中的浓度幂之积,浓度指达到什么时候的值?幂如何确定?2)根据K的书写方法书写下列反应的表达式。
①Cr2O72-(aq) + H2O(l) 2CrO42-(aq) + 2H+(aq) K1=② 3Fe(s) + 4H2O(g) Fe3O4(s) + 4H2(g) K2=③ 2NO2(g)N2O4(g)K3 = N2O4(g)2NO2(g)K4 =NO2(g)1/2N2O4(g)K5=④ H2(g)+S(s)H2S(g)K6 = S(s)+O2(g)SO2(g) K7 =H2(g)+SO2(g) O2(g)+H2S(g)K8 =思考:①K表达式中对物质状态有何要求?②N2(g)+3H2(g) 2NH3(g)ΔH<0,温度升高时,平衡如何移动?K如何变?压强升高时,平衡如何移动?K如何变?③K 时,我们认为反应进行完全。
④K越大,反应进行的程度是否越大?转化率是否越高?⑤K增大时,平衡是否一定会移动?平衡移动,K是否一定会变化?3.已知:mA(g)+nB(g)=pC(g) + qD(g)在任意时刻都符合则Q c与K含义有何不同?Q c>K时,平衡如何移动?Q c<K时,平衡如何移动?Q c=K时,平衡是否移动?1.由基础感知1的2)③可以得出什么规律?(从正、逆反应平衡常数关系和K与系数关系角度)2.由基础感知1的2)④讨论方程式相加时,K之间有何关系?方程式相减,K之间如何计算?组议:将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s) NH3(g)+HI(g);②2HI(g) H2(g)+I2(g)达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数(单位:mol2·L-2)为?。

化学平衡常数学案化学平衡常数是中学化学中一个重要的概念,它是指在一定条件下,可逆反应达到平衡状态时,反应物和生成物浓度之间的关系。
化学平衡常数的计算和应用是中学化学中的重要内容,也是学生掌握化学反应原理的基础。
一、引言化学平衡常数是化学中的一个重要概念,它反映了在一定条件下,可逆反应达到平衡状态时,反应物和生成物浓度之间的关系。
在中学化学中,掌握化学平衡常数的计算和应用是学习化学反应原理的基础。
二、化学平衡常数的定义和计算化学平衡常数是指一定条件下,可逆反应达到平衡状态时,反应物和生成物浓度之间的比值。
其数学表达式为:K = [C]^p / [D]^q其中,K为化学平衡常数,[C]和[D]分别为反应物和生成物的浓度,p和q 为反应方程中的系数。
化学平衡常数的计算需要先测定反应物和生成物的初始浓度,然后根据反应方程计算出反应过程中各物质的浓度变化,最终根据K的数学表达式计算出化学平衡常数。
具体计算方法可参考中学化学教材。
三、实际应用化学平衡常数在化学反应原理的研究中有广泛的应用。
例如,通过测定化学平衡常数,可以判断反应是否达到平衡状态,进而分析反应进行的程度和速度。
此外,化学平衡常数还可以用于计算反应的标准自由能变和反应速率常数等重要参数。
在工业生产中,化学平衡常数也有着重要的应用。
例如,在化工生产中,通过调节反应物和生成物的浓度,使反应向生成物的方向进行,从而提高产物的产量。
此外,在环境保护中,化学平衡常数也可以用于研究污染物在环境中的迁移转化规律,为污染治理提供理论依据。
四、总结化学平衡常数是中学化学中一个重要的概念,它反映了在一定条件下,可逆反应达到平衡状态时,反应物和生成物浓度之间的关系。
通过掌握化学平衡常数的计算和应用,可以深入理解化学反应原理,为今后的学习和工作打下坚实的基础。
化学平衡常数在工业生产、环境保护等领域也有着广泛的应用,对于促进经济发展和保护环境具有重要意义。
化学平衡化学平衡常数化学平衡是化学反应中一个重要的概念,它描述了可逆反应在一定条件下达到平衡状态时反应物和生成物的浓度关系。
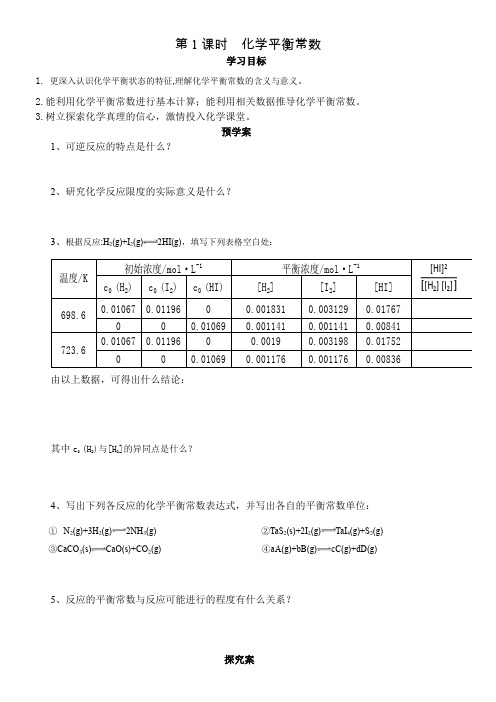
第1课时 化学平衡常数学习目标1. 更深入认识化学平衡状态的特征,理解化学平衡常数的含义与意义。
2.能利用化学平衡常数进行基本计算;能利用相关数据推导化学平衡常数。
3.树立探索化学真理的信心,激情投入化学课堂。
预学案1、可逆反应的特点是什么?2、研究化学反应限度的实际意义是什么?3、根据反应:H 2(g )+I 2(g )2HI (g ),填写下列表格空白处:c 0 (H 2)c 0 (I 2)c 0 (HI)[H 2][I 2][HI]0.010670.0119600.0018310.0031290.01767000.010690.0011410.0011410.008410.010670.0119600.00190.0031980.0175200.010690.0011760.0011760.00836温度/K 初始浓度/mol·L -1平衡浓度/mol·L -1698.6723.6由以上数据,可得出什么结论:其中c 0 (H 2)与[H 2]的异同点是什么?4、写出下列各反应的化学平衡常数表达式,并写出各自的平衡常数单位:① N 2(g )+3H 2(g )2NH 3(g ) ②TaS 2(s )+2I 2(g )TaI 4(g )+S 2(g ) ③CaCO 3(s )CaO (s )+CO 2(g ) ④a A (g )+b B (g )c C (g )+d D (g )5、反应的平衡常数与反应可能进行的程度有什么关系?探究案探究一:同反应不同表达式之间化学平衡常数间的关系:1、反应N2(g)+3H2(g)2NH3(g)的平衡常数为K1;NH3(g) 2 N2(g)+3H2(g)的平衡常数为K2,则K1与K2的关系如何?2、反应:N2(g)+3H2(g)2NH3(g)的平衡常数为K1,NH3(g)N2(g)+H2(g)的平衡常数为K2,则K1与K2的关系如何?探究二:浓度商与化学反应平衡常数之间的关系:吸热反应:N2(g)+O2(g)2NO(g),在2000℃时,K=6.2×10-4.2000℃时,在10L密闭容器内放入2.94×10-3molNO、2.50×10-1mol N2和4.00×10-2mol O2,通过计算回答:⑴此反应的初始状态是否为平衡状态,判断依据是什么?⑵若不是平衡状态,反应将向哪个方向移动,判断依据是什么?⑶总结浓度商与化学反应平衡常数之间的关系:课堂练习1、.对反应:2HBr(g)Br2(g)+H2(g)而言,当容积一定或混合气体的密度一定时,能否认为该反应达到平衡状态?2、已知反应:X(g)+Y(g)Z(g)在不同温度下的平衡常数如下:温度60 ℃90 ℃K10050则温度为70 ℃时,反应:Z(g)X(g)+Y(g)的平衡常数K可能为()。

化学一轮复习《化学平衡常数》复习学案【考纲要求】1.了解化学平衡常数(K)的含义,能利用化学平衡常数进行相关计算。
2.能正确计算化学反应的转化率(α)。
【学习目标】1.能熟练准确写出各类平衡常数的表达式,清楚平衡常数的意义及影响因素。
2.能综合题目中各种信息,熟练列出三行式计算化学平衡常数。
3.了解化学平衡常数及其他各类平衡常数的意义,初步建立大平衡思想。
【学习过程】课前活动平衡常数的含义与表达式活动元一平衡常数的计算活动形式活动过程与结果审题识图规范书写审题识表规范书写归纳总结思维建模1.根据图像信息计算平衡常数:【例1】[2018全国Ⅲ节选]对于反应2SiHCl3(g)==SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
343K温度下对应的平衡常数K=________(保留2位小数)。
➢请规范列出计算过程:2.根据表格数据计算平衡常数:【例2】[2015全国Ⅰ节选]Bodensteins研究了下列反应:2HI(g)①H2(g)+I2(g)ΔH=+11 kJ·mol-1。
在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:t/min020*********x(HI)10.910.850.8150.7950.784x(HI)00.600.730.7730.7800.784根据上述实验结果,该反应的平衡常数K的计算式为____________________。
➢请规范列出计算过程:自主练习规范书写自主练习规范书写3.恒压条件下K p的计算:【例3】[2020全国Ⅱ,节选]乙烷在一定条件可发生如下反应:C2H6(g)= C2H4(g)+H2(g) 。
向容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。
反应的平衡常数K p=_________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。

《化学平衡常数》教学设计《《化学平衡常数》教学设计》这是优秀的教学设计文章,希望可以对您的学习工作中带来帮助!教学设计模板课题摘要学科化学学段第一学期年级高二单元第二单元教材版本苏教版课程名称化学平衡常数一、学习内容分析1.教材分析【学习背景】“化学平衡常数”位于苏教版《化学》专题2第二单元《化学反应的方向和限度》,前两节是化学反应速率的相关内容,属于化学动力学范畴;后两节是化学平衡的相关内容,属于化学热力学范畴。
化学平衡中共3个板块:可逆反应、化学平衡状态、化学平衡常数。
化学平衡常数是热力学常数,用于定量表征化学反应限度,揭示平衡本质,利于学生科学分析化学平衡及其移动规律。
【学习内容前后联系】必修阶段学生主要建立“可逆反应”、“化学平衡状态”和“化学平衡移动”三个概念;发展至选修化4学反应原理阶段,通过本专题学习,学生建立好利用K、Q关系分析平衡移动的思路,进而能够以K 为工具对各类平衡进行分析。
在这过程中,学生对化学反应限度的认识由定性认识上升到定量认识,由孤立认识发展到受环境影响的系统认识,由静态认识上身到动态认识。
【学习内容的地位与作用】化学平衡常数K是新课程中的新增内容,课标对此明确提出“知道化学平衡常数的含义 , 能利用化学平衡常数计算反应的转化率”。
事实上,“化学平衡常数”的提出具有两个重要意义:其一,弄清其概念,能增进对化学反应限度和化学平衡移动规律的理解;其二,掌握其计算,比较其与浓度商Qc的关系,能帮助学生掌握判断平衡移动方向的方法与思路,而这二者是“化学反应限度”的学习难点,也是后续溶液中的离子平衡学习的基础。
因此,化学平衡常数为学生提供了理性分析的思维“支架”,笔者在“化学平衡常数”和“平衡移动理论”的教学顺序上作了调整;同时,化学平衡常数本身是基于实验数据的分析得出的概念,反映化学研究的基本方法与思想,体现了新课程中化学教育提升学生科学素养的宗旨。
2.学情分析【知识基础】通过对化学平衡状态的学习,学生已经知道化学平衡具有“逆、等、动、定、变”五个基本特征,对于达到平衡状态的化学反应而言,各组分浓度不再变化。

高中化学化学平衡常数教案
教学目标:
1. 了解化学平衡反应的定义和特点。
2. 掌握化学平衡常数的概念及其计算方法。
3. 通过实例掌握如何应用化学平衡常数。
教学重点:
1. 化学平衡反应的定义和特点。
2. 化学平衡常数的计算方法。
3. 化学平衡常数的应用。
教学难点:
1. 化学平衡常数的概念理解。
2. 化学平衡常数的计算方法掌握。
教学准备:
1. PPT课件。
2. 化学平衡实验器材。
3. 化学平衡实验材料。
教学过程:
一、导入(5分钟)
老师引入化学平衡反应的概念和特点,让学生了解化学平衡反应的定义及其特点。
二、讲解化学平衡常数(10分钟)
1. 介绍化学平衡常数的概念。
2. 讲解化学平衡常数的计算方法。
3. 举例说明如何应用化学平衡常数。
三、实验操作(15分钟)
老师带领学生进行化学平衡实验,让学生通过实际操作体会化学平衡反应的变化过程。
四、讲解实验结果(10分钟)
根据实验结果,讲解化学平衡常数的应用及计算方法。
五、小结(5分钟)
总结本节课的内容,强调化学平衡常数的重要性和应用。
六、课堂练习(15分钟)
布置相关练习,让学生巩固所学知识。
七、作业布置(5分钟)
布置相关作业,让学生巩固所学内容。
教学反思:
通过本节课的教学,学生对化学平衡常数的概念和计算方法有了初步了解,并通过实验实践加深了对化学平衡反应的理解。
在今后的教学中,需要激发学生的学习兴趣,多使用案例和实验让学生加深对知识的理解和应用。

第25讲 化学平衡常数及其计算【考纲要求】1.了解化学平衡常数(K )的含义。
2.能利用化学平衡常数进行相关计算。
3.能正确计算化学反应的转化率(α)考点一 化学平衡常数【基础梳理】 一、化学平衡常数 1.概念在一定温度下,当一个可逆反应达到化学平衡时,生成物 与反应物 的比值是一个常数,称为化学平衡常数,用符号K 表示。
2.表达式对于反应m A(g)+n B(g)p C(g)+q D(g),K =c p (C )·c q (D )c m (A )·c n (B )(固体和纯液体的浓度视为常数,通常不计入平衡常数表达式中)。
3.实例化学方程式平衡常数 关系式 N 2(g)+3H 2(g)2NH 3(g) K 1= K 2=K 1(或121K )K 3=1K 112N 2(g)+32H 2(g) NH 3(g)K 2= 2NH 3(g)N 2(g)+3H 2(g)K 3=4.意义(1)K 值越大,反应物的转化率 ,正反应进行的程度 。
(2)K 只受 影响,与反应物或生成物的浓度变化无关。
(3)化学平衡常数是指某一具体反应的平衡常数。
5.化学平衡常数的两大应用 (1)判断化学反应进行的方向 对于可逆反应a A(g)+b B(g)c C(g)+d D(g),在一定温度下的任意时刻,反应物与生成物浓度有如下关系:c c (C )·cd (D )c a (A )·c b (B )=Q c ,称为浓度商。
Q c ⎩⎪⎨⎪⎧<K 反应向正反应方向进行,v 正>v 逆=K 反应处于化学平衡状态,v 正=v 逆>K 反应向逆反应方向进行,v 正<v 逆(2)判断可逆反应的热效应[基点小练]1.判断正误(正确的打“√”,错误的打“×”)。
(1)平衡常数表达式中,可以是物质的任一浓度( ) (2)温度、浓度、压强、催化剂均能改变平衡常数( ) (3)升高温度,平衡常数一定增大( )(4)平衡常数变化,化学平衡不一定发生移动( ) (5)化学平衡发生移动,平衡常数一定改变( ) 2.书写下列化学平衡的平衡常数表达式。

化学平衡常数导学案【学习目标】1.理解化学平衡常数的含义,能正确书写平衡常数表达式;2.能利用化学平衡常数判断反响进行的程度;3.能进行有关化学平衡常数的简单计算。
【学习重点】化学平衡常数的含义、平衡常数的应用、有关平衡常数的简单计算。
【学习难点】有关平衡常数的简单计算。
【学习过程】【课前预习】阅读教材P28—31内容,完成以下填空。
1.化学平衡状态是指在一定条件下的反响,当正、逆反响的速率,反响体系中所有物质的质量或浓度保持的状态。
2.如果改变影响平衡的条件之一〔如温度、压强、浓度〕,平衡将向着能够这种改变的方向移动,这就是著名的勒夏特列原理。
例如:升高温度平衡向着方向移动,降低温度平衡向着方向移动。
3.某一反响物的平衡转化率α=4.化学平衡计算的根本模式——“三行式〞例: a A + bB c C + d D起始量:m n 0 0变化量:ax平衡量:5.请完成以下表格〔要求计算出具体数值〕,并思考在不同起始浓度下达平衡时,反响物和生成物浓度之间有何定量关系。
表1:2NO起始浓度/mol·L-1平衡浓度/mol·L-1平衡时浓度关系NO2N2O4NO2N2O42.00×10-20 6.32×10-3 6.84×10-33.00×10-20 8.00×10-3 1.10×10-20 2.00×10-29.46×10-3 1.52×10-20 2.28×10-28.86×10-2【课中互动解疑】活动形式过程和结果分析思考、讨论、交流阅读教材,完成填空【思考与交流】分析表格数据,总结归纳在不同起始浓度下达平衡时,反响物浓度与生成物浓度之间有怎样的定量关系。
三、化学平衡常数1.定义:在一定下,当一个可逆反响到达时,浓度幂之积与浓度幂之积的比值是一个常数,这个常数就是该反响的化学平衡常数〔简称平衡常数〕,符号为。

第4课时 化学平衡常数【目标要求】1.知道化学平衡常数的含义。
2.能运用化学平衡常数对化学反应进行的程度做出判断。
3.能利用化学平衡常数计算反应物的转化率。
【重、难点】化学平衡常数与化学平衡计算 基础落实:1.含义在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数(简称平衡常数),用符号“K ”表示。
2.表达式对于一般的可逆反应:m A(g)+n B(g)p C(g)+q D(g),当在一定温度下达到化学平衡状态时,平衡常数的表达式为:K =c p C ·c q Dc m A ·c n B 。
3.意义(1)K 值越大,说明正反应进行的程度越大,反应物的转化率越大;反之进行的程度就越小,转化率就越小。
(2)K 只受温度影响,与反应物或生成物的浓度变化无关。
4.反应物的转化率某指定反应物的转化率α=Δn n 始×100%=Δcc 始×100%。
【对点训练】:知识点一 化学平衡常数的概念 1.对于3Fe +4H 2O(g)Fe 3O 4+4H 2(g),反应的化学平衡常数的表达式为( )A .K =c Fe 3O 4·c H 2c Fe ·c H 2OB .K =c Fe 3O 4·c 4H 2c Fe ·c 4H 2OC .K =c 4H 2O c 4H 2D .K =c 4H 2c 4H 2O2.关于化学平衡常数的叙述,正确的是( )A .只与化学反应方程式本身和温度有关B .与化学反应本身和温度有关,并且会受到起始浓度的影响C .只与反应的温度有关D .只与化学反应本身有关,与其他任何条件无关的一个不变的常数 知识点二 平衡常数的应用 3.1 000 K 时反应C(s)+2H 2(g )CH 4(g)的K =8.28×107,当各气体物质的量浓度分别为H 20.7mol·L-1、CH 40.2mol·L-1时,上述反应高温( )A .正向移动B .逆向移动C .达到平衡D .不一定 4.放热反应CO(g)+H 2O(g)CO 2(g)+H 2(g)在温度t 1时达到平衡,c 1(CO)=c 1(H 2O)=1.0mol·L -1,其平衡常数为K 1。

化学平衡常数知识点二 化学平衡常数⑴定义:在一定温度下,当一个可逆反应达到化学平衡时,的比值是一个常数,这个常数就是该反应的化学平衡常数(简称平衡常数),用符号 表示。
如:mA(g) + nB(g) pC(g) + qD(g),K =⑵注意:①对于有 或 参加的反应,它们的浓度不列入平衡常数的表达式。
②只受 影响。
不指明温度,K 值无意义。
K 值与反应物或生成物的 无关,只要温度不变,平衡常数保持不变。
③化学平衡常数是指某一具体反应的平衡常数。
若反应方向改变,则平衡常数 (填“改变” 或“不变”,下同)。
若方程式中各物质的系数等倍扩大或缩小,尽管是同一反应,平衡常数 。
探究二 平衡常数表达式根据平衡常数的定义,写出下表中的反应的平衡常数表达式与单位,并讨论下面的问题。
反 应 K单位1 1/2N 2(g)+3/2H 2(g)NH 3(g)2 N 2(g)+3H 2(g)2NH 3(g)3 2NH 3(g)N 2(g)+3H 2(g)4CH 3COOH (aq )CH 3COO -(aq )+H +(aq )53Fe (s )+4H 2O (g )Fe 3O 4(s )+4H 2(g )6BaSO 4(s )Ba 2+(aq )+ SO 42-(aq )1、对于一个反应,其平衡常数的表达式是唯一的吗?平衡常数的表达式与哪些因素有关?2、对于一个反应,其正反应和逆反应的平衡常数之间有什么关系?3、如果浓度的单位为mol ·L -1,代入平衡常数表达式写出K 的单位。
化学平衡常数有统一固定单位吗?K 的单位与化学方程式之间有什么关系? 探究三 平衡常数的应用对于化学反应a A (g )+bB (g )cC (g )+dD (g )的任意状态时,浓度商)()()()(B C A C D C C C Q b a d c ⋅⋅=①若Q>K ,说明反应 ②若Q=K ,说明反应 ③若Q<K ,说明反应 ◆ 典例分析(Ⅰ)已知在448 ℃时,反应H 2(g)+I 2(g) 2HI(g)的平衡常数K 1为49,则该温度下反应2HI(g)H 2(g)+I 2(g)平衡常数K 2为________;反应12H 2(g)+12I 2(g)HI(g)的平衡常数K 3为________。
第二章
第三节化学平衡常数学案
【学习目标】
1、知道化学平衡常数的涵义,会根据化学反应书写化学平衡常数表达式。
2、能利用化学平衡常数计算反应物的转化率。
3、理解平衡常数的重要意义。
【重、难点】化学平衡常数的意义;化学平衡常数的有关计算。
【自主学习】已知反应H2 (g)+I2 (g) 2HI (g) △H< 0。
在425.6℃和525.6℃时分别用不同起始浓度的H2、I2(g)、HI进行反应,平衡后得到以下实验数据。
表一
温度序
号
初始浓度(mol/L)平衡浓度(mol/L)平衡时c(H2) c(I2) c(HI) c(H2) c(I2) c(HI)
425.6℃①
0.010
67
0.0119
6
0.0018
31
0.0031
29
0.017
67 ②
0.011
35
0.0090
44
0.0035
60
0.0012
50
0.015
59
③0 0
0.010
69
0.0011
41
0.0011
41
0.008
410
表二
温度序
号
初始浓度(mol/L)平衡浓度(mol/L)平衡时c(H2) c(I2) c(HI) c(H2) c(I2) c(HI)
525.6℃④
0.011
35
0.0090
44
0.0045
6
0.0019
5
0.0085
9 ⑤0 0
0.01
655
0.0033
9
0.0033
9
0.0097
7
⑥0 0
0.0125
8
0.0025
8
0.0025
8
0.0074
2
一化学平衡常数:
定义
二化学平衡常数的表达式
mA(g) + nB(g) pC(g) + qD(g),当在一定温度下达到平衡时,平衡常数的表达式为:三影响化学平衡的因素
四化学方程式的书写
化学反应K表达式
1 1/2N2(g)+3/2H2(g) NH3(g)△H<0 K1 =
2 N2(g)+3H2(g) 2NH3(g)△H<0 K2 =
3 2NH3(g) N2(g)+3 H2(g)△H>0 K3 =
4 CaCO3(s)CaO(s)+CO2(g) △H>0 K4 =
5 Cr2O72-(aq)+ H2O(l)2CrO42- (aq)+ 2H+(aq) K5=
6 FeCl3(aq)+3KSCN(aq)Fe(SCN)3(aq)+3KCl(aq) K6=
思考:① K1和 K2, K2和 K3的之间的关系是什么?
②书写化学平衡常数表达式时应注意哪些问题?
五化学平衡的意义
(1)判断可逆反应进行的程度
表格一:下表为25 ℃时,卤化氢生成反应的平衡常数
化学方程式平衡常数K
F2+H2 2HF 6.5×1095
Cl2+H2 2HCl 2.57×1033
Br2+H2 2HBr 1.91×1095
I2+H2 2HI 8.67×102
形成规律
(2)判断可逆反应是否达到平衡及反应进行的方向
在一定温度下,对于可逆反应mA(g) + nB(g) pC(g) + qD(g) 的任意时刻,生成物浓度幂之积与反应物浓度幂之积的比值(称为浓度商Q C)与平衡常数K 的大小与反应进行方向的关系:
(3)判断反应的热量变化
下表为反应N 2(g)+3H2(g) 2NH3(g) ΔH<0 的平衡常数K与温度T的关系反应温度T/K 373 473 573 673 773
K 3.35×109 1.00×107 2.45×105 1.88×104 2.99×103
下表为反应CO2(g)+H2(g)CO(g)+H2O(g) ΔH>0 的平衡常数K和温度T的关系
反应温度T/℃700 800 830 1000 1200
K0.6 0.9 1.0 1.7 2.6
形成规律
练习:下表为I 2(g)+H2(g)2HI (g) 的平衡常数与温度的关系
反应温度T/K 623 698 763
K66.9 54.4 45.9
则该反应的ΔH_______0(“<”、“>”)
六化学平衡常数的计算
例一:在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,充分反应,
达到平衡后,测得C(H2)=0.0080mol/L.
(1)求该反应的平衡常数
(2)在上述温度下,容器中若通入H2和I2蒸气各0.20 mol.求达到化学平衡状态时H2的转
化率
例二:在容积固定的密闭容器中,将2.0molCO与10molH2O混合加热到800℃,达到下
列平衡:
CO(g)+H 2O(g) CO 2(g)+H 2(g) K=1.0
求平衡时CO 转化为CO 2的转化率。
习题巩固
1.对于反应3Fe(s)+4H 2O(g) Fe 3O 4(s)+4H 2(g)的平衡常数,下列说法正确的是( )
A .K =c 4(H 2)·c (Fe 3O 4)c 3(Fe)·c 4(H 2O)
B .K =c 4(H 2)
c 4(H 2O)
C .增大c (H 2O)或减小c (H 2),会使该反应平衡常数减小
D .改变反应的温度,平衡常数不一定变化 2.关于化学平衡常数的叙述,正确的是( )
A .只与化学反应方程式本身和温度有关
B .只与反应的温度有关
C .与化学反应本身和温度有关,并且会受到起始浓度的影响
D .只与化学反应本身有关,与其他任何条件无关的一个不变的常数 3.900 K 时反应C(s)+2H 2(g) CH 4(g)的K =8.28×107,当各气体物质的量浓度分别
为H 2 0.7 mol·
L -1、CH 4 0.2 mol·L -1时,上述反应( ) A .正反应方向进行 B .逆反应方向进行 C .平衡状态 D .不一定 4.298 K 时,各反应的平衡常数如下:
①N 2(g)+O 2(g)
2NO(g),K =1×10-30; ②2H 2(g)+O 2(g)
2H 2O(g),K =2×1081; ③2CO 2(g)
2CO(g)+O 2(g),K =4×10-92 则常温下,NO 、H 2O 、CO 2这三个化合物分解放氧的倾向最大的是( ) A .① B .② C .③ D .无法判断 5.对于可逆反应:C(s)+CO 2(g) 2CO(g),在一定温度下,其平衡常数为K ,下列条件的变化中,能使K 发生变化的是 ( )
A .将C(s)的表面积增大
B .增大体系的压强
C .升高体系的温度
D .使用合适的催化剂。