碱金属和卤族元素
- 格式:ppt
- 大小:3.85 MB
- 文档页数:38


卤族元素与碱金属反应
卤族元素(如氟、氯、溴、碘等)与碱金属(如钠、钾、锂等)在一定条件下可以发生化学反应。
这些反应通常涉及元素的氧化还原过程。
以下是卤族元素与碱金属可能发生的一些化学反应:
1.置换反应:卤族元素可以与碱金属发生置换反应,生成相应的碱金属卤化物。
例如,钠可以与氯反应生成氯化钠(NaCl),钾可以与溴反应生成溴化钾(KBr)等。
2.氧化还原反应:卤族元素具有较高的氧化性,而碱金属具有较低的氧化性,因此当它们相互作用时,可能发生氧化还原反应。
例如,氟可以氧化锂生成氟化锂(LiF)和氧气,氯可以氧化钠生成氯化钠(NaCl)和氧气等。
3.配合反应:卤族元素还可以与碱金属发生配合反应,生成配合物。
例如,溴可以与钠生成溴化钠(NaBr),其中溴原子与钠原子之间通过配位键结合。
需要注意的是,卤族元素与碱金属的反应性取决于多种因素,包括反应物的浓度、温度、压力等。
此外,不同的卤族元素与不同的碱金属之间也可能存在不同的反应性和产物。
因此,具体的反应条件和产物需要结合实验来确定。



元素周期表中的主族元素元素周期表是化学中的重要工具,它将元素按照一定规律排列。
其中,主族元素是指周期表中第1A到第8A族元素,也就是代表性元素。
这些元素具有共性,其化学性质也有规律可循。
本文将介绍元素周期表中的主族元素,以及它们在日常生活中的应用。
一、第1A族元素 - 碱金属碱金属是元素周期表中的第1A族元素。
它们包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
这些元素具有低密度、低熔点和非常活泼的化学性质。
碱金属在自然界中以化合物的形式存在,比如氯化钠(NaCl),它是我们常见的食盐。
此外,钾和铷还用于冶金工业中的合金制备。
二、第2A族元素 - 碱土金属碱土金属是元素周期表中的第2A族元素。
它们包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)。
与碱金属相比,碱土金属的化学性质更为稳定。
它们在自然界中以氧化物和硫化物的形式广泛存在。
钙是人体骨骼、牙齿的重要组成元素,被广泛应用于医药和建筑材料制造。
镁用于制备轻便合金,广泛应用于航空航天领域。
三、第3A族元素 - 硼族元素硼族元素是元素周期表中的第3A族元素。
它们包括硼(B)、铝(Al)、镓(Ga)、铟(In)、铊(Tl)和镓(Uut)。
这些元素的数量较少,化学性质各异。
铝是最常见的硼族元素,具有良好的导电性和导热性,广泛应用于建筑、汽车和航空领域。
四、第4A族元素 - 碳族元素碳族元素是元素周期表中的第4A族元素。
它们包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb)和镤(Fl)。
碳是生命的基础,几乎所有有机物都含有碳元素。
硅在电子工业中应用广泛,是半导体材料的重要组成部分。
锡和铅常用于合金制备,具有良好的焊接性能。
五、第5A族元素 - 氮族元素氮族元素是元素周期表中的第5A族元素。
它们包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)和镤(Mc)。
氮是地球大气中的主要成分,也是生物体内常见的元素。


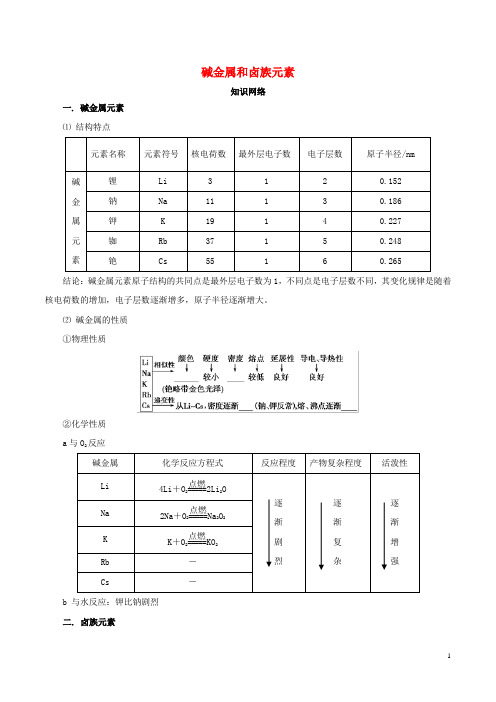
碱金属和卤族元素知识网络一. 碱金属元素 ⑴ 结构特点元素名称元素符号 核电荷数 最外层电子数电子层数原子半径/nm 碱金属 元素锂 Li 3 1 2 0.152 钠 Na 11 1 3 0.186 钾 K 19 1 4 0.227 铷 Rb 37 1 5 0.248 铯Cs55160.265结论:碱金属元素原子结构的共同点是最外层电子数为1,不同点是电子层数不同,其变化规律是随着核电荷数的增加,电子层数逐渐增多,原子半径逐渐增大。
⑵ 碱金属的性质 ①物理性质②化学性质 a 与O 2反应碱金属 化学反应方程式 反应程度产物复杂程度活泼性Li 4Li +O 2=====点燃2Li 2O 逐 渐 剧 烈逐 渐 复 杂逐 渐 增 强Na 2Na +O 2=====点燃Na 2O 2 K K +O 2=====点燃KO 2Rb - Cs-b 与水反应:钾比钠剧烈 二. 卤族元素⑴原子结构元素名称 氟(F) 氯(Cl) 溴(Br) 碘(I) 原子序数 9 17 35 53 最外层电子数 7 7 7 7 电子层数2345结论:卤族元素原子结构的共同点是最外层电子数为7,不同点是电子层数不同,其变化规律是随着原子序数增大,电子层数逐渐增多,原子半径逐渐增大。
⑵ 卤族元素单质的性质 ①物理性质F 2 Cl 2 Br 2 I 2颜色: ———————————————————→浅黄绿色 黄绿色 深红棕色 紫黑色颜色变深 熔、沸点:———————————————————→ 气体 气体 液体 固体 逐渐升高 密度:———————————————————→ 逐渐 增大 水溶性:———————————————————→反应 溶解 溶解 微溶 逐渐减小 ②化学性质 a 与H 2反应反应条件 化学方程式 产物稳定性 F 2 无 H 2+F 2=2HF 最稳定 Cl 2 光或点燃 H 2+Cl 2=2HCl 稳定 Br 2 加热 H 2+Br 2=2HBr 较稳定I 2加热H 2+I 22HI 较不稳定,可逆结论:从F 2到I 2,与H 2反应所需要的条件逐渐升高,反应剧烈程度依次减弱,生成气态氢化物的稳定性依次减弱。


卤族元素和碱金属元素反应生成的是什么键?在化学元素中,卤族元素和碱金属元素都是常见的元素之一。
它们在化学反应中会发生相互作用,产生各种化合物。
那么,当卤族元素和碱金属元素发生化学反应时,会生成什么样的键呢?这是一个需要深入探讨的问题。
1. 卤族元素和碱金属元素简介让我们简单了解一下卤族元素和碱金属元素。
卤族元素位于周期表的第七族,包括氟(F)、氯(Cl)、溴(Br)和碘(I)等元素。
这些元素在化合物中通常表现为负离子,具有较强的化学活性。
而碱金属元素位于周期表的第一族,包括锂(Li)、钠(Na)、钾(K)等元素。
这些金属元素通常以阳离子的形式存在,同样具有较强的化学活性。
2. 化学反应过程当卤族元素和碱金属元素发生化学反应时,会发生离子键的形成。
以氯气与钠金属反应为例,化学方程式如下所示:2Na + Cl2 -> 2NaCl在这个反应中,钠金属失去一个电子形成Na+离子,而氯气接受一个电子形成Cl-离子。
由于钠离子的正电荷和氯离子的负电荷之间存在电荷吸引力,它们之间会形成离子键。
这种离子键是由阳离子和阴离子之间的强烈电荷吸引力形成的,具有很强的结合能力。
3. 总结当卤族元素和碱金属元素发生化学反应时,生成的是离子键。
这种键形成于阳离子和阴离子之间,具有很强的结合能力。
通过对这一反应过程的深入理解,我们能够更好地把握化学元素之间的相互作用,为化学实验和工业生产提供指导。
4. 个人观点个人认为,了解化学元素的反应特性对于我们理解化学原理和应用具有重要意义。
在今后的学习和工作中,我会继续深入探讨化学元素之间的反应特性,不断丰富自己的化学知识,为科学研究和实践工作做出贡献。
通过以上文章的撰写,我对卤族元素和碱金属元素反应生成的键有了更深入的理解。
希望这篇文章能够对您有所帮助,如有任何疑问或补充,请随时与我联系。
祝好!此为示例文章,非真实事例。
化学反应是化学领域中的重要概念,而卤族元素和碱金属元素的反应更是化学领域中的经典反应之一。


初中化学元素周期表:碱金属和卤素的性质一、碱金属的性质1. 碱金属的基本特点碱金属是元素周期表中位于第ⅠA族的六种金属元素,包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
碱金属具有以下基本特点:- 电子排布:碱金属原子具有一个外层电子,这个外层电子容易失去形成离子。
- 亲电性:碱金属的亲电性很强,即它们喜欢与非金属形成离子键。
- 密度和熔点:由于原子半径大、原子间距小,因此碱金属具有较低的密度和较低的熔点。
- 反应活泼:由于它们易失去外层电子形成阳离子,在水和氧气等常见物质中也能进行激烈反应。
2. 碱金属与水的反应碱金属与水发生剧烈反应,并放出大量氢气。
以钠与水反应为例:2Na(s) + 2H₂O(l) → 2NaOH(aq) + H₂(g)该反应产生了氢氧化钠溶液和氢气。
反应过程中会出现发烟、冒火、溅射的现象。
3. 碱金属与酸的反应碱金属与酸产生中和反应,生成相应的盐和水。
以钠与盐酸反应为例:2Na(s) + 2HCl(aq) → 2NaCl(aq) + H₂(g)该反应生成了氯化钠盐和氢气。
4. 碱金属离子的颜色特点碱金属离子在化合物中具有不同的颜色特点。
例如,铷离子(Rb⁺)在溶液中呈紫色,锂离子(Li⁺)呈红色。
二、卤素的性质1. 卤素的基本特点卤素是元素周期表第ⅦA族五种非金属元素,包括氟(F)、氯(Cl)、溴(Br)、碘(I)和铯(Cl)。
卤素具有以下特点:- 在自然界中多以单质形式存在。
- 高电负性:由于原子结构中外层电子云稳定且容易吸引电子,因此卤素都具有很高的电负性。
- 卤素分子是由两个相同原子组成的双原值分子。
2. 卤素的物理性质卤素在常温下呈现不同的颜色,氟元素无色、氯元素淡黄绿色、溴元素深红褐色和碘元素紫黑色。
此外,卤素具有以下物理性质:- 摩尔质量:由于原子量的增加,摩尔质量也相应增大。
- 密度:随着原子半径增加,密度也会增加。
- 熔点和沸点:从氟到碘,熔点和沸点依次升高。


金属(jiǎn jīn shǔ)是元素周期表中第IA族元素锂、钠、钾、铷、铯、钫六种金属元素的统称,也是它们对应单质的统称。
(钫因为是放射性元素所以通常不予考虑)因它们的氢氧化物都易溶于水(除LiOH溶解度稍小外),且呈强碱性,故此命名为碱金属。
氢虽然是第IA族元素,但它在普通状况下是双原子气体,不会呈金属状态。
只有在极端情况下(1.4兆大压力),电子可在不同氢原子之间流动,变成金属氢。
碱金属盐类溶解性的最大特点是易溶性,它们的盐类大都易溶于水。
已知LiF,Li2CO3,Li3PO4及固体Li2SiO3是难溶(微溶)的,少数大的阴离子的碱金属盐也是难溶的,如Na2C2H5N4O3(脲酸钠)、Na[Sb(OH)6](六羟基合锑酸钠)、K2PtCl6(氯铂酸钾)、KClO4(高氯酸钾)、KHC4H4O6(酒石酸氢钾)等。
它们在溶液中完全电离。
碱金属都是银白色的(铯略带金黄色),比较软的金属,密度比较小,熔点和沸点都比较低。
他们生成化合物时都是正一价阳离子,碱金属原子失去电子变为离子时最外层一般是8个电子,但锂离子最外层只有2个电子。
在古代埃及把天然的碳酸钠叫做neter或nitrum,在洗涤时使用。
14世纪时,阿拉伯人称植物的灰烬为kali,逐渐演变到叫做碱,但这时钠和钾的区别还不清楚,统称为苏打(soda)。
一直到18世纪才分清从食盐得到的泡碱和从植物灰得到的钾碱不是同一种东西。
碱金属都能和水发生激烈的反应,生成强碱性的氢氧化物,随原子量增大反应能力越强。
在氢气中,碱金属都生成白色粉末状的氢化物。
碱金属都可在氯气中燃烧,而碱金属中只有锂能在常温下与氮气反应。
由于碱金属化学性质都很活泼,为了防止与空气中的水发生反应,一般将他们放在煤油或石蜡中保存。
碱金属都是活泼金属。
碱金属单质以金属键相结合。
因原子体积较大,只有一个电子参加成键,所以在固体中原子间相互作用较弱。
碱金属的熔点和沸点都较低,硬度较小(如钠和钾可用小刀切割)。