抗体纯化手册-
- 格式:pdf
- 大小:493.45 KB
- 文档页数:16

之老阳三干创作抗体的纯化第一节硫酸铵沉淀法基来源根基理硫酸铵沉淀法可用于从大量粗制剂中浓缩和部分纯化蛋白质。
用此方法可以将主要的免疫球蛋白从样品中分离,是免疫球蛋白分离的经常使用方法。
高浓度的盐离子在蛋白质溶液中可与蛋白质竞争水分子,从而破坏蛋白质概况的水化膜,降低其溶解度,使之从溶液中沉淀出来。
各种蛋白质的溶解度分歧,因而可利用分歧浓度的盐溶液来沉淀分歧的蛋白质。
这种方法称之为盐析。
盐浓度通经常使用饱和度来暗示。
硫酸铵因其溶解度大,温度系数小和不容易使蛋白质变性而应用最广。
试剂及仪器· 组织培养上清液、血清样品或腹水等· 硫酸铵(NH4)SO4 · 饱和硫酸铵溶液(SAS)· 蒸馏水· PBS(含0.2g/L叠氮钠) (见附录一)· 透析袋· 超速离心机· pH计· 磁力搅拌器实验步调以腹水或组织培养上清液为例来介绍抗体的硫酸铵沉淀。
各种分歧的免疫球蛋白盐析所需硫酸铵的饱和度也不完全相同。
通经常使用来分离抗体的硫酸铵饱和度为33%—50%。
一、配制饱和硫酸铵溶液(SAS)将767g(NH4)2SO4 边搅拌边慢慢加到1升蒸馏水中。
用氨水或硫酸调到pH7.0。
此即饱和度为100%的硫酸铵溶液(4.1 mol/L, 25°C);其它分歧饱和度硫酸铵溶液的配制见表1;二、沉淀1、样品(如腹水)20 000´g 离心30 min,除去细胞碎片;2、保存上清液并丈量体积;3、边搅拌边慢慢加入等体积的SAS到上清液中,终浓度为1:1(v/v);4、将溶液放在磁力搅拌器上搅拌6小时或搅拌过夜(4°C),使蛋白质充分沉淀。
三、透析1、蛋白质溶液10 000´g 离心30 min (4°C)。
弃上清保存沉淀;2、将沉淀溶于少量(10-20ml)PBS-0.2g/L叠氮钠中。

一、抗体纯化部分1、腹水/血清的亚型测定完成后,IgG亚型的腹水/血清使用Protein G 抗体纯化柱纯化;IgM亚型的腹水/血清则使用饱和硫酸铵沉淀法沉淀。
1.1 Protein G 抗体纯化步骤:(1)新柱子先用DDW 5ml过柱;(2)10倍柱体积的Binding Buffer (pH 7.0) 平衡纯化小柱;(3)抗体过柱,过程中要求缓慢过柱,以求抗体蛋白更好的结合在结合位点上;(4)继续10倍柱体积的Binding Buffer (pH 7.0) 平衡纯化小柱;(5)5倍柱体积甘氨酸-盐酸缓冲液(pH 2.7)洗脱结合位点上的抗体,并加入Tris-HCI(pH9.0)中和甘氨酸,使pH保持为适合抗体保存的中性;(6)10倍柱体积的Binding Buffer (pH 7.0) 平衡纯化小柱;(7)5倍柱体积20%乙醇溶液过柱,于4℃条件下保存纯化小柱;(8)将洗脱的抗体用聚乙二醇浓缩并透析,以彻底去除不相干离子。
其中所用试剂配方:DDW:超纯水Binding Buffer(100ml):A液,0.2M磷酸氢二钠61mlB液,0.2M磷酸二氢钠39ml磷酸氢二钠4.37g 磷酸二氢钠1.22g甘氨酸-盐酸缓冲液:0.1M甘氨酸溶液加浓盐酸调pH 2.7Tris-HCL缓冲液:1M Tris溶液加浓盐酸调pH 9.01.2 饱和硫酸铵沉淀法步骤:(1)配制饱和硫酸铵溶液,再用氨水调节pH至8.5(2)沉淀:a、腹水/血清离心去除细胞碎片,保留上清液并测定体积;b、边搅拌边逐滴滴入等体积的饱和硫酸铵溶液,搅拌均匀使蛋白充分沉淀;c、上述蛋白质溶液经过离心弃上清取沉淀,并用PBS溶液(pH 7.0)溶解;d、继续向上一步蛋白溶液中滴入1/2体积的饱和硫酸铵溶液,搅拌均匀使蛋白充分沉淀;e、继续离心沉淀弃上清去沉淀,用PBS溶液(pH 7.0)溶解;(3)透析:每隔3-6小时换一次透析液,以彻底去除硫酸铵。

抗体纯化的基本流程一、引言抗体是一种特殊的蛋白质,可以识别并结合到特定的抗原上。
在生物医学研究中,抗体被广泛应用于诊断、治疗和基础研究等领域。
抗体纯化是制备高纯度抗体的重要步骤之一,本文将介绍抗体纯化的基本流程。
二、前期准备1.选择适当的来源:根据需要选择合适的来源,如小鼠、兔子等。
2.免疫原制备:根据需要制备相应的免疫原。
3.动物免疫:将免疫原注射到动物体内进行免疫。
三、收集血清1.采集血液:在动物免疫后,采集相应量的血液。
2.离心分离血清:将采集到的血液离心分离出血清。
四、初步纯化1.蛋白A亲和层析:将血清通过蛋白A亲和层析柱进行初步纯化。
蛋白A是与IgG亚类结合较紧密的亲和素。
2.洗脱:通过改变pH值或盐浓度等条件,将与蛋白A柱结合的IgG 洗脱下来。
五、中期纯化1.离子交换层析:将初步纯化后的IgG通过离子交换层析柱进行中期纯化。
选择适当的离子交换树脂,使得IgG可以被结合并随后洗脱。
2.洗脱:通过改变盐浓度或pH值等条件,将与离子交换树脂结合的IgG洗脱下来。
六、后期纯化1.凝胶过滤层析:将中期纯化后的IgG通过凝胶过滤层析柱进行后期纯化。
选择适当的凝胶过滤树脂,使得IgG可以在某一分子量范围内被分离出来。
2.洗脱:将分离出来的IgG进行洗脱,并进行最终检测。
七、总结抗体纯化是制备高质量抗体的重要步骤之一。
本文介绍了抗体纯化的基本流程,包括前期准备、收集血清、初步纯化、中期纯化和后期纯化等步骤。
在实际操作中,应根据具体情况选择适当的方法和条件,以获得高纯度的抗体。

抗体的纯化第一节硫酸铵沉淀法基本原理硫酸铵沉淀法可用于从大量粗制剂中浓缩和部分纯化蛋白质。
用此方法可以将主要的免疫球蛋白从样品中分离,是免疫球蛋白分离的常用方法。
高浓度的盐离子在蛋白质溶液中可与蛋白质竞争水分子,从而破坏蛋白质表面的水化膜,降低其溶解度,使之从溶液中沉淀出来。
各种蛋白质的溶解度不同,因而可利用不同浓度的盐溶液来沉淀不同的蛋白质。
这种方法称之为盐析。
盐浓度通常用饱和度来表示。
硫酸铵因其溶解度大,温度系数小和不易使蛋白质变性而应用最广。
试剂及仪器· 组织培养上清液、血清样品或腹水等· 硫酸铵(NH4)SO4 · 饱和硫酸铵溶液(SAS)· 蒸馏水· PBS(含0.2g/L叠氮钠) (见附录一)· 透析袋· 超速离心机· pH计· 磁力搅拌器实验步骤以腹水或组织培养上清液为例来介绍抗体的硫酸铵沉淀。
各种不同的免疫球蛋白盐析所需硫酸铵的饱和度也不完全相同。
通常用来分离抗体的硫酸铵饱和度为33%—50%。
一、配制饱和硫酸铵溶液(SAS)将767g(NH4)2SO4 边搅拌边慢慢加到1升蒸馏水中。
用氨水或硫酸调到pH7.0。
此即饱和度为100%的硫酸铵溶液( 4.1 mol/L, 25°C);其它不同饱和度硫酸铵溶液的配制见表1;二、沉淀1、样品(如腹水)20 000´g 离心30 min,除去细胞碎片;2、保留上清液并测量体积;3、边搅拌边慢慢加入等体积的SAS到上清液中,终浓度为1:1(v/v);4、将溶液放在磁力搅拌器上搅拌6小时或搅拌过夜(4°C),使蛋白质充分沉淀。
三、透析1、蛋白质溶液10 000´g 离心30 min(4°C)。
弃上清保留沉淀;2、将沉淀溶于少量(10-20ml)PBS-0.2g/L 叠氮钠中。
沉淀溶解后放入透析袋对PBS-0.2g/L 叠氮钠透析24-48小时(4°C),每隔3-6 小时换透析缓冲液一次,以彻底除去硫酸氨;3、透析液离心,测定上清液中蛋白质含量。



抗体P r o t e i n A纯化方法-CAL-FENGHAI.-(YICAI)-Company One1抗体ProteinA纯化一.P roteinA柱子的制备1.配制溶液;结合/洗涤缓冲液:NaCl,;Na2HPO4,20mM ;。
配制500ml的方法:称取NaCl ,Na2HPO4溶解于450ml的双蒸水中。
调节PH为,补加双蒸水至总体积500ml。
2. 制备空柱子(1)先打开用过的PD-10上盖,拿掉上面的盖膜。
盖上盖子,摇晃,倒去里面的填料,用PBS清洗3次。
(2)用胶带固定好PD-10空柱子,要求垂直放置。
(3)在PD-10空柱子里加入2ml的Binding Wash buffer.结合缓冲液。
(4)ProteinA填料混匀,(10ml包装一小瓶)。
(5)加入5ml的ProteinA到柱子中。
(6)(7)(8)二.纯化步骤1.样品准备;将兔血清与结合缓冲液1:1混合,过滤(防止堵塞柱子)。
2.平衡柱子:用5-10倍体积的结合缓冲液过Protein A柱。
3.上样:将准备好的血清样品上样,根据柱子的结合能力考虑上样量的体积。
4.洗脱杂蛋白:用结合缓冲液冲洗柱子,直至结合液中不含蛋白。
5.收集抗体:用洗脱液过柱,同时收集漏出液(约3-4ml/管),直至漏出液中不含蛋白。
测定各收集管中的蛋白含量,合并蛋白管。
(注意:收集管中需事先加入约150ul的1M Tris-HCl缓冲液,防止抗体在过酸的环境下失活)6.柱子再生:用5-10倍体积的再生液再生柱子。
7.PBS透析收集的抗体。
三.试剂的制备1. 结合缓冲液1000ml 500ml甘氨酸氯化钠氢氧化钠调PH至2. 洗脱缓冲液500ml甘氨酸用盐酸调PH至3. 再生缓冲液500ml甘氨酸酸调PH至4.称取碱,加80毫升的双蒸水,溶解后用盐酸调节,补加到水100毫升,。


抗体纯化手册一、引言概述嘿,小伙伴们!咱们今天来讲讲抗体纯化这事儿呢。
抗体纯化啊,就像是从一堆杂物里把宝贝挑出来一样,超级有趣又特别重要。
在生物研究领域,抗体纯化可是相当关键的一步哦。
二、使用范围说明这个抗体纯化呢,在很多地方都能用得到。
比如在医学研究中,当我们想要研究某种疾病相关的抗体时,就需要把抗体纯化出来,这样才能准确地进行检测、分析啥的。
还有在生物制药方面,纯化后的抗体可以用来制作药物,治疗各种疾病。
三、操作步骤指南1. 样品准备首先得收集含有抗体的样品啦,这个样品可能来自细胞培养上清液,也可能是血清之类的。
收集的时候要小心哦,可不能把样品搞污染了。
就像你从果园里摘水果,要挑那些完好无损的一样。
然后对样品进行预处理,可能需要过滤一下,把那些大的杂质颗粒去掉。
这就像是筛沙子,把大石头筛出去,留下细沙一样。
2. 选择纯化方法有亲和纯化法,这是一种比较常用的方法。
就像磁铁吸引铁屑一样,亲和纯化利用抗体和特定配体之间的特异性结合来纯化抗体。
不过呢,这个方法需要先准备好合适的亲和介质哦。
离子交换纯化法也不错。
根据抗体的电荷性质,让它在离子交换柱上进行吸附和洗脱。
这就有点像按照颜色把小珠子分类,不同电荷的抗体就像不同颜色的珠子。
凝胶过滤纯化法呢,是根据抗体的大小来进行分离的。
大的分子先流出来,小的分子后流出来,就像大的球先从管道里滚出来,小的球后滚出来一样。
3. 进行纯化操作按照所选的纯化方法,把样品加到相应的柱子或者设备里。
如果是亲和纯化,要注意控制流速,不能太快,不然抗体和配体还没结合好就被冲走了。
这就像你浇水的时候,水流不能太急,不然种子会被冲走一样。
在洗脱的时候呢,要选择合适的洗脱液。
这个洗脱液的浓度啊、pH值啊都很重要。
就像调鸡尾酒,各种成分的比例要合适才能调出好喝的酒。
收集纯化后的抗体,要收集在干净、无菌的容器里。
这就像把采到的蜂蜜放在干净的罐子里一样。
四、功能特点介绍纯化后的抗体有很多厉害的地方哦。



抗体的纯化第一节硫酸铵沉淀法基本原理硫酸铵沉淀法可用于从大量粗制剂中浓缩和部分纯化蛋白质。
用此方法可以将主要的免疫球蛋白从样品中分离,是免疫球蛋白分离的常用方法。
高浓度的盐离子在蛋白质溶液中可与蛋白质竞争水分子,从而破坏蛋白质表面的水化膜,降低其溶解度,使之从溶液中沉淀出来。
各种蛋白质的溶解度不同,因而可利用不同浓度的盐溶液来沉淀不同的蛋白质。
这种方法称之为盐析。
盐浓度通常用饱和度来表示。
硫酸铵因其溶解度大,温度系数小和不易使蛋白质变性而应用最广。
试剂及仪器· 组织培养上清液、血清样品或腹水等· 硫酸铵(NH4)SO4 · 饱和硫酸铵溶液(SAS)· 蒸馏水· PBS(含0.2g/L叠氮钠) (见附录一)· 透析袋· 超速离心机· pH计· 磁力搅拌器实验步骤以腹水或组织培养上清液为例来介绍抗体的硫酸铵沉淀。
各种不同的免疫球蛋白盐析所需硫酸铵的饱和度也不完全相同。
通常用来分离抗体的硫酸铵饱和度为33%—50%。
一、配制饱和硫酸铵溶液(SAS)将767g (NH4)2SO4 边搅拌边慢慢加到1升蒸馏水中。
用氨水或硫酸调到pH7.0。
此即饱和度为100%的硫酸铵溶液(4.1 mol/L, 25°C);其它不同饱和度硫酸铵溶液的配制见表1;二、沉淀1、样品(如腹水)20 000´g 离心30 min,除去细胞碎片;2、保留上清液并测量体积;3、边搅拌边慢慢加入等体积的SAS到上清液中,终浓度为1:1(v/v);4、将溶液放在磁力搅拌器上搅拌6小时或搅拌过夜(4°C),使蛋白质充分沉淀。
三、透析1、蛋白质溶液10 000´g 离心30 min(4°C)。
弃上清保留沉淀;2、将沉淀溶于少量(10-20ml)PBS-0.2g/L叠氮钠中。
沉淀溶解后放入透析袋对PBS-0.2g/L 叠氮钠透析24-48小时(4°C),每隔3-6 小时换透析缓冲液一次,以彻底除去硫酸氨;3、透析液离心,测定上清液中蛋白质含量。

(关键词:抗体;抗体的提取与纯化;盐析法;冷酒精沉淀法;DEAE-SephadexA-50柱层析纯化免疫球蛋白;SPA-SepharoseCL-4B 亲合层析纯化IgG;离子交换层析)精制免疫球蛋白的方法很多。
一般采用综合技术,避免蛋白变性。
如分离IgG时,多结合使用盐析法与离子交换法,以求纯化。
提取IgM的方法也很多,如应用凝胶过滤与制备电泳法,或离子交换与凝胶过滤等。
一、盐析法取x ml血清加x ml生理盐水,于搅拌下逐滴加入2xml饱和硫酸铵,硫酸铵的终饱和度为50%。
↓4℃,3h以上,使其充分沉淀离心(3000rpm),20min,充上清,以xml生理盐水溶解沉淀,再逐滴加饱和硫酸铵x/2ml。
↓置4℃3h以上,[此时,(NH4)2SO4的饱和度为33%]重复上述第二步过程1~2次。
末次离心后所得沉淀物为γ-球蛋白,以0.02%mol/L pH7.4PBS溶解至xml装入透析袋。
↓对PBS充分透析、换液3次,至萘氏试剂测透析外液无黄色,即无NH4+为止。
取透析袋内样品少许作适当倍数稀释后,以751型紫外分光光度计测定蛋白含量。
影响盐析的因素很多,如蛋白质的浓度,盐的浓度,饱和度和pH,温度等都可影响盐析的结果,操作时要充分注意(参阅本章第二节)。
二、冷酒精沉淀法分离过程如下。
血清加3倍体积的蒸馏水,调节pH至7.7(±)冷却到0℃。
在激烈搅拌的条件下,加预冷的酒精(-20℃)到最终浓度为20%,保持在-5℃。
产生的沉淀(A),含有大多数种类的免疫球蛋白。
沉淀A悬浮于25倍体积的0.15~20mol/L NaCl溶液(冷)中,加有0.05mol/L醋酸调节pH到5.1,产生的沉淀(B),包括大部分的IgA 和IgM,IgG留在上清液内。
调节上清液的pH到7.4,加冷酒精(-20℃~-30℃)到最终浓度为25%,维持在-5℃。
所得到的沉淀(C)含有90%~98%IgG。
不同动物,IgG分离的条件和产量略有不同。

抗体的初步纯化与鉴定实验方案提要第三组:组长:曹婷组员:聂莉、许春燕、吴永琴、周姣一、实验主要内容1.兔抗人IgG抗体及鼠抗BSA抗体的初步纯化硫酸铵分级沉淀法一、材料与试剂配制1、硫酸铵饱和溶液将硫酸铵800g~850g 到 1 000ml H2O中加热至绝大部分溶质溶解为止,趁热过滤,置室温过夜,然后以28%NH3H2O调pH至7.02、0.01mol/L pH7.4的PB液A液:0.10mol/L NaH2PO4液称NaH2PO4·2H2O 15.60g,加入H2O至1000.mlB液:0.10mol/L Na2HPO4液称Na2HPO4·12H2O 35.80g,加入H2O至1 000ml取A液19ml,B液81ml加水至1000ml即可。
3、1%BaCl2溶液:称取1gBaCl2溶于100ml水中即可4、纳氏液HgI 115.00gKI 80.00g加H2O至500.00ml溶化后过滤,然后再加20%NaOH500.00ml,混合即可。
5、生理盐水:称取9克氯化钠,溶解在少量蒸馏水中,稀释到1000毫升。
6、透析袋:孔径为4KD的透析袋操作步骤1、动物血清的取得(1. 取血后,37℃下,让血液凝固1 到2 小时(不加抗凝剂);2. 4℃冰箱过夜(让血块固缩);3. 当血清自然析出后,4℃,3000 r/ min,离心10 min,分离血清,弃去不溶物;4. 将血清移至于灭菌后的100ml的烧杯中,并且估计血清的体积)假设获得的血清的体积为20ml(若体积有变化则按此比例进行适当的改变)向20ml血清中,加生理盐水20ml,再逐滴加入(NH4)2SO4饱和溶液10ml,使成20%(NH4)2SO4溶液,边加边搅拌,充分混合后,静置30min。
2、将静置好的溶液置于50ml的离心管中,离心,3000r/min,20min,弃去沉淀,以除去纤维蛋白,并且获得上清液,将上清液置于100ml的烧杯中。

抗原配体特异性纯化1. 抗原(抗体/蛋白)特异性亲和柱制备1.1 含氨基配体特异性亲和柱的制备1.1.1称取0.3 g溴化氰活化的琼脂糖凝胶(CNBr-activated Sepharose 4B)干粉加入1mM盐酸中,常温搅拌至少30min或者4℃过夜使其充分溶涨,0.3g可以获得1ml溶涨胶。
也可直接取1ml NHS 活化的琼脂糖凝胶。
1..12将凝胶转移入纯化柱中,用约30ml 1mM的HCl抽滤介质3次。
抽滤去除内部空气气泡。
1.1.3用5~10倍体积的超纯水清洗介质一遍,(留1~2倍体积超纯水将凝胶重悬起来)。
1.1.4将含氨基待偶联抗原/蛋白用偶联缓冲液(0.5M NaCl,0.1M NaHCO3,pH8.3)溶解成2mg/ml 浓度。
1.1.5将重悬的凝胶与待偶联抗原/蛋白-偶联缓冲液迅速混合,室温(25℃)反应2h以上,期间不断摇动,使其充分偶联反应;1.1.6偶联结束,取上清液检测是否还有游离未偶联的配体(蛋白或抗体),检测方法:用分光光度计直接检测计算,如果溶液中配体含量>0.2mg/mL,说明偶联饱和;否则重复第1.1.4~第1.1.5)步。
一般1ml凝胶可以偶联10mg抗体/蛋白配体。
1.1.7确认偶联完全后,取15ml封闭缓冲液(1M 乙醇胺,0.5M NaCl,pH8.3或0.1M Tris-Cl,pH8.5)室温(25℃)孵育2h或4 ℃过夜;1.1.8交替使用20ml的偶联缓冲液和20ml的乙酸盐缓冲液(0.5M NaCl,0.1M HAc-NaAc,pH4)洗凝胶柱4次;1.1.9亲和柱制备好后,用PBS平衡后即可用于抗体纯化;1.1.10如若暂不使用,用20%的乙醇(含20% 乙醇,0.02% NaN3的PBS)保存。
1.2 含巯基抗原/多肽特异性亲和柱的制备1.2.1 取适量Sulfolink Beads去掉保护剂,用3倍柱床体积的偶联缓冲液(50Mm Tris,5mM EDTA-Na,pH8.5)洗涤柱子3次。
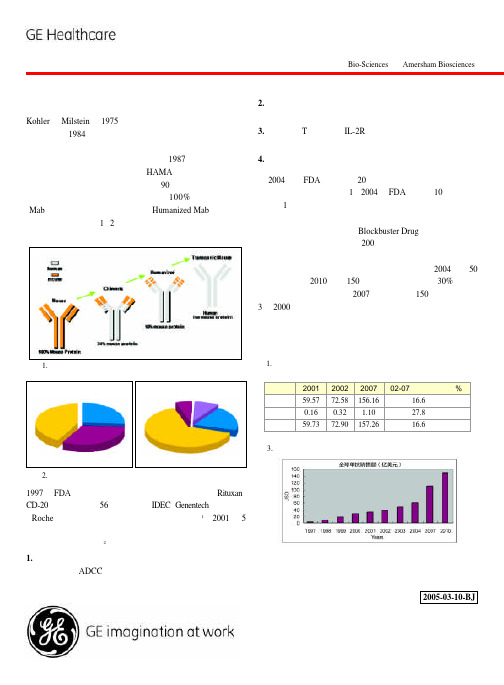
图1.治疗性单抗技术演化一、单抗技术的发展、应用和市场前景Kohler 和Milstein 于1975年发明了被称之为“魔弹”的单抗技术,并在1984年获得了诺贝尔奖。
单抗是B淋巴细胞和骨髓瘤细胞杂交形成的杂交瘤细胞产生,其重链和轻链所形成的结构域可以识别和结合特异性抗原。
1987年单抗技术被成功应用到诊断试剂当中,但由于HAMA (人抗鼠抗体) 反应,没能有效应用在人类疾病的治疗上。
90年代,随着基因工程技术的迅速发展,治疗性单抗从早期100%的鼠源性单抗(Mab ),到嵌合抗体,人源化抗体(Humanized Mab ),到近年的全人源性抗体 (图1、2),逐步消除了抗体的免疫源性问题,在保持对抗原高亲和力的同时,改善了抗体的药动力学。
1997年FDA 批准第一个治疗淋巴癌的嵌合单抗药物Rituxan ,CD-20上市,并进入56个国家,由IDEC /Genentech/Roche 三大药厂联合生产,至今仍然供不应求1。
2001年5月,《时代周刊》封面文章指出,治疗性单抗是人类与癌症战斗中的一次重大胜利2。
单抗药物的主要治疗机制是:1. 直接诱导癌细胞凋亡或抑制癌细胞生长和代谢,或通过 补体效应或ADCC (抗体依赖性细胞介导的细胞毒作用) 间接杀死癌细胞。
2. 癌症、心血管等疾病的导向治疗:以单抗荷载同位素、 毒素蛋白、抗生素等药物制成生物导弹。
3. 应用抗体T 细胞、抗IL-2R 的单抗防治器官移植排斥反 应等。
4. 以单抗制成避孕、传染病的预防药物。
至2004年,FDA 已批准了20多种治疗性单抗药物,约一半用于治疗癌症 (详见附录1,2004年FDA 批准了10个治疗用抗体,1个诊断用抗体),在治疗慢性疾病如关节炎方面也取得了显著的临床效果。
已上市抗体有不少已成为年销售额数亿美元的“重磅炸弹药物” (Blockbuster Drug )。
全球抗体药物的市场增长十分迅猛,有约200多种单抗在临床实验,占整个临床生物技术药品总数的三分之一多,其中四分之一在临床三期或等候批准。
预计单抗的全球销售额将从2004年的50多亿美金增至2010年的150亿美金,平均年增长30%。
预计整个抗体市场 (包括多抗) 2007年即将达到150多亿美金 (图3)。
2000年人类基因组序列初稿的完成,近年蛋白质组和结构基因组技术的蓬勃发展,也给抗体研究带来更多机遇和挑战。
国内正在推动的抗原表位组学、抗体组学和抗体药物组学,将对中国抗体技术的发展起到很大的促进作用。
抗体纯化手册孙文改 陈昕·通用电气(中国)医疗集团Bio-Sciences (原Amersham Biosciences)图3.全球单抗销售额趋势2005-03-10-BJ图2. 上市单抗的分布图51 正在临床试验的单抗分布51鼠源性单抗30%人源化抗体40%嵌合型抗体30%人源化抗体65%人源性抗体9%鼠源性单抗15%嵌合型抗体11%表1. 2007年全球治疗与诊断用抗体(单抗与多抗)市场预测(单位:亿美元)52利用DNA 重组技术,在全分子抗体往嵌合抗体及改型抗体的发展的同时,小分子及单链等基因工程抗体 (Gab ) 也得到了极大的发展 (表2)。
2.2 单抗特性及纯化策略每个单抗等电点、电荷密度、疏水性、糖基化程度等生化性质各不相同。
选择单抗的纯化方法,既要了解他们的共性,又要了解个性,从而制定相应的纯化策略 (下表3)。
二、单抗的结构、种类、性质及纯化策略概览2.1 单抗的结构和种类传统单抗的Y 型结构,由重链和轻链组成 (图4)。
图4. 全分子、小分子及单链抗体结构示意图表3. 单抗的基本性质表2. 基因工程抗体 (Genetically engineered antibody, Gab) 49、50图5. 抗体及主要杂蛋白等电点分布范围(右下图为抗体等电聚焦结果图:基因工程抗体(Gab)由于细胞培养过程带来的糖基化的不均一,等电点往往较分散而非单一条带)2.3 针对不同抗体和其生产宿主的特性制定纯化策略(下表4)* 需考虑不同宿主病毒灭活验证问题。
表4. 不同宿主生产抗体纯化策略三、不同亲和层析介质纯化单抗及优化策略3.1 Protein A Sepharose、rProtein A Sepharose亲和 层析介质与抗体的结合目前,约70-80%的抗体纯化使用了Protein A、Protein G亲和层析13。
A蛋白(Protein A)来源于金黄色葡萄球菌的一个株系。
A蛋白作为亲和配体被固定于琼脂糖上,它所包含的5个与IgG Fc段结合的结构域被空出来以便捕捉IgG。
1个A蛋白分子至少可以结合2个IgG。
A蛋白也可以结合另一些免疫球蛋白与如IgA、IgM。
天然和重组的A蛋白(rProtein A)对于IgG的Fc段有着相似的特异结合。
重组的A蛋白经改造后含有一个C末端半胱氨酸,可以单一位点固定于琼脂糖上,增加了与IgG的结合能力。
A蛋白与IgG的结合强度依赖于该抗体的物种来源,而其动态结合能力则决定于结合强度及其他因素(例如上样时的流速)。
3.2 Protein G Sepharose 亲和层析介质与抗体的结合G 蛋白是一种源自链球菌G 族的细胞表面蛋白,一种三型Fc 受体。
其通过类似于A 蛋白的非免疫机制与抗体的Fc 段结合。
像A 蛋白一样,G 蛋白与IgG 的Fc 区域特异性结合,不同的是,Protein G Sepharose 还可以特异性低亲和地与重链的C H 1及轻链的C 结合而用于纯化Fab 及F(ab’)2 54。
另外,Protein G 可以广泛、更强地结合许多类型的IgG ,多克隆IgG 及人IgG ,同时血清蛋白结合水平更低,纯度更高,配体脱落也相对更低。
3.3 Protein A 、Protein G 亲和层析方法优化14由于不同抗体与A 蛋白或G 蛋白的亲和力不同,有必要单独优化结合和洗脱条件和层析柱载量,过程可以通过用自动化层析系统如AKTA 来完成。
以下是一个杂交瘤细胞培养单抗的纯化条件探索 (表5,图6-9)。
图7. AKTA自动摸索HiTrap rProtein A FF最优pH洗脱条件: pH梯度从pH 7.4到pH3.03.4 MabSelect 系列——大规模抗体纯化亲和层析介 质16,17MabSelect 是一系列最新的大规模纯化抗体的亲和层析介质。
它们的特点包括:1. 更高的流速和动态载量:MabSelect的蛋白A配体经基因 工程改造,C端含一个半胱氨酸,形成一个定向的硫键 (见图11),同时增加了对IgG的有效结合。
蛋白A 和凝 胶交联时采用了全新的工艺流程,增加了介质的稳定性和 胶内孔的表面积,因此增加了流速和动态载量:在线形流 速为500 cm/hr和柱床高度为20 cm的条件下,每毫升 MabSelect的动态载量可以达到30多mg IgG (图10、12), 超过原来A蛋白介质数倍,在纯化特性方面也明显优于其 他几种蛋白A偶联的介质。
图10、12是几种不同的蛋白A 介质纯化人IgG 的动态载量与线形流速的比较。
近年来, CHO细胞单抗的表达量进一步提升到每升2-5克,因应市 场对更高载量蛋白A亲和介质的需求,2004年底推出的 MabSelect Xtra,载量又比普通MabSelect增加了30% 46。
优化条件优 化 过 程 优化目的、结果rProtein A 柱利用AKTA的自动探索功尽量避免杂蛋白的结合缓冲液能 (scouting ) 连续尝试不结合,在载量与纯NaCl 浓度同浓度的NaCl (0-3.5M )下度间取得平衡。
最单抗的载量和纯度。
佳条件为NaCl 2.5M 。
rProtein A 柱利用AKTA 的自动缓冲液避免剧烈的洗脱条洗脱pH配置功能 (bufferprep ) 在件 (如pH<3.0) 易导pH7-2.5范围逐步降低pH ,致抗体失活。
最佳找最佳的pH 洗脱条件。
在条件为pH 4.5。
洗脱缓冲液中加精氨酸,更利于保护抗体活性,提高回收率和防止抗体聚合15。
Superdex 200利用自动探索功能 (scout-去除微量杂质和二、柱上样量ing ) 尝试不同上样量 (1-5%多聚体,达到最终柱体积),并探索连续自动所需纯度。
进样的条件。
表5. 抗体层析方法优化图8. Superdex 200精细纯化图9. 全自动二维抗体纯化及纯化结果电泳图 (还原电泳)图6. AKTA自动摸索HiTrap rProtein A FF上样最优盐浓度0.20.40.60.81.0Total amount of hIgG applied (mg/ml adsorbent)图10. 蛋白A亲和凝胶载量测定2. 更低的宿主杂蛋白吸附,抗体纯度更高: 著名抗体生产商 IDEC公司的研究显示,MabSelect对CHO细胞宿主杂蛋 白的吸附比其它同类介质如Prosep-A低七倍,对其它小 分子杂质的吸附比Prosep-A更低数百倍以上48。
毫无疑 问,MabSelect所纯化的抗体纯度更高,这将大大有利于大 规模治疗性抗体的下游纯化。
3. 更低的蛋白A 脱落: MabSelect由于通过环氧共价交联,蛋 白A的脱落比其它同类介质低一半。
微量的脱落可以在后 续的层析中,如凝胶过滤或离子交换层析有效去除。
4. 更易于工艺的线性放大:通过实验室条件的优化,MabSelect可以在保持线性流速和上样比例等参数不变的条 件下,通过增加柱直径进行线性放大。
装填在内径为60- 80厘米层析柱时,可以在一个工作日处理超过上万升高表 达的抗体发酵液18。
5. MabSelect 易于清洗与除菌,寿命更长、更经济:在长期连 续的生产中,介质寿命是成本效益的一项重要指标。
蛋白 A配体常比一般层析介质的配基对在位清洗 (CIP) 试剂更 不稳定,有效的CIP有助延长介质使用寿命。
MabSelect的 CIP和除菌程序简单,一般用很常规和经济的试剂如50 mM NaOH+1M NaCl 或50 mM NaOH+0.5 M Na 2SO 4溶液就可以去除沉淀和变性物质;用非离子去污剂或酒精 可以去除通过疏水作用结合的物质;用0.1M醋酸和20%酒精可以除菌。
由于CIP所使用的化学试剂不能被重复使 用,CIP试剂的成本对整个生产成本的影响不容忽视。
某 些蛋白A介质使用尿素、盐酸胍等作为CIP试剂,长期的 CIP花费比蛋白A介质本身还高 (图13)。
经测试,Mabselect 配合CIP (50 mM NaOH+1 M NaCl) 纯化三百次后,纯 度与回收率不变 (图14)19,20。
2004年底新推出的MabSelect SuRe ,更可以直接用0.1 M NaOH 做CIP ,两百次后纯度 与回收率保持不变48。