结构化学 第三章习题(周公度)
- 格式:doc
- 大小:334.00 KB
- 文档页数:9

【1.15】已知在一维势箱中粒子的归一化波函数为()n n x x l πϕ=1,2,3n =⋅⋅⋅ 式中l 是势箱的长度,x 是粒子的坐标)x l <,求粒子的能量,以及坐标、动量的平均值。
解:(1)将能量算符直接作用于波函数,所得常数即为粒子的能量:222n222h d n πx h d n πx ˆH ψ(x )-)-)8πm d x l 8πm d x l ==(sin )n n n x l l l πππ=⨯-22222222()88n h n n x n h x m l l ml ππψπ=-⨯= 即:2228n h E ml =(2)由于ˆˆx ()(),x n n x c x ψψ≠无本征值,只能求粒子坐标的平均值:()()x l x n sin l x l x n sin l x x ˆx x l *ln l*n d 22d x 000⎰⎰⎰⎪⎪⎭⎫ ⎝⎛⎪⎪⎭⎫ ⎝⎛==ππψψ()x l x n cos x l dx l x n sin x l l l d 22122002⎰⎰⎪⎪⎪⎭⎫ ⎝⎛-=⎪⎭⎫ ⎝⎛=ππ2000122sin sin d 222l l l x l n x l n x x x l n l n l ππππ⎡⎤⎛⎫=-+⎢⎥ ⎪⎝⎭⎣⎦⎰ 2l =(3)由于()()ˆˆp,p x n n x x c x ψψ≠无本征值。
按下式计算p x的平均值:()()1*ˆd x n x n p x px x ψψ=⎰0d 2n x ih d n x x l dx l πππ⎛=- ⎝⎰20sin cos d 0l nih n x n x x l l l ππ=-=⎰【1.20】若在下一离子中运动的π电子可用一维势箱近似表示其运动特征:估计这一势箱的长度 1.3l nm =,根据能级公式222/8n E n h ml =估算π电子跃迁时所吸收的光的波长,并与实验值510.0nm 比较。

【1.3】金属钾的临阈频率为5.464×10-14s -1,如用它作为光电极的阴极当用波长为300nm 的紫外光照射该电池时,发射光电子的最大速度是多少?解:2012hv hv mv =+()1201812341419312 2.998102 6.62610 5.46410300109.10910h v v m m s J s s m kg υ------⎡⎤=⎢⎥⎣⎦⎡⎤⎛⎫⨯⨯⨯-⨯⎢⎥ ⎪⨯⎝⎭⎢⎥=⎢⎥⨯⎢⎥⎣⎦134141231512 6.62610 4.529109.109108.1210J s s kg m s ----⎡⎤⨯⨯⨯⨯=⎢⎥⨯⎣⎦=⨯【1.4】计算下列粒子的德布罗意波的波长: (a )质量为10-10kg ,运动速度为0.01m·s -1的尘埃;(b )动能为0.1eV 的中子; (c )动能为300eV 的自由电子。
解:根据关系式: (1)34221016.62610J s6.62610m 10kg 0.01m s h mv λ----⨯⋅===⨯⨯⋅34-11 (2) 9.40310mh p λ-==⨯ 34(3) 7.0810mh p λ-==⨯【1.7】子弹(质量0.01kg ,速度1000m ·s -1),尘埃(质量10-9kg ,速度10m ·s -1)、作布郎运动的花粉(质量10-13kg ,速度1m ·s -1)、原子中电子(速度1000 m ·s -1)等,其速度的不确定度均为原速度的10%,判断在确定这些质点位置时,不确定度关系是否有实际意义?解:按测不准关系,诸粒子的坐标的不确定度分别为: 子弹:343416.2610 6.63100.01100010%h J sx mm v kg m s ---⨯⋅∆===⨯⋅∆⨯⨯⋅尘埃:3425916.62610 6.6310101010%h J sx m m v kg m s ----⨯⋅∆===⨯⋅∆⨯⨯⋅花粉:34201316.62610 6.631010110%h J sx mm v kg m s ----⨯⋅∆===⨯⋅∆⨯⨯⋅电子:3463116.626107.27109.10910100010%h J s x m m v kg m s ----⨯⋅∆===⨯⋅∆⨯⨯⨯⋅ 【1.9】用不确定度关系说明光学光栅(周期约610m -)观察不到电子衍射(用100000V 电压加速电子)。

《结构化学》第三章习题答案3001 ( A, C )3002 H ab =∫ψa [-21∇2- a r 1 - br 1 +R 1 ] ψb d τ =E H S ab + R 1 S ab - ∫a r 1ψa ψb d τ= E H S ab + K因 E H = -13.6e V , S ab 为正值,故第一项为负值; 在分子的核间距条件下, K 为负值。
所以 H ab 为负值。
3003 ∫ψg ψu d τ=(4 - 4S 2)-1/2∫(ψa s 1+ψb s 1)((ψa s 1-ψb s 1)d τ = (4 - 4S 2)-1/2∫[ψa s 12 -ψb s 12 ] d τ= (4 - 4S 2)-1/2 [ 1 - 1 ] = 0故相互正交。
3004 ( C )3006 描述分子中单个电子空间运动状态的波函数叫分子轨道。
两个近似 (1) 波恩 - 奥本海默近似 ( 核质量 >> 电子质量 )(2) 单电子近似 (定态)3007 单个电子3008 (B)3009 (1) 能级高低相近(2) 对称性匹配(3) 轨道最大重叠3010 不正确3011 (B)3012 ψ= (0.8)1/2φA + (0.2)1/2φB3013 能量相近, 对称性匹配, 最大重叠> , < 或 < , >3014 正确3015 不正确3016 σ π π δ30173018 z3019 (C)3020 π3021 σ轨道: s -s , s -p z , s -d z , p z –p z , p z -2z d , 2z d -2z d ,π轨道p x –p x ,p x –d xz ,p y –p y ,p y –d yz ,d yz –d yz ,d xz –d xzδ轨道:d xy -d xy , d 22y x -- d 22y x -3022 σ δ π 不能 不能3023 (B)3024 原子轨道对 分子轨道p z -d xy ×p x -d xz πd 22y x -- d 22y x - δ2z d -2z d σp x –p x π3025 1σ22σ21π43σ2 , 3 , 反磁3026 d xy , δ3027 p y , d xy3028 C 2 ( 1σg )2( 1σu )2( 1πu )2+2 s -p 混杂显著.因1σu 为弱反键,而1σg 和1πu 均为强成键,故键级在2-3之间.3029 N 2: (1σg )2(1σu )2(1πu )4(2σg )2O 2: σ2s 2σ2s σ2pz 2π2px 2π2py 2π2px *π2py *1或 ( 1σg )2(1σu )22σg 2(1πu )4(1πg )23030 ( 1σg )2( 1σu )2( 1πu )4( 2σg )2的三重键为 1 个σ键 (1σg )2,2个π键 (1πu )4,键级为 3( 1σu )2和(2σg )2分别具有弱反键和弱成键性质, 实际上成为参加成键作用很小的两对孤对电子,可记为 :N ≡N: 。




习题1. CO 是一个极性较小的分子还是极性较大的分子?其偶极矩的方向如何?为什么?2. 下列AB型分子:N2,NO,O2,C2,F2,CN,CO,XeF中,哪几个是得电子变为AB–后比原来中性分子键能大?哪几个是失电子变为AB+ 后比原来中性分子键能大?3. 按分子轨道理论说明Cl2的键比Cl2+ 的键强还是弱?为什么?4. 下列分子中,键能比其正离子的键能小的是____________________ 。
键能比其负离子的键能小的是________________________ 。
O2,NO,CN,C2,F25. 比较下列各对分子和离子的键能大小:N2,N2+( )O2,O2+( )OF,OF–( )CF,CF+( )Cl2,Cl2+( )6. 写出O2+,O2,O2–和O22–的键级、键长长短次序及磁性。
7. 按分子轨道理论写出NF,NF+ 和NF–基态时的电子组态,说明它们的键级、不成对电子数和磁性。
8. 判断NO 和CO 哪一个的第一电离能小,原因是什么?9. HF分子以何种键结合?写出这个键的完全波函数。
10.试用分子轨道理论讨论SO分子的电子结构,说明基态时有几个不成对电子。
11.下列AB型分子:N2,NO,O2,C2,F2,CN,CO,XeF中,哪几个是得电子变为AB–后比原来中性分子键能大?哪几个是失电子变为AB+ 后比原来中性分子键能大?12.OH分子于1964年在星际空间被发现。
(a)试按分子轨道理论只用O原子的2 p轨道和H原子的1 s轨道叠加,写出其电子组态。
(b)在哪个分子轨道中有不成对电子?(c)此轨道是由O和H的原子轨道叠加形成,还是基本上定域于某个原子上?(d)已知OH的第一电离能为13.2eV,HF的第一电离能为16.05eV,它们的差值几乎与O原子和F原子的第一电离能(15.8eV和18.6eV)的差值相同,为什么?(e)写出它的基态光谱项。
13.试写出在价键理论中描述H2运动状态的、符合Pauli 原理的波函数,并区分其单态和三重态。

01.量子力学基础知识【1.1】将锂在火焰上燃烧,放出红光,波长λ=670.8nm,这是Li原子由电子组态(1s)2(2p)1→(1s)2(2s)1跃迁时产生的,试计算该红光的频率、波数以及以k J·mol-1为单位的能量。
解:811412.99810m s4.46910s670.8mcνλ--⨯⋅===⨯【1.3】金属钾的临阈频率为5.464×10-14s-1,如用它作为光电极的阴极当用波长为300nm的紫外光照射该电池时,发射光电子的最大速度是多少?解:212hv hv mv =+【1.4】计算下列粒子的德布罗意波的波长:(a)质量为10-10kg,运动速度为0.01m·s-1的尘埃;(b)动能为0.1eV的中子;(c)动能为300eV的自由电子。
解:根据关系式:(1)34221016.62610J s6.62610m10kg0.01m shmvλ----⨯⋅===⨯⨯⋅【1.6】对一个运动速度cυ(光速)的自由粒子,有人进行了如下推导:结果得出12m mυυ=的结论。
上述推导错在何处?请说明理由。
解:微观粒子具有波性和粒性,两者的对立统一和相互制约可由下列关系式表达:式中,等号左边的物理量体现了粒性,等号右边的物理量体现了波性,而联系波性和粒性的纽带是Planck 常数。
根据上述两式及早为人们所熟知的力学公式:知①,②,④和⑤四步都是正确的。
微粒波的波长λ服从下式:式中,u是微粒的传播速度,它不等于微粒的运动速度υ,但③中用了/u vλ=,显然是错的。
在④中,E hv=无疑是正确的,这里的E是微粒的总能量。
若计及E中的势能,则⑤也不正确。
【1.7】子弹(质量0.01kg,速度1000m·s-1),尘埃(质量10-9kg,速度10m·s-1)、作布郎运动的花粉(质量10-13kg,速度1m·s-1)、原子中电子(速度1000 m·s-1)等,其速度的不确定度均为原速度的10%,判断在确定这些质点位置时,不确定度关系是否有实际意义?解:按测不准关系,诸粒子的坐标的不确定度分别为:子弹:343416.26106.63100.01100010%h J sx m m v kg m s---⨯⋅∆===⨯⋅∆⨯⨯⋅尘埃:3425916.626106.6310101010%h J sx m m v kg m s----⨯⋅∆===⨯⋅∆⨯⨯⋅花粉:34201316.62610 6.631010110%h J s x m m v kg m s ----⨯⋅∆===⨯⋅∆⨯⨯⋅电子:3463116.626107.27109.10910100010%h J s x m m v kg m s ----⨯⋅∆===⨯⋅∆⨯⨯⨯⋅【1.8】电视机显象管中运动的电子,假定加速电压为1000V ,电子运动速度的不确定度υ∆为υ的10%,判断电子的波性对荧光屏上成像有无影响?解:在给定加速电压下,由不确定度关系所决定的电子坐标的不确定度为:34102/10%3.8810h x m m eV m mυ--==⨯==⨯这坐标不确定度对于电视机(即使目前世界上最小尺寸最小的袖珍电视机)荧光屏的大小来说,完全可以忽略。

姓名: 班级: 学号:3001 H 2+的H ˆ= 21∇2- a r 1 - b r 1 +R 1, 此种形式已采用了下列哪几种方法: ------------------------------ ( A C )(A) 波恩-奥本海默近似 (B) 单电子近似(C) 原子单位制 (D) 中心力场近似3002 分析 H 2+的交换积分(β积分) H ab 为负值的根据。
H ab =∫ψa [-21∇2- a r 1 - b r 1 +R 1 ] ψb d τ=E H S ab + R 1 S ab - ∫a r 1ψa ψb d τ = E H S ab + K 因 E H = -13.6e V , S ab 为正值,故第一项为负值; 在分子的核间距条件下, K 为负值。
所以 H ab 为负值3003 证明波函数()()()()b a b a ψψψψψψS S s 1s 121us 1s 121g 221221--=++=是相互正交的。
∫ψg ψu d τ=(4 - 4S 2)-1/2∫(ψa s 1+ψb s 1)((ψa s 1-ψb s 1)d τ = (4 - 4S 2)-1/2∫[ψa s 12 -ψb s 12 ] d τ = (4 - 4S 2)-1/2 [ 1 - 1 ] = 0 故相互正交3004 通过变分法计算得到的微观体系的能量总是:----------------- ( C )(A) 等于真实基态能量(B) 大于真实基态能量(C) 不小于真实基态能量(D) 小于真实基态能量3006 什么叫分子轨道?按量子力学基本原理做了哪些近似以后才有分子轨道的概念? 这些近似的根据是什么?描述分子中单个电子空间运动状态的波函数叫分子轨道。
3个近似 (1) 波恩 - 奥本海默近似 (2) 非相对论近似(3) 单电子近似3007 描述分子中 ______单个电子_________ 空间运动状态的波函数称为分子轨道。
01.量子力学基础知识【】将锂在火焰上燃烧,放出红光,波长λ=,这是Li 原子由电子组态 (1s)2(2p)1→(1s)2(2s)1跃迁时产生的,试计算该红光的频率、波数以及以k J ·mol -1为单位的能量。
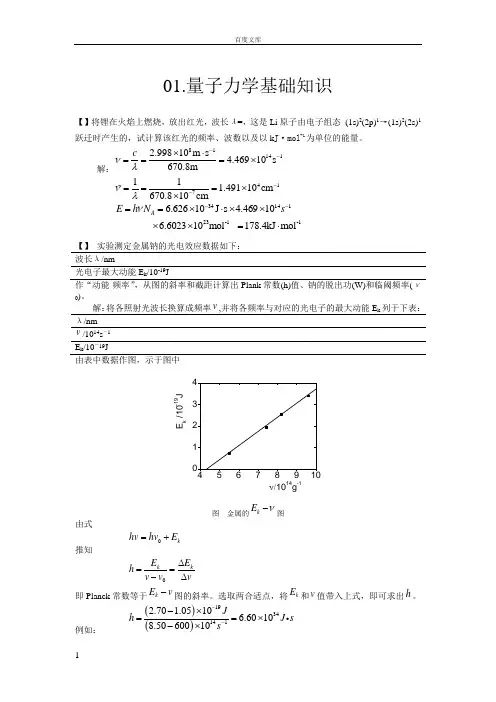
解:811412.99810m s 4.46910s 670.8m cνλ--⨯⋅===⨯ 41711 1.49110cm 670.810cm νλ--===⨯⨯3414123-1 -16.62610J s 4.46910 6.602310mol 178.4kJ mol A E h N sν--==⨯⋅⨯⨯⨯⨯=⋅【】 实验测定金属钠的光电效应数据如下: 波长λ/nm光电子最大动能E k /10-19J 作“动能-频率”,从图的斜率和截距计算出Plank 常数(h)值、钠的脱出功(W)和临阈频率(ν0)。
解:将各照射光波长换算成频率v ,并将各频率与对应的光电子的最大动能E k 列于下表: λ/nmv /1014s -1E k /10-19J由表中数据作图,示于图中4567891001234E k /10-19Jν/1014g-1图 金属的k E ν-图由式 0k hv hv E =+ 推知0k kE E h v v v ∆==-∆即Planck 常数等于kE v -图的斜率。
选取两合适点,将k E 和v 值带入上式,即可求出h 。
例如:()()19341412.70 1.0510 6.60108.5060010J h J ss ---⨯==⨯-⨯图中直线与横坐标的交点所代表的v 即金属的临界频率0v ,由图可知,1410 4.3610v s -=⨯。
因此,金属钠的脱出功为:341410196.6010 4.36102.8810W hv J s s J---==⨯⨯⨯=⨯【】金属钾的临阈频率为×10-14s -1,如用它作为光电极的阴极当用波长为300nm 的紫外光照射该电池时,发射光电子的最大速度是多少?解:2012hv hv mv =+()1201812341419312 2.998102 6.62610 5.46410300109.10910h v v m m s J s s m kgυ------⎡⎤=⎢⎥⎣⎦⎡⎤⎛⎫⨯⨯⨯-⨯⎢⎥ ⎪⨯⎝⎭⎢⎥=⎢⎥⨯⎢⎥⎣⎦134141231512 6.62610 4.529109.109108.1210J s s kg m s ----⎡⎤⨯⨯⨯⨯=⎢⎥⨯⎣⎦=⨯【】计算下列粒子的德布罗意波的波长: (a ) 质量为10-10kg ,运动速度为·s -1的尘埃; (b ) 动能为的中子;(c ) 动能为300eV 的自由电子。

【1.1】将锂在火焰上燃烧,放出红光,波长λ=670.8nm ,这是Li 原子由电子组态 (1s)2(2p)1→(1s)2(2s)1跃迁时产生的,试计算该红光的频率、波数以及以k J ·mol -1为单位的能量。
解:811412.99810m s 4.46910s 670.8m cνλ--⨯⋅===⨯ 41711 1.49110cm670.810cm νλ--===⨯⨯3414123-1 -16.62610J s 4.46910 6.602310mol 178.4kJ mol A E h N sν--==⨯⋅⨯⨯⨯⨯=⋅【1.3】金属钾的临阈频率为5.464×10-14s -1,如用它作为光电极的阴极当用波长为300nm 的紫外光照射该电池时,发射光电子的最大速度是多少?解:2012hv hv mv =+()1201812341419312 2.998102 6.62610 5.46410300109.10910h v v m m s J s s m kgυ------⎡⎤=⎢⎥⎣⎦⎡⎤⎛⎫⨯⨯⨯-⨯⎢⎥ ⎪⨯⎝⎭⎢⎥=⎢⎥⨯⎢⎥⎣⎦134141231512 6.62610 4.529109.109108.1210J s s kg m s ----⎡⎤⨯⨯⨯⨯=⎢⎥⨯⎣⎦=⨯【1.4】计算下列粒子的德布罗意波的波长:(a ) 质量为10-10kg,运动速度为0.01m ·s -1的尘埃; (b ) 动能为0.1eV 的中子; (c ) 动能为300eV 的自由电子。
解:根据关系式:(1)34221016.62610J s 6.62610m 10kg 0.01m s h mv λ----⨯⋅===⨯⨯⋅ 34-11 (2) 9.40310mh p λ-====⨯3411(3) 7.0810mh p λ--====⨯【1.6】对一个运动速度c υ(光速)的自由粒子,有人进行了如下推导:1v vv v 2h h E m p m νλ=====①②③④⑤结果得出12m m υυ=的结论。
【1.1】将锂在火焰上燃烧,放出红光,波长λ=670.8nm ,这是Li 原子由电子组态 (1s)2(2p)1→(1s)2(2s)1跃迁时产生的,试计算该红光的频率、波数以及以k J ·mol -1为单位的能量。
解:811412.99810m s 4.46910s 670.8m cνλ--⨯⋅===⨯ 41711 1.49110cm670.810cm νλ--===⨯⨯3414123-1 -16.62610J s 4.46910 6.602310mol 178.4kJ mol A E h N sν--==⨯⋅⨯⨯⨯⨯=⋅【1.3】金属钾的临阈频率为5.464×10-14s -1,如用它作为光电极的阴极当用波长为300nm 的紫外光照射该电池时,发射光电子的最大速度是多少?解:2012hv hv mv =+()1201812341419312 2.998102 6.62610 5.46410300109.10910h v v m m s J s s m kgυ------⎡⎤=⎢⎥⎣⎦⎡⎤⎛⎫⨯⨯⨯-⨯⎢⎥ ⎪⨯⎝⎭⎢⎥=⎢⎥⨯⎢⎥⎣⎦134141231512 6.62610 4.529109.109108.1210J s s kg m s ----⎡⎤⨯⨯⨯⨯=⎢⎥⨯⎣⎦=⨯【1.4】计算下列粒子的德布罗意波的波长:(a ) 质量为10-10kg,运动速度为0.01m ·s -1的尘埃; (b ) 动能为0.1eV 的中子; (c ) 动能为300eV 的自由电子。
解:根据关系式:(1)34221016.62610J s 6.62610m 10kg 0.01m s h mv λ----⨯⋅===⨯⨯⋅ 34-11 (2) 9.40310mh p λ-====⨯3411(3) 7.0810mh p λ--====⨯【1.6】对一个运动速度c υ(光速)的自由粒子,有人进行了如下推导:1v vv v 2h h E m p m νλ=====①②③④⑤结果得出12m m υυ=的结论。
结构化学基础第五版周公度答案目录01.量子力学基础知识 ...................................................................................................................... 1 02 原子的结构和性质 ................................................................................................................. 13 04分子的对称性 ............................................................................................................................ 48 05 多原子分子中的化学键 ........................................................................................................... 61 06配位化合物的结构和性质 ........................................................................................................ 91 07晶体的点阵结构和晶体的性质 .............................................................................................. 103 08金属的结构和性质 .................................................................................................................. 119 09离子化合物的结构化学 .......................................................................................................... 135 10次级键及超分子结构化学 (153)01.量子力学基础知识【1.1】将锂在火焰上燃烧,放出红光,波长λ=670.8nm ,这是Li 原子由电子组态 (1s)2(2p)1→(1s)2(2s)1跃迁时产生的,试计算该红光的频率、波数以及以k J ·mol -1为单位的能量。
【】金属钾的临阈频率为×10-14s-1,如用它作为光电极的阴极当用波长为300nm的紫外光照射该电池时,发射光电子的最大速度是多少?解:【】计算下列粒子的德布罗意波的波长:(a)质量为10-10kg,运动速度为·s-1的尘埃;(b)动能为的中子;(c)动能为300eV的自由电子。
解:根据关系式:(1)【】子弹(质量,速度1000m·s-1),尘埃(质量10-9kg,速度10m·s-1)、作布郎运动的花粉(质量10-13kg,速度1m·s-1)、原子中电子(速度1000 m·s-1)等,其速度的不确定度均为原速度的10%,判断在确定这些质点位置时,不确定度关系是否有实际意义?解:按测不准关系,诸粒子的坐标的不确定度分别为:子弹:尘埃:花粉:电子:【】用不确定度关系说明光学光栅(周期约)观察不到电子衍射(用电压加速电子)。
解:解法一:根据不确定度关系,电子位置的不确定度为:这不确定度约为光学光栅周期的10-5倍,即在此加速电压条件下电子波的波长约为光学光栅周期的10-5倍,用光学光栅观察不到电子衍射。
解法二:若电子位置的不确定度为10-6m,则由不确定关系决定的动量不确定度为:在104V的加速电压下,电子的动量为:由Δp x和p x估算出现第一衍射极小值的偏离角为:这说明电子通过光栅狭缝后沿直线前进,落到同一个点上。
因此,用光学光栅观察不到电子衍射。
【】是算符的本征函数,求其本征值。
解:应用量子力学基本假设Ⅱ(算符)和Ⅲ(本征函数,本征值和本征方程)得:因此,本征值为。
【】和对算符是否为本征函数?若是,求出本征值。
解:,所以,是算符的本征函数,本征值为。
而所以不是算符的本征函数。
【】证明在一维势箱中运动的粒子的各个波函数互相正交。
证:在长度为的一维势箱中运动的粒子的波函数为:=1,2,3,……令n和n’表示不同的量子数,积分:和皆为正整数,因而和皆为正整数,所以积分:根据定义,和互相正交。
10次级键及超分子结构化学【10.1】在硫酸盐和硼酸盐中,24SO -和23BO -的构型分别为正四面体和平面正三角形,S O -键和B O -键的键长平均值分别为和,试计算S O -和B O -键的键价以及S 原子和B 原子的键价和。
解:将查得的0R 值和B 值数据代入计算价键的公式。
24SO -: 162.4148exp 1.4837pm pm S pm ⎡⎤-==⎢⎥⎣⎦S 原子的键价和为4 1.48 5.92⨯=。
此值和S 原子的氧化态6相近。
33BO -:137.1136.6exp 1.0137pm pm S pm ⎡⎤-==⎢⎥⎣⎦B 原子的键价和为3 1.01 3.03⨯=。
此值和B 原子的原子价3相近。
【10.2】2ClO -(弯曲形)、3ClO -(三角锥形)和4ClO -(四面体形)离子中,Cl O -键的平均键长值分别为157pm ,148pm 和142.5pm ,试分别计算其键价及键价和。
解:2ClO -: 171157exp 1.4637pm pm S pm ⎡⎤-==⎢⎥⎣⎦2ClO -中Cl 原子键价和为2 1.46 2.92⨯=和氧化态为3相近。
3ClO -: 167148exp 1.6737pm pm S pm ⎡⎤-==⎢⎥⎣⎦3ClO -中Cl 原子的键价和为3 1.67 5.01⨯=和氧化态为5相近。
4ClO -: 163.2142.5exp 1.7537pm pm S pm ⎡⎤-==⎢⎥⎣⎦4ClO -中Cl 原子的键价和为4 1.757.0⨯=和氧化态为7相近。
【10.3】试计算下列化合物已标明键长值的Xe F -键键价。
说明稀有气体Xe 原子在不同条件下和其他原子形成化学键的情况。
[按(7.1.3)式计算Xe F -键时0R 值为()2200Xe pm ,()4193Xe pm ,()6189Xe pm ,B 值为37pm ]。
(a )XeF 2(直线形): Xe-F200pm(b )[][]236Xe F SbF +-:XeXe F FF210pm190pm151o+(c )[][]2213NO Xe F +-:F 5XeFF XeF 6255pm-(d )()[]26342,6F C H Xe BF +--⎡⎤⎣⎦:C CC CC C FHHHXe FBF 3279pm(e )[][]45Me N XeF +-: 平面五角形的5XeF -离子中Xe F -202pm解: (a )Xe F :200200exp 1.0037pm pm S pm ⎡⎤-==⎢⎥⎣⎦ (b )XeF :200190exp 1.3137pm pm S pm ⎡⎤-==⎢⎥⎣⎦ XeF :200214exp 0.6837pm pm S pm ⎡⎤-==⎢⎥⎣⎦ (c )Xe F :189255exp 0.1737pm pm S pm ⎡⎤-==⎢⎥⎣⎦ (d )XeF :200279exp 0.1237pm pm S pm ⎡⎤-==⎢⎥⎣⎦(e )Xe F -:193202exp 0.7837pm pm S pm ⎡⎤-==⎢⎥⎣⎦Xe 和F 的范德华半径和为216pm +147pm=363pm 。