醋酸纤维薄膜电泳法分离血清蛋白质
- 格式:ppt
- 大小:148.50 KB
- 文档页数:7

醋酸纤维薄膜电泳分离血清蛋白质一、实验目的:掌握电泳的一般原理和醋酸纤维薄膜电泳的操作技术;二、实验原理:1、电泳:带电粒子在电场中向着与其电荷相反的方向泳动。
2、分类:按支持介质、电场强度、技术特点等分类。
支持介质:自由界面电泳;区带电泳:滤纸、醋纤薄膜、凝胶等。
3、基本原理---电荷效应:F=Eq,f=6лrηv。
匀强电场中,F=f,v=Eq/6лrη。
在同一电泳条件下,混合物中不同组分将因其r和q的差异而具有不同的移动速度。
因此,电泳一定的时间(t),就可以互相分离。
通常使用“迁移率”(m)表示不同物质具有不同移动速度的特性。
m=V/E指在单位电场强度下带电颗粒的移动速度。
4、影响电泳的因素:内在因素:样品本身所带净电荷、分子大小和形状。
外界因素:电场强度、缓冲液、支持介质。
5、血清蛋白的分离:血清蛋白各组分pI≤7.5,缓冲液pH=8.6,净电荷为负电荷,向正极泳动。
由于各蛋白质成分的pI不同,所带电荷量q不同,加上分子半径大小r和形状的差别,依V=Eq/6πrη 可知,不同蛋白质成分向正极泳动的速度不同,电泳一定时间就可相互分离(Δd=Δv·t)。
分离后的蛋白质须经显色才能检测鉴定,通常用氨基黑10B 将血清蛋白质显色。
三、实验步骤:1.泡膜洗净手,戴乳胶手套,取薄膜,于毛面距一端1.5 cm 处用铅笔轻画一直线。
小心将膜浮于巴比妥缓冲液上,待下面湿润后再将膜完全浸入,浸泡1小时。
2.仪器准备检查电源,接好电线(不通电),注意正负极。
加巴比妥缓冲液于电泳槽内,调整水平。
3.点样取出泡好的薄膜,用滤纸吸去多余的缓冲液。
毛面向上,于毛面膜的一端画线处点样,注意点样量适当。
待样品渗入膜内后,将点样面翻转朝向下方(以防电泳时薄膜表面蒸发干燥),置于电泳槽的支架上,点样端放在负极。
4.电泳盖上电泳槽盖平衡 5 分钟。
然后检查电源正负极无误后通电,E= 15V/cm,电泳 60分钟后断电。

醋酸纤维薄膜电泳分离血清蛋白实验报告醋酸纤维薄膜电泳分离血清蛋白实验报告引言:血清蛋白是人体内一类重要的生物大分子,对于维持人体正常生理功能具有重要作用。
因此,对血清蛋白的研究一直备受关注。
本实验旨在利用醋酸纤维薄膜电泳技术,对血清蛋白进行分离和鉴定,以期获得关于血清蛋白的更深入了解。
实验方法:1. 实验仪器和试剂准备本实验所需仪器包括电泳装置、电源、薄膜电泳槽等。
试剂包括醋酸纤维、缓冲液、血清样品等。
2. 实验步骤(1)制备醋酸纤维薄膜:将醋酸纤维溶液均匀涂布在玻璃板上,待干燥后剥离,得到醋酸纤维薄膜。
(2)制备电泳槽:将醋酸纤维薄膜固定在电泳槽中,保证其平整并与电极接触良好。
(3)样品准备:将待测血清样品离心,取上清液作为实验样品。
(4)电泳操作:将实验样品均匀涂布在醋酸纤维薄膜上,接通电源进行电泳,设定适当的电压和时间。
(5)染色和观察:将电泳结束后的薄膜进行染色处理,然后观察薄膜上蛋白带的分布情况。
实验结果:经过实验,我们观察到在醋酸纤维薄膜上形成了多个蛋白带,这些蛋白带代表了血清中不同种类的蛋白质。
通过比较不同样品的蛋白带分布情况,我们可以发现不同样品中蛋白质的种类和含量存在差异。
讨论:1. 醋酸纤维薄膜电泳技术的优势相比于传统的凝胶电泳技术,醋酸纤维薄膜电泳具有以下优势:操作简单、分辨率高、分离效果好、重复性好等。
因此,该技术在血清蛋白分离和鉴定中具有广泛应用前景。
2. 血清蛋白的研究意义血清蛋白是人体内一类重要的生物大分子,对于维持人体正常生理功能具有重要作用。
通过对血清蛋白的研究,可以了解人体内不同蛋白质的种类和含量,从而为临床医学、生物医学研究等领域提供重要的参考依据。
结论:本实验利用醋酸纤维薄膜电泳技术成功分离和鉴定了血清蛋白,观察到了不同蛋白质在薄膜上的分布情况。
该实验结果为进一步研究血清蛋白的功能和生理意义提供了基础数据。
醋酸纤维薄膜电泳技术的应用前景广阔,有望在血清蛋白研究领域发挥重要作用。

醋酸纤维薄膜电泳分离血清蛋白实验结果一、前言醋酸纤维薄膜电泳是一种常见的分离血清蛋白的方法,它能够将复杂的血清样品中的蛋白质分离出来,从而便于进行后续的研究。
本文将详细介绍醋酸纤维薄膜电泳分离血清蛋白实验结果。
二、实验方法1. 样品制备将血清样品加入到离心管中,并进行离心处理,去除其中的颗粒物和红细胞等杂质。
然后取出上清液,进行下一步处理。
2. 薄膜电泳将制备好的样品加入到电泳槽中,并在两端接上电极。
然后通过调节电场强度和时间等参数,使得不同分子量的蛋白质在电场作用下向不同方向移动,并最终被分离开来。
3. 银染将分离好的样品进行银染处理,使得其中存在的蛋白质能够被显色。
然后观察显色效果,并对其进行记录和分析。
三、实验结果经过以上实验步骤,我们成功地得到了血清样品中的蛋白质分离结果。
具体结果如下:1. 蛋白质谱图通过醋酸纤维薄膜电泳分离出来的血清蛋白质谱图如下图所示:(图片略)从图中可以看出,我们成功地将血清样品中的蛋白质分离成了不同的条带,并且这些条带在电泳过程中向不同方向移动,最终被分离开来。
2. 蛋白质种类通过对分离出来的蛋白质进行银染处理后,我们可以看到其中存在多种不同种类的蛋白质。
具体包括:(1)白蛋白(2)球蛋白(3)免疫球蛋白(4)转铁蛋白等。
3. 调整实验参数对结果的影响在实验过程中,我们还尝试了调整一些实验参数,以观察其对结果的影响。
具体包括:(1)电场强度:当电场强度较大时,不同分子量的蛋白质能够更快地向两端移动,并且更容易被分离开来。
但是,如果电场强度过大,也会导致蛋白质的断裂和聚集,从而影响分离效果。
(2)电泳时间:当电泳时间较长时,不同分子量的蛋白质能够更充分地被分离开来,并且条带也更加清晰。
但是,如果电泳时间过长,也会导致蛋白质的断裂和聚集,从而影响分离效果。
四、结论通过以上实验结果的观察和分析,我们可以得出以下结论:1. 醋酸纤维薄膜电泳是一种有效的血清蛋白质分离方法。


生物化学实验醋酸纤维素薄膜电泳法分离血清蛋白质一、实验目的掌握醋酸纤维薄膜电泳法分离蛋白质的原理和方法二、实验原理蛋白质是两性电解质。
在pH值小于其等电点的溶液中,蛋白质为正离子,在电场中向阴极移动;在pH值大于其等电点的溶液中,蛋白质为负离子,在电场中向阳极移动。
血清中含有数种蛋白质,它们所具有的可解离基团不同,在同一pH的溶液中,所带净电荷不同,故可利用电泳法将它们分离。
血清中含有白蛋白、α-球蛋白、β-球蛋白、γ-球蛋白等,各种蛋白质由于氨基酸祖坟、立体构象、相对分子质量、等电点及形状不同,在电场中迁移速度不同。
由表可知,血清中5种蛋白质的等电点大部分低于pH值7.0,所以在剪下,分别用0.4mol/L NaOH溶液浸洗下来,进行比色,测定其相对含量。
也可以将染色后的薄膜直接用光密度计扫描,测定其相对含量。
肾病、弥漫性肝损害、肝硬化、原发性肝癌、多发性骨髓瘤、慢性炎症、妊娠等都可以使白蛋白下降。
肾病时α1、α2、β球蛋白升高,γ-球蛋白降低。
肝硬化时α2、β-球蛋白降低,而α1、γ-球蛋白升高。
三、实验器材1、醋酸纤维薄膜(2cm*8cm,厚度120μm)2、人血清;3、烧杯及培养皿数只;4、点样器;5、竹镊子;6、玻璃棒;7、电吹风;8、试管六只;9、恒温水浴锅;10、电泳槽;11、直流稳压电泳仪;12、7220型分光光度计;13、剪刀四、实验试剂1、巴比妥-巴比妥钠缓冲液:取两个大烧杯,分别称取巴比妥钠和巴比妥溶解于500ml 蒸馏水中;2、染色液,可反复使用;3、漂洗液:取乙醇45ml ,冰醋酸10ml ,混匀;4、浸出液:0.4mol/L NaOH 溶液;5、透明液:取冰醋酸25ml 、无水乙醇75ml ,混匀。
五、实验操作1、准备和点样取一条醋酸纤维薄膜,浸入缓冲液中,完全浸透后,用镊子轻轻取出,将薄膜无光泽的一面向上,平放在干净滤纸上,再放一张干净滤纸吸取多余的缓冲液;用玻棒蘸取少量血清,涂在点样器上,然后轻轻于距纤维薄膜一端1.5cm 处接触,样品即呈一条状突于纤维膜上。

实验二醋酸纤维膜凝胶电泳分离血清蛋白质目的:1.掌握醋酸纤维膜电泳的基本原理及其临床意义2.熟悉电泳仪器的使用和操作电泳(一)原理带电的颗粒在外加电场中,向带相反电荷的电极作定向移动的现象称为电泳。
生物分子都带电荷,其电荷的多少取决于分子性质及其所在介质(溶液)的pH及其组成。
当溶液的pH小于等电点pH时,蛋白质将带有正电荷,在电场中作为一个正离子移动。
当溶液的pH大于等电点pH时,蛋白质将带有负电荷,在电场中作为一个阴离子移动。
COO-COO-COOH ╱+ H +╱+ H +╱Pr ←————→Pr ←————→Pr ╲+ OH-╲+ OH-╲NH 2NH 3+NH 3+PH>PI PH=PI PH<PI电泳用于分离物质的原理:以生物大分子为例阐明电荷来源:(二)电泳的分类按支持介质的不同可分为:⑴纸电泳(Paper electrophorisis)⑵醋酸纤维薄膜电泳(Cellulose Acetate electrophoresis)⑶琼脂凝胶电泳(Agar Gel electrophoresis)⑷聚丙烯酰胺凝胶电泳(Polyacrylamide Gel electrophoresis)(PAGE)⑸SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)。
按支持介质形状不同可分为:⑴薄层电泳;⑵板电泳;⑶柱电泳(三)电泳的影响因素1.待分离大分子的性质:所带的电荷、分子大小和形状,分子带的电荷量越大、直径越小、形状越接近球形,则其电泳迁移速度越快2. 缓冲液pH和离子强度:pH值距离其等电点愈远,其所带净电荷量就越大,电泳的速度也就越大;但是pH过高或过低引起蛋白变性,缓冲液通常要保持一定的离子强度;强度过低,则缓冲能力差,不易维持PH恒定,离子强度过高,在待分离分子周围形成较强的带相反电荷的离子扩散层(即离子氛),降低了蛋白质的带电量,使电泳速度减慢。
一般所用离子强度为0.02-0.2之间。

实验3 醋酸纤维薄膜电泳法分离血清蛋白质一、实验目的学习醋酸纤维薄膜电泳法的原理及操作。
测定人血清中各种蛋白质相对百分含量。
二、基本原理蛋白质是两性电解质。
在pH小于其等电点的溶液中,蛋白质为正离子,在电场中向阴极移动;在pH大于其等电点的溶液中,蛋白质为负离子,在电场中向阳极移动。
血清中含有数种蛋白质,分别为白蛋白,α1球蛋白,α2球蛋白,β球蛋白,γ球蛋白,它们所具有的可解离基不同,在同一pH的溶液中,所带净电荷不同,因此在电场中移动速度不同,故可利用电泳法将它们分离。
醋酸纤维(二乙酸纤维素)薄膜具有匀一的泡沫状结构 (厚约120 µm),渗透性强,对分子移动无阻力,用它作区带电泳的支持物,具有用样量少,分离清晰,无吸附作用,应用范围广和快速简便等优点。
目前已广泛用于血清蛋白、脂蛋白、血红蛋白、糖蛋白、酶的分离和免疫电泳等方面。
三、试剂与器材1.巴比妥—巴比妥钠缓冲液(pH 8.6,0.075 mol/L):称取巴比妥钠(A.R)15.4g和巴比妥(A.R.)2.76g,溶于蒸馏水,稀释至1000mL。
用酸度计校测后使用。
2.染色液:氨基黑10B 0.2g、甲醇(A.R)20mL、冰乙酸(A.R.)4mL,加蒸馏水16mL,混匀即可。
3. 漂洗液:乙醇(A.R)90mL、冰乙酸(A.R)10 mL,加蒸馏水100mL,混匀即可。
(现配现用)4.透明液:冰乙酸(A.R)10mL、无水乙醇30mL(1:3),混匀即得。
(现配现用)5.人血清(新鲜、无溶血现象)。
6.器材:醋酸纤维薄膜(12×8cm,2×8cm);厚度120μm;培养皿直径Ф10cm(×8);点样器(或载玻片);直尺;铅笔;竹镊子;玻璃棒;烧杯50ml(×2),200ml (×1);试管1.5×15cm(×8);吸管5mL(×1);水浴锅;电泳槽;直流稳压电泳仪;分光光度计;剪刀。


醋酸纤维素薄膜电泳分离血清蛋白原理和实验方法一、原理醋酸纤维薄膜电泳是用醋酸纤维素薄膜作为支持物的电泳方法。
带电颗粒在电场力作用下,向着与其电性相反的电极移动的现象称为电泳。
由于各种蛋白质都有特定的等电点,如将蛋白质置于pH值低于其等电点的溶液中,则蛋白质将带正电荷而向负极移动。
反之,则向正极移动。
因为蛋白质分子在电场中移动的速度与其带电量、分子的形状及大小有关,所以,可用电泳法将不同的蛋白质分离开来。
血清中含有多种蛋白质,它们的等电点都在pH 7.5以下。
将血清放于pH 8.6的缓冲液电泳时,所有的血清蛋白都带有负电荷,在电场中将向正极移动。
由于各种血清蛋白在相同pH时所带电荷数量不等,分子颗粒大小不一,因而泳动速度不同,经电泳被分离开来。
血清蛋白质的等电点和分子量见下表。
本实验以醋酸纤维素薄膜(简称CAM)为支持物分离血清中的不同蛋白质。
它是一种良好的呈均一泡沫状疏松薄膜,厚约120μm具有一定的吸水性。
二、实验材料、仪器及试剂1.材料:健康人血清或鸡血清2.仪器:电泳仪电泳槽3.试剂:(1)醋酸纤维素薄膜;(2)pH8.6 巴比妥缓冲液(离子强度0.06~0.07):取巴比妥0.83克,巴比妥钠6.38克,加蒸馏水加热溶解后,定容至500ml。
(3)染色液:取氨基黑10 B 0.5克,溶于50ml甲醇中,再加冰醋酸10ml,蒸馏水40ml混匀。
(4)漂洗液:95%乙醇4.5ml,冰醋酸 5ml,蒸馏水50ml混合。
(5)透明液:95%乙醇80ml,冰醋酸20ml混合。
三、实验方法1.准备薄膜:将切割整齐的2.5×6cm的薄膜条,浸入巴比妥缓冲液中浸透后,取出,用吸水纸吸去多余缓冲液。
2.点样:仔细辩认薄膜的粗糙面与光滑面,在粗糙面距离薄膜一端1.5cm处,用铅笔轻轻划一条直线。
用玻棒蘸上血清样品,涂于盖玻片边缘处(边缘长度应比膜条宽度窄),将此边缘按压在直线上。
注意:样品应点在薄膜的粗糙面一侧。


血清蛋白质醋酸纤维薄膜电泳
血清蛋白质醋酸纤维薄膜电泳(serum protein acetic acid
fiber membrane electrophoresis, SPAFME)是一种常用的分离和定
量检测血清中蛋白质的方法。
该技术的原理是将血清样品在pH8.6的缓冲液中加热变性,然后
在电泳板上涂覆一层纤维薄膜,将变性的蛋白质在电场作用下在薄膜
上进行分离,再用染料染色进行检测。
不同的蛋白质在电场作用下具
有不同的迁移速率和电荷,因此可以在薄膜上清晰地分离出多种蛋白
质成分,如白蛋白、球蛋白、β-球蛋白等。
血清蛋白质醋酸纤维薄膜电泳是一种较为简单、快速、灵敏的检
测方法,可以用于检测肝病、血液病、肾病等疾病。
在临床医学中有
着广泛的应用价值,特别是对于肝脏疾病的筛查和诊断具有重要意义。
不过,在进行血清蛋白质醋酸纤维薄膜电泳的过程中需要严格控
制各个环节,如加热时间、电泳时间、染色时间等,否则可能会产生
偏差或错误的结果。
因此,操作时需要具有一定的技术水平和操作经验。
总的来说,血清蛋白质醋酸纤维薄膜电泳是一种在临床医学中经
常使用的检测方法,可以较为准确地定量分析血清样品中的蛋白质成分,对许多疾病检测和诊断有着重要的意义。

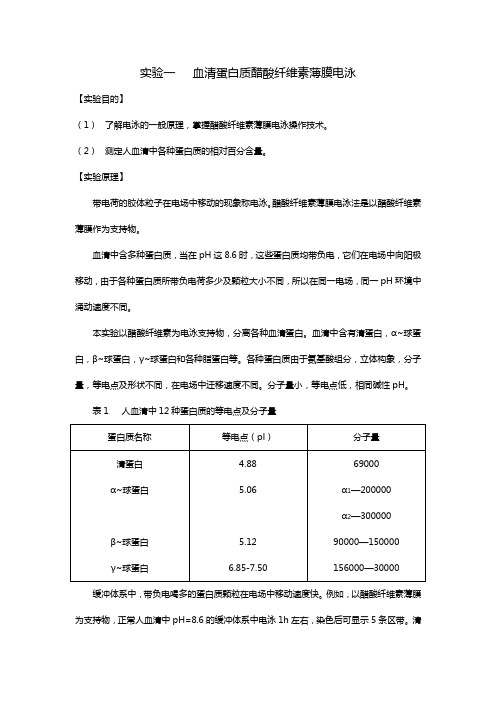
实验一血清蛋白质醋酸纤维素薄膜电泳【实验目的】(1)了解电泳的一般原理,掌握醋酸纤维素薄膜电泳操作技术。
(2)测定人血清中各种蛋白质的相对百分含量。
【实验原理】带电荷的胶体粒子在电场中移动的现象称电泳。
醋酸纤维素薄膜电泳法是以醋酸纤维素薄膜作为支持物。
血清中含多种蛋白质,当在pH这8.6时,这些蛋白质均带负电,它们在电场中向阳极移动,由于各种蛋白质所带负电荷多少及颗粒大小不同,所以在同一电场,同一pH环境中涌动速度不同。
本实验以醋酸纤维素为电泳支持物,分离各种血清蛋白。
血清中含有清蛋白,α~球蛋白,β~球蛋白,γ~球蛋白和各种脂蛋白等。
各种蛋白质由于氨基酸组分,立体构象,分子量,等电点及形状不同,在电场中迁移速度不同。
分子量小,等电点低,相同碱性pH。
表1 人血清中12种蛋白质的等电点及分子量缓冲体系中,带负电喝多的蛋白质颗粒在电场中移动速度快。
例如,以醋酸纤维素薄膜为支持物,正常人血清中pH=8.6的缓冲体系中电泳1h左右,染色后可显示5条区带。
清蛋白泳动最快,其余依次为α1~,α2~,β~及γ~球蛋白。
这些区带经洗脱后可用分光光度法定量,也可直接进行光吸收扫描自动绘出区带吸收峰及相对百分比。
临床医学常利用它们异常区带的出现作为临床鉴别诊断的依据。
此法由于操作简单,快速。
图1 正常人血清醋酸纤维素薄膜电泳示意图为清蛋白,2,3,4,5分别为α1,α2,β~及γ~球蛋白,6为点样原点(3)优点。
目前,已成为临床生化检验的常规操作之一。
【临床意义】清蛋白62-72% α1—球蛋白3-4% α2—球蛋白6-10% β~—球蛋白7-11% γ~—球蛋白9-18%血清蛋白电泳的病理改变多半是清蛋白降低和一种或二种以上球蛋白增加。
表2 血清蛋白的临床意义【试剂】1.巴比妥缓冲液(pH=8.6离子强度为0.06):称取巴比妥纳12.76克,巴比妥1.66克,置于盛有200ml蒸馏水的烧杯中稍加热溶解后,移置100ml容量瓶中,加蒸馏水稀释至刻度。


血清蛋白醋酸纤维素薄膜电泳血清蛋白醋酸纤维素薄膜电泳是一种新兴的蛋白质分离和分析技术。
它将血清蛋白作为示踪物,通过电泳运动在醋酸纤维素薄膜上进行分离,从而实现对血清蛋白的分离和定量分析。
本篇文章将介绍血清蛋白醋酸纤维素薄膜电泳的原理、方法和应用,并提供相关的参考内容。
1. 原理:血清蛋白醋酸纤维素薄膜电泳基于电荷和大小的差异,通过电场作用将血清蛋白分离开来。
在醋酸纤维素薄膜上,血清蛋白会在电场的作用下向阳极或阴极迁移,从而在薄膜上形成条带。
不同类型和含量的血清蛋白具有不同的迁移速度和位置,可以通过分析条带的移动距离和形态来定量分析不同的血清蛋白。
2. 方法:(1)样品准备:将血清样品离心,取上清液即可。
(2)制备醋酸纤维素薄膜:将醋酸纤维素溶液均匀涂覆在电泳盒上的玻璃或硅胶片上,待溶液干燥后形成醋酸纤维素薄膜。
(3)电泳操作:将样品在醋酸纤维素薄膜上加载,设置适当的电压和时间进行电泳操作。
(4)染色和测量:电泳结束后,将醋酸纤维素薄膜染色,然后用影像扫描仪或相似设备测量分离和形态信息。
3. 应用:血清蛋白醋酸纤维素薄膜电泳已在医学和生物学研究中得到广泛应用。
(1)疾病诊断:通过分析血清中的特定蛋白质,可以判断某些疾病的发生和发展,如癌症、心血管疾病等。
(2)蛋白质组学研究:血清蛋白醋酸纤维素薄膜电泳可以用于蛋白质组学的定性和定量分析,有助于了解蛋白质组的组成和功能。
(3)药物筛选:通过血清蛋白醋酸纤维素薄膜电泳,可以评估药物对特定蛋白质的影响,从而为药物筛选和设计提供参考。
(4)食品安全检测:血清蛋白醋酸纤维素薄膜电泳可以检测食品中的蛋白质污染,例如乳制品中的外源性蛋白质添加剂。
参考文献:[1] Ge R S, Tan B P. Determination of immunoglobulin in fish serum using cellulose acetate membrane electrophoresis[J]. Journal of chromatography, 1990, 494: 177-182.[2] Yan Z, Cao D, Lin B, et al. Identification of Cancer Biomarkers With Differential Abundance Using Statistical Analysis of High-Dimensional Proteomics Data[J]. Frontiers in Physiology, 2018, 9: 1744.[3] Fu Q, Li J, Qiu J, et al. Proteomics-based identification of a group of apoptosis-related proteins and biomarkers in gastric cancer[J]. International journal of oncology, 2016, 48(1): 343-352.[4] Zhao X, Li C, Ye X, et al. Indirect Competitive ELISA Assayfor Rapid Detection of Milk Residues in Wine Using Nanomaterials to Amplify Signal[J]. Food Analytical Methods, 2009, 2(1): 18-23.[5] Kawakami T, Nishida K, Akutsu H. Blood serum protein electrophoresis on cellulose acetate film during adult Mizuneri (Jellyfish) Toxicity[J]. Journal of toxicological sciences, 1997,22(2): 177-181.[6] Janssena。

醋酸纤维薄膜电泳法分离血清蛋白质醋酸纤维薄膜电泳法分离血清蛋白质(山东大学)Xxxx20190014xxxx生科三班同组者:xxx一、实验目的:掌握醋酸纤维薄膜电泳法分离蛋白质的原理和方法。
二、实验原理:蛋白质是两性电解质。
在pH 小于其等电点的溶液中,蛋白质为正离子,在电场中向阴极移动;在pH 大于其等电点的溶液中,蛋白质为负离子,在电场中向阳极移动。
血清中含有数种蛋白质,它们所具有的可解离基团不同,在同一pH 的溶液中,所带静电荷不同,因此在电场中移动速度不同,故可利用电泳法奖它们分离。
血清中含有白蛋白、α-球蛋白,β-球蛋白、γ-球蛋白等,各种蛋白质由于氨基酸组分、立体构象、相对分子质量、等电点及形状不同(见表1),在电场中迁移速度不同。
由表可知,血清中5种蛋白质的等电点大部分低于pH7.0,所以在缓冲液(pH8.6)中,它们都电离成负离子,在电场中向阳极移动。
表1 人血清中各种蛋白质的等电点及相对分子质量蛋白质名称白蛋白α1-球蛋白α2-球蛋白β-球蛋白γ-球蛋白三、实验器材:醋酸纤维薄膜(2㎝×8㎝,厚度120μm )、人血清(新鲜、无溶血现象)、培养皿Φ10㎝(×5)、点样器(或玻璃片)、镊子、玻璃棒、电吹风、吸管5.0㎝(×1)、电泳槽、直流稳压电泳仪。
等电点(pI ) 4.88 5.06 5.06 5.12 6.85~7.50 相对分子质量 69000 200000 300000 90000~150000 156000~300000四、实验试剂:1. 巴比妥-巴比妥钠缓冲液(pH8.6,离子强度0.06mol/L):称取巴比妥钠(A.R. )12.76g 和巴比妥(A.R. )1.66g ,溶于蒸馏水并稀释至1000ml 。
用pH计校正后使用。
2. 染色液:氨基黑10B0.5g 、甲醇(A.R. )5ml 、冰乙酸(A.R. )10ml ,加蒸馏水40ml ,混匀即可。

醋酸纤维薄膜电泳法分离血清蛋白质——学习指南
l 学习重点 1. 掌握薄膜电泳的基本原理和操作。
2. 学习血清蛋白质的分离、鉴定的意义和临床应用。
l 知识要点
1. 等电点:蛋白质是两性解离物质,所带电荷因溶液的pH 值不同而改变,当蛋白质所带净电荷为0时,溶液的pH 值即为蛋白质的等电点。
2. 蛋白质电泳:在电场的作用下,不同蛋白质由于带电性质、分子大小、形状等性质的差异,产生不同的迁移方向和速度,达到分离、鉴定或提纯的目的。
l 试剂 1. 0.075mol/L pH8.6巴比妥钠缓冲液。
2. 氨基黑10B 染色液。
3. 漂洗液(100mL 含:95%乙醇45mL 、冰乙酸5mL 、蒸馏水50mL )。
4. 透明液:冰乙酸:无水乙醇(V/V )=1:3。
5. 0.4 mol/L NaOH 溶液。
l 材料
新鲜人血清(无溶血)
l 仪器
醋酸纤维素薄膜、载玻片、点样玻片、滤纸、纱布、培养皿、镊子、直流稳压电泳仪、水平电泳槽、电吹风、恒温水浴锅、紫外可见分光光度计、脱色摇床
l 操作
l 注意事项
1. 点样时动作应轻、稳,操作过程中要防止指纹污染。
点
样宽度应小于薄膜宽度且不能重复点样。
2. 注意电极连接位置。
3. 比色定量时,空白对照不是蒸馏水,而是醋酸纤维薄膜上空白
区域的浸出液。