北京科技大学2019--2020学年第一学期无机化学B 期末模拟试卷
- 格式:pdf
- 大小:1.69 MB
- 文档页数:7

2019-2020学年北京市高一(上)期末化学试卷一、选择题(共18小题,每小题3分,满分54分)1.(3分)当光束通过下列分散系时,能观察到丁达尔效应的是()A.NaCl溶液B.水C.Fe(OH)3胶体D.CuSO4溶液2.(3分)下列说法中不正确的是()A.生铁是铁的一种合金B.合金是混合物C.一般地说合金的熔点比它的各成分金属的熔点都高D.铝制餐具不宜用来蒸煮或长期存放酸性或碱性食物3.(3分)下列化学用语正确的是()A.CO2的结构式O═C═OB.H2SO4的电离方程式为:H2SO4=2H++S﹣+O4﹣C.Cl﹣的离子结构示意图为D.用电子式表示氯化钠的形成过程:4.(3分)氯水中含有多种成分,因而具有多重性质。
根据氯水分别与如图四种物质发生的反应(a、b、c、d重合部分代表物质间反应,且氯水足量),能证明氯水有漂白性的是()A.a B.b C.C D.d5.(3分)N A表示阿伏加德罗常数的值,下列判断正确的是()A.在常温常压下,48g氧气和臭氧的混合气体含氧原子数是3N AB.标准状况下,22.4LSO3中含有的原子数目为3N AC.1molCl2参加反应转移电子数一定为2N AD.lmolNa2O2与水充分反应转移的电子数为2N A6.(3分)若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,一定能大量共存的是()A.NH4+、SO42﹣、CO32﹣、K+B.Na+、Ba2+、Ca2+、HCO3﹣C.Mg2+、SO42﹣、K+、Cl﹣D.K+、Cl﹣、Na+、SO42﹣7.(3分)下列离子反应方程式正确的是()①碳酸氢钙溶液与过量烧碱溶液混合:Ca2++HCO3﹣+OH﹣═CaCO3↓+H2O②碳酸镁与稀硫酸:MgCO3+2H+═H2O+CO2↑+Mg2+③醋酸与大理石:2CH3COOH+CaCO3═Ca2++2CH3COO﹣+H2O+CO2↑④向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42﹣刚好沉淀完全:H++SO42﹣+Ba2++OH﹣═H2O+BaSO4↓⑤Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+═2Fe3++2H2OA.①②③④⑤B.②③④⑤C.②③④D.①③④8.(3分)下列叙述不正确的是()选项被提纯物质杂质除杂试剂或方法A FeCl3溶液FeCl2通入适量Cl2B Cl2H2O (蒸气)通入浓硫酸中C铜粉铁粉加入过量盐酸并过滤D CO2HCl通入饱和的碳酸钠溶液中A.A B.B C.C D.D9.(3分)运用元素周期律分析下面的推断,其中不正确的是()A.锂(Li)与水反应比钠与水反应剧烈B.砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸C.在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂D.HBrO4的酸性比HIO4的酸性强10.(3分)为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的是()A.NaOH溶液[Ba(OH)2溶液]B.FeSO4溶液(KSCN溶液)C.KI(淀粉溶液)D.Na2SO3溶液(BaCl2溶液)11.(3分)下列实验,能达到实验目的的是( ) ABCD观察钾元素的焰色实验室制备Fe (OH )2制备氧化钠 比较NaHCO 3和Na 2CO 3溶解度A .AB .BC .CD .D12.(3分)下列关于钠及其化合物的叙述正确的是( ) A .钠能与硫酸铜溶液反应置换出红色的铜B .在Na 2O 2与水的反应中,氧化产物与还原产物物质的量之比为1:4C .相同物质的量的氧化钠和过氧化钠中阴离子物质的量之比为1:1D .等质量的Na 2O 与Na 2O 2投入等量且足量水中充分反应后所得溶液物质的量浓度相等 13.(3分)某同学在研究前10号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表一种元素,其中O 点代表氢元素。

《无机化学》期末考试试卷(B)适用专业:注意:请将答案写在答题纸上。
一、单项选择题(每小题只有一个正确的答案,请将其代码填入括号中;每小题1分,共40分)1.下列物质不属于弱电解质的是()A.HAc B.NH3·H2O C.AgCl D.H2O2.下列元素中,非金属性最强的是()A.F B.Cl C.S D.O3.下列选项中导电性最好的金属是()A.Fe B.Cu C.Na D.Ag4.地壳中含量最多的元素是()A.O B.S C.Fe D.Si5.下列符号通常代表弱酸的解离常数的是()A.K a B.K b C.K w D.K sp6.0.1 mol·L 1氢氧化钠溶液的pH值为()A.1 B.12 C.2 D.137.原子核外电子层第一层最多容纳的电子数是多少个()A.2 B.6 C.8 D.10 8.配制FeCl3溶液时,常加入少量盐酸,其目的是()A.防止Fe2+被氧化B.防止Fe2+水解C.防止Fe3+被氧化D.防止Fe3+水解9.下列物质中,属于共价化合物的是()A.NaCl B.HCl C.Na2CO3D.Na 10.可逆反应达到平衡后()A.V正>V逆B.V正=V逆C.V正<V逆D.无法确定11.将pH=3.5的盐酸溶液与pH=10.5的NaOH溶液等体积混合后,溶液的pH是()A.7 B.<7C.>7 D 无法判断12.离子键最可能存在于()A.金属原子之间B.非金属原子之间C.金属原子与非金属原子之间D.任意两种元素的原子之间13.用0.1000 mol/L NaOH溶液滴定等体积、等pH值的HCl溶液和HAc 溶液时,所消耗NaOH溶液的体积()A.相同B.V NaOH(HCl溶液消耗)> V NaOH(HAc溶液消耗)C.V NaOH(HCl溶液消耗)< V NaOH(HAc溶液消耗)D.无法确定14.34.2 g/L蔗糖溶液的物质的量浓度为(蔗糖的摩尔质量为342 g/mol)()A.0.01 mol/L B.0.1 mol/LC.0.001 mol/L D.1 mol/L15.摩尔是表示()A.物质的量的单位B.摩尔质量的单位C.物质浓度的单位D.物质微粒的单位16.目前对人类环境造成危害的酸雨主要是由下列哪种气体污染造成的()A.CO2B.H2S C.SO2D.CO17.配制医疗上用的生理盐水是采用固体()A.NaCl B.KCl C.CaCl2 D.MgCl2 18.下列不能与氯气直接化合的物质是()A.H2B.Na C.Fe D.N219.没有强烈刺激性气味的气体是()A.O2 B.NH3C.SO2D.Cl220.原子序号11~17号的元素,随核电核数的递增而逐渐变小的是()A.电子层数B.最外层电子数C.原子半径D.元素最高化合价21.金属Na长时间放置在空气中,最终的产物是()A.Na2CO3B.NaOHC.Na2O D.Na2O222.已知某溶液,可使石蕊试液变红,使甲基橙变黄色,则该溶液的pH 值范围为( ) A.8~10 B.5~8C.4.4~5.0 D.3.1~4.423.一定温度下,加水稀释弱酸,下列数值将减少的是()A.[H+] B.pH C.Ka D.不确定24.可逆反应C(s)+H2+H2(g)-Q (表示正反应为吸热反应)达平衡状态时,若降低温度,则化学平衡向哪移动()A.正反应方向B.逆反应方向C.没有D.无法判断25.下列指示剂中,不属于酸碱指示剂的是()A.酚酞B.甲基橙C.石蕊D.淀粉26.下列关于催化剂作用的叙述中错误的为()A.可以加速某些反应的进行B.可以抑制某些反应的进行C.可以使正逆反应速度以相等的速度加快D.可以改变反应进行的方向27.醋酸与NaOH溶液等浓度等体积混合后,溶液的pH是()A.等于7 B.小于7 C.大于7 D.无法判断28.某同学选择HAc~NaAc作缓冲对,配制pH=5.0的缓冲溶液,经酸度计测定所配溶液的pH为4.78,则应向此缓冲溶液中滴加少量什么溶液来调节。

《无机化学》期末考试试卷附答案一、单选(共20小题,每小题3分,共60分)1、在标准状态下, 1.0 dm3氢气的质量应为()A、0.089 gB、0.11 gC、9.0 gD、11.2 g2、扩散速率三倍于水蒸气的气体是()A、HeB、H2C、CO2D、CH43、欲配制 pH = 13.00 的溶液 10.0 dm3, 所需 NaOH 固体的质量是()(相对原子质量: Na 23 )A、 40 gB、 4.0 gC、 4.0×10-11 gD、 4.0×10-12 g4、有一种称“墨海”的带盖砚台,其结构如图所示,当在砚台中加入墨汁,在外圈加入清水,并盖严,经过足够的时间,开盖看到的情况是()A、砚中墨汁干枯,外圈水成淡墨B、砚中墨汁变淡,外圈水成淡墨,且二者浓度相同C、砚中墨汁变淡,外圈水干枯D、没有发生变化5、下列说法正确的是()A、当液体与其蒸气处于平衡时,蒸气的压力称为液体的饱和蒸气压B、液体混合物的蒸气压等于各纯组分液体的蒸气压之和C、非电解质稀溶液中某一液体组分的蒸气分压等于它在相同温度下的饱和蒸气压与其在溶液中的摩尔分数之积D、蒸气压的大小与容器体积的大小有关6、已知:2H2(g) + S2(g)2H2S(g) K p12Br2(g) + 2H2S(g)4HBr(g) + S2(g) K p2H2(g) + Br2(g)2HBr(g) K p3则K p3 等于()A、(K p1 / K p2 )1/2B、(K p2·K p1)1/2C、K p2 /K p1D、K p2·K p17、氢硫酸电离常数K1 = 1 ⨯ 10-7,K2 = 1 ⨯ 10-13,在0.1 mol·dm-3 H2S水溶液中溶液的pH值是()A、10-2B、 2C、 3D、48、用0.20 mol·dm-3 HAc和0.20 mol·dm-3 NaAc溶液直接混合(不加水),配制1.0 dm3pH = 5.00的缓冲溶液,需取0.20 mol ·dm -3HAc 溶液为( ) (p K a (HAc) = 4.75)A 、6.4 ⨯ 102cm 3B 、6.5 ⨯ 102 cm 3C 、3.5 ⨯ 102cm 3 D 、3.6 ⨯ 102cm 39、钒的电势图为 1.000.360.25()()()()VVVV V V IV V III V II ++-已知: ϕ(Zn 2+/Zn) = -0.76 V , ϕ(Sn 4+/Sn 2+) = +0.15 Vϕ(Fe 3+/Fe 2+) = +0.77 V , ϕ(S/H 2S) = +0.14 V欲将V(V) 还原到V(IV),在下列还原剂中应选用( ) A 、FeSO 4 B 、Zn C 、SnCl 2 D 、H 2S10、对于下面两个反应方程式,说法完全正确的是( )2Fe 3+ + Sn 2+Sn 4+ + 2Fe 2+Fe 3+ + 21Sn2+21Sn 4+ + Fe 2+A 、两式的 E ,m r G ∆,K C 都相等 B 、两式的 E , m r G ∆,K C 不等 C 、两式的 m r G ∆相等, E ,K C 不等 D 、两式的 E 相等, m r G ∆,K C 不等11、铅蓄电池在充电时,阳极反应是( )A 、PbSO 4 + H 2O =PbO 2 + 4H ++ SO -24+ 2e -B 、Pb + SO -24= PbSO 4+ 2e -C 、PbSO 4+ 2e -= Pb + SO -24D 、PbO 2+ 4H ++ SO -24+ 2e -= PbSO 4 + 2H 2O12、已知金属 M 的下列标准电极电势数据:( )(1) M 2+ (aq) + e - =M +(aq)1ϕ= -0.60 V(2) M 3+(aq) + 2e -= M +(aq)2ϕ= 0.20 V 则M 3+(aq) + e -= M 2+ (aq) 的ϕ是A 、0.80 VB 、-0.20 VC 、-0.40 VD 、1.00 V13、对于一个一级反应,如其半衰期t 1/2在0.0100 s 以下即称为快速反应,此时它的速率常数k 值在( )A 、 69.3 s -1以上 B 、6.39 s -1以上 C 、0.0693 s -1以上D 、6.39 s -1以下14、反应2A −→−B 为二级反应,若A 的起始浓度为1.00 mol ·dm -3,在开始反应1 h 之后减少了一半,那么2 h 后,A 的浓度将为( ) A 、 0.125B 、0.333C 、0.250D 、0.49115、在各种不同的原子中3d 和4s 电子的能量相比时( ) A 、3d 一定大于4s B 、 4s 一定大于3d C 、3d 与4s 几乎相等D 、不同原子中情况可能不同16、下列关于屏蔽效应的说法中,正确的一个是( )A 、4s 电子的屏蔽常数σ 4s 反映了4s 电子屏蔽原子核作用的大小B 、当n 和Z 相同时,某电子的σ 值愈大,该电子的能量就愈低C 、主量子数n 相同,角量子数l 不同;随l 增大,电子的屏蔽作用增大D 、当屏蔽电子数目愈多或被屏蔽电子离核愈远时,σ 值也愈大 17、下列各对分子型物质中,沸点高低次序不正确的是( ) A 、HF > NH 3 B 、 S 2(g) > O 2 C 、NH 3 > PH 3 D 、SiH 4 > PH 3 18、已知金刚石晶胞是类似于立方 ZnS 型的面心立方晶格 ,则晶胞中碳原子数是 ( ) A 、4B 、8C 、12D 、619、按分子轨道理论,-2O 的键级是 ( ) A 、1 B 、2 C 、1 D 、220、下列分子和离子中,中心原子的价层电子对几何构型为四面体,且分子(离子)空间构型为角形(V 形)的是( ) A 、+4NH B 、SO 2C 、H 3O +D 、OF 2二、填空(共20空,每空2分,共40分)1、0℃ 和标准压力下,1 dm 3水能溶解49.0 cm 3O 2 和23.5 cm 3N 2,在相同的条件下,1 dm 3水约能溶解空气 ________________________ cm 3。

《无机化学》〔上册〕期末考试试卷及答案《无机化学》〔上册〕期末考试试卷试卷 (一)一、填空题 (每空1分,共44分)1.当体系的状态被改变时,状态函数的变化只决定于_________,而与_________无关2.空气中的SO2与水作用并经氧化,生成 ___________ 使大理石转化为_________, ________,因而使雕象遭到破坏.3.:碘元素的电势图: 0.145V E? 0.535VIO3–IO–I2I–0.49V 那么:E?IO–/I2=_______, E?IO3–/I–=_____________﹣·L1的H2SO4溶液(铂为电极),阴极产物是______, 阳极产物是 ______﹣﹣﹣:E? O2/OH=1.229V, E? H+/H2 = 0.000V, E? S2O82/SO42=2.01V5.我国化学家徐光宪总结归纳出了能级的相对上下与____________________有关,且能级的上下与值有关的近似规律.6.制备胶体的方法有_______和_______.7.气体的根本特征是它的性和性。
··L-1NaAc溶液,HAc的电离度将________________,这种作用被称为__________________.9.离子的结构特征一般包括: 离子电荷、、三个方面.10.:2A+B=2C为简单反响,此反响对A物质反响级数为___________,总反响为____________级反响.11.共价键按共用电子对来源不同分为_____________和_______________; 共价键按轨道重叠方式不同分为_______________和________________。
12.亚氯酸可用_____________________反响而制得水溶液,它极不稳定迅速分解,反响式为:1。
13.在化学反响方程式 2KMnO4+5H2O2+6HNO3=2Mn(NO3)2+2KNO3+8H2O+5O2↑中,氧化产物为 ___________, 复原产物为 ____________14.O2分子中有 _________________________键,依公式 _________________ 可以算出O2的磁矩.15.A,B两种气体反响,设A的浓度增加一倍,速度增加一倍,B的浓度增加一倍,那么反响速度增加三倍,假设总压力减小为原来的1/2时,反响速度将变为原来的_________倍,该反响的总反响级数为____________. —————————,,是由————————于————————年制备的。
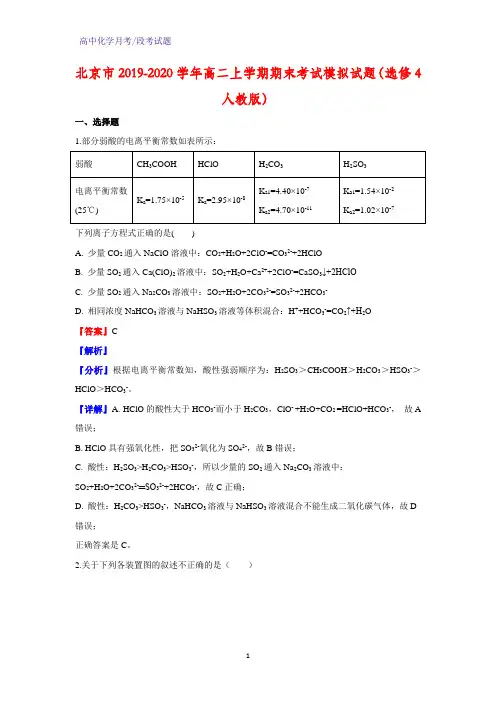
北京市2019-2020学年高二上学期期末考试模拟试题(选修4人教版)一、选择题1.部分弱酸的电离平衡常数如表所示:下列离子方程式正确的是()A. 少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=CO32-+2HClOB. 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClOC. 少量SO2通入Na2CO3溶液中:SO2+H2O+2CO32-=SO32-+2HCO3-D. 相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-=CO2↑+H2O『答案』C『解析』『分析』根据电离平衡常数知,酸性强弱顺序为:H2SO3>CH3COOH>H2CO3>HSO3->HClO>HCO3-。
『详解』A. HClO的酸性大于HCO3-而小于H2CO3,ClO- +H2O+CO2 =HClO+HCO3-,故A 错误;B. HClO具有强氧化性,把SO32-氧化为SO42-,故B错误;C. 酸性:H2SO3>H2CO3>HSO3-,所以少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-═SO32-+2HCO3-,故C正确;D. 酸性:H2CO3>HSO3-,NaHCO3溶液与NaHSO3溶液混合不能生成二氧化碳气体,故D 错误;正确答案是C。
2.关于下列各装置图的叙述不正确的是()A. 用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液B. 图②装置盐桥中KCl的Cl-移向右烧杯C. 图③装置中钢闸门应与外接电源的负极相连获得保护D. 图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同『答案』B『解析』『详解』A.用图①装置实现铁上镀铜,根据电流的移动方向可知a极为阳极,是铜电极,b 电极为Fe电极,电解质溶液可以是CuSO4溶液,A正确;B.Zn电极为负极,Cu电极为正极,负极Zn失去电子变为Zn2+进入溶液,根据异种电荷相互吸引的原则,在含有盐桥的原电池中,盐桥中阴离子流向负极区、阳离子流向正极区,该装置中Zn作负极、Cu作正极,所以盐桥中KCl的Cl-移向左烧杯,B错误;C.电解池阴极与电源的负极连接,金属被保护,电解池阳极的金属与电源正极连接而加速被腐蚀,要保护钢铁,则钢铁连接原电池负极,C正确;D.在左边的原电池中Al为负极,Al是+3价的金属,每27gAl会失去3mol电子;右边的原电池中Zn是负极,Zn是+2价的金属,65gZn会失去2mol电子,所以图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同,D正确;故合理选项是B。
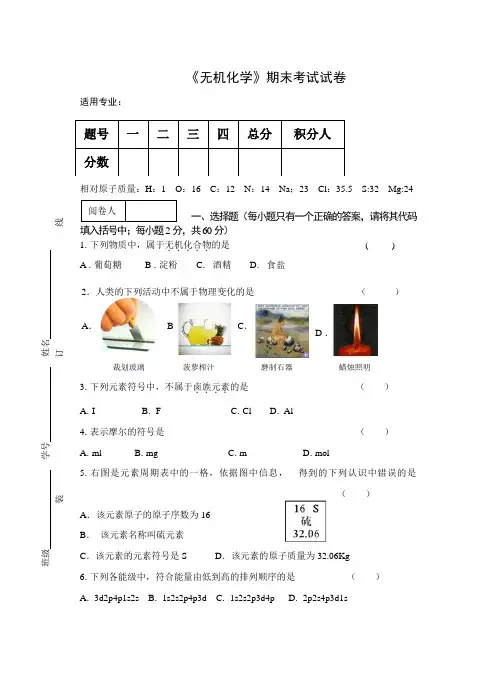
《无机化学》期末考试试卷适用专业:相对原子质量:H :1 O :16 C :12 N :14 Na ;23 Cl :35.5 S:32 Mg:24一、选择题(每小题只有一个正确的答案,请将其代码填入括号中;每小题2分,共60分) 1.下列物质中,属于无机化合物.....的是 ( ) A .葡萄糖 B .淀粉 C . 酒精 D . 食盐3.下列元素符号中,不属于卤族元素....的是 ( ) A .I B . F C .Cl D . Al4.表示摩尔的符号是 ( ) A .ml B .mg C .m D .mol5.右图是元素周期表中的一格,依据图中信息, 得到的下列认识中错误的是( )A .该元素原子的原子序数为16B . 该元素名称叫硫元素C .该元素的元素符号是SD .该元素的原子质量为32.06Kg 6.下列各能级中,符合能量由低到高的排列顺序的是 ( ) A . 3d2p4p1s2s B . 1s2s2p4p3d C . 1s2s2p3d4p D . 2p2s4p3d1s题号 一 二 三 四 总分 积分人 分数裁划玻璃A .B 菠萝榨汁C .磨制石器D .蜡烛照明2.人类的下列活动中不属于物理变化的是 ( ) 阅卷人班级 学号 姓名 - -------------------------------------装--------------------------------------------订---------------------------------------线-------------------------------------7. 5.5 mol 水的质量是 ( ) A . 18g B . 9g C . 99g D . 108g( )9.在标准状况下,任何气体的标准摩尔体积都是 ( ) A . 2.24L B . 11.2L C . 22.4L D . 224L10.下列物质的分子中属于极性分子的是 ( ) A . CO 2 B . O 2 C . HCl D . I 211.NaOH 的摩尔质量是 ( ) A . 4g B . 40 g/mol C . 40 Kg D . 28 mol12.在0.0001 mol/L 的NaOH 溶液中H +浓度为 ( ) A .10-4 mol/L B .10-10 mol/L C . 10-14 mol/L D .10-7mol/L14. 196g H 2SO 4的物质的量是 ( ) A .1mol B .2mol C .3mol D . 0.2mol 15. 浓度为0.01 mol/L 的稀盐酸的pH 是 ( ) A . 7 B . 2 C . 4 D . 816. 在标准状况下44.8L N 2气体的物质的量是 ( ) A .2mol B .1mol C .0.5mol D . 0.2mol17.配制250mL0.1mol/L 的NaOH 溶液需要NaOH 的质量是 ( ) A . 1g B . 10g C . 0.1g D .4gA . 试管B .烧瓶 D . 锥形C .容量瓶8.配制一定物质的量的浓度的溶液应选用的主要仪器是13.下列图像中不是..p 亚层电子云的是 ( ) A.C .B.D.19.配制250mL0.1mol/L 的NaCl 溶液应该选用的容量瓶的规格是 ( ) A . 250 mL B .200mL C . 100mL D . 500mL 20. 0.5mol 的水中含有的水分子个数是 ( ) A .3.01×1023B .6.02×1023C . 1.8×1023D .6.02×102221.标准状况下,与6.4gO 2的分子数目相同的CO 2气体的体积是 ( ) A . 22.4L B .11.2L C .4.48L D .2.24L22.在纯水中pH=7的原因是纯水 ( ) A . [H +]﹥[OH -] B . [H +]﹤[OH -] C . [H +]=[OH -] D .只有[H +] 无[OH -] 23.阿伏伽德罗常数是 A .5×1026B . 3.01×1022C . 6.02×1023D .3.01×1022.24.食盐属于 ( ) A .分子晶体 B .原子晶体 C . 离子晶体 D . 金属晶体 25.物质的量的国际单位是 ( ) A .千克 B .克 C .摩尔 D . 米27.非极性分子与非极性分子之间的作用力主要是 ( ) A .取向力 B .诱导力 C .色散力 D . 氢键28.在通常情况下,水的离子积常数.....是 ( ) A . 1×10-8B .1×10-7C .1×10-14D .1×10-1018.下图是元素周期表中某元素的原子结构示意图, ( ) 依据图中信息所得的结论错误的是 A .该元素的原子很容易得到电子 B .C. 该元素在第一主族 D . 该元素是碱金属元素v26.如图表示某可逆反应的化学平衡建立过程,下 列对于图像中的意义分析有错误的是A . 正反应速率在不断的减小B . 逆反应速率不断增大C .达到平衡时正反应和逆反应都停止,速率都为零D .达化学平衡时正、逆反应速率相等,29.某可逆反应的逆反应的平衡常数K 逆为4,则正反应的平衡常数K 正为( ) A .0.25 B .10 C .2 D .530. 金属铝属于 ( ) A . 原子晶体 B . 分子晶体 C .金属晶体 D .离子晶体 二、判断题(正确的打“√”,错误的打“×”;每小题1分,共10分)31.元素周期表中同一周期的元素随着原子序数的递增原子的半径由大变小 ( ) 32.元素周期表中同一主族的元素原子的最外层电子数一定相等 ( ) 33.分子是否有极性取决于整个分子中正负电荷的重心是否重合 ( ) 34.氧化还原反应的特征是有元素化合价的升降 ( ) 35. 强酸弱碱盐水解,溶液呈酸性 p H ﹤7 ( ) 36. 原电池是一种将电能转变为化学能的装置 ( ) 37. 物质的量就是指物质的质量 ( )38. 酸性溶液中[OH -]﹥[H +]﹥1×10-7mol/L ( ) 39.电子云图中的一个小黑点就代表一个电子. ( )40. 在NaAc-HAc 组成的缓冲溶液 中抗酸成分是HAc ( ) 三、填空题(每空1分,共10分)41. 硫酸四氨合铜(Ⅱ)的化学式是 。

3么7-/北京科技大学2005年硕士学位研究生入学考试试题试题编号:诚题名称:(共5頁)适用专北:应用化学___________________________________________________________________________ 说明:1.所有答案必须茗在答题紙上.做在试题或草«纸上无效.2.符号S在右上角表示标准态,例如/表承一个标准大气压101325Pa. f5表示标准电动势等.—、填空题(共21题50分)1-(6 分)某电池在/时电动势与温度的关系为公mV = -68.00 - 0.312 (77K- 298).298 K时电池的电动势E = __________ ,当瑜出2 mol电子电ft时,电池反应的 : 45ra= •当输出丨mol电子电最时,电池的____________ 电动势£- :电池反应的 : 45-=•2-(5 分)NH4HS(S)放入抽空的瓶内发生分解:NH,HS(s) = NHj(g) * H2S(g), 则分解反应达到平衡时该体系的独立组分数为 ,相数为 , 自由度数为 :在25X?时测得体系达到平衡时的压力为66.66 kPa.若此湿度时NH}的分S为13.33 kPa;要使NH,和H2S的混合气体体系中不形成NH.HS固体.则应将H:S的分压控制在(填入大.小,等)于kPa.3.(4 分>298 K 时,已知^(Cu^lCul^.SS? V, ^(Zn^lZn^ - 0.7628 V.则电池Zn(s)|Zn2,(a|-l)||Cu2,(a2-l)|Cu(s)的£-,电池反应的平衡常数 ,当电能耗尽时,两离子的活度比卬/<12- •4.(2 分)电池放电时.随电流密度増加阳极电位变.阴极电位变, 正极变■负极变•5.P 分>K化学反应在恒压、绝热和只做膨胀功的条件下进行,系统的温度由K升髙至则此过程的焓变零;如果这一反应在恒恒压和只做膨胀功的条件下进行,则其熗变零.(填入大于,等于,小于)6.(2 分)计算下列各ffi俎过S7- (2 分)液态汞的表面张力r = 0.4636N • m-' + 8.32X10-3N • m.1• K.1• T-3.13X 10.7N • m.1• K2• T2 在400 K时,汞的⑽dA、T.V B_____________________________________________________ .8.(2 分)有理想气体反应达化学平衡A(g) + B(g) = 3C(g).在等滋下维持体系总压不变,向体系中加入惰性气体,平衡移动:若将气体®于钢简内加入惰性气体后平衡移动•9.(2 分)己知0.536 V,/(Bri/Br)= 1.065 V. «»$(Clz/CI? 1.360V.溶液中各卤索离子浓度相笏• 在不考®超电势的情况f, Cl2, Br:, h析出的先后顺序是•10.(2 分)对于任何宏现物质.其焓//一定内能t/(填上>、<,=)•因为____ :对于等沮理想气体反应,分子数埔多的AW—定A(/,因为______________________ •11.(2 分)300 K时,将2molZn片溶于过量的蚝昧酸中,若反应在敞口容器中进行时放热込,在封闭刚性容器中进行时放热则Qv-Q^ _____________________ J-12.(2 分)若298 K 时,反应2NOj(g) = N?O4(g)的K\■ 8.834 .则当p(NO2)=l kPa,p(N204)-IO kPa 时,反应将.(A)向生成N2O«方向进行(B)向生成NOj方向进行(C)反应恰好达到平衡(D)不能判断K进行的方向13.(2 分)在恒墒恒容只做体枳功的封闭体系甩,当热力学函数到达坫ffi时,体系处于平衡状态•14.(2 分)卡诺热机的效率只与葙关.而与关争15.(2 分)对一射闭体系.ir f=o时,下列过程中体系的AR AS. AG何界必为零?(1)绝热密闭刚性容器中进行的化学反应过程 :(2)某物璜的恒溢恒压可逆相变过程 !(3)某物庾经一棚环恢复®状态____________ •16.(2 分)选择">”,“<”、•* = ■•中的一个填入下列空格:实际气体绝热自由膨胀,0. AS0.17.(2 分}1 mol 原子分子理想气体•从p>=202 650 Pa. T|=-273K在p/r=常数的条件不加热,使压力增加到灼=405 300 Pa,則体系做的体积功W=J.18. (2 分>选择“> ”、“<”、“=”中的一个填入下列空格:100-C, 1.5/的水蒸气变成1WC ,1.0/的液体水.AS _________________ 0, AG _________ 0. 19. (2 分>在2000 K 时,理想气体反应CO(g) + (l/2)O2(g) = CO 2(g)的平衡常数K p =0.640 (kPa)'则该反应 的 J mor 1 . 20.(2 分)在封闭体系中,只做体积功•在恒温•恒压条件下某化学反应的<dG/d^)rfi = 0.农示该反应己达 平衡,即反应体系的熵到达最大值•此说法珐否正确, 21.(I 分> 可以通过实验碥定胶粒带电符号•二、计算题(共9题70分> 22. (10 分)水和溴苯酊形成完全不互溶的体系.该体系在外压为101.325 kPa 时,«沸点为95.4 °C ,此溢® 下溴苯的饱和蒸气压为15.700 kPa.计算:(1〉在95.4 °C 时,对溴苯进行水蒸气蒸馏的馏出物中, 溴苯的质量分数w(C t H,Br); (2)蒸出10kg 浹苯时,需消耗水蒸气多少公斤?己知泱苯的分子量为 157.01.水的分子量为18.02. 23. 10 分 反应B.正逆反应均为一级己知:IgAi/s 1 - -2000/7+ 4.0,1队(平衡常数)=2000/T- 4,0.反应开始时.(Afc- 0.5 mol • dm 人(B]o=0.05 mol - dm 3.试计算:(1)逆反应的活化能£.! ? (2)400K 下,反应平衡时A 和B 的浓度• 24. (15 分)苻一固定的导热良好的瞞板(aa’>将一个带对无庠擦的绝热活寒的绝热气缸分为左右两室•左室 中充入I mol 坩子分子理想气体(C..-1.5R).右宽中充入2 mol 双垛子分子理想气体(C,.. -2.5R) (始态如下图所示〉•若将绝热活戏上的钔钉拔掉.求达到平衡时体系终态的温度7;及过程的IK.Al/.AW.aS.己知外压p n -10l.325 kPa.25.(10 分)液体A 和B 玎形成理想溶液,己知某溶液含有25%(摩尔分数)的A,在298 K 时与溶液平衡的热 气含有 50%的 A,又知 A 的 ■=20.9kg mor 1,B 的 =29.26 kg-mof'.求:(1)298 K 时纯A 蒸气伍与纯B 热气压之比: (2) 373 K 时两者蒸气压比值(可只列方程^-101 325 kPaPJ Q:四、证明题(10分)34.(5 分)证明:Q-Cr= •曲_ 綱!啪T-V\35.(5 分)总反应的表现速率W数*,若与各元反应的逨率常数*.宵如下之关系: *= n*7则请证明农观活化能E.与元反应活化能E,之关系必为E a第S»汝:^7-/北京科技大学2007年硕士学位研究生入学考试试题相編号:«7 _________________ 试题名称:物g化学B ________________________ (共4 K)遂用专i: 分析化学.无权化荦,有学.物理化李 ________________________________________________ 说明:1.所有答案必須骂在答题纸上,做在试題或草稿纸上无效.2.#兮$在右上角表示标准态,例如表示一个标准大气及101325P*. f5表示标准屯劝势等.送择E (AlO£ 20分) ,1.2分关于》摩尔最,下面的fi述中不正SI的是:< )(A)»摩尔》的数ffi可以ft正數.负数和零(B)溶液中种广度性«»赉曲摩尔量,而不等于M庫尔景(o味曲摩尔自由K外.其惟《摩尔量籌不等于化学》(D)番液中各组分的番犀尔•之M符合W4BM-杜亥》关系式2.2分在環想气体的5-riH上,任_条《««与任一条rani找的斜帛之比,在怕《时所代农的含义a:()(A)(aswv(咖(B)(aw7M«叫載~(Q (aSWM3SWX>=</Cr(D)3.2分以下送因1(中,<B—个®索是乳状液8油/水水/油®的主费因累?( )(A)乳化H的tt廉(B)两I♦濱镎的互溶S曲(C)液律的相对体枳(D) 助4.2分下E为某气体的W中为W溢可逆变化•对外做功为^A-C为绝热可逆变化,对外做功为JK AC;A-D为多方不町逆交化力外傲功为»T KD. BJJ.C «的体》相匁• W下述关系,个ff«?( )(A) W^W M:(B) W汐W比(C)IFkPir*© (D) WaWto5. 2分在电泳实驺中.现察到分效相向阳极移动.农明: (A) 胶粒帝正电 (B) 胶粒?B 负屯(C) 电动电位相对于溶液本体为E (D) Stera 面处电位相对溶液本体为正理想气体经绝热可逆膨胀至一定的终态.该过0中体系的規变AS-及环境的《变为:() (A) AS«>0, AS<<0 (B)厶S»<0, AS»>0 (C) ASipO. AS»-0 (D) AS»-O. A5»-0 . 995Pa,则该地区水的沸点为: • (〉(A) 358.2 K (B) 8S.2K (0 358.2 Z (D) 373 K8. 2分有一容S 四逝泞热,上®有一可移动的《塞,在该容器中W 时放入锌块和站®.发生化学反应活》将上移一定 距离,若以碎和挂酸为体系则: ()(A) Q<0, ^-0, A.l/<0 . (B) Q^O, W>0, A,t/<0 (C) g<0, W>0, 6,U=0 (D) g<0, W>Q. A r U<0 一饵乐反应体系,若产物与反应物的AC 戶0,M 此反敁 (A)吸热 (B)放热 (C)无热效应 (D)吸放热不能W 定H 想气体从相问始态分别经绝热可逆和绝热不对逆膨胀H 达相网的压力,则其终 态的坦议、体积和44系的焓变必定是: (二、填空题(共4g 20分) . n. 6分在w 溫怛乐s 有北体积功&在的w 况r,则可用 _____________ *判别过s 超否ws ,即在不可逆t«况下,外 界对体系所做的 _______ 子体系 ____________________ 的增毋.12. 4 分对于下面的及应2NO 2(g)^2NO(g) + O,(g)如果对体系坩加还力.则反应向 _______ 移动.如®对体系如入悄性气体,«反极向 ________ 移动.(填左成右> 13. 5 分-绝热容S 分成两ffi 分,分别2组3、压力相P )的ZmolO,. 3D10JN,(均为gw 气体〉,抽去臟,使两气体捉合达平衡,《计算体系*的变化= __________ .N»: ^7-2-在OX :到lOOT?的范IB 内.液态水的达气压P 与r 的关系为Jg(p/Pa):-2265/7*U.101 , 地区的气压只有5910. 2 分>么H 相< A//«» < △ //« >中各气体的物®的置分数t 压在310 K 时为729.54 栳匁浓沿的《供浓度应该为多少?质ft 为 0.174 kg mor 1,%®報液$«为 KPkg tn’.•olNaCl ffi 液中的溶解度3.95X 10" dn^NaCI 的T1C1饱和洛液屮离子平均活度系数. 相平衡时,体系的自珀度. B 由度数目井不矛盾.因为,乙烯反应iCH^g) — CH J =CH :(B )+H 2(g)51-988 kPa 压力下,标准平衡常数AT* =0.898.反应开始前钵系中只有2 mol 乙饶,11CI 在W 水屮的娜勤 1.607X IO'2 mol -dm 3,在 0.100 S 是2.022X 10'试求在不含NaCl 和含夼0.100 mol ScChtt 焦耳-汤姆孙系数W .T "l.07X10i KkPa l ,CO 2的 =301 J K lmol 1,求在 298 K 时ISSOgCO,由 !5 kPa 答fflffi 缩到 1013.25 kPa 时的 A H. CO ;的茚尔分7® 为 44g/mol.i 分解反应,CICOOCCIXg) - 2COCWg) &-级反E, —定景CICOOCCIj 迅速51入一个说® ,.经454$ ,测树压力2.475 kPa,经过极长时岡后压力为4.000 kPa.此实«在578 K 时祇复 后.»得压力2.83SfcPa ■求此分解反应活化能E ,.B 两个组分在定圧T 形成的二元相阁如下阁所示.求液柱上升2 cm 的毛细管®大半径ft 多少?第3Jfrr>(共8E 80分)•但ft,此时物系A 都可以变化,而不至于导®新相产生和旧相消失,Ni:甲W松氮反应如下:CHjOH(g) ■ HCHO (g) ♦ H2(g).试求此反应在700t时的K* •己知各物现的热容表达式为: {20.42 + 103.68X10°TK + 24.64X lO^TVK/jJ.K-' mor'C*J:甲{18.83 ♦ 58.S8X !04TK -15^1 X !04(7yK),}J K , n>ol' C *^(H,) - {29.0S - 0.837 X10J PK ♦ 101X IO*(77K),}J K4 moJ-' A <(298 KyUmol' ^^[,(299 KyUoor'¥S -115.90 -110.04VBI-201.17 -161.88四、问答K (共3E 15分)23. 5 分当光攻射入分B体系时会发生什么情》?24. 5 分B钵*•力学的不松定律系.《它R在相当长的MfflStt史存4•试解鞾»因、25 5分元索x存在有丨,n.m三矜品喟,在其三相点o附近,摩尔熵的关系为么(11>>么(11])>5_(1),摩尔体积的关系为r^iu)>F;a)>^ii),a用p-rm函出H相的三条两相平衡曲线(要求各曲城的方本正确),)t 标出三个区域.五.(共2S 15 分〉26. 10 分的反庆物,常遇»—迕乎行的一《反应充争发生.ra为从ft力学上番来.很多神产物曲珐可ft产生的•试于£应》即僅*1和*1的位不同,B和C的半衰期M表观为相柯的、27. $ 分祖合物,试证明:(a)(a6_G/a7)r<0o»)«a(A^;^Dydn,-oN E : —/第1页北京科技大学2008年硕士学位研究生入学考试试题试题编号: 627试题名称:物理化学B(共3页)适用专业:分折化学、无机化学、有机化学、物理化学说明:1.所有答案必须写在答题纸上,做在试题或萇稿纸上无效。

无机化学期末考试试卷(B卷)答案课程考试试卷答案(B卷)课程名称:普通化学和无机化学考试时间:120分钟年级:xxx级专业:xxx题目部分;(卷面共有53题;100分;各大题标有题量和总分)一、单项选择题(20小题;共20分)1、在标准状态下, 1.0 dm3氢气的质量应为A、0.089 gB、0.11 gC、9.0 gD、11.2 g答案:A2、扩散速率三倍于水蒸气的气体是A、HeB、H2C、CO2D、CH4答案:B3、欲配制pH = 13.00 的溶液10.0 dm3, 所需NaOH 固体的质量是(相对原子质量: Na 23 )A、40 gB、4.0 gC、4.0×10-11 gD、4.0×10-12 g答案:A4、有一种称“墨海”的带盖砚台;其结构如图所示;当在砚台中加入墨汁;在外圈加入清水;并盖严;经过足够的时间;开盖看到的情况是A、砚中墨汁干枯;外圈水成淡墨B、砚中墨汁变淡;外圈水成淡墨;且二者浓度相同C、砚中墨汁变淡;外圈水干枯D、没有发生变化答案:C5、下列说法正确的是A、当液体与其蒸气处于平衡时,蒸气的压力称为液体的饱和蒸气压B、液体混合物的蒸气压等于各纯组分液体的蒸气压之和C、非电解质稀溶液中某一液体组分的蒸气分压等于它在相同温度下的饱和蒸气压与其在溶液中的摩尔分数之积D、蒸气压的大小与容器体积的大小有关答案:C6、已知:2H 2(g) + S 2(g)2H 2S(g) K p 1 2Br 2(g) + 2H 2S(g)4HBr(g) + S 2(g) K p 2 H 2(g) + Br 2(g)2HBr(g) K p 3 则K p 3 等于A 、(K p 1 / K p 2 )1/2B 、(K p 2·K p 1)1/2C 、K p 2 /K p 1D 、K p 2·K p 1 答案:B7、氢硫酸电离常数K 1 = 1 ⨯ 10-7;K 2 = 1 ⨯ 10-13;在0.1 mol ·dm -3 H 2S 水溶液中溶液的pH 值是A 、10-2B 、 2C 、 3D 、4 答案:D8、用0.20 mol ·dm -3 HAc 和0.20 mol ·dm -3 NaAc 溶液直接混合(不加水);配制1.0 dm 3 pH = 5.00的缓冲溶液;需取0.20 mol ·dm -3 HAc 溶液为 (p K a (HAc) = 4.75)A 、6.4 ⨯ 102 cm 3B 、6.5 ⨯ 102 cm 3C 、3.5 ⨯ 102 cm 3D 、3.6 ⨯ 102 cm 3 答案:D9、钒的电势图为 1.000.360.25()()()()VVVV V V IV V III V II ++-已知: ϕ(Zn 2+/Zn) = -0.76 V ; ϕ(Sn 4+/Sn 2+) = +0.15 Vϕ(Fe 3+/Fe 2+) = +0.77 V ; ϕ(S/H 2S) = +0.14 V欲将V(V) 还原到V(IV);在下列还原剂中应选用 A 、FeSO 4 B 、Zn C 、SnCl 2 D 、H 2S答案:A10、对于下面两个反应方程式;说法完全正确的是 2Fe 3+ + Sn 2+Sn 4+ + 2Fe 2+Fe 3+ + 21Sn 2+21Sn 4+ + Fe 2+ A 、两式的 E ; m r G ∆;K C 都相等 B 、两式的 E ; m r G ∆;K C 不等 C 、两式的 m r G ∆相等; E ;K C 不等 D 、两式的 E 相等; m r G ∆;K C 不等答案:D11、铅蓄电池在充电时;阳极反应是A 、PbSO 4 + H 2O =PbO 2 + 4H + + SO -24+ 2e -B 、Pb + SO -24= PbSO 4+ 2e -C 、PbSO 4+ 2e -= Pb + SO -24D 、PbO 2+ 4H ++ SO -24+ 2e -= PbSO 4 + 2H 2O答案:A12、已知金属M 的下列标准电极电势数据:(1) M2+ (aq) + e-= M+(aq) 1ϕ= -0.60 V(2) M3+ (aq) + 2e-= M+(aq) 2ϕ= 0.20 V则M3+ (aq) + e-= M2+ (aq) 的 ϕ是A、0.80 VB、-0.20 VC、-0.40 VD、1.00 V答案:D13、对于一个一级反应;如其半衰期t1/2在0.0100 s以下即称为快速反应;此时它的速率常数k值在A、69.3 s-1以上B、6.39 s-1以上C、0.0693 s-1以上D、6.39 s-1以下答案:A−B为二级反应;若A的起始浓度为1.00 mol·dm-3;在开始反应1 h之14、反应2A−→后减少了一半;那么2 h后;A的浓度将为A、0.125B、0.333C、0.250D、0.491答案:B15、在各种不同的原子中3d和4s电子的能量相比时A、3d一定大于4sB、4s一定大于3dC、3d与4s几乎相等D、不同原子中情况可能不同答案:D16、下列关于屏蔽效应的说法中;正确的一个是A、4s电子的屏蔽常数σ4s反映了4s电子屏蔽原子核作用的大小B、当n和Z相同时;某电子的σ值愈大;该电子的能量就愈低C、主量子数n相同;角量子数l不同;随l增大;电子的屏蔽作用增大D、当屏蔽电子数目愈多或被屏蔽电子离核愈远时;σ值也愈大答案:D17、下列各对分子型物质中;沸点高低次序不正确的是A、HF > NH3B、S2(g) > O2C、NH3 > PH3D、SiH4 > PH3答案:D18、已知金刚石晶胞是类似于立方ZnS 型的面心立方晶格;则晶胞中碳原子数是A、4B、8C、12D、6答案:BO的键级是19、按分子轨道理论;-2A、1B、2C、1D、2答案:C20、下列分子和离子中;中心原子的价层电子对几何构型为四面体;且分子(离子)空间构型为角形(V形)的是A 、+4NHB 、SO 2C 、H 3O +D 、OF 2答案:D二、填空(20小题;共20分)1、0℃ 和标准压力下,1 dm 3水能溶解49.0 cm 3 O 2 和23.5 cm 3 N 2,在相同的条件下;1 dm 3水约能溶解空气 ________________________ cm 3。

北京科技大学成人教育学院2007—2008学年第二学期《无机化学》试题B卷姓名:班级:学号:题号一二三四五六总分得分一、填空题:(每空1分,共30分)1、频率越高,活化分子数,反应。
2、H2(g)+I2(g)=2HI(g),Kθ=50.3(713k).某状态下,p氢气=p碘=5.379×105pa,p碘化氢=62.59×105pa.则自发进行的方向是______________,原因是________________。
2、2NH3(g)=N2(g)+3H2(g).298k,△rHm=+92.22kj·mol-1,△rS m=+198.53j·mol-1·k-1,则标准状态下,NH3(g)自发分解的温度是_________________。
3、系统命名[CoCl(NH3)3(H2O)2]Cl2为,三羟基.水.乙二胺合铬(Ⅲ)的化学式为。
4、已知基元反应2NO2=2NO+O2,则其速率方式为v= ,反应级数为。
5、当J<Ksp时,沉淀从溶液中;当J>Ksp时,平衡移动,沉淀无析出;J=Ksp时,为饱和溶液,溶液中的离子和沉淀处于状态。
6、自然界中硬度最大的单质是_______________;熔点最高的金属元素是____________.7、往KI和足量KCIO3组成的混合溶液中逐滴加入稀H2SO4,可观察到的现象是_____________。
8、根据"碰撞理论”,反应速率取决于以下3个因素:、_和。
9、在水溶液中,HCIO4与HNO3的酸强度比较,是________,水被称为__________; 在液体CH3COOH中,HCIO4与HNO3的酸强度比较,是_________,,故液态CH3COOH被称为。
10、已知反应1)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)2)3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)3)Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)则反应feo(s)+co(g)=fe(s)+co2(g)的恒压反应热计算公式是=____________,其值=___________。