品质不良报告格式.doc
- 格式:doc
- 大小:17.93 KB
- 文档页数:4
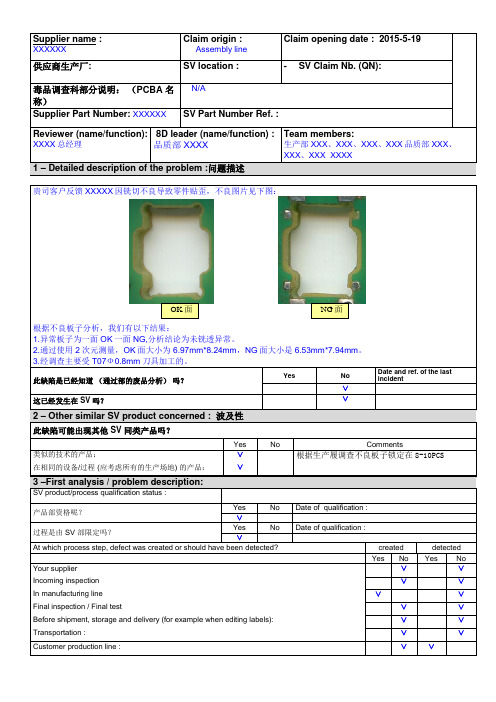
Supplier name :XXXXXXClaim origin :Assembly lineClaim opening date : 2015-5-19供应商生产厂: SV location : - SV Claim Nb. (QN):毒品调查科部分说明:(PCBA 名称)N/ASupplier Part Number: XXXXXX SV Part Number Ref. :Reviewer (name/function):XXXX总经理8D leader (name/function) :品质部 XXXXTeam members:生产部XXX、XXX、XXX、XXX品质部XXX、XXX、XXX XXXX1 – Detailed description of the problem :问题描述贵司客户反馈XXXXX因铣切不良导致零件贴歪,不良图片见下图:根据不良板子分析,我们有以下结果:1.异常板子为一面OK一面NG,分析结论为未铣透异常。
2.通过使用2次元测量,OK面大小为 6.97mm*8.24mm,NG面大小是6.53mm*7.94mm。
3.经调查主要受T07Ф0.8mm刀具加工的。
此缺陷是已经知道(通过部的废品分析)吗?Yes NoDate and ref. of the lastincident∨这已经发生在 SV 吗?∨2 – Other similar SV product concerned : 波及性此缺陷可能出现其他 SV 同类产品吗?Yes No Comments类似的技术的产品:∨根据生产履调查不良板子锁定在8-10PCS在相同的设备/过程 (应考虑所有的生产场地) 的产品:∨3 –First analysis / problem description:SV product/process qualification status :产品部资格呢?Yes No Date of qualification :∨过程是由 SV 部限定吗?Yes No Date of qualification :∨At which process step, defect was created or should have been detected? created detectedYes No Yes No Your supplier ∨∨Incoming inspection ∨∨In manufacturing line ∨∨Final inspection / Final test ∨∨Before shipment, storage and delivery (for example when editing labels): ∨∨Transportation : ∨∨Customer production line : ∨∨OK面NG面。

来料品质异常报告模板概述来料品质异常报告用于记录在物料检验、验收、入库过程中发现的品质异常,包括但不限于:外观缺陷、尺寸不符、成分分析不合格等问题。
本模板旨在规范来料品质异常报告的格式,以便于异常信息的准确、及时、全面传达,以及后续问题跟踪和处理。
报告日期报告的日期填写检验员发现品质异常的当天,格式为年-月-日,例如:2021-06-01。
报告编号在报告日期之后填写“报告编号”,编号格式由公司内部制定。
建议按照年份、部门、顺序编号方式(如2021-QC-001),以便于后续的追溯和统计。
检验物料信息检验物料信息包括物料名称、规格型号、产地、供应商、批次号等,根据实际情况填写完整、准确。
特别是批次号,必须填写清楚,否则将影响后续问题定位和追溯。
异常情况描述在此部分中,详细记录检验员发现的异常情况。
包括以下内容:1.检验要求:记录该检验项对应的检验要求,可以是外观缺陷、尺寸要求、成分分析标准等,根据实际情况填写。
2.检验结果:记录检验员实际检测到的结果,即外观/尺寸/成分等方面是否符合要求。
需要在正文中给出详细的检验数据。
3.异常情况描述:结合检验要求和检验结果,对不合格的物料进行描述,具体表现和特点如何,以及影响范围、程度、数量等。
需要客观、全面、准确地描述,并配以检验数据或照片作为佐证。
原因分析在此部分中,对异常情况进行分析,找出原因,以达到问题解决的目的。
包括以下内容:1.根据检验及其他相关数据信息进行原因分析。
2.给出问题原因的结论,对原因结论进行论述。
3.若需要,可以列举类似问题或类似检验项目的数据分析和对比,以便于更准确地找出问题根源。
处理措施在此部分中,记录公司对该异常情况的处理措施,包括:1.处理结果:记录处理结果,表明异常问题已经得到控制或解决。
2.责任人:指定处理负责人信息及职责。
3.处理时效:记录处理该异常情况的时间节点和期限,以保证问题得到及时解决。
检验员总结在此部分中,检验员可以对该异常情况进行总结,包括:1.对检验中可能出现的常见异常情况和原因进行总结,以便于检验员在今后工作中能够更好地避免和排除异常情况。

不良事件报告制度格式版台河市人民医院医疗不良事件报告制度一、建立医疗不良事件报告制度的目的:1、通过报告不良事件,可有效避免缺陷2、医疗不良事件报告制度的建立,是医院进行医疗责任保险的前提3、医疗不良事件的全面报告有利于医疗管理部门对医院内医疗纠纷、事故和隐患有宏观的认识,便于分析原因及处理的合理性,从而制定行之有效的控制措施。
二、建立医疗不良事件报告制度的原则:建立不良事件报告制度坚持行业性、自愿性、保密性、非处罚性和公开性的特性。
1、行业性。
是仅限于医院内与患者安全有关的部门,如临床、医技、护理、服务、后勤保障等相关部门。
2、自愿性。
医院各科室、部门和个人有自愿参与(或退出)的权利,提供信息报告是报告人(部门)的自愿行为,保证信息的可靠性。
3、保密性。
该制度对报告人以及报告中涉及的其他人和部门的信息完全保密,报告人可通过网络、信件等多种形式具名或匿名报告医务科,医务科闫宏图专职受理并严格保密。
4、非处罚性。
本制度不具有处罚权,报告内容不作为对报告人或他人违章处罚的依据,也不作为对所涉及人员和部门处罚的依据,不涉及人员的晋升、评比、奖罚。
5、公开性。
医疗安全信息在院内医疗相关部门公开和公示。
通过申请向自愿参加的科室开放,分享医疗安全信息及其分析结果,用于医院和科室的质量持续改进。
公开的内容仅限于事例的本身信息,不需经认定和鉴定,不涉及报告人和被报告人的个人信息。
三、医疗不良事件报告制度性质报告性质分为强制报告和自愿报告两类。
(一)强制报告范围:1、严重医疗差错,致病人残疾或死亡;2、事件可能会被公开;3、可能会受到处罚。
(二)自愿报告范围:1、各种各样可能引发医疗纠纷的医疗事件;2、事件将被保密;3、有助于发现医疗安全隐患;4、有助于预防严重医疗差错的发生。
四、报告程序、形式及时限当发生不良事件后,当事人填写书面《医疗不良事件报告表》,记录事件发生的具体时间、地点、过程、采取的措施等内容,一般不良事件要求24-48h内报告,重大事件、情况紧急者应在处理的同时口头报告医务科闫宏图;护理事件上报护理部杨茹;后勤事件上报总务科杨春雷;安全事件上报保卫科周传明;设备事件上报设备科王占元;医务科、质控办接到报告后立即调查分析事件发生的原因、影响因素及管理等各个环节并制定改进措施。

品质改善报告格式一、背景介绍:(200字)本报告旨在总结和分析过去一年内公司在品质改善方面所做的工作和取得的成果。
通过对品质管理体系的评估和改进,公司不断提高产品和服务的品质水平,从而增强竞争力,满足客户需求,实现可持续发展。
二、品质改善工作回顾:(500字)1. 品质目标设定:在报告期内,公司制定了符合行业标准和客户需求的品质目标,并将其贯彻到各个部门和岗位间。
2. 品质管理体系建立:公司多次召开品质管理培训和会议,完善了品质管理体系,引入了先进的管理工具和方法,提高了品质管理水平。
3. 品质控制机制:公司在产品研发、生产、交付和售后服务等环节建立了严格的品质控制机制,加强了对关键过程和关键环节的监控和管控。
4. 风险管理与改进措施:公司加强了对品质风险的识别和评估,及时制定改进措施,保证产品和服务的持续稳定。
三、品质改善成果分析:(600字)1. 产品质量提升:通过不断改进工艺流程和生产技术,产品质量指标得到显著提升,产品缺陷率明显下降,产品合格率达到了98%以上。
2. 客户满意度提升:根据客户反馈和市场调研结果,客户满意度得到了明显提升,产品质量和售后服务得到认可,客户投诉率降低了30%。
3. 成本降低:通过品质改善,产品生产成本得到一定程度的降低,抛弃率减少,废品率下降,有效提高了企业经济效益。
四、品质改善展望:(200字)未来,公司将继续加大对品质改善的投入,不断优化品质管理体系,持续提升产品和服务品质水平,加强对关键工艺和环节的管理,以满足客户需求,保障产品质量安全,提升企业市场影响力。
公司将不断改善内部协作机制,推动全员参与品质改善,营造良好的品质管理氛围。
五、结语:(100字)品质改善是企业永恒的追求和发展之基,我们将始终坚持以客户为中心,以品质为中心,持续改进,不断创新,为客户提供更优质的产品和服务。
希望公司的品质改善工作能够为企业的可持续发展和行业的品质提升贡献一份力量。
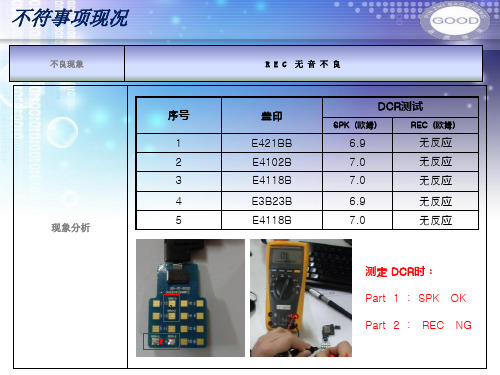

不良分析报告格式一、报告概述本不良分析报告为针对某产品或项目出现问题而进行的分析和研究,目的是为了找出问题的原因,并提出解决方案和预防措施,确保该产品或项目的安全和可靠性。
二、报告内容1. 问题描述:对发生问题的产品或项目进行详细的描述,包括产品或项目的名称、型号、使用情况、问题发生时间、地点等信息。
2. 问题分析:对问题进行分析,包括具体现象、原因分析、影响分析等,尽可能详细地阐述问题所在。
3. 结果总结:对问题进行总结,给出具体结论,并提出解决方案和预防措施。
4. 附录部分:本部分根据需要选用,主要包括有关测试数据、实验记录、照片、图表等资料,用于证明分析结论的正确性。
三、报告格式1. 封面:应含有报告名称、单位名称、报告编码、编写日期等信息。
2. 扉页:应包含报告名称、报告编码、编写日期、编写单位、项目名称、项目来源以及报告编写人员等相关信息。
3. 目录:列出各章节、附录的名称及页码。
4. 正文:应有明显的章节标题、段落编号,使用小四号宋体字体,行间距为1.5倍。
5. 图表和表格:应有编号和标题,编号用阿拉伯数字,标题用小五号黑体加粗字体。
6. 页眉:应注明报告名称和页码,页码使用阿拉伯数字。
7. 页脚:应注明报告编写人员信息和报告日期,使用小五号宋体字体,左右对称排版。
四、附加要求1. 报告内容必须准确、详细、全面。
2. 报告语言要清晰、简洁、明了,避免使用含糊、难懂的行话。
3. 图表要直观、清晰、准确,避免造成解释上的困难。
4. 报告中所使用的任何材料或数据,必须真实可靠,且出处清晰明确。
5. 报告中要遵循客观、公正、科学的原则,确保分析结论正确和可靠。


产品不良质量分析报告单一、报告目的本报告旨在对近期出现的产品不良质量问题进行深入分析,找出问题原因,并提出相应的改进措施,以确保产品质量的持续改进。
二、问题描述最近一段时间,公司生产的款产品出现了一定数量的不良品情况。
产品主要问题集中在以下几个方面:1.外观问题:部分产品存在色差、气泡、划痕、刻字不清晰等问题。
2.功能问题:部分产品在使用过程中出现漏液、漏气等问题。
3.耐久性问题:部分产品使用时间较短就出现开裂、断裂等问题。
三、问题原因分析1.外观问题原因分析:1)生产工艺不稳定:部分产品在生产过程中,工艺参数控制不当,导致产品表面色差较大。
2)质量把控不严格:生产线上存在一些质量检查环节,但并不够严格,容易出现疏漏情况。
3)原材料质量不合格:部分原材料供应商提供的原材料质量与承诺不符,导致产品出现气泡、划痕等问题。
2.功能问题原因分析:1)设计不合理:产品部分结构设计存在问题,导致容易漏液、漏气等功能问题。
2)生产线工艺控制不当:生产过程中部分工艺参数未能达到要求,导致产品功能问题。
3.耐久性问题原因分析:1)材料选择不当:部分产品使用的材料未能经受长期使用的考验,导致开裂、断裂等耐久性问题。
2)原材料供应商质量不稳定:原材料供应商存在质量不稳定的情况,不同批次的原材料质量差异较大。
四、改进措施建议1.外观问题改进措施:1)优化生产工艺:对生产过程中的关键工艺参数进行调整和优化,确保色差控制在合理范围内。
2)质量检查强化:加强生产线上质量检查环节,增加检查频次,确保产品表面没有瑕疵。
3)加强原材料质量把关:与原材料供应商进行沟通,要求提供符合要求的原材料,并建立质量监督机制。
2.功能问题改进措施:1)重新设计产品结构:针对存在漏液、漏气等问题的部分产品,进行结构调整,确保功能得到有效改善。
2)加强生产线工艺控制:对产品生产过程中涉及到功能的工艺参数进行严格控制,确保产品功能稳定可靠。
3.耐久性问题改进措施:1)材料选择优化:重新评估使用材料的性能和耐久性,选择更加耐久可靠的材料进行生产。

不合格品试验报告制度范文一、前言不合格品试验报告制度是组织和管理不合格品试验工作的重要制度。
通过制定有效的试验报告制度,可以规范试验工作流程,提高试验报告的质量和可靠性。
不合格品试验报告制度的实施,对于提高企业的产品质量,保障客户权益具有重要意义。
二、试验报告的目的和意义试验报告是对不合格品试验工作结果的记录和总结,具有如下目的和意义:1. 提供试验结果的客观依据。
试验报告记录了不合格品试验的全过程和试验结果,能够提供客观、准确的试验数据,为产品质量问题的解决提供依据;2. 完善不合格品控制流程。
试验报告可以帮助企业完善和改进不合格品控制流程,提高产品质量;3. 规范试验报告的编制和审核工作。
通过试验报告制度,明确试验报告的编制和审核责任,保证试验报告的质量和规范性;4. 保障客户权益。
试验报告是企业与客户之间沟通的桥梁,能够帮助客户了解产品质量问题,保护客户的权益。
三、试验报告编制的基本要求试验报告的编制应符合以下基本要求:1. 确定试验报告的编制责任部门。
企业应明确试验报告的编制责任部门,并制定相应的岗位职责和权限;2. 确定试验报告的编制流程。
试验报告的编制流程包括信息收集、数据整理、分析总结、报告撰写等环节,企业应根据试验工作的特点和需要,明确试验报告的编制流程,确保流程清晰、有序;3. 确定试验报告的编制格式和内容。
试验报告的编制格式应符合国家相关标准和规范要求,内容应包括不合格品试验的目的、试验工作的执行情况、试验结果和结论等;4. 确定试验报告的审核机制。
试验报告应有独立、专业的审核机构,对试验报告的内容、结论进行审核,确保试验报告的准确、可靠;5. 确定试验报告的保密措施。
试验报告的编制和使用应符合相关的保密制度和规定,保护企业的核心技术和商业秘密。
四、试验报告编制的具体流程试验报告的编制流程可以分为以下几个环节:1. 信息收集。
收集和整理有关不合格品试验的相关资料和信息,包括试验方案、试验记录、样品情况等;2. 数据整理。

投诉件的报告范文格式尊敬的XX公司客服部门:我是一位消费者,我对最近在贵公司购买的某商品的质量表示极度不满。
我在此写信投诉,并希望能得到解决。
首先,我在6月1日购买了贵公司的某商品。
然而,当我回家使用时发现该商品存在明显的质量问题。
首先,商品的外包装上有明显的撕裂、破损痕迹,导致商品内部零件可能受到了损坏。
其次,当我尝试使用商品时,它根本无法正常工作。
无论我如何操作,都无法启动商品,也无法享受到所承诺的功能。
鉴于上述情况,我对贵公司的商品质量表示极度不满。
作为消费者,我对每一分支付的货物都有合理的期望值,而贵公司所提供的商品却明显无法达到这一期望值。
我非常失望和愤怒,并希望贵公司能尽快解决这一问题。
基于以上情况,我希望贵公司能够立即采取措施解决以下问题:1. 退款:我要求贵公司退还我购买该商品所支付的金额,因为它明显无法正常使用。
2. 更换商品:如上所述,商品存在严重的质量问题,因此希望贵公司能提供一份全新的、正常品质的商品,以替换我原先购买的无法使用的商品。
3. 产品质量保证:希望贵公司能下一步措施,确保类似事件不再发生。
贵公司应加强质量控制,避免将质量不合格的商品出售给消费者,同时提供更好的售后服务。
我希望贵公司能尽快认真对待我的投诉,并在3个工作日内给予我回复。
如若贵公司未能妥善处理此事,我将不得不考虑采取其他合法手段保护自己的权益。
我希望这一问题能够得到合理解决,同时也希望贵公司能够引以为戒,完善质量管理制度,提升服务品质。
请尽快处理该投诉,并通过以下联系方式与我取得联系。
联系人:XXX联系电话:XXX联系地址:XXX再次希望贵公司能对此事重视,尽快解决问题,维护消费者权益。
谢谢!此致,XXX(投诉人)。

医疗器械不良事件报告表疗人员的死亡或严重伤害,应该按可疑医疗器械不良事件报告。
3、主动报告原则:医疗器械生产企业、经营企业、使用单位应该在发现可疑医疗器械不良事件后,主动向药监部门报告。
四、报告流程:1、发现可疑医疗器械不良事件后,立即停止使用该器械,采取必要的救治措施,并将事件报告给医疗器械生产企业、经营企业、使用单位的负责人。
2、医疗器械生产企业、经营企业、使用单位应该及时向药监部门报告可疑医疗器械不良事件,提供详细的事件陈述和医疗器械情况。
3、药监部门收到报告后,将对事件进行调查和分析,评估事件的严重程度,并根据评估结果采取相应的措施,包括通知医疗器械生产企业、经营企业和使用单位,要求其采取必要的措施,防止类似事件再次发生。
五、报告表填写说明:医疗器械不良事件报告表应该详细记录患者资料、医疗器械情况、不良事件情况、事件处理情况等信息,并在事件陈述中尽可能详细地描述事件的经过和影响。
填写报告表时应该注意格式的正确性,删除明显有问题的段落,并尽可能用简明的语言表达。
1、格式错误已经被修正;2、删除明显有问题的段落;3、改写每段话如下:一、报告原则:医疗器械不良事件报告是指在医疗器械使用过程中,发生了与医疗器械有关的意外、事故、质量问题、疾病传播等不良事件,需要向相关部门进行报告。
报告原则包括:必报原则、可疑即报原则和免除报告原则。
二、必报原则:根据《医疗器械不良事件报告管理办法》,以下情况必须报告:1.引起或造成死亡或严重伤害的事件;2.对医疗器械性能的影响性质严重,很可能引起或造成死亡或严重伤害的事件;3.使器械不能发挥其必要的正常作用,并且影响医疗器械的治疗、检查或诊断作用,可能引起或造成死亡或严重伤害的事件;4.医疗器械属于长期植入物或生命支持器械,因此对维持人类生命十分必要的事件;5.医疗器械生产企业需要采取或被要求采取行动来减少产品对公众健康造成损害的风险的事件;6.类似事件在过去实际已经引起或造成死亡或严重伤害的事件。
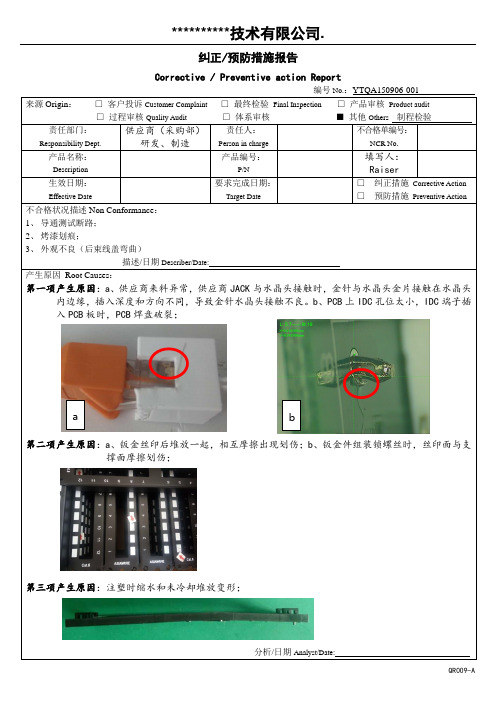
纠正/预防措施报告Corrective / Preventive action Report编号No.:YTQA150906-001来源Origin : □ 客户投诉Customer Complaint □ 最终检验 Final Inspection □ 产品审核 Product audit □ 过程审核Quality Audit □ 体系审核 ■ 其他Others 制程检验责任部门:Responsibility Dept. 供应商(采购部) 研发、制造责任人: Person in charge 不合格单编号: NCR No . 产品名称: Description产品编号: P/N 填写人: Raiser 生效日期:Effective Date 要求完成日期: Target Date □ 纠正措施 Corrective Action □ 预防措施 Preventive Action 不合格状况描述Non Conformance :1、 导通测试断路;2、 烤漆划痕;3、 外观不良(后束线盖弯曲)描述/日期Describer/Date:产生原因 Root Causes :第一项产生原因:a 、供应商来料异常,供应商JACK 与水晶头接触时,金针与水晶头金片接触在水晶头内边缘,插入深度和方向不同,导致金针水晶头接触不良。
b 、PCB 上IDC 孔位太小,IDC 端子插入PCB 板时,PCB 焊盘破裂;第二项产生原因:a 、钣金丝印后堆放一起,相互摩擦出现划伤;b 、钣金件组装锁螺丝时,丝印面与支撑面摩擦划伤;第三项产生原因:注塑时缩水和未冷却堆放变形;分析/日期Analyst/Date:a b记录发放Issue to: □供应商Supplier □供应商质量SQE □供应链Supply Chain □供方开发Supplier Development。


品质异常改善对策报告格式一、背景介绍近期,我们的产品出现了一些品质异常问题,给客户带来了不良的使用体验,并对公司的声誉造成了一定的影响。
为了解决这一问题,我们着手制定了改善品质异常的对策,并希望通过本报告向管理层汇报我们的对策方案以期得到支持和配合。
二、问题分析经过调查分析,我们发现造成产品品质异常问题的主要原因有以下几点:1.生产过程缺乏严格的质量控制标准,巡检不到位;2.材料供应商提供的原材料质量不稳定;3.生产工艺标准存在一定的漏洞;4.员工培训不足,存在操作不规范的情况。
三、改善对策针对以上问题,我们制定了以下改善对策:1.建立严格的质量控制标准和流程,确保每个生产环节都能按照标准执行,包括原材料检验、生产过程监控、产品检测等;2.与材料供应商建立长期合作关系,并要求其提供稳定质量的原材料,并进行定期审核;3.对生产工艺流程进行全面梳理和优化,消除漏洞,并制定详细的操作规范,确保每位员工能正确执行操作;4.加强对员工的培训,包括产品知识培训、操作规范培训等,通过提高员工素质来减少操作不规范的情况。
四、执行计划根据以上改善对策,我们制定了以下执行计划:1.建立质量控制小组,负责制定质量标准和流程,并进行监督和检查;2.与材料供应商建立合作协议,明确质量要求,并进行定期评估;3.开展对生产工艺的全面梳理和优化,制定操作规范,并培训员工;4.制定员工培训计划,为员工提供产品知识和操作规范培训;5.定期开展内部质量检查,及时发现问题并进行改善和纠正;6.与客户保持良好的沟通,及时回应客户的反馈和投诉,并采取有效措施解决问题。
五、预期成效经过以上的改善对策和执行计划的实施,我们预期能够取得以下成效:1.产品品质异常问题得到有效解决,客户满意度提升;2.公司声誉得到恢复和提升,品牌形象得到加强;3.生产效率提高,成本控制得到优化;4.员工素质和意识得到提高,团队凝聚力增强。
六、结论与建议品质异常问题是一个需要高度重视和解决的问题,通过制定改善对策和执行计划,我们将能够有效解决这一问题,并为公司带来诸多好处。
纠正/预防措施报告Corrective / Preventive action Report
产生原因 Root Causes:
第一项产生原因:a、供应商来料异常,供应商JACK与水晶头接触时,金针与水晶头金片接触在水晶头内边缘,插入深度和方向不同,导致金针水晶头接触不良。
b、PCB上IDC孔位太小,IDC端子插入PCB板时,PCB焊盘破裂;
第二项产生原因:a、钣金丝印后堆放一起,相互摩擦出现划伤;b、钣金件组装锁螺丝时,丝印面与支撑面摩擦划伤;
第三项产生原因:注塑时缩水和未冷却堆放变形;
分析/日期Analyst/Date: 临时对策Temporary Countermeasure:
第一项:通过测试挑出不良品,汇报上级确认是否承担风险出货;PCB铜箔断裂处加上焊锡,确保导通及性能合格;
第二项:要求钣金丝印部门装箱时每层用隔板隔离;锁螺丝时垫上海绵类软垫片;
第三项:挑出不良品报废;
提出者/日期Raiser/Date:
永久性纠正/预防措施Permanent Corrective/Preventive Action:
第一项:要求供应商修模后送样确认,或者公司新增JACK主体模具,使用公司内金针;PCB孔位由改为;
第二项:钣金丝印部门装箱时每层用隔板隔离;锁螺丝时垫上海绵类软垫片;
第三项:
提出者/日期Raiser/Date:
a b
记录发放Issue to: □供应商Supplier □供应商质量SQE □供应链Supply Chain □供方开发Supplier Development。

质量问题报告范文
报告编号:QP001
报告日期:2021年8月10日
报告对象:销售部
报告内容:
我司在最近一批生产的产品中发现了质量问题,经过仔细调查,确认问题主要集中在产品的外包装和标识上。
问题描述:
1. 外包装:在最近一批产品中,有20%的产品外包装存在质量
问题。
主要表现为包装拉环易断,开启困难;包装袋易破裂,导
致产品受损。
2. 标识:在最近一批产品中,有10%的产品标识存在质量问题。
主要表现为标识模糊不清,字体大小不一,对产品使用和储存说
明不明确。
问题原因:
经过详细分析,我们发现造成问题的原因主要是外包装和标识
的印刷质量未达到标准设置要求,同时在生产过程中操作不规范、使用材料质量不稳定也是问题的主要原因。
解决方案:
针对以上问题,我们制定了如下的解决方案:
1. 外包装问题:我们将从明天开始,对所有进入库房的外包装
物进行全面检查,严格按照标准规范操作,同时采用新的高品质
材料,确保产品质量稳定可靠。
2. 标识问题:我们已经开始进行全面的标识质量升级计划,将会新增标识打印设备和印刷耗材,同时请生产人员提高标识打印操作的技能和质量。
报告结论:
我们非常重视产品质量问题,也非常感谢销售部门对我们工作的支持和监督。
希望通过我们的努力,将产品质量提高到更高的水平,为广大消费者提供更加优质的产品和服务。
报告人:
XXX 生产部 2021 年 8 月 10 日。

产品质量问题报告的格式范文嘿,大家好!今天咱们聊聊产品质量的问题,简单来说就是我们用的东西,有时候它们真的是让人哭笑不得。
记得上个月我买了一款新的咖啡机,想着终于能在早上享受一杯香浓的咖啡了。
结果呢?一开机,哐当一下,水没出,咖啡也没来。
这可真是让我差点哭出来。
说到产品质量,这可是个大问题,咱们不能轻易放过。
得说这机器的外包装,看上去是非常不错的,闪闪发光,简直像是新车一样。
但打开一看,里面的零件简直就是“山寨版”的感觉,连说明书都像是用来凑字数的。
朋友们,这说明书上说的“简单易懂”,我看了半天,只能默默地问自己:“这到底是哪个星球的语言啊?”心里那个无奈呀,真是没谁了。
用我朋友的话说,就是“吃了亏才知道好”,这回可真是一次大教训。
再说说这咖啡机的性能,真是让我欲哭无泪。
一开始以为只是我操作不当,结果经过几次尝试,我才发现这机器根本不听话。
每次都要等个半天,像个磨蹭的老大爷,心里暗想:“你是咖啡机还是慢性子?”我这小心脏都快受不了了,喝咖啡还得心急如焚,这不是给自己添堵吗?哎,真是想想都觉得搞笑。
用着用着,这咖啡机突然冒烟,简直就像在演戏,搞得我差点以为要来个火灾警报。
再说这质量,我就问问,做咖啡的机器,冒烟算是正常的吗?说好的享受生活,结果给我整成了“生死时速”,真的是冤屈。
这可不是开玩笑,得想个办法解决这个问题。
于是,我决定写个质量问题报告,向厂家反映一下。
说到这报告,大家可别以为是个严肃的东西。
其实写起来还蛮有意思的,像是在写一篇搞笑的文章。
开头当然得先礼貌一下,毕竟我们都是讲究礼仪的人。
然后就可以开始叙述我的遭遇,像在讲故事一样,把这咖啡机的奇葩表现一一列举。
你看,这机器的外观多么吸引人,然而它的性能却让我心灰意冷,真是“外强中干”的典型例子。
接下来就得把我遇到的问题详细描述一下,包括它为何让我如此痛苦,像个“老虎屁股摸不得”,让人无从下手。
光说问题可不够,咱们得给厂家点建议。
比如,能不能在产品质量上多下点功夫,别让消费者心累。

不合格化妆品工作总结报告近年来,不合格化妆品的问题愈发严重,给消费者带来了严重的健康风险和经济损失。
作为一家从事化妆品生产和销售的公司,我们深感责任重大,必须认真总结工作,找出问题所在,采取有效措施,确保生产出的化妆品符合国家标准,保障消费者的权益。
首先,我们发现了一些不合格化妆品的主要问题。
其中包括产品成分不符合标准、生产过程不规范、质量检测不严格等。
这些问题导致了产品的质量不稳定,有些产品甚至存在严重的安全隐患。
这对公司形象和市场信誉造成了极大的损害。
针对这些问题,我们采取了一系列的措施。
首先,我们加强了原材料的采购管理,严格把关原材料的质量,确保符合国家标准。
其次,我们对生产工艺进行了全面的调整和优化,加强了生产环节的监管和管理,确保产品的质量稳定。
另外,我们也加大了对产品的质量检测力度,提高了产品质量的把控能力。
经过一段时间的努力,我们取得了一些成效。
公司生产的化妆品质量得到了明显的提升,不合格产品的比例大幅下降。
消费者对我们的产品也表现出了更高的信任度,市场份额逐渐增加。
这些都是我们工作的成果,也是我们努力的动力。
然而,我们也清醒地意识到,这只是一个开始。
不合格化妆品问题是一个长期的、复杂的问题,需要我们持续不断地努力。
我们将继续加大对产品质量的管理力度,不断改进生产工艺和质量检测技术,确保生产出的每一款化妆品都是安全、合格的。
我们也将加强与监管部门的合作,积极响应国家的政策和标准,共同维护消费者的权益。
总之,不合格化妆品的问题是一个严峻的挑战,但我们有信心和决心克服这一困难。
我们将以更加严谨和负责的态度,不断提升产品质量,为消费者提供更加安全、放心的化妆品产品。

不良事件报告制度格式版护理不良事件是指治疗和护理过程中以及医院运行过程中,任何可能影响患者治疗护理效果,增加患者痛苦和负担,并可能引发护理纠纷或护理事故,以及影响护理工作正常运行和护理人员人身安全的因素和事件,称为护理不良事件。
一、不良事件的等级划分1、Ⅰ级事件(警讯事件)。
非预期的死亡,或是非疾病自然进展过程中造成永久性功能丧失。
2、Ⅱ级事件(不良后果事件)。
在疾病医疗过程中因诊疗活动而非疾病本身造成的永久患者机体与功能丧失。
3、Ⅲ级事件(未造成后果事件)。
虽然发生了错误事实,但未给患者机体与功能造成任何损害,或有轻微后果而不需任何处理可完全康复。
4、Ⅳ级事件(隐患事件)。
由于发现及时,错误在对患者实施之前被发现并得到纠正,患者最终没有得到错误的医疗护理服务。
二、不良事件的报告范围1、患者在住院期间发生跌倒、坠床、用药错误、走失、误吸或窒息、导管滑脱、烫伤以及其他与患者安全相关的护理意外。
2、护理差错或护理事故导致患者出现严重并发症、非正常死亡、严重功能障碍、住院时间延长或住院费用增加等事件。
3、严重药物不良反应或输血不良反应。
4、因医疗器械或医疗设备原因给患者或医务人员带来的损害。
5、因陪护人员的原因给患者带来的损害。
6、严重院内感染。
7、门急诊、保卫、信息等其他相关不良事件。
三、不良事件的上报时限1、Ⅰ级事件(警讯事件)。
护理部应主动及时向医院相关职能报告。
2、Ⅱ级事件(不良后果事件)。
在采取积极救治措施的同时,当事人须立即通知护士长、上级医生和科主任,同时报护理部、医务科(夜间为总值班),事后____小时内上报《护理不良事件报告表》。
3、Ⅲ级事件(未造成后果事件),当事人应立即报告护士长,护士长在了解情况后及时报科护士长,并填写《护理不良事件报告表》上报护理部。
4、Ⅳ级事件(隐患事件),鼓励护理人员主动上报,护士长每月进行记录,科护士长审核,对共性问题及1时向护理部报告。
四、具体要求1、科室应按规定时限主动上报护理不良事件,逾期未报或有意隐瞒不报者,视情节轻重予以处罚,并与科室质量考评挂钩。
威尔丽特品质不良对策报告书第 1 页共 2 页第 2 页共 2 页篇二:品质不良对策报告书勤拓品质不良对策报告书. 第 1 页共 3 页第 2 页共 3 页第 3 页共 3 页篇三:品质部品质异常检讨报告品质部品质异常检讨报告事件问题描述如下:在6-1至6-3号生产的t8椭圆1/2平钩26*29.5和t8 1/2斜钩v字型直径26的产品,现这两款产品在生产至出货过程中混料包装出货到客户那里,导致影响客户的出货交期,有损客户对我司的印象,并造成公司物力资源的重大损失。
产品工序责任人如下:开机技术员:蔡灿军、赖虔洲品质ipqc:廖仲坤、赖惠兰点数贴标签:廖凤凤、罗贞凤、吕明裁管:廖国林出货检验:易浩品质部经查证对此事做原因分析如下:1、商务部的制令单上的图纸没更新只是文字描述。
2、针对产品规格和形状差不多的产品,且在同一台机器上生产,生产一款产品订单时更换模具生产下一款时,技术员未跟品质或点数工序沟通说下。
3、产品点数贴标签的时候标签贴错了,但当班的ipqc盖章时没检查到位发现问题。
4、裁管工序裁切时也没核对制令单来做,裁管员在裁管时没主动把首件拿给oqc检验确认。
5、生产出来的产品没有明确区分标识并分开放置,导致裁切、包装容易出错。
6、出货检查时oqc检验没及时发现问题杜绝流入客户那里。
7、新来员工及临时工未做相关岗前作业培训,容易放错误。
永久改善纠正措施如下:1、通知此事件相关负责人,然后召开品质异常检讨会。
2、商务部发出的制令单产品资料要及时更新。
3、新来员工及临时工应做相关的产品品质与作业规模培训再上岗。
4、品质部加强对品质检验员的培训与督导,特别是出货检查要把关到位。
5、生产车间5s要做好,如产品要准确标识区分,对于类似的产品要做明显标识并分开放置。
6、各部门的岗位职责说明书的制定落实。
让工作流程化,制度化。
这样大家工作更顺心。
7、各部门的管理制度撰写制定出来,并落实执行到位。
8、成立iso内部审核小姐,对各部门的工作流程、5s、管理制度、作业规范、检验规范等相关事项进行不定期地审核与督导。
对于这件事,作为品质主管的我,在对品质检验员的培训与监督工作没做到位,虽有做品质程序文件及相关表单记录,品质部也有按程序来做事,但没监督品质检验员落实执行到位。
现出此品质异常造成了公司的重大损失及有损客户对我司的印象。
我愿接受公司对我工作失职处罚及考核!品质部:篇四:品质异常报告诏安县铭欣玩具有限公司质量纠正和预防措施报告篇五:制程品质异常报告浙江勝祥機械有限公司制程品質異常報告編號: (保存時間: )注:1、當品質問題嚴重或不良品批量大或需要停產時需由廠長級或以上領導批示。
2、發送部門:口品保部口製造部口生管口倉庫口業務部口其他________ 品质管理制度公司为了保证产品的品质制定,品质管理制度的推行,能提前发现异常、迅速处理改善,借以确保及提高产品品质符合管理及市场需要。
目录展开编辑本段1、总则第一条:目的为保证本公司品质管理制度的推行,并能提前发现异常、迅速处理改善,借以确保及提高产品品质符合管理及市场需要,特制定本细则。
第二条:范围本细则包括: (一)组织机能与工作职责;(二)各项品质标准及检验规范; (三)仪器管理;(四)品质检验的执行;(五)品质异常反应及处理; (六)客诉处理;(七)样品确认;(八)品质检查与改善。
第三条:组织机能与工作职责本公司品质管理组织机能与工作职责。
各项品质标准及检验规范的设订第四条:品质标准及检验规范的范围规范包括: (一)原物料品质标准及检验规范;(二)在制品品质标准及检验规范;(三)成品品质标准及检验规范的设订; 第五条:品质标准及检验规范的设订 (一)各项品质标准总经理室生产管理组会同品质管理部、制造部、营业部、研发部及有关人员依据操作规范,并参考①国家标准②同业水准③国外水准④客户需求⑤本身制造能力⑥原物料供应商水准,分原物料、在制品、成品填制品质标准及检验规范设(修)订表一式二份,呈总经理批准后品质管理部一份,并交有关单位凭此执行。
(二)品质检验规范总经理室生产管理组召集品质管理部、制造部、营业部、研发部及有关人员分原物料、在制品、成品将①检查项目②料号(规格)③品质标准④检验频率(取样规定)⑤检验方法及使用仪器设备⑥允收规定等填注于品质标准及检验规范设(修)订表内,交有关部门主管核签且经总经理核准后分发有关部门凭此执行。
第六条:品质标准及检验规范的修订(一)各项品质标准、检验规范若因①机械设备更新②技术改进③制程改善④市场需要⑤加工条件变更等因素变化,可以予以修订。
(二)总经理室生产管理组每年年底前至少重新校正一次,并参照以往品质实绩会同有关单位检查各料号(规格)各项标准及规范的合理性,酌予修订。
(三)品质标准及检验规范修订时,总经理室生产管理组应填立品质标准及检验规范设(修)订表,说明修订原因,并交有关部门会签意见,呈现总经理批示后,始可凭此执行。
编辑本段2、仪器管理第七条:仪器校正、维护计划(一)周期设订仪器使用部门应依仪器购入时的设备资料、操作说明书等资料,填制仪器校正、维护基准表设定定期校正维护周期,作为仪器年度校正、维护计划的拟订及执行的依据。
(二)年度校正计划及维护计划? 仪器使用部门应于每年年底依据所设订的校正、维护周期,填制仪器校正计划实施表、仪器维护计划实施表做为年度校正及维护计划实施的依据。
第八条:校正计划的实施(一)仪器校正人员应依据年度校正计划执行日常校正,精度校正作业,并将校正结果记录于仪器校正卡内,一式二份存于使用部门。
(二)仪器外协校正:有关精密仪器每年应定期由使用单位通过品质管理部或研发部申请委托校正,并填立外协请修单以确保仪器的精确度。
第九条:仪器使用与保养 1、仪器使用人进行各项检验时,应依检验规范内的操作步骤操作,使用后应妥善保管与保养。
2、特殊精密仪器,使用部门主管应指定专人操作与负责管理,非指定操作人员不得任意使用(经主管核准者例外) 。
3、使用部门主管应负责检核各使用者操作正确性,日常保养与维护,如有不当的使用与操作应予以纠正教导并列入作业检核扣罚。
4、各生产单位使用的仪器设备(如量规)由使用部门自行校正与保养,由品质管理部不定期抽检。
5.仪器保养 (1)仪器保养人员应依据年度维护计划执行保养作业并将结果记录于仪器维护卡内。
(2)仪器外协修造:仪器邦联保养人员基于设备、技术能力不足时,保养人员应填立外表请修申请单并呈主管核准后送采购办理外协修造。
(3)任何仪器损坏后的维修都应当保留维修履历及验证记录,以便追踪。
编辑本段3、原物料品质管理第十条;原物料品质检验(1)原物料进入厂区时,库管单位应依据资材管理办法的规定办理收料,对需用仪器检验的原物料,开立’材料验收单(基板)、材料验收单(钻头)及材料验收单(一般),通知品质管理工程人员检验且品质管理工程人员于接获单据三日内,依原物料品质标准及检验规范的规定完成检验。
(2)材料验收单(一般)、(基板)、(钻头)各一式五联检验完成后,第一联送采购,核对无误后送会计整理付款,第二联会计存,第三联料库,第四联品质管理存,第五联送保税。
且每次把检验结果记录于供应厂商品质记录卡,并每月根据原物料品名规格类别的结果统计于供应商品质统计表及每月评核供应商的行分于供应商的评价表,提供采购作为选择对抗厂商的参考资料。
编辑本段4、制造前品质条件复查第十一条:制造通知单的审核(新客户、新流程、特殊产品)品质管理部主管收到制造通知单后,应于一日内完成审核。
(一)制造通知单的审核1、订制料号-pc板类别的特殊要求是否符合公司制造规范。
2、种类-客户提供的油墨颜色。
3、底板-底板规格是否符合公司制造规范,使用于特殊要求者有否特别注明。
4、品质要求-各项品质要求是否明确,并符合本公司的品质规范,如有特殊品质要求是否可接受,是否需要先确认再确定产量。
5、包装方式-是否符合本公司的包装规范,客户要求的特殊包装方式可否接受,外销订单的shipping mark及side mark是否明确表示。
6、是否使用特殊的原物料。
(二)制造通知单审核后的处理1、新开发产品、试制通知单及特殊物理、化学性质或尺寸外观要求的通知单应转交研发部提示有关制造条件等并签认,若确认其品质要求超出制造能力时应述明原因后,将制造通知单送回制造部办理退单,由营业部向客户说明。
2、新开发产品若品质标准尚未制定时,应将制造通知单交研发部拟定加工条件及暂订品质标准,由研发部记录于制造规范上,作为制造部门生产及品质管理的依据。
第十二条:生产前制造及品质标准复核(一)制造部门接到研发部送来的制造规范后,须由科长或组长先查核确认下列事项后始可进行生产:1、该制品是否订有成品品质标准及检验规范作为品质标准判定的依据。
2、是否订有标准操作规范及加工方法。
(二)制造部门确认无误后于制造规范上签认,作为生产的依据。
编辑本段5、制程品质管理第十三条:制程品质检验(一)质检部门对各制程在制品均应依在制品品质标准及检验规范的规定实施品质检验,以提早发现异常,迅速处理,确保在制品品质。
(二)在制品品质检验依制程区分,由品质管理部ipqc负责检验:1、钻孔-ipqc钻孔科日报表。
2、修一-针对线路印刷检修后分十五条以下及十五条以上分别检验记录于ipqc修一日报表。
3、修二-针对镀铜(cu)易(sn/pb)后15条以上分别检验记录于ipqc修二日报表。
4、镀金-ipqc镀金日报表。
5、底片制造完成正式钻孔前由品质管理工程科检验并记录于底片检查要项。
6、其他如喷锡板制程抽验管理日报表、qai进料抽验报告、s/m抽验日报表等抽验。
(三)品质管理工程科于制程中配合在制品的加工程序、负责加工条件的测试: 1、钻头研磨后规范检验并记录于钻头研磨检验报告上。
2、切片检验分pih、一次铜、二次铜及喷锡蚀铜分别依检验规范检验并记录于(qae microsection report)、(aqe solderability tes report)等检验报告。
(四)各部门在制造过程中发现异常时,组长应即追查原因,并加以处理后将异常原因、处理过程及改善对策等开立异常处理单呈(副)经理指示后送品质管理部,责任判定后送有关部门会签再送总经理室复核。
(五)质检人员于抽验中发现异常时,应反应单位主管处理并开立异常处理单呈经(副)理核签后送有关部门处理改善。
(六)各生产部门依自检查及顺次点检发生品质异常时,如属其他部门所发生者以异常处理单反应处理。
(七)制程间半成品移转,如发现异常时以异常处理单反应处理。
第十四条:制程自主检查(一)制程中每一位作业人员均应对所生产的制品实施自主检查,遇品质异常时应即予挑出,如系重大或特殊异常应立即报告科长或组长,并开立异常处理单见(表)一式四联,填列异常说明、原因分析及处理对策、送品质管理部门判定异常原因及责任发生部门后,依实际需要交有关部门会签,再送总经理室拟定责任归属及奖惩,如果有跨部门或责任不明确时送总经理批示。