中考化学专题复习计算题及详细答案汇总
- 格式:doc
- 大小:192.18 KB
- 文档页数:15

【化学】中考化学化学计算题真题汇编(含答案)及解析一、中考化学计算题1.某化学兴趣小组的同学在实验室配制溶质质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数。
下图表示用该氢氧化钠溶液与10g某稀盐酸发生反应时溶液温度的变化情况。
试计算稀盐酸中溶质的质量分数。
【答案】14.6%【解析】试题分析:由于中和反应放热,故随着反应的进行,溶液的温度逐渐升高,直至反应恰好完全,溶液温度达到最高,故根据图示可判断,当加入氢氧化钠那溶液的质量为20g时,反应恰好完全解:分析图知与10g稀盐酸恰好完全反应的氢氧化钠质量为:20g×8%=1.6g设稀盐酸中溶质的质量为xNaOH+HCl=NaCl+H2O40 36.51.6g x40:1.6g=36.5:xx=1.46g稀盐酸中溶质的质量分数为:1.46g/10g=14.6%答:稀盐酸中溶质的质量分数为14.6%考点:根据化学方程式计算2.现有碳酸钠和氯化钠的固体混合物12.6g,其中含氧元素4.8g,将该混合物加入到一定质量的稀盐酸中,恰好完全反应,得到137g氯化钠溶液。
计算:(l)原固体混合物中碳酸钠的质量分数(结果保留至0.1%)______;(2)所用稀盐酸中溶质的质量分数(结果保留至0.1%)______。
【答案】84.1% 5.7%【解析】【分析】【详解】(l)原固体混合物中碳酸钠的质量分数4.8g÷=10.6g;混合物中碳酸钠的质量分数为10.6g÷12.6g×100%≈84.1%;(2)设盐酸中溶质的质量为x,生成二氧化碳质量为y 2322Na CO+2HCl=2NaCl+H O+CO106734410.6g x y↑1067344==10.6g x yx=7.3gy=4.4g所用稀盐酸中溶质的质量分数7.3g÷(137g+4.4g-12.6g)×100%≈5.7%3.化学兴趣小组的同学用一瓶含有少量氯化钠和氯化钙的固体混合物进行下列实验:取样品14 g,放入烧杯中,加入96 g碳酸钠溶液恰好完全反应后过滤,称得滤液的总质量为100 g。

(化学)中考化学化学计算题专项训练及答案一、中考化学计算题1.某化学兴趣小组在实验室用碳酸钠溶液和熟石灰制取少量氢氧化钠溶液,他们的实验过程和相关数据如图所示。
请计算:(1)实验中生成沉淀的质量为。
⑵所得氢氧化钠溶液中溶质的质量分数为.【答案】1010%【解析】【分析】【详解】(1)实验中生成沉淀的质量=195.6g-185.6g=10g⑵设氢氧化钠的质量为x。
Ca(0H)+NaCO=CaCO J+2NaOH22331008010gx1008010gxx=8g所的溶液的质量=185.6g-105.6g=80g氢氧化钠溶液的溶质质量分数=第x100%=10%80g答:(1)实验中生成沉淀的质量为10g;(2)所得氢氧化钠溶液中溶质的质量分数为10%。
2.某校化学兴趣小组为了测定某一碳酸钠样品中碳酸钠的质量分数,进行如下实验,取13.25g碳酸钠样品(杂质既不溶于酸也不溶于水)放入烧杯中,加入95.8g水使其完全溶解,再向其中加入稀盐酸,测得反应放出气体的总质量与所加入稀盐酸的质量关系曲线如图所示,请回答:(1)当加入212g 稀盐酸时,放出气体的质量为g 。
⑵碳酸钠样品中碳酸钠的质量分数为多少?(写出计算过程)⑶加入106g 稀盐酸(即A 点)时烧杯中溶液的溶质质量分数为多少?(写出计算过程)【答案】4.4g80%5.6%【解析】【分析】【详解】(1)根据图像,可以看出当加入106g 稀盐酸的时候,反应就结束,产生气体质量为4.4g ,所以当加入212g 稀盐酸时,放出气体的质量仍然为4.4g(2)发生反应:Na 2CO 3+2HCl=2NaCl+H 2O+CO 2个,根据方程式中碳酸钠与二氧化碳的质量关系可算出碳酸钠的质量,进而可以计算碳酸钠样品中碳酸钠的质量分数,反应后得到的是NaCl 溶液,所以也可根据方程式中NaCl 与二氧化碳的质量关系,求出溶液中溶质的质量解:设碳酸钠的质量为x ,生成的NaCl 质量为V 。

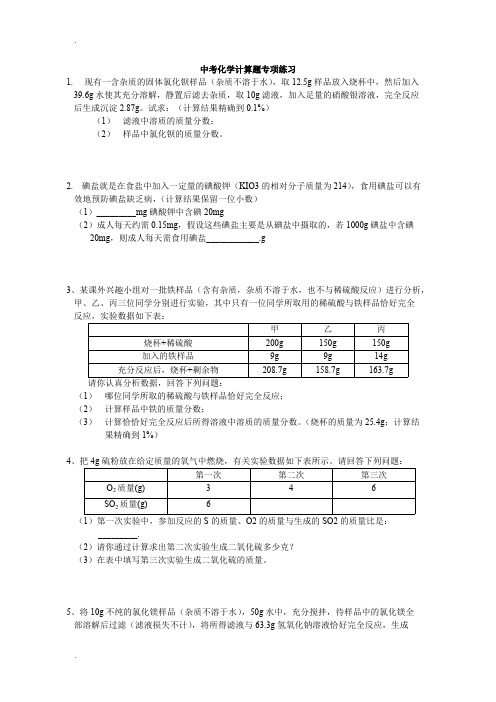
中考化学计算题专项练习1. 现有一含杂质的固体氯化钡样品杂质不溶于水,取样品放入烧杯中,然后加入水使其充分溶解,静置后滤去杂质,取10g 滤液,加入足量的硝酸银溶液,完全反应后生成沉淀;试求:计算结果精确到%1滤液中溶质的质量分数;2样品中氯化钡的质量分数;2. 碘盐就是在食盐中加入一定量的碘酸钾KIO3的相对分子质量为214,食用碘盐可以有效地预防碘盐缺乏病,计算结果保留一位小数1_________mg碘酸钾中含碘20mg2成人每天约需,假设这些碘盐主要是从碘盐中摄取的,若1000g碘盐中含碘20mg,则成人每天需食用碘盐3、某课外兴趣小组对一批铁样品含有杂质,杂质不溶于水,也不与稀硫酸反应进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应,实验数据如下表:请你认真分析数据,回答下列问题:(1)哪位同学所取的稀硫酸与铁样品恰好完全反应;(2)计算样品中铁的质量分数;(3)计算恰恰好完全反应后所得溶液中溶质的质量分数;烧杯的质量为;计算结果精确到1%4、把4g硫粉放在给定质量的氧气中燃烧,有关实验数据如下表所示;请回答下列问题:1第一次实验中,参加反应的S的质量、O2的质量与生成的SO2的质量比是:_________.2请你通过计算求出第二次实验生成二氧化硫多少克3在表中填写第三次实验生成二氧化硫的质量;5、将10g不纯的氯化镁样品杂质不溶于水,50g水中,充分搅拌,待样品中的氯化镁全部溶解后过滤滤液损失不计,将所得滤液与氢氧化钠溶液恰好完全反应,生成白色沉淀;求:1样品中氧化镁的质量;2反应所得溶液中溶质的质量分数;6、“骨质疏松症”是由人体缺钙引起的,可服用补钙剂来治疗;乳酸钙CaC6H10O6·5H2O是一种常见的补钙剂,出售乳酸钙片剂每片含乳酸钙200mg.一个成年缺钙病人每天服用20片乳酸钙片剂可达到补钙目的;计算:计算结果保留整数(1)乳酸钙中各元素的质量比;(2)该成年缺钙病人改用喝牛奶每100mg牛奶中含钙来补钙,每天至少需喝多少毫升牛奶;7、生铁和钢都是铁合金,生铁中碳的含量在%~%之间,钢中碳的含量在%~2%之间;将一块质量为的铁合金放入锥形瓶中,再向锥形瓶中加入100g稀H2SO4,恰好使铁合金中的铁完全反应碳不熔于稀硫酸;铁合金中其他元素含量很低,可忽略不计,测得生成H2的体积为H2在该条件下的密度为L;试根据计算回答:计算结果保留三位效数字1该铁合金是生铁还是钢2反应后所得溶液的溶质质量分数;8、将克氧化钠加到质量为m的水中,完全反应后,得到溶质的质量分数为16%的溶液,在该溶液中加入50克稀盐酸,两者恰好完全反应;氧化钠与水反应的化学方程式为:Na2O+H2O==2NaOH;求:(1)m的值(2)所加盐酸中溶质的质量分数;(3)若要使反应后的氧化钠溶液成为20oC时的饱和溶液,至少要蒸发掉多少克水20oC时,氧化钠的溶解度为36克9、以下是我省生产的某种加钙食盐包装标签上的部分文字;请仔细阅读后回答以下问题:(1)包装标签上钙含量是指___________填单质钙、碳酸钙、钙元素中的一种(2)为了检验此盐中是否含有碳酸钙,在家庭厨房里可选用的物质是___________.(3)为了测定此盐中的钙元素含量,取10g这种盐溶于水,加入足量盐酸,生成二氧化碳;请计算此加钙食盐中钙元素的质量分数.10、向盛有碳酸氢钠固体的烧杯中,加入硫酸溶液恰好反应;反应过程用精密仪器测得烧杯连同药品的质量m与反应时间t 的关系如图所示;烧杯连同药品的起始质量为;反应的化学方程式为:2NaHCO3+H2SO4==Na2SO4+2H2O+2CO2↑回答下列问题:12当碳酸氢钠与硫酸溶液完全反应时,所产生二氧化碳的质量为_________;3反应后,所得硫酸钠溶液的溶质量分数为多少11、医疗上常用的生理盐水是质量分数为%密度近似为1g/cm3的氯化钠溶液;500mL的这种生理盐水中含氯化钠________g,水________g;若以每分钟50滴20滴约为1mL的速率给病人静脉输液500mL,约需___________分钟输完;12、我国约在南北朝时就开始冶铸黄铜,黄铜是铜和锌的合金,它可用来造机器,电器零件及日用品,为了测定某黄铜样品中铜的质量分数,取10g黄铜加入到50g稀硫酸中,恰好完全反应,产生氢气;试求:(1)该黄铜样品中铜的质量分数;(2)原稀硫酸中溶质的质量分数;13、一个青少年正常情况下每天约需钙;若每天从食物中得到钙,其余,由钙片补充,则每天需吃含葡萄糖酸钙C6H11O72Ca的质量分数为85%的钙片_________g;保留两位小数14、为了对海水中的氯化物假设以NaCl计算进行成分分析,甲、乙、丙三位同学分别进行实验数据如下,请仔细观察分析,回答下列问题:(1)两溶液恰好完全反应的是__________的实验;(2)请计算海水中的氯化物以氯化钠计算的质量分数是多少15、把10g氯酸钾和二氧化锰的混合物加热到不再产生气体为止,质量减少了;计算原混合物中氯酸钾的质量分数16、“烟台苹果”享誉全国;波尔多液是烟台果农常用的一种果树杀菌农药;一果农管理了5亩果园,准备为果树喷洒一次波尔多液,他现有8%的硫酸铜溶液30㎏、蓝矾CuSO4·5H2O10㎏,每亩地需要用150㎏1%的硫酸铜溶液来配制波尔多液;请你计算一下他现有的硫酸铜药品是否能够满足需要已知:蓝矾中CuSO4的质量分数为64%17、二氧化硫是大气污染物之一,我国的环境空气质量标准中对空气中二氧化硫的最高浓单位体积的空气中所含二氧化硫的质量限值如下表所示:浓度限值mg/m3一级标准二级标准三级标准为测定某地空气中二氧化硫的含量,某中学环保小组按上图所示的实验装置进行如下实验:向试管中加入一定量的含碘I2的碘溶液,再加入2—3滴淀粉溶液淀粉遇I2变蓝色,通过抽气装置抽气,使空气由导气管进入试管与碘溶液充分接触,当溶液由蓝色变为无色时,恰好完全反应,反应的化学方程式是:SO2 + I2 + 2H2O = H2SO4 + 2HI;实验过程中进入试管内的空气的总体积为1000L;请通过计算判断此空气中二氧化硫的浓度级别;18、常温下,将含有少量氯化钾的碳酸钾样品放入盛有稀盐酸的烧杯中,恰好完全反应,可得到200g不饱和溶液,求反应后所得溶液中溶质的质量分数;19、实验室现需纯净的氧气标准状况下,氧气的密度是L;某同学用质量比为3:1的氯酸钾和二氧化锰制取氧气,并回收二氧化锰和氧化钾;下表为该同学实验的有关数据:问该同学最多能回收到多少克二氧化锰结果精确到0;01g20、实验室利用石灰石与足量的稀盐酸反应制取二氧化碳,若要制取二氧化碳,至少需要含杂质20%杂质不与盐酸反应的石灰石多少克21、将18g不纯的氯化铜样品杂质不溶于水,也不参与反应跟一定量的氢氧化钠恰好完全反应,得到溶质量分数为20%的溶液;求:(1)样品中氯化铜的质量分数;2加入的氢氧化钠溶液的质量;22、1989年世界卫生组织把铝列为食品污染源之一,每人每日的摄入量控制在以下;若在1Kg米面食品中加入明矾2g明矾的化学式为KAlSO42·12H2O,相对分子质量为474,请回答下列问题:1 人从食物中摄入的铝指的是_________填字母;A.铝元素 B;铝单质 C;铝合金 D;只有明矾2 明矾中各元素的质量比K:Al:S:O:H =_______;铝元素的质量分数为计算结果精确到%_______.3 如果某人一天吃了100上述米面食品,通过计算说明其摄入的铝的量是否超过安全摄入量23、某校化学兴趣小组为测定空气中二氧化硫的含量,用NOH溶液吸收SO2,反应方程式如下:2NaOH+SO2=NaSO3+H2O用NaOH溶液吸收1000L已除去CO2的空气样品,溶液质量增重了;已知此时空气的密度约为/L,求:1被吸收的SO2的质量;2发生反应的NaOH的质量;3空气中SO2的质量分数计算结果精确到0.01%;24、将硫酸钠溶液与足量的氯化钡溶液充分反应,生成硫酸钡沉淀;求硫酸钠溶液中溶质的质量分数;25、一定质量10%的A溶液和一定质量10%的CaCl2溶液恰好完全反应,生成白色沉淀B,化学方程式为:A+CaCl2==B↓+2NaCl 已配平1、A物质必定含有的金属元素是_________,A和B的相对分子质量之差为__________;2、滤出沉淀B,加入足量稀盐酸,B逐渐溶解,收集到无色无气味的气体;求滤出B后所得溶液中NaCl的质量分数;26、配制%的医用生理盐水500g,需氯化钠_________g,蒸馏水__________g;27、煅烧含碳酸钙80%的石灰石100t,生成二氧化碳多少吨若石灰石中的杂质全部进入生石灰中,可得到这样的生石灰多少吨28、把100g溶质质量分数为20%的氢氧化钠溶液稀释成溶质质量分数为10%的溶液,需要水________g,稀释后溶液的质量为__________g;29、取石灰石样品,放入盛有126g稀盐酸的烧杯中,石灰石中的碳酸钙与盐酸恰好完全反应杂质不反应,也不溶解,烧杯内物质质量变为;则石灰石中碳酸钙的质量为_________g,反应后所得溶液中溶质的质量分数为______________30、燃烧含硫的煤和鞭炮都会产生污染空气的二氧化硫气体,完全燃烧硫,能生成多少克二氧化硫气体31、将放入50g水中完全溶解后,加入80gCaNO32溶液,恰好完全,反应的化学方程式为:K2CO3 +CaNO32====CaCO3↓+ 2KNO3;计算:(1)生成沉淀的质量;(2)过滤后,所得滤液的溶质质量分数;计算结果精确到32、在防治非典型肺炎的工作中,过氧乙酸是一种常用消毒剂,具有强氧化能力,可将各种病原微生物杀灭;工业品过氧乙酸原液通常是15%过氧乙酸溶液密度cm3;使用时,通常取20mL原液,加自来水稀释至1000mL,搅拌均匀,即配制成1000mL密度约为1g/cm3用于空气喷雾消毒、环境地面消毒的过氧乙酸溶液;120mL15%过氧乙酸原液的质量是多少克其中含过氧乙酸多少克2配制成的1000mL过氧乙酸溶液中,过氧乙酸的质量分数是多少33、今年春天,非典型肺炎在我国部分地区造成的疫情形势非常严重,为了预防非典型肺炎,很多部门用过氧乙酸对环境进行消毒,已知过氧乙酸的化学式为C2H4O3(1)过氧乙酸的相对分子质量为________,碳、氢、氧三种元素的质量比为__________;(2)用含溶质的质量分数为20%的过氧乙酸溶液密度为cm3配溶质的质量分数为%的消毒液密度为cm315L,需要20%的过氧乙酸溶液体积是多少毫升最后结果保留一位小数34、把15g不纯硫酸钠所含杂质不溶于水,放入水中配成溶液;过滤后,取10g溶液加入适量的氯化钡溶液,恰好完全反应,生成白色沉淀;试计算:最后结果保留二位小数(1)10g溶液中硫酸钠的质量;(2)原不纯硫酸钠中含硫酸钠的质量分数;35、过氧乙酸是一种杀菌能力较强的消毒剂,过氧乙酸容易挥发、分解,有腐蚀性,自从防“非典”工作开展以来,这种消毒剂被广泛使用;用市售的一种20%的过氧乙酸溶液,配制用于室内预防性消毒的%的过氧乙酸溶液1000g时,需20%的过氧乙酸溶液和水各多少克根据上述对过氧乙酸的有关介绍,说说在使用它的过程中应注意什么全国中考化学计算题专项练习答案1、4分2、6分解:1设10滤液中含氯化钡的质量为xBaCl2 + 2AgNO3====2AgCl↓ +BaNO32208 287x208:287===x:x== 滤液中溶质的质量分数为10g×100%==%2设样品中含氯化钡的质量为y:10g-==y:y== 样品中氯化钡的质量分数为×100%===83. 2%3、8分解:1乙2设样品中铁的质量为x,生成的质量FeSO4质量为y生成氢气的质量150g + 9g-==用甲、丙组数据计算氢气质量也给分Fe+H2SO4==FeSO4 + H2↑56 152 2x yx=样品中铁的质量分数为:9g×100%==93%y==溶液中溶质的质量分数:--9g-×100%==17%答:1乙同学所取用的稀硫酸与铁样品恰好完全反应;2样品中铁的质量分数是93%3恰好完全反应后所得溶液中溶质的质量分数是17% 4、共6分11:1:2或32:32:64:或3:3:628g38g5、共7分设样品中MgCl2的质量为x,生成NaCl的质量为yMgCl2+2NaOH===MgOH2↓+2NaCl95 58 117x y95/58==x/ 58/117=yx= y=NaCl溶液的溶质的质量分数为+50g+-==10%答:1原样品中氯化镁质量为2反应后,所得溶液中溶质的质量分数为10%6、5分1解:mCa:mC:mH:mO=40×12×6:1×20:1611 =10:18:5:442解:设该缺钙病人每天至少需喝牛奶的体积为x 钙的质量分数为:40/308×100%=13%x×/100mL=×20×13%x=500nL7、6分1解:设该铁合金中铁的质量为xH 2=×L=Fe+H 2SO 4====FeSO 4+H 2↑ 56 2 xx=56×/2=该铁合金中碳的质量分数为-/×100%=% 介于%~%之间,该铁合金是钢 2解:设反应后所得溶液中的质量为yFe+H 2SO 4 ==FeSO 4+H 2↑152 2 yy=152×/2=FeSO 4的质量分数为: 100g +-×100%=%8、6分解:1根据题意,设生成NaOH 的质量为xNa 2O+H 2O==2NaOH 62 80 x62:80=:x x=4g 4g/+m=16% m=2设盐酸中溶质的质量分数为y,生成NaCl 的质量为aHCl + NaOH ===NaCl40 50g·y a:40=50g·y: y=%340:=:a a=设蒸发质量为b 的水后可得到20C 时NaCl 的饱和溶 50g+25g --b=36/100b=答:1m 为;2盐酸中溶质的质量分数为%3需蒸发水9、5分1钙元素; 2醋或水;3解:设产生二氧化碳所需CaCO 3的质量为x CaCO 3 +2HCl===CaCl 2 + H 2O + CO 2↑ 100 44g x 100/x=44/ x= Ca 元素质量:×40/100= Ca 元素质量分数:10g×100%=% 答:此加钙食盐中钙元素的质量分数为% 10.8分14s 23设完全反应时,生成硫酸钠的质量为x 2NaHCO 3 + H 2SO 4 ====Na 2SO 4 + 2H 2O+ 2CO 2↑14288x142/88=x/ x= mNa 2SO 4溶液=+-= wNa 2SO 4=×100%=10%答:所得硫酸钠溶液的溶质质量分数为10% 11.3分; ; 20012.6分解:设样品中锌的质量为x ;稀硫酸中的溶质质量为yZn+H 2SO 4==ZnSO 4 + H 2↑ 65 98 2 x y 1 65/2=x/ x=铜的质量为 10g -= 样品中铜的质量分数为 10g×100%=% 298/2=y/ y=稀硫酸中硫酸的质量分数为50g×100%=% 答:1该黄铜样品中铜的质量分数为%2原稀硫酸中溶质的质量分数为%13.3分 14.4分1乙2解:设50g 海水中含氯化钠的质量为xNaCl + AgNO 3===AgCl↓ + NaNO 3xx=×/=则海水中氯化钠的质量分数为:50g×100%=% 答:海水中的氯化物以氯化钠计算的质量分数是% 15.4分解:设原混合物中氯酸钾的质量为X 2KClO 3=====2KCl + 3O 2↑24596x 245:96=x : x= 10g×100%=%答:原混合物中氯酸钾的质量分数是61;25%16.6分解:现有的药品中含硫酸铜的质量为:30㎏×8%+10㎏×64%=㎏ 5亩果园需硫酸铜的质量为: 150㎏×1%×5=㎏ 因为㎏>㎏所以这一果农现有的硫酸铜药品能够满足需要 17.5分解:设参加反应的二氧化硫的质量为xSO 2+ I2 +2H 2O==H 2SO 4 + 2HI 64254x64:254=x : x=空气中二氧化硫的浓度为1000L=m3由于m3<m3<m3所以空气中二氧化硫的浓度级别是二级18.5分解:设混合物中K 2CO 3的质量为x,反应后生成KCl 的质量为y根据题意,反应后生成CO 2的质量为 + -200 g=K 2CO 3 +2HCl===2KCl +H2O+CO2↑138 149 44x y138:x==44: x=149:y=44: y=反应后所得溶液中溶质的质量分数为:+-/200g==10%答:反应后所得溶液中溶质的质量分数为10%19;4分在实际操作中,会损失少量氧气;解:设原混合物中MnO 2质量为x,则KClO 3质量为3x2KClO 3=====3KCl+3O 2↑245 1493x -x245/3x==149/-x x=答:最多可回收的二氧化锰;20、4分解:设至少需要含杂质20%的石灰石的质量为,则:CaCO3+2HCl==CaCl2+CO2↑+H2O100441-20%m100g:1-20%m=44g: m=答:要制取二氧化碳,至少需要含杂质20%的石灰石21、6分解:设样品中CuCl2的质量为x,NaOH溶液中含NaOH质量为y ×20%=CuCl2+2NaOH===CuOH2↓+2NaCl135 80 117x y1135:x=117: x=样品中CuCl2的质量分数为:18g×100%=75% 280:y=117: y=80gNaOH溶液中的水的质量为-=所以NaOH溶液的质量为:8g+=或其他正确答案也可以22、5分1A或铝元素239:27:64:320:24; %32g/1000g×100g= ×%=>超过了安全摄入量;23、7分12设参加反应的氢氧化钠的质量为x2NaOH+SO 2===Na 2SO 3+H 2O80 64x80:64=x : x=3SO 2质量分数=1000L×L×100%=%其他合理答案也给分24、3分解:设硫酸钠溶液中溶质的质量为XNa 2SO 4+BaCl 2===BaSO 4↓+2NaCl142 233x142/233=x/ x=Na 2SO 4%=×100%=25%25、8分1钠或Na 62解:由题意判断:B 是CaCO3,A 是Na2CO3设生成CaCO 3的质量为w,Na 2CO 3溶液的质量为x,CaCl 2溶液的质量为y,生成NaCl 的质量为zCaCO 3+2HCl==CaCl 2+CO 2↑+CO 2+H 2O100 44w100/44=w/ w=10gNa 2CO 3+CaCl 2=CaCO 3↓+2NaCl106 111 100 11710%x 10%y 10g z106/100=10%x/10g x=106g111/100=10%y/10g y=111g117/100=z/10g z=NaCl 溶液中溶质的质量分数为106g+111g -10g×100%=%26. 4分 2227. 6分解:设生成二氧化碳的质量为XCaCO 3=====CaO+CO 2↑100 44100t·80% x100/100t·80%==44/x x=生石灰的质量:100t -=答:略28、4分 100 20029. 4分 20 %30. 3分 解:设生成SO 2气体的质量为XS+O 2====SO 232 64x32/64==x x=答:略31、5分解:设生CaCO 3沉淀的质量为x,生成KNO 3的质量为y(1) K 2CO 3+CaNO 32====CaCO 3↓+2KNO 3138 100 202x y138/100=x x=5g138/202=y y=2+50g+80g -5g×100%=%答:略32、6分解:120ml15%过氧乙酸原液质量为:20cm3×cm3=23g其中含过氧乙酸的质量为:23g×15%=21000ml 过氧乙酸溶液中过氧乙酸的质量分数:1000cm3×1g/cm3×100%==% 答:略注:1;计算结果为%或%或%均给分 2.其他合理解法均可参照给分33. 6分 176 6:1:12(2) V 过氧乙酸=1500cm3×cm3×%/×cm3=277;7mL 或cm334.6分1解:设10g 溶液中硫酸钠的质量为xNa 2SO 4+BaSO 4==BaSO 4↓+2NaCl142 233x142/x=233/ x=2水溶解的Na 2SO 4的质量为10g -×=原不纯硫酸钠中Na2SO4的质量为15g×100%=%35、6分解:设需20%的过氧乙酸溶液的质量为xx×20%=1000g×% x=10g需水的质量:1000g-10g=990g 答:略。

初三化学中考化学复习:计算题复习题及答案一、选择题1.在一烧杯中盛有2.4g金属镁,向其中加入一定质量的稀硫酸,充分反应后,向所得溶液中逐滴滴入未知溶质质量分数的氢氧化钠溶液,产生沉淀与滴入氢氧化钠溶液的质量关系曲线如图所示。
(1)完全反应后,产生沉淀的质量为________g;(2)氢氧化钠溶液中溶质的质量分数是_________?(写出计算过程,结果精确到0.1%)答案:8 13.3%【解析】(1)完全反应后,产生沉淀的质量为∶Mg→Mg﹙OH﹚2,24→58,=,x=5.8g。
(2)解∶设氢氧化钠溶液中溶质的质量分数是x2NaOH+MgSO4=Mg﹙OH﹚解析:8 13.3%【解析】(1)完全反应后,产生沉淀的质量为∶Mg→Mg﹙OH﹚2,24→58,=,x=5.8g。
(2)解∶设氢氧化钠溶液中溶质的质量分数是x2NaOH+MgSO4=Mg﹙OH﹚2↓+Na2SO480 5860g×x 5.8g=,x=13.3%。
点睛∶(1)完全反应后,产生沉淀的质量为5.8g。
(2)氢氧化钠溶液中溶质的质量分数是13.3%。
点睛∶硫酸先与金属镁反应生成硫酸镁和氢气,然后硫酸镁再与氢氧化钠反应生成氢氧化镁白色沉淀和硫酸钠。
2.请你参与配制一定溶质质量分数的氢氧化钠溶液,并进行有关计算。
(1)要将100g 40%的氢氧化钠溶液稀释成10%的稀溶液,需加水_____________g。
(2)量取水时若仰视读数,会使得到的稀氢氧化钠溶液质量分数____________。
(填“偏大”“偏小”或“不变”)(3)将一定质量的CO2通入200g10%的氢氧化钠溶液中,最多能生成的碳酸钠的质量是____g。
答案:偏小 26.5【解析】(1)根据溶液配制过程中,溶质的质量保持不变解答;(2)根据用量筒读数时,要使视线与液体凹液面的最低处保持水平,仰视或俯视都会造成读数不准确解答;(3)根据反应的化学方程式解析:偏小 26.5【解析】(1)根据溶液配制过程中,溶质的质量保持不变解答;(2)根据用量筒读数时,要使视线与液体凹液面的最低处保持水平,仰视或俯视都会造成读数不准确解答;(3)根据反应的化学方程式计算解答。

初三化学中考化学复习:计算题知识点-+典型题及答案一、选择题1.实验室常用氯酸钾制备氧气,现加热 24.5g 氯酸钾,最多可制得氧气多少克? 答案:6g【解析】【分析】氯酸钾在二氧化锰催化作用下反应生成氯化钾氧气。
【详解】设生成的氧气的质量为x答:生成的氧气的质量为为9.6g 。
解析:6g【解析】【分析】氯酸钾在二氧化锰催化作用下反应生成氯化钾氧气。
【详解】设生成的氧气的质量为x322MnO +Δ2KClO 2KCl 32459624.O 5g x24596=24.5g xx=9.6g答:生成的氧气的质量为为9.6g 。
2.近日网路传言用不锈钢水壶烧水会导致锰中毒。
专家实验证明,使用正规厂家生产的不锈钢水壶烧开水并无明显风险隐患,但不建议用于酸性和碱性环境中。
查阅资料:锰的化学性质与铁相似,它的活动性比铁强,MnSO4 溶液为浅红色。
(1)写出Mn 与CuSO 4溶液反应的化学方程式(产物中锰的化合价为+2 价) 。
(2)MnO 2常用作H 2O 2制取O 2的催化剂,工业上用菱锰矿(主要成分MnCO 3)制取MnO 2,过程如下:步骤1:将22t 菱锰矿粉碎;步骤2:往粉碎后的菱锰矿中加入H 2SO 4溶解MnCO 3,写出化学方程式,反应的现象是 ;步骤3:把生成的MnSO4 再与NH4HCO3 反应后得到11.5t MnCO3,MnCO3 再经过煅烧、氧化转变为MnO2,涉及到的化学反应如下:计算理论上能制得MnO2 。
答案:(1)Mn+CuSO4=MnSO4+Cu (2)MnCO3+H2SO4=MnSO4+CO2↑+H2O ; 固体减少,有气泡产生,溶液变成浅红色(3)8.7t【解析】试题分析:Mn 与CuSO4解析:(1)Mn+CuSO4=MnSO4+Cu (2)MnCO3+H2SO4=MnSO4+CO2↑+H2O ; 固体减少,有气泡产生,溶液变成浅红色(3)8.7t【解析】试题分析:Mn 与CuSO4溶液反应的化学方程式(产物中锰的化合价为+2 价)Mn+CuSO4=MnSO4+Cu;粉碎后的菱锰矿中加入H2SO4溶解MnCO3,写出化学方程式MnCO3+H2SO4=MnSO4+CO2↑+H2O,反应的现象是固体减少,有气泡产生,溶液变成浅红色;11.5t×55/115=X×55/87,解得X =8.7T。

2024年中考化学《必考经典》计算题大全(含答案及解析)1.实验室欲测定一瓶标签破损的稀硫酸中溶质的质量分数,现取10g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化情况如图所示。
分析并计算:(1)a点溶液中含有的离子是_____。
(2)当pH=7时,消耗氢氧化钠溶液中NaOH质量为_____g。
(3)计算稀H2SO4中溶质的质量分数。
_____(4)计算恰好完全反应时所得溶液的溶质质量分数。
_____【答案】Na+、H+、SO42- 0.8 稀H2SO4的溶质质量分数是9.8%;恰好完全反应时所得溶液的溶质质量分数是5.5%。
【解析】【详解】(1)由图示可知,在a点时溶液的pH小于7,说明加入的NaOH完全反应,有剩余的硫酸,所以,溶液中含有的离子为:Na+、H+、SO42-;(2)由图示可知,在溶液的pH等于7,消耗的NaOH溶液的质量为16g,溶质的质量为:16g×5%=0.8g;(3)10g稀硫酸样品含有H2SO4的质量为x,生成的硫酸钠的质量为y2NaOH+H SO=Na SO+2H O2424280981420.8g x y解得:x=0.98g y=1.42g稀H2SO4的溶质质量分数为:×100%=9.8%;(4)恰好完全反应时所得溶液的溶质质量分数:×100%≈5.5%。
2.某小组同学将530 g碳酸钠溶液加入到280 g石灰乳(水和氢氧化钙的混合物)中,使之恰好完全反应,所得溶液中溶质的质量分数为1%,计算加入的碳酸钠溶液中溶质的质量分数。
【答案】2%【解析】【详解】设原碳酸钠溶液中溶质的质量为xNa2CO3+ Ca(OH)2=CaCO3↓+ 2NaOH106 100 80X则解得x =10.6g所以加入的碳酸钠溶液中溶质的质量分数为答:加入的碳酸钠溶液中溶质的质量分数为2%。
3.取一定量的氯化钠与氢氧化钠的混合物,加一定量的水配成溶液,然后向其中滴加溶质质量分数为7.3%稀盐酸,直至恰好反应,共消耗稀盐酸50g。

初三化学化学计算题题20套(带答案)1. 假设有一块铁块,其质量为56克。
求该铁块中含有的铁原子数。
解答:我们需要知道铁的摩尔质量。
铁的摩尔质量约为56克/摩尔。
因此,该铁块中含有的铁原子数为56克 / 56克/摩尔 = 1摩尔。
由于1摩尔物质中含有6.022 x 10²³个原子,所以该铁块中含有的铁原子数为1摩尔x 6.022 x 10²³个/摩尔= 6.022 x 10²³个。
2. 某化学反应中,反应物A和反应物B的化学计量比为2:3。
如果反应物A的质量为24克,求反应物B的质量。
解答:我们需要根据化学计量比计算出反应物B的质量。
由于反应物A和反应物B的化学计量比为2:3,所以反应物B的质量为24克x (3/2) = 36克。
3. 在一定条件下,一定量的氧气与一定量的氢气完全反应,了36克水。
求反应中消耗的氧气和氢气的质量。
解答:我们需要根据水的化学式H₂O计算出水的摩尔质量。
水的摩尔质量为2 x 1.008克/摩尔 + 16.00克/摩尔 = 18.016克/摩尔。
因此,36克水的物质的量为36克 / 18.016克/摩尔 = 2摩尔。
由于水的化学计量比为2:1,所以反应中消耗的氢气的物质的量为2摩尔,质量为2摩尔 x 2.016克/摩尔 = 4.032克。
同样,消耗的氧气的物质的量为1摩尔,质量为1摩尔 x 32.00克/摩尔 = 32.00克。
4. 某溶液中,溶质的质量分数为10%。
如果该溶液的质量为500克,求溶质的质量。
数为10%,即溶质的质量占溶液总质量的10%。
因此,溶质的质量为500克 x 10% = 50克。
5. 在一定条件下,一定量的氢气和一定量的氧气完全反应,了水。
如果反应中消耗的氢气的质量为2克,求反应中消耗的氧气的质量。
解答:我们需要根据水的化学式H₂O计算出水的摩尔质量。
水的摩尔质量为2 x 1.008克/摩尔 + 16.00克/摩尔 = 18.016克/摩尔。
.5.8g白色沉淀。
求:(1)样品中氧化镁的质量。
(2)反应所得溶液中溶质的质量分数。
6、“骨质疏松症”是由人体缺钙引起的,可服用补钙剂来治疗。
乳酸钙(CaC6H10O6·5H2O)是一种常见的补钙剂,出售乳酸钙片剂每片含乳酸钙200mg.一个成年缺钙病人每天服用20片乳酸钙片剂可达到补钙目的。
计算:(计算结果保留整数)(1)乳酸钙中各元素的质量比。
(2)该成年缺钙病人改用喝牛奶(每100mg牛奶中含钙0.104g)来补钙,每天至少需喝多少毫升牛奶。
7、生铁和钢都是铁合金,生铁中碳的含量在2.0%~4.3%之间,钢中碳的含量在0.03%~2%之间。
将一块质量为10.0g的铁合金放入锥形瓶中,再向锥形瓶中加入100g稀H2SO4,恰好使铁合金中的铁完全反应(碳不熔于稀硫酸;铁合金中其他元素含量很低,可忽略不计),测得生成H2的体积为4.00L(H2在该条件下的密度为0.0880g/L)。
试根据计算回答:(计算结果保留三位效数字)(1)该铁合金是生铁还是钢?(2)反应后所得溶液的溶质质量分数。
8、将3.1克氧化钠加到质量为m的水中,完全反应后,得到溶质的质量分数为16%的溶液,在该溶液中加入50克稀盐酸,两者恰好完全反应。
(氧化钠与水反应的化学方程式为:Na2O+H2O==2NaOH)。
求:(1)m的值(2)所加盐酸中溶质的质量分数。
(3)若要使反应后的氧化钠溶液成为20ºC时的饱和溶液,至少要蒸发掉多少克水?(20ºC时,氧化钠的溶解度为36克)9、以下是我省生产的某种加钙食盐包装标签上的部分文字。
请仔细阅读后回答以下问题:摄入量?23、某校化学兴趣小组为测定空气中二氧化硫的含量,用NOH溶液吸收SO2,反应方程式如下:2NaOH+SO2=NaSO3+H2O用NaOH溶液吸收1000L已除去CO2的空气样品,溶液质量增重了0.64g。
已知此时空气的密度约为1.3g/L,求:(1)被吸收的SO2的质量。

中考化学化学计算题20篇(附带答案解析)1一、中考化学计算题1.向13.6g碳酸钠和氯化钠的固体混合物滴加稀盐酸,所加稀盐酸质量与生成气体质量的关系如图所示。
计算:(1)固体混合物中碳酸钠的质量。
(2)该稀盐酸中溶质的质量分数。
(3)恰好完全反应时所得的溶液中溶质的质量分数。
(计算结果精确至0.1%)【答案】(1)10.6克(2)10%(3)17.9%【解析】试题分析:设固体混合物中Na2CO3的质量为x,稀盐酸中溶质的质量为y,反应生成NaCl 的质量为z。
Na2CO3+ 2HCl ="=" 2NaCl + H2O + CO2↑106 2×36.5 2×58.5 44x y z 4.4g得x=10.6克稀盐酸中溶质的质量分数为:恰好完全反应时所得的溶液溶质质量分数为:考点:根据化学方程式的计算物质的质量分数2.现有一份氧元素质量分数为 89.5%的过氧化氢溶液,加入 MnO2充分反应后,得到液体的质量为 90g(不考虑操作过程中液体的损失),则生成氧气的质量为________________g(精确到小数点后 1 位)。
【答案】 5.2【解析】解法一:设生成氧气的质量为x,过氧化氢溶液的质量为y,根据反应前后氧元素的质量不变可得关系式:①y-90g=x,②y89.5%=x+90g100%,x=5.2g,答:生成氧气的质量为5.2g。
解法二:可根据反应前后氢元素的质量不变进行分析解答,则:根据题意过氧化氢溶液的质量=90g100%(1-89.5%),生成氧气的质量=90g100%(1-89.5%)-90g=5.2g,答:生成氧气的质量为5.2g。
3.我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献,工业上用侯氏制碱法制得的纯碱中含有一定量的氯化钠杂质。
现称取只含氯化钠杂质的纯碱样品11g,全部溶解在50g水中,当加入稀盐酸64.4g时,恰好完全反应,所得溶液的质量为121g。

中考化学化学计算题20篇(附带答案解析)(word )一、中考化学计算题1.某混合溶液中含有硫酸和盐酸,取该混合溶液20g 于烧杯中,不断滴加氢氧化钡溶液,反应过程中烧杯中产生沉淀的质量、溶液pH 的变化如图所示(BaCl 2溶液呈中性)。
求:(1)完全反应后生成沉淀的质量为_____g ;(2)氢氧化钡溶液的质量分数为_____;(3)计算20g 混合溶液中HCl 的质量为多少?_____【答案】4.66 17.1% 2.92g【解析】【分析】根据图可知,生成4.66g 沉淀消耗的氢氧化钡溶液的质量为20g ,而总消耗的氢氧化钡的溶液的质量为60g ,则与盐酸反应的氢氧化钡溶液的质量为60g ﹣20g =40g ,据此结合对应的化学方程式求算。
【详解】由图可知生成沉淀的质量为4.66g ,与硫酸反应的氢氧化钡溶液的质量为20g 设氢氧化钡溶液的质量分数为x22442Ba(OH)+H SO BaSO +2H O 17123320gx 4.66g ↓=171233=20g 4.66gx x =17.1%与盐酸反应的氢氧化钡溶液的质量为60g ﹣20g =40g设20g 混合溶液中HCl 的质量为y222()1717317.1%40g yBa OH +2HCl BaCl +2H O ⨯=17173=17.1%40g y ⨯y=2.92g故填:(1)4.66;(2)17.1%;(3)2.92g【点睛】根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
2.化学兴趣小组取26g石灰石样品(杂质不参加反应,也不溶于水)放在烧杯中,向其中加入90g稀盐酸,恰好完全反应,反应后烧杯中物质的总质量为105g,计算:(1)生成二氧化碳的质量是____。
(2)反应后所得溶液的溶质质量分数是____。
【答案】(1)11克(2) 26.7%【解析】试题解析:由质量守恒定律可以知道反应前的各物质的总质量等于反应后各物质的总质量的,所以二氧化碳的质量=26+90-105=11克,反应后的溶质是CaCl2,而溶液的质量等于105克减去石灰石中的不反应的杂质的质量,设:石灰石中CaCO3质量为X,生成的CaCl2质量为Y,CaCO3+ 2HCl==CaCl2 + CO2↑ + H2O100 111 44X Y 11克列比例式:100:X=44::11克解得:X=25克111:Y=44:11克解得:Y="27.75" 克反应后所得溶液的溶质质量分数=27.75/105-(26-25)×100%≈26.7%考点:质量守恒定律及其根据化学方程式的计算溶液的相关计算3.我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献,工业上用侯氏制碱法制得的纯碱中含有一定量的氯化钠杂质。

一、中考初中化学计算题1.某碳酸钠样品中含有少量氯化钠。
现称量11 g该样品放入烧杯中,然后加入一定量溶质的质量分数为14.6%的稀盐酸,至恰好完全反应,去除溶液中的水分,最终得到12.1g氯化钠固体。
计算:(1)碳酸钠样品中碳酸钠的质量______________(2)反应后所得溶液中溶质的质量分数。
(结果精确到0.1%)_____________【答案】10.6g 21.4%【解析】【分析】【详解】设样品中氯化钠的质量为x,则生成的氯化钠质量为12.1g-x,样品中碳酸钠的质量为11g-x,生成的二氧化碳质量为y,反应中消耗的盐酸质量为z。
2322 Na CO+2HCl=2NaCl+H O+CO106731174411g-x z14.6%12.1g-x y ↑⨯1067311744=== 11g-x z14.6%12.1g-x y⨯解得x=0.4g;y=4.4g;z=50g则样品中碳酸钠的质量为10.6g反应后所得溶液中溶质质量分数为:12.1g100%11g+50g-4.4g⨯≈ 21.4%答:碳酸钠样品中碳酸钠的质量为10.6g,反应后所得溶液中溶质的质量分数为21.4%。
2.在一烧杯中盛有24.3g Na2SO4和NaCl组成的固体混合物,加入100g水使Na2SO4和NaCl全部溶解。
向其中逐渐滴加溶质质分数为20%的氯化钡溶液,生成沉淀的总质量与所滴入氯化钡溶液的质量关系曲线如图所示。
(1)请分析当BaCl2溶液滴加到B点时,溶液中的溶质是。
(2)请计算当滴加BaCl2溶液至图中A点时,所得溶液的溶质质量分数(计算结果保留一位小数)。
【答案】(1)BaCl2NaCl (2)10.6%【解析】试题分析:(1)当沉淀的质量不再增加时,说明反应已经进行完毕,所以当BaCl2溶液滴加到B点时说明氯化钡溶液滴加过量,当BaCl2溶液滴加到B点时,溶液中的溶质有刚生成的氯化钠和原来的氯化钠以及过量的氯化钡。

25基础计算1.在一个实验室中发现一橡胶球可以漂浮在0.5mol/L的NaCl溶液表面,求该NaCl溶液的密度。
答案:1.018g/mL。
解析:根据阿威休斯定律得到:Fb=FgρVg=m*gρ=m/V=(Vg*g)/V=(Fg/Ag*g)/V=(4πr^3/3*g)/[(4/3)*π*r^3]=3/4*r*g=7.35*10^-5*g其中,Ag为橡胶球跟水接触的面积,r为橡胶球半径,g为重力加速度。
因此,NaCl溶液的密度为:ρNaCl=ρwater+ρball=1.000g/mL+7.35*10^-5*g/mL=1.018g/mL。
2.一种饱和食盐水的密度为1.20g/mL,问在哪个温度下它的浓度为26%。
答案:56.8°C。
解析:首先,要知道饱和食盐水在不同温度下的密度变化情况,参考表格得出如下数据:温度(°C)密度(g/mL)01.091101.078201.064301.049401.033501.015600.996700.975800.951900.9241000.895然后,根据浓度的定义可知:浓度=质量/总质量总质量=质量/浓度因为食盐水是饱和的,所以其浓度为100%。
设实验时食盐水的质量为m,则总质量为m/1.20,其中1.20为食盐水的密度。
根据题意,浓度为26%,所以食盐的质量为0.26*(m/1.20)。
由此0.26*(m/1.20)=m/(1.20+Δρ)其中Δρ为实验时食盐水的密度与需要求的密度的差值。
将参考表格中的数据代入上式计算,得到Δρ为0.325g/mL。
解方程得出:Δρ=0.325=0.26*m/(1.20+Δρ)m=68.45g因此,实验时食盐水的质量为68.45g。
而在哪个温度下其密度为1.20*0.26=0.312g/mL呢?查表可得,在56.8°C时,食盐水的密度约为0.312g/mL,因此答案为56.8°C。

初三化学化学计算题专题训练答案及解析一、有关化学式的计算1、计算尿素CO(NH₂)₂中氮元素的质量分数。
答案:尿素中氮元素的质量分数=(氮原子的相对原子质量×氮原子个数)÷尿素的相对分子质量×100%氮原子的相对原子质量为 14,尿素的化学式为 CO(NH₂)₂,其中氮原子个数为 2。
尿素的相对分子质量= 12 + 16 +(14 + 1×2)×2 = 60氮元素的质量分数=(14×2)÷60×100% ≈ 467%解析:要计算化合物中某元素的质量分数,就用该元素原子的相对原子质量乘以原子个数,再除以化合物的相对分子质量,最后乘以100%。
在尿素中,明确氮原子的个数以及各原子的相对原子质量,按照公式准确计算即可。
2、已知氧化铁(Fe₂O₃)的相对分子质量为 160,求其中铁元素与氧元素的质量比。
答案:铁元素与氧元素的质量比=(铁原子的相对原子质量×铁原子个数)∶(氧原子的相对原子质量×氧原子个数)铁原子的相对原子质量为 56,氧原子的相对原子质量为 16。
氧化铁中,铁原子个数为 2,氧原子个数为 3。
铁元素与氧元素的质量比=(56×2)∶(16×3)= 7∶3解析:计算化合物中各元素的质量比,同样要依据各元素原子的相对原子质量和原子个数。
先分别算出铁元素和氧元素的质量,然后相比得出质量比。
二、有关化学方程式的计算1、加热分解 63g 高锰酸钾,可以得到多少克氧气?答案:设可以得到氧气的质量为 x。
2KMnO₄=△= K₂MnO₄+ MnO₂+ O₂↑316 3263g x316 / 63g = 32 / xx = 064g解析:首先写出高锰酸钾受热分解的化学方程式。
根据化学方程式找出高锰酸钾与氧气的质量比,然后设出未知量氧气的质量为 x,列出比例式进行求解。
2、实验室用 10g 碳酸钙与足量的稀盐酸反应,可制得多少克二氧化碳?答案:设生成二氧化碳的质量为 y。

(一)根据化学式计算一、基础知识1.化学式:用元素符号来表示物质组成的式子.2.化学式(分子式)表示的含义:(1)表示该物质的一个分子.(2)表示构成一个分子的各种原子的原子个数.(3)表示一种物质及组成该物质的各种元素.3.常用的计算关系式(以化合物A m B n为例):(1)相对分子质量=A的相对原子质量×m+B的相对原子质量×n(2)A的质量分数(3)A、B元素的质量比(4)A元素的质量=化合物质量×A的质量分数(5)在混合物中,某物质的质量分数(纯度)(杂质不含该元素时)4.两种物质的质量比等于相对分子质量×分子个数之比.5.两种元素的原子个数比等于它们的质量比除以相对原子质量之比.一·例题解析例1、为了消除碘缺乏病,我国政府规定居民的食用盐必须是加碘盐。
碘盐就是在食盐中加入一定量的碘酸钾(KIO3)。
1000g碘盐中约含0.02g碘。
(相对原子质量:K-39 I-127 O-16)(1)__________g碘酸钾中含有0.02g碘。
(保留小数点后3位)(2)成人每天约需1.5×10-4g碘,假设这些碘是从碘盐中摄取的,成人每天需要食用碘盐解析:碘盐中碘元素的质量=碘盐中碘酸钾的质量×碘酸钾中碘元素的质量分数(1)碘酸钾中碘元素的质量分数为:×100%=59.3%需碘酸钾的质量为:0.02g/59.3%=0.034g(2)需要食用碘盐的质量为:1.5×10-4g/x=0.02g/1000g x=7.5g答案:(1)0.034(2)7.5例2、研究表明,Al3+在人体内会阻止小肠壁对磷的吸收,使血液和其它组织内磷的含量减少,造成记忆力减退,免疫功能下降,被世界卫生组织确定为食品污染源之一。
营养学家指出每天铝的安全摄入量为每千克体重0.7mg。
请回答下列问题:(1)传统食品加工过程中,一般在1kg面粉中加入1g明矾(已知:明矾的化学式为KAl(SO4)2·12H2O,其相对分子质量是474;1g = 1000mg)。

✧守恒法✧质量守恒:反应前生成的各物质的质量总和=反应后生成的各物质的质量总和1.在一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则关于此反应认识不正确的是()A.C.反应中 N、P 的质量比为 5:4 D.物质 Q 可能是该反应的催化剂2.将一定量的丙醇(C3H8O)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:A.表中 a 的值为 2.8 B.X 一定是该反应的催化剂C.X 可能含有氢元素D.若起始时氧气的质量是 14.4g,则无 X 生成3.将20克甲、5克乙、8克丙三种纯净物混合,在密闭容器中加热发生化学反应,经分析可知:反应后混合物中含有5克甲、16克丙,还含有一种新物质丁。
则丁物质的质量是A.12gB.9gC. 4gD.17g4.一定条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量如下:B和D两种物质变化的质量比为。
✧元素守恒:化学变化过程中,同种元素的存在形式可以不同,但其质量不变5.现有一样品,经分析含氢氧化钾、碳酸钾和水三种物质。
向该样品中加入溶质质量分数为7.3%的稀盐酸100 g,恰好完全反应得到中性溶液,蒸干该溶液得到固体质量为()A.74.5 g B.14.9 g C.10 g D.7.45 g6.某NH4NO3样品中混有一种其他氮肥,经分析产品中氮元素质量分数为20%。
那么,该样品中可能含有的氮肥:( )A. (NH4)2SO4B. NH4ClC.CO(NH2)2D. NH4HCO37. 有一不纯石灰石样品,经分析知道它有 9%碳(杂志中不含碳),则该样品里含 CaCO3 ()A.9%B.12%C.25%D.75%8.有一不纯的NH4NO3样品,经分析知道,200g样品中含氮元素60g(杂质中不含氮元素)。
求样品中NH4NO3的质量分数9.将3.6gCaCO3固体高温煅烧一会,冷却后测量剩余固体中钙的质量分数为57.6%。

最新中考化学化学计算题20篇(附带答案解析)(word)一、中考化学计算题1.将一定质量的NaCl和Na2SO4 固体混合物完全溶于水后,加入一定质量分数的BaCl2溶液208g,恰好完全反应,过滤,得到23.3g沉淀,经测定滤液中含氯元素的质量为21.3g (不考虑过滤过程中物质质量的损失)。
计算:(1)所加BaCl2溶液的溶质质量分数_______。
(2)原固体混合物中Na2SO4的质量________。
(3)原固体混合物中NaCl的质量__________。
【答案】10% 14.2g 23.4g【解析】【分析】由题可知生成硫酸钡的质量是23.3g,根据化学方程式列比例求出Na2SO4的质量,BaCl2的质量,由化学式求出BaCl2中氯元素的质量,可得出原固体混合物中NaCl中氯元素的质量,从而求得NaCl的质量;【详解】设BaCl2的质量是xg,Na2SO4的质量是yg,Na2SO4+BaCl2=2NaCl+BaSO4↓142 208 233y x 23.3g142/y=208/x=233/23.3gy=14.2g,x=20.8gBaCl2溶液的溶质质量分数==10﹪BaCl2中氯元素的质量=g=7.1g原固体混合物中NaCl中氯元素的质量=21.3g-7.1g=14.2g原固体混合物中NaCl的质量=14.2g=23.4g2.化学实验小组的同学为了研究某公共场所铁制护栏锈蚀程度,取12.8g已生锈的铁护栏(假设其成分只有Fe和Fe2O3,不含其它杂质),加入到120g一定浓度的稀盐酸中,充分反应,测得产生气体质量与稀盐酸质量关系如图所示。
请回答问题:(1)发生复分解反应的化学方程式为_____。
(2)根据已知信息列出求解参加反应的铁的质量(X )的比例式_____。
(3)铁护栏中氧化铁的质量分数为_____。
(4)若用质量分数36.5%的浓盐酸配制120g 上述稀盐酸,需要浓盐酸与水的质量比为_____。

中考化学化学计算题专项训练及答案一、有关化学式的计算1、计算尿素CO(NH₂)₂中氮元素的质量分数。
解:尿素中氮元素的相对原子质量总和为:14×2 = 28尿素的相对分子质量为:12 + 16 +(14 + 1×2)×2 = 60氮元素的质量分数=(氮元素的相对原子质量总和÷相对分子质量)× 100%=(28÷60)× 100% ≈ 467%答:尿素中氮元素的质量分数约为 467%。
2、已知氧化铁(Fe₂O₃)的化学式,计算:(1)氧化铁中各元素的质量比。
(2)氧化铁中铁元素的质量分数。
解:(1)氧化铁中 Fe、O 元素的质量比=(56×2):(16×3)= 7:3(2)氧化铁的相对分子质量为:56×2 + 16×3 = 160铁元素的质量分数=(56×2÷160)× 100% = 70%答:(1)氧化铁中 Fe、O 元素的质量比为 7:3;(2)氧化铁中铁元素的质量分数为 70%。
二、有关化学方程式的计算1、实验室用 13 克锌与足量稀硫酸反应,可制得氢气多少克?解:设生成氢气的质量为 xZn + H₂SO₄= ZnSO₄+ H₂↑65 213g x65/13g = 2/xx = 04g答:可制得氢气 04 克。
2、加热分解 63 克高锰酸钾,可以得到氧气的质量是多少?解:设生成氧气的质量为 x2KMnO₄加热 K₂MnO₄+ MnO₂+ O₂↑316 3263g x316/63g = 32/xx = 064g答:可以得到氧气 064 克。
3、工业上,高温煅烧石灰石(CaCO₃)可制得生石灰(CaO)和二氧化碳。
如果要制取 56 吨氧化钙,需要碳酸钙的质量是多少?解:设需要碳酸钙的质量为 xCaCO₃高温 CaO + CO₂↑100 56x 56 吨100/x = 56/56 吨x = 10 吨答:需要碳酸钙 10 吨。

初三化学化学计算题专项训练及答案一、有关化学式的计算1、计算相对分子质量相对分子质量等于化学式中各原子的相对原子质量总和。
例 1:计算硫酸(H₂SO₄)的相对分子质量。
解:氢(H)的相对原子质量约为 1,硫(S)的相对原子质量约为32,氧(O)的相对原子质量约为 16。
硫酸的相对分子质量= 2×1 + 32 + 4×16 = 98练习 1:计算碳酸钙(CaCO₃)的相对分子质量。
答案:钙(Ca)的相对原子质量约为 40,碳(C)的相对原子质量约为 12,氧(O)的相对原子质量约为 16。
碳酸钙的相对分子质量= 40 + 12 + 3×16 = 1002、计算物质组成元素的质量比物质中各元素的质量比等于各元素的相对原子质量乘以原子个数之比。
例 2:计算水(H₂O)中氢元素和氧元素的质量比。
解:氢元素的相对原子质量约为1,氧元素的相对原子质量约为16。
水(H₂O)中氢元素和氧元素的质量比=(2×1)∶(1×16)=1∶8练习 2:计算二氧化碳(CO₂)中碳元素和氧元素的质量比。
答案:碳元素的相对原子质量约为 12,氧元素的相对原子质量约为16。
二氧化碳(CO₂)中碳元素和氧元素的质量比=(1×12)∶(2×16)= 3∶83、计算物质中某元素的质量分数某元素的质量分数=(该元素的相对原子质量×原子个数÷相对分子质量)×100%例 3:计算硝酸铵(NH₄NO₃)中氮元素的质量分数。
解:氮(N)的相对原子质量约为 14,氢(H)的相对原子质量约为 1,氧(O)的相对原子质量约为 16。
硝酸铵的相对分子质量= 14×2 + 1×4 + 16×3 = 80氮元素的质量分数=(14×2÷80)×100% = 35%练习 3:计算尿素CO(NH₂)₂中氮元素的质量分数。

化学中考化学复习:计算题知识点-+典型题含答案一、选择题1.加热20gKMnO 4制氧气,制得所需氧气后,停止加热,冷却后称取剩余固体质量为18.72g .试计算:(1)制取氧气的质量为_____g ;(2)KMnO 4分解的百分率是多少?(要有计算过程)_____ (K ﹣39 Mn ﹣55 O ﹣16)答案:28 63.2% 【解析】 【分析】高锰酸钾加热分解生成锰酸钾和二氧化锰和氧气,根据质量守恒定律,反应前反应物的总质量等于生成物的总质量,如果不相等,则减少的质量即为氧气的质量,根据解析:28 63.2% 【解析】 【分析】高锰酸钾加热分解生成锰酸钾和二氧化锰和氧气,根据质量守恒定律,反应前反应物的总质量等于生成物的总质量,如果不相等,则减少的质量即为氧气的质量,根据氧气的质量可计算出分解的高锰酸钾的质量,再计算出高锰酸钾分解的百分率。
【详解】(1)高锰酸钾加热分解生成锰酸钾和二氧化锰和氧气,根据质量守恒定律,反应前反应物的总质量等于生成物的总质量,如果不相等,则减少的质量即为氧气的质量,制取氧气的质量为20g-18.72g=1.28g 。
(2)设参加反应的高锰酸钾的质量为x42422Δ2KMnO K MO +MnO +O 31632x1.28g↑31632=x 1.28gx=12.64gKMnO 4分解的百分率是12.64g100%=63.2%20g⨯ 答:KMnO 4分解的百分率是63.2%。
【点睛】高锰酸钾受热分解放出氧气,根据质量守恒定律,剩余固体减少的质量就是生成的氧气的2.氯酸钾(KClO3)固体在二氧化锰作催化剂并加热的条件下,能较快的分解生成氯化钾和氧气。
(1)反应后,将二氧化锰从混合物中分离出来的操作方法是、。
(2)要得到9.6g氧气,计算需要分解氯酸钾的质量。
(写出计算过程)答案:(1)溶解、过滤;(2) 24.5g【解析】(1)反应后,将二氧化锰从混合物中分离出来的操作方法是溶解、过滤;(2)解∶设要得到9.6g氧气,需要分解氯酸钾的质量为xg2KClO3 2解析:(1)溶解、过滤;(2) 24.5g【解析】(1)反应后,将二氧化锰从混合物中分离出来的操作方法是溶解、过滤;(2)解∶设要得到9.6g氧气,需要分解氯酸钾的质量为xg2KClO3催化剂,加热 2KCl+3O2↑。
------------------------------------------精品文档-------------------------------------初三化学计算中考化学计算题分类复习有关化学式的计算题1、计算CuSO·5HO的式量242、计算NHNO中所含各元素的质量比343、某黄铁矿中含FeS为72%,计算该黄铁矿中硫元素的质量分数是()2 A.36%B.38.4%C.42.6%D.48%4、某元素R的单质跟氧气化合生成的氧化物中,R元素跟氧元素的质量比为21:8,原子个数比为3:4,又知氧元素的相对原子质量为16,则元素R的相对原子质量为()A.24B.27C.56D.655、在SO和SO的两种物质中,相同的是()23 A.氧元素的质量分数 B.硫元素的质量分数 C.元素种类 D.原子个数比6、A、B两种化合物均由R和氧两种元素组成的,在化合物A和B中,R元素的质量分数分别为50%和40%,若A的化学式为RO,则B的化学式为()2 A.RO B.RO C.ROD.RO 32237、在FeSO和Fe (SO)的混合物中,氧元素的质量分数为a%,则该混合物中铁元素的质3424量分数为()A.2a%B.1-a%C.1-0.5a%D.1-1.5a%8、甲、乙两种化合物xy和yz中,y元素的质量分数分别约为40%和50%,则在丙化合物22xyz 中y元素的质量分数约为()32 A.20% B.25% C.30% D.35%(一)标签型化学式计算题:1、(2008 甘肃兰州)锌是人体健康必需的元素,锌缺乏容易造成发育障碍,易患异食癖等病症,使人体免疫功能低下。
市售的葡萄糖酸锌口服液对治疗锌缺乏病具有较好的疗效。
下图是某品牌葡萄糖酸锌口服液的标签,请根据标签信息回答:;(1)葡萄糖酸锌中各元素的质量比××牌口服液(精确到。
2()葡萄糖酸锌中锌元素的质量分数主要成分:葡萄糖酸锌0.01%)Zn OH化学是:C141222)某患者除正常饮食吸锌元素外,还需服用该品牌葡萄糖酸锌3(每只口服液含葡萄糖酸锌75%锌元素,而这些锌有口服液。
若治疗一个疗程需补充104mg45.5mg支葡萄糖酸锌口服液?(简来自该口服液,则患者共需服用××制药厂写出解题过程)(二)叙述型化学式计算题:构成的极为复杂的化等])COOHCH(NHCH[2008 、1(四川)蛋白质是由多种氨基酸丙氨酸:23合物,人体通过食物获得蛋白质,在胃肠道里与水发生反应,生成氨基酸,试计算:- 1 -初三化学计算(1)丙氨酸分子中氮原子与氧原子的个数比。
(2)丙氨酸的相对分子质量。
(3)丙氨酸中碳、氢、氧、氮元素的质量比。
(三)综合型化学式计算题:1、(2007徐州市)青少年正处于生长发育时期,每天需要摄取足量的蛋白质,蛋白质的代谢产物主要是尿素[CO(NH)]。
若从食物中摄取的蛋白质经体内新陈代谢后完全转化为尿素排22出体外,每人每天相当于排出尿素30g。
(1)30g尿素中含氮元素多少克?(2)已知蛋白质中氮元素的平均质量分数为16%,则每人每天至少应从食物里摄取的蛋白质为多少克?(3)请你根据下表中几种常见食物的蛋白质含量,计算出每天至少应摄人多少克下列食物才能满足你对蛋白质的需求(可以只摄取一种食物,也可同时摄取几种食物)。
食物白面鸡蛋瘦猪肉牛奶3%2010%%14%蛋白质含量有关化合价的计算题1、(2008 天津市)据报道,“第三代”瓷珠圆珠笔问世,该圆珠笔的球珠有氧化锆陶瓷材料制成,这种材料的应用使球珠的耐腐蚀性,耐磨性得到了提高,从而填补了国内空白,氧化锆的化学式为ZrO,在氧化锆中锆元素的化合价为:()2A.+2 B.+3 C.+4 D.+52、(2007 天津大港)世界卫生组织(WHO)将ClO列为A级高效安全灭菌消毒剂,它在食2品保鲜,饮用水消毒等方面都有广泛应用,ClO分子中氯元素的化合价为:()2A.-1 B.+2 C.+3 D.+4有关化学方程式的计算题有关反应物和生成物的计算1、(2007泉州市)发射通讯卫星的火箭用联氨(NH)做燃料,用四氧化二氮(NO)助燃,反应4224的化学方程式如下:2NH+ NO=== 3N+4HO,生成物不会对大气造成污染。
请计算:3.2Kg 242224N2H4发生燃烧,需要助燃物NO的质量。
42含有杂质的反应物和生成物的计算1、(2008太原市)将100g含CaCO质量分数为80%的石灰石样品(杂质不发生化学反应也3不含钙),高温灼烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成CaO的质量约为多少克?有关混合原料参加反应的化学方程式的计算1、不纯的铁片5.6g与足量的HCl反应,放出0.21g氢气,则铁片中可能含有的一种金属杂质为()A.Zn B.Pb C.Cu D.Mg2、(2007德阳市)将26g某金属混合物投入到足量的稀硫酸中,共收集到2g氢气,该金属混合物的组成可能是()A、Mg和ZnB、Fe和ZnC、Zn和CuD、Cu和Fe与实验结合的计算- 2 -初三化学计算1.(2007永州市)石灰石是我市主要矿产之一,小江同学为了寻找纯度超过85%的石灰石,对一样品进行了如下定量实验。
中和其的石灰石样品样品的质量为烧杯实验烧杯的质量为烧杯和盐酸12.0g50.0g 质数据物的质量为100.0g 混合107.6g量为①该实验中生成的二氧化碳的质量是多少克?②该石灰石样品的纯度是否试通过分析计算:符合要求?(假设石灰石样品中的杂质不与盐酸反应也不溶于水)过量计算%的稀盐酸的甲乙两烧克质量分数为36.516克镁粉分别加入各装有2001、将28克铁粉和杯中,哪个烧杯中生成的气体较多。
%的稀盐酸的甲乙克质量分数为36.527克铝粉分别加入各装有2002、若是将24克镁粉和两烧杯中,哪个烧杯中生成的气体较多。
多步反应计算克的氯酸钾完全分解后生12.251、计算用多少克的锌跟足量稀硫酸反应生成的氢气,能跟成的氧气恰好完全反应生成水。
有关字母型化学反应方程式计算题。
若增加D,它们化合时只能生成30 g新物质B、C三种物质各15 g、1(2008南通市)A、)10 g A,则反应停止后,原反应物中只余C。
根据上述条件推断下列说法中正确的是(50 g 的质量为.第二次反应后,D B A.第一次反应停止后,B 剩余9 g的质量比是3∶2 D.反应中A和CC.反应中A和B的质量比是5∶2有关溶液的计算题溶质的质量分数公式计算1、(2007天津市)将100g 10%的某固体物质M的溶液,分别进行下述操作,所得溶液中溶质的质量分数最小的是()A. 蒸发掉10g水,无晶体析出B. 加入10g10%的M的溶液C. 加入10g固体M,并使之完全溶解D. 加入10g水稀释、浓缩、不同浓度溶液混合等计算1、现有8%的氯化钠溶液50g,若是其溶质质量分数增达到16%,可采用的方法是:①需要蒸发多少克水?②需要加入多少克氯化钠?③需要加入多少克40%的氯化钠溶液?2、(2007重庆市)电解水时,常常要加入少量氢氧化钠使反应容易进行。
现将加有氢氧化钠的水通电一段时间后,产生lg氢气,其中氢氧化钠的质量分数也由4.8%变为5%。
计算:(1)生成氧气的质量。
(2)电解后剩余水的质量。
- 3 -初三化学计算配制溶液或与实验结合的质量分数计算1、(2007威海市)实验室要配制50 g溶质质量分数为20%的硝酸钾溶液,现有25 g溶质质量分数为40%的硝酸钾溶液、20 g溶质质量分数为15%的硝酸钾溶液及足够多的硝酸钾晶体和蒸馏水,请选用上述的药品,设计三种配制方案填入下表方案一方案二方案三饱和溶液溶解度计算1、已知某物质A在40℃时溶解度为2 5克,若温度降低到20℃,每300克A溶液中将析出10克晶体,那么20℃时A的饱和溶液中溶质的质量分数为多少?此时,A的溶解度为多少?溶解度与溶质质量分数换算有关晶体析出的计算,31.6g℃下的溶解度为20℃、601、现有210克60℃下的硝酸钾饱和溶液,已知硝酸钾在需蒸可析出硝酸钾晶体多少克?若采取蒸发水分的办法,若将该溶液降温到20℃,和110g,发掉多少克水能得到同样多的晶体?(设蒸发后恢复原温度)有关溶液和化学方程式的简单综合计算(一)叙述型计算题:涉及沉淀的叙述型计算题:a.课外探究小组的同学欲测定纯碱,家里蒸馒头用的纯碱中含有少量的NaCl 1、(2007重庆市)溶液水中,再加入100.0gCaCl 中碳酸钠的含量。
他们取该纯碱样品11.0g,全部溶解在2)纯碱样品中碳(1141.0g,恰好完全反应。
过滤干燥后,称得沉淀质量为10.0g。
请计算:2)反应后所得滤液中溶质的质量分数。
酸钠的质量;(涉及气体的叙述型计算题:b.天津市)我国化工专家侯得榜的“侯是制碱法”为世界制碱工业做出了杰出贡献。
(2006 1、杂质。
现称取只含氯化钠的纯碱样品NaCl工业上用侯氏制碱法制得的纯碱中含有一定量的,121g64.4g时,恰好完全反应,所得溶液质量为11g,全部溶解在50g水中,当加入稀盐酸试求:0.1%)①该纯碱样品的纯度(计算结果精确到②所的溶液中溶质的质量分数。
由溶液质量和质量分数进行计算:c.南充市名优特产阆中保宁醋,是中国四大名醋之一,其主要成分是醋酸,南充市(2007)1、。
COONa + H2OCOOH + NaOH = CHCHCOOHCH化学式为:。
测定保宁醋醋酸含量的原理是:333- 4 -初三化学计算化学课外活动小组中和30g保宁醋,用去质量分数为5%的NaOH溶液20g。
请你计算:(1)30g保宁醋中含醋酸的质量;(2)该保宁醋中醋酸的质量分数。
(二)标签型计算题:1. (2007德阳市)某校化学实验室有一瓶标签残缺的过氧化氢溶液(如。
该校化学课外兴趣小组的同学为了测定其中溶质的质量分图所示),加入适量催化剂,待完全反应后,共收集34g数,他们取出该溶液氧气。
试计算该溶液中溶质的质量分数。
到0.32g (三)图像型计算题:小红同学在某化工厂进行社会实践,技术员与小红一起分析由氯化钡和氯)(2007无锡市1、固16.25g化钠组成的产品中氯化钠的质量分数。
取水中,向所得到的混合体样品,全部溶于143.6mL的碳酸钠溶溶液中逐滴加入溶质质量分数为10.6% 液,记录了如图所示的曲线关系。
技术员给小红的提示:反应的化学方程式+2NaCl===BaCO↓BaCl+NaCO322310.6%⑴当氯化钡与碳酸钠恰好完全反应时,消耗。
g的碳酸钠溶液的质量是⑵产品中氯化钠的质量分数是多少?⑶当氯化钡与碳酸钠恰好完全反应时,过滤,所得溶液中溶质的质量分数是多少?:(四)表格型计算题。