华南理工大学期末考试物理化学试卷试卷b附答案汇编
- 格式:doc
- 大小:189.00 KB
- 文档页数:7


物理化学上学期试卷(应用化学专业上学期用)校名:华南理工大学系名:专业:得分:班级:本班排序号:姓名:日期:年月日一、选择题( 共10题20分)1. 2 分(2435)2435CuSO4与水可生成CuSO4ּH2O,CuSO4ּ3H2O,CuSO4⋅5H2O三种水合物,则在一定温度下与水蒸气平衡的含水盐最多为: ( ) (A) 3种 (B) 2种 (C) 1种 (D) 不可能有共存的含水盐2. 2 分(1192)1192用130℃的水蒸气(蒸气压为 2.7p∃)与1200℃的焦炭反应生成水煤气:C+H2O−−→CO+H2,如果通入的水蒸气反应掉70%,问反应后混合气体中CO的分压为多少?设总压2.7p∃不变。
( )(A) 0.72p∃(B) 1.11p∃(C) 2.31p∃(D) 1.72p∃3. 2 分(0485)0485氧气的燃烧热应为何值? ( )(A) 大于零(B) 小于零(C) 等于零(D) 不确定4. 2 分(1513)1513气体CO和N2有相近的转动惯量和相对分子摩尔质量,在相同温度和压力时,两者平动和转动熵的大小为:( )(A) S t,m(CO)=S t,m(N2), S r,m(CO)>S r,m(N2)(B) S t,m(CO)>S t,m(N2), S r,m(CO)>S r,m(N2)(C) S t,m(CO)=S t,m(N2), S r,m(CO)<S r,m(N2)(D) S t,m(CO)=S t,m(N2), S r,m(CO)=S r,m(N2)5. 2 分(2392)2392将固体NH4HCO3(s) 放入真空容器中,恒温到400 K,NH4HCO3按下式分解并达到平衡: NH4HCO3(s) = NH3(g) + H2O(g) + CO2(g)体系的组分数C和自由度数f为: ( )(A) C= 2,f= 1(B) C= 2,f= 2(C) C= 1,f= 0(D) C= 3,f= 26. 2 分(0422)0422已知:Zn(s)+(1/2)O2−−→ZnO Δc H m=351.5 kJ·mol-1Hg(l)+(1/2)O2−−→HgO Δc H m= 90.8 kJ·mol-1因此Zn+HgO−−→ZnO+Hg 的Δr H m是:( )(A) 442.2 kJ·mol-1(B) 260.7 kJ·mol-1(C) -62.3 kJ·mol-1(D) -442.2 kJ·mol-17. 2 分(2329)2329相律在下列体系中何者不适用?( )(A)NaCl水溶液(B)NaCl饱和水溶液(C)NaCl过饱和水溶液(D)NaCl水溶液与纯水达渗透平衡8. 2 分(0111)0111一可逆热机与另一不可逆热机在其他条件都相同时,燃烧等量的燃料,则可逆热机牵引的列车行走的距离: ( )(A) 较长(B) 较短(C) 一样(D) 不一定9. 2 分(0008)0008(1) 体系的同一状态能否具有不同的体积?(2) 体系的不同状态能否具有相同的体积?(3) 体系的状态改变了,是否其所有的状态函数都要发生变化?(4) 体系的某一状态函数改变了,是否其状态必定发生变化?*. 2 分(0157)0157下述哪一种说法错误? ( )(A) 焓是定义的一种具有能量量纲的热力学量(B) 只有在某些特定条件下,焓变ΔH才与体系吸热相等(C) 焓是状态函数(D) 焓是体系能与环境能进行热交换的能量二、填空题( 共5题10分)11. 2 分(2438)2438含有KNO3和NaCl的水溶液与纯水达渗透平衡时,其组分数为 ,相数为 ,自由度数为。

,考试作弊将带来严重后果!华南理工大学期末考试《物理化学》试卷B1. 考前请将密封线内各项信息填写清楚;所有答案请直接答在试卷上(或答题纸上);.考试形式:闭卷;1.6分,共16分)1)今有AX、BX和CY三种离子化合物,离子半径分别为:r X =0.181nm,rY=0.130nm,rA=0.095nm,rB=0.169nm,rC=0.034nm。
这三种化合物的阳离子配位数大小顺序排列是():(A)BX>AX>CY (B)AX>CY>BX(C)BX>CY>AX (D)CY>BX>AX2)下列硅酸盐矿物。
属于链状结构的是():(A)镁橄榄石Mg2[SiO4] (B)顽火辉石Mg2[Si2O6](C)绿柱石Be3Al2[Si6O18] (D)叶腊石Al2[Si4O10](OH)23)斜长石是由钠长石和钙长石所形成的完全互溶固溶体。
欲测定斜长石的性):(A)单一物质(B)混合物质(C)钠长石和钙长石两者的加和性(D)钠长石或钙长石单一物质4)在Al2O3中掺加0.5%(mol)的NiO和0.02%(mol)的Cr2O3所制备的金黄色人经分析认为是形成了置换型固溶体,此人造黄玉的化学式可写成():(A)Al1.996Ni0.005Cr0.0002O2.9975(B)Al1.996Ni0.005Cr0.0002O3(C)Al1.9948Ni0.005Cr0.0002O3(D)Al1.9948Ni0.005Cr0.0002O2.99755)尖晶石(MgAl2O4)型晶体中,O2-作面心立方最紧密堆积,Mg2+填入():(A)四面体空隙的半数(B)四面体空隙的八分之一(C)八面体空隙的半数(D)八面体空隙的八分之一(6)若有一个变价金属氧化物MO,在还原气氛下形成阴离子缺位型非计量化合物,金属原子数和氧原子数之比为:M:O=1.1:1,则其化学式为():(A)M1.1O (B)MO0.89(C)MO0.91(D)MO1.1(7)能单独形成玻璃的氧化物,其单键强度为():(A)小于250KJ/mol (B)250~335KJ/mol(C)大于335KJ/mol (D)大于350KJ/mol(8)对于一般的玻璃网络中间体,其阳离子电负性值范围为():(A)大于2.1 (B)1.8~2.1(C)1.5~1.8 (D)0.7~1.7(9)在氧离子立方密堆中,若一半八面体空隙均填充一种阳离子,则该阳离子的价态为():(A)+1价(B)+2价(C)+3价(D)+4价(10)某晶面与各轴的截距分别是2a、3b和6c,则其晶面指数为():(A)(236)(B)(123)(C)(632)(D)(321)二、回答下列问题(共24分)1、电冰箱能致冷。

物理化学b期末考试试题及答案一、选择题(每题3分,共30分)1. 下列物质中,哪一种是电解质?A. 蔗糖B. 氯化钠C. 酒精D. 植物油答案:B2. 根据热力学第一定律,下列说法正确的是?A. 系统吸收热量,内能一定增加B. 系统对外做功,内能一定增加C. 系统吸收热量且对外做功,内能可能不变D. 系统对外做功且放出热量,内能一定减少答案:C3. 反应速率常数k与温度的关系遵循下列哪个定律?A. 牛顿定律B. 阿伏伽德罗定律C. 盖斯定律D. 阿伦尼乌斯定律答案:D4. 在理想气体状态方程中,下列哪一个变量是温度的函数?A. PB. VC. nD. R答案:B5. 根据热力学第二定律,下列说法正确的是?A. 热量可以自发地从低温物体传向高温物体B. 热量不能自发地从低温物体传向高温物体C. 所有自发过程都是不可逆的D. 熵总是减少的答案:B6. 根据吉布斯自由能变化,下列说法正确的是?A. ΔG < 0时,反应自发进行B. ΔG > 0时,反应自发进行C. ΔG = 0时,反应处于平衡状态D. 以上说法都不正确答案:A7. 根据化学平衡常数的定义,下列说法正确的是?A. 化学平衡常数只与温度有关B. 化学平衡常数与反应物和生成物的浓度有关C. 化学平衡常数与反应物和生成物的摩尔数有关D. 化学平衡常数与反应物和生成物的摩尔数和温度有关答案:A8. 根据电离平衡理论,下列说法正确的是?A. 弱电解质的电离是完全的B. 弱电解质的电离是可逆的C. 强电解质的电离是完全的D. 强电解质的电离是不可逆的答案:B9. 根据布朗运动,下列说法正确的是?A. 布朗运动是分子运动的直接体现B. 布朗运动是分子运动的间接体现C. 布朗运动是宏观物体的运动D. 布朗运动是微观粒子的运动答案:B10. 根据表面张力的定义,下列说法正确的是?A. 表面张力是液体表面层分子间相互吸引的力B. 表面张力是液体内部分子间相互吸引的力C. 表面张力是液体表面层分子间相互排斥的力D. 表面张力是液体内部分子间相互排斥的力答案:A二、填空题(每题4分,共20分)1. 理想气体状态方程为 _______。

,考试作弊将带来严重后果!华南理工大学期末考试《信号与系统》试卷B1. 考前请将密封线内填写清楚;所有答案请直接答在试卷上(或答题纸上); .考试形式:闭 卷;2分/题,共20分)1) 信号x(n), n=0,1,2,3,…是能量有限的意思是a) x(n)有限;b) |x(n)|有界;c)()2n x n ∞=<∞∑; d)()01Nn x n N=<∞∑。
c2) 一个实信号x(t)的偶部是a) x(t)+x(-t); b) 0.5(x(t)+x(-t)); c) |x(t)|-|x(-t)|; d) x(t)-x(-t)。
b 3) LTI 连续时间系统输入为(),0ate u t a ->,冲击响应为h(t)=u(t), 则输出为a)()11at e a --; b) ()()11at e t a δ--; c) ()()11at e u t a --; d) ()()11at e t aδ---。
c 4) 设两个LTI 系统的冲击响应为h(t)和h 1(t),则这两个系统互为逆系统的条件是 a) ()()()1h t h t t δ*=; b) ()()()1h t h t u t *=; a c) ()()()1h t h t u t *=-; d) ()()10h t h t *=。
5) 一个LTI 系统稳定指的是a) 对于周期信号输入,输出也是周期信号;b)对于有界的输入信号,输出信号趋向于零;c)对于有界输入信号,输出信号为常数信号;d)对于有界输入信号,输出信号也有界 d6) 离散信号的频谱一定是a) 有界的;b) 连续时间的;c) 非负的;d) 连续时间且周期的。
d 7) 对于系统()()()dy t y t x t dtτ+=,其阶跃响应为 a) ()/1t e u t τ-⎡⎤-⎣⎦; b) ()/1t e t τδ-⎡⎤-⎣⎦; c) ()/1t e u t τ-⎡⎤+⎣⎦; d) ()/1t e t τδ-⎡⎤+⎣⎦. a8) 离散时间LTI 因果系统的系统函数的ROC 一定是a) 在一个圆的外部且包括无穷远点; b)一个圆环区域;c) 一个包含原点的圆盘;d) 一个去掉原点的圆盘。

12020-2021《物理化学》期末课程考试试卷B3适用专业: 试卷所需时间:120分钟 闭卷 试卷总分 :100分 考试说明:自带计算器 一、选择题(共16小题,每题2.5分,共40分)1、物质量为n 的理想气体,该气体的哪一组强度物理量确定后其他状态函数方有定值的是: A 、 P ,TB 、VC 、T ,VD 、 P2、工作于100 o C 和25 o C 的两个大热源之间的可逆机,其效率是: A 、20% B 、30%C 、50%D 、75%3、理想气体反抗一定的压力,经过绝热可逆膨胀其:A 、△H =0B 、△U >0C 、△U <0D 、△U =04、下列哪一组全为状态函数: A 、T 、S 、H 、A B 、A 、G 、T 、VC 、S 、Q P 、H 、GD 、W 、G 、A 、T5、摩尔范氏气体方程(P +a/V 2m )(V m –b )=RT 的(d S /d V )T 应等于: A 、–R /(V m –b) B 、R /V m C 、a/V 2m D 、R /(V m –b)6、1000K时对于反应2SO 3(g)=SO 2(g)+O 2(g),其KP为0.29,KC为: A 、0.595 B 、0.000354 C 、0.294 D 、0.5397、无限稀释的水溶液中,下列离子电导最大的是: A 、Ac - B 、Br - C 、OH - D 、PO 43-8、某一级反应无论其开始浓度如何,完成65%的时间都相等,则该反应的反应级数为:A 、一级B 、二级C 、三级D 、零级9、在隔离体系内:A 、热力学能守恒,焓守恒B 、热力学能不一定守恒,焓守恒C 、热力学能守恒,焓不一定守恒D 、热力学能,焓均不一定守恒 10、二组分理想液态混合物的蒸气总压:A 、与溶液的组成无关B 、介于两纯组分的蒸气压之间C 、大于任一组分的蒸气压D 、小于任一组分的蒸气压 11、从同一始态出发,理想气体经可逆与不可逆两种绝热过程: A 、可以到达同一终态 B 、不可能到达同一终态 C 、可以到达同一终态,但给环境留下不同影响12、对于恒沸混合物,下列说法中错误的是:A 、不具有确定组成B 、平衡时气相组成和液相组成相同C 、其沸点随外压的变化而变化D 、与化合物一样具有确定组成 13、定温定压下,A 与B 组成的均相体系,若A 的偏摩尔热力学能随系统组成的改变而增加时,则B 的偏摩尔热力学能的变化将:A 、增加B 、减小C 、不变D 、无法确定 14、已知A ,B 两液体可组成无最高或最低恒沸点的液态完全互溶的体系,则将某一组成的溶液蒸馏可以获得:A 、一个纯组分和一个恒沸混合物B 、两个恒沸混合物C 、两个纯组分D 、无法确定15、理想气体与温度为T 的大热源接触作等温膨胀吸热为Q 所作功是变到相同终态的最大功的25%,则体系的熵变为 ( )A 、Q /TB 、4Q /(3T )C 、4Q /TD 、3Q /(4T )院系: 专业班级: 姓名: 学号: 装 订 线216、对封闭的单组分均相体系,且W ’=0时,TP G ⎪⎭⎫⎝⎛∂∂的值应是: A 、<0 B 、>0 C 、=0 D 、无法判断 二、填空题(每空2分,共20分)1、理想气体的两个特征是 、 。
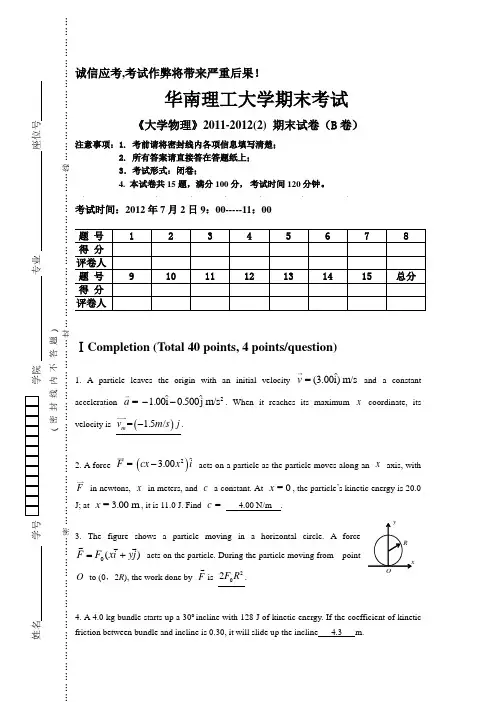
maximum x coordinate,)/s j.( =F cxin meters, and c a constant. At= 3.00 m, it is 11.0 J. Find3. The figure5. The angular acceleration of a wheel is 42 =6.0 4.0t t α-, with α in radians per second-squared and t in seconds. At time = 0t , the wheel has an angular velocity of +2.0 rad/s and an angular position of +1.0 rad . Write expressions for(a) the angular velocity 531.2 1.33 2.0t t ω=-+(rad/s) ;(b) the angular position 640.200.33 2.0 1.0t t t θ=-++(rad).6. An iron anchor of density 7870 kg/m 3 appears 200 N lighter in water than in air. The volume of the anchor is 232.0410 m -⨯. Its weight in the air is 31.5710 N ⨯.7. In the figure, two diverse springs of spring constant respectively 1k and 2k are inseries attached to a block of mass m , the frequency of oscillation is8. A stationary motion detector sends sound waves of frequency 0.150 MHz toward a truck approaching at a speed of 45.0 m/s. The frequency of the waves reflected back to the detector is 0.195 MHz .9. The figure represents a closed cycle for a gas (the figure is notdrawn to scale). The change in the internal energy of the gas as itmoves from a to c along the path abc is -200 J. As it moves from c tod , 180 J must be transferred to it as heat. An additional transfer of 80J to it as heat is needed as it moves from d to a . As it moves from c tod , the work done on the gas is 60 J .10. The figure shows the Maxwell-Boltzmann velocity distribution functions of a gas for two different temperatures 1T and 2T , then 1T < 2T (<, >, or = ).p V《大学物理》2011-2012(2) 期末试卷(B卷)第 3 页共 9 页12. (Total 12 points, 4 points/question)(1) What is the rotational inertia CM I of a propeller with three blades (treated as rods) of mass m , length L at 120o relative to each other?(2) If a torque τ acts on this propeller, how long will it take to reach an angular velocityω? (3) How many revolutions will it have made before reaching thisω?Solution (1) We know that the rotational inertia of a single rod rotating around its end is 213mL . It ’s not hard to convince oneself that if there are three of them rotating around the same axis and in thesame plane, the rotational inertia is just three times this, 2CM I mL =.(2) Since t ωα= and CM I τα=,2CM I mL t ωωττ==. (3) From our knowledge of constant acceleration problems,222222 222CM I mL ωωωωαθθαττ=⇒=== The number of revolution it made is2224mL N θωππτ==13.(Total 12 points) A hollow spherical iron shell floats almost completely submerged in water. The outer diameter is 60.0 cm, and the density of iron is 7.87 g/cm 3. Find the inner diameter.SolutionFor our estimate of submerged V we interpret “almost completely submerged ” to mean3submerged 4 where 30 cm 3o o V r r π≈= Thus, equilibrium of forces (on the iron sphere) leads tog r g V g r r g m F o water submerged water i o iron iron b ⋅⋅=⋅⋅=⋅⎪⎭⎫ ⎝⎛-⋅=⋅=333343434πρρππρ Where i r is the inner radius (half the inner diameter). Substitute into our estimate for submerged V as well as the densities of water (1.0 g/cm 3) and iron (7.87 g/cm 3), we obtain the inner diameter:31122⎪⎪⎭⎫ ⎝⎛-=iron water o i r r ρρ=57.3cm《大学物理》2011-2012(2) 期末试卷(B 卷) 第 7 页 共 9 页14.(Total 12 points, 4 points/question) A progressive wave travelling along a string has maximum amplitude A 0.0821 m =, angular frequency = 100 rad/s ωand wave number = 22.0 rad/m k . If the wave has zero amplitude at = 0t and = 0x for its starting conditions(1) State the wave function that represents the progressive wave motion for this wavetravelling in the negative x -direction.(2) Find the wavelength ()λ, period ()T and the traveling speed ()v of this wave.(3) Find its amplitude at a time = 2.5 s t at a distance = 3.2 m x from its origin, for thiswave travelling in the negative x -direction.Solution(1) ()m 1000.22sin 102.82t x y -⨯=- (2) 22221000.2856 m; 0.0628 s; 4.545 m/s 2210022T v k k ππππωλω========= (3) ()[]m 10-9.85.21002.30.22sin 102.8-32⨯=⨯--⨯⨯=-y .15. (Total 12 points, 4 points/question) One mole of an ideal diatomic gas goes from a to c along the diagonal path in Figure. The scale of the vertical axis is set by = 5.0 kPa ab p and = 2.0 kPa c p , and the scale of the horizontal axis is set by 3 = 4.0 m bc V and 3 = 2.0 m a V . During the transition,(1) What is the change in internal energy of the gas?(2) How much energy is added to the gas as heat?(3) How much heat is required if the gas goes from a to c along the indirect path abc ?V a V bcVolume (m 3)SolutionTwo formulas (other than the first law of thermodynamics) will be used. It is straightforward to show, for any process that is depicted as a straight line on the pV diagram, the work isstraight 2i f p p W V +⎛⎫=∆ ⎪⎝⎭Which includes, as special cases, W p V =∆ for constant-pressure process and 0W = for constant-volume processes. Furtherint 22f f E n RT pV ⎛⎫⎛⎫== ⎪ ⎪⎝⎭⎝⎭Where we have used the ideal gas law in the last step. We emphasize that, in order to obtain work and energy in joules, pressure should be in pascals (N/m 2) and volume should be in cubic meters. The degrees of freedom for a diatomic gas is 5f =.(1) The internal energy change isp abP c Pressure (kPa)《大学物理》2011-2012(2) 期末试卷(B 卷) 第 9 页 共 9 页 3333int int 355()(2.010 Pa)(4.0 m )(5.010 Pa)(2.0 m )225.010 Jc a c c a a E E p V p V -=-=⨯-⨯=-⨯(2) The work done during the process represented by the diagonal path is()333diag (3.510 Pa)(2.0 m )7.010 J 2a c c a p p W V V +⎛⎫=-=⨯=⨯ ⎪⎝⎭Consequently, the first law of thermodynamics gives()333diag int diag 5.0107.010 J 2.010 J Q E W =∆+=-⨯+⨯=⨯.(3) The fact that int E ∆ only depends on the initial and final states, and not on the details ofthe “path ” between them, means we can write 3int int int 5.010 J c a E E E ∆=-=-⨯ forthe indirect path, too. In this case, the work done consists of that done during the constant pressure part (the horizontal line in the graph) plus that done during the constant volume part (the vertical line):334indirect (5.010 Pa)(2.0 m )+0 1.010 J W =⨯=⨯Now, the first law of thermodynamics leads to343indirect int indirect ( 5.010 1.010) J 5.010 J Q E W =∆+=-⨯+⨯=⨯。

诚信应考,考试作弊将带来严重后果!华南理工大学期末考试《 物理化学 》(64学时)试卷(B)注意事项:1. 考前请将密封线内容(特别是姓名和班内编号)填写清楚; 2. 所有答案请直接答在试卷上; 3.考试形式:闭卷;4. 本试卷共 三 大题,满分100分, 考试时间120分钟。
题 号 一二 三总分1 2345612得 分 评卷人一、选择题(10题,每题2分,共20分)1. 一定量的理想气体从同一初态分别经历等温可逆膨胀、绝热可逆膨胀到具有相同压力的终态,终态体积分别为V 1,V 2,则: ( )(A) V 1> V 2 (B) V 1< V 2 (C) V 1= V 2 (D) 无法确定2. 理想气体在等温条件下反抗恒定外压膨胀,该变化过程中体系的熵变∆S 系及环境的熵变∆S 环应为: ( )(A) ∆S 系>0,∆S 环=0 (B) ∆S 系<0,∆S 环=0 (C) ∆S 系>0,∆S 环<0 (D) ∆S 系<0,∆S 环>03. 冬季建筑施工中,为了保证施工质量,通常在浇注混凝土时加入少量盐类,其主要作用是( )(A) 吸收混凝土中的水分 (B) 防止建筑物被腐蚀 (C) 增加混凝土的强度 (D) 降低混凝土的固化温度4. 某温度时,反应2NO 2(g) = N 2O 4(g) 的K ∃=8,则当p (NO 2)=100 kPa, p (N 2O 4)=200 kPa 时,反应将( )(A) 向生成N 2O 4方向进行 (B) 向生成NO 2方向进行 (C) 反应恰好达到平衡 (D) 不能判断其进行的方向5. 硫酸与水可形成H 2SO 4·H 2O(s)、H 2SO 4·2H 2O(s)、H 2SO 4·4H 2O(s)三种水合物,问在_____________ ________名 学号学院 专业 班上编号( 密 封 线 内 不 答 题 ) …………………………密………………………………………………封………………………………………线……………………………………101325 Pa 的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种? ( )(A) 3种 (B) 2种 (C) 1 种 (D) 不可能有硫酸水合物与之平衡共存6. 电池反应达平衡时,电池的电动势E 有( )(A) E >0 (B) E <0 (C) E = E ∃ (D) E =07. 在一个绝热的刚壁容器中,发生一个化学反应,使系统的温度从T 1升高到T 2,压力从p 1升高到p 2,则( )(A) Q >O ,W <0,△U <O (B) Q =0,W =0,△U =0 (C) Q =0,W <0,△U <0 (D) Q >0,W =0,△U >08. 一定体积的水,当聚成一个大水球或分散成许多水滴时,在同温度下,两种状态相比,以下性质保持不变的有( )(A) 表面能 (B) 表面张力 (C) 比表面 (D) 液面下的附加压力9.对某基元反应 A+2B →3D ,用A 、B 、D 的浓度变化表示的反应速率常数分别为 k A 、k B 、k D ,它们之间的关系为( )(A) k A =k B =k D (B) k A =2k B =3k D (C) k A =(1/2)k B =(1/3)k D (D) (1/2)k A =k B =(2/3)k D 10.某反应速率系数与各基元反应速率系数的关系为2/1412)2/(k k k k =,则该反应的表观活化能E a 与各基元反应活化能的关系是: ( )(A) E a =E 2+(1/2)E 1-E 4 (B) E a =E 2+(1/2)(E 1-E 4) (C) E a =E 2+ (E 1-E 4)1/2(D) E a =E 2+E 1-E 4二、计算题(6题,共65分)1. 甲醇在101.325kPa 下的沸点为64.65℃,在此条件下的摩尔蒸发焓△vap H m = 35.32 kJ mol -1。

,考试作弊将带来严重后果!华南理工大学期末考试《物理化学》(48、56、64学时)试卷(B)1. 考前请将密封线内填写清楚;2. 所有答案请直接答在试卷上;3.考试形式:闭卷;选择题.(每题2分,10题共20分)1. 已知反应CO(g)+1/2O2(g) →CO2(g) 的焓变为△H,下列说法中何者是不正确?A. △H是CO2(g) 的生成焓B. △H是CO(g)的燃烧焓C. △H是负值D. △H与反应△U的数值不等2. 室温下,10 p O-的理想气体绝热节流膨胀至5p O-的过程有:(1) W < 0 ;(2) T1> T2;(3) Q = 0 ;(4) △S > 0A. (3)、(4)B. (2)、(3)C. (1)、(3)D. (1)、(2)3. 反应N2(g) + 3H2(g) = 2NH3(g) 可视为理想气体间反应,在反应达平衡后,若维持系A. K pθ不变,平衡时N2和H2的量将增加,而NH3的量减少B. K pθ不变,且N2,H2,NH3的量均不变C. K pθ不变,平衡时N2和H2的量将减少,而NH3的量增加D. K pθ 增加,平衡时N2和H2的量将减少,NH3的量增加4. 298K时A和B两种气体在某一溶剂中溶解的享利系数分别为k A和k B,且知k A>k B,A和B压力相同时,在该溶剂中所溶解的量是( )A. A的量大于B的量B. A的量小于B的量C. A的量等于B的量 C. A的量与B的量无法比较5. NH4HS(s) 和任意量的NH3(g) 及H2S(g) 达平衡时有( )A. C = 2,P = 2,F = 2;B. C = 1,P = 2,F = 1;C. C = 2,P = 3,F = 2;D. C = 3,P = 2,F = 3;6. 下列纯物质两相平衡有关的描述,不正确的是( )A.沸点将随压力增加而升高B. 熔点将随压力增加而升高C.蒸气压将随温度升高而加大D. 升华温度将随压力增大而升高7. 同一温度、压力下,一定量某纯物质的熵值______________ 。

华南理工大学《物理化学》64-3试卷 (参考答案其它试题)专业________ 班级编号______ 姓名分数一、选择体(每题2分,共20分)1. 在恒T、pθ下,C(石墨) + O2 (g)─→CO2(g) 的反应焓为△r H mθ,下列哪种说法是错误的( )A. △r H mθ是CO2(g)的标准生成焓B. △r U mθ< △r H mθC. △r H mθ是石墨的燃烧焓D. △r H mθ=△r U mθ2. 1mol的纯液体在其正常沸点时汽化为蒸气,该过程中增大的量是( )A. 蒸气压B. 汽化焓C. 系统熵D. 吉氏函数3. 根据依数性以渗透压法来测定化合物的摩尔质量时,最广泛被用来测定的化合物是( )A. 无机非电解质B.低分子的有机物C.无机的电解质D.大分子化合物4. 反应 CO(g) + H2O(g) = CO2(g) + H2(g) 在 600℃、100kPa下达到化学平衡,当压力增大到 5000kPa 时,各气体的逸度系数为:ϕ(CO2) = 1.90 ϕ(H2) = 1.10 ϕ(CO) = 1.23 ϕ(H2O) = 0.77 则平衡点( )A. 向右移动B. 不移动C. 向左移动D. 无法确定5. 将NH4Cl(s)置于抽空容器中,加热到597K,使NH4Cl(s)分解, NH4Cl(s)=NH3(g)+HCl(g)达平衡时系统总压力为100kPa,则热力学标准平衡常数K pθ为( )A. 0.5B. 0.025C. 0.05D. 0.256. 下列各电池中,其电池电动势与氯离子的活度a(Cl-)无关的是( )A. Zn |ZnCl2(aq) | Cl2(p),PtB. Zn | ZnCl2(aq) KCl(aq) | AgCl(s) | AgC.Pt,H2(p1) | HCl(aq)| Cl2 (p2),PtD. Ag | AgCl(s) | KCl(aq) | Cl2(p),Pt7. 当表面活性物质加入溶剂后,所产生的结果是( )A. dγ/d c < 0,正吸附B. dγ/d c <0,负吸附C. dγ/d c > 0,正吸附D. dγ/d c >0,负吸附8. 微小晶体与普通晶体相比较,那一种性质不确?( )A. 微小晶体的饱和蒸气压大B. 微小晶体的溶解度大C. 微小晶体的熔点较低D. 微小晶体的溶解度较小9. 反应速率常数随温度变化的阿累尼乌斯(Arrhenius)经验公式适用于( )A. 基元反应B. 基元反应和大部分非基元反应C. 对行反应D. 所有化学反应10. 憎液溶胶是热力学上的( )A. 不稳定、可逆的系统B. 不稳定、不可逆系统C. 稳定、可逆的系统D. 稳定、不可逆系统二、填空题(共12分)1. 一个过程系统的熵变为△S,而另一个过程的始终态与前过程相同,但路径不同,则此过程系统的熵变应为___________。
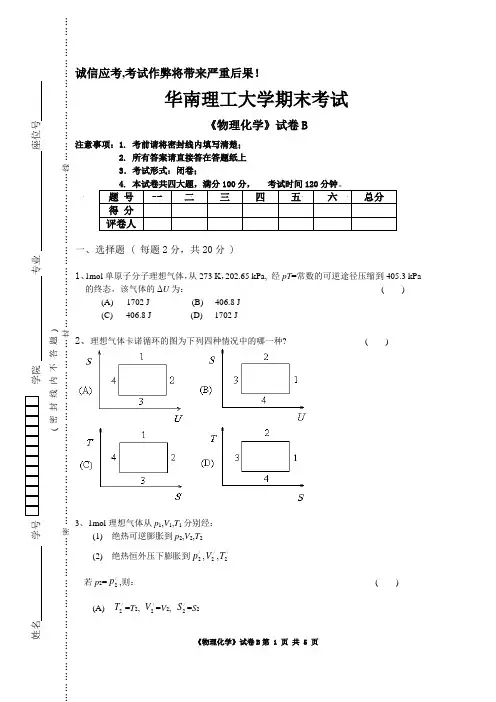
,考试作弊将带来严重后果!华南理工大学期末考试《物理化学》试卷B1. 考前请将密封线内填写清楚; 所有答案请直接答在答题纸上 .考试形式:闭卷;( 每题2分,共20分 ) 、1mol 单原子分子理想气体,从273 K ,202.65 kPa, 经pT =常数的可逆途径压缩到405.3 kPa的终态,该气体的ΔU 为: ( ) (A) 1702 J (B) -406.8 J (C) 406.8 J (D) -1702 J、理想气体卡诺循环的图为下列四种情况中的哪一种? ( )、1mol 理想气体从p 1,V 1,T 1分别经: (1) 绝热可逆膨胀到p 2,V 2,T 2 (2) 绝热恒外压下膨胀到/2p ,/2V ,/2T若p 2=/2p ,则: ( ) (A) /2T =T 2, /2V =V 2, /2S =S 2(B) /2T >T 2, /2V <V 2, /2S <S 2(C) /2T >T 2, /2V >V 2, /2S >S 2(D) /2T <T 2, /2V <V 2, /2S <S 24、在未达平衡的多相体系中,组成B 若在各相中的物质的量分数都相等,则 ( )(A )B 组分在各相中的化学势相等 (B )B 组分在各相中的活度相等 (C )B 组分在气相中的分压相等 (D )上述三种情况均不可确定。
5、理想气体反应 CO(g) + 2H 2(g) = CH 3OH(g), 若起始原料CO 与H 2的分子比为1:2, 平衡时CO 的转化率为α,平衡常数为K p ,则 ( ) (A) α与p 有关 (B) H 2的转化率是2α(C) K p =[ α(3-2α)2] / [ 4(1-α)2p 2] (D) K p 与p 2成反比6、FeCl 3和 H 2O 能形成 FeCl 3·6H 2O ,2FeCl 3·7H 2O ,2FeCl 3·5H 2O , FeCl 3·2H 2O 四种水合物,则该体系的独立组分数C 和在恒压下最多可能的平衡共存的相数 Φ分别为: ( ) (A) C = 3,Φ = 4 (B) C = 2,Φ = 4 (C) C = 2,Φ = 3 (D) C = 3,Φ = 57、在CuSO 4溶液中用铂电极以0.1 A 的电流通电10 min ,在阴极上沉积的铜的质量是: ( )(A) 19.9 mg (B) 29.0 mg (C) 39.8 mg (D) 60.0 mg8、25℃时,水的表面张力为0.071 97 N ·m -1,水的饱和蒸气压为3168 Pa ,若此水中有一个半径为2×10-6 m 的空气泡,则气泡中水蒸气的含量为: ( ) (A) x 水=0.0440 (B) x 水=0.0313 (C) x 水=0.0215 (D) x 水=0.01839、在光的作用下,O 2可转变为O 3,当1 mol O 3生成时,吸收了3.01×1023个光子,则该反应之总量子效率Φ为: (L=6.022×1023mol -1) ( ) (A) Φ=1 (B) Φ=1.5 (C) Φ=2 (D) Φ=310、某一反应在一定条件下最大转化率为30%,在同样条件下,当加入催化剂后,其转化率将: ( ) (A) 大于 30% (B) 小于 30% (C) 等于 30% (D) 不确定二、填空题(每题2分,共10分)1、25 °C 下,1g蔗糖溶液溶于1 kg水中。
大学化学专业《大学物理(二)》期末考试试题B卷附解析姓名:______ 班级:______ 学号:______考试须知:1、考试时间:120分钟,本卷满分为100分。
2、请首先按要求在试卷的指定位置填写您的姓名、班级、学号。
一、填空题(共10小题,每题2分,共20分)1、将热量Q传给一定量的理想气体:(1)若气体的体积不变,则热量转化为_____________________________。
(2)若气体的温度不变,则热量转化为_____________________________。
(3)若气体的压强不变,则热量转化为_____________________________。
2、长为的匀质细杆,可绕过其端点的水平轴在竖直平面内自由转动。
如果将细杆置与水平位置,然后让其由静止开始自由下摆,则开始转动的瞬间,细杆的角加速度为_____,细杆转动到竖直位置时角加速度为_____。
3、从统计的意义来解释, 不可逆过程实质上是一个________________的转变过程, 一切实际过程都向着________________ 的方向进行。
4、一质点作半径为0.1m的圆周运动,其运动方程为:(SI),则其切向加速度为=_____________。
5、一弹簧振子系统具有1.OJ的振动能量,0.10m的振幅和1.0m/s的最大速率,则弹簧的倔强系数为_______,振子的振动频率为_______。
6、均匀细棒质量为,长度为,则对于通过棒的一端与棒垂直的轴的转动惯量为_____,对于通过棒的中点与棒垂直的轴的转动惯量_____。
7、一束平行单色光垂直入射在一光栅上,若光栅的透明缝宽度与不透明部分宽度相等,则可能看到的衍射光谱的级次为____________。
8、长为、质量为的均质杆可绕通过杆一端的水平光滑固定轴转动,转动惯量为,开始时杆竖直下垂,如图所示。
现有一质量为的子弹以水平速度射入杆上点,并嵌在杆中. ,则子弹射入后瞬间杆的角速度___________。
大学化学专业《大学物理(上册)》期末考试试卷B卷附答案姓名:______ 班级:______ 学号:______考试须知:1、考试时间:120分钟,本卷满分为100分。
2、请首先按要求在试卷的指定位置填写您的姓名、班级、学号。
一、填空题(共10小题,每题2分,共20分)1、如图所示,一静止的均匀细棒,长为、质量为,可绕通过棒的端点且垂直于棒长的光滑固定轴在水平面内转动,转动惯量为。
一质量为、速率为的子弹在水平面内沿与棒垂直的方向射出并穿出棒的自由端,设穿过棒后子弹的速率为,则此时棒的角速度应为______。
2、若静电场的某个区域电势等于恒量,则该区域的电场强度为_______________,若电势随空间坐标作线性变化,则该区域的电场强度分布为 _______________。
3、一质点作半径为R的匀速圆周运动,在此过程中质点的切向加速度的方向______,法向加速度的大小______。
(填“改变”或“不变”)4、质量为的物体,初速极小,在外力作用下从原点起沿轴正向运动,所受外力方向沿轴正向,大小为。
物体从原点运动到坐标为点的过程中所受外力冲量的大小为_________。
5、二质点的质量分别为、. 当它们之间的距离由a缩短到b时,万有引力所做的功为____________。
6、某人站在匀速旋转的圆台中央,两手各握一个哑铃,双臂向两侧平伸与平台一起旋转。
当他把哑铃收到胸前时,人、哑铃和平台组成的系统转动角速度应变_____;转动惯量变_____。
7、如图所示,轴沿水平方向,轴竖直向下,在时刻将质量为的质点由a处静止释放,让它自由下落,则在任意时刻,质点所受的对点的力矩=________ ;在任意时刻,质点对原点的角动量=_____________。
8、刚体绕定轴转动时,刚体的角加速度与它所受的合外力矩成______,与刚体本身的转动惯量成反比。
(填“正比”或“反比”)。
9、静电场中有一质子(带电荷) 沿图示路径从a点经c点移动到b点时,电场力作功J.则当质子从b点沿另一路径回到a点过程中,电场力作功A=___________;若设a点电势为零,则b点电势=_________。
大学化学专业《大学物理(上册)》期末考试试卷B卷附解析姓名:______ 班级:______ 学号:______考试须知:1、考试时间:120分钟,本卷满分为100分。
2、请首先按要求在试卷的指定位置填写您的姓名、班级、学号。
一、填空题(共10小题,每题2分,共20分)1、反映电磁场基本性质和规律的积分形式的麦克斯韦方程组为:()。
①②③④试判断下列结论是包含于或等效于哪一个麦克斯韦方程式的.将你确定的方程式用代号填在相应结论后的空白处。
(1) 变化的磁场一定伴随有电场;__________________(2) 磁感线是无头无尾的;________________________(3) 电荷总伴随有电场.__________________________2、如图所示,一束自然光入射到折射率分别为n1和n2的两种介质的交界面上,发生反射和折射.已知反射光是完全偏振光,那么折射角r的值为_______________________。
3、一条无限长直导线载有10A的电流.在离它 0.5m远的地方它产生的磁感强度B为____________。
一条长直载流导线,在离它1cm处产生的磁感强度是T,它所载的电流为____________。
4、一电子以0.99 c的速率运动(电子静止质量为9.11×10-31kg,则电子的总能量是__________J,电子的经典力学的动能与相对论动能之比是_____________。
5、质点p在一直线上运动,其坐标x与时间t有如下关系:(A为常数) (1) 任意时刻t,质点的加速度a =_______; (2) 质点速度为零的时刻t =__________.6、质量为的物体,初速极小,在外力作用下从原点起沿轴正向运动,所受外力方向沿轴正向,大小为。
物体从原点运动到坐标为点的过程中所受外力冲量的大小为_________。
7、简谐振动的振动曲线如图所示,相应的以余弦函数表示的振动方程为__________。
12020-2021《物理化学》期末课程考试试卷B2适用专业: 试卷所需时间:120分钟 闭卷 试卷总分 :100分 考试说明:自带计算器 一、 选择题 (2.5×16=40分)1、溶剂服从拉乌尔定律,溶质服从亨利定律的二元溶液是: A 、理想稀溶液 B 、理想溶液 C 、实际溶液 D 、一切溶液2、某一个二组分溶液由2.0 mol A 和1.5 mol B 混合而成,其体积V 为425 cm 3。
已知组分B 的偏摩尔体积V B =250 cm 3mol -1,则组分 A 的偏摩尔体积 V A 为:A 、20 cm 3mol -1B 、25 cm 3mol -1C 、10 cm 3mol -1D 、15 cm 3mol -1 3、298K 时,要使下列电池成为自发电池:Na(Hg)(a 1) ∣Na +(aq) ∣Na(Hg)(a 2),则必须使两个活度的关系为:A 、a 1 < a 2B 、a 1 = a 2C 、a 1 > a 2D 、a 1 , a 2可取任意值 4、对于一个一级反应,如其半衰期t 1/2在 0.01s 以下即称为快速反应,此时它的速率常数k 值在:A 、69.32 s -1以上B 、6.932 s -1以上C 、0.06932 s -1以上D 、6.932 s -1以下 5、理想气体的自由膨胀过程为:A 、Q>0B 、ΔU<0C 、W<0D 、ΔH=0 6、在高原地带敞开体系中,水的沸点比地面: A 、高 B 、低 C 、相同 D 、不能确定7、工作于100℃ 和25℃ 的两个大热源之间的可逆机,其效率是 A 、20% B 、30% C 、50% D 、75%8、刚性密闭容器中,理想气体A(g) + B(g) = Y(g)达到平衡时,若在一定温度下加入定量的惰性气体,平衡将:A 、向右移动B 、向左移动C 、不移动D 、无法确定 9、ΔH 是指体系的什么:A 、反应热B 、吸收的热量C 、焓的增量D 、生成热 10、溶剂服从拉乌尔定律,溶质服从亨利定律的二元溶液是:A 、理想稀溶液B 、理想溶液C 、实际溶液D 、一切溶液 11. 物质量为n 的理想气体,该气体的哪一组强度物理量确定后其他状态函数方有定值的是:A 、P ,TB 、VC 、T ,VD 、P12、以一定速度发生变化的孤立体系,其总熵变: A 、不变 B 、可能增大也可能减少 C 、总是增大 D 、增大或不变13、总压为101.3kPa 的容器中装有基本混合气体实验测得其中O 2的分压为20.26kPa ,则氧所占摩尔分数为:A 、0.20B 、0.50C 、0.60D 、0.80 14、浓度为 0.1mol ·kg 的 MgCl 2水溶液,其离子强度为: A 、0.1 mol ·kg B 、0.15 mol ·kg C 、0.3 mol ·kg D 、0.2 mol ·kg 15、克劳修斯-克拉贝龙方程可用于:A 、液-气两相平衡B 、液-液两相平衡C 、固-液两相平衡D 、固-固两相平衡院系: 专业班级: 姓名: 学号: 装 订 线16、反应2NO (g) + O2(g) = 2 NO2 (g)是放热的,当反应在某温度、压力下达到平衡时,若使平衡向右移动,则应采取的措施是:A、降低温度和减小压力B、降低温度和增大压力C、升高温度和减小压力D、升高温度和增大压力二、填空题(每空2分,共10分)1、非理想气体进行绝热自由膨胀,则△U,W,△H中哪个不为0;2、热力学第三定律数学表示方法:;3、绝热箱中装有水,水中绕有电阻丝,由电池供给电流,设电池在放电时无热效应,通电后电阻丝和水的温度都上升,若以电池为体系,以水和电池为环境,则Q O(大于,等于, 小于),W0(小于,等于,小于), △U0(大于,等于,小于)三、计算题(每题10分,共50分)1、已知25℃时反应N 2O 4 ( g ) = 2 NO2 ( g ) 的K P=0.141,求25℃时①N 2O 4 ( g , P =1大气压) = 2 NO2 ( g , P =1大气压) 的△G?②1/2 N 2O 4 ( g ,P =1大气压) = NO2 ( g ,P =1大气压) 反应的K P?2、某物质按一级反应分解,已知反应完成40%需时50min,求(1)以秒(s)为单位的速率常数;(2)完成80%反应所需时间。
4.不挥发的溶质溶于溶剂中形成稀溶液之后,将会引起()。
(A)凝固点升高(B)沸点升高(C)蒸汽压升高(D)总是放出热量5.在1100℃时,发生下列反应: (1)C(s)+2S(s)=CS 2(g)K 1(2)Cu 2S(s)+H 2(g)=2Cu(s)+H 2S(g)K 2 (3)2H 2S(g)=2H 2(g)+2S(s)K 3则1100℃时反应C(s)+2Cu 2S(s)=4Cu(s)+CS 2(g)的K 为()。
(A)K =K 1(K 2)2/K 3(B)K =K 1(K 2)2K 3 (C)K =K 1(K 2)-2K 3(D)K =(K 2)2K 3/K 16.一定温度下,一定量的PCl 5(g)在某种条件下的解离度为α,改变下列条件,何者可使α增大?()(A)增加压力使体积缩小一倍(B)体积不变,通入N 2气使压力增大一倍 (C)压力不变,通入N 2气使体积增大一倍 (D)体积不变,通入Cl 2气使压力增大一倍7.101325Pa 下,NH 4HCO 3(s)在抽空的封闭系统中,NH 3(g),H 2O(g),CO 2(g)达到分解平衡,该情况下的组分数、相数、自由度分别为()。
(A)C =1,P =2,F =1(B)C =1,P =2,F =0 (C)C =1,P =1,F =1(D)C =2,P =2,F =18.科尔劳施从实验中总结出电解质溶液的摩尔电导率与其浓度成线性关系m m ΛΛ∞=-,这一规律适用于()。
(A)弱电解质(B)强电解质的稀溶液 (C)无限稀溶液(D)浓度在一定范围的溶液 9.下列有关界面张力的说法:(1)液-液界面张力的大小一般介于构成该界面的两种液体的表面张力大小之间; (2)同种物质的表面张力一般随温度的升高而增大; (3)一般而言,分子之间的作用力越大,界面张力就越大;(4)同一温度下,在水、乙醇、水银、乙醚4种物质中,水的表面张力最大。
其中不正确的是()。
华南理工大学期末考试物理化学试卷B华南理工大学期末考试物理化学试卷B物理化学上学期试卷(应用化学专业上学期用)校名:华南理工大学系名:专业:得分:班级:本班排序号:姓名:日期:年月日一、选择题 ( 共10题 20分 )1. 2 分 (2435)2435CuSO4与水可生成CuSO4 H2O,CuSO4 3H2O,CuSO4 5H2O三种水合物,则在一定温度下与水蒸气平衡的含水盐最多为: ( )(A) 3种 (B) 2种 (C) 1种 (D) 不可能有共存的含水盐2. 2 分 (1192)1192用130℃的水蒸气(蒸气压为2.7p )与1200℃的焦炭反应生成水煤气:C+H2O CO+H2,如果通入的水蒸气反应掉70%,问反应后混合气体中CO的分压为多少?设总压2.7p 不变。
( )(A) 0.72p (B) 1.11p(C) 2.31p (D) 1.72p3. 2 分 (0485)0485氧气的燃烧热应为何值? ( )(A) 大于零 (B) 小于零(C) 等于零 (D) 不确定4. 2 分 (1513)1513气体CO和N2有相近的转动惯量和相对分子摩尔质量,在相同温度和压力时,两者平动和转动熵的大小为: ( )(A) St,m(CO)=St,m(N2), Sr,m(CO)>Sr,m(N2)(B) St,m(CO)>St,m(N2), Sr,m(CO)>Sr,m(N2)(C) St,m(CO)=St,m(N2), Sr,m(CO)<Sr,m(N2)(D) St,m(CO)=St,m(N2), Sr,m(CO)=Sr,m(N2)5. 2 分 (2392)2392将固体NH4HCO3(s) 放入真空容器中,恒温到400 K,NH4HCO3 按下式分解并达到。
,考试作弊将带来严重后果!华南理工大学期末考试《物理化学》试卷1. 考前请将密封线内填写清楚;所有答案请直接答在试卷上(或答题纸上);.考试形式:闭卷;选择题(每题2分,共20分)原电池是指:()(A)将电能转换成化学能的装置(B)将化学能转换成电能的装置(C)可以对外作电功的装置(D)对外作电功同时从环境吸热的装置电解金属盐的水溶液时, 在阴极上:( )(A) 还原电势愈正的粒子愈容易析出(B) 还原电势与其超电势之代数和愈正的粒子愈容易析出(C) 还原电势愈负的粒子愈容易析出(D) 还原电势与其超电势之和愈负的粒子愈容易析出LiCl 的无限稀释摩尔电导率为115.03×10-4 S·m2·mol-1,在298 K 时,测得LiCl 稀溶液中Li+ 的迁移数为0.3364,则Cl- 离子的摩尔电导率λm(Cl-)为:()(A) 76.33×10-4 S·m2·mol-1(B) 113.03×10-4 S·m2·mol-1(C) 38.70×10-4 S·m2·mol-1(D) 76.33×102 S·m2·mol-1有一ZnCl2水溶液,m=0.002 mol·kg-1,γ±=0.83,则a±为:()(A) 1.66×10-3 (B) 2.35×10-3(C) 2.64×10-3 (D) 2.09×10-4对于反应2NO2= 2NO + O2,当选用不同的反应物和产物来表示反应速率时,其( )(A) -2d[NO2]/d t = 2d[NO]/d t = d[O2]/d t(B) - d[NO2]/2d t = d[NO]/2d t = d[O2]/d t = dξ/d t(C) - d[NO2]/d t = d[NO]/d t = d[O2]/d t(D) - d[NO2]/2d t = d[NO]/2d t = d[O2]/d t = 1/V dξ/d t6. 二级反应的速率常数的单位是:( )(A) s-1(B) dm6·mol-2·s-1(C) s-1·mol-1(D) dm3·s-1·mol-17. 气相反应A + 2B ─→2C,A 和B 的初始压力分别为p A和p B,反应开始时并无C,若p为体系的总压力,当时间为t时,A 的分压为:( )(A) p A- p B(B) p - 2p A(C) p - p B(D) 2(p - p A) - p B8. 光化学反应中的量子效率Φ一定是:( )(A) 正整数(B) <1(C) >1 (D) 可>1,也可<19. 多孔硅胶的强烈吸水性能说明硅胶吸附水后,表面自由能将:( )(A) 变高(B) 变低(C) 不变(D) 不能比较10. 下列物系中为非胶体的是:( )(A) 灭火泡沫(B) 珍珠(C) 雾(D) 空气二.填空题(每题2分,共10分)1.在10 cm3 1mol·dm-3 KOH溶液中加入10 cm3水,其电导率将_______________,摩尔电导率将_________________(填入增加、减小、不能确定)。
2.电池放电时,随电流密度增加阳极电位变________,阴极电位变________,正极变________ ,负极变_____。
3.N2和H2合成NH3, 在400℃下, 动力学实验测定结果表明没有催化剂时, 其活化能为334.9 kJ·mol-1,用Fe催化时, 活化能降至167.4 kJ·mol-1。
假定催化和非催化反应的指前因子相等, 则两种情况下,反应速率常数之比值k c a t / k0) =______________________________。
4.已知φ∃ (Fe2+/Fe)= -0.440 V, φ∃ (Cu2+/Cu) = 0.337 V,在25℃, p∃时, 以Pt 为阴极,石墨为阳极,电解含有FeCl2(0.01 mol·kg-1)和CuCl2 (0.02 mol·kg-1)的水溶液,若电解过程不断搅拌溶液,且超电势可忽略不计,则最先析出的金属是______。
5.对带正电的溶胶,NaCl 比AlCl3的聚沉能力。
对对带负电的溶胶,Na2SO4比NaCl 的聚沉能力。
三.计算题1.25℃时,TlCl在纯水中的溶解度为1.607×10-2 mol·dm-3,在0.100 mol·dm-3 NaCl 溶液中的溶解度是3.95×10-3 mol·dm-3,TlCl的活度积是2.022×10-4,试求在不含NaCl 和含有0.1000 mol·dm-3 NaCl的TlCl饱和溶液中离子平均活度系数。
(10分)。
2.电池Ag(s)|AgBr(s)|HBr(0.1 kJ·mol-1)|H2(0.01p∃),Pt,298 K时,E=0.165 V,当电子得失为1mol时,∆r H m= - 50.0 kJ·mol-1,电池反应平衡常数K∃=0.0301,E∃(Ag+|Ag)=0.800 V,设活度系数均为1。
(1) 写出电极与电池反应;(2) 计算298 K时AgBr(s)的K sp;(3) 求电池反应的可逆反应热Q R;(4) 计算电池的温度系数。
(15 分)3. 气相反应2NO2+ F2→2NO2F,当2 mol NO2和 3 mol F2在400 dm3的反应釜中混合,已知300 K 时,k = 38 dm3·mol-1·s-1,反应速率方程为:r = k[NO2][F2]。
试计算反应10 s 后,NO2 ,F2,NO2F 在反应釜中物质的量(10 分)。
4.苯乙烯工业化生产是从石油裂解得到的乙烯与苯作用生成乙苯,在由乙苯直接脱氢而制得:C6H5CH2CH3(g) C6H5CH=CH2(g)+H2(g)乙苯直接脱氢的工艺条件为:温度:600~800℃;压力:常压;原料:过热水蒸气与乙苯蒸气,物质的量比为9:1 的混合气,已知数据如下:乙苯(g) 苯乙烯(g) 水(g)$(298 K)/kJ⋅mol-129.79 146.9 -241.8Δf Hm$(298 K)/kJ⋅mol-1130.58 213.8 -228.6Δf Gm$=33.26 kJ⋅mol-1,700~1100 K 之间反应(1)已知700 K 时,上述乙苯脱氢反应的Δr Gm$=124.4 kJ⋅mol-1,计算1000 K 时乙苯的理论转化率。
热效应平均值Δr Hm(2)试对本反应为什么采取高温常压,充入惰性气体等工艺条件,做热力学的分析说明。
(3)用蒸馏法从粗品中分离苯乙烯时,采用什么措施防止或减少其聚合作用。
(4)文献报道,有人建议可用乙苯氧化脱氢的办法来制取苯乙烯C6H5CH2CH3(g)+(1/2)O2(g) = C6H5CH=CH2(g)+H2O(g)从热力学角度估算一下,在25℃、标准压力下有无实际的可能性,若可能实现,从理论上来讲比直接脱氢法具有什么优点。
(15 分)5.水在40℃下若以半径为r =1×10-3 m 的小液滴存在,试计算其饱和蒸气压增加的百分率。
已知液滴的附加压力p s =1.39×107 N ·m -2,水在40℃的摩尔体积V m =1.84×10-5 m 3·mol -1。
(10 分)四.问答题1.用 Pt 为电极,通电于稀 CuSO 4溶液, 指出阴极部、中部、阳极部中溶液的颜色在通电过程中有何变化?若都改用 Cu 作电极,三个部分溶液颜色变化又将如何? (5分)2.简述憎液溶胶的三个最基本特征。
(5分)物理化学试卷 答案一、选择题 ( 共10题 20分 )BBADDDCDBD二、填空题 ( 共 5题 10分 ) 1 [答] 减小 ;增加2 正,负,负,正. 3. k (cat)/k 0 =exp{[-E (cat)-E ]/RT }=10134 φ (Fe 2+/Fe) = φ ∃+ RT /2F × ln 0.01 = -0.4992 Vφ (Cu 2+/Cu) = φ ∃+ RT /2F × ln 0.02 = 0.2868 V最先析出的是 Cu5 大;小三、计算题 ( 共 5题 60分 ) 1[答] 1231/51/5()[(2)(2)]108m m m m m m ννν+-±+-=⋅==所以:235555243[Al (SO )]()108()m m a a a a m m γγ±±+-±±====$$2--sp 2(Tl )(Cl )(Tl )(Cl )()c c K a a c γ++±==$在不含NaCl 的TlCl 饱和溶液中:-2-3(Tl )(Cl ) 1.60710mol dm c c +-==⨯0.885γ±==在含0.1000 -3mol dm NaCl 的TlCl 饱和溶液中:3-3(Tl ) 3.9510 mol dm c +-=⨯ --3(Cl )0.1040 mol dm c =702.0=±γ2[答]⑴ (-) Ag(s)+Br –(Br a -) – e -→AgBr(s) (+) H +(+H a )+e -→12H 2(0.01p ∃)Ag(s)+HBr →AgBr(s)+12H 2(0.01p ∃)⑵ 可用设计电池求算:Ag(s)|Ag +||Br -|AgBr(s)+Ag(s)E ∃= E ∃(AgBr|Ag) –E ∃(Ag +|Ag)= - 0.71 V [由K ∃求得,E ∃=ln 0.09 V RTK zF=-=$ - E ∃(AgBr|Ag)] K sp =exp(zE F RT $) = exp(RTF)71.0(1-⨯) = 9.8×10-13⑶ Q R =T ∆r S m =∆r H m - ∆r G m = - 50.0 kJ – ( - zEF )= - 34.08 kJ ⑷ 31() 1.1910 V K R p E QT zFT--∂==-⨯⋅∂(3[答] 2NO 2(g) + F 2(g) ─→ 2NO 2F(g) t =0 a b 0 t =t a -x b -(x /2) x 可得积分速率方程12()1ln[]2()a b x kt b a b a x -=-- x = 4.9×10-3 mol ·dm -3n (NO 2F) = V ·x = 1.96 moln (NO 2) = 0.04 mol n (F 2) = 2.02 mol4[答] (1) K p $=exp(-Δr G m $/RT ) =3.3×10-3ln[K p $(1000 K)/K p $(700 K)]=(124 400/8.314)[(1000-700)/(1000×700)]求得 K p $(1000 K) =2.013 C 6H 5CH 2CH 3(g) C 6H 5CH=CH 2(g) + H 2(g) + H 2O(g) 平衡/mol 1-α α α 9∑BBn=(10+α)molK p $=K n [(p /p ∃)/∑n B ]Δν =[α2/(1-α)][1/(10+α)] =2.013 解得α=0.9584(2) Δr H m $=(146.9-29.79) kJ·mol -1=117.11 kJ·mol -1 Δr G m $=(213.8-130.58) kJ·mol -1=83.22 kJ·mol -1 由于Δr G m $<0,表明在常温标准状态下反应不能进行,只有升高温度,增大T Δr S m $值,使得Δr G m $<0时反应才可以进行。