15第10章分析化学中常用的分离和富集方法及小结分析
- 格式:ppt
- 大小:5.18 MB
- 文档页数:13

分析化学中常用的分离和富集方法1.蒸馏法:蒸馏是根据溶液中各组分的沸点差异来进行分离的方法。
通过加热混合液体使其汽化,然后再冷凝收集汽化物,从而分离不同沸点的组分。
蒸馏法适用于溶液中的挥发性组分富集和纯化。
2.萃取法:萃取是利用两种或多种不相溶液体的亲和性差异将待分析的组分从混合体系中转移到单一溶剂中的分离方法。
常见的有液液萃取和固相萃取。
萃取法适用于挥发性差异较小的物质分离。
3.结晶法:结晶是根据物质在溶液中的溶解度差异来进行分离的方法。
通过逐渐降低溶解度使其中一种或几种溶质结晶出来,从而实现分离和富集。
结晶法适用于固体组分富集和纯化。
4.洗涤法:洗涤是通过溶解或稀释洗涤剂来将带有目标分子的样品与杂质分离的方法。
洗涤法适用于固态、液态和气态混合物中分离和富集。
5.离子交换法:离子交换是通过离子交换树脂的吸附作用来分离和富集组分的方法。
树脂上的离子可与溶液中的离子发生交换,从而实现目标组分的富集。
离子交换法适用于溶液中离子的分离和富集。
6.气相色谱法:气相色谱是一种利用气相色谱柱对待分析物进行分离的方法。
根据化合物在不同固定相上的吸附特性差异进行分离和富集。
气相色谱法适用于气态和挥发性物质的分离和富集。
7.液相色谱法:液相色谱是一种利用液相色谱柱对待分析物进行分离的方法。
根据待分析物在流动相和固定相之间的分配系数差异进行分离和富集。
液相色谱法适用于液态和溶液中的分离和富集。
8.电泳法:电泳是一种利用电场对待分析物进行分离和富集的方法。
根据待分析物在电场中的迁移速度差异来分离和富集。
电泳法适用于溶液中离子和带电粒子的分离和富集。
以上是常见的分离和富集方法,每一种方法在不同场合的适应性和分离效果各有差异。
在实际应用中,需要根据具体情况选择合适的方法。
不同的分析问题可能需要结合多种方法的优势来达到理想的分析结果。

第章分析化学中常用的分离富集方法分析化学是研究物质成分和性质的科学,分析化学中常常需要进行分离和富集样品中的目标组分以便进行后续的定性与定量分析。
在分析化学中,常用的分离富集方法包括溶剂提取法、固相萃取法、离子交换法、凝胶过滤法等。
以下将对这些方法进行详细介绍。
1.溶剂提取法溶剂提取法是利用目标组分在水相和有机相之间的分配系数差异将目标组分从样品中分离出来的方法。
该方法常用于富集有机物、金属离子等。
常用的溶剂包括正己烷、乙酸乙酯、乙酸纳等。
溶剂提取法具有操作简便、富集效果好的特点,但需要注意溶剂的选择和体积比的控制。
2.固相萃取法固相萃取法是利用固态吸附剂或吸附剂包裹在固态材料上,通过吸附目标物质来实现分离和富集的方法。
该方法常用于富集挥发性有机物、农药、药物等。
常用的吸附剂有活性炭、硅胶、聚酯、聚乙烯等。
固相萃取法具有操作简便、富集效果好的特点,但需要注意吸附剂的选择和样品前处理的步骤。
3.离子交换法离子交换法是利用离子交换树脂将样品中的离子按照离子交换性质进行分离和富集的方法。
离子交换树脂是一种具有交换离子基团的吸附剂,可以选择性地吸附目标离子。
离子交换法常用于富集金属离子、阴离子、阳离子等。
常用的离子交换树脂有强阴离子交换树脂、强阳离子交换树脂、弱阴离子交换树脂等。
离子交换法具有选择性好、重现性好的特点,但需要注意树脂的选择和样品的处理方法。
4.凝胶过滤法凝胶过滤法是利用凝胶材料的孔隙大小将大分子与小分子进行分离和富集的方法。
凝胶过滤法常用于分离大分子如蛋白质、DNA等。
常用的凝胶材料有琼脂糖、聚丙烯酰胺凝胶等。
凝胶过滤法具有操作简便、选择性好的特点,但需要注意凝胶材料的选择和样品前处理的步骤。
以上是分析化学中常用的分离富集方法,不同的方法适用于不同的目标组分和样品类型。
在进行分析前,需要根据样品的特性和分析要求选择合适的分离富集方法,并进行合理的样品前处理步骤,以确保分析结果的准确性和可靠性。

分析化学中常用分离富集方法在分析化学中,常用的分离富集方法有溶剂萃取、吸附、离子交换、凝胶渗透层析、电动毛细管层析等。
这些方法根据分析样品的性质以及分离纯化的目的选择合适的方法。
下面将对这些方法进行详细介绍。
溶剂萃取是一种常用的分离富集方法,它基于溶液中不同物质的相溶性差异。
一般来说,溶液中的物质可以根据其分配系数(即溶于有机溶剂相对于水溶液中浓度比值)在两个不同的相中分散。
通过调整溶液的pH、温度或添加其他化学试剂,可以改变物质在两个相中的分配系数,从而实现分离富集功能。
溶剂萃取适用于分离大分子有机化合物、脂肪酸、金属离子等。
吸附是一种以吸附剂与待分离物质之间的吸附作用为基础的分离方法。
吸附剂可以是固体(如硅胶、活性炭、分子筛)或液体(如活性炭糊剂、萃取液)。
吸附分离原理包括亲和性吸附、离子交换吸附等。
亲和性吸附是通过亲和剂和待测物之间的特异性相互作用实现分离,如抗体-抗原、酶-底物、核酸-亲和基团的结合。
离子交换吸附是利用固定在吸附剂上的离子官能团与溶液中的离子发生相互作用实现分离,如阳离子交换剂、阴离子交换剂。
离子交换是利用带电荷的树脂与待分离物质之间的吸附-解吸作用,实现分离富集的方法。
树脂具有氧阴离子或聚合物等功能基团,它们可以与离子相互作用形成络合物,通过控制pH、离子浓度等参数的变化,实现离子交换和分离。
离子交换常用于水样中稀释度高的金属离子分离、无机阴阳离子的分离等。
凝胶渗透层析:是一种以凝胶为固定相进行分析的方法。
凝胶是由网状三维网络结构构成的,分子可以在凝胶孔隙中进行渗透和扩散。
样品进入凝胶后,分子的速率取决于其分子尺寸,较大的分子会被凝胶阻滞在孔隙中,而较小的分子则能够通过孔隙。
通过调节凝胶孔隙的大小和形状,可以实现对分子大小的选择性分离。
电动毛细管层析(CE)是近年来发展起来的一种高效分离富集方法。
它利用毛细管内的电细胞电动力学作用,使待分离物质在电场作用下,根据体积、电荷、形状等特性进行分离。

分析化学中常用的分离和富集方法分析化学作为一门研究物质组成和性质的科学,其中常用的分离和富集方法起着至关重要的作用。
分离和富集方法可以将需要分析的目标物质从复杂的混合物中分离出来,提高分析的灵敏度和准确度。
本文将介绍常用的分析化学分离和富集方法,包括溶剂萃取、固相萃取、薄层板法和气相色谱。
溶剂萃取是一种常见的分离和富集方法。
它基于物质在不同溶剂中的溶解度差异来实现分离。
常用的溶剂包括醚类、酯类和芳烃类。
溶剂萃取可以根据目标物质的亲水性或疏水性进行选择,有效地将目标物质从样品中富集。
例如,对于水样中的有机污染物分析,可以使用非极性的有机溶剂进行富集,如二氯甲烷、正己烷等。
溶剂萃取方法操作简便,成本较低,已广泛应用于环境监测和食品安全等领域。
固相萃取是一种利用固相吸附材料对目标物质进行富集的方法。
固相萃取通常以固相萃取柱或固相萃取膜的形式存在。
固相萃取材料多为具有特定化学性质的固体材料,如聚苯乙烯、聚二氟乙烯、硅胶等。
富集过程中,样品通过固相萃取材料,目标物质被吸附在固相上,其他杂质被去除,从而实现分离和富集。
固相萃取方法具有选择性好、灵敏度高的特点,广泛应用于环境、生物医药、食品和化学等行业的样品前处理中。
薄层板法是一种常用的分析化学分离技术,广泛应用于天然产物和化学成分分析中。
薄层板法利用了化学物质在不同极性固体支持物上的吸附和分配性质。
分离过程中,样品溶液在薄层板上扩展,不同成分因溶液中的分配系数不同而在薄层板上分离出来。
随后,可以通过显色剂、紫外灯或其他检测手段进行成分的定性分析或定量测定。
薄层板法操作简单、迅速,结果直观,已成为化学分析中不可或缺的手段之一。
气相色谱是一种基于物质在气相中分配系数的分离技术,被广泛应用于挥发性有机物的分析。
在气相色谱中,样品经过蒸发器的加热,被气体载气(如氮气或氦气)带入色谱柱进行分离。
色谱柱内填充有具有特定性质的固体或液体填料,目标物质通过填充物与载气发生相互作用,从而实现分离。

分析化学中的分离与富集方法
1.蒸馏法:根据不同物质的沸点差异进行分离和富集。
常用的蒸馏方
法有常压蒸馏、减压蒸馏、水蒸气蒸馏等。
2.萃取法:利用两种或多种溶剂相互不溶的特性,将目标物质从混合
物中转移到溶剂中,从而达到分离和富集的目的。
典型的例子有固-液萃
取和液-液萃取。
3.变温结晶法:根据不同物质溶解度随温度变化的规律,通过调节温
度使目标物质结晶,从而将其与其他组分分离。
4.气相色谱法:利用物质在固定相和流动相之间的分配系数差异,以
气态物质的流动为介质,将目标物质从混合物中分离并富集。
1.沉淀法:通过在混合物中加入沉淀剂,使得目标物质与沉淀剂反应
生成不溶性沉淀,从而分离富集目标物质。
这种方法常用于分离金属离子。
2.化学还原法:通过还原剂将目标物质转化为不溶性化合物,从而使
其与混合物分离。
例如,将有机污染物还原为不溶性沉淀。
3.化学萃取法:利用目标物质与萃取剂之间的化学反应进行分离。
例如,萃取剂选择性地与目标物质发生络合反应,形成可溶性络合物,从而
将其与其他组分分离。
4.吸附分离法:通过吸附剂对目标物质的选择性吸附将其从混合物中
分离。
主要有固相萃取、层析和磁性吸附等方法。
以上仅是分析化学中常用的一些分离与富集方法,实际应用中还有很
多其他方法,如超临界流体萃取、电分离、膜分离等。
在实际的分析过程
中,要根据混合物的性质和目标物质的特点选择合适的方法,并合理优化条件,以提高分离效果和分析结果的准确性。


分析化学_分析化学中常用的分离和富集方法分析化学是研究物质的组成、结构和性质的一门学科。
在分析化学中,为了检测和测定分析对象中微量或痕量的目标物质,常常需要使用分离和富集方法,以提高目标物质的检测灵敏度。
1.搅拌萃取:搅拌萃取是一种常见的分离和富集方法。
通过将样品与其中一种有机溶剂反复搅拌混合,使目标物质从水相转移到有机相中,从而实现分离和富集。
该方法适用于目标物质在水相和有机相之间有较大的分配系数差异的情况。
2.相间萃取:相间萃取是指根据目标物质在两相中的分配差异进行分离和富集的方法。
常见的相间萃取方法包括液液萃取、固相微萃取和液相萃取等。
相间萃取通常需要将样品与萃取剂反复摇匀并分离两相,以实现目标物质的富集。
3.固相萃取:固相萃取是指使用固定在固相萃取柱或固相萃取膜上的吸附剂来对目标物质进行分离和富集的方法。
固相萃取方法具有操作简单、富集效果好、适用范围广等优点,常用于分析化学中的前处理过程。
4.蒸馏:蒸馏是指通过加热使液体汽化,然后冷凝收集汽化液体的方法。
蒸馏可以实现液体的分离和富集,适用于目标物质在样品中的浓度较低且需高度富集的情况。
5.色谱分离:色谱分离是一种基于目标物质在不同相之间的分配差异进行分离的方法。
常用的色谱分离方法包括气相色谱、液相色谱、固相色谱等。
色谱分离方法具有分辨率高、重复性好、操作简便等优点,广泛应用于分析化学中。
6.气相萃取:气相萃取是指利用气相萃取装置将目标物质从固体、液体或气体中分离和富集的方法。
气相萃取主要通过溶剂的蒸发和再冷凝,将目标物质从样品中富集到溶剂中,然后通过蒸发或其他方法将溶剂去除,得到目标物质。
7.凝胶电泳:凝胶电泳是一种基于目标物质的电荷、大小或形状差异进行分离和富集的方法。
常见的凝胶电泳方法包括聚丙烯酰胺凝胶电泳、聚丙烯酰胺梯度凝胶电泳等。
凝胶电泳方法具有分辨率高、富集效果好等优点,适用于复杂样品的分析。
总之,分析化学中常用的分离和富集方法有搅拌萃取、相间萃取、固相萃取、蒸馏、色谱分离、气相萃取和凝胶电泳等。

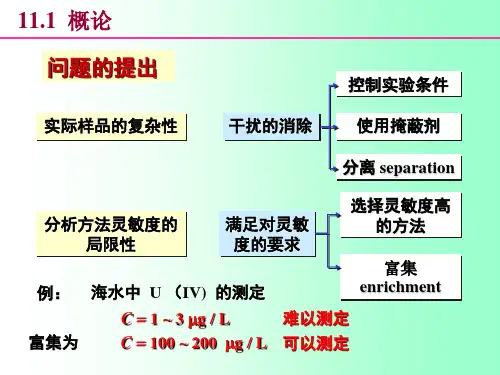
第8章 分析化学中常用的分离和富集方法8.1 概述分离和富集是定量分析化学的重要组成部分。
当分析对象中的共存物质对测定有干扰时,如果采用控制反应条件、掩蔽等方法仍不能消除其干扰时,就要将其分离,然后测定;当待测组分含量低、测定方法灵敏度不足够高时,就要先将微量待测组分富集,然后测定。
分离过程往往也是富集过程。
对分离的要求是分离必须完全,即干扰组分减少到不再干扰的程度;而被测组分在分离过程中的损失要小至可忽略不计的程度。
被测组分在分离过程中的损失,可用回收率来衡量。
1. 回收率(R ) 其定义为:%100⨯==分离前待测组分的质量分离后待测组分的质量R对质量分数为1%以上的待测组分,一般要求R >99.9%;对质量分数为0.01%~1%的待测组分,要求R >99%;质量分数小于0.01%的痕量组分要求R 为90%~95%。
例1. 含有钴与镍离子的混合溶液中,钴与镍的质量均为20.0mg ,用离子交换法分离钴镍后,溶液中余下的钴为0.20mg ,而镍为19.0mg,钴镍的回收率分别为多少?解:%0.10.2020.0 %,0.950.200.19Co Ni ====R R2. 分离因子S A/B分离因子S B/A 等于干扰组分B 的回收率与待测组分A 的回收率的比,可用来表示干扰组分B 与待测组分A 的分离程度。
%100/⨯=ABA B R R SB 的回收率越低,A 的回收率越高,分离因子越小,则A 与B 之间的分离就越完全,干扰消除越彻底。
8.2 沉淀分离法沉淀分离法是一种经典的分离方法,它是利用沉淀反应选择性地沉淀某些离子,而与可溶性的离子分离。
沉淀分离法的主要依据是溶度积原理。
沉淀分离法的主要类型如下表。
8.2.1常量组分的沉淀分离1. 氢氧化物沉淀分离大多数金属离子都能生成氢氧化物沉淀,各种氢氧化物沉淀的溶解度有很大的差别。
因此可以通过控制酸度,改变溶液中的[OH-],以达到选择沉淀分离的目的。


分析化学中常用的分离富集方法1.蒸馏法:蒸馏法是一种基于物质沸点差异的分离富集方法。
通过加热混合物,使成分具有不同沸点的组分分别转化为气态和液态,然后通过冷凝收集液态成分,从而实现分离。
蒸馏法广泛应用于分离液体的混合物,例如石油的分离和酒精的纯化。
2.萃取法:萃取法是一种基于物质在不同相中的分配系数差异的分离富集方法。
它通过萃取剂与混合物中其中一成分发生作用,将其从混合物中提取出来。
常用的萃取剂包括有机溶剂、水和金属络合剂等。
萃取法广泛应用于固体、液体或气体的分离富集,例如从矿石中提取金属离子、从天然产物中提取天然色素等。
3.结晶法:结晶法是一种基于物质在溶液中溶解度差异的分离富集方法。
通过逐渐降低溶液中的溶质浓度,使其超过饱和度,从而导致溶质结晶出来。
结晶法广泛应用于分离纯化固体物质,例如提取药物原料和脱盐。
4.吸附法:吸附法是一种基于物质在固体吸附剂表面吸附能力差异的分离富集方法。
通过将混合物与吸附剂接触,利用其表面活性或化学反应特性,将目标成分吸附在吸附剂上,然后通过洗脱、干燥等步骤分离目标成分。
常用的吸附剂包括硅胶、活性炭和分子筛等。
吸附法广泛应用于气体和溶液的分离富集,例如气体的净化和水处理。
5.色谱法:色谱法是一种基于物质在固相或液相载体上移动速度差异的分离富集方法。
它利用混合物成分在固定相和流动相之间相互作用的差异,通过在柱上或薄层上移动,分离各个组分。
常用的色谱法包括气相色谱法、液相色谱法和薄层色谱法等。
色谱法广泛应用于有机化合物和生物大分子的分离分析,例如对复杂的混合物进行定性和定量分析。
除了上述常用的分离富集方法,还有一些其他的方法如离子交换法、电泳法、过滤法等。
这些方法在不同的应用领域具有独特的优势和适用性。
分析化学中的分离富集方法是实现样品预处理、纯化和定性定量分析的基础,对于提高分析的准确性和灵敏度具有重要意义。
第十章常用的分离和富集方法1.试说明定量分离在定量分析中的重要作用。
答:在实际的分析工作中,遇到的样品往往含有各种组分,当进行测定时常常彼此发生干扰。
不仅影响分析结果的准确度,甚至无法进行测定,为了消除干扰,较简单的方法是控制分析条件或采用适当的掩蔽剂,但在有些情况下,这些方法并不能消除干扰,因此必须把被测元素与干扰组分分离以后才能进行测定。
所以,定量分离是分析化学的主要内容之一。
2.何谓回收率?在回收工作中对回收率要求如何?答:回收率是用来表示分离效果的物理量,回收率越大,分离效果越好,一般要求R A>90~95%即可。
3.何谓分离率?在分析工作中对分离率的要求如何?答:分离率表示干扰组分B与待测组分A的分离程度,用表示S B/A,S B/A越小,则R B越小,则A与B之间的分离就越完全,干扰就消除的越彻底。
通常,对常量待测组分和常量干扰组分,分离率应在0.1%以下;但对微量待测组分和常量干扰组分,则要求分离率小于10-4%。
4.有机沉淀剂和有机共沉淀剂有什么优点。
答:优点:具有较高的选择性,沉淀的溶解度小,沉淀作用比较完全,而且得到的沉淀较纯净。
沉淀通过灼烧即可除去沉淀剂而留下待测定的元素。
5.何谓分配系数、分配比?二者在什么情况下相等?答:分配系数:是表示在萃取过程中,物质进入有机溶剂的相对大小。
分配比:是该物质在有机溶剂中存在的各种形式的浓度之和与在水中各存在形式的浓度之和的比值,表示该物质在两相中的分配情况。
当溶质在两相中仅存在一种形态时,二者相等。
6.为什么在进行螯合物萃取时控制溶液的酸度十分重要?答:在萃取过程中,溶液的酸度越小,则被萃取的物质分配比越大,越有利于萃取,但酸度过低则可能引起金属离子的水解,或其他干扰反应发生,应根据不同的金属离子控制适宜的酸度。
7.解释下列各概念:交联度,交换容量,比移值。
答:交联度:在合成离子交换树脂的过程中,将链状聚合物分子相互连接而形成网状结构的过程中,将链状聚合物分子连接而成网状结构的过程称为交联。
分析化学中常用的分离和富集方法1.在分析化学中,为什么要进行分离富集?分离时对常量和微量组分的回收率要求如何?答:在定量分析,对于一些无法通过控制分析条件或采用掩蔽法来消除干扰,以及现有分析方法灵敏度达不到要求的低浓度组分测定,必须采用分离富集方法。
换句话说,分离方法在定量分析中可以达到消除干扰和富集效果,保证分析结果的准确性,扩大分析应用范围。
在一般情况下,对常量组分的回收率要求大于99.9%,而对于微量组分的回收率要求大于99%。
样品组分含量越低,对回收率要求也降低。
2.常用哪些方法进行氢氧化物沉淀分离?举例说明。
答:在氢氧化物沉淀分离中,沉淀的形成与溶液中的[OH-]有直接关系。
因此,采用控制溶液中酸度可使某些金属离子彼此分离。
在实际工作中,通常采用不同的氢氧化物沉淀剂控制氢氧化物沉淀分离方法。
常用的沉淀剂有:a 氢氧化钠:NaOH是强碱,用于分离两性元素(如Al3+,Zn2+,Cr3+)与非两性元素,两性元素的含氧酸阴离子形态在溶液中,而其他非两性元素则生成氢氧化物胶状沉淀。
b 氨水法:采用NH4Cl-NH3缓冲溶液(pH8-9),可使高价金属离子与大部分一、二金属离子分离。
c 有机碱法:可形成不同pH的缓冲体系控制分离,如pH5-6六亚甲基胺-HCl缓冲液,常用于Mn2+,Co2+,Ni2+,Cu2+,Zn2+,Cd2+与Al3+,Fe3+,Ti(IV)等的分离。
d ZnO悬浊液法等:这一类悬浊液可控制溶液的pH值,如ZnO悬浊液的pH值约为6,可用于某些氢氧化物沉淀分离。
3.某矿样溶液含Fe3+,A13+,Ca2+,Mg2+,Mn2+,Cr3+,Cu2+和Zn2+等离子,加入NH4C1和氨水后,哪些离子以什么形式存在于溶液中?哪些离子以什么方式存在于沉淀中?分离是否完全?答:NH4Cl与NH3构成缓冲液,pH在8-9间,因此溶液中有Ca2+,Mg2+,,Cu(NH3)42-、Zn(NH3)42+等离子和少量Mn2+,而沉淀中有Fe(OH)3,Al(OH)3和Cr(OH)3和少量Mn(OH)2沉淀。
分析化学中常用的分离和富集方法要求:了解分析化学中常用的分离方法;理解萃取分离法的基本原理、萃取条件的选择及主要的萃取体系;掌握分配比、分配系数和萃取率的计算;掌握各种色谱法分离的机理。
了解一些新的分离富集方法。
一、概述在分析中对分离的要求是,干扰组分应减少到不再干扰被测组分的测定,被测组分在分离过程中损失要小到可以忽略不计。
后者常用回收率来衡量。
%100⨯=原来所含待测组分质量质量分离后待测的待测组分回收率回收率越高越好,不同体系对回收率的要求不一。
二、沉淀分离法沉淀分离法是一种经典的分离方法,它是利用沉淀反应有选择地沉淀某些离子,而其他离子则留在溶液中,从而达到分离的目的。
常用方法有:常量组分的沉淀分离(氢氧化物沉淀分离:氢氧化钠法、氨水法、有机碱法、ZnO 悬浊液法;硫化物沉淀分离;利用有机沉淀剂进行分离;其他无机沉淀剂),痕量组分共沉淀分离和富集(无机共沉淀剂;有机共沉淀剂)。
三、挥发和蒸馏分离法挥发和蒸馏分离法是利用物质的挥发性的差异进行分离的一种方法,可以用于除去干扰组分,也可以使被测组分定量分出后再测定。
在无机物中,具有挥发性的物质并不多,因此这种方法选择性较高。
四、液—液萃取分离法1.萃取分离的原理:利用与水不相混溶的有机溶剂同试液一起震荡,一些组分进入有机相,另一些留在水相中,达到分离富集的目的。
2. 分配比和分配系数3. 萃取百分比%100⨯=被萃取物质的总量的总量被萃取物质在有机相中E即%100/00000⨯+=+=V V D D V C V C V C E w ww[] [::]D organic w aterO O D w wA A A c K D K A c D ==分配系数分配比ww V DV V m m +⋅=001若用0V (mL )溶剂,萃取n 次,水相中剩余被萃取物为m n (g ),则DV DV V m m nw w n )]/([00+=,查表得出同量的萃取剂,分几次萃取的效率比一次萃取的效率高,但增加萃取次数会影响工作效率。