高考化学练习题物质结构与性质-word
- 格式:doc
- 大小:20.00 KB
- 文档页数:6

高考化学复习专题检测—物质结构与性质(含解析)一、选择题(本题包括25小题,每小题2分,共50分,每小题只有一个选项符合题意)1.(2023·黑龙江省绥化市第九中学高三质检)已知在一定条件下,SO2也能体现其氧化性,例如:2H2S+SO2=3S+2H2O,下列化学用语使用正确的是()A.SO2的VSEPR模型:B.HS-电离的离子方程式:HS-+H2O H2S+OH-C.基态硫原子p x轨道的电子云轮廓图:D.基态氧原子最外层电子的轨道表示式:【答案】C【解析】A项,二氧化硫中心原子S的价层电子对数为3,有1对孤电子对,S杂化类型为sp2,VSEPR模型为平面三角形,A错误;B项,HS-电离的离子方程式HS-H++S2-,B错误;C项,基态硫原子P x轨道的电子云轮廓为哑铃型,C正确;D项,基态氧原子最外层电子的轨道表示式:,D错误;故选C。
2.(2023·江苏省南京市江宁区高三期中)尿素CO(NH2)2是一种高效化肥,也是一种化工原料。
反应CO2+2NH3CO(NH2)2+H2O可用于尿素的制备。
下列有关说法不正确...的是()A.NH3与CO(NH2)2均为极性分子B.N2H4分子的电子式为C.NH3的键角大于H2O的键角D.尿素分子σ键和π键的数目之比为6∶1【答案】D【解析】A项,NH3分子为三角锥形,为极性分子,CO(NH2)2中的N原子与NH3中的N成键方式相同,所以二者均为极性分子,A正确;B项,N原子的最外层电子数为5个,要达到稳定结构,N2H4的电子式为:,B正确;C项,NH3分子中有3个σ键,1对孤电子对,H2O分子中有2个σ键和2对孤电子对,孤电子对与成键电子对之间的排斥力大于成键电子对之间的排斥力,所以H2O的键角小于NH3中的键角,C正确;D项,1个单键1个σ键,1个双键1个σ键和1个π键,尿素中含有6个单键和1个双键,7个σ键和1个π键,尿素分子σ键和π键的数目之比为7∶1,D错误;故选D。

高考化学物质结构与性质前言:高中化学120个关键知识,为高中理科生整理,请同学们收藏学习,为了资源的共享,请把此资料转载分享、或发表在博客、论坛上,以便分享给更多的同学一. 学习内容:分子结构与晶体结构二. 学习目标了解化学键的含义,理解并掌握共价键的主要类型及特点,共价键、离子键及金属键的主要区别及对物质性质的影响。
能根据杂化轨道理论和价层电子对互斥模型判断简单分子或离子的空间构型,了解等电子体的含义。
了解原子晶体、分子晶体和金属晶体的结构特征,掌握不同晶体的构成微粒及微粒间的相互作用力,掌握影响晶体熔沸点、溶解性的因素。
三. 学习重点、难点分子结构与晶体结构的特点,影响物质熔沸点和溶解性、酸性的因素四. 学习过程(一)化学键与分子结构:1、化学键:相邻的两个或多个原子之间强烈的相互作用,通常叫做化学键。
三种化学键的比较:离子键共价键金属键形成过程阴阳离子间的静电作用原子间通过共用电子对所形成的相互作用金属阳离子与自由电子间的相互作用构成元素典型金属(含NH4+)和典型非金属、含氧酸根非金属金属实例离子化合物,如典型金属氧化物、强碱、大多数盐多原子非金属单质、气态氢化物、非金属氧化物、酸等金属配位键:配位键属于共价键,它是由一方提供孤对电子,另一方提供空轨道所形成的共价键,例如:NH4+的形成在NH4+中,虽然有一个N-H键形成过程与其它3个N-H键形成过程不同,但是一旦形成之后,4个共价键就完全相同。
共价键的三概念意义共价键按成键形式可分为σ键和π键两种,σ键主要存在于单键中,π键主要存在于双键、叁键以及环状化合物中。
σ键较稳定,而π键一般较不稳定。
共价键具有饱和性和方向性两大特征。
2、分子结构:价层电子对互斥理论:把分子分成两大类:一类是中心原子上的价电子都用于形成共价键。
如CO2、CH2O、CH4等分子中的C原子。
它们的立体结构另一类是中心原子上有孤对电子(未用于形成共价键的电子对)的分子。

2023届高考化学一轮专题练习题——物质结构与性质1.(2022·天津和平·二模)铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe3+的电子排布式为___。
-的立体构型是(2)FeCl3的熔点为306℃,沸点为315℃。
FeCl3的晶体类型是__。
FeSO4常作补铁剂,SO24__。
(3)羰基铁[Fe(CO)5]可作催化剂、汽油抗暴剂等。
1mol其分子中含__molσ键。
(4)氧化亚铁晶体的晶胞如图所示。
已知:氧化亚铁晶体的密度为ρg·cm-3,N A代表阿伏加德罗常数的值。
在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为__;Fe2+与O2-的最短核间距为__pm。
(5)某研究小组为了探究一种含铁无机矿物盐X(仅含四种元素)的组成和性质,设计并完成了如图实验:另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1。
℃X的化学式是___,在惰性气流中加热X至完全分解的化学方程式为__。
℃白色沉淀2在空气中变成红褐色沉淀的原因是__(用化学反应方程式表示)。
2.(2022·广东广州·模拟预测)氮、磷、砷及其化合物在工农业生产等方面有着重要应用。
请按要求回答下列问题。
(1)基态砷原子价电子排布图不能写为,是因为该排布方式违背了___________这一原理。
(2)元素第一电离能N___________P(填“>”或“<”或“=”,下同),电负性P___________As。
(3)腓(24N H )可用作火箭燃料等,它的沸点远高于乙烯的原因是___________。
(4)尿素()和2NaNO 在酸性环境下生成2N 、2CO 和2H O ,该反应的离子方程式为___________;-2NO 离子的立体构型(即空间构型)为___________。
(5)GaAs 的熔点为1238℃可作半导体材料;而3GaCl 的熔点为77.9℃。

(word完整版)⾼中化学选修3物质结构与性质习题附答案《物质结构与性质》同步复习第1讲原⼦结构1题⾯(1)34.969是表⽰__________;(2)35.453是表⽰__________;(3)35是表⽰_______________;(4)35.485是表⽰__________;(5)24.23%是表⽰__________;答案:(1)34.969是表⽰同位素35Cl 的相对原⼦质量;(2)35.453是表⽰氯元素的相对原⼦质量;(3)35是表⽰35Cl 原⼦的质量数;(4)35.485是表⽰氯元素的近似相对原⼦质量;(5)24.23%是表⽰同位素37Cl 在⾃然界存在的氯元素中所占的原⼦个数百分⽐。
5题⾯已知A 、B 、C 、D 和E 5种分⼦所含原⼦数⽬依次为1、2、3、4和6,且都含有18个电⼦。
⼜知B 、C 和D 是由两种元素的原⼦组成。
请回答:(1)组成A 分⼦的原⼦的核外电⼦排布式是;(2)B 和C 的分⼦式分别是和;C 分⼦的⽴体结构呈型,该分⼦属于分⼦(填“极性”或“⾮极性”);(3)若向D 的稀溶液中加⼊少量⼆氧化锰,有⽆⾊⽓体⽣成。
则D 的分⼦式是,该反应的化学⽅程式为;(4)若将1mol E 在氧⽓中完全燃烧,只⽣成1mol CO 2和2molH 2O ,则E 的分⼦式是。
答案:(1)1s 22s 22p 63s 23p 6 (2)HCl H 2S V 极性(3)H 2O 2 2H 2O22H 2O+O 2↑(4)CH 4O1题⾯答案:①1s 22s 22p 63s 23p 5 ②3s 23p 5 ③3 ④ⅦA ⑤10 ⑥2s 22p 6 ⑦2 ⑧0 ⑨24 ⑩1s 22s 22p 63s 23p 63d 54s 1 ⑾4 2题⾯(1)砷原⼦的最外层电⼦排布式是4s 24p 3,在元素周期表中,砷元素位于_______周期族;最⾼价氧化物的化学式为,砷酸钠的化学式是。

物质结构与性质综合题目录:2023年真题展现考向一考查杂化轨道、空间结构、晶体类型、晶胞计算考向二考查同素异形体、晶体类型、杂化轨道、晶胞计算考向三考查电子排布式、电负性、空间结构、杂化轨道、晶胞计算考向四考查电子排布式、电离能、空间结构、晶胞计算考向五考查电子排布式、杂化轨道、晶胞计算真题考查解读近年真题对比考向一考查电子排布式、杂化轨道、空间构型、晶胞计算考向二考查电子排布式、键角、电负性、杂化轨道、晶胞计算考向三考查轨道表示式、电离能、杂化轨道、晶胞计算考向四考查电子排布式、元素周期表、配位键、氢键、相似相溶考向五考查电子排布式、键角、氢键、晶胞计算考向六考查电离能、几何构型、轨道表示式、顺磁性物质命题规律解密名校模拟探源易错易混速记考向一考查杂化轨道、空间结构、晶体类型、晶胞计算1(2023·浙江选考第17题)硅材料在生活中占有重要地位。
请回答:(1)Si (NH 2)4分子的空间结构(以Si 为中心)名称为,分子中氮原子的杂化轨道类型是。
Si (NH 2)4受热分解生成Si 3N 4和NH 3,其受热不稳定的原因是。
(2)由硅原子核形成的三种微粒,电子排布式分别为:①[Ne ]3s 23p 2、②[Ne ]3s 23p 1、③[Ne ]3s 23p 14s 1,有关这些微粒的叙述,正确的是。
A.微粒半径:③>①>②B.电子排布属于基态原子(或离子)的是:①②C.电离一个电子所需最低能量:①>②>③D.得电子能力:①>②(3)Si 与P 形成的某化合物晶体的晶胞如图。
该晶体类型是,该化合物的化学式为。
2(2023·山东卷第16题)卤素可形成许多结构和性质特殊的化合物。
回答下列问题:物质结构与性质综合题-2023年新高考化学真题(解析版)(1)-40℃时,F2与冰反应生成HOF利HF。
常温常压下,HOF为无色气休,固态HOF的晶体类型为,HOF水解反应的产物为(填化学式)。

选做大题快速练(一)物质结构与性质1.现有原子序数递增的X、Y、Z、W四种常见元素。
其中X元素基态原子核外电子占据了三个能级,且每个能级上的电子数相等;Y原子的p轨道处于半充满状态,Z的单质是空气的主要成分之一;W在周期表中位于ds区,且与Z可形成化学式为W2Z或WZ的二元化合物。
请回答下列问题:(1)W元素原子核外电子运动状态有________种,该元素基态离子W+的核外电子排布式为________。
(2)元素X、Y和Z的第一电离能由大到小的顺序为__________(填元素符号)。
(3)Y2Z与XZ2具有相同的结构特征,其理由是_______________________________________________________________________________________________________________________________________________________________________________。
(4)X、Y和Z均可形成多种氢化物,写出X的一种氢化物分子结构中σ键和π键数目之比3∶2的结构式:______;A、B分别是Y、Z的最简单氢化合物,A的立体构型为________,其中Y原子的杂化轨道类型为________;W2+与A、B分子结合成配合离子[W A4B2]2+结构如下图,该配合离子加热时首先失去的组分是________(填“A”或“B”)。
(5)元素W的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图a和b所示,假定不同温度下元素W原子半径不变,且相邻最近原子间距为原子半径之和,则其体心立方堆积与面心立方堆积的两种晶体密度之比为________。
2.硼化镁是迄今发现的临界温度最高的简单的金属化合物超导材料。
回答下列问题:(1)基态硼的电子排布图为____________,基态镁原子的电子运动状态有____种。

专题五物质结构与性质A组基础巩固练1.(2022北京海淀区一模)铋可改善钢的加工性能。
元素周期表中铋与砷(As)同主族,铋最稳定的同位素是Bi。
下列说法不正确的是( )A.Bi是第六周期元素B Bi的中子数是126C.Bi的原子半径比As的小D Bi和Bi具有相同的电子数2.(2022辽宁本溪一模)下列有关化学用语表示正确的是( )A.水分子的球棍模型:B.钾原子的结构示意图:C.Na2O2的电子式:Na+[]2-Na+D.中子数为20的氯原子Cl3.(2022广东梅州一模)为纪念元素周期表诞生150周年,IUPAC向世界介绍118位优秀青年化学家,并形成一张“青年化学家元素周期表”。
中国学者雷晓光、姜雪峰、刘庄分别成为“N、S、Hg”元素的代言人。
下列说法正确的是( )A.S6与S8互为同位素B Hg的中子数为118C.NH3的电子式为H HD.金属汞的熔点高于硫黄4.(2022北京朝阳区一模)下列性质的比较,不正确的是( )A.酸性:H2SO4>H3PO4B.电负性:S<ClC.热稳定性:H2S>H2OD.第一电离能:S<O5.短周期主族元素X、Y、Z、W原子序数依次增大,X原子核外电子只有一种自旋取向,Y、Z两种原子核外s能级上的电子总数与p能级上电子总数相等,W原子的价电子中,在不同形状的原子轨道中运动的电子数之比为2∶1。
下列说法不正确的是( )A.W的第一电离能比同周期相邻元素的小B.原子半径:r(X)<r(Y)<r(W)<r(Z)C.工业上电解熔融化合物ZY制备单质ZD.W的最高价氧化物是非极性分子6.(2022山东日照一模,改编)硼砂阴离子[B4O5(OH)4]2-的球棍模型如图所示,下列说法不正确的是( )A.B原子的杂化方式为sp2和sp3B.该阴离子中所存在的化学键类型有配位键、极性共价键、氢键C.硼砂阴离子呈链状结构,则阴离子间以氢键结合D.1、2原子之间的化学键为配位键7.(2022辽宁省名校联盟联考)Cu、Au能形成多种组成固定的合金,其中一种晶体的晶胞结构(立方体)如图所示,下列说法正确的是( )A.该晶体的化学组成可表示为CuAuB.与1个Cu原子距离最近的Au原子是4个C.Au填充了与之距离最近的Cu原子构成的正四面体空隙D.根据图中信息,铜原子a的分数坐标为(0.5,0.5,0.5)8.(2022湖南卷,5)科学家合成了一种新的共价化合物(结构如图所示),X、Y、Z、W为原子序数依次增大的短周期元素,W的原子序数等于X与Y的原子序数之和。

目夺市安危阳光实验学校课时跟踪检测(三十九)“物质结构与性质”选考题1.钛及其化合物的应用越来越受到人们的关注。
(1)基态Ti原子核外电子排布的能量最高的能级符号是______。
与钛同周期的元素中,基态原子的未成对电子数与钛相同的有________种。
(2)钛比钢轻,比铝硬,是一种新兴的结构材料。
钛硬度比铝大的原因是_________________________________________________________________ _______。
(3)催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如图所示。
①M中,碳原子的杂化形式有________种。
②M中,不含________(填标号)。
a.π键b.σ键c.配位键d.氢键e.离子键(4)金红石(TiO2)是含钛的主要矿物之一,具有典型的四方晶系结构。
其晶胞结构(晶胞中相同位置的原子相同)如图所示。
①4个微粒A、B、C、D中,属于氧原子的是________。
②若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,________,________);钛氧键键长d=________(用代数式表示)。
解析:(1)基态Ti原子核外电子排布式为1s22s22p63s23p63d24s2,能量最高的能级符号为3d。
钛的3d能级上有2个未成对电子,第四周期元素中,基态原子的未成对电子数为2的元素还有Ni(3d84s2)、Ge(4s24p2)、Se(4s24p4),共3种。
(2)钛、铝均为金属晶体,其硬度取决于金属键强弱。
Ti原子的价电子数比Al多,金属键更强,因此钛硬度比铝大。
(3)①M 的结构如图,1类碳原子的杂化类型为sp2,2类碳原子的杂化类型为sp3。
②M 中,C—C键、C—H键、C—O键、Ti—Cl键属于σ键,苯环中存在大π键、Ti与O间存在配位键,M中不存在氢键与离子键。

第十一单元物质结构与性质A卷新题基础练一、选择题:本题共14个小题,每小题4分,共56分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列有关化学键的说法正确的是A.任何离子和原子之间都可能存在化学键B.只有直接相邻的原子或离子之间才存在相互作用C.离子键是指阴、阳离子之间的相互吸引力D.分子和分子之间不存在化学键2.(2021·辽宁·大连八中)下列化学用语使用正确的是A.Cu+价层电子的轨道表达式为B.空间填充模型可以表示甲烷分子,也可以表示四氯化碳分子C.用电子式表示水的形成过程:→D.2Fe+的结构示意图:3.(2021·辽宁实验中学)下列说法正确的是A.原子轨道与电子云都是用来形象描述电子运动状态的B.电子的运动状态可从能层、能级、轨道3个方面进行描述C.气体单质中,一定有σ键,可能有π键D.1个乙烯分子中含有4个σ键,1个π键4.(2021·辽宁沈阳·)以下现象与原子核外电子的跃迁有关的是①节日焰火②棱镜分光③激光④LED灯光⑤凹透镜聚光⑥钢铁生锈A.③⑥B.①③④C.①③④⑤D.①②③⑤⑥5.(2021·全国·)如图是物质的微观结构示意图,请认真观察两图,判断下列说法正确的是A.两种物质在一定条件下都会自动形成有规则几何外形的晶体B.I形成的固体物理性质有各向异性C.II形成的固体一定有固定的熔点D.二者的X射线衍射图谱是相同的6.(2021·全国·)下列有关电子排布式或排布图的结论错误的是N的电子排布图:7.(2021·辽宁·辽河油田第一高级中学)已知A、B、C、D、E是原子序数依次增大的前四周期元素,其元素性质成原子结构如表:下列说法错误的是A.B有3个未成对电子B.A、B、C三种元素的原子半径由大到小的顺序:A>B>CC .D 元素基态原子的价电子排布图为:D .E 的基态原子的简化电子排布式为:[]2Ar 4s8.(2021·江苏·)在气体分析中,常用CuCl 2的盐酸溶液吸收并定量测定CO 的含量。

物质结构与性质 1.(2022梅州模考)短周期主族元素W 、X 、Y 、Z 的原子序数依次增大,W 、X 原子的最外层电子数之比为4:3,Z 原子比X 原子的核外电子数多4。
下列说法正确的是( ) A .W 、Y 、Z 的电负性大小挨次确定是Z>Y>WB .W 、X 、Y 、Z 的原子半径大小挨次可能是W>X>Y>ZC .Y 、Z 形成的分子的空间构型可能是正四周体D .WY2分子中σ键与π键的数目之比是2:12.我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO +O2――→催化剂CO2+H2O 。
下列有关说法正确的是( ) A .该反应为吸热反应B .CO2分子中的化学键为非极性键C .HCHO 分子中既含σ键又含π键D .每生成1.8 g H2O 消耗 2.24 L O23.下列数据是对应物质的熔点(℃):据此做出的下列推断中错误的是( ) A .铝的化合物的晶体中有的是离子晶体 B .表中只有BCl3和干冰是分子晶体C .同族元素的氧化物可形成不同类型的晶体D .不同族元素的氧化物可形成相同类型的晶体4.(2022荆门调研)短周期非金属元素X 和Y 能形成XY2型化合物,下列有关XY2的推断不正确的是( ) A .XY2确定是分子晶体B .XY2的电子式可能是:Y ·· : :X: :Y ··: C .XY2水溶液不行能呈碱性D .X 可能是ⅣA 、ⅤA 或ⅥA 族元素。
5.两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表前10号元素中,满足上述关系的元素共有( ) A .1对 B .2对 C .3对 D .4对6.下列关于σ键和π键的理解不正确的是( )A .σ键能单独形成,而π键确定不能单独形成B .σ键可以绕键轴旋转,π键确定不能绕键轴旋转C .双键中确定有一个σ键、一个π键,三键中确定有一个σ键、两个π键D .气体单质中确定存在σ键,可能存在π键7.(2022无锡模拟)用VSEPR 模型猜想下列分子或离子的立体结构,其中不正确的是( ) A .NH +4为正四周体形 B .CS2为直线形 C .HCN 为折线形(V 形) D .PCl3为三角锥形8.下列有关物质结构和性质的说法中,正确的是( )A.元素非金属性Cl>S的试验依据是酸性HCl>H2S。

2023届高考化学一轮专题训练题—物质结构与性质 1.(2022·广东广州·模拟预测)环烷酸金属(Cu 、Ni 、Co 、Sn 、Zn )盐常作为合成聚氨酯过程中的有效催化剂。
请回答下列问题:(1)基态Co 原子的价电子排布式为___________。
(2)镍的氨合离子()236Ni NH +⎡⎤⎣⎦中存在的化学键有___________。
A .离子键B .共价键C .配位键D .氢键E .σ键F .π键(3)Cu 、Zn 的第二电离能比较:()2I Cu ___________()2I Zn (填>、=或<)。
(4)锡元素可形成白锡、灰锡、脆锡三种单质。
其中灰锡晶体与金刚石结构相似,但灰锡不如金刚石稳定,其原因是___________。
(5)硒化锌晶胞结构如图所示,其晶胞参数为apm 。
①已知原子坐标:A 点为()0,0,0,B 点为()1,1,1,则C 点原子坐标为___________。
①若硒化锌晶体的密度为-3ρg cm ⋅,则阿伏加德罗常数A N =___________(用含a 、ρ的计算式表示)。
2.(2022·广西南宁·模拟预测)我国“嫦娥”五号首次实现地外天体采样返回,这是我国航天事业的又一突破。
带回的月壤中含有H 、N 、O 、Al 、S 、Cd 、Zn 、Ti 、Cu 、Au 、Cr 等多种元素。
请完成下列问题:(1)N 、O 、Al 、S 四种元素第一电离能从大到小的顺序为_______。
(2)Cu 、Au 是同一副族的元素,Au 的原子序数更大,它们属于_______区元素,基态Au 原子的价电子排布式为_______。
(3)SO 2分子的空间构型为_______,请写出一种与SO 2互为等电子体的单质_______(填化学式)。
(4)某晶体的晶胞结构如图所示,该晶体的化学式为_______。
如果将Se 原子看做密堆积,则其堆积模型为_______。

2023届高考化学一轮备考专题练习题:物质结构与性质一、结构与性质1.(2022·山东滨州·高三期末)前四周期元素A 、B 、C 、D 、E 的原子序数依次增大,A 元素原子的核外电子只有一种运动状态;基态B 原子s 能级的电子总数比p 能级的多1;基态C 原子和基态E 原子中成对电子数均是未成对电子数的3倍;D 形成简单离子的半径在同周期元素形成的简单离子中最小。
回答下列问题:(1)E 的元素名称为_______,它位于元素周期表的_______区。
(2)元素A 、B 、C 中,电负性最大的是_______(填元素符号,下同),元素B 、C 、D 第一电离能由大到小的顺序为_______。
(3)与同族其他元素X 形成的3XA 相比,3BA 易液化的原因是_______。
(4)3BC -中B 原子轨道的杂化类型为_______,3A C +离子的空间结构为_______。
(5)化合物DB 是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。
若DB 的晶胞参数为a pm ,则晶体的密度为_______3g cm -⋅(用A N 表示阿伏加德罗常数)。
2.(2022·天津·二模)元素的性质与其在周期表中的位置密切相关,回答下列问题:(1)焰色实验是检测金属元素常用的方法,下列元素不能用焰色实验检测的是____。
A .FeB .CuC .BaD .Ca(2)如表是Fe 和Cu 的部分数据,I 2(Cu)____I 2(Fe)(填“>”或“<”)。
(3)磷酸亚铁锂电池的新能源汽车对减少二氧化碳排放和大气污染具有重要意义。
工业上用FeCl 3、NH 4H 2PO 4、LiCl 及苯胺为原料制磷酸亚铁锂电池材料。
NH 4+的空间构型为____;PO 34-中P的杂化轨道类型是____;O、P、Cl原子的半径最大的是____。
(填元素符号)(4)如图是CuSO4•5H2O结构式,CuSO4•5H2O中Cu2+的配位数是____。

分子结构与性质1.三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如下图所示,已知其燃烧热△H=-3677kJ/mol(P被氧化为P4O10),下列有关P4S3的说法中不正确的是A.分子中每个原子最外层均达到8电子稳定结构B.P4S3中硫元素为-2价,磷元素为+3价C.热化学方程式为P4S3(s)+8O2(g)=P4O10(s)+3SO2(g);△H=-3677kJ/molD.一个P4S3分子中含有三个非极性共价键【答案】B【解析】A、P原子最外层有5个电子,含3个未成键电子,S原子最外层有6个电子,含2个未成键电子,由P4S3的分子结构可知,每个P形成3个共价键,每个S形成2个共价键,分子中每个原子最外层均达到8电子稳定结构,A正确;B、由P4S3的分子结构可知,1个P为+3价,其它3个P都是+1价,正价总数为+6,而S为-2价,B错误;C、根据燃烧热的概念:1mol可燃物燃烧生成稳定氧化物放出的热量为燃烧热,则P4S3(s)+8O2(g)=P4O10(s)+3SO2(g);△H= -3677kJ/mol,C正确;D、由P4S3的分子结构可知,P-P之间的键为非极性键,P-S之间的键为极性键,一个P4S3分子中含有三个非极性共价键,D正确。
2.常温下三氯化氮(NCl3)是一种淡黄色的液体,其分子结构呈三角锥形,以下关于NCl3说法正确的是()A.该物质中N-C1键是非极性键B.NCl3中N原子采用sp2杂化C.该物质是极性分子D.因N-C1键的键能大,所以NCl3的沸点高【答案】C【解析】A、N和Cl是不同的非金属,则N-Cl键属于极性键,故A错误;B、NCl3中N有3个σ键,孤电子对数5312-⨯=1,价层电子对数为4,价层电子对数等于杂化轨道数,即NCl3中N的杂化类型为sp3,故B错误;C、根据B选项分析,NCl3为三角锥形,属于极性分子,故C正确;D、NCl3是分子晶体,NCl3沸点高低与N-Cl键能大小无关,故D错误。

2023届高考化学一轮练习题:物质的结构与性质1.(2022·广东·深圳市龙岗区平冈中学高三期中)I .新型储氢材料是开发利用氢能的重要研究方向,Ti(BH 4)3是一种储氢材料,可由LiBH 4和TiCl 4反应制得。
(1)基态B 原子有___________种运动状态的电子,Li 属于___________区(填“s”或“p”或“d”或“f”); (2)LiBH 4由Li +和-4BH 构成,-4BH 的空间结构是___________,与-4BH 互为等电子体的分子为___________,Li 、Be 、B 元素的第一电离能由大到小排列顺序为___________; (3)某储氢材料是短周期金属元素M 的氢化物。
M 的部分电离能如下表所示: I 1/kJ·mol -1 I 2/kJ·mol -1 I 3/kJ·mol -1 I 4/kJ·mol -1 I 5/kJ·mol -1 738 1451 7733 10540 13630M 是___________(填元素名称)。
II .叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN 3)是一种弱酸,其分子结构可表示为H-N=N≡N ,肼(N 2H 4)被亚硝酸氧化时便可得到氢叠氮酸(HN 3),发生的反应为:N 2H 4+HNO 2=2H 2O+HN 3.HN 3的酸性和醋酸相近,可微弱电离出H +和-3N 。
回答下列问题:(4)下列有关说法正确的是___________(填序号);A .HN 3中含有5个σ键 B .HN 3、HNO 2、H 2O 、N 2H 4都是极性分子 C .HN 3中含有2个π键D .N 2H 4沸点高达113.5℃,说明肼分子间可形成氢键(5)叠氮酸根能与许多金属离子等形成配合物,如[Co(N 3)(NH 3)5]SO 4,该配合物中心离子显___________价;钴价电子排布式为___________;NH 3空间构型是___________。
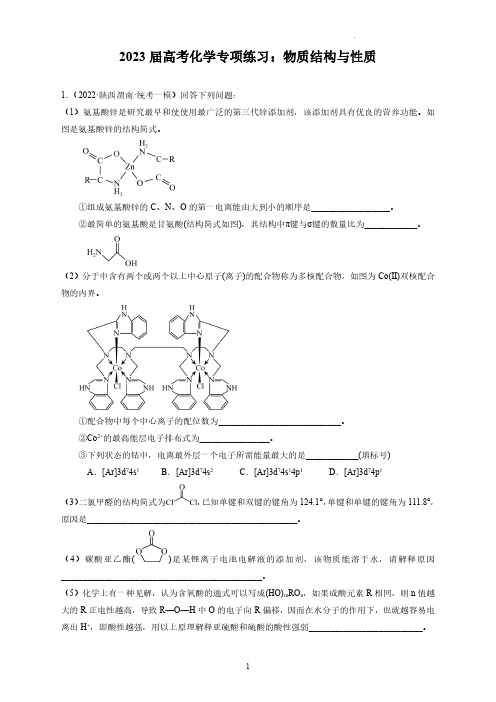
2023届高考化学专项练习:物质结构与性质1.(2022·陕西渭南·统考一模)回答下列问题:(1)氨基酸锌是研究最早和使使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。
如图是氨基酸锌的结构简式。
①组成氨基酸锌的C、N、O的第一电离能由大到小的顺序是__________________。
②最简单的氨基酸是甘氨酸(结构简式如图),其结构中π键与σ键的数量比为____________。
(2)分于中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(Ⅱ)双核配合物的内界。
①配合物中每个中心离子的配位数为____________________________。
②Co2+的最高能层电子排布式为________________。
③下列状态的钴中,电离最外层一个电子所需能量最大的是____________(填标号)A.[Ar]3d74s1B.[Ar]3d74s2C.[Ar]3d74s14p1D.[Ar]3d74p1(3)二氯甲醛的结构简式为,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是________________________________________________。
(4)碳酸亚乙酯()是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因______________________________________________。
(5)化学上有一种见解,认为含氧酸的通式可以写成(HO)m RO n,如果成酸元素R相同,则n值越大的R正电性越高,导致R—O—H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱__________________________。
2.(2022·天津·模拟预测)1797年法国化学家沃克兰从当时称为红色西伯利亚矿石中发现了铬,后期人类发现铬元素在其他方面有重要用途。

1、稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17种元素。
稀土元素有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)钪(Sc)为21号元素,位于周期表的_____区,基态原子价电子排布图为_______。
(2)离子化合物Na3[Sc(OH)6]中,存在的化学键除离子键外还有_______。
(3)Sm(钐)的单质与l,2-二碘乙烷可发生如下反应:Sm +ICH2CH2I→SmI2+CH2=CH2。
ICH2CH2I中碳原子杂化轨道类型为______, lmol CH2=CH2中含有的σ键数目为______。
常温下l,2-二碘乙烷为液体而乙烷为气体,其主要原因是__________(4)与N3-互为等电子体的分子有________________(写两个化学式)。
(5)Ce(铈)单质为面心立方晶体,其晶胞参数a=516pm。
晶胞中Ce(铈)原子的配位数为_______,列式表示Ce(铈)单质的密度:________g/cm3(用N A表示阿伏伽德罗常数的值,不必计算出结果)2、(物质结构与性质)(15分)钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属。
目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:2FeTiO3+7Cl2+6C2TiCl4+2FeCl3+6CO;TiO2+2Cl2+2C TiCl4+2CO将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg Ti+2MgCl2 MgCl2和过量Mg用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭。
请回答下列问题:(1)基态钛原子的价电子排布式为。
(2)与CO互为等电子体的离子为(填化学式)。
(3)在CH2Cl2、C6H6、CO2、C2H4中,碳原子采取sp杂化的分子有。
(4)TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟。
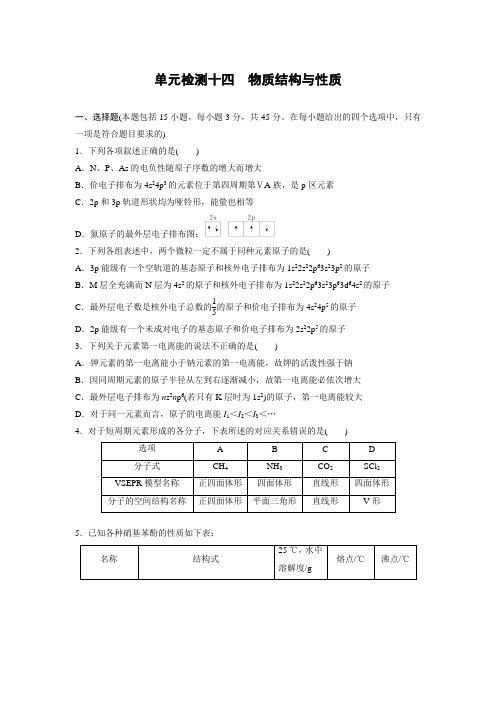
单元检测十四 物质结构与性质一、选择题(本题包括15小题,每小题3分,共45分。
在每小题给出的四个选项中,只有一项是符合题目要求的) 1.下列各项叙述正确的是( )A .N 、P 、As 的电负性随原子序数的增大而增大B .价电子排布为4s 24p 3的元素位于第四周期第ⅤA 族,是p 区元素C .2p 和3p 轨道形状均为哑铃形,能量也相等D .氮原子的最外层电子排布图:2.下列各组表述中,两个微粒一定不属于同种元素原子的是( )A .3p 能级有一个空轨道的基态原子和核外电子排布为1s 22s 22p 63s 23p 2的原子B .M 层全充满而N 层为4s 2的原子和核外电子排布为1s 22s 22p 63s 23p 63d 64s 2的原子C .最外层电子数是核外电子总数的15的原子和价电子排布为4s 24p 5的原子D .2p 能级有一个未成对电子的基态原子和价电子排布为2s 22p 5的原子 3.下列关于元素第一电离能的说法不正确的是( )A .钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠B .因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大C .最外层电子排布为n s 2n p 6(若只有K 层时为1s 2)的原子,第一电离能较大D .对于同一元素而言,原子的电离能I 1<I 2<I 3<…4.对于短周期元素形成的各分子,下表所述的对应关系错误的是( )选项 A B C D 分子式 CH 4 NH 3 CO 2 SCl 2 VSEPR 模型名称 正四面体形四面体形直线形 四面体形 分子的空间结构名称正四面体形 平面三角形直线形V 形5.已知各种硝基苯酚的性质如下表:名称结构式25 ℃,水中溶解度/g熔点/℃沸点/℃邻硝基苯酚0.2 45 100 间硝基苯酚 1.4 96 194 对硝基苯酚 1.7 114 295下列关于各种硝基苯酚的叙述不正确的是()A.邻硝基苯酚分子内形成氢键,使其熔、沸点低于另两种硝基苯酚B.间硝基苯酚不仅分子间能形成氢键,也能与水分子形成氢键C.对硝基苯酚分子间能形成氢键,使其熔、沸点较高D.三种硝基苯酚都不能与水分子形成氢键,所以在水中溶解度小6.下列有关原子晶体的叙述不正确的是()A.金刚石和二氧化硅晶体的最小结构单元都是正四面体B.1 mol金刚石中的C—C数目是2N A,1 mol SiO2晶体中的Si—O数目是4N AC.水晶和干冰在熔化时,晶体中的共价键都会断裂D.SiO2晶体是原子晶体,所以晶体中不存在分子,SiO2不是它的分子式7.元素周期表是安置元素的一座“大厦”,已知原子的下列结构或性质,能确定其在周期表中的“单元号和房间号”即位置的是()A.某元素原子的第二电子层电子排布图为B.某元素在某种化合物中的化合价为+4C.某元素的原子最外层电子数为6D.某元素的原子价电子排布式为5s25p18.硫酸盐(含SO2-4、HSO-4)气溶胶是雾霾的成分之一。

物质结构与性质选做题专项训练一1.海底热液研究处于当今科研的前沿;海底热液活动区域“黑烟囱”的周围,存活的长管虫、蠕虫、蛤类、贻贝类等动植物,成了极佳的天然海底实验室,且海底“黑烟囱”周围常存在FeS 、黄铜矿及锌矿等矿物; 1有关几种气体分子的说法正确的是; A .CO 的结构式可表示为B .C02与COS 硫化羰互为等电子体C .NH 3分子中氮原子采用sp 2杂化D .HCN 分子呈直线形2酸性热液中大量存在一价阳离子,结构如图2,它的化学式为: 3铁原子核外电子排布式为:4“黑烟囱“热液冷却后若可检测出图3所示分子,该分子中手性碳原子数为:; 5FeS 与NaCl 均为离子晶体,晶胞相似,前者熔点为985℃,后者80l ℃,其原因是 6从“黑烟囱”形成的矿床中提取镍,需将其转化为四羰基合镍结构如上图4,则该络合物的配位数为;答案..12分每空均2分1ABD2H 11O 5+31s 22s 22p 63s 23p 63d 64s 2或Ar3d 64s 2445FeS 晶体的晶格能比NaCl 晶体晶格能大642.为了比较温室效应气体对目前全球增温现象的影响, 科学家通常引用“温室效应指数”,以二氧化碳为相对标准;表1有A 至I 共九种气体在大气中的体积百分比及其温室效应指数;结合表中列出的九种气体,试参与回答下列各题: 1下列由极性键形成的极性分子是; A .N 2B .O 2C .H 2OD .CO 2E .CH 42下列说法不正确的是;A .N 2O 与CO 2,CCl 3F 与CCl 2F 2互为等电子体B .CCl 2F 2无同分异构体,说明其中碳原子采用sp 3方式杂化C .CH 4是目前引起温室效应的主要原因D .H 2O 沸点是九种物质中最高的,是因为水分子间能形成氢键3在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF 3、CHClFCF 3、C 3F 8,它们虽是微量的,有些确是强温室气体,下列推测不正确的是 ;A .由价层电子对互斥理论可确定NF 3分子呈三角锥形B .C 3F 8在CCl 4中的溶解度比水中大 C .CHClFCF 3存在手性异构D .第一电离能:N <O <F4甲烷晶体的晶胞结构如右图,下列有关说法正确的 ;A .甲烷在常温下呈气态,说明甲烷晶体属于分子晶体B .晶体中1个CH 4分子有12个紧邻的甲烷分子C .CH 4晶体熔化时需克服共价键D .可燃冰8CH 4·46H 2O 是在低温高压下形成的晶体5水能与多种过渡金属离子形成络合物,已知某红紫色络合物的组成为CoCl 3·5NH 3·H 2O;其水溶液显弱酸性,加入强碱并加热至沸腾有氨放出,同时产生Co 2O 3沉淀;加AgNO 3于该化合物溶液中,有AgCl 沉淀生成,过滤后再加AgNO 3溶液于滤液中无变化,但加热至沸腾有AgCl 沉淀生成,且其质量为第一次沉淀量的二分之一;则该配合物的化学式最可能为; A .CoCl 2NH 34Cl ·NH 3·H 2O B .CoNH 35H 2OCl 3 C .CoCl 2NH 33H 2OCl ·2NH 3D .CoClNH 35Cl 2·H 2O;6题5中钴离子在基态时核外电子排布式为:;答案..共12分,每空均2分A .1C2C3D4ABD5D6Co 3+1s 22s 22p 63s 23p 63d 63.如图所示:2个甲分子反应生成1个丙分子和3个乙分子,对此下列判断不正确的是C A .根据阿佛加德罗定律可推知,1个乙分子中含有2个A 原子 B .该反应类型是分解反应 C .反应生成的丙物质属于单质D .化学反应中分子的种类发生了改变4.不锈钢是由铁、铬、镍、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素;其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO 3防止腐蚀; 1基态碳C 原子的轨道表示式为 ;2CrH 2O 4Cl 2Cl·2H 2O 中Cr 的配位数为 ;已知CrO 5中Cr 为+6价,则CrO 5的结构式为 ;3金属镍粉在CO 气流中轻微加热,生成无色挥发性液态NiCO 4,呈四面体构型;423K 时,NiCO 4分解为Ni 和CO,从而制得高纯度的Ni 粉;试推测:四羰基镍的晶体类型是 ,与NiCO 4中配体互为等电子的离子是;4Fe 的一种晶体如甲、乙所示,若按甲虚线方向切乙得到A~B 图中正确的是;5据报道,只含镁、镍和碳三种元素的晶体竟然具有超导性;鉴于这三种元素都是常见元素,从而引起广泛关注;该晶体的结构可看作由镁原子和镍原子在一起进行面心立方密堆积,试写出该晶体的化学式;晶体中每个镁原子周围距离最近的镍原子有个;答案.12分A12分2 61分1分3 分子晶体 1分 CN -、C 22-任写一个2分4 A2分5MgCNi 3 2分 12 1分5.均由两种短周期元素组成的A 、B 、C 、D 化合物分子,都含有18个电子,它们分子中所含原子的数目依次为2、3、4、6;A 和C 分子中的原子个数比为1∶1,B 和D 分子中的原子个数比为1∶2;D 可作为火箭推进剂的燃料; 请回答下列问题:图中:碳原子用小球,镍原子用大球,镁原子用大CrOO OOO + +乙 甲 甲 丙 表示A 原子 表示B 原子1A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为用元素符号回答;2A与HF相比,其熔、沸点较低,原因是;3B分子的空间构型为形,该分子属于分子;填“极性”或“非极性”4C为一种绿色氧化剂,有广泛应用;请写出Cu、稀H2SO4与C反应制备硫酸铜的离子方程式,该反应中反应物Cu原子的基态电子排布式为;铜晶体中铜原子的堆积方式为面心立方堆积,右图是铜晶体一个晶胞的示意图,则晶胞中含个铜原子;5D分子中心原子的杂化方式是,由该原子组成的单质分子中包含个π键,与该单质分子互为等电子体的常见分子的分子式为;答案.A.1N>O>Cl>S2分2HF分子间形成氢键1分3V形或角形1分极性分子1分4Cu+2H++H2O2=Cu2++2H2O2分Ar3d104s11分41分5sp31分21分CO1分6.已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期;A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂;E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同;请回答下列问题:答题时,A、B、C、D、E用所对应的元素符号表示1E的基态原子的外围电子排布式为;2下列叙述正确的是;填字母a.M与水分子间能形成氢键,N是非极性分子b.M和二氧化碳分子中的中心原子均采用sp2杂化c.N分子中含有6个σ键和1个π键d.BD2晶体的熔点、沸点都比二氧化硅晶体的低3E的一种氧化物Q,其晶胞结构如右上图所示,则Q的化学式为,该晶体中氧的配位数为;4电镀厂排放的废水中常含有剧毒的BC-离子,可在Q的催化下,先用NaClO将BC-氧化成BCD-,再在酸性条件下BCD-继续被NaClO氧化成C2和BD2;①A、B、C、D四种元素的电负性由小到大的顺序为;②与BCD-互为等电子体的分子、离子的化学式依次为各写1种;③上述反应中后一步反应的离子方程式是;5在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为ECl3·6H20的绿色晶体,该晶体中两舞更体的物质的量之比为1:5,则该配离子的化学式为;答案.A.13d2阶段4s21分2ad2分3TiO21分31分4①H<C<N<O1分②CO2N2O、SCN-等2分③2CNO-+2H++3ClO-=N2↑+2CO2↑+3C1-+H2O2分5TiClH2O52+2分7.空气质量高低直接影响着人类的生产和生活,它越来越受到人们的关注;被污染的空气中杂质的成分有多种,其中计入空气质量日报空气污染指数的项目有SO2、CO、NO2、O3和可吸入颗粒物等;请回答下列问题:⑴S、N、O的第一电离能由大到小的顺序为;⑵血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒;①写出亚铁离子的基态电子排布式;②CO有多种等电子体,其中常见的两种为;⑶SO2是一种大气污染物,为减轻SO2污染,火力发电厂生产中常在燃煤中加入CaO以“固硫”;CaO晶胞如右图所示,其中Ca2+的配位数为,CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO-3 401kJ/mol、NaCl-786kJ/mol;CaO晶体的熔点NaCl晶体的熔点填“高于”、“等于”或“低于”;⑷随着人们生活质量的提高,不仅室外的环境安全为人们所重视,室内的环境安全和食品安全也越来越为人们所关注;甲醛是室内主要空气污染物之一其沸点是-℃,甲醇是“假酒”中的主要有害物质其沸点是℃,甲醇的沸点明显高于甲醛的主要原因是:;答案..12分:每空2分A.⑴N>O>S⑵①1s22s22p63s23d6②N2、CN-⑶6 高于⑷甲醇分子间存在氢键,而甲醛没有8.下表为长式周期表的一部分,其中的编号代表对应的元素;①②③④⑤⑥⑦⑧⑨⑩试填空;1写出上表中元素⑨原子的外围电子排布式;2元素③与⑧形成的化合物中元素③的杂化方式为:杂化,其形成的化合物的晶体类型是:________________;3元素④、⑤的第一电离能大小顺序是:>用元素符号表示;元素④与元素①形成的X 分子的空间构型为:;请写出与N 3—互为等电子体的分子、离子的化学式,各写一种;4在测定①与⑥形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是:;5某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质,写出元素②的氢氧化物与NaOH 溶液反应后盐的化学式;6元素⑩在一定条件下形成的晶体的基本结构单元如下图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为:;答案..每空1分,共12分 13d 54s 11分2sp 31分;分子晶体1分3N >O1分;三角锥形1分,CO 21分,或CS 2、N 2O 、BeCl 2CNO -2分4HF 分子之间有氢键,形成HFn1分 5Na 2BeO 262∶3,或8∶12、4∶69.分子式为PtNH 32Cl 2的配位化合物有顺铂和反铂两种同分异构体;顺铂的结构式为Pt NH 3ClClNH 3,具有抗癌作用;反铂的结构式为PtCl H 3NClNH 3,无抗癌作用;⑴C 、N 、O 三种元素的电负性由大到小的顺序是;Ni 元素与Pt 元素位于同一族,写出Ni 元素基态原子的电子排布式:;⑵顺铂和反铂的物理性质有很大差异,其中只有一种易溶于水,请你通过所学知识判断哪一种易溶于水,并说明理由:;⑶金属铂的原子堆积方式为与铜型面心立方堆积,一个金属铂的晶胞中含有个铂原子; ⑷NH 3还能与很多化合物通过配位键发生相互作用;例如:科学家潜心研究的一种可作储氢材料的化合物X 是NH 3与第二周期另一种元素的氢化物相互作用的产物,X 是乙烷的等电子体;加热化合物X 会缓慢释放H 2,转变为化合物Y,Y 是乙烯的等电子体; ①化合物X 的结构式为必须标明配位键;②化合物X 、Y 分子中,N 元素分别发生了杂化; 答案..12分A .⑴O >N >C1s 22s 22p 63s 23p 63d 84s 2⑵顺铂易溶于水,因为它是极性分子,易溶于极性溶剂 ⑶4⑷①B HN H HHH ②sp 3和sp 210.下列排列顺序正确的一组是A .半径:FeOH 3胶粒>I ->K +>Na +B .熔沸点:HF <HCl <HBr <HIC.还原性:Fe3+>Cu2+>Fe2+>Zn2+D.热稳定性:HF<PH3<H2S<HCl11.不锈钢是由铁、铬、镍、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素;其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3防止腐蚀; 1基态碳C 原子的轨道表示式为;2CrH2O4Cl2Cl·2H2O中Cr的配位数为;已知CrO5中Cr为+6价,则CrO5的结构式为;3金属镍粉在CO气流中轻微加热,生成无色挥发性液态NiCO4,呈四面体构型;423K时,NiCO4分解为Ni和CO,从而制得高纯度的Ni粉;试推测:四羰基镍的晶体类型是,NiCO4易溶于下列;A.水B.四氯化碳C.苯D.硫酸镍溶液4Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~B图中正确的是;5据报道,只含镁、镍和碳三种元素的晶体竟然具有超导性;鉴于这三种元素都是常见元素,从而引起广泛关注;该晶体的结构可看作由镁原子和镍原子在一起进行面心立方密堆积,试写出该晶体的化学式;晶体中每个镁原子周围距离最近的镍原子有个;答案.、A12分2 61分1分3 分子晶体1分bc 2分4 A2分5 MgCNi32分12 1分图中:碳原子用小球,镍原子用大球,镁原子用大CrOOOOO。
高考化学练习题物质结构与性质物质结构与性质
考点1 原子结构与元素的性质
1.了解原子核外电子的能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子的排布。
了解原子核外电子的运动状态。
2.了解元素电离能的含义,并能用以说明元素的某些性质。
3.了解原子核外电子在一定条件下会发生跃迁,了解其简单应用。
4.了解电负性的概念,知道元素的性质与电负性的关系。
高频考点1 原子核外电子的排布规律
【样题1】下列各组原子中,彼此化学性质一定相似的是() A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.2p轨道上有一个空轨道的X原子与3p轨道上只有一个空轨道的Y原子
D.最外层都只有一个电子的X、Y原子
【解题指导】A中1s2结构的He,1s22s2结构为Be,两者性质不相似。
B项X原子为Mg,Y原子N层上有2个电子的有多种元素,如第四周期中Ca、Fe等都符合,化学性质不一
定相似。
C项为同主族的元素,化学性质一定相似。
D项最外层只有1个电子可能是第ⅠA族元素,过渡元素中也有很多最外层只有1个电子的,故性质不一定相似。
【答案】 C
【命题解读】原子核外电子的排布规律是中学化学原子结构的重点内容,也是元素周期律的基础。
原子轨能级是决定核外电子排布和构型的重要因素,原子的外层电子构型是随原子序数的增加呈现周期性变化,而原子的外层电子构型的周期性变化又引起元素性质的周期性变化,元素性质周期性变化的规律称元素周期律,反映元素周期律的元素排布称元素周期表。
考点2 化学键与物质的性质
1.理解离子键的形成,能根据离子化合物的结构特征解释其物理性质。
2.了解共价键的主要类型键和键,能用键能、键长、键角等说明简单分子的某些性质。
3.了解简单配合物的成键情况。
4.了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。
5.理解金属键的含义,能用金属键理论解释金属的一些物理性质。
6.了解杂化轨道理论及常见的杂化轨道类型(sp,sp2,sp3),
能用价层电子对互斥理论或者杂化轨道理论推测常见的简
单分子或者离子的空间结构。
高频考点1 杂化轨道理论及常见的杂化轨道类型
【样题1】在乙烯分子中有5个键和1个键,它们分别是 ()
A.sp2杂化轨道形成键,末杂化的2p轨道形成键
B.sp2杂化轨道形成键,未杂化的2p轨道形成键
C.CH之间是sp2杂化轨道形成键,CC之间是未杂化的2p轨道形成键
D之间是sp2杂化轨道形成键,CH之间是未杂化的2p轨道形成键
【解题指导】选A。
在乙烯分子中,每个碳原子的2s轨道与2个2p轨道杂化形成3个sp2杂化轨道,其中2个sp2杂化轨道分别与2个氢原子的1s轨道头碰头重叠形成CH 键,另外1个sp2杂化轨道形成CC 键。
2个碳原子未杂化的2p轨道肩并肩重叠形成1个键。
【命题解读】《高考考纲》明确要求:了解杂化轨道理论及常见的杂化轨道类型(sp,sp2,sp3),能用价层电子对互斥理论或者杂化轨道理论推测常见的简单分子或者离子的空间
结构。
随着课程改革的深入,高考中对杂化轨道理论知识的考查也在不断加强,对元素原子杂化轨道及空间构型的判断主要采取价电子对互斥理论和归纳记忆法。
本文导航 1、首页2、物质结构与性质
考点3 分子间作用力与物质的性质
1.了解化学键和分子间作用力的区别。
2.了解氢键的存在对物质性质的影响,能列举含有氢键的物质。
3.了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别。
高频考点1 化学键与晶体类型
【样题1】下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是 ( )
A.SiO2和SO2
B.CO2和H2O
C.NaCl和HCl Dl4和KCl
【解题指导】选B。
SiO2是共价键形成的原子晶体,SO2是共价键形成的分子晶体,A错;CO2和H2O均为共价键,而且是分子晶体,B对;NaCl是离子键形成的离子晶体,HCl是共价键形成的分子晶体,C错;CCl4是共价键形成的分子晶体,KCl是离子键形成的离子晶体,D错。
【命题解读】《高考考纲》明确要求:了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别。
高考命题主要考查了离子键、共价键的概念,同时隐含着考查离子化合物、共价化合物的区别及离子化合物、共价化合物与化学键的关系。
充分体现了对学生基本知识的掌握情况及基础知识的运用能力的考查。
高频考点2 物质结构与性质综合应用
【样题1】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
请回答下列问题:
(1)Ni原子的核外电子排布式为
______________________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填或
(3)NiO晶胞中Ni和O的配位数分别为_______________、_______________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。
该合金的化学式为
_______________;
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是
_______________;
②该结构中,氧氢之间除共价键外还可存在
_______________;
③该结构中,碳原子的杂化轨道类型有_______________。
【试题解析】(1)利用能量最低原理等可知28Ni的核外电子排布式为:1s22s22p63s23p63d84s2。
(2)利用Ni2+与Fe2+
的离子半径大小关系可知NiO的晶格能大于FeO的,故熔点:NiOFeO。
(3)利用信息知可类比NaCl的配位数可知NiO晶胞中Ni与O的配位数均为6。
(4)由均摊法知每个晶胞中含有:一个La(81/8)、五个Ni(1+81/2),故该合金的化学式为:LaNi5。
(5)①在该结构中,碳氮双键中其中一个是键、一个是氮镍之间的键是由N原子提供孤对电子,Ni提供空轨道形成的配位键。
②由于氧的电负性强,因此该结构中,氧氢之间除形成共价键外,还可以形成氢键。
③该结构中-CH3中的碳原子是sp3杂化、用于形成C=N的碳原子是sp2杂化。
【答案】(1) 1s22s22p63s23p63d84s2 (2) (3)6 6 (4) LaNi5 (5) ①一个键、一个配位键;②氢键; ③sp2、sp3
【命题解读】物质结构与性质作为高中化学新课程的一个选修模块,侧重于帮助学生了解人类探索物质结构的重要意义和基本方法,研究物质构成的奥秘,认识物质结构与性质之
间的关系,提高分析问题和解决问题的能力。