生物化学知识点汇总(王镜岩版)
- 格式:doc
- 大小:536.00 KB
- 文档页数:125

生物化学复习第一章 糖类 1、 什么叫糖多羟基醛或多羟基酮及其聚合物和衍生物。
一般构型:D 型 四大类生物大分子:糖类、脂质、蛋白质和核酸 2、 分成哪几类单糖:是不能被水解成更小分子的糖类,也称简单糖,如葡萄糖、果糖、核糖和丙糖(三碳糖)、丁糖(四碳糖)、戊糖(五碳糖)、己糖等(六碳糖)。
寡糖(低聚糖):能水解产生少数几个单糖的糖类,如麦芽糖、蔗糖、乳糖(水解生成2分子单糖,称双糖或二糖)和棉子糖(水解生成3分子单糖)。
多糖:是水解时产生20个以上单糖分子的糖类,包括同多糖(水解时只产生一种单糖或单糖衍生物)如淀粉、糖原、壳多糖等;杂多糖(水解时产生一种以上的单糖或/和单糖衍生物)如透明质酸、半纤维素等。
3、 单糖的开链结构离最远的—OH 在左边的是L 型;在右边的是D 型 D 型和L 型是一对对映体Fischer 投影式表示单糖结构竖线表示碳链;羰基具有最小编号, 并写在投影式上端;一短横线代表手性碳上的羟基。
单糖的差向异体:这种仅一个手性碳原子的构型不同的非对映异构体称为差向异构体 4、单糖的环状结构α-异构体:半缩醛羟基与氧桥在同侧;或半缩醛羟基与C5上的羟基在链同侧 β-异构体:半缩醛羟基与氧桥在异侧;或半缩醛羟基与C5上的羟基在链异侧。
β-D-(+)-吡喃葡萄糖 β-D-(+)-呋喃葡萄糖 α-D-呋喃葡萄糖 α-D-吡喃葡葡萄糖 Fischer 式转换Haworth 式C-2差向异构C-4差向异构体游离的半缩醛羟基的写法α-D-吡喃葡萄糖β-D-吡喃葡萄糖β-D-吡喃葡萄糖β-L-吡喃葡萄D-型:CH2OH在环上方;L-型:CH2OH在环下方。
D-型糖中:α-异构体:半缩醛羟基在环的下方;β-异构体:半缩醛羟基在环的上方。
L-型糖中:情况相反。
OHβ-D-呋喃果糖α -D-呋喃果糖β-D-呋喃葡萄糖D-吡喃葡萄糖β-D-吡喃葡萄糖α-D-吡喃葡萄糖5、单糖的性质(1)物理性质旋光性:当平面偏振光通过手性化合物溶液后,偏振面的方向就被旋转了一个角度。

教学目标:1.掌握蛋白质的概念、重要性和分子组成。
2.掌握α-氨基酸的结构通式和20种氨基酸的名称、符号、结构、分类;掌握氨基酸的重要性质;熟悉肽和活性肽的概念。
3.掌握蛋白质的一、二、三、四级结构的特点及其重要化学键。
4.了解蛋白质结构与功能间的关系。
5.熟悉蛋白质的重要性质和分类第一节蛋白质的分子组成一、蛋白质的元素(化学)组成主要有 C(50%~55%)、H(6%~7%)、O(19%~24%)、N(13%~19%)、S(0%~4%)。
有些蛋白质还含微量的P、Fe、Cu、Zn、Mn、Co、Mo、I等。
各种蛋白质的含氮量很接近,平均为16%。
因此,可以用定氮法来推算样品中蛋白质的大致含量。
每克样品含氮克数×6.25×100=100g样品中蛋白质含量(g%)二、蛋白质的基本组成单位——氨基酸蛋白质在酸、碱或蛋白酶的作用下,最终水解为游离氨基酸(amino acid),即蛋白质组成单体或构件分子。
存在于自然界中的氨基酸有300余种,但合成蛋白质的氨基酸仅20种(称编码氨基酸),最先发现的是天门冬氨酸(1806年),最后鉴定的是苏氨酸(1938年)。
(三)氨基酸的重要理化性质1.一般物理性质α-氨基酸为无色晶体,熔点一般在200 oC以上。
各种氨基酸在水中的溶解度差别很大(酪氨酸不溶于水)。
一般溶解于稀酸或稀碱,但不能溶解于有机溶剂,通常酒精能把氨基酸从其溶液中沉淀析出。
芳香族氨基酸(Tyr、Trp、Phe)有共轭双键,在近紫外区有光吸收能力,Tyr、Trp的吸收峰在280nm,Phe在265 nm。
由于大多数蛋白质含Tyr、Trp残基,所以测定蛋白质溶液280nm的光吸收值,是分析溶液中蛋白质含量的快速简便的方法。
2.两性解离和等电点(isoelectric point, pI)氨基酸在水溶液或晶体状态时以两性离子的形式存在,既可作为酸(质子供体),又可作为碱(质子受体)起作用,是两性电解质,其解离度与溶液的pH有关。

导入:100年前,恩格斯指出“蛋白体是生命的存在形式”;今天人们如何认识蛋白质的概念和重要性?1839年荷兰化学家马尔德(G.J.Mulder)研究了乳和蛋中的清蛋白,并按瑞典化学家Berzelius的提议把提取的物质命名为蛋白质(Protein,源自希腊语,意指“第一重要的”)。
德国化学家费希尔(E.Fischer)研究了蛋白质的组成和结构,在1907年奠立蛋白质化学。
英国的鲍林(L.Pauling)在1951年推引出蛋白质的螺旋;桑格(F.Sanger)在1953年测出胰岛素的一级结构。
佩鲁茨(M.F.Perutz)和肯德鲁(J.C.kendrew) 在1960年测定血红蛋白和肌红蛋白的晶体结构。
1965年,我国生化学者首先合成了具有生物活性的蛋白质——胰岛素(insulin)。
蛋白质是由L-α-氨基酸通过肽键缩合而成的,具有较稳定的构象和一定生物功能的生物大分子(biomacromolecule)。
蛋白质是生命活动所依赖的物质基础,是生物体中含量最丰富的大分子。
单细胞的大肠杆菌含有3000多种蛋白质,而人体有10万种以上结构和功能各异的蛋白质,人体干重的45%是蛋白质。
生命是物质运动的高级形式,是通过蛋白质的多种功能来实现的。
新陈代谢的所有的化学反应几乎都是在酶的催化下进行的,已发现的酶绝大多数是蛋白质。
生命活动所需要的许多小分子物质和离子,它们的运输由蛋白质来完成。
生物的运动、生物体的防御体系离不开蛋白质。
蛋白质在遗传信息的控制、细胞膜的通透性,以及高等动物的记忆、识别机构等方面都起着重要的作用。
随着蛋白质工程和蛋白质组学的兴起和发展,人们对蛋白质的结构与功能的认识越来越深刻。
第一节蛋白质的分子组成一、蛋白质的元素组成经元素分析,主要有 C(50%~55%)、H(6%~7%)、O(19%~24%)、N(13%~19%)、S(0%~4%)。
有些蛋白质还含微量的P、Fe、Cu、Zn、Mn、Co、Mo、I等。

王镜岩——生物化学名词解释(2013年~2002年)【2013年】1.寡聚蛋白质(oligomeric protein):两条或两条以上具有三级结构的多肽链组成的蛋白质。
(也称多聚蛋白质)。
如:血红蛋白(两条α链,两条β链)、己糖激酶(4条α链)。
附:仅由一条多肽链构成的蛋白质称为单体蛋白质。
如:溶菌酶和肌红蛋白【第三章蛋白质】(上159)2.酶的转换数(turnover number,TN):即K3,又称催化常数(catalytic constant,K cat)是指在一定条件下每秒钟每个酶分子转换底物的分子数。
(通常来表示酶的催化效率)附:[ 或每秒钟每微摩尔酶分子转换底物的微摩尔数] ,大多数酶对它们的天然底物的转换数的变化围是每秒1到104(上321)【第四章酶】3.糖的变旋现象(mutarotation):是当一种旋光异构体,如糖溶于水中转变为几种不同的旋光异构体的平衡混合物时,发生的旋光变化的现象。
【第一章糖类】(上8;2013、2008)4.油脂的酸值(acid number):是指中和1g油脂中的游离脂肪酸所消耗KOH 的毫克数。
【第二章脂类和生物膜】(上95)5.激素受体:位于细胞表面或细胞,结合特异激素并引发细胞响应的蛋白质。
【第六章维生素、激素和抗生素】6.乙醛酸循环(glyoxylic acid cycle ,GAC):是一种被修改的三羧酸循环,在两种循环中具有某些相同的酶和产物,但代谢途径不同,在乙醛酸循环中乙酰CoA首先和草酰乙酸缩合成柠檬酸,然后转变为异柠檬酸,再裂解为琥珀酸和乙醛酸,在这一循环中产生乙醛酸,故称乙醛酸循环。
【第八章糖代谢】(这个循环除两步由异柠檬酸裂合酶和苹果酸合酶催化的反应外,其他的反应都和“柠檬酸循环”相同。
)(2013、2012)资料2:又称三羧酸循环支路,该途径在动物体不存在,只存在于植物和微生物中,主要在乙醛酸循环体中和线粒体中进行。
乙醛酸循环从草酰乙酸与乙酰CoA缩合形成柠檬酸开始,柠檬酸经异构化生成异柠檬酸,与TCA循环不同的是异柠檬酸经异柠檬酸裂解酶裂解为琥珀酸和乙醛酸。

生物化学复习第一章糖类1、什么叫糖多羟基醛或多羟基酮及其聚合物和衍生物。
一般构型:D型四大类生物大分子:糖类、脂质、蛋白质和核酸2、分成哪几类单糖:是不能被水解成更小分子的糖类,也称简单糖,如葡萄糖、果糖、核糖和丙糖(三碳糖)、丁糖(四碳糖)、戊糖(五碳糖)、己糖等(六碳糖)。
寡糖(低聚糖):能水解产生少数几个单糖的糖类,如麦芽糖、蔗糖、乳糖(水解生成2分子单糖,称双糖或二糖)和棉子糖(水解生成3分子单糖)。
多糖:是水解时产生20个以上单糖分子的糖类,包括同多糖(水解时只产生一种单糖或单糖衍生物)如淀粉、糖原、壳多糖等;杂多糖(水解时产生一种以上的单糖或/和单糖衍生物)如透明质酸、半纤维素等。
3、单糖的开链结构离最远的—OH 在左边的是L型;在右边的是D型D型和L型是一对对映体Fischer投影式表示单糖结构竖线表示碳链;羰基具有最小编号, 并写在投影式上端;一短横线代表手性碳上的羟基。
单糖的差向异体:这种仅一个手性碳原子的构型不同的非对映异构体称为差向异构体C-2差向异构C-4差向异构体4、单糖的环状结构α-异构体:半缩醛羟基与氧桥在同侧;或半缩醛羟基与C5上的羟基在链同侧β-异构体:半缩醛羟基与氧桥在异侧;或半缩醛羟基与C5上的羟基在链异侧。
β-D-(+)-吡喃葡萄糖β-D-(+)-呋喃葡萄糖α-D-呋喃葡萄糖α-D-吡喃葡葡萄糖Fischer式转换Haworth式游离的半缩醛羟基的写法α-D-吡喃葡萄糖β-D-吡喃葡萄糖β-D-吡喃葡萄糖β-L-吡喃葡萄D-型:CH2OH在环上方;L-型:CH2OH在环下方。
D-型糖中:α-异构体:半缩醛羟基在环的下方;β-异构体:半缩醛羟基在环的上方。
L-型糖中:情况相反。
OHβ-D-呋喃果糖α -D-呋喃果糖β-D-呋喃葡萄糖D-吡喃葡萄糖β-D-吡喃葡萄糖α-D-吡喃葡萄糖5、单糖的性质(1)物理性质旋光性:当平面偏振光通过手性化合物溶液后,偏振面的方向就被旋转了一个角度。

王镜岩生物化学考研第三版笔记第一章概述第一节概述一、生物分子是生物特有的有机化合物生物分子泛指生物体特有的各类分子,它们都是有机物。
典型的细胞含有一万到十万种生物分子,其中近半数是小分子,分子量一般在500以下。
其余都是生物小分子的聚合物,分子量很大,一般在一万以上,有的高达1012,因而称为生物大分子。
构成生物大分子的小分子单元,称为构件。
氨基酸、核苷酸和单糖分别是组成蛋白质、核酸和多糖的构件。
二、生物分子具有复杂有序的结构生物分子都有自己特有的结构。
生物大分子的分子量大,构件种类多,数量大,排列顺序千变万化,因而其结构十分复杂。
估计仅蛋白质就有1010-1012种。
生物分子又是有序的,每种生物分子都有自己的结构特点,所有的生物分子都以一定的有序性(组织性)存在于生命体系中。
三、生物结构具有特殊的层次生物用少数几种生物元素(C、H、O、N、S、P)构成小分子构件,如氨基酸、核苷酸、单糖等;再用简单的构件构成复杂的生物大分子;由生物大分子构成超分子集合体;进而形成细胞器,细胞,组织,器官,系统和生物体。
生物的不同结构层次有着质的区别:低层次结构简单,没有种属专一性,结合力强;高层次结构复杂,有种属专一性,结合力弱。
生物大分子是生命的物质基础,生命是生物大分子的存在形式。
生物大分子的特殊运动体现着生命现象。
四、生物分子都行使专一的功能每种生物分子都具有专一的生物功能。
核酸能储存和携带遗传信息,酶能催化化学反应,糖能提供能量。
任何生物分子的存在,都有其特殊的生物学意义。
人们研究某种生物分子,就是为了了解和利用它的功能。
五、代谢是生物分子存在的条件代谢不仅产生了生物分子,而且使生物分子以一定的有序性处于稳定的状态中,并不断得到自我更新。
一旦代谢停止,稳定的生物分子体系就要向无序发展,在变化中解体,进入非生命世界。
六、生物分子体系有自我复制的能力遗传物质DNA能自我复制,其他生物分子在DNA的直接或间接指导下合成。


第一章概述第一节概述一、生物分子是生物特有的有机化合物生物分子泛指生物体特有的各类分子,它们都是有机物。
典型的细胞含有一万到十万种生物分子,其中近半数是小分子,分子量一般在500以下。
其余都是生物小分子的聚合物,分子量很大,一般在一万以上,有的高达1012,因而称为生物大分子。
构成生物大分子的小分子单元,称为构件。
氨基酸、核苷酸和单糖分别是组成蛋白质、核酸和多糖的构件。
二、生物分子具有复杂有序的结构生物分子都有自己特有的结构。
生物大分子的分子量大,构件种类多,数量大,排列顺序千变万化,因而其结构十分复杂。
估计仅蛋白质就有1010-1012种。
生物分子又是有序的,每种生物分子都有自己的结构特点,所有的生物分子都以一定的有序性(组织性)存在于生命体系中。
三、生物结构具有特殊的层次生物用少数几种生物元素(C、H、O、N、S、P)构成小分子构件,如氨基酸、核苷酸、单糖等;再用简单的构件构成复杂的生物大分子;由生物大分子构成超分子集合体;进而形成细胞器,细胞,组织,器官,系统和生物体。
生物的不同结构层次有着质的区别:低层次结构简单,没有种属专一性,结合力强;高层次结构复杂,有种属专一性,结合力弱。
生物大分子是生命的物质基础,生命是生物大分子的存在形式。
生物大分子的特殊运动体现着生命现象。
四、生物分子都行使专一的功能每种生物分子都具有专一的生物功能。
核酸能储存和携带遗传信息,酶能催化化学反应,糖能提供能量。
任何生物分子的存在,都有其特殊的生物学意义。
人们研究某种生物分子,就是为了了解和利用它的功能。
五、代谢是生物分子存在的条件代谢不仅产生了生物分子,而且使生物分子以一定的有序性处于稳定的状态中,并不断得到自我更新。
一旦代谢停止,稳定的生物分子体系就要向无序发展,在变化中解体,进入非生命世界。
六、生物分子体系有自我复制的能力遗传物质DNA能自我复制,其他生物分子在DNA 的直接或间接指导下合成。
生物分子的复制合成,是生物体繁殖的基础。

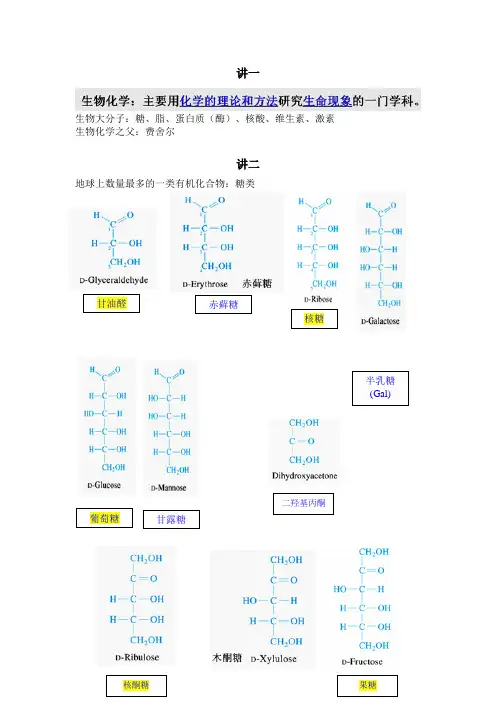
赤藓糖葡萄糖甘油醛核糖甘露糖半乳糖(Gal)((Gal)二羟基丙酮核酮糖果糖讲一生物大分子:糖、脂、蛋白质(酶)、核酸、维生素、激素生物化学之父:费舍尔讲二地球上数量最多的一类有机化合物:糖类α和β吡喃葡萄糖(羟基在下为α型,在上为β型)糖原高度分支的生理意义:第三章、蛋白质20种氨基酸英文名等电点掌握氨基酸的用途、现象DNFB法PITCCys半胱氨酸Ellman反应,DTNB,二硫硝基苯甲酸Ellman反应(二硫硝基苯甲酸,DTNB)Cys与二硫硝基苯甲酸(DTNB) 或称Ellman 试剂发生硫醇-二硫化物交换反应。
反应中1 分子的Cys引起1分子的硫硝基苯甲酸的释放。
它在pH 8.0 时, 在412nm 波长处有强烈的光吸收, 因此可利用分光光度法定量测定-SH。
肽平面(酰胺平面)——由肽键周围的6个原子组成的刚性平面3.6蛋白质的纯化注:用尽可能少的步骤、尽可能短的时间。
1.前处理阶段物理法——冻融法,超声波法,均浆法,研磨法等。
酶裂解法——就是利用水解酶将细胞壁和细胞膜消化的方法,常用的水解酶有溶菌酶、葡聚糖酶、蛋白酶、糖苷酶、壳多糖酶、细胞壁溶解酶等。
其中溶菌酶主要对细菌类有作用,其他酶对酵母作用显著。
2.粗分级/粗分离根据蛋白质的①溶解性质、②大小不同、③带电状态不同/电荷多少④净化方法根据与其他化合物相互作用的蛋白质(部分蛋白质对..有特定的..)②:凝胶过滤层析常用凝胶过滤介质Sephadex:交联葡聚糖,是采用环氧氯丙烷作交联剂将右旋葡聚糖交联而成。
干粉容易膨胀,在水、盐溶液、有机溶液、碱和弱酸中化学性质稳定,可高压灭菌。
高交联度的Sephadex,其颗粒坚硬,适于高流速下操作。
Sephacryl : 烯丙基葡聚糖同N、Nˊ—甲叉双丙烯酰胺共价交联而成。
颗粒坚硬,性质比Sephadex更为稳定,可高压灭菌,在pH3~11条件下稳定,可用有机溶剂洗脱,也可用SDS、尿素及盐酸胍洗脱。

生物化学知识点汇总(王镜岩版)————————————————————————————————作者:————————————————————————————————日期:生物化学讲义(2003)孟祥红绪论(preface)一、生物化学(biochemistry)的含义:生物化学可以认为是生命的化学(chemistryoflife)。
生物化学是用化学的理论和方法来研究生命现象。
1、生物体是有哪些物质组成的?它们的结构和性质如何?容易回答。
2、这些物质在生物体内发生什么变化?是怎样变化的?变化过程中能量是怎样转换的?(即这些物质在生物体内怎样进行物质代谢和能量代谢?)大部分已解决。
3、这些物质结构、代谢和生物功能及复杂的生命现象(如生长、生殖、遗传、运动等)之间有什么关系?最复杂。
二、生物化学的分类根据不同的研究对象:植物生化;动物生化;人体生化;微生物生化从不同的研究目的上分:临床生物化学;工业生物化学;病理生物化学;农业生物化学;生物物理化学等。
糖的生物化学、蛋白质化学、核酸化学、酶学、代谢调控等。
三、生物化学的发展史1、历史背景:从十八世下半叶开始,物理学、化学、生物学取得了一系列的重要的成果(1)化学方面法国化学家拉瓦锡推翻“燃素说”并认为动物呼吸是像蜡烛一样的燃烧,只是动物体内燃烧是缓慢不发光的燃烧——生物有氧化理论的雏形瑞典化学家舍勒——发现了柠檬酸、苹果酸是生物氧化的中间代谢产物,为三羧酸循环的发现提供了线索。
(2)物理学方面:原子论、x-射线的发现。
(3)生物学方面:《物种起源——进化论》发现。
2、生物化学的诞生:在19世纪末20世纪初,生物化学才成为一门独立的科学。
德国化学家李比希:1842年撰写的《有机化学在生理与病理学上的应用》一书中,首次提出了新陈代谢名词。
另一位是德国医生霍佩赛勒:1877年他第一次提出Biochemie这个名词英文译名是Biochemistry(orBiologicalchemistry)汉语翻译成生物化学。
第一章糖第一节概述一、糖的命名糖类是含多羟基的醛或酮类化合物,由碳氢氧三种元素组成的,其分子式通常以Cn(H2O)n 表示。
因为一些糖分子中氢和氧原子数之比往往是2:1,与水相同,过去误认为此类物质是碳与水的化合物,所以称为"碳水化合物"(Carbohydrate)。
实际上这一名称并不确切,如脱氧核糖、鼠李糖等糖类不符合通式,而甲醛、乙酸等虽符合这个通式但并不是糖。
只是"碳水化合物"沿用已久,一些较老的书仍采用。
我国将此类化合物统称为糖,而在英语中只将具有甜味的单糖和容易的寡糖称为糖(sugar)。
二、糖的分类按照分子的构成,糖可分为单糖、寡糖、多糖、结合糖和衍生糖。
1.单糖单糖是不能水解为更小分子的糖。
葡萄糖,果糖都是常见单糖。
按照羰基在分子中的位置,单糖可分为醛糖和酮糖。
按照碳原子数目,可分为丙糖,丁糖,戊糖,己糖和庚糖。
2.寡糖寡糖由2-6个单糖分子构成,其中以双糖最普遍。
寡糖和单糖都可溶于水,多数有甜味。
3.多糖多糖由多个单糖聚合而成,又可分为同聚多糖和杂聚多糖。
同聚多糖由同一种单糖构成,杂聚多糖由两种以上单糖构成。
4.结合糖糖链与蛋白质或脂类物质构成的复合分子称为结合糖。
其中的糖链普通是杂聚寡糖或杂聚多糖。
如糖蛋白,糖脂,蛋白聚糖等。
5.衍生糖由单糖衍生而来,如糖胺、糖醛酸等。
三、糖的分布与功能1.分布糖在生物界中分布很广,几乎所有的动物,植物,微生物体内都含有糖。
糖占植物干重的80%,微生物干重的10-30%,动物干重的2%。
糖在植物体内起着重要的结构作用,而动物则用蛋白质和脂类代替,所以行动更灵便,适应性强。
动物中惟独昆虫等少数采用多糖构成外骨胳,其形体大小受到很大限制。
在人体中,糖主要以三种形式存在:(1)以糖原形式贮藏在肝和肌肉中。
糖原代谢速度很快,对维持血糖浓度衡定,满意机体对糖的需求有重要意义。
(2)以葡萄糖形式存在于体液中。
细胞外液中的葡萄糖是糖的运输形式,它作为细胞的内环境条件之一,浓度相当衡定。
第一章蛋白质的结构与功能一、选择题(A型题)1.各种蛋白质平均含氮量约为( )A. 0.6%B. 6%C. 16%D. 26E. 36%2.关于蛋白质结构的下列描述,其中正确的是( )A.至少有100个以上的氨基酸组成的高分子化合物B.每一蛋白质都含有2条以上的多肽链C.每种蛋白质都有种类不同的辅基D.不同蛋白质分子的氨基酸组成基本相同E.组成蛋白质一级结构主键的是肽键3.蛋白质一级结构中的主要化学键是( )A. 氢键B. 盐键C. 肽键D. 疏水键E. 范德华引力4.蛋白质的等电点是()A.蛋白质溶液的pH等于7时溶液的pH值B.蛋白质溶液的pH等于7.4时溶液的pH值C.蛋白质分子呈正离子状态时溶液的pH值D.蛋白质分子呈负离子状态时溶液的pH值E.蛋白质的正电荷与负电荷相等时溶液的pH值5. 食物蛋白质的消化产物氨基酸,最主要的生理功能是()A.合成某些含氮化合物B.合成蛋白质C.氧化供能D.转变为糖E.转变为脂肪6.蛋白质变性不包括( )A.氢键断裂B.肽键断裂C.疏水键断裂D.盐键断裂E.二硫键断裂7.蛋白质分子中,生理条件下,下列那种氨基酸残基的侧链间可形成离子键:A.天冬氨酸,谷氨酸B.苯丙氨酸,酪氨酸C.赖氨酸,天冬氨酸D.天冬氨酸,苯丙氨酸E.亮氨酸,精氨酸8.蛋白质高级结构取决于( )A.蛋白质肽链中的氢键B.蛋白质肽链中的肽键C. 蛋白质肽链中的氨基酸残基组成和顺序D.蛋白质肽链中的肽键平面E.蛋白质肽链中的肽单位9.下列提法中错误者是()A.所有的蛋白质分子都具有一级结构B.蛋白质的二级结构是指多肽链的局部构象C.蛋白质的三级结构是整条肽链的空间结构D.所有的蛋白质分子都有四级结构E.蛋白质四级结构中亚基的种类和数量均不固定10.肽链中有下列哪种氨基酸时易发生β-转角( )A.HisB.AlaC.GluD.ProE.Arg11.蛋白质肽键的提法何者是正确的( )A.肽键是典型的单键B.肽键是典型的双键C.肽键带有部分双键的性质D.肽键平面可以扭转E.可由任何氨基和羧基缩合形成12.蛋白质在溶液中带负电荷时,溶液的PH为( )A.酸性B.碱性C.PH=PID.PH>PIE.PH<PI13.蛋白质一级结构的化学键主要是( )A.肽键B.盐键C.二硫键D.氢键E.疏水键14.蛋白质变性时( )A.肽键断裂B.二硫键断裂C.次级键断裂D.普遍发生沉淀E.生物学功能可能增减15.蛋白质对紫外光的最大吸收峰是由于含有下列哪些氨基酸所引起的( )A.甘氨酸和赖氨酸B.谷氨酸和精氨酸C.色氨酸和酪氨酸D.丝氨酸和胱氨酸E.丙氨酸和苏氨酸16.在下列各种pH的溶液中使清蛋白(等电点 4.7)带正电荷的是A. pH4.0B. pH5.0C. pH6.0D. pH7.0E. pH8.017.稳定蛋白质二级结构的化学键主要是( )A.肽键B.氢键C.疏水键D.二硫键E.范氏力18.在具有四级结构的蛋白质分子中,每个具有三级结构的多肽链是( )A.辅基B.辅酶C.亚基D.寡聚体E.肽单位19. 下列哪种氨基酸含有苯环( )A.PheB.ArgC.ThrD.AspE.His20. 下列哪种氨基酸属于碱性氨基酸( )A.精氨酸B.丙氨酸C.苏氨酸D.亮氨酸E.甘氨酸二、填空题1. 在镰刀状红细胞贫血中血红蛋白的β亚基的第六位___ _ 残基变异成 __ _。
(一)蛋白质的二级结构1、蛋白质主链骨架不同的多肽链,实际上就是a-碳原子上连接的侧链基团不同,如果去掉侧链基团,不同多肽链剩余的部分完全是一样的,称之为多肽链的主链骨架。
肽单位:主链骨架上的重复单位一个肽单位就是一个肽平面。
2`蛋白质二级结构的概念⏹蛋白质多肽链主链骨架在空中盘绕折叠的方式就是蛋白质的二级结构。
⏹即多肽链主链骨架的构象⏹以氢键维系以羰基氧与亚氨基氢形成氢键: -C=O - - - - H-N-3、决定主链骨架构象的因素(1)а-C原子的二面角与a-碳原子连接的两个单键旋转的角度。
(Φ:Cа-N单键旋转的角度;Ψ:Cа-C单键旋转的角度)Cа原子的二面角决定了相邻肽单位的空间位置。
(2)侧链基团的影响:⏹Cа的二面角所决定的构象能否存在,取决于两个相邻肽单位中非键合原子之间的接触距离。
⏹-R大小、极性、电荷。
二级结构的成因:(1) 肽键不能转动→肽平面(2) 一个氨基酸R 基团与前后R 基团的限制→肽平面不能任意转动(3) R 基团的大小、电荷限制→只做規律折叠→-α螺旋, -β折叠和-β转角(4) 稳定二结构的力:氢键4、几种典型的二级结构:(1)а-螺旋1951年Pauling and Corey 研究а-角蛋白时提出的。
蛋白质中含量最丰富、最常见的二级结构。
规律性构象。
а-螺旋结构要点:⏹主链骨架螺旋式盘绕。
螺旋上升一圈3.6个氨基酸残基,螺距0.54nm。
(0.15nm/aa;100º/ aa )⏹相邻螺圈间形成氢键。
氢键几乎与轴平行;氢键封闭的环包括13个原子(3.613螺旋);是由羰基氧与其后面第四个氨基酸残基的亚氨基氢形成。
⏹侧链基团伸向外侧。
侧链基团的大小和性质决定了а-螺旋能否形成和稳定性。
Pro是а-螺旋的最大破坏者;其次是Gly;极性基团连续存在时а-螺旋也不稳定。
⏹天然а-螺旋多为右旋。
(2)ß-片层结构(β-pleated sheet)⏹将α-螺旋沿长轴牵引伸展,这时,H键断裂,肽链可以较充分伸展,整个肽链形成一个锯齿状结构,几条肽链彼此平行,靠H键维系固定,就形成了片层结构⏹ß-折叠有两种形式:平行式:Φ=-119O Ψ=+113O反平行式:Φ=-139O Ψ=+135O是一种肽链相当伸展的结构。
教学目标:1.掌握蛋白质的概念、重要性和分子组成。
2.掌握α-氨基酸的结构通式和20种氨基酸的名称、符号、结构、分类;掌握氨基酸的重要性质;熟悉肽和活性肽的概念。
3.掌握蛋白质的一、二、三、四级结构的特点及其重要化学键。
4.了解蛋白质结构与功能间的关系。
5.熟悉蛋白质的重要性质和分类第一节蛋白质的分子组成一、蛋白质的元素(化学)组成主要有 C(50%~55%)、H(6%~7%)、O(19%~24%)、N(13%~19%)、S(0%~4%)。
有些蛋白质还含微量的P、Fe、Cu、Zn、Mn、Co、Mo、I等。
各种蛋白质的含氮量很接近,平均为16%。
因此,可以用定氮法来推算样品中蛋白质的大致含量。
每克样品含氮克数×6.25×100=100g样品中蛋白质含量(g%)二、蛋白质的基本组成单位——氨基酸蛋白质在酸、碱或蛋白酶的作用下,最终水解为游离氨基酸(amino acid),即蛋白质组成单体或构件分子。
存在于自然界中的氨基酸有300余种,但合成蛋白质的氨基酸仅20种(称编码氨基酸),最先发现的是天门冬氨酸(1806年),最后鉴定的是苏氨酸(1938年)。
(三)氨基酸的重要理化性质1.一般物理性质α-氨基酸为无色晶体,熔点一般在200 oC以上。
各种氨基酸在水中的溶解度差别很大(酪氨酸不溶于水)。
一般溶解于稀酸或稀碱,但不能溶解于有机溶剂,通常酒精能把氨基酸从其溶液中沉淀析出。
芳香族氨基酸(Tyr、Trp、Phe)有共轭双键,在近紫外区有光吸收能力,Tyr、Trp的吸收峰在280nm,Phe在265 nm。
由于大多数蛋白质含Tyr、Trp残基,所以测定蛋白质溶液280nm的光吸收值,是分析溶液中蛋白质含量的快速简便的方法。
2.两性解离和等电点(isoelectric point, pI)氨基酸在水溶液或晶体状态时以两性离子的形式存在,既可作为酸(质子供体),又可作为碱(质子受体)起作用,是两性电解质,其解离度与溶液的pH有关。
生物化学精要速览(希望对广大生化初学者有助)第一章绪论一、生物化学的的概念:生物化学(biochemistry)是利用化学的原理与方法去探讨生命的一门科学,它是介于化学、生物学及物理学之间的一门边缘学科。
二、生物化学的发展:1.叙述生物化学阶段:是生物化学发展的萌芽阶段,其主要的工作是分析和研究生物体的组成成分以及生物体的分泌物和排泄物。
2.动态生物化学阶段:是生物化学蓬勃发展的时期。
就在这一时期,人们基本上弄清了生物体内各种主要化学物质的代谢途径。
3.分子生物学阶段:这一阶段的主要研究工作就是探讨各种生物大分子的结构与其功能之间的关系。
三、生物化学研究的主要方面:1.生物体的物质组成:高等生物体主要由蛋白质、核酸、糖类、脂类以及水、无机盐等组成,此外还含有一些低分子物质。
2.物质代谢:物质代谢的基本过程主要包括三大步骤:消化、吸收→中间代谢→排泄。
其中,中间代谢过程是在细胞内进行的,最为复杂的化学变化过程,它包括合成代谢,分解代谢,物质互变,代谢调控,能量代谢几方面的内容。
3.细胞信号转导:细胞内存在多条信号转导途径,而这些途径之间通过一定的方式方式相互交织在一起,从而构成了非常复杂的信号转导网络,调控细胞的代谢、生理活动及生长分化。
4.生物分子的结构与功能:通过对生物大分子结构的理解,揭示结构与功能之间的关系。
5.遗传与繁殖:对生物体遗传与繁殖的分子机制的研究,也是现代生物化学与分子生物学研究的一个重要内容。
第二章蛋白质的结构与功能一、氨基酸:1.结构特点:氨基酸(amino acid)是蛋白质分子的基本组成单位。
构成天然蛋白质分子的氨基酸约有20种,除脯氨酸为α-亚氨基酸、甘氨酸不含手性碳原子外,其余氨基酸均为L-α-氨基酸。
2.分类:根据氨基酸的R基团的极性大小可将氨基酸分为四类:①非极性中性氨基酸(8种);②极性中性氨基酸(7种);③酸性氨基酸(Glu和Asp);④碱性氨基酸(Lys、Arg和His)。
生物化学知识点汇总(王镜岩版)————————————————————————————————作者:————————————————————————————————日期:生物化学讲义(2003)孟祥红绪论(preface)一、生物化学(biochemistry)的含义:生物化学可以认为是生命的化学(chemistryoflife)。
生物化学是用化学的理论和方法来研究生命现象。
1、生物体是有哪些物质组成的?它们的结构和性质如何?容易回答。
2、这些物质在生物体内发生什么变化?是怎样变化的?变化过程中能量是怎样转换的?(即这些物质在生物体内怎样进行物质代谢和能量代谢?)大部分已解决。
3、这些物质结构、代谢和生物功能及复杂的生命现象(如生长、生殖、遗传、运动等)之间有什么关系?最复杂。
二、生物化学的分类根据不同的研究对象:植物生化;动物生化;人体生化;微生物生化从不同的研究目的上分:临床生物化学;工业生物化学;病理生物化学;农业生物化学;生物物理化学等。
糖的生物化学、蛋白质化学、核酸化学、酶学、代谢调控等。
三、生物化学的发展史1、历史背景:从十八世下半叶开始,物理学、化学、生物学取得了一系列的重要的成果(1)化学方面法国化学家拉瓦锡推翻“燃素说”并认为动物呼吸是像蜡烛一样的燃烧,只是动物体内燃烧是缓慢不发光的燃烧——生物有氧化理论的雏形瑞典化学家舍勒——发现了柠檬酸、苹果酸是生物氧化的中间代谢产物,为三羧酸循环的发现提供了线索。
(2)物理学方面:原子论、x-射线的发现。
(3)生物学方面:《物种起源——进化论》发现。
2、生物化学的诞生:在19世纪末20世纪初,生物化学才成为一门独立的科学。
德国化学家李比希:1842年撰写的《有机化学在生理与病理学上的应用》一书中,首次提出了新陈代谢名词。
另一位是德国医生霍佩赛勒:1877年他第一次提出Biochemie这个名词英文译名是Biochemistry(orBiologicalchemistry)汉语翻译成生物化学。
3、生物化学的建立:从生物化发展历史来看,20世纪前半叶,在蛋白质、酶、维生素、激素、物质代谢及生物氧化方面有了长足进步。
成就主要集中于英、美、德等国。
英国,代表人物是霍普金斯——创立了普通生物化学学派。
1929年他和荷兰的艾克曼因发现维生素而获得诺贝尔生理和医学奖。
后来又发现了色氨酸和谷胱甘肽。
德国,在以下几个方面的成就:糖和嘌呤类物质、血红素、叶绿素、糖原——乳酸循环、维生素D、细胞呼吸等都荣获了诺贝尔化学和生理学。
美国,这一时期在留德的美国学者的推动下,他们在营养与卫生工作方面的研究较为突出。
4、发展中的生物化学从上世纪50年代至今,生物化学进入了飞速发展阶段。
A、主要成就有:2(1)酶的结晶:1926年Sumner发表了他第一次成功结晶了脲酶,随后Northrup制得了胃蛋白酶和胰蛋白酶结晶,开辟了酶学研究的新领域。
(2)代谢途径的阐明:30年代阐明了糖酵解途径;1937年Krebs发现三羧酸循环获1953年诺贝尔生理学或医学奖。
目前,糖、脂肪、蛋白质及氨基酸的代谢途径基本阐明。
当前努力的方向为代谢调控。
(3)生物能研究的发现:50年代以来阐明了:ATP是能量代谢能的产生和利用的关键化合物。
提出了氧化磷酸化和呼吸链的理论,建立了生物能学。
B、这个时期生物化学发展的几个特征:首先是物理学家、化学家以及遗传学家参加到生物化学的领域中来;其次是研究方法有突破性改进;通讯交流方面:各类科学期刊增多,以及计算机的存储、网络的普遍使用,使信息的传递变得更为方便快捷。
物理学家、化学家、遗传学家等参加了生物化学的领域中来:在蛋白质方面:两位英国物理学家将x-射线应用于蛋白质分子的高级结构研究,肯德鲁(Kendrew)测定了肌红蛋白的结构,(Perutz)佩鲁茨测定了血红蛋白的结构,二人于1962年分别分享诺贝尔化学奖。
目前x-射线衍射分析已成为蛋白质与核酸高级结构研究常规方法。
美国化学家鲍林(Pauling)确认氢键在蛋白质的结构以及大分子间的相互作用中的重要性;鲍林认为某些蛋白质具有类似于螺旋的结构。
这就是我们在蛋白质一章中将要学到的α-螺旋结构。
他还研究了镰刀形红细胞贫血病,并提出了分子病的名称,因此荣获诺贝尔化学奖。
Sanger――生物化学家1955年确定了牛胰岛素的结构,获1958年诺贝尔化学奖。
1980年设计出一种测定DNA内核苷酸排列顺序的方法,获1980年诺贝尔化学奖。
在核酸方面,最著名的莫过于DNA双螺旋结构的发现。
这一成果是物理学家、化学家和生物化学家共同智慧的结晶。
英国物理学家威尔金斯(Wilkins)1946年完成了DNAx-衍射研究。
1953年沃森与克里克在此基础上确定了DNA分子结构。
他们三人于1962年荣获了诺贝尔生理和医学奖。
由此我们可以得到一点启示:学科交叉是推动科学发展的动力之一。
加拿大细菌遗传学家艾弗里Avery与美国生物学家Macleod,Carty1944年在美国纽约洛克菲勒研究所著名实验做了著名的转化试验,证明遗传物质是DNA美国遗传学家麦克林托克以发现了可移动的基因获1958年诺贝尔生理奖。
Ochoa和Korngerg发现RNA和DNA生物合成机制获1959年诺贝尔生理奖。
1916年,Lwoff提出信使RNA的存在。
1960年,Jacob、Monod--阐明了基因控制酶的生物合成,从而调节细胞的方式。
3发现操纵子(Operon)基因,能影响mRNA的合成,从而调节其他基因的功能,在微生物界Operon 普遍存在。
以上三人共获1965年诺贝尔生理或医学奖。
(2)生物化学研究方法的改进:a.分配色谱方法的建立:马丁与辛格发明了可用于核苷酸、氨基酸、糖、生物碱等多种混合物分离的色谱方法。
这种方法已在化学、医学和生物学中得到了广泛的应用并取得了重要进展。
b.电泳法:在糖、蛋白质、核酸等物质的分析分离方面取得广泛应用c.离心法:在蛋白质、核酸的分离、分子量测定中有不可替代作用d.另外还有荧光分析法,同位素示踪和电镜等。
近年来新兴的生化仪器层出不穷,这里仅列出几例,如基因扩增仪,基因合成仪,基因序列分析仪、超过滤系统、高效层析系统、多肽序列分析、生物芯片、生物传感器等。
(3)生物化学在基础理论方面的发展——分子生物学的诞生:学术界普遍认为1953年DNA双螺旋结构的发现是分子生物学的开端从此人们开始在分子水平上分析纷繁复杂的生命现象。
分子生物学在近十年的发展非常迅速,只有计算机科学的发展速度能与之相比。
(4)生物化学在应用方面的发展——生物工程(生物技术)基因工程(遗传工程);蛋白质工程;酶工程;细胞工程;生化工程(5)生化研究的新领域:糖类生物化学;蛋白质化学—;信号传导机制四、中国对生物化学的贡献:吴宪:曾与美国哈佛医学院Folin一起首次用比色定量方法测定血糖。
吴宪与刘思职、万昕、陈同度、汪猷、张昌颖、杨恩孚、周启源等完成了蛋白质变性理论,血液的生物化学方法检查研究,免疫化学研究,素食营养研究,内分泌研究。
王应睐,邹承鲁,钮经文,邢其毅,曹天钦,王德宝,汪猷1987年又人工合成了具有生物活性的酵母丙胺酸转移RNA,从而使我国在核酸人工合成方面处于国际领先地位1.今后我们要在基础理论研究方面特别注意:生物大分子的结构与功能生物大分子之间相互作用分子遗传和遗传工程生物膜的结构与功能激素、活性多肽及其重要的活性小分子的结构与功能代谢调节与调控方面的研究另一方面我们应该注意研究工、医、农、国防等各方面急需解决的问题。
2.生物化学的应用工业领域的应用:食品工业;发酵工业及其抗生素制造业;酶制剂工业;饲料工业;生物制品工业;皮革工业等。
在农业领域的应用:如研究植物的新陈代谢的各种过程,便能够控制植物的发育明确糖类、脂类、蛋白质、维生素、生物碱、芳香油以其他的化合物在植物体内的合成规律,可获得大量优4质的各种作物。
植物新品种的培育,许多作物的遗传性状如:抗寒性、耐水性、抗病性的可以利用生化技术鉴定。
对合理贮藏食物原料、谷物、果实、蔬菜有很大意义。
提高肉类蛋白质的产量、牛乳分泌量、牛乳脂肪含量等方面有实际意义。
临床生化的诊断今天已经成为一种不可缺少的诊断的方法:如确定血糖浓度和糖韧量曲线才能确定糖尿病的诊断是否正确;血清中酸性磷酸酶的活力的测定可以诊断前列腺癌;碱性磷酸酶的产品可以诊断骨癌;血清和尿中淀粉酶的活力测定可以诊断急性胰腺炎。
生物化学对一般预防医学也很重要。
增进人体的健康是预防疾病的一种积极的因素。
如何给病人以适当营养从而增进人体健康是生化的另一个重要问题。
适当营养不仅可以预防,而且还可以治疗疾病。
第一章糖类化学第一节糖类化学概论一、糖类的概念与分类:㈠曾用的概念——碳水化合物:通式Cn(H2O)m误认为是碳与水的化合物,故称碳水化合物(carbohydrate)。
糖类的现代概念:糖类:鼠李糖(rhamnase)C6H10O5和脱氧核糖(deoxyribose)C5H10O4非糖的物质:甲醛CH2O、乳酸C3H6O3有些糖类化合物:除C、H、O外,还有N、S、P,多羟基的醛或酮及其缩聚物和某些衍生物的总称。
研究简史:十八世纪后半叶德国化学家E,Fisher提出投影式十九世纪二十年代中期C.S.Hudson建立了表示糖的结构、立体构形与光学性质关系的法则W.N.Hworth提出的糖的环状结构七十年代以后——糖类化合物研究的新局面:通过糖类的研究发现了许多新的生物合成反应与酶调节机理;认识许多基本的生命过程:如细胞环境、细胞识别、细胞生长与分化、免疫、先天缺陷遗传病、药物的作用等等;生物信息的携带者糖类化合物(多糖、寡糖)是第三(核酸、蛋白质)大重要的生物高分子化合物。
㈡糖类的分类1、单糖(monosaccharides)是最简单的糖,不能再被水解为最小的单位。
根据其所含碳原子(C)数目:丙糖、丁糖、戊糖(pentose)和已糖(hexose)等根据其羟基(-OH)又可以分为醛糖和酮糖2、寡糖(oligosaccharides)是有两到十分子的单糖缩合而成的,水解后产生单糖。
3、多糖(polysaccharides)是由多个单糖分子缩和而成的如按其组成:同多糖:相同的单糖组成;5杂多糖:不同的单糖基组成如按其分子有无支链:支链、直链多糖;如按其功能的不同:结构多糖、储存多糖、抗原多糖等;如按其分布:胞外多糖、胞内多糖、胞壁多糖之分。
4、结合糖:如果糖类化合物尚有非糖物质部分,则称为糖缀物和复合糖例如,糖肽、糖脂、糖蛋白等。
二、糖类分布及重要性:(一)分布:所有生物细胞质和细胞核内,含有戊糖植物界最多:约占干重的80%,动物:血液中含有葡萄糖、肝脏和肌肉中含有糖原、乳汁中含有乳糖微生物中:糖约占菌体干重的10-13%。