安徽安徽高中化学竞赛无机化学第十章氮族元素
- 格式:doc
- 大小:183.50 KB
- 文档页数:28

高中化学知识点规律大全——氮族元素1.氮和磷[氮族元素]包括氮(7N)、磷、(15P)、砷(33As)、锑(51Sb)、铋(83Bi)五种元素.氮族元素位于元素周期表中第V A族,其代表元素为氮和磷.[氮族元素的原子结构](1)相似性:①最外层电子数均为5个;②主要化合价:氮有-3、+1、+2、+3、+4、+5价;磷和砷有-3、+3、+5价;锑、铋有+3、+5价.(2)递变规律:按氮、磷、砷、锑、铋的顺序,随着核电荷数的增加,电子层数增多,原子半径增大,失电子能力增强,得电子能力减弱,非金属性减弱,金属性增强.在氮族元素的单质中,氮、磷具有较明显的非金属性;砷虽然是非金属,但有一些金属性;锑、铋为金属.[氮族元素单质的物理性质]N2P As Sb Bi颜色无色白磷:白色或黄色红磷:红棕色灰砷:灰色银白色银白色或微显红色状态气体固体固体固体固体密度逐渐增大熔点、沸点先按N2、P、As的顺序逐渐升高,而后按Sb、Bi的顺序逐渐降低[氮气](1)氮元素在自然界中的存在形式:既有游离态又有化合态.空气中含N2 78%(体积分数)或75%(质量分数);化合态氮存在于多种无机物和有机物中,氮元素是构成蛋白质和核酸不可缺少的元素.(2)氮气的物理性质:纯净的氮气是无色气体,密度比空气略小.氮气在水中的溶解度很小.在常压下,经降温后,氮气变成无色液体,再变成雪花状固体.(3)氮气的分子结构:氮分子(N2)的电子式为,结构式为N≡N.由于N2分子中的N≡N键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼.(4)氮气的化学性质:①N2与H2化合生成NH3N2 +3H22NH3说明该反应是一个可逆反应,是工业合成氨的原理.②N2与O2化合生成NO:N2 + O22NO说明在闪电或行驶的汽车引擎中会发生以上反应.(5)氮气的用途:①合成氨,制硝酸;②代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;⑧在灯泡中填充氮气以防止钨丝被氧化或挥发;④保存粮食、水果等食品,以防止腐烂;⑤医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术;⑥利用液氮制造低温环境,使某些超导材料获得超导性能.[NO、NO2性质的比较]氮的氧化物一氧化氮(NO) 二氧化氮(NO2)物理性质为无色、不溶于水、有毒的气体为红棕色、有刺激性气味、有毒的气体,易溶于水化学性质①极易被空气中的O2氧化:2NO + O2= 2NO2②NO中的氮为+2价,处于中间价态,既有氧化性又有还原性与H2O反应:3NO2 + H2O=2HNO3 + NO(工业制HNO3原理.在此反应中,NO2同时作氧化剂和还原剂)[自然界中硝酸盐的形成过程](1)电闪雷鸣时:N2+O22NO(2) 2NO + O2= 2NO2(3)下雨时:3NO2 + H2O=2HNO3 + NO(4)生成的硝酸随雨水淋洒到土壤中,并与土壤中的矿物作用生成能被植物吸收的硝酸盐.[光化学烟雾]NO、NO2有毒,是大气的污染物.空气中的NO、NO2污染物主要来自于石油产品和煤燃烧的产物、汽车尾气以及制硝酸工厂的废气.NO2在紫外线照射下,发生一系列光化学反应,产生一种有毒的烟雾——光化学烟雾.因此,NO2是造成光化学烟雾的主要因素.光化学烟雾刺激呼吸器官,使人生病甚至死亡.[磷](1)磷元素在自然界中的存在形式:自然界中无游离态的磷.化合态的磷主要以磷酸盐的形式存在于矿石中.动物的骨骼、牙齿和神经组织,植物的果实和幼芽,生物的细胞里都含有磷.(2)单质磷的化学性质:①与O2反应:4P+5O 22P2O5②磷在C12中燃烧:2P+3C12(不足量) 2PCl32P+5Cl2(足量) 2PCl5[磷的同素异形体——白磷与红磷]磷的同素异形体白磷红磷说明物理性质颜色、状态无色蜡状固体红棕色粉末①白磷与红磷的结构不同是物理性质存在差别的原因②由两者物理性质的不同,证明了白磷与红磷是不同的单质密度(g·cm-3)1.822.34溶解性不溶于水,溶于CS2不溶于水,也不溶于CS2毒性剧毒无毒着火点40℃(白磷受到轻微的摩擦就会燃烧;常温时,白磷可被氧化而发光)240℃化学性质白磷、红磷在空气中燃烧,都生成白色的P2O5白磷与红磷燃烧都生成P2O5,证明它们都是由磷元素形成的单质相互转化白磷红磷证明白磷与红磷所含元素相同——互为同素异形体保存方法密封保存,少量白磷保存在水中密封保存,防止吸湿切削白磷应在水中进行用途制造高纯度磷酸;制造燃烧弹、烟幕弹制造高纯度磷酸;制农药、安全火柴[五氧化二磷、磷酸](1)五氧化二磷的性质:五氧化二磷是白色粉末状固体,极易吸水(因此可作酸性气体的干燥剂).P2O5是酸性氧化物,与水反应:P2O5+3H2O2H3PO4(2)磷酸的性质、用途:磷酸(H3PO4)是一种中等强度的三元酸,具有酸的通性.磷酸主要用于制造磷肥,也用于食品、纺织等工业.[氮、磷元素及其单质、化合物性质的比较]元素氮(N)磷(P)自然界中存在的形式游离态和化合态只有化合态单质与O2化合的情况N2+O22NO(易)4P+5O22P2O5(难)单质与H2化合的情况N2 +3H22NH32P(蒸汽) + 3H22PH3单质的化学活泼性及原因单质活泼性:N2<P原因:N2分子中N≡N键很牢固,故N2性质稳定、不活泼氢化物的稳定性NH3>PH3最高价氧化物对应水化物的酸性HNO3>H3PO4非金属性N>P2.铵盐 [氨](1)氨的物理性质:①氨是无色、有刺激性气味的气体,比空气轻;②氨易液化.在常压下冷却或常温下加压,气态氨转化为无色的液态氨,同时放出大量热.液态氨气化时要吸收大量的热,使周围的温度急剧下降;③氨气极易溶于水.在常温、常压下,1体积水中能溶解约700体积的氨气(因此,氨气可进行喷泉实验);④氨对人的眼、鼻、喉等粘膜有刺激作用.若不慎接触过多的氨而出现病症,要及时吸入新鲜空气和水蒸气,并用大量水冲洗眼睛.(2)氨分子的结构:NH 3的电子式为,结构式为,氨分子的结构为三角锥形,N 原子位于锥顶,三个H 原子位于锥底,键角107°18′,是极性分子. (3)氨的化学性质:①跟水反应.氨气溶于水时(氨气的水溶液叫氨水),大部分的NH 3分子与H 2O 分子结合成NH 3·H 2O(叫一水合氨).NH 3·H 2O 为弱电解质,只能部分电离成NH 4+和OH -:NH 3 + H 2O NH 3·H 2O NH 4+ + OH -a .氨水的性质:氨水具有弱碱性,使无色酚酞试液变为浅红色,使红色石蕊试液变为蓝色.氨水的浓度越大,密度反而越小(是一种特殊情况).NH 3·H 2O 不稳定,故加热氨水时有氨气逸出:NH 4++ OH -NH 3↑+ H 2Ob .氨水的组成:氨水是混合物(液氨是纯净物),其中含有3种分子(NH 3、NH 3·H 2O 、H 2O)和3种离子(NH 4+和OH -、极少量的H +).c .氨水的保存方法:氨水对许多金属有腐蚀作用,所以不能用金属容器盛装氨水.通常把氨水盛装在玻璃容器、橡皮袋、陶瓷坛或内涂沥青的铁桶里.d .有关氨水浓度的计算:氨水虽然大部分以NH 3·H 2O 形式存在,但计算时仍以NH 3作溶质. ②跟氯化氢气体的反应:NH 3 + HCl = NH 4C1说明 a .当蘸有浓氨水的玻璃棒与蘸有浓盐酸的玻璃棒靠近时,产生大量白烟.这种白烟是氨水中挥发出来的NH 3与盐酸挥发出来的HCl 化合生成的NH 4C1晶体小颗粒.b .氨气与挥发性酸(浓盐酸、浓硝酸等)相遇,因反应生成微小的铵盐晶体而冒白烟,这是检验氨气的方法之—.c .氨气与不挥发性酸(如H 2SO 4、H 3PO 4等)反应时,无白烟生成.③跟氧气反应: 4NH 3 + 5O 2 4NO + 6H 2O说明 这一反应叫做氨的催化氧化(或叫接触氧化),是工业上制硝酸的反应原理之一. (4)氨气的用途:①是氮肥工业及制造硝酸、铵盐、纯碱的原料;②是有机合成工业如合成纤维、塑料、染料、尿素等的常用原料;③用作冰机中的致冷剂.[铵盐]铵盐是由铵离子(NH 4+)和酸根阴离子组成的化合物.铵盐都是白色晶体,都易溶于水. (1)铵盐的化学性质:①受热分解.固态铵盐受热都易分解.根据组成铵盐的酸根阴离子对应的酸的性质的不同,铵盐分解时有以下三种情况:a .组成铵盐的酸根阴离子对应的酸是非氧化性的挥发性酸时,则加热时酸与氨气同时挥发,冷却时又重新化合生成铵盐。


氮族元素【知识归纳】 一.氮族元素概况1.概况:N 2是一种无色无味的气体,密度比空气略小,不溶于水。
分子结构式为__ N ≡N ,该化学键很牢固,键能很大,难以破坏,所以通常情况下氮气性质__很稳定 。
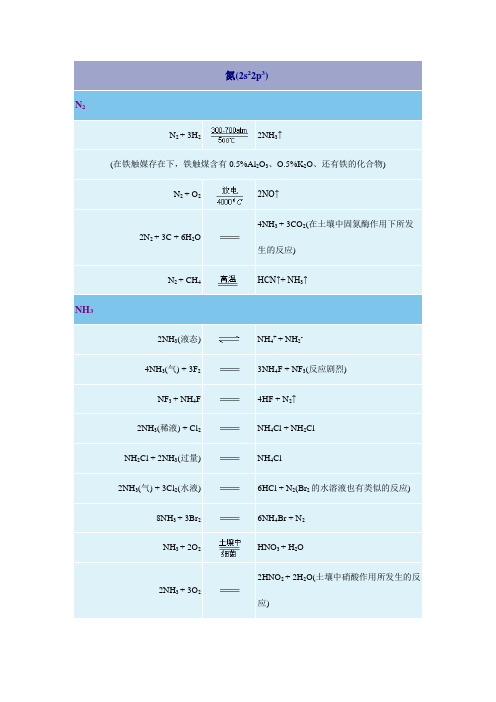
2.化学性质:(1)工业合成氨的反应方程式:(2)高温或闪电时与O 2的反应的反应方程式:________________________ (3)点燃时与金属Mg(或Ca, Sr, Ba)的反应方程式:___________________以上反应均为__氮的固定,即将空气中_游离_态的氮气转化为化合态的氮。
三.氮的氧化物:N 2O 、(笑气 麻醉剂)NO 、N 2O 3、NO 2、N 2O 4、N 2O 5注意:N 2O 3是 HNO 2 酸酐;N 2O 5是 HNO 3 酸酐。
其它的氧化物都不是酸酐。
N 2 + 3H 22N H 3N 2+O 2 2NO高温或闪电3M g +N 2M g 3N 2点燃)3Cu(NO注意:2NO 2N2O4(通常情况下NO2气体不是纯净物)2.如何鉴别一瓶红棕色气体是二氧化氮或溴蒸气?(找出尽可能多的方法)①AgNO3 :加入少量硝酸银溶液振荡,若有浅黄色沉淀生成,是溴蒸气,若无浅黄色沉淀生成,是二氧化氮。
(二者的共同现象是红棕色消失)② H2O:加入少量的水后振荡,若红棕色消失,是二氧化氮,若红棕色不消失,是溴蒸气。
③CCl4:加入少量CCl4后振荡,若红棕色消失且CCl4由无色变为橙红色,是溴蒸气。
若红棕色不消失,是二氧化氮。
④降温:冷凝成红棕色液体的是溴蒸气,颜色变浅的是NO2。
不能用湿润的淀粉—KI试纸鉴别二者四.氨气1.概况:氨是一种无色,有刺激性气味的气体,易液化形成液氨,极易溶于水,2.性质:(1)氨水显弱碱性,在溶液中存在如下转化(方程式表示) NH3+H2O NH3·H2O NH4+ +OH—。
氨水密度小于水的密度,所以氨水的浓度越大,密度越小。





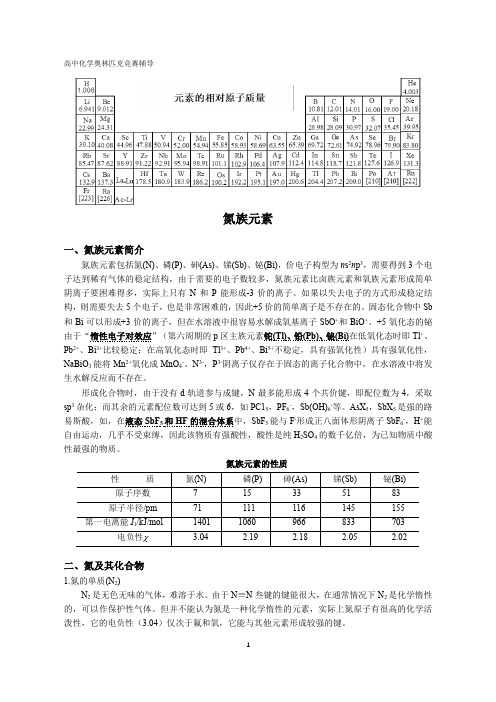
高中化学奥林匹克竞赛辅导氮族元素一、氮族元素简介氮族元素包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi),价电子构型为n s2n p3,需要得到3个电子达到稀有气体的稳定结构,由于需要的电子数较多,氮族元素比卤族元素和氧族元素形成简单阴离子要困难得多,实际上只有N和P能形成-3价的离子。
如果以失去电子的方式形成稳定结构,则需要失去5个电子,也是非常困难的,因此+5价的简单离子是不存在的。
固态化合物中Sb 和Bi可以形成+3价的离子,但在水溶液中很容易水解成氧基离子SbO+和BiO+。
+5氧化态的铋由于“惰性电子对效应”(第六周期的p区主族元素铊(Tl)、铅(Pb)、铋(Bi)在低氧化态时即Tl+、Pb2+、Bi3+比较稳定;在高氧化态时即Tl3+、Pb4+、Bi5+不稳定,具有强氧化性)具有强氧化性,NaBiO3能将Mn2+氧化成MnO4-。
N3-,P3-阴离子仅存在于固态的离子化合物中,在水溶液中将发生水解反应而不存在。
形成化合物时,由于没有d轨道参与成键,N最多能形成4个共价键,即配位数为4,采取sp3杂化;而其余的元素配位数可达到5或6,如PC15,PF6-,Sb(OH)6-等。
AsX5,SbX5是强的路易斯酸,如,在液态SbF5和HF的混合体系中,SbF5能与F-形成正八面体形阴离子SbF6-,H+能自由运动,几乎不受束缚,因此该物质有强酸性,酸性是纯H2SO4的数千亿倍,为已知物质中酸性最强的物质。
氮族元素的性质二、氮及其化合物1.氮的单质(N2)N2是无色无味的气体,难溶于水。
由于N≡N叁键的键能很大,在通常情况下N2是化学惰性的,可以作保护性气体。
但并不能认为氮是一种化学惰性的元素,实际上氮原子有很高的化学活泼性,它的电负性(3.04)仅次于氟和氧,它能与其他元素形成较强的键。
Mg在氮气中能燃烧生成Mg3N2(微黄色粉末):3Mg+N2Mg3N2,Mg3N2水解生成氢氧化镁和氨气:Mg3N2+6H2O=3Mg(OH)2+2NH3↑。
氮族元素及其化合物1.氮和磷[氮族元素]包括氮(7N)、磷、(15P)、砷(33As)、锑(51Sb)、铋(83Bi)五种元素.氮族元素位于元素周期表中第VA族,其代表元素为氮和磷.[氮族元素的原子结构](1)相似性:①最外层电子数均为5个;②主要化合价:氮有-3、+1、+2、+3、+4、+5价;磷和砷有-3、+3、+5价;锑、铋有+3、+5价.(2)递变规律:按氮、磷、砷、锑、铋的顺序,随着核电荷数的增加,电子层数增多,原子半径增大,失电子能力增强,得电子能力减弱,非金属性减弱,金属性增强.在氮族元素的单质中,氮、磷具有较明显的非金属性;砷虽然是非金属,但有一些金属性;锑、铋为金属.[氮族元素单质的物理性质]N2P As Sb Bi颜色无色白磷:白色或黄色红磷:红棕色灰砷:灰色银白色银白色或微显红色状态气体固体固体固体固体密度逐渐增大熔点、沸点先按N2、P、As的顺序逐渐升高,而后按Sb、Bi的顺序逐渐降低[氮气](1)氮元素在自然界中的存在形式:既有游离态又有化合态.空气中含N278%(体积分数)或75%(质量分数);化合态氮存在于多种无机物和有机物中,氮元素是构成蛋白质和核酸不可缺少的元素.(2)氮气的物理性质:纯净的氮气是无色气体,密度比空气略小.氮气在水中的溶解度很小.在常压下,经降温后,氮气变成无色液体,再变成雪花状固体.(3)氮气的分子结构:氮分子(N2)的电子式为,结构式为N≡N.由于N2分子中的N≡N键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼.(4)氮气的化学性质:①N2与H2化合生成NH3N2 +3H22NH3说明该反应是一个可逆反应,是工业合成氨的原理.②N2与O2化合生成NO:N2 + O22NO说明在闪电或行驶的汽车引擎中会发生以上反应.(5)氮气的用途:①合成氨,制硝酸;②代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;⑧在灯泡中填充氮气以防止钨丝被氧化或挥发;④保存粮食、水果等食品,以防止腐烂;⑤医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术;⑥利用液氮制造低温环境,使某些超导材料获得超导性能.[NO、NO2性质的比较]氮的氧化物一氧化氮(NO) 二氧化氮(NO2)物理性质为无色、不溶于水、有毒的气体为红棕色、有刺激性气味、有毒的气体,易溶于水化学性质①极易被空气中的O2氧化:2NO + O2= 2NO2②NO中的氮为+2价,处于中间价态,既有氧化性又有还原性与H2O反应:3NO2 + H2O=2HNO3 + NO(工业制HNO 3原理.在此反应中,NO2同时作氧化剂和还原剂)[自然界中硝酸盐的形成过程](1)电闪雷鸣时:N2+O22NO (2) 2NO + O2= 2NO2(3)下雨时:3NO2 + H2O=2HNO3 + NO(4)生成的硝酸随雨水淋洒到土壤中,并与土壤中的矿物作用生成能被植物吸收的硝酸盐.[光化学烟雾]NO、NO2有毒,是大气的污染物.空气中的NO、NO2污染物主要来自于石油产品和煤燃烧的产物、汽车尾气以及制硝酸工厂的废气.NO2在紫外线照射下,发生一系列光化学反应,产生一种有毒的烟雾——光化学烟雾.因此,NO2是造成光化学烟雾的主要因素.光化学烟雾刺激呼吸器官,使人生病甚至死亡.[磷](1)磷元素在自然界中的存在形式:自然界中无游离态的磷.化合态的磷主要以磷酸盐的形式存在于矿石中.动物的骨骼、牙齿和神经组织,植物的果实和幼芽,生物的细胞里都含有磷.(2)单质磷的化学性质:①与O2反应:4P+5O22P2O5②磷在C12中燃烧:2P+3C12(不足量) 2PCl32P+5Cl2(足量) 2PCl5[磷的同素异形体——白磷与红磷]磷的同素异形体白磷红磷说明物理性质颜色、状态无色蜡状固体红棕色粉末①白磷与红磷的结构不同是物理性质存在差别的原因②由两者物理性质的不同,证明了白磷与红磷是不同的单质密度(g·cm-3)1.822.34溶解性不溶于水,溶于CS2不溶于水,也不溶于CS2毒性剧毒无毒着火点40℃(白磷受到轻微的摩擦就会燃烧;常温时,白磷可被氧化而发光)240℃化学性质白磷、红磷在空气中燃烧,都生成白色的P2O5白磷与红磷燃烧都生成P2O5,证明它们都是由磷元素形成的单质相互转化白磷红磷证明白磷与红磷所含元素相同——互为同素异形体保存方法密封保存,少量白磷保存在水中密封保存,防止吸湿切削白磷应在水中进行用途制造高纯度磷酸;制造燃烧弹、烟幕弹制造高纯度磷酸;制农药、安全火柴[五氧化二磷、磷酸](1)五氧化二磷的性质:五氧化二磷是白色粉末状固体,极易吸水(因此可作酸性气体的干燥剂).P2O5是酸性氧化物,与水反应:P2O5+3H2O2H3PO4(2)磷酸的性质、用途:磷酸(H3PO4)是一种中等强度的三元酸,具有酸的通性.磷酸主要用于制造磷肥,也用于食品、纺织等工业.[氮、磷元素及其单质、化合物性质的比较]元素氮(N)磷(P)自然界中存在的形式游离态和化合态只有化合态单质与O2化合的情况N2+O22NO(易)4P+5O22P2O5(难)单质与H2化合的情况N2 +3H22NH32P(蒸汽) + 3H22PH3单质的化学活泼性及原因单质活泼性:N2<P原因:N2分子中N≡N键很牢固,故N2性质稳定、不活泼氢化物的稳定性NH3>PH3最高价氧化物对应水化物的酸性HNO3>H3PO4非金属性N>P2.铵盐[氨](1)氨的物理性质:①氨是无色、有刺激性气味的气体,比空气轻;②氨易液化.在常压下冷却或常温下加压,气态氨转化为无色的液态氨,同时放出大量热.液态氨气化时要吸收大量的热,使周围的温度急剧下降;③氨气极易溶于水.在常温、常压下,1体积水中能溶解约700体积的氨气(因此,氨气可进行喷泉实验);④氨对人的眼、鼻、喉等粘膜有刺激作用.若不慎接触过多的氨而出现病症,要及时吸入新鲜空气和水蒸气,并用大量水冲洗眼睛.(2)氨分子的结构:NH3的电子式为,结构式为,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子.(3)氨的化学性质:①跟水反应.氨气溶于水时(氨气的水溶液叫氨水),大部分的NH3分子与H2O分子结合成NH3·H2O(叫一水合氨).NH3·H2O为弱电解质,只能部分电离成NH4+和OH-:NH3 + H2O NH3·H2O NH4++ OH-a.氨水的性质:氨水具有弱碱性,使无色酚酞试液变为浅红色,使红色石蕊试液变为蓝色.氨水的浓度越大,密度反而越小(是一种特殊情况).NH3·H2O不稳定,故加热氨水时有氨气逸出:NH4++ OH-NH3↑+ H2Ob.氨水的组成:氨水是混合物(液氨是纯净物),其中含有3种分子(NH3、NH3·H2O、H2O)和3种离子(NH4+和OH-、极少量的H+).c.氨水的保存方法:氨水对许多金属有腐蚀作用,所以不能用金属容器盛装氨水.通常把氨水盛装在玻璃容器、橡皮袋、陶瓷坛或内涂沥青的铁桶里.d.有关氨水浓度的计算:氨水虽然大部分以NH3·H2O形式存在,但计算时仍以NH3作溶质.②跟氯化氢气体的反应:NH3 + HCl =NH4C1说明a.当蘸有浓氨水的玻璃棒与蘸有浓盐酸的玻璃棒靠近时,产生大量白烟.这种白烟是氨水中挥发出来的NH3与盐酸挥发出来的HCl化合生成的NH4C1晶体小颗粒.b.氨气与挥发性酸(浓盐酸、浓硝酸等)相遇,因反应生成微小的铵盐晶体而冒白烟,这是检验氨气的方法之—.c.氨气与不挥发性酸(如H2SO4、H3PO4等)反应时,无白烟生成.③跟氧气反应:4NH3 + 5O24NO + 6H2O说明 这一反应叫做氨的催化氧化(或叫接触氧化),是工业上制硝酸的反应原理之一. (4)氨气的用途:①是氮肥工业及制造硝酸、铵盐、纯碱的原料;②是有机合成工业如合成纤维、塑料、染料、尿素等的常用原料;③用作冰机中的致冷剂. [铵盐]铵盐是由铵离子(NH 4+)和酸根阴离子组成的化合物.铵盐都是白色晶体,都易溶于水. (1)铵盐的化学性质:①受热分解.固态铵盐受热都易分解.根据组成铵盐的酸根阴离子对应的酸的性质的不同,铵盐分解时有以下三种情况:a .组成铵盐的酸根阴离子对应的酸是非氧化性的挥发性酸时,则加热时酸与氨气同时挥发,冷却时又重新化合生成铵盐。

安徽安徽高中化学竞赛无机化学第九章氧族元素9. 1. 01 氧气的生产和制备:工业上制取 O2 的方法是分馏液化空气。
因为N2 的沸点为77 K ,O 2 的为90 K ,沸点之差专门大,足以分馏将两者分离。
实验室中一样采纳加热分解含氧化合物的方法制O2,例如: 2 BaO2 ====== 2 BaO + O2↑2 NaNO3 ====== 2 NaNO2 + O2↑其中最常用的是MnO2催化分解 KClO3。
9. 1. 02 氧气的物理性质:常温下,O2无色无味无臭。
O2 分子为非极性分子,故在H2O 中溶解度专门小。
O2 90 K 液化成为淡蓝色液体;54 K 凝固成为淡蓝色固体。
9. 1. 03 氧气的物理性质:O2能够与大多数单质直截了当化合,不管金属依旧非金属。
如: 3 Fe + 2 O2 ======== Fe3O42 H2 + O2 ======== 2 H2O O2与大多数非金属氢化物反应:2 H2S + O2 ======== 2 S + 2 H2O2 H2S +3 O2 ======== 2 SO2 + 2 H2O4 NH3 + 3 O2 ======== 2 N2 + 6 H2OO2能够与硫化物、低氧化数的氧化物反应,如:4 FeS2 + 11O2 ======== 8SO2 + 2 Fe2O3 2 CO + O2 ======= 2 CO29. 1. 04 氧化物的酸碱性规律:同周期元素的最高氧化数氧化物从左向右酸性增强,以第三周期为例: 氧化物 Na2O MgO Al2O3 SiO2 P2O5 SO3 C l2O7 △△ 点燃 点燃 点燃点燃 点燃 点燃高温性质 碱性 碱性 两性 酸性 酸性 酸性 酸性同主族相同氧化数的氧化物从上到下碱性增强,以V A 族为例: 氧化物 N2O3 P2O3 As2O3 Sb2O3 Bi2O3性质 酸性 酸性 两性 两性 碱性同一元素的多种氧化物,其中氧化数高的酸性强,以Mn 元素为例: 氧化物 MnO MnO2 MnO3 Mn2O7性质 碱性 两性 酸性 酸性9. 1. 05 氧化物的酸碱性分类:绝大多数非金属氧化物属于酸性氧化物。
安徽安徽高中化学竞赛无机化学第十章氮族元素10. 1. 01 氮气的性质:N2 是空气的重要成分之一,它无色无臭无毒,在水中溶解度小。
N2 是已知的最稳固的双原子分子之一。
常温下 N2 专门稳固,高温下能够与一些金属及非金属反应。
在一定温度、压力和催化剂条件下,N2 能够与H2直截了当化合: N2 + 3 H2 ======== 2 NH3在放电条件下 N2 能够与 O2 直截了当化合:N2 + O2 ======= 2 NO高温下,N2 能够与 Mg ,Ca ,Sr ,Ba 等碱金属反应,例如: 3 Ca + N2 ======= Ca3N2N2 与 Li 反应最容易,250℃ 时差不多专门快。
10. 1. 02 氮气的生产与制备:工业上,分馏液态空气制 N2。
制取高纯 N2,需将N2 通过灼热的铜网以除去 O2,再通过 P2O5 干燥剂除去 H2O ,之后储入钢瓶。
实验室中制 N2,一样采纳加热分解亚硝酸铵溶液的方法: NH4NO2(aq ) ====== 2 H2O + N2↑也能够加热分解其他氧化性酸的铵盐,反应过程中铵盐被酸根氧化,例如:(NH4)2Cr2O7(s ) ======= Cr2O3 + 4 H2O + N2↑10. 1. 03 储气钢瓶的标识:储氯钢瓶黄绿色,白字;储氧钢瓶为天蓝色,黑字;储氮钢瓶为黑色,黄字。
10. 1. 04 氨分子的构型及氨的物理性质:NH3分子的构型为三角锥形,N 原子具有一对孤对电子。
氨气 -33.3 ℃ 液化,液氨是典型的非水溶剂。
-77.7 ℃ 氨变成固体。
10. 1. 05 氨的络合反应:高温、高压 催化剂NH3分子中有一对孤电子对,属于路易斯碱,可与许多路易斯酸结合成配位单元。
NH3 溶于水中形成氨水,即水合氨分子 NH3•H2O 。
氨水部分解离: NH3•H2O NH4+ + OH - Kb = 1.8 ´ 10-5 其中的 NH4+ 确实是 NH3 与 H+ 结合成的配位单元。
AgCl 沉淀能够溶于氨水,是因为NH3 与 Ag+ 结合成可溶性配位单元:AgCl + 2 NH3 ==== [ Ag (NH3)2 ]+ + Cl -10. 1. 06 氨的还原性:NH3 中 N 的氧化数为 -3,属于最低氧化态,因此氨气能够被氧化剂氧化。
例如:4 NH3 + 3 O2(纯)======= 2 N2 + 6 H2O4 NH3 +5 O2 ======= 4 NO +6 H2O2 NH3 + 3 CuO ======== N2 + 3 Cu + 3 H2O氨水也有还原性,例如向其中通入Cl2时发生如下反应:2 NH3 + 3 Cl2 ===== N2 + 6 HCl若NH3 过量,产物中会有 NH4+。
又如:NH3 + HNO2 ===== N2 + 2 H2O10. 1. 07 氨的取代反应:NH3 中的 H 可被依次取代,生成氨基 H2N -,亚氨基 HN 和氮化物等衍生物。
液氨与金属Na 反应生成 NaNH2 ,是典型的取代反应:2 Na + 2 NH3(l ) ===== 2 NaNH2 + H2↑NH3与金属Mg 在900℃下能够发生取代反应制取氮化镁:3 Mg + 2 NH3 ======= Mg3N2 + 3 H2银氨溶液中存在 [ Ag (NH3)2 ] +,Ag+ 和 NH3,久置时Ag+ 与 NH3会因发生取代反应,导致一系列容易爆炸的物质生成:Ag+ + NH3 → AgNH2 → Ag2NH → Ag3N故实验剩余的银氨溶液,要及时处理,不宜长期放置。
高温 高温10. 1. 08 氨解反应:氨的自耦解离反应为2 NH3 NH4+ + NH2-生成的氨基、铵根可分别与其他化合物的原子或基团结合,发生氨解反应。
氨解反应和水解反应类似,例如HgCl2与氨水反应生成白色的氨基氯化汞沉淀:HgCl2 + 2 NH3 ==== Hg(NH2)Cl↓+ NH4ClCOCl2 是碳酸的衍生物碳酰氯,俗称光气,它与液氨发生下面的氨解反应:COCl2 + 4 NH3(l)====== + 2 NH4Cl产物之一为碳酰胺,俗称尿素,这是一种化学肥料。
10. 1. 09 铵盐的热分解反应:铵盐不稳固,易分解成氨气和相应的酸,事实上质是质子转移反应,例如:(NH4)3PO4 ======= 3 NH3↑+ H3PO4NH4HCO3 ======= NH3↑+ CO2↑+ H2O酸越弱,酸根越容易与H+ 结合,其铵盐越容易分解。
氧化性酸的铵盐,分解产物中的NH3 可能被氧化,例如:NH4NO3 ===== N2O↑+ 2 H2O10. 1. 10 氨的生产与制备:工业上生产NH3,一样采纳H2与N2直截了当化合的方法。
低温反应专门慢,要在高温下进行。
然而那个化合反应放热,高温下平稳向NH3的分解方向移动,阻碍产率。
因此要选用适当的催化剂,以提高反应速率。
实验室制取NH3的反应为:2 NH4Cl + Ca(OH)2 ======= CaCl2 + 2 H2O + 2 NH3↑氮化物水解也能够得到NH3,如:Ca3N2 + 6 H2O ===== 3 Ca(OH)2 + 2 NH3↑10. 1. 11 联氨、羟氨和叠氮化氢的分子结构及物理性质:联氨又叫做肼(音jǐng),分子式为N2H4。
N2H4 能够看成是NH3中的一个H 被-NH2 取代,两个N 原子之间直截了当成N-N 单键,键长约为147 pm。
纯的N2H4为无色液体,熔点1.5 ℃,沸点113.6 ℃。
N2H4分子的极性专门大,偶极矩μ= 1.75 D,与水能够任意比例互溶。
纯羟氨NH2OH是白色固体,又叫做胲(音hǎi)。
羟氨NH2OH 能够看成是NH3 中的一个H 被-OH 取代。
NH2OH 中N 的氧化数为-1。
叠氮化氢HN3是一种无色液体,分子中的3个N 原子几乎成一直线,其一端与H相连的N原子sp2 杂化,键角∠HNN为109°12′。
10. 1. 12 联氨的弱碱性:N2H4是一种二元弱碱,其碱性比NH3 略弱。
显碱性的机理与NH3 类似:N2H4 + H2O N2H5+ + OH-K1 = 8.7 ´1 0-7N2H4可与强酸成盐,如N2H5Cl 即N2H4•HCl;N2H6SO4 即N2 H4•H2SO4。
10. 1. 13 联氨的还原性:N2H4 中N 的氧化数为-2。
酸中的电极电势如下N2H5+ / NH4+ E ⊖= + 1.28 V,N2 / N2H5+ E ⊖= -0.23 V从氧化数和电极电势看,N2H4既有氧化性又有还原性。
但N2H4作氧化剂,反应都专门慢,以致于没有实际意义。
故N2H4只是一种好的还原剂,其反应如:N2H4 + 2 H2O2 ===== N2↑+ 4 H2ON2H4 + 4 AgBr ===== N2↑+ 4 Ag + 4 HBrN2H4在空气中燃烧时产生大量的热:N2H4 + O2 ===== N2 + 2 H2ON2H4与HNO2反应,生成氮的又一种氢化物叠氮化氢:N2H4 + HNO2 ===== 2 H2O + HN310. 1. 14 羟氨的弱碱性及还原性:NH2OH 有比N2H4更弱的碱性NH2OH + H2O NH3OH+ + OH - Kb = 8.7 ´ 10-9NH2OH 也能够与强酸成盐,如 NH2OH •HCl 和(NH2OH )2•H2S O4。
NH2OH 在酸中、碱中经常作还原剂,产物一样是 N2 或 N2O ,例如: 2 NH2OH + 2 AgBr ===== 2 Ag ↓ + N2↑ + 2 HBr + 2 H2ONH2OH + HNO2 ===== N2O ↑ + 2 H2O10. 1. 15 叠氮化氢HN3 的水溶液称为叠氮酸,它是一种弱酸,其 Ka = 2.4 ´ 10-5。
叠氮酸根N3- 称为叠氮离子,其性质类似于卤素离子,AgN3,Pb (N 3)2,Hg2(N3)2 等为难溶盐。
这些叠氮酸盐不稳固,易爆炸分解。
例如:2 AgN3 ====== 2 Ag + 3 N2↑Pb (N3)2 能够作雷管的引火物。
爽朗金属的叠氮酸盐较稳固。
10. 1. 16 联氨、羟氨和叠氮化氢等几种氢化物的获得:用 NaClO 氧化过量氨水能够得到 N2H4:2 NH3 + NaClO ===== N2H4 + NaCl + H2O用 Pt / 木炭催化,在硫酸中进行 NO 的氢化,能够得到NH2OH 的硫酸盐:2 NO +3 H2 + H2SO4 ======== (NH2OH )2•H2SO4 N2H4与HNO2反应,生成叠氮化氢:N2H4 + HNO2 ===== 2 H2O + HN310. 1. 17 联氨、羟氨和叠氮化氢等几种氢化物的稳固性:N2H4不稳固,当 Si 作催化剂时,将发生如下歧化分解反应:3 N2H4 ====== N2↑ + 4 NH3↑∆Si ∆NH2OH不稳固,要在0℃下储存。
HN3 不稳固,受热爆炸分解:2 HN3 ====== H2↑+ 3 N2↑10. 1. 18 联氨、羟氨和叠氮化氢等几种氢化物的配位作用:由于N2H4中N原子上有孤电子对,因此可与金属离子形成配位单元,例如[ Co(N2H4)6 ]3+。
NH2OH 中N 原子上仍有孤对电子,能够配位。
叠氮离子也能够作为配体与中心原子形成配位化合物。
10. 1. 19 氮的氧化物的差不多认识:N2O 为无色气体,微有好闻的气味。
吸入N2O 时,人的面部受麻醉抽搐而似呈笑状,故有时称N2O 为笑气。
N2O 在水中有一定的溶解度。
NH4NO3 分解可得N2O。
N2O 在500℃时分解成两种气体单质。
NO 为无色气体,在水中溶解度专门小。
N2O3 是HNO2 的酸酐,273 K 时N2O3 为蓝色液体。
NO2 是红棕色气体。
N2O4 为无色气体,其中的氮元素呈+ 4 氧化态,与NO2 相同。
常温下N2O5为白色固体,是HNO3 的酸酐。
NO2+ 和NO3-由离子键结合成N2O5离子晶体。
47℃以上,N2O5 为气体。
10. 1. 20 N2O 的分子构型:N2O 分子构型为直线形,中心的N原子经sp等性杂化形成两条有单电子的sp杂化轨道,如下图所示。
两条sp杂化轨道分别与配体N原子及配体O原子的px轨道成σ键,决定了N2O分子的直线形结构。
中心N原子的pz 轨道有两个未参加杂化的电子,与配体N原子及配体O原子的各1个pz电子形成三中心四电子的大键;Py轨道的1个未参加杂化的电子,与配体N原子的1个py电子及配体O原子的两个py 电子形成三中心四电子的大键。