化学有关化学式计算题
- 格式:docx
- 大小:223.97 KB
- 文档页数:8

化学式计算专题一、选择题1、【05阜新市】尿素是一种高效氮肥,其化学式为CO(NH2)2,下列有关尿索的叙述正确的是 ( )A.尿素是由4种元素组成的混合物 B.尿素是由CO(NH2)2分子构成C.尿素中氧、氮元素的个数比为1:2 D.尿素中碳、氢元素的质量比为6:1 2、【05黑龙江】2005年4 月卫生部发布检测报告,市场上有近90种食品被检出有“苏丹红”如果长期食用含该类物质的食品会增加人体患癌的危险性。
其中“苏丹红一号”的化学式为C16H12ON2。
对该物质的叙述正确的是()A苏丹红一号是氧化物B苏丹红一号由四种元素组成C苏丹红一号是由多原子构成的化合物 D苏丹红一号中碳元素和氮元素的质量比为8:13、【05黑龙江】目前市场上的补钙药剂很多。
右图是某品牌补钙药品的部分说明书。
如果按用量服用,则每天补充钙元素的质量为() A 0.5g B 1g c1.25g D 0.25g4、【05天津市】新型净水剂铁酸钠(Na2FeO4)中铁元素的化合价是()A. +2B. +3C. +5D. +65、【05天津市】有一可能含下列物质的硝酸铵样品,经分析知道其中氮元素的质量分数为20%。
那么该样品中一定含有的下列物质是(括号内的数据为相应物质中氮元素的质量分数)()A. (NH4)2SO4(21%) B. NH4HCO3 (18%) C. CO(NH2)2(47%) D.NH4Cl(26%)6、【05北京市】手机中使用的锂(Li)电池是新型的高能电池,某种锂电池的总反应可表示为Li + MnO2 === LiMnO2。
此反应中锂元素的化合价变化为0→+1,下列对锰元素的化合价变化判断正确的是()A.+4→+3B. +2→+3C. 0→+2D.-4→-27、【05北京·海淀】二氧化钛(化学式为TiO2)俗称钛白,是世界上最白的物质,常用作高级白色颜料。
二氧化钛中钛元素的化合价是() A. -2B. +2C. +3D. +48、【05上海·嘉定】汽车发动机排放的尾气中含一定量的氮氧化合物,造成空气污染,下列物质中氮元素化合价最高的是( )A.NO B.N2O3C.NO2D.N2O59、【05安徽·课改】我省盛产茶叶,“太平猴魁”“黄山毛峰”等绿茶享誉海内外.绿茶中的单宁酸具有抑制血压上升、清热解毒、抗癌等功效,其化学式为C76H52O46,下列关于单宁酸的说法不正确的是( )A.由碳氢氧三种元素组成B.一个分子含76个碳原子C.碳氢氧原子个数比为76:52:46D.一个分子中含23个氧分子10、【05江西·课改】宇宙飞船内宇航员所呼出的气体要通过氢氧化锂(化学式为LiOH)的过滤网,以除去所含二氧化碳。

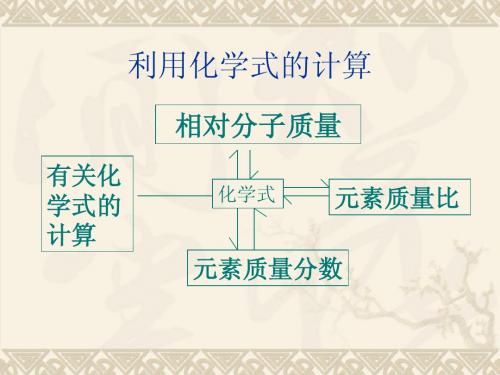
有关化学式的计算一、单选题1.维生素A的化学名为视黄醇,是最早被发现的维生素。
其化学式为C20H30O,下列有关说法正确的是( )A.维生素A属于有机高分子化合物 B.维生素A中含有碳、氢、氧三中原子C.维生素A中氢元素的质量分数最大 D.维生素A分子中含有51个原子【答案】B2.乙酸(CH3COOH)又名醋酸,下列有关说法正确的是( )A.乙酸是食醋的主要成分 B.CH3COOH中C、H、O元素的质量比是2:4:2C.乙酸不能溶于水 D.CH3COOH中C元素的质量分数是【答案】A【解析】A、乙酸是食醋的主要成分,正确;B、CH3COOH中C、H、O原子的个数比为2:4:2,故质量比一定不是2:4:2,错误;C、乙酸易溶于水,错误;D、CH3COOH中C元素的质量分数=,错误。
故选A。
3.阿司匹林的主要成分是乙酰水杨酸(化学式C9H8O4),是治疗心血管疾病的重要药物之一。
下列关于乙酰水杨酸的说法错误的是( )A.一个乙酰水杨酸分子中原子总个数为21 B.乙酰水杨酸的相对分子质量为180C.乙酰水杨酸属于有机物 D.乙酰水杨酸中氢元素与氧元素的质量比为2:1【答案】D【解析】A.一个乙酰水杨酸分子中原子总个数为9+8+4=21,正确;B.乙酰水杨酸的相对分子质量为12×9+1×8+16×4=180,正确;C.乙酰水杨酸属于有机物,正确;D.乙酰水杨酸中氢元素与氧元素的质量比为(1×8):(16×4)=1:8,错误。
故选D。
4.葡萄糖酸钙常用于预防和治疗钙缺乏症,其化学式为Ca(C6H11O7)2,下列有关葡萄糖酸钙的说法正确的是A.葡萄糖酸钙属于氧化物 B.葡萄糖酸钙的相对分子质量为235C.葡萄糖酸钙由钙、碳、氧、氢四种元素组成 D.葡萄糖酸钙中葡萄糖酸根(C6H11O7)化合价为-2 【答案】C5.抗病毒处方药磷酸奥可他韦能够有效治疗甲型和乙型流感,分子式为C16H28N2O4•H3PO4下列说法正确的是()A.分子式中含7种元素 B.C16H28N2O4中C、O元素的质量比为4:1C.H3PO4由3个氢原子、1个磷原子、4个氧原子构成的D.H3PO4和H2SO4的相对分子质量相同【答案】D【解析】A、该物质是由碳、氢、氮、氧、磷五种元素组成的,错误;B、C16H28N2O4中C、O元素的质量比为(12×16):(16×4)=3:1,错误;C、一个H3PO4分子由3个氢原子、1个磷原子、4个氧原子构成的,错误;D、H3PO4的相对分子质量为1×3+31+16×4=98,H2SO4的相对分子质量为1×2+32+16×4=98,正确。

1.计算CuSO4·5H2O的相对分子质量分析:CuSO4·5H2O组成中,是由CuSO4和5个H2O分子组成的,因此是二者相对质量之和。
解答:CuSO4·5H2O的相对分子质量=64+32+16×4+(1×2+16)×5=2502.计算NH4NO3中所含各元素的质量比分析:从NH4NO3的化学式知:组成硝酸铵的三种元素是N、H、O,在一个NH4NO3中分别计算各元素的相对质量比即硝酸铵中各元素的质量比。
解答:∵m N :m H:m O=(14×2):(1×4):(16×3)=28 : 4 : 48=7 : 1 : 12∴N、H、O三种元素的质量比为7:1:123.某黄铁矿中含FeS2为72%,计算该黄铁矿中硫元素的质量分数是()A.36%B.38.4%C.42.6%D.48%分析1:黄铁矿中含FeS2为72%,其余为杂质,再根据化学式算出FeS2中硫的质量分数。
设取黄铁矿100克,则其中FeS2的质量为:100×72%=72克,在72克FeS2中所含硫的质量为:分析2:也可以根据对应关系计算:设100克黄铁矿中含硫的质量为x。
对应关系:黄铁矿~含FeS2~含2S100克100×72%=72克x克120 32×2列出比例式:x=38.4克解:本题的正确答案应选B.4.有气肥(化学式为NH4HCO3)样品50克,其中含NH4HCO3为96%,则该气肥样品中所含氮元素的质量为()A.17克B.8.5克C.6.5克D.4克分析1:样品中含NH4HCO3 96%,说明样品为不纯净的物质。
利用纯度可以计算出50克样品中纯NH4HCO3的质量,再根据气肥的化学式算出所含氮元素的质量分数,利用氮元素质量分数便可计算氮元素的质量。
50克气肥样品中所含纯NH4HCO3的质量:50×96%=48克NH4HCO3中氮元素的质量分数:∴50克样品中所含氮元素的质量:48×17.7%=8.5克分析2:也可以根据对应关系计算,设50克气肥样品中含氮元素的质量为x。

【化学】化学化学方程式的计算题20套(带答案)一、中考化学方程式的计算1.欲测得某块大理石中所含碳酸钙的含量,现取该大理石加入到足量稀盐酸中(杂质不与稀盐酸反应),产生CO2的质量与稀盐酸的质量关系如图所示,请计算。
(1)该实验中最多制得CO2的质量为_____。
(2)该大理石中所含碳酸钙的质量_____(写出计算过程)。
【答案】8.8g 20g【解析】【分析】碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳。
【详解】(1)由图像可知,该实验中最多制得CO2的质量为8. 8g。
(2)设该大理石中碳酸钙的质量为x3222CaCO+2HCl=CaCl+H O+CO10044x8.8g100x =448.8gx=20g答:大理石中所含碳酸钙的质量为20g。
2.请根据如图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题:计算稀盐酸中溶质质量。
【答案】7.3g【解析】【分析】【详解】根据质量守恒反应前后物质总质量不变可得二氧化碳的质量等于12g+100g+100g-207.6g=4.4g设稀盐酸中溶质质量为x3222CaCO2HCl=CaCl CO H O7344x 4.4g73x=,x=7.3g44 4.4g++↑+答:稀盐酸中溶质质量7.3g【点睛】根据质量守恒,求出二氧化碳质量,根据二氧化碳质量求稀盐酸中溶质质量3.有一种自生氧防毒面具,其使用的生氧剂的主要成分是(KO2)。
取100g生氧剂放入质量为20g的烧杯中,再向其中加入20g水,使生氧剂KO2全部反应,其充分反应后(4KO2+2H2O═4KOH+3O2↑),称得烧杯及烧杯中物质的总质量为116g,计算(假设杂质不含钾元素且不与稀硫酸反应)(1)100g生氧剂生成氧气的质量_____;(2)KO2中钾元素的质量分数为_____;(计算结果精确到 0.1%)(3)要将烧杯中的溶液完全中和,通过计算,需要溶质质量分数为10%的稀硫酸溶液的质量_____。

精编:利用化学式进行计算——20题(基础专题+答案)1、松油醇(C 10H 18O )是一种调香香精,多存在于松节油、方樟油、玉树油、橙花油中。
请回答:(1)松油醇的相对分子质量是________。
(2)松油醇中氢元素和氧元素的质量比为________(填最简整数比)。
(3)30.8g 松油醇所含碳元素质量与________g 二氧化碳所含碳元素质量相等。
答案:154 9∶8 882、大蒜中的硫化丙烯(化学式为C x H 6S )能杀菌,具有一定的抗病功能和食疗价值。
(1)硫化丙烯的相对分子质量为74,则x 的数值为______。
(2)硫化丙烯中,碳、氢、硫三种元素的质量比为______。
(3)求硫化丙烯中硫元素的质量分数______。
(写出计算过程,计算结果精确到0.1%)。
答案:(1)3 (2)18∶3∶16(3)解:硫化丙烯中六元素的质量分数为%2.43%100326131232≈⨯+⨯+⨯ 3、甲醇(化学式为CH 3OH )是一种重要的化工原料,用途十分广泛。
请计算(1)甲醇中碳、氢、氧三种元素的原子个数比为__________(填最简整数比)。
(2)甲醇中氧元素的质量分数为____________。
(3)6.4g 甲醇中含有____________g 氢元素。
(4)若甲醇和乙醇(化学式为C 2H 5OH )两种物质中含有等质量的碳元素,则甲醇和乙醇两种物质的质量比为___________(填最简整数比)。
答案:1∶4∶1 50% 0.8 32∶234、某品牌补铁剂的成分为富马酸亚铁颗粒,其化学式为C 4H 2FeO 4。
试计算(1)富马酸亚铁中碳元素与氧元素的质量比为_____(最简整数比)。
(2)富马酸亚铁中铁元素的质量分数是_______(精确到0.1%)。
答案:3∶4 32.9%5、布洛芬(中文别名异丁苯丙酸)是一种常用的解热镇痛类非处方药,具有抗炎镇痛解热作用。
异丁苯丙酸的分子式是C13H18O2,是一种不溶于水的物质。

初三化学化学方程式的计算题20套(带答案)含解析一、中考化学方程式的计算1.欲测得某块大理石中所含碳酸钙的含量,现取该大理石加入到足量稀盐酸中(杂质不与稀盐酸反应),产生CO 2的质量与稀盐酸的质量关系如图所示,请计算。
(1)该实验中最多制得CO 2的质量为_____。
(2)该大理石中所含碳酸钙的质量_____(写出计算过程)。
【答案】8.8g 20g【解析】【分析】碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳。
【详解】(1)由图像可知,该实验中最多制得CO 2的质量为8. 8g 。
(2)设该大理石中碳酸钙的质量为x3222CaCO +2HCl =CaCl +H O +CO 10044x 8.8g↑100x =448.8gx=20g答:大理石中所含碳酸钙的质量为20g 。
2.氯酸钾24.5g 加热完全反应后,制得氧气的质量是___________?【答案】9.6g【解析】【分析】【详解】解:设制得氧气的质量是x 。
232MnO 2KClO 2KCl +3O 2459624Δ.5g x ↑2459624.5g x=x=9.6g答:制得氧气的质量是9.6g。
【点睛】根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
3.过氧化钙(CaO2)常用于活鱼运输时的增氧剂,过氧化钙与水反应方程式为:2CaO2+2H2O═2Ca(OH)2+O2↑.某过氧化钙样品中含有少量不溶于水且不与水反应杂质,取该样品15.0g投入盛有108.0g水的烧杯中,缓慢搅拌,充分反应,最终收集到氧气质量为3.20g,计算该样品中过氧化钙的质量分数____(写出计算过程)。
【答案】96%【解析】【分析】【详解】解:设过氧化钙质量为x,22222CaO2H O=2Ca(OH)O14432x 3.2g14432=x 3.2g++↑x=14.4g,该样品中过氧化钙的质量分数是:14.4g15.0g×100%=96%,答:该样品中过氧化钙的质量分数是96%。

2024年中考化学模拟题汇编:有关化学式的计算一.选择题(共13小题)1.(2024春•越秀区校级月考)已知重铬酸钠的化学式为:Na2Cr2O7,则该化合物中硌元素的化合价为()A.+2B.+3C.+4D.+6 2.(2023秋•牟平区期末)在由乙烷(C2H6)和酒精蒸气(C2H5OH)组成的混合气体中,碳元素的质量分数为56%,则混合气体中氧元素的质量分数为()A.40%B.30%C.20%D.10% 3.(2023秋•和田地区期末)绿原酸(化学式为C16H18O9)是一种中药的提取物。
下列关于该物质的说法正确的是()A.由三种元素组成B.碳、氧元素的质量比为16:9C.相对分子质量为354gD.绿原酸是由16个碳原子、18个氢原子、9个氧原子构成4.(2023秋•舞阳县期末)千金藤素(C37H38N2O6)对新冠病毒有良好抑制作用。
下列说法正确的是()A.从宏观上看:千金藤素(C37H38N2O6)由四种元素组成B.从微观上看:千金藤素(C37H38N2O6)含有3个氧气分子C.从类别上看:千金藤素(C37H38N2O6)属于混合物D.从质量上看:千金藤素(C37H38N2O6)中所含氢元素质量分数最大5.(2023秋•桐城市期末)某中药中含有的金丝桃苷【C21H20O12】在与病毒的主要蛋白酶的对接方面有一定的效果,是首个被证明能减缓新冠肺炎病例的药物。
下列说法正确的是()A.金丝桃苷属于氧化物B.金丝桃苷的相对分子质量是464gC.每个金丝桃苷分子由53个原子构成D.金丝桃苷元素的质量比为21:20:126.(2023秋•河口区期末)“笑气”是人类最早应用于医疗的麻醉剂之一。
笑气是氮和氧形成的化合物,该化合物中氮元素和氧元素的质量比为7:4,,则该化合物的化学式可能是第1页(共21页)。


初三化学化学计算题专题训练答案及解析一、有关化学式的计算1、计算尿素CO(NH₂)₂中氮元素的质量分数。
答案:尿素中氮元素的质量分数=(氮原子的相对原子质量×氮原子个数)÷尿素的相对分子质量×100%氮原子的相对原子质量为 14,尿素的化学式为 CO(NH₂)₂,其中氮原子个数为 2。
尿素的相对分子质量= 12 + 16 +(14 + 1×2)×2 = 60氮元素的质量分数=(14×2)÷60×100% ≈ 467%解析:要计算化合物中某元素的质量分数,就用该元素原子的相对原子质量乘以原子个数,再除以化合物的相对分子质量,最后乘以100%。
在尿素中,明确氮原子的个数以及各原子的相对原子质量,按照公式准确计算即可。
2、已知氧化铁(Fe₂O₃)的相对分子质量为 160,求其中铁元素与氧元素的质量比。
答案:铁元素与氧元素的质量比=(铁原子的相对原子质量×铁原子个数)∶(氧原子的相对原子质量×氧原子个数)铁原子的相对原子质量为 56,氧原子的相对原子质量为 16。
氧化铁中,铁原子个数为 2,氧原子个数为 3。
铁元素与氧元素的质量比=(56×2)∶(16×3)= 7∶3解析:计算化合物中各元素的质量比,同样要依据各元素原子的相对原子质量和原子个数。
先分别算出铁元素和氧元素的质量,然后相比得出质量比。
二、有关化学方程式的计算1、加热分解 63g 高锰酸钾,可以得到多少克氧气?答案:设可以得到氧气的质量为 x。
2KMnO₄=△= K₂MnO₄+ MnO₂+ O₂↑316 3263g x316 / 63g = 32 / xx = 064g解析:首先写出高锰酸钾受热分解的化学方程式。
根据化学方程式找出高锰酸钾与氧气的质量比,然后设出未知量氧气的质量为 x,列出比例式进行求解。
2、实验室用 10g 碳酸钙与足量的稀盐酸反应,可制得多少克二氧化碳?答案:设生成二氧化碳的质量为 y。

与化学式有关的八种计算一、计算元素种类、原子个数例1NH4NO3中共有____种元素,_____个原子。
解析:化学式中重复出现的N只算一种,共三种,原子总数:2个氮原子+4个氢原子+3个氧原子=9例2蔗糖在充足的氧气中燃烧,生成二氧化碳和水,则蔗糖中一定有_____元素,可能有_____元素。
将蔗糖隔绝空加热生成碳和水,则蔗糖中含有的元素是_____。
解析:生成物中有CO2和H2O,共C、H、O三种元素,反应物也应有这三种,若氧元素全部由氧气提供,则蔗糖中有C、H元素,反之则蔗糖中C、H、O三种都有,可得蔗糖有一定有C、H、O三种元素都有。
二、计算相对质量1、计算相对分子质量例1(HN4)2SO4的相对分子质量=__,CuSO4·5H2O的相对分子质量=___。
解析:(HN4)2SO4的相对分子质量=(14+1×4)×2+32+16×4=132CuSO4·5H2O的相对分子质量=63.5+32+16×4+5(1×2+16)=249.5元素符号之间用“+”,元素符号与数字间用“×”,括号保留,括号前后的数字用“×”,结晶水合物中间的“·”变为“+”,不要与数学上的乘号“·”混淆。
2、计算相对原子质量例1mg化学式为RO的氧化物中含有ngR,则R的相对原子质量为____。
解析:O的质量=(m-n)g,O的相对原了质量为16则O的相对原子质量的标准“1”=m-n16,R的相对原子质量=nm-n16=16nm-n例2某物质化学式为H2RO4,相对分子质量为98,则R的相对原子质量为_____,该元素1个原子中有16个中子,该元素的符号为_____.解析:根据相对分子质量的计算1×2+R的相对原子质量+16×4=98,R的相对原子质量=32又因质子数+中子数=相对原子质量,则R的质子数=32-16=16,R为S。

有关化学式的计算复习:1、指出下列化学符号中数字“2”的含义:-22Fe SMg2+CO22、用元素符号或化学式表示:(1)5个水分子(2)铝元素(3)2个氮原子(4)氯化氢(5)-2价的氧元素(6)两个氧离子3、标出下列物质中硫元素的化合价H2S S SO2 SO3Na2SO44、已知化学式R2O3,写出R元素分别与Cl—、NO3—、SO42—形成化合物的化学式。
一、计算相对分子质量:相对分子质量= 各(相对原子质量×原子个数)之和如物质A x B y的相对分子质量为:Mr=xAr(A)+yAr(B)1、练习:请分别计算下列物质的相对分子质量(1)N2(2)H2O(3)K2CO3(4)Mg(OH)2(5)KMnO4(6)Al2(SO4)3(7)NH4HCO3(8)2H2O二、计算元素质量比物质中X与Y元素质量比= 各(相对原子质量×原子个数) 之比如物质A x B y中A、B元素质量比为:A∶B= xAr(A)∶yAr(B)2、计算下列化合物种各种原子个数比核元素的质量比(1)H2O(2)Fe2O3(3)C6H12O6(4)CO(NH2)2(5)NH4HCO33、某氮的氧化物中,氮与氧的质量比为7:8,试求该氧化物的化学式。
三、化合物中某元素的质量分数的计算某元素% = (原子个数×相对原子质量)÷相对分子质量×100%4、计算水中氧元素和氢元素的质量分数;5、计算KIO3中碘的质量分数;6、计算硝酸铵中氮元素质量分数;7、近年来,乳酸在医药、食品等工业中应用前景广阔.乳酸的化学式为C 3H 6O 3 :1)乳酸中所含元素种类有 种;其一个乳酸分子中原子个数有 个2)乳酸的相对分子质量是 ,其中各元素的原子个数比 元素质量为 。
3)乳酸中碳元素的质量分数是多少?200g 乳酸中含有多少克碳元素?8、2011年我国女科学家屠呦呦发现青蒿素(青蒿素的化学式:C15H22O5),它是一种用于治疗疟疾的药物,获美国拉斯克奖。

有关化学方程式的计算 典型例题【例1】将13g 金属混合物粉末投入足量稀硫酸中,产生1g 氢气。
此金属混合物可能的组成的是可能的组成的是[ [ ] A .Fe 和Zn B .Mg 和Zn C .Cu 和Fe D .Zn 和Cu分析:用平均值法。
用平均值法。
Fe Fe Fe、、Zn Zn、、Mg 和稀硫酸反应的化学方程式为:和稀硫酸反应的化学方程式为:M+H 2SO 4==MSO 4+H 2↑ 设混合物金属的平均相对原子质量为x ,则有,则有x ∶2=13∶1 x=26所以组成混合物的两种金属的相对原子质量必然是一个小于2626,另一个大于,另一个大于2626。
铁的相对原子质量是5656,锌的相对原子质量是,锌的相对原子质量是6565,都大于,都大于2626。
铜是不活泼金属,。
铜是不活泼金属,不能和稀硫酸反应生成氢气。
所以应选B 。
答案:B 。
【例2】下列各组物质共热后产生氧气最多的是 [ [ ] A .4g 氯酸钾和2g 二氧化锰二氧化锰 B .2g 氯酸钾和4g 二氧化锰二氧化锰 C .4g 氯酸钾和2g 高锰酸钾高锰酸钾 D .2g 氯酸钾和4g 高锰酸钾高锰酸钾分析:在氯酸钾、在氯酸钾、高锰酸钾和二氧化锰三种物质中,高锰酸钾和二氧化锰三种物质中,高锰酸钾和二氧化锰三种物质中,二氧化锰不能分解放出氧气,二氧化锰不能分解放出氧气,只是对氯酸钾分解放氧气有催化作用。
在A 和B 两组中,由于A 含氯酸钾的质量比B 多,所以A 放氧气的质量比B 多。
多。
在C 和D 两组中,氯酸钾和高锰酸钾都能分解放出氧气,它们的质量关系表示如下:下:从化学方程式可以看出245g 氯酸钾能生成96g 氧气,而245g 高锰酸钾生成氧气的质量不足96g (约为24.8g 24.8g))。
由于C 含氯酸钾比D 多,所以C 生成氧气质量比D 多。
A 和C 相比,虽所含氯酸钾的质量相同,然而C 中的高锰酸钾也能生成氧气,中的高锰酸钾也能生成氧气,A A 中的二氧化锰却不能,所以C 生成氧气比A 多。

化学式计算专题训练一、根据化学式计算相对分子质量1. 题目- 计算水(H_2O)的相对分子质量。
- 计算碳酸钙(CaCO_3)的相对分子质量。
- 计算硫酸(H_2SO_4)的相对分子质量。
解析- 对于水(H_2O):- 相对分子质量等于各原子相对原子质量之和。
- 氢原子(H)的相对原子质量约为1,氧原子(O)的相对原子质量约为16。
- 水的相对分子质量M = 2×1+16 = 18。
- 对于碳酸钙(CaCO_3):- 钙原子(Ca)的相对原子质量约为40,碳原子(C)的相对原子质量约为12,氧原子(O)的相对原子质量约为16。
- 碳酸钙的相对分子质量M = 40 + 12+3×16=100。
- 对于硫酸(H_2SO_4):- 氢原子(H)的相对原子质量约为1,硫原子(S)的相对原子质量约为32,氧原子(O)的相对原子质量约为16。
- 硫酸的相对分子质量M = 2×1+32 + 4×16=98。
二、根据化学式计算元素的质量比1. 题目- 计算水(H_2O)中氢元素和氧元素的质量比。
- 计算二氧化碳(CO_2)中碳元素和氧元素的质量比。
- 计算硝酸铵(NH_4NO_3)中氮、氢、氧三种元素的质量比。
解析- 对于水(H_2O):- 氢元素和氧元素的质量比等于它们的相对原子质量乘以原子个数之比。
- 氢原子(H)的相对原子质量约为1,氧原子(O)的相对原子质量约为16,氢原子个数为2,氧原子个数为1。
- 氢元素和氧元素的质量比=(1×2):16 = 1:8。
- 对于二氧化碳(CO_2):- 碳元素(C)的相对原子质量约为12,氧原子(O)的相对原子质量约为16,碳原子个数为1,氧原子个数为2。
- 碳元素和氧元素的质量比=12:(16×2)=3:8。
- 对于硝酸铵(NH_4NO_3):- 氮原子(N)的相对原子质量约为14,氢原子(H)的相对原子质量约为1,氧原子(O)的相对原子质量约为16。
化学有关化学式计算题集团文件发布号:(9816-UATWW-MWUB-WUNN-INNUL-DQQTY-有关化学式的计算1在SO 2中硫元素的质量分数是 [ ] A .3.1% B .50% C .66.7% D .33.3%2.在(NH 4)2SO 4,NH 4Cl ,NH 4NO 3,NH 4HCO 3四种物质中,氮元素的质量分数由多到少排列的顺序是正确的是 [ ] A .NH 4NO 3 (NH 4)2SO 4 NH 4HCO 3 NH 4Cl B .(NH 4)2SO 4 NH 4NO 3 NH 4Cl NH 4HCO 3 C .NH 4HCO 3 NH 4Cl (NH 4)2SO 4 NH 4NO 3 D .NH 4NO 3 NH 4Cl (NH 4)2SO 4 NH 4HCO 33下列氮肥中,含氮量最高的是 [ ] A .NH 4NO 3 B .CO(NH 2)2 C .NH 4HCO 3 D .KNO 34下列物质中,铁元素含量最高的是 [ ] A .Fe(OH)2 B .Fe(OH)3 C .Fe 2O 3 D .Fe 3O 45.某氮肥中氮、氢、氧三种元素质量比为7∶1∶12,则这种氮肥可能是 [ ] A .CO(NH 2)2 B .NH 4HCO 3 C .NH 4NO 3 D .(NH 4)2SO 46在M 2O 3中,氧元素的质量分数是30%,则M 的相对原子质量是 [ ] A .16 B .32 C .56 D .647.已知M 2O 3的相对分子质量为160,氧的相对原子质量为16,则M 的相对原子质量是 [ ] A .56 B .72 C .112 D .1448.某氧化物(MO)中,其M 元素的质量分数为80%,则M 的相对原子质量是_____ 9某+2价金属的氯化物,经测定知道含氯55.9%,该金属元素是 ( )A .MgB .CaC .CuD .Fe10下列物质中,属于混合物的是 [ ]A .水银B .含铁70%的氧化铁(Fe 2O 3)C .澄清石灰水D .氧化镁11已知碳酸钙和另一物质组成的混合物中含碳质量分数大于12%,则另一物质可能是( )A .Na 2CO 3B .KHCO 3C .MgCO 3D .K 2CO 312在硝酸铵样品中,含有98%的硝酸铵,则该样品中氮元素的质量分数是 [ ] A .35% B .34.3% C .17.15% D .16.8%13.已知X ,Y 两元素的相对原子质量分别是14和16,X 和Y 所形成的化合物,其相对分子质量为44,则该化合物的化学式是 [ ] A .XY 2 B .X 2Y 2 C .X 2Y D .X 2Y 314.下列氮元素的氧化物中,所含氮元素与氧元素的质量比为7∶20的化合物的化学式是 ( )A .N 2OB .NO 2C .N 2O 3D .N 2O 515某正三价元素M的氧化物中,M元素与氧元素的质量比为9:8,则化学式为某金属元素R在氧化物里显+2价,其氧化物中R的质量分数为60%,则该氧化物的相对分子质量为( )A.113 B.40 C.54 D.40克16.某元素R的+4价氧化物的相对分子质量为N,则R的相对原子质量是 ( ) A.N+32 B.N-16 C. D.N-3217 A、B元素相对原子质量之比为2∶1。
仅由这两种元素组成的化合物里,A、B元素的质量比为2∶3,其中B显-n价,则此化合物中A的化合价是( )A.+n B.+3n C.-n D.+2n18.含0.1克氢元素的水质量是 ( )A.18克B.1.8克C.9克D.0.9克19.要使Fe2O3和Fe3O4中含有相同质量的铁元素,则这两种物质的质量比应该是( )A.3∶2 B.1∶1 C.30∶29 D.29∶4220..10克一氧化碳(CO)和10克二氧化碳中,所含碳元素的质量是()A、相等B、二氧化碳中多C、一氧化碳中多D、无法估计21、要使三氧化二铁和四氧化三铁含有相同质量的铁元素,则三氧化二铁和四氧化三失的质量比是。
22缺碘易使人患甲状腺亢进,因此在食盐中一般都加入碘酸钾这种物质。
在碘酸钾中碘的化合价为+5价,则碘酸钾的化学式为( )A.KIO B.KIO2 C.KIO3D.KIO423.常用作消毒剂的高锰酸钾(KMnO4)中锰元素的化合价是( ) A.+7价B.+6价C.+5价D.+4价24.某元素的氧化物相对分子质量为M1,其硫酸盐的相对分子质量为M2,则该元素的化合价可能是下列关系中的 ( )A. B. C.D.25.已知元素R的最高价氧化物的化学式为RO3,又知该元素的氢化物中氢元素的质量分数为5.88%,则R的原子量为________________________________。
26.X与Y两种元素可组成不同化合物C1和C2,从表中两种化合物含X和Y的质量分数等27.在含氮的五种氧化物NO、N2O、N2O3、NO2、N2O5中,含氮量最高的是_________________,其含氮量是______________%;含氮量最低的是_________,其含氮量是________%。
1.1989年世界卫生组织把铝列为食品污染源之一,每人每日的摄入量控制在0.004g 以下。
若在1kg 米面食品中加入明矾2g (胆矾的化学式为KAl(SO 4)2·12H 2O ,相对分子质量为474),请回答下列问题:⑴人从食物中摄入的铝指的是 (填字母)。
A .铝元素 B .铝单质 C .铝合金 D .只有明矾⑵明矾中各元素的质量比K ∶Al ∶S ∶O ∶H = ;铝元素的质量分数为(计算结果精确到0.1%) 。
⑶如果某人一天吃了100g 上述面食品,通过计算说明其摄入的铝的量是否超过安全摄入量?2.蛋白质是机体生长及修补受损组织的主要原料,人体通过食物获得的蛋白质在胃肠中与水反应,生成氨基酸,蛋氨酸(化学式为C5H11O2NS)就是其中的一种。
请回答下列问题。
(1)蛋氨酸中各元素的质量比C :H :O :N :S= 。
(2)蛋氨酸中氮元素的质量分数为: 。
(3)合格奶粉每100 g 中含蛋白质约18 g ,蛋白质中氮元素的平均质量分数为16%,则每100 g 合格奶粉中氮元素的质量为 g ;现测定某奶粉每100 g 中含有氮元素的质量为0.5 g 。
则这种奶粉属于 (填“合格”或“不合格”)奶粉。
3.锌是人体生长发育、维持器官正常功能不可缺少的微量元素,人体缺锌会引起多种疾病,缺锌者可在医生指导下通过服用葡萄糖酸锌等含锌保健食品来补锌。
已知葡萄糖酸锌的化学式为C 12H 22O 14Zn(相对分子质量为455)。
试回答: (1)葡萄糖酸锌是由 种元素组成的。
(2)葡萄糖酸锌中所含锌元素的质量分数为 (计算结果精确到O .1%)。
(3)现有一支20 mL 某品牌的葡萄糖酸锌口服液,其中含锌6.5 mg ,则该口服液中葡萄糖酸锌的质量是 mg(计算结果精确到0.1 mg)。
碘。
下图为广东盐业总公司生产的加碘盐的部分标签,请根据标签图回答:⑴碘酸钾(KIO3)中碘元素的化合价为。
⑵从“食用方法”推测,碘酸钾的一种化学性质是。
⑶为确保碘盐中碘的最低含量,1kg碘盐中至少应加入碘酸钾 mg(精确到0.1)。
5.蛋白质在人体胃肠内与水反应,最终生成氨基酸被人体吸收。
丙氨酸(化学式为C3H7O2N)就是其中的一种。
请回答下列问题:(1)丙氨酸分子中C、H、O、N各原子个数比为。
(2)丙氨酸的相对分子质量是,氮元素的质量分数为 (计算结果精确到0.1%)。
(3)合格奶粉每100 g中含蛋白质约18g,蛋白质中氮元素的平均质量分数为16%。
现测定某奶粉每100 g中含有氮元素的质量为 2 g。
请通过计算判断该奶粉是否属于合格奶粉。
6.2008年初,我国南方地区抗击暴风雪中融雪剂发挥了一定的作用。
其中一种融雪效果好、无污染的融雪剂的主要成份是醋酸钾(CH3COOK)。
请回答:(1)醋酸钾中C、H、O元素的质量比为(2)醋酸钾的相对分子质量为,钾元素的质量分数为 (保留一位小数)。
10.蔗糖的化学式为C12H22O11,是食品中常用的甜品剂。
请回答下列问题:(1)蔗糖中C、H、O三种元素的原子个数比为。
(2)要配制15%的蔗糖溶液80g,需要蔗糖的质量为 g。
(3)要把(2)配得的溶液稀释为5%,需要添加水的质量为 g。
12.低钠盐适合患有高血压、肾病、心脏病的患者服用,苹果酸钠盐(C4H5O5Na)是低钠盐的一种。
请回答:(1)苹果酸钠盐的相对分子质量是。
(2)苹果酸钠盐中各元素的质量比为C:H:O:Na= 。
(3)若某病人每天食用5.85g 苹果酸钠盐,比食用相同质量的食盐(NaCl)少摄入钠元素多少克(计算结果保留一位小数)1、要使一氧化碳与二氧化碳含有相同质量的氧元素,两种物质的质量比是多少? 相同质量的一氧化碳和二氧化所含的氧元素质量比是多少?2、某正三价元素M 的氧化物中,M 元素与氧元素的质量比为9:8,则化学式为 。
3、在某氮的氧化物中,氮与氧的质量比为7:12,则此化合物的化学式为 。
4、非金属元素M 与金属元素N 的相对原子质量之比为3:7,它们形成的一种化合物中两种元素质量比为2:7,则其化学式如何书写。
5、A 、B 两种元素的相对原子质量之比为2:1。
在它们的一种化合物中,A 元素的质量分数为50%,则该物质的化学式如何书写?6、已知某化合物的化学式H n RO 3n-2为其相对分子质量为N ,则R 的原子量为 ;其中元素R 的化合价为 。
1、要使三氧化二铁和四氧化三铁含有相同质量的铁元素,则三氧化二铁和四氧化三失的质量比是 。
2、硫的一种氧化物中,硫与氧元素的质量比为1:1,化学式为?3、化合物X 2Y 3中,X 与Y 元素的质量比为9:8,则X 与Y 的相对原子的质量比为多少? 4、.碳的一种氧化物中,碳与氧元素的质量比为3:4,确定该氧化物中碳元素的化合价? 5、6.氮的一种氧化物中,氮与氧元素的质量比为7:8,求氮元素的化合价?6、某正三价金属元素M 的氧化物中,M 元素与氧元素的质量比为7:3,则该元素的相对原子质量为 。
7、某铜矿(主要成分为CuFeS 2)中含硫29.75%,该矿中含铜为( )A 、34.78%B 、29.75%C 、85.53%8、310克一氧化碳(CO )和10克二氧化碳中,所含碳元素的质量是( ) A 、相等B 、二氧化碳中多C 、一氧化碳中多D 、无法估计9、相同质量的二氧化硫与三氧化硫中所含氧元素的质量比是 。
10、在FeO 、Fe 2O 3、Fe 3O 4三种化合物中,与等质量铁元素相结合的氧元素的质量比为( )A 、6:9:8B 、12:8:9C 、2:3:6D 、1:3:411、已知某Fe 2O 3样品中铁元素的质量分数为63%(杂质不含铁元素),求此氧化铁样品中的质量分数。