2021年高中化学专题2研究物质的基本方法原子结构与核外电子排布规律教学案苏教版必修一
- 格式:doc
- 大小:155.50 KB
- 文档页数:3

专题2 研究物质的基本方法第一单元研究物质的实验方法............................................................................................ - 1 - 第1课时实验安全与基本规范物质的分离提纯.................................................. - 1 - 第2课时物质的检验物质性质和变化的探究.................................................... - 11 - 第二单元溶液组成的定量研究........................................................................................ - 19 - 第三单元人类对原子核的认识.......................................................................................... - 29 - 第1课时人类认识原子结构的历程原子核的构成.......................................... - 29 - 第2课时原子核外电子排布.................................................................................... - 35 - 微专题2原子结构与核外电子排布规律......................................................................... - 42 -第一单元研究物质的实验方法第1课时实验安全与基本规范物质的分离提纯发展目标体系构建1.能规范使用常见的实验仪器。

专题1 微观结构与物质的多样性第一单元核外电子排布与周期律教学目标与教学设计的核心问题在化学1的基础上,学生已对原子结构、核外电子排布及元素的金属性和非金属性有所了解。
本单元则较为系统地学习核外电子排布与周期律的重要原理和规律。
本教案侧重引导学生,在学习相关知识的同时,让学生理解:(1).科学家得出元素周期律所用的思维方式与方法。
重点有归纳与演绎。
(2).利用原子结构更好的学习元素周期律与元素周期表。
(3).利用元素周期表的典型应用示例,认识科学理论的应用价值。
1-1 原子核外电子的排布一、教学目标1.知识与技能:(1).了解1-18号元素核外电子排布及相应的规律,并能用原子结构示意图表示上述元素的核外电排布。
2.过程与方法:(1).利用对1-18号元素核外电子排布及相应的规律的分析,学习归纳思维方法。
(2).利用练习巩固原子结构示意图。
3.情感态度与价值观培养学生小组合作精神,以及从微观角度认识事物。
4.教学重点:(1).1-18号元素核外电子排布规律。
(2). 用原子结构示意图表示元素的核外电排布。
二、教学过程[板书] [第一课时原子核外电子的排布][问题情景]画出1-18号所有元素的原子结构示意图。
[问题与探究]按某些共同特征,将上述18种元素分组,说明你分组的依据及优势(注意:不能与图1-2重复)例如:可以按核外电子偶数分组,可以按单质状态分组。
[小结]科学理论来自于客观事实。
但科学理论在被证实之前,会有很多瑕疵,从简单到复杂,是所有科学理论的发展路线。
[问题与讨论]图1-2中核外电子排布依据的规律主要有以下几个要点:[板书]1.元素核外电子排布所遵循的规律(1).核外电子依据电子能量的高低不同划分电子层(K、L、M、N、O、P、Q或n=1、2、3、4、5、6、7)。
离核近的电子层能量低,离核远的电子层能量高。
(2).电子总是尽先占据能量最低的电子层。
(3).各层最多可容纳的电子数为2n2(n=1、2、3…)(4).最外层最多不超过8个电子[思考](1).依据上述规律解释 Na 为什么不是?(2).上述规律能否解下列现象。

专题1 微观结构与物质的多样性第一单元原子核外电子排布与元素周期律第1课时原子核外电子的排布元素周期律(教师用书独具)●课标要求1.了解原子核外电子的排布。
2.能结合有关数据和实验事实认识元素周期律,了解原子结构与元素性质的关系。
●课标解读1.了解核外电子排布规律和表示方法。
2.理解元素周期律和金属性、非金属性的强弱判断。
●教学地位结构决定性质,原子核外电子排布和元素周期律是研究物质性质的基础,并且在高考题中均有涉及。
(教师用书独具)●新课导入建议我们在日常生活中经常会观察到,蜜蜂在某一朵花附近采蜜时,没有确定的飞行路径,一会儿向西、一会儿向东,蜜蜂在一朵花的近处、远处都可能出现,似乎没有什么规律。
但经过仔细观察不难发现:蜜蜂在花朵附近出现的次数总比在远离花朵的地方出现的次数多。
与此类似,原子核外电子的排布也是有规律的,该规律是怎样的呢?答案就在本课时的学习中。
●教学流程设计1.(1)电子在核外排布时,总是尽量先排在能量最低的电子层里,即先排满K 层再排L层等。
(2)每层最多容纳的电子数为2n2(n代表电子层数)。
(3)最外层电子数则不超过8(第一层为最外层时,电子数不超过2个)。
次外层最多不超过18个。
3.原子核外电子排布的表示——结构示意图Cl、Cl-、K+的结构示意图分别为○+17 2 8 7 ,○+17 2 8 8 ,○+19 2 8 8 。
1.同一元素的原子和离子的原子构成有什么差异?【提示】核电荷数或质子数相同,核外电子数不相同。
1.(1)原子序数:按核电荷数由小到大的顺序给元素编号,这种编号就叫做原子序数。
(2)原子序数与元素原子结构之间的关系:原子序数=核电荷数=质子数=核外电子数。
2.元素周期律(1)原子最外层电子呈周期性变化:随着元素核电荷数的递增,元素原子最外层电子的排布呈现周期性的变化,除H、He外,最外电子层上的电子数重复出现从1递增到8的变化。
(2)元素原子半径呈现周期性变化随着原子序数的递增,元素的原子半径呈现由大到小的周期性变化。
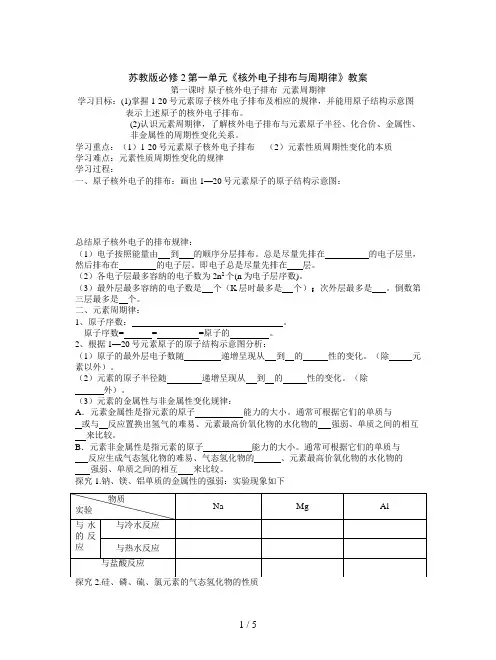
苏教版必修2第一单元《核外电子排布与周期律》教案第一课时原子核外电子排布元素周期律学习目标:(1)掌握1-20号元素原子核外电子排布及相应的规律,并能用原子结构示意图表示上述原子的核外电子排布。
(2)认识元素周期律,了解核外电子排布与元素原子半径、化合价、金属性、非金属性的周期性变化关系。
学习重点:(1)1-20号元素原子核外电子排布(2)元素性质周期性变化的本质学习难点:元素性质周期性变化的规律学习过程:一、原子核外电子的排布:画出1—20号元素原子的原子结构示意图:总结原子核外电子的排布规律:(1)电子按照能量由到的顺序分层排布。
总是尽量先排在的电子层里,然后排布在的电子层。
即电子总是尽量先排在层。
(2)各电子层最多容纳的电子数为2n2个(n为电子层序数)。
(3)最外层最多容纳的电子数是个(K层时最多是个);次外层最多是。
倒数第三层最多是个。
二、元素周期律:1、原子序数:。
原子序数= = =原子的。
2、根据1—20号元素原子的原子结构示意图分析:(1)原子的最外层电子数随递增呈现从到的性的变化。
(除元素以外)。
(2)元素的原子半径随递增呈现从到的性的变化。
(除外)。
(3)元素的金属性与非金属性变化规律:A.元素金属性是指元素的原子能力的大小。
通常可根据它们的单质与或与反应置换出氢气的难易、元素最高价氧化物的水化物的强弱、单质之间的相互来比较。
B.元素非金属性是指元素的原子能力的大小。
通常可根据它们的单质与反应生成气态氢化物的难易、气态氢化物的、元素最高价氧化物的水化物的强弱、单质之间的相互来比较。
探究1.钠、镁、铝单质的金属性的强弱:实验现象如下总结:钠、镁、铝金属性的强弱顺序是。
硅、磷、硫、氯非金属性的强弱顺序是。
(4)元素的主要化合价:分析11—17号元素的主要化合价。
最高正价随递增呈现从到的性的变化。
最低负价随递增呈现从到的性的变化。
【总结归纳】1、元素的随递增而呈变化的规律叫做元素周期律。

第1单元课时1原子核外电子的排布教学设计【三维目标】知识与技能:(1)了解1-18号元素核外电子排布及相应的规律,并能用原子结构示意图表示上述元素的核外电排布。
(2)认识元素周期律,了解核外电排布与元素金属性、非金属性、化合价、原子半径的周期性变化。
(3)了解周期表的基本结构,了解主族元素在周期表中的位置与其原子结构及性质之间的关系。
知道同周期、同主族元素性质的变化趋势及规律。
过程与方法:(1)利用原子半径的周期性变化、钠镁铝的活泼性顺序、氢化物的热稳定性变化趋势、同周期元素化合价上升等,学习归纳思维方法。
(2)利用元素周期表的应用学习演绎思维方法。
情感与价值观:利用元素周期表及元素周期律发现简史,学习科学研究中的去伪存真,培养学生的创新意识。
【教学重点】(1)1-18号元素核外电子排布。
(2)元素周期律。
(3)元素周期表的基本结构。
【教学难点】元素周期律【教学方法】讨论、比较、归纳一、学习目标1.了解原子核外电子运动的特征。
2.初步掌握原子核外电子排布规律,会画1~18号元素原子结构示意图。
3.培养学生的观察能力、分析能力和抽象思维的能力。
二、教学重点及难点重点:知道原子核外电子是如何分层排布的。
难点:原子核外电子排布规律间相互制约关系。
三、设计思路教学中,首先引导学生观察1~18号元素的原子结构示意图,熟悉这些元素的原子核外电子排布情况,然后采用交流、讨论、归纳、总结的方法,探究原子核外电子的排布规律,得出以下规律:1.电子总是尽量先排布在能量最低的电子层,然后排布在能量较高的电子层。
即电子总是尽量先排在内层。
2.随着核电荷数的增加,元素原子的最外层电子数逐步增加,每一电子层都容纳一定数目的电子。
3.再引导学生观察稀有气体的原子核外电子的排布情况,探究排布规律,通过分析讨论下列规律:(1)各电子层最多容纳的电子数为2n 2个(n 为电子层序数)。
(2)各稀有气体元素的原子中最外层所容纳的电子数是8(氦除外)。

专题1 微观结构与物质的多样性第一单元核外电子排布与周期律教学目标1.了解1-18号元素核外电子排布及相应的规律,并能用原子结构示意表示上述元素的核外电排布。
2.认识元素周期律,了解核外电排布与元素金属性、非金属性、化合价、原子半径的周期性变化。
3.了解周期表的基本结构,了解主族元素在周期表中的位置与其原子结构及性质之间的关系。
知道同周期、同主族元素性质的变化趋势及规律。
教学重点1.1-18号元素核外电子排布。
2.元素周期律。
3.元素周期表的基本结构。
教学难点:元素周期律教学过程第一课时原子核外电子的排布【复习回顾】原子是有什么构成的?【板书】质子Z原子核原子Z A X 中子 A-Z核外电子 Z质量数(A)= 质子数(Z) + 中子数(N)原子:核电荷数=核外电子数=质子数=原子序数【板书】(边讲边画)【讲述】科学上形象地把能量不同的电子运动的区域称为电子层。
离核最近的称为第1电子层,也叫K层;能量稍高,离核较远的电子层称为第2电子层,也叫L层;由里往外依次为第3,4,5,6…层,也叫M,N,O,P…层等等。
这样不同能量的核外电子就排布在不同的电子层中。
【设问】核外电子到底是怎样排布在电子层里的呢?阅读课本第2页【强调】按照这一规律,排满了K层才排L层,排满L层才排M层。
【设问】原子核外电子的排布除了要遵循刚讲的由里到外即能量低的先排,还需要遵循哪些规律?阅读第3页【交流与讨论】各电子层最多容纳的电子数与电子层序数关系由教师引导推出结论2n2【小结】原子核外电子的排布规律(1)各电子层最多容纳电子数目为2n2。
(2)最外层电子数目不超过8个(K层为最外层时不超过2个)(3)次外层电子数目不超过18个(4)核外电子总是由能量低的电子层逐步进入能量高的电子层【课堂练习】1、判断正误2.质子数为13,核外有10个电子的微粒的符号和结构示意图是()。
(A)符号:Al 结构示意图:(B)符号:Al3+ 结构示意图:(C)符号:Al 结构示意图:(D)符号:Al3+ 结构示意图:3、电子层结构和氖原子相同的-1价阴离子的符号和结构示意图为()。

新教材苏教版高中化学必修第一册专题2研究物质的基本方法优秀教案教学设计课题:研究物质的基本方法教学目标:1. 了解物质的性质和变化的研究方法。
2. 掌握对物质进行化学分析和鉴定的实验方法。
3. 培养学生的科学实验能力和思维能力。
教学重点:1. 物质的性质和变化的研究方法。
2. 物质的化学分析和鉴定的实验方法。
教学难点:1. 学生对物质的研究方法的理解和应用。
教学准备:1. 实验室实验材料。
2. 多媒体教学课件。
教学过程:一、导入(5分钟)通过多媒体课件展示一些实验现象,引起学生的思考。
提问:你们是如何研究物质的性质和变化的?有什么方法?二、讲解与实验(20分钟)1. 讲解物质的性质和变化的研究方法,包括观察法、实验法、测定法等。
2. 进行相关实验,如观察不同物质的性质、探究物质变化的条件等。
三、讨论与总结(15分钟)1. 根据实验结果,让学生对物质的研究方法进行讨论,总结出各种方法的优缺点。
2. 引导学生思考如何选择适当的方法来研究不同的物质性质和变化。
四、拓展与应用(10分钟)1. 进一步介绍物质的化学分析和鉴定的实验方法,并进行相关实验。
2. 引导学生思考在实际应用中如何利用化学分析和鉴定的方法来研究和解决问题。
五、小结与反思(5分钟)概括本节课的内容和学到的知识,让学生自主总结和反思。
教学方法:1. 针对性讲解和实验相结合的教学方法,提高学生的实践动手能力。
2. 通过讨论和思考,培养学生的科学思维能力和问题解决能力。
教学评价:1. 对学生的课堂参与度和实验操作情况进行评价。
2. 对学生的讨论能力和思维能力进行评价。
教学延伸:1. 可以引导学生进行更多的实验探究,拓宽他们对物质研究方法的理解和应用。
2. 可以组织学生参观化学实验室,让他们亲身体验化学研究的过程。
:
[课后练习]
1.某同学在总结“构造原理、能量最低原理、泡利原理、洪特规则”后得出了:“在同一原子里,没有运动状态完全相同的电子存在”的结论。
你认为此结论是否正确,请说明理由。
2.按照下列元素基态原子的电子排布特征判断元素,并回答问题。
A的原子中只有一个能层且只含1 个电子;B的原子3p轨道上得到1个电子后不能再容纳外来电子;C的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;D的原子第三能层上有8个电子,第四能层上只有1个电子;E原子的外围电子排布为3s23p6。
(1)写出由A、B、C、D中的三种元素组成的化合物的化学式(至少写出5个):
;(2)写出用上述元素组成的物质制得A的单质的化学方程式(至少写出2个):
、
;(3)检验某溶液中是否含有D+的离子,可通过______________反应来实现;
检验某溶液中是否含有B—的离子,通常所用的试是_________和_______
(4)写出E的元素符号___________,要证明太阳上是否含有E元素,可采用的方法是。

化学2专题1第一单元原子核外电子排布与元素周期律(第一课时)原子核外电子的排布三维目标(一)知识与技能1.了解原子核外电子排布的基本规律。
能用原子(离子)结构示意图表示原子(离子)的核外电子排布。
2.能正确运用有关化学用语 (二)过程与方法回顾复习原子结构的有关知识,采用交流、讨论、归纳、总结的方法,探究原子核外电子的排布规律。
(三)情感、态度与价值观1.体会科学发现和发展的历程.领悟科学发展的艰辛。
2.培养学观察能力、分析能力和抽象归纳的能力。
学情分析在初中化学和高中化学1专题1第三单元《人类对原子结构的认识》中,学生已经初步接触到原子的内部结构,知道原子核的构成、原子核外电子是分层排布的,知道质量数与质子数、中子数的关系,知道质子数、核电荷数、核外电子数的关系,对离子的形成有了一些感性认识和初步概念。
但是理解不深,缺乏系统,在教学中需要复习:构成物质的微粒、原子结构、的表达含义、原子的质量数等。
教材分析1.知识体系与核心知识2.教学设计与教学评价内容特点与教学设计:观察图表+比较与对比+抽象归纳 教学重、难点1.重点:原子核外电子排布规律。
2.难点:原子核外电子排布规律间相互制约关系。
教学过程【复习】构成原子的微粒有哪些?这些微粒之间存在何种数量关系?质子:质子数(Z )决定元素的种类 原子核外电 子的排布 概念、规律、原理电子层、电子的能量、能量最低原理 原子核外电子 的排布规律实践、技能能写出1~18号元素 的原子结构示意图原子核【投影】原子中子:中子数(N)决定核数的种类核外电子:核外电子排布(尤其是最外层电子数)决定元素的性质数量关系:质量数(A)=质子数(Z)+中子数(N)中性原子:核电荷数=质子数=核外电子数电性关系阳离子:核电荷数=质子数>核外电子数阴离子:核电荷数=质子数<核外电子数【引入】你知道吗?电子在核外是分层排布的。
【思考】如何用原子结构示意图表示钠原子的核外电子排布?【投影】钠的原子结构示意图核电荷数电子层各电子层排布的电子数【观察与思考】由钠的原子结构示意图,思考为什么核外电子是分层排布的?各电子层的能量相同吗?请你按能量由低到高的顺序排列电子层。

元素周期表及其应用教学设计【课标要求】了解元素周期表的结构以及周期、族等概念。
通过自学有关周期表的结构的知识,培养学生分析问题、解决问题的能力。
通过精心设计问题,激发学生的求知欲和学习热情,培养学生的学习兴趣。
【教学重点】元素周期表的结构【教学方法】讨论、比较、归纳。
【教学过程设计】【复习】元素周期律:——元素的性质随着元素原子序数的递增而呈现周期性的变化。
包括:1、原子半径呈周期性变化2、元素化合价呈周期性变化3、元素金属性和非金属性呈周期性变化实质就是元素的原子核外电子排布的周期性。
【问题】:试根据元素周期律将1—18号元素排成一个表:学生活动:可能的结果是:具体分析表二:排布的原则是:1.将电子层数相同的元素按原子序数递增的顺序从左到右排列排成一个横行。
2.把最外层电子数相同(严格地说是外围电子排布相似)的元素按电子层递增的顺序从上到下排成纵行。
把最外层电子数排满的同一纵行。
学生阅读课本第七页到第八页。
一、元素周期表的结构:【交流与讨论】(1)元素周期表的编排原则:把电子层数相同的元素排在同一横行,把最外层电子数相同的元素按电子层数递增的顺序排在同一个纵行?(2)元素周期表中有多少横行(称为周期)、纵行(称为族)?(3)原子电子层数与周期表周期数的关系,最外层电子数与族序数的关系?【归纳与整理】(一)元素周期表的结构1、周期:元素周期表共有7个横行,每一横行称为一个周期,故元素周期表共有7个周期①周期序数与电子层数的关系:周期序数与电子层数相同②周期的分类元素周期表中,我们把1、2、3周期称为短周期,4、5、6、7周期称为长周期,第7周期又称为不完全周期,因为一直有未知元素在发现。
【课堂练习1】请大家根据元素周期表,完成下表内容。
【小结论】1、周期序数用阿拉伯数字表示,周期序数与电子层数相等。
2、族:元素周期表共有18个纵行,除了8、9、10三个纵行称为Ⅷ外,其余的每一个纵行称为一个族,故元素周期表共有16个族。

第2课时原子核外电子的排布[学习目标定位] 1.熟知原子核外电子排布的“两原理一规则”。
2.知道原子核外电子排布的轨道能量顺序,会正确书写原子核外电子排布式和轨道表示式。
一核外电子的排布原理1.原子核外电子排布的轨道能量顺序设想从氢原子开始,随着原子核电荷数的递增,原子核每增加一个质子,原子核外便增加一个电子,这个电子大多是按下图所示的轨道能量顺序进行填充:观察分析上图,讨论回答下列问题:(1)在多电子原子中,电子进入能级的先后应遵循的原理是什么?答案能量最低原理。
电子最先排布在能量低的轨道上,然后依次排布在能量较高的轨道上。
(2)多电子原子核外电子排布是否完全遵循电子层的顺序?答案由上图可知,从第三电子层开始各轨道不完全遵循电子层顺序,产生了轨道能量交错排列,即产生“能级交错”现象。
(3)轨道的能量高低主要是由哪些因素决定的?答案各轨道的能量由电子层序数和轨道类型共同决定,各轨道的能量高低顺序,可由下列公式得出:n s<(n-2)f<(n-1)d<n p(n表示电子层序数)。
2.下图是某原子核外第二电子层的电子轨道示意图:(1)请填写对应的符号:(2)电子层与原子轨道类型、原子轨道数目有何关系? (3)同一原子轨道最多容纳的电子数是多少?其依据是什么? 答案 (1)①2s ②2p y ③2p z ④2p x(2)第n 电子层有n 种原子轨道类型,有n 2个原子轨道。
(3)同一轨道上的电子自旋方向只能相反,不能相同,最多只能容纳2个电子。
其依据是泡利不相容原理。
3.每个原子轨道中最多只能容纳2个电子,通常称为电子对。
电子除了空间运动状态外,还在不停地自旋,电子的自旋有顺时针和逆时针两种相反的状态,常用上下箭头(↑和↓)表示自旋状态相反的电子。
在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋状态相反,这一原理被称为泡利不相容原理。
如2s 轨道上的轨道表示式为,不能表示为。
4.能量相同轨道电子排布规则(1)在能量相同的原子轨道上,电子的排布将尽可能占据不同的轨道,而且自旋状态相同,这就是洪特规则。
2.3.2原子核外电子排布教材在学习了原子结构发展历程的基础上,引入了多电子原子的核外电子排布的基础知识,包括电子层、原子结构示意图等,并以惰性气体元素为例,让学生完成相应的原子结构示意图的书写,强化了学生对知识运用和理解。
引导学生从微观角度进行分析,提升学生解决问题的能力!1、宏观辨识与微观探析:从微观角度了解原子核外电子排布的规律,能用原子(离子)结构示意图表示核外电子排布。
2、证据推理与模型认知:建构原子结构示意图模型,认识核外电子的排布规律。
能书写1至18号元素和惰性元素的核外电子排布。
3、科学探究与创新意识:培养学生分析、归纳能力,掌握元素原子核外电子排布规律。
1、元素原子核外电子的排布规律2、能用原子(离子)结构示意图表示核外电子排布3、元素化学性质与核外电子排布的规律多媒体课件,图片等知识回顾1、原子结构的发展历程包________、________、________、_______、_______2、玻尔提出的原子结构模型的内容是______________________________________________3、原子由_______、_______和______组成。
4、有关概念:(1)元素__________________________________________________________(2)核素__________________________________________________________(3)同位素_________________________________________________________(4)原子序数______________________________________________________ 5、原子序数、质子数、核外电子数有什么关系?引入新课根据上节所学知识我们知道原子是由质了、中子和电子构成,原子不同,核外电子数目也不同。
原子核外电子的排布教学设计Revised by Liu Jing on January 12, 2021《原子核外电子的排布》教学设计一、教材分析本章《物质结构元素周期律》是高中必修二第一章的内容,是在九年级化学上册第四单元《物质构成的奥秘》的理论基础上进一步的深入学习,而本节内容——原子核外电子的排布又是本章的核心内容,是后面学习元素周期律的基础。
二、学生分析学生初中时已经学习了原子的构成和元素,对核外电子是分层排布这一知识点也做了初步了解,所以在此节内容的学习之前学生就已经具备了一些原子的相关基础知识。
同时也具备一定的数学基础,能够对一些数据进行分析处理。
三、教学目标(一)知识与技能目标1.了解原子核外电子运动的特征。
2.了解元素原子核外电子排布的基本规律,能用原子(离子)结构示意图表示常见原子(离子)的核外电子排布。
(二)过程与方法目标培养学生分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工。
四、教学重难点重点:原子核外电子分层排布、原子核外电子的排布及其规律。
难点:原子核外电子排布规律间相互制约关系。
五、教学过程【引入】大家好,这节课我们进入到新课的学习:【板书】原子核外电子的排布【提问】在进入新课内容之前,我们先来复习一下以前学习的内容。
初中的时候在《物质构成的奥秘》这一章当中我们就学习了原子的相关知识,下面我们来回顾一下,什么是原子原子由什么微粒构成【学生回顾】……【板书】【教师】原子由原子核和核外电子构成,而原子核又由质子和中子构成,其中质子带一个单位的正电荷,中子不带电。
核外电子则带一个单位的负电荷。
【提问】那么为什么原子对外显电中性呢?【学生】质子所带的正电荷数等于核外电子所带的负电荷数,所以原子不显电性。
【教师】很好,其中我们还学习到了一个重要的等式关系:核电荷数=质子数=核外电子数。
所以质子所带的正电荷与核外电子所带的负电荷相互抵消,导致原子不显电性。
【过渡】好,我们都知道了原子的结构。
核外电子的排布规律一、评价要点1.认识:原子结构示意图。
2.知道:核电荷数为1~18的元素的原子结构示意图。
3.运用:原子核外电子分层排布的一般规律解题。
二、方法指引1.原子结构示意图的的含义电子层(从里向外依次为K层、L层、M层)各电子层排布的电子数核电荷数2.在含有多个电子的原子里,电子依能量的不同分层排布,其主要规律是:(1)核外电子总是尽先排布在能量较低的电子层,然后由里向外,依次排布在能量逐步升高的电子层。
(2)原子核外各电子层最多容纳2n2个电子。
(3)原子最外层电子数目不超过8个(K层为最外层时不超过2个),次外层电子数目不超过18个,倒数第三层电子数目不超过32个。
三、典型例题例1 某元素(核电荷数小于20)最外层电子数是次外层电子数的a(1<a<4)倍,则该原子核内的质子数是 ( )A. 2aB. 8a +2C. 2a +10D. 2a +2[分析] 本题考查核外电子的排布规律,答题时按电子层数分析讨论。
当该原子核外有三或四个电子层时,则该原子最外层电子数为8a(8a>8),显然不符合核外电子的排布规律;当该原子核外有两个电子层时,则最外层电子数为2a(2a<8),则符合核外电子的排布规律,所以该原子的核外电子数为2a+2,即核内的质子数为2a+2。
[答案] D例2今有A、B、C、D四种元素,其中A元素是1826年一位法国青年科学家发现的。
他在研究海水制盐时,往剩余的副产物苦卤中通入氯气后发现溶液颜色变深,若进一步提取,可得一种红棕色液体,有刺鼻的气味。
B、C、D的原子核外电子层均不超过3个。
D原子核内的质子数正好等于C原子核内质子数的2倍,而它们最外电子层上的电子数恰好相等。
D 原子的最内电子层上电子数则是B原子核外电子总数的2倍。
则(1)四种元素分别为:A_____,B______,C______,D______。
(2)由上述某元素的单质与另两种元素的化合物反应生成两种酸的化学方程是。
第2课时原子核外电子排布发展目标体系构建1.能从宏观和微观结合的视角理解原子结构模型提出的证据,知道常见的原子核外电子排布规律。
2.初步形成模型构建的认知方式,会画1~18号元素的原子结构示意图。
一、原子核外电子排布1.电子层(1)概念:在多电子原子里,把电子运动的能量不同的区域简化为不连续的壳层,称作电子层。
(2)不同电子层的表示及能量关系各电子层由内到外电子层数 1 2 3 4 5 6 7 字母代号K L M N O P Q 离核远近由近到远能量高低由低到高2.电子分层排布(1)能量最低原理核外电子总是优先排布在能量最低的电子层里,然后再由里往外排布在能量逐步升高的电子层里,即按K→L→M→N……顺序排列。
(2)电子层最多容纳的电子数①各电子层最多容纳2n2个电子。
如K、L、M、N层最多容纳电子数分别为2、8、18、32。
②最外层电子数目最多不能超过8个(K层为最外层时,最多只能容纳2个)。
③次外层最多能容纳的电子数不超过18个。
根据电子分层排布的原理,写出3号、9号、11号、17号、19号元素的原子结构示意图。
[提示]二、元素性质与原子核外电子排布的关系1.化学反应的特点:原子核不发生变化,但最外层电子数可能发生变化。
2.化合价和核外电子排布的关系(1)活泼金属在反应中,一般失去电子,表现正化合价。
(2)活泼非金属在反应中,一般得到电子,表现负化合价。
(3)化合价与得失电子的关系:失去的电子数=正价的数值;得到的电子数=负价的数值。
微点拨:原子的最外层电子数决定了元素的化学性质,一般说来,最外层电子数小于4易失电子,最外层电子数大于4易得电子,最外层电子数等于4,既不易得也不易失电子。
1.判断正误(正确的打“√〞,错误的打“×〞。
)(1)最外层电子达到稳定结构的微粒只能是稀有气体的原子。
(× )(2)原子的核外电子排布决定了元素的化学性质。
(√ )(3)依据原子的核外电子排布,可知同位素的化学性质非常相似。
微专题2 原子结构与核外电子排布规律
1.原子核外电子排布表示方法
(1)原子结构示意图是核外电子排布规律的具体体现,其构成图示如下:
(2)原子失去电子变为阳离子时,原子核不变,电子层数改变,最外层电子数改变,原子带正电荷;原子得到电子变为阴离子时,原子核不变,电子层数不变,最外层电子数改变,原子带负电荷。
2.元素性质与原子核外电子排布的关系
(1)当原子最外层电子数达到8(氦为2)时,该原子处于稳定结构,化学性质较稳定。
(2)一般来讲:当原子最外层电子数小于4时,易失去电子,表现为金属性;最外层电子数大于4时,易得到电子,表现为非金属性;最外层电子数等于4时,既不易失去电子也不易得到电子。
(3)元素的化合价的数值与原子的最外层电子数有关。
例如:钠原子最外层只有1个电子,容易失去这个电子而达到稳定结构,因此钠元素在化合物中通常显+1价;氯原子最外层有7个电子,只需得到1个电子便可达到稳定结构,因此氯元素在化合物中常显-1价。
【典例】核内中子数为N的R2+,质量数为A,则它的n g氧化物中所含质子的物质的量是( )
A.
n
A+16
(A-N+8) mol
B.
n
A+16
(A-N+10) mol
C.(A-N+Z) mol
D.n
A
(A-N+6) mol
A [在化学变化中质子、中子均不变,故R2+的质量数为A,中子数为N,则R原子的质量数也为A,中子数也为N,故R原子的质子数为A-N,R2+的氧化物为RO,摩尔质量为(A+
16) g·mol-1,n g RO的物质的量为n
A+16
mol。
1 mol RO中含质子(A-N+8) mol,故n g RO
中含质子的物质的量为n
A+16
(A-N+8) mol,A项正确。
]
1.我国安徽发现了全国最大的钼矿,下图是钼元素的相关信息,下列有关钼的说法错误的是( )
A.95Mo原子核内有53个中子
B.95Mo原子核外有42个电子
C.92Mo、95Mo、98Mo互为同位素
D.92Mo、95Mo、98Mo的化学性质有较大的不同
D [由图可知,95Mo表示质子数为42,质量数为95,中子数为53,则A、B正确。
92Mo、95Mo、98Mo质子数相同,质量数(中子数)不同,互为同位素,C正确。
92Mo、95Mo、98Mo核外电子排布相同,化学性质相同,D错误。
]
2.下列叙述中正确的是( )
A.23592U和23892U是中子数不同质子数相同的同种核素
B.中子数为20的氯原子可以表示为2017Cl
C.同种元素的原子均有相同的质子数和中子数
D.F-的结构示意图可以表示为
D [23592U和23892U是同种元素的两种不同核素,A项错误;中子数为20的氯原子,其质量数为20+17=37,其符号为3717Cl,B项错误;互为同位素的原子的质子数相同,但中子数不同,C项错误;F的质子数为9,核外电子数也是9,F-核外有10个电子,其离子结构示意图为,D项正确。
]
3.下列原子或离子的结构示意图正确的是( )
[答案] B
4.下列有关化学用语的说法正确的是( )
A.氯原子的结构示意图:
B.中子数为146、质子数为92的铀(U)原子:14692U
C.1H与2H互称同位素
D.230Th和232Th的化学性质不相同
C [氯原子最外层有7个电子,A项错误;铀原子的质量数为146+92=238,原子符号为23892U,B项错误;同位素的物理性质不同,化学性质几乎完全相同,D项错误。
] 5.近年来,科学家通过微粒加速器进行了一周的实验,获得了6个非常罕见的铁(26号元素)原子,该铁原子的质量数为45 ,接着,科学家又使用特制的测量仪器观测到,这6个原子中有4个发生了衰变,这一实验证实了曾经预言的双质子衰变方式,即有一个原子同时放出两个质子的衰变方式。
(1)该铁原子的核内中子数为,该原子的核外电子数为。
(2)该铁原子的衰变是化学变化吗?说明理由。
[解析] (1)铁元素为26号元素,中子数=质量数-质子数=45-26=19,核外电子数=质子数=26。
(2)化学变化中原子种类不变,即原子所含质子数不变,衰变时质子数减少,故衰变不属于化学变化。
[答案] (1)19 26 (2)不是。
化学变化中原子种类不变,即原子所含质子数不变,衰变时质子数减少,故衰变不属于化学变化。