第五单元质量守恒定律知识点+例题+练习(含答案)
- 格式:doc
- 大小:443.50 KB
- 文档页数:12
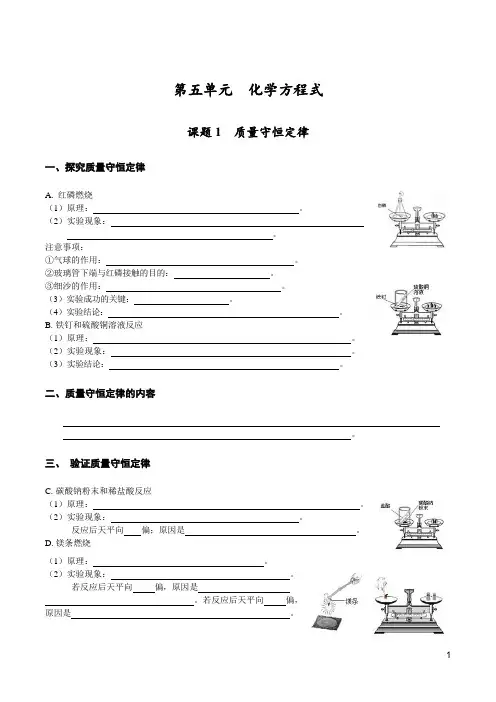
第五单元化学方程式课题1 质量守恒定律一、探究质量守恒定律A. 红磷燃烧(1)原理:。
(2)实验现象:。
注意事项:①气球的作用:。
②玻璃管下端与红磷接触的目的:。
③细沙的作用:。
(3)实验成功的关键:。
(4)实验结论:。
B.铁钉和硫酸铜溶液反应(1)原理:。
(2)实验现象:。
(3)实验结论:。
二、质量守恒定律的内容。
三、验证质量守恒定律C.碳酸钠粉末和稀盐酸反应(1)原理:。
(2)实验现象:。
反应后天平向偏;原因是。
D.镁条燃烧(1)原理:。
(2)实验现象:。
若反应后天平向偏,原因是。
若反应后天平向偏,原因是。
四、质量守恒定律的原因2、两个一定变:。
3、两个可能变:。
五、化学方程式的意义1、宏观:。
2、微观:。
3、质量:即相对分子质量与化学计量数乘积的比。
课题2 如何正确书写化学方程式一、书写原则1、;2、。
二、书写步骤1234三、配平方法1、观察法(1(2(3(4(5(6(72、奇数变偶法(1(2(3(4(53、归一法(1(24、设未知数法(1)(2)(3)课题3 利用化学方程式的简单计算利用化学方程式的计算步骤(1)设:根据题意设未知数。
(2)写:正确写出反应的化学方程式。
(3)算:写出相关物质的相对分子质量与化学式前面的化学计量数之积,以及已知量和未知量。
(4)列:列比例式,求解。
(5)答:简明地写出答案。
例题:电解18g水会产生多少氧气和氢气?。

第五单元化学方程式课题1 质量守恒定律★知识点1:质量守恒定律的内容参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,这个规律叫做质量守恒定律。
易错警示(1)质量守恒定律应用于化学变化,不能应用于物理变化。
(2)质量守恒定律说的是“质量守恒”而不是其他方面的守恒。
(3)化学反应中,各反应物之间要按一定的质量比相互作用,因此参加反应的各物质的质量总和不是任意比例的反应物质量的简单加和。
(4)不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中。
(5)“质量和” 相等,而非“质量比”相等。
(6)质量守恒中的“守恒”是指物质的总质量守恒,而非某一种或几种物质的质量守恒。
★知识点2:利用原子、分子知识解释质量守恒的原因(1)化学反应的实质化学反应的过程,就是参加反应的各物质(反应物)的原子重新组合而生成其他物质(生成物)的过程。
由分子构成的物质在化学反应中的变化过程可表示为:分子原子新分子新物质(2)质量守恒的原因①宏观上:化学反应前后元素的种类没有改变,元素的质量也不变,所以反应前后物质的质量总和必然相等。
②微观上:在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子本身的质量也没有改变。
所以,化学反应前后物质的质量总和必然相等。
(3)理解质量守恒定律要抓住“六个不变”“两个一定变”“两个可能变”。
⎧⎧⎪⎪⎨⎪⎪⎪⎪⎩⎨⎧⎪⎪⎪⎨⎪⎪⎪⎩⎩反应物、生成物的总质量不变宏观元素质量不变元素种类不变六个不变原子的种类不变微观原子的数目不变原子的质量不变:⎧⎨⎩宏观物质的种类一定变两个一定变微观:构成物质的分子种类一定变⎧⎨⎩分子的总数可能变两个可能变元素化合价可能变★知识点3:质量守恒定律的应用(1)推断某反应物、生成物的组成元素(依据:化学反应前后元素种类和质量不变)。
(2)推断化学方程式中的未知化学式及化学式前系数(依据:化学反应前后元素种类、原子数目不变)。
(3)解释化学变化中的质量变化、密闭容器中化学反应的相关数据问题(依据:化学反应前后反应物和生成物的总质量不变)。

质量守恒定律典型例题质量守恒定律的理解:质量守恒定律描述的是化学反应前后各种“守恒”。
首先我们要清楚有哪些守恒:宏观上:1、物质的质量守恒——参加反应的各物质的质量总和==反应生成的各物质的质量总和注意:是“质量总和”,不是单个的某些物质的质量2、元素的守恒——元素的种类和元素的质量微观上:原子的守恒——原子的种类、原子的数目、原子的质量(原子是化学变化中的最小粒子)另外注意:质量守恒定律定律除了这些守恒之外,还表现为,对于任何一个化学反应,参加反应的各种物质和生成的各种物质之间有固定的质量比。
例如:4 P + 5O2点燃 2P2O5化学计量数(也就是配平系数)乘以相对分子质量(或相对原子质量)→ 4*31 5*32 2*142124 160 284也就是说:任何一个磷与氧气的反应中,磷与氧气与五氧化二磷的质量比都是124:160:284。
比如用31克的磷燃烧,需要消耗多少氧气呢?我们可以利用“比恒定”列出数学式子:124:160=31g:x 求出氧气质量所以,质量守恒定律理解为:“和相等,比恒定”[例1] 对质量守恒定律的正确理解是()A.参加反应的各种物质的质量不变B.化学反应前后各物质的质量不变C.化学反应前的各物质质量总和等于反应后生成的各物质质量总和D.参加化学反应的各物质质量总和与反应后生成的各物质质量总和相等分析:质量守恒定律是指反应物与生成物的质量关系,即参加反应的各物质与反应后生成的各物质之间的质量关系。
无数实验证明:参加反应的各物质质量总和=反应后生成的各物质质量总和,这就是质量守恒定律。
因此A、B不正确。
C中“化学反应前的各物质”不一定是“参加”反应的各物质,故不正确。
答案:D。
[例2] 参加反应的各物质质量总和等于反应后生成的各物质质量总和,是因为()。
A.反应后物质的种类没有变化B.反应后元素的种类没有变化C.反应后原子的种类、数目和质量没有变化D.反应后分子的种类、数目和质量没有变化分析:化学反应的过程是反应物的原子重新组合而生成其它物质的过程。

质量守恒定律(习题)1.下列现象能用质量守恒定律解释的是()A.50 g 糖溶于200 g 水中,制得250 g 糖水B.氧化钙与水反应生成氢氧化钙,反应前后物质总质量不变C.湿衣服晾干后,质量变小D.100 mL 水与100 mL 酒精混合后总体积小于200 mL 2.下列现象不能用质量守恒定律解释的是()A.煤燃烧后留下的灰烬的质量比煤的质量少了B.红磷在密闭的锥形瓶中燃烧,反应前后质量相等C.水结冰前后质量保持不变D.加热高锰酸钾制得氧气后,剩余固体的质量比高锰酸钾质量少了3.用质量守恒定律解释:铜在氧气中加热后,生成物(氧化铜)的质量比原来铜的质量大。
4.在化学反应A+B→C+D 中,参加反应的A 和B 的总质量为14 g,生成D 的质量为6 g,则生成C 的质量是g。
5.在化学反应A→B+C 中,当一定量A 反应一段时间后,生成56 g B 和44 g C,则发生反应的A 质量为()A.12 g B.44 g C.56 g D.100 g 6.在化学反应A+B C 中,若12 g A 参与反应,生成28 g C,其中D 的质量为3 g,则参加反应的 A 和B 的质量比为()A.1:1 B.2:3 C.3:4 D.3:77. a g 高锰酸钾加热全部分解后,生成b g 锰酸钾和c g 二氧化锰,则反应中得到氧气的质量为()A.(a+b-c)g B.(a-b)gC.(a-b-c)g D.(a-c)g8.在化学反应E+F→G 中,m 克E 和n 克F 反应生成G 的质量()A.等于(m+n)g B.小于(m+n)gC.大于(m+n)g D.不大于(m+n)g9.下列关于质量守恒定律的说法正确的是()①在化学反应前后,元素的种类一定不变②在化学反应前后,分子的种类一定不变③在化学反应前后,物质的种类一定不变④在化学反应前后,原子的种类一定不变A.①②B.②③C.③④D.①④10.硝酸银(AgNO3)固体见光或者受热易分解,故用棕色瓶保存,AgNO3固体受热分解时,放出一种有刺激性气味的气体,它可能是()A.SO2B.O2C.N2D.NO211.根据化学方程式不能获得的信息是()A.反应中的反应物和生成物B.反应物、生成物之间的质量关系C.化学反应速率的快慢程度D.反应发生所需要的条件12.关于化学方程式3Fe+2O2 Fe3O4的说法错误的是()A.反应物都是单质B.该反应属于化合反应C.反应后固体质量增加D.3 份质量的铁与2 份质量的氧气反应后生成1 份质量的四氧化三铁【参考答案】1. B2. C3.铜在氧气中加热生成氧化铜,根据质量守恒定律,参加反应的铜和氧气的质量总和等于生成的氧化铜的质量,所以生成物的质量比原来铜的质量大。

质量守恒定律大题专练(含答案)
本文档包含一系列质量守恒定律的大题练,并提供答案。
以下是练及答案的详细内容:
1. 问题:在一个封闭系统中,物质A和物质B发生化学反应生成物质C。
如果物质A的质量为10克,物质B的质量为15克,最终生成的物质C的质量是多少克?
答案:质量守恒定律指出,在封闭系统中,物质的总质量不会发生改变。
因此,物质A和物质B的质量之和等于生成物质C的质量。
在这个例子中,物质C的质量为10克 + 15克 = 25克。
2. 问题:一个木头燃烧产生了灰烬和烟气。
在这个过程中,质量是否守恒?为什么?
答案:质量守恒定律适用于封闭系统,而燃烧过程发生在开放系统中。
当木头燃烧时,一部分木材质量转化为了灰烬,一部分转化为了烟气。
然而,一些部分的质量也以灰烬和烟气的形式逸出系统,因此质量没有完全守恒。
3. 问题:在一个封闭系统中,一个氧气分子和两个氢气分子发生反应生成水分子。
氧气分子的质量为32克,氢气分子的质量为2克。
生成的水分子的质量是多少克?
答案:根据质量守恒定律,反应过程中物质的总质量不会发生改变。
因此,生成的水分子的质量应等于氧气分子和氢气分子质量之和,即32克 + 2克 + 2克 = 36克。
4. 问题:为什么铁锈生成后,金属铁的总质量会增加?
答案:铁锈是由铁与氧气发生化学反应生成的。
当铁与氧气反应时,氧气分子与铁离子结合形成铁锈。
铁离子和氧气的结合增加了铁物质的质量,因此金属铁的总质量会增加。
以上是《质量守恒定律大题专练(含答案)》的内容,希望对您有所帮助。

《质量守恒定律》练习题一、单选题(本大题共24小题,共48.0分)1.科学家探索用CO除去SO2,该研究涉及的一个反应SO2+2CO=2X+S,则X为()A. CO2B. CC. CS2D. COS2.在化学反应前后:①物质的化学性质②原子的种类③元素的种类④反应物的质量总和与生成物的质量总和。
其中一定不发生变化的是()A. ①②③④B. ①③④C. ②③④D. ②③3.汽车尾气是空气污染的元凶之一,使用催化净化装置可有效减少尾气污染。
下图是一种处理汽车尾气的反应微观示意图,下列有关说法正确的是()A. 反应前后均为纯净物B. 反应前后分子数不发生改变C. 该反应可以减少NO2的排放D. 该图不符合质量守恒定律4.关于下列观点中错误的有①铁丝在氧气中燃烧,生成物的质量比铁丝的质量大,这个反应不遵守质量守恒定律②因为“质量守恒”,所以氢气燃烧生成的水中一定含有氢元素③根据质量守恒定律,二氧化碳变成“干冰”后质量保持不变④根据质量守恒定律,双氧水和二氧化锰的混合物制取氧气前后,二氧化锰质量不变。
A. ②③④B. ①②④C. ①③④D. ①②③④5.偏二甲肼(C2H8N2)与N2O4反应放出的能量能把火箭送入太空。
该化学方程式为C2H8N2+2N2O4=2X↑+3N2↑+4H2O↑。
下列说法正确的是()A. X的化学式为COB. 偏二甲肼中碳的质量分数为40%C. 该反应属于化合反应D. 生成N2和H2O的质量比为14:96.下图中的四位同学对H2+Cl22HCl的认识中,不正确的是()A. B. C. D.7. 下列关于化学方程式C +O 2点燃̲̲̲̲̲̲CO 2的读法,错误的是( )A. 碳和氧气在点燃的条件下生成二氧化碳B. 1个碳原子与1个氧分子反应生成1个二氧化碳分子C. 每12份质量的碳跟32份质量的氧气完全反应,生成44份质量的二氧化碳D. 碳加上氧气点燃等于二氧化碳8. 在一个密闭容器内有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表,下列说法正确的是( )物质 甲 乙 丙 丁反应前质量/g4 6 111 4 反应后质量/g 待测15 0 84 A. 该反应不遵循质量守恒定律B. 丙一定属于化合物C. 反应后密闭容器中甲的质量为22 gD. 该反应中,乙、丙的质量变化之比为6:1119. 小明同学从中获得以下信息:①该反应反应物是硫和氧气;②反应发生条件是点燃;③反应前后元素种类和原子个数不变;④反应前后分子总数保持不变;⑤参加反应的硫和氧气的质量比为2:1其中正确的信息是( )A. ①②④⑤B. ①②③C. ④⑤D. ①②③⑤10. 化学方程式不能提供的信息是( )A. 各物质之间的质量比B. 化学反应的快慢C. 在什么条件下发生反应D. 哪些物质参加反应11. 某物质在空气中燃烧生成二氧化碳和水,则关于这种物质的组成描述正确的是( )A. 该物质只含有碳、氢元素B. 该物质一定含有碳、氢、氧元素C. 该物质一定含有碳元素和氢元素,可能含有氧元素D. 无法确定12.如图为某化学反应的微观示意图。

2024年人教版九年级上册化学第五单元课后练习题(含答案和概念)试题部分一、选择题:1. 下列物质中,属于纯净物的是()A. 自来水B. 空气C. 氧气D. 酒精溶液2. 下列关于分子的说法,错误的是()A. 分子是由原子组成的B. 分子在不停的运动C. 分子之间有间隔D. 分子的质量和体积都很小3. 下列关于原子的说法,正确的是()A. 原子是由质子、中子和电子组成的B. 原子是化学变化中的最小粒子C. 原子不可再分D. 原子的质量和体积都很小4. 下列元素中,属于金属元素的是()A. 氧B. 碳C. 氢D. 铁锌5. 下列物质中,属于单质的是()A. 氧气B. 水C. 二氧化碳D. 氯化钠6. 下列关于化合价的描述,错误的是()A. 化合价表示元素在化合物中的相对位置B. 化合价表示元素在化合物中的相对数量C. 化合价表示元素在化合物中的相对质量D. 化合价表示元素在化合物中的相对能力7. 下列关于化学式的说法,正确的是()A. 化学式表示物质的一个分子B. 化学式表示物质的一个原子C. 化学式表示物质的一个离子D. 化学式表示物质的一个元素8. 下列关于质量守恒定律的说法,错误的是()A. 反应前后物质的质量不变B. 反应前后元素的种类不变C. 反应前后原子的种类不变D. 反应前后分子的种类不变9. 下列关于化学方程式的说法,正确的是()A. 化学方程式表示反应物和物的质量关系B. 化学方程式表示反应物和物的分子关系C. 化学方程式表示反应物和物的原子关系D. 化学方程式表示反应物和物的离子关系10. 下列关于氧化反应的说法,错误的是()A. 氧化反应是指物质与氧发生的反应B. 氧化反应一定有氧气参与C. 氧化反应是一种放热反应D. 氧化反应是一种还原反应二、判断题:1. 分子和原子都是构成物质的基本粒子。
()2. 同种分子性质相同,不同种分子性质不同。
()3. 原子的核内一定含有中子。
()4. 化学变化的实质是分子破裂成原子,原子重新组合成新分子。
课题1 质量守恒定律一选择题1.下列有关对质量守恒定律的理解,正确的是( )A.将5 g铁和5 g铜混合加热后,物质的总质量为10 g,遵循质量守恒定律B.化学反应前后分子的总数一定不会发生变化C.5 g硫和5 g氧气恰好完全反应后,生成物质量为10 gD.镁条燃烧后质量增加,不遵循质量守恒定律2.用如图所示装置证明质量守恒定律,反应前后容器中物质的总质量不相等的是()3.镁带在耐高温的容器中密封(内含空气)加热,下图中能正确表示容器里所盛的物质总量变化的是()4.关于化学方程式CH4+2O2 CO2+2H2O的描述正确的是()A.甲烷加氧气在点燃条件下,反应生成二氧化碳和水B.1个甲烷和2个氧气在点燃条件下,生成1个二氧化碳和2个水C.1个CH4分子和2个O2分子在点燃条件下,生成1个CO2分子和2个H2O分子D.1 gCH4和2 gO2在点燃条件下,生成1 gCO2和2 gH2O5.现有32 g某可燃物在密闭容器中完全燃烧后,测得生成88 g二氧化碳和72 g 水。
关于该可燃物的说法正确的是( )A.一定是氧化物B.只含有碳、氢两种元素C.一定含有碳、氢、氧三种元素D.一定含有碳、氢元素,可能含有氧元素6.在一定条件下,一密闭容器内发生某反应,测得反应前后各物质的质量如下表所示。
下列说法错误的是( )A.a一定是反应物B.x+y=20C.x的取值范围一定是0≤x≤30D.反应生成c与d的质量比为2:17.如图反映了某个化学反应中各种物质质量与时间的关系。
下列描述正确的是( )A.该反应是化合反应B.甲的相对分子质量大于乙C.丙是反应物,甲和乙是生成物D.t1时,丙的质量一定等于甲、乙的质量之和二非选择题1.请写出下列物质的化学式:氧化镁:________,氧化铝:_________,二氧化碳:______,二氧化硫:_______,高锰酸钾:______,锰酸钾:________,氯酸钾:_________,氯化钾:_______,过氧化氢:_______,四氧化三铁:_____,五氧化二磷:_____,二氧化锰:_____。

质量守恒定律典型例题例1 镁带在空气中燃烧生成氧化镁的质量比金属镁的质量大,有人说这个事实不符合质量守恒定律,你说对吗?为什么?选题目的:本题目的在于考察学生是否真正理解质量守恒定律思路分析:在应用质量守恒定律时,要确实理解定律中“参加”和“生成”两个词在具体化学反应中的含义。
镁带在空气中燃饶参加反应的物质不仅有金属镁还有空气中的氧气依据质量守恒定律金属镁和空气中氧气的质量和为生成物氧化镁的质量。
解答:此说法不对。
镁带在空气里燃饶,是镁和氧气发生了化学反应。
根据质量守恒定律,反应后生成物氧化镁的质量,一定等于参加反应的镁带和氧气的质量和,所以生成物的质量比镁带质量重。
启示:对于知识来说不仅要记住,而且要真正理解。
例2 蜡烛燃烧后的产物有二氧化碳和水,根据质量守恒定律可知,该物质的组成中一定含有(______)元素和(______)元素,可能含有(______)元素。
选题目的:本题是考察学生对质量守恒定律本质——原子的三不变(化学反应前后原子的种类没有改变,原子的数目没有增减,原子的质量也没发生变化)的认识和应用。
思路分析:蜡烛在空气中燃烧生成二氧化碳和水,可初步表示为:蜡烛+O2——CO2+H2O根据原子种类在反应前后不变的道理可知,生成物中碳、氢原子来自可燃物,但不能确定生成物中的氧原子是全部来自空气中的氧气,还是一部分来自空气中的氧气、另一部分来自蜡烛,所以只能证明蜡烛中可能含有氧原子,原子是元素的个体,是构成并体现元素性质的基本单元。
解答:蜡烛的组成中一定含有碳元素和氢元素,可能含有氧元素。
启示:能灵活运用知识比只记住知识更重要。
例3 和的混合物38g,内含 8.5g,将上述混合物加热一段时间后,停止加热,冷却后称得残余固体重28.4g。
问残余物中包含几种物质?各是多少克?选题角度:考查依据质量守恒定律进行计算思路分析:设分解后生成的质量为。
根据质量守恒定律,可求出生成的质量为:残余固体中包括二氧化锰、氯化钾和未参加反应的氯酸钾。

第五单元化学方程式课题1 质量守恒定律知识点一质量守恒定律一、实验探究化学反应前后物质的质量关系1、红磷燃烧前后质量的测定2、铁钉与硫酸铜溶液反应前后质量的测定二、质量守恒定律1、内容参加化学反应的各物质的质量总和,等于反应后生成物的质量总和,这个规律叫做质量守恒定律。
2、探究反应前后质量是否守恒应注意的问题以上实验说明,探究反应前后质量是否守恒应注意:反应中是否有气体生成;反应中是否有外界物质进入。
理解辨析1、验证质量守恒定律应注意什么?凡有气体参加或生成的反应,在设计实验验证反应前后遵循质量守恒时,应该在密闭容器中进行。
三、理解质量守恒定律应注意的问题。
1、正确理解“参加反应”的含义不能把“参加反应的物质”理解成“反应物”。
化学反应中往往存在“反应物过量”问题。
2、不要漏掉气体或沉淀很多化学反应有气体或沉淀生成,因此“生成的各物质质量”总和包括“固、液、气”三种状态的物质。
讨论质量守恒定律时,各状态均要一起讨论,不能遗漏。
也不能因为生成了气体,而误认为质量减少,不符合质量守恒定律。
3、明确普遍性质量守恒定律是化学变化中的普遍规律,没有一个化学反应例外。
4、明确适用范围质量守恒定律解释的是化学变化而不是物理变化。
如1g水加热后变成了1g水蒸气,这一变化虽然前后质量相等,但不能说这一变化符合质量守恒定律。
例题1、下列现象能用质量守恒定律解释的是( D)A.水结冰前后质量不变B.1 L芝麻和1 L大米混合,总体积小于2 LC.在加压降温的条件下,氧气变为淡蓝色液体D.氧化钙与水反应生成氢氧化钙,反应前后物质的总质量不变例题2.下列叙述中,正确的是( B )A.参加化学反应的分子个数等于反应生成的分子个数B.所有的化学反应都符合质量守恒定律C.两种物质相互反应时,它们的质量一定相等D.在化学反应中,参加反应的固体的质量跟反应生成的固体的质量相等例题3.下列现象能用质量守恒定律解释的是(B)A.湿衣服晾干B.生铁生锈C.酒精挥发D.干冰升华例题4.某科学兴趣小组的同学设计了三个实验装置(托盘天平略)来验证质量守恒定律,如图A、B、C 所示。

第五单元知识清单和练习01 知识框架1.质量守恒定律2.化学方程式化学方程式⎩⎪⎨⎪⎧意义⎩⎪⎨⎪⎧宏观⎩⎪⎨⎪⎧表示 、 和 表示各物质的 微观:表示各物质的 书写⎩⎪⎨⎪⎧原则:以 为基础;遵守 步骤:写→配→注计算:(解题步骤)设→写→算→列→答 02 知识纵横 1.对质量守恒定律宏观、微观方面的理解2.利用化学方程式计算的步骤及注意事项反应前后物质质量总和不变微观:化学反应前后原子的_ ___、__ __与__ ___不变 质 量 守 恒 定 律 内容:参加化学反应的各物质质量总和__ __反应后生成各物质质量总和 实质 宏观 化学反应前后元素的__ __ 、___ __不变 应用:解释现象、推断元素、确定化学式、辅助计算等03 实验再现(红磷燃烧前后质量的测定)(1)实验装置(如图)(2)实验步骤①在锥形瓶底部铺上一薄层细沙,在细沙上面放入一小块白磷;②在锥形瓶口的橡皮塞上安装一根玻璃管,在其上端系牢一个气球,并使玻璃管下端能与红磷接触;③将锥形瓶放在托盘天平上,用砝码调节天平,使天平平衡,记录所称的质量m 1;④取下锥形瓶,将橡胶塞上的玻璃管放到酒精灯火焰上灼烧至红热后,迅速用橡胶塞将锥形瓶塞紧,将白磷引燃;⑤待锥形瓶冷却后,重新放到托盘天平上,记录所称的质量m 2。
(3)实验现象①红磷燃烧,产生__________,放出________;②玻璃管上的气球___ _________;③反应后的物质总质量m 2与反应前的物质总质量m 1______,天平________。
(4)注意事项①为了防止红磷燃烧而使锥形瓶炸裂,所以在锥形瓶底部铺上一薄层细沙;②在锥形瓶口的橡皮塞上安装一根玻璃管,并在其上端系牢一个气球是为了防止红磷燃烧放出大量的热使瓶内气体迅速膨胀而冲开胶塞;③冷却前瓶内气体受热膨胀气球体积变大,受到浮力而使实验不准确,所以要待锥形瓶冷却后再称量。
(5)装置的改进:做白磷燃烧前后质量的测定实验时,为了防止外界空气的进入和白烟的逸散,可按如图改进。
课题1 质量守恒定律知识点一、质量守恒定律1、含义: 参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
说明:①质量守恒定律只适用于化学变化....,不适用于物理变化....; ②没有参加反应的物质质量及不是反应生成的物质质量不能..计入“总和”中; ③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏。
2、微观解释:在化学反应前后,原子的种类、数目、质量均保持不变(原子的“三不变”)。
3、化学反应前后(1)一定不变宏观:反应物、生成物的总质量不变;元素种类、质量不变 微观:原子的种类、数目、质量不变 (2)一定改变 宏观:物质的种类一定变微观:分子种类一定变(3)可能改变:分子总数可能变 考点1 质量守恒定律的含义 1、下列叙述正确的是()A 、因为“质量守恒”,所以煤燃烧后产生的煤渣的质量一定和所用煤的质量相等B 、镁带在空气中燃烧后,生成物的质量比镁带的质量增大C 、100g 酒精和100g 水混合在一起,质量等于200g ,符合质量守恒定律D 、氢气和氧气形成的混合物的质量等于其反应后生成水的质量 考点2 质量守恒定律的微观解释 1、化学反应前后肯定没有变化的是()①原子的数目 ②分子的数目 ③元素的种类 ④物质的总质量 ⑤物质的种类 ⑥原子的种类 A 、①②④⑥ B 、①③⑤ C 、①③④⑥ D 、①③④⑤⑥ 2、化学反应前后可能发生变化的是()A 、物质的总质量B 、元素种类C 、原子数目D 、分子数目知识点二 质量守恒定律的应用考点1 解释一些化学变化中的质量变化点燃1、在2Mg+O2===2MgO 的反应中,参加反应的氧气的质量和生成的氧化镁的质量关系是() A 、氧气的质量>氧化镁的质量 B 、氧气的质量<氧化镁的质量 C 、氧气的质量=氧化镁的质量 D 、无法判断2、镁带在耐高温的密闭容器中(内含空气)加热。
图中能正确表示容器中所有物质的总质量(m )与时间(t )的变化关系的是()A B C D 考点2推断化学反应中反应物或生成物中的组成元素1、实验证明M 气体在空气中燃烧有水生成。
质量守恒定律练习题质量守恒定律是化学中的一个重要定律,它对于理解化学反应的本质和进行化学计算具有至关重要的意义。
下面为大家带来一系列关于质量守恒定律的练习题,希望能帮助大家更好地掌握这一知识点。
一、选择题1、下列变化中,能用质量守恒定律解释的是()A 5g 水受热变成 5g 水蒸气B 5g 蔗糖溶解在 95g 水中,得到 100g 蔗糖溶液C 木炭燃烧后质量减少D 100mL 水加入 100mL 酒精,得到体积小于 200mL 的溶液答案:C解析:质量守恒定律适用于化学变化,A 选项水受热变成水蒸气是物理变化,B 选项蔗糖溶解是物理变化,D 选项 100mL 水和 100mL 酒精混合体积小于 200mL 是因为分子间有间隔,是物理变化。
C 选项木炭燃烧生成二氧化碳,是化学变化,参加反应的木炭和氧气的质量总和等于生成的二氧化碳的质量,所以燃烧后质量减少,能用质量守恒定律解释。
2、在化学反应 2A + B = 2C 中,已知 A 的相对分子质量为 24,B 的相对分子质量为 32,C 的相对分子质量为 48,则 A、B、C 的化学计量数之比为()A 2:1:2B 3:1:2C 2:3:2D 3:2:1答案:A解析:设 A、B、C 的化学计量数分别为 x、y、z。
根据质量守恒定律,参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。
则有:\(24x + 32y = 48z\)化简得:\(3x + 4y = 6z\)当 x = 2,y = 1,z = 2 时,等式成立。
所以 A、B、C 的化学计量数之比为 2:1:2,选择 A 选项。
3、加热高锰酸钾制取氧气的化学方程式为\(2KMnO_{4}\stackrel{\triangle}{=\!=\!=}K_{2}MnO_{4} + MnO_{2} +O_{2}\uparrow\),对该反应说法正确的是()A 反应前后锰元素的化合价没有变化B 反应前后氧元素的质量不变C 高锰酸钾是一种混合物D 生成氧气的质量等于高锰酸钾中氧元素的质量答案:B解析:在高锰酸钾\(KMnO_{4}\)中,锰元素的化合价为+7 价,在锰酸钾\(K_{2}MnO_{4}\)中锰元素的化合价为+6 价,在二氧化锰\(MnO_{2}\)中锰元素的化合价为+4 价,A 选项错误;根据质量守恒定律,反应前后元素的种类和质量不变,所以反应前后氧元素的质量不变,B 选项正确;高锰酸钾是由一种物质组成的,属于纯净物,C 选项错误;生成氧气的质量小于高锰酸钾中氧元素的质量,因为还有部分氧元素存在于锰酸钾和二氧化锰中,D 选项错误。
质量守恒定律1.氢气和氧气的混合气体共20克,在点燃的条件下,让它们充分反应后,生成9克水,则原混合气体中含有氢气的质量可能是()A.8克B.12克C.11克D.无法确定2.已知化学方程式:R+2O2CO2+2H2O,关于R组成的叙述正确的(点燃)A.只含有碳元素B.只含碳、氢元素C.一定含碳、氢、氧元素D.一定含碳、氢元素,可能含氧元素3.煤燃烧时会排放出二氧化硫、二氧化氮等污染物.在一定条件下,二氧化硫与二氧化氮能发生反应:SO2+NO2=SO3+X,其中X的化学式为()A.N2 B.NO C.N2O D.N2O34.参加反应的各物质质量总和等于反应后生成的各物质质量总和,因为()A.反应后物质的种类没有变化B.反应后元素的种类没有变化C.反应后原子的种类、数目和质量没有变化D.反应后分子的种类、数目和质量没有变化5.对质量守恒定律的正确理解是()A.参加反应的各种物质的质量不变B.化学反应前后各物质的质量不变C.化学反应前的各物质质量总和等于反应后生成的各物质质量总和D.参加化学反应的各物质质量总和与反应后生成的各物质质量总和相等6.在一个密闭容器内有M、N、X、Y四种物质,在一定条件下反应一段时间后,测得反应前后各物质的质量如下:物质M N X Y反应前质量/g8111810反应后质量/g 83342下列能正确表示容器中化学变化的表达式是( )A.X+Y====M+NB.X+Y====NC.N====M+X+YD.X+Y+M====N7.NH 4ClO 4(高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不能生成的物质是( )A .COB .Cl 2C .O 2D .N 28.某物质发生完全燃烧反应,反应式为:( )C x H y O z +(x+-)O 2点燃xCO 2+H 2O24z y2y 若1个分子的C x H y O z 与3个O 2分子完全燃烧,生成了2个分子的CO 2和3个分子的H 2O ,则x 、y 、z 值分别为( )A .2,3,4B .2,6,1C .1,3,2D .1,2,39.将A 、B 、C 三种物质各10克,加热进行化合反应生成D (其中B 是催化剂),当A 已完全反应后,测得生成的D 为16克。
第五单元化学方程式课题1 质量守恒定律知识点一质量守恒定律一、实验探究化学反应前后物质的质量关系1、红磷燃烧前后质量的测定2、铁钉与硫酸铜溶液反应前后质量的测定二、质量守恒定律1、内容参加化学反应的各物质的质量总和,等于反应后生成物的质量总和,这个规律叫做质量守恒定律。
2、探究反应前后质量是否守恒应注意的问题以上实验说明,探究反应前后质量是否守恒应注意:反应中是否有气体生成;反应中是否有外界物质进入。
理解辨析1、验证质量守恒定律应注意什么?凡有气体参加或生成的反应,在设计实验验证反应前后遵循质量守恒时,应该在密闭容器中进行。
三、理解质量守恒定律应注意的问题。
1、正确理解“参加反应”的含义不能把“参加反应的物质”理解成“反应物”。
化学反应中往往存在“反应物过量”问题。
2、不要漏掉气体或沉淀很多化学反应有气体或沉淀生成,因此“生成的各物质质量”总和包括“固、液、气”三种状态的物质。
讨论质量守恒定律时,各状态均要一起讨论,不能遗漏。
也不能因为生成了气体,而误认为质量减少,不符合质量守恒定律。
3、明确普遍性质量守恒定律是化学变化中的普遍规律,没有一个化学反应例外。
4、明确适用范围质量守恒定律解释的是化学变化而不是物理变化。
如1g水加热后变成了1g水蒸气,这一变化虽然前后质量相等,但不能说这一变化符合质量守恒定律。
例题1、下列现象能用质量守恒定律解释的是( D)A.水结冰前后质量不变B.1 L芝麻和1 L大米混合,总体积小于2 LC.在加压降温的条件下,氧气变为淡蓝色液体D.氧化钙与水反应生成氢氧化钙,反应前后物质的总质量不变例题2.下列叙述中,正确的是( B )A.参加化学反应的分子个数等于反应生成的分子个数B.所有的化学反应都符合质量守恒定律C.两种物质相互反应时,它们的质量一定相等D.在化学反应中,参加反应的固体的质量跟反应生成的固体的质量相等例题3.下列现象能用质量守恒定律解释的是(B)A.湿衣服晾干B.生铁生锈C.酒精挥发D.干冰升华例题4.某科学兴趣小组的同学设计了三个实验装置(托盘天平略)来验证质量守恒定律,如图A、B、C 所示。
第五单元化学方程式课题1质量守恒定律第1课时质量守恒定律一、质量守恒定律1.定义:_____________________________________________________________________。
2.注意:(1)适用于所有的__________变化,不适用于物理变化。
(2)质量守恒,不是体积守恒。
(3)质量守恒不包括未参加反应的物质的质量。
(4)各物质质量包括固态、液态、__________所有物质的质量。
3.微观解释:化学反应前后,______________没有改变,__________没有增减,__________也没有改变。
二、化学反应中的变与不变1.六个不变宏观:(1)物质的__________不变;(2)元素的种类不变;(3)元素的质量不变。
微观:原子的__________、__________、__________不变。
2.两个一定变宏观:__________一定改变。
微观:__________一定改变。
3.两个可能改变(1)__________可能改变。
(2)__________可能改变。
第2课时 化学方程式 质量守恒定律的应用一、化学方程式及其意义1.化学方程式的概念:用__________来表示化学反应的式子。
2.化学方程式的宏观意义:表明____________、____________、____________,各物质之间的质量比。
微观意义:表示反应物和生成物之间__________________比。
3.从化学方程式中可获取的信息:(1)______________________;(2)______________________;(3)______________________;(4)______________________。
二、化学方程式的读法对照化学方程式的意义,化学方程式有三种读法(以C +O 2=====点燃CO 2为例):(1)质:________和________在________的条件下反应生成______________;(2)量:每________份质量的碳和________份质量的氧气完全反应,生成________份质量的二氧化碳;(3)微观:每________个碳原子和________个氧分子反应,生成________个二氧化碳分子。
第五单元化学方程式课题1质量守恒定律知能演练提升能力提升1.下列物质受热分解时没有氧气生成的是()A.氯化铵B.氯酸钾C.高锰酸钾D.氧化汞2.下列有关质量守恒定律的理解,正确的是()A.将5 g铁和5 g铜混合加热后,物质的总质量为10 g,遵循质量守恒定律B.化学反应前后分子的总数一定不会发生变化C.5 g硫与5 g氧气完全反应后,生成物质量为10 gD.镁条燃烧后质量增加,不遵循质量守恒定律3.(2021天津中考)将16 g纯净物R在足量氧气中完全燃烧,生成44 g二氧化碳和36 g 水。
下列判断正确的是()A.R只含碳、氢元素B.消耗氧气32 gC.R含碳、氢、氧三种元素D.R中碳元素的质量分数为70%4.过氧化氢和二氧化锰的混合物共a g,完全反应后得到b g氧气和c g水,则混合物中二氧化锰的质量为()A.(a+b-c)gB.(a-b-c)gC.(a+b+c)gD.(a-c)g5.★在一个密闭容器中,有a、b、c、d四种物质,反应前各物质的质量关系如下图刻度纸所示(例如:d的质量为2 g)。
在一定条件下发生反应,反应结束后,再次测得各物质的质量变化,并通过刻度的移动来表示,且记录在同一张刻度纸上:刻度线Ⅰ向右移动9格;刻度线Ⅱ向左移动8格;刻度线Ⅲ向左移动8格。
下列说法正确的是()A.反应结束后c的质量为14 gB.该反应可能为化合反应C.a、b变化的质量比一定为9∶17D.a、d的相对分子质量之比一定为9∶86.四种物质在一定的条件下充分混合反应,测得反应前后各物质的质量分数如图所示。
则有关说法中不正确的是()A.丁一定是化合物B.乙可能是这个反应的催化剂C.生成的甲、丙两物质的质量比为8∶1D.参加反应的丁的质量一定等于生成甲和丙的质量之和7.镁在空气中燃烧,发生反应的化学方程式为2Mg+O22MgO,其固体质量变化可用右图表示,则(20-12)g表示的质量是()A.生成物MgO的质量B.参加反应的Mg的质量C.参加反应的氧气的质量D.生成物MgO与参加反应的O2的质量和8.某化学反应过程的微观示意图如下。
课题1 质量守恒定律知识点一、质量守恒定律1、含义: 参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
说明:①质量守恒定律只适用于化学变化....,不适用于物理变化....; ②没有参加反应的物质质量及不是反应生成的物质质量不能..计入“总和”中; ③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏。
2、微观解释:在化学反应前后,原子的种类、数目、质量均保持不变(原子的“三不变”)。
3、化学反应前后(1)一定不变 宏观:反应物、生成物的总质量不变;元素种类、质量不变微观:原子的种类、数目、质量不变 (2)一定改变 宏观:物质的种类一定变 微观:分子种类一定变 (3)可能改变:分子总数可能变 考点1 质量守恒定律的含义 1、下列叙述正确的是()A 、因为“质量守恒”,所以煤燃烧后产生的煤渣的质量一定和所用煤的质量相等B 、镁带在空气中燃烧后,生成物的质量比镁带的质量增大C 、100g 酒精和100g 水混合在一起,质量等于200g ,符合质量守恒定律D 、氢气和氧气形成的混合物的质量等于其反应后生成水的质量 考点2 质量守恒定律的微观解释 1、化学反应前后肯定没有变化的是()①原子的数目 ②分子的数目 ③元素的种类 ④物质的总质量 ⑤物质的种类 ⑥原子的种类 A 、①②④⑥ B 、①③⑤ C 、①③④⑥ D 、①③④⑤⑥ 2、化学反应前后可能发生变化的是()A 、物质的总质量B 、元素种类C 、原子数目D 、分子数目知识点二 质量守恒定律的应用考点1 解释一些化学变化中的质量变化1、在2Mg+O2===2MgO 的反应中,参加反应的氧气的质量和生成的氧化镁的质量关系是()A 、氧气的质量>氧化镁的质量B 、氧气的质量<氧化镁的质量C 、氧气的质量=氧化镁的质量D 、无法判断2、镁带在耐高温的密闭容器中(内含空气)加热。
图中能正确表示容器中所有物质的总质量(m )与时间(t )的变化关系的是()A B C D 考点2 推断化学反应中反应物或生成物中的组成元素1、实验证明M 气体在空气中燃烧有水生成。
仅根据此结果,对M 的成分推测正确的是() A 、M 是氢气 B 、M 是甲烷 C 、M 含有氢元素 D 、M 含有氢、氧两种元素2、为判断某化合物是否含碳、氢、氧三种元素,取一定质量该化合物在氧气中充分燃烧,接下来还需要进行的实验有()①用无水硫酸铜检验是否有水生成 ②用澄清石灰水检验是否有二氧化碳生成 ③用带火星的木条检验氧气 ④测定水和二氧化碳的质量 A 、①②③ B 、①②④ C 、②③④ D 、①②③④ 考点3 推断化学反应中某物质的化学式1、2008年奥运会“祥云”火炬中燃料燃烧后不会对环境造成污染,体现了“绿色奥运”的理念。
反应的化学方程式是: CaH 8+5O 2 3CO 2+4H 2O ,则a 的值为A 、1B 、2C 、3D 、42、用酸性高锰酸钾溶液可以测定居室内甲醛的含量是否超标。
相关反应的化学方程式是:4KMnO 4+5CH 2O+6H 2SO 4===2K 2SO 4+4MnSO 4+5X+11H 2O ,其中X 的化学式为()A 、COB 、CO 2C 、H 2CO 3D 、K 2CO 3 考点4 推断化学反应中某物质的质量点燃ttt点1、在一密闭容器中,盛放A 、B 、C 三种物质各30g ,经电火花引燃,充分反应后,各物质的质量变化下:关于此反应,下列认识不正确的是()A 、C 物质中所含有的元素种类是A 、B 、D 三种物质中所有元素种类之和B 、变化后待测的A 质量为5gC 、该变化的基本反应类型是分解反应D 、A 物质由可能是单质 知识点三 化学方程式1、含义:用化学式表示化学反应的式子。
能直接反映质量守恒定律。
2、表示的意义:⑴表示反应物、生成物和反应条件⑵表示各物质间的质量比(质量比=各物质的相对分子质量×各化学式前面 的系数的积的比)⑶表示各物质的微粒个数比(即各化学式前面的系数比)例如:以2H 2+O 2 2H 2O 为例①表示氢气与氧气在点燃条件下生成水 ②表示氢气、氧气与水的质量比为4:32:36 ③表示氢分子、氧分子与水分子的个数比为2:1:23、化学方程式的读法 以2H 2+O 2 2H 2O 为例 ①从反应物、生成物和反应条件角度:氢气与氧气在点燃条件下生成水 ②从各物质的质量比角度:每4份质量的氢气与32份质量的氧气在点燃条件 下生成36份质量的水③从各物质的微粒个数比角度:每2个氢分子与1个氧分子在点燃条件下生 成2个水分子。
考点1 化学方程式的意义1、化学方程式不能直接表示的是()点燃点燃A 、参加反应的物质与生成的物质之间的质量比B 、反应条件C 、反应物、生成物的种类D 、含杂质的物质间的质量比2、用I 2O 5可以测定空气受CO 污染的程度,发生反应的化学方程式为:I 2O 5+5CO===I 2+5CO 2,根据生成的CO 2的多少,可以判断CO 的含量。
关于这个反应,下列说法中正确的是()A 、参加反应的I 2O 5的质量等于生成的I 2的质量B 、参加反应的各物质中的氧原子的总数等于生成的CO 2中的氧原子数C 、反应物所含元素种类与生成物所含元素种类不同D 、参加反应的I 2O 5和CO 的质量比等于生成的I 2和CO 2的质量比 考点2 化学方程式的应用1、现将10gA 和足量的B 混合加热,A 和B 发生化学反应。
10gA 完全反应后生成 8gC 和4gD ,则参加反应的A 与B 的质量比是()A 、1:1B 、2:1C 、5:1D 、4:12、在密闭容器内有四种物质,在一定条件下充分反应,测定反应前后各物质的质量如下表()下列说法正确的是()A 、反应后X 的质量为6gB 、该反应的反应物是X 、YC 、参加反应的X 、Z 的质量比是1:3D 、Y 、Q 的相对分子质量比一定为1:1课题2 如何正确书写化学方程式知识点一 化学方程式的书写原则 1、以客观事实为基础绝不能凭空设想,随意臆造事实上存在的物质和化学反应 如Fe+O 2===FeO 2违背了客观事实2、遵守质量守恒定律(标准:两边原子的种类和数目相等)如Fe+O 2Fe 3O 4不符合质量守恒定律 考点1 判断给出的化学方程式的正误 1、书写化学方程式的原则是()点燃 点① 以客观事实为基础 ②根据反应的条件 ③遵守质量守恒定律 ④根据反应的现象 A 、①③ B 、②④ C 、①④ D 、②③ 2、下列化学方程式中,完全正确的是()A 、C+O 2===CO 2B 、4Fe+3O 2===2Fe 2O 3C 、KMnO 4===K 2MnO 4+MnO 2+O 2↑ D 、Ca(OH)2+Na 2CO 3===CaCO 3 ↓+2NaOH 考点2 根据题中信息判断化学方程式的正误1、一氧化氮是大气污染物之一,目前有一种治理方法,在400℃左右,在有催化剂存在的情况下,用氨气(NH 3)和一氧化氮反应,生成氮气和水,则该反应的化学方程式为()A 、NO+NH 3===N 2+H 2OB 、2NO+2NH 3 ==== 2N 2+3H 2OC 、6NO+4NH 3 ==== 5N 2+6H 2OD 、8NO+4NH 3 ==== 5N 2+6H 2O 2、火柴头上的深色物质的主要成分是KClO 3、MnO 2和Sb 2S 3(硫化锑),火柴盒侧面涂有一层红褐色物质,主要成分是红磷和玻璃粉。
划火柴时,借助摩擦产生的热,KClO 3在MnO 2催化下放出O 2,使红磷燃烧。
同时Sb 2S 3也可与O 2反应生成Sb 2O 3和另一种气体。
Sb 2S 3燃烧生成Sb 2O 3和一种气体的化学方程式为()A 、Sb 2S 3+8O 2===Sb 2S 3+3SO 2B 、Sb 2S 3+9O 2===Sb 2O 3+3SO 2C 、2Sb 2S 3+8O 2===2Sb 2O 3+6SO 2D 、2Sb 2S 3+9O 2===2Sb 2O 3+6SO 2知识点二 方程式的配平3、配平概念:根据质量守恒定律,在化学式前面配上适当的化学计量数,使式子左右两边的每一种元素的原子数目相等4、配平原:① 配平时只能改动化学式前的化学计量数,不能改动化学式中元素符号右下角的下标数字② 要将化学计量数之比化为最简整数比5、配平方法:①最小公倍数法 ②奇数配偶法 ③观察法点点点点点催化剂 催化剂催化剂奇数配偶法观察法考点1 配平给出的化学方程式1、配平化学方程式时,判断所配化学计量数是否正确的依据是()A 、反应前后所配化学计量数之和是否相等B 、反应前后元素种类是否相等C 、反应前后各元素的原子总数是否相等D 、反应前后各物质质量是否相等 2、配平下列化学方程式:①32====________PbO+_______NO 2 ↑+______O 2↑ ②_______Fe 3O 4+____CO====________Fe+______CO 2③_______NH 3+_____Cl 2====_______NH 4Cl+_______N 2 3、化学方程式 aC 2H 2+bO 2===cH 2O+dCO 2,配平后,a 、b 、c 、d 之和为() A 、15 B 、14 C 、13 D 、10 考点2 配平用符号代表物质的化学方程式1、下列反应中,生成物都是C ,如果C 的化学式是AB 5,则正确的化学方程式 为()A 、2A+5B 2===2C B 、2A+3B 2===2C C 、AB+B 2===2CD 、AB+5B===2C 知识点三 书写化学方程式 高温 点燃 点燃考点1 根据已学知识书写化学方程式3、现有下列物质:水、铁丝、氧气、硫磺、高锰酸钾,从中选出物质,写出符合下列要求的化学方程式各一个:① 物质燃烧生成黑色固体____________________________ ② 有两种气体单质生成的分解反应____________________ ③ 点燃物质,生成有刺激性气味的气体________________ ④ 一种物质受热分解生成三种物质____________________ 考点2 根据题中信息书写化学方程式3、如图所示是密闭体系中某反应的微观示意图“●”“○”分别表示不同原子⑴ 反应后方框内应再填入1个______微粒(选填序号)。
⑵ 该反应属于_________反应(填“分解”“化合”“置换”“复分解”) ⑶ 写出符合微观图的一个具体反应的化学方程式______________________ 4、年北京奥运火炬使用的燃料是丙烷(C 3H 8),这是一种价格低廉的燃料,且燃 烧的产物不会对环境产生污染。