几种类型的小鼠缺氧实验.
- 格式:ppt
- 大小:771.00 KB
- 文档页数:21


第1篇一、实验目的1. 复制不同病因导致小鼠缺氧的模型,了解乏氧性、血液性、组织中毒性缺氧的分类。
2. 观察缺氧对呼吸系统、中枢神经系统的影响,以及血液颜色变化。
3. 了解影响缺氧耐受性的因素。
二、实验原理通过模拟不同类型的缺氧环境,观察小鼠的生理反应,了解缺氧对机体的影响。
实验分为三种缺氧类型:乏氧性缺氧、血液性缺氧、组织中毒性缺氧。
三、实验材料与仪器1. 实验动物:健康小白鼠若干只。
2. 实验仪器:小鼠缺氧瓶(100ml-125ml带塞广口瓶)、一氧化碳发生装置广口瓶、恒温水浴箱、5ml或2ml刻度吸管、1ml注射器、酒精灯、剪刀、镊子、钠石灰、甲酸、浓硫酸、5%硝酸钠、0.1%氰化钾、生理盐水、耗氧量测定装置、记录表格等。
四、实验方法与步骤1. 乏氧性缺氧实验- 将四只小鼠分别编号为甲、乙、丙、丁。
- 将甲、乙、丙鼠放入缺氧瓶中,每2分钟记录一次死亡情况(记录时间及耗氧量)。
- 观察并记录甲鼠尸体部分肝叶颜色变化。
2. 一氧化碳中毒性缺氧实验- 将一只小鼠放入一氧化碳发生装置的广口瓶中,观察并记录其死亡时间。
3. 亚硝酸钠中毒性缺氧实验- 将一只小鼠腹腔注射5%亚硝酸钠,观察并记录其死亡时间。
4. 缺氧耐受性实验- 将四只小鼠分为两组,一组为实验组,另一组为对照组。
- 实验组小鼠腹腔注射氯丙嗪,使其进入人工冬眠状态;对照组小鼠注射生理盐水。
- 将两组小鼠分别放入装有5g钠石灰的广口瓶中,塞紧瓶塞,连通测氧耗装置。
- 开始计时,每3分钟重复观察并记录上述指标一次,直至动物死亡。
五、实验结果与分析1. 乏氧性缺氧实验- 甲、乙、丙鼠均死亡,耗氧量逐渐减少,肝叶颜色变暗。
- 结果表明,乏氧性缺氧会导致小鼠呼吸系统功能障碍,进而引起肝细胞缺氧,导致肝叶颜色变暗。
2. 一氧化碳中毒性缺氧实验- 小鼠死亡时间较短,耗氧量迅速下降。
- 结果表明,一氧化碳中毒会导致小鼠呼吸系统功能障碍,迅速引起缺氧。
3. 亚硝酸钠中毒性缺氧实验- 小鼠死亡时间较长,耗氧量逐渐减少。

小鼠缺氧实验实验报告一、实验目的本次实验旨在通过对小鼠进行不同类型的缺氧处理,观察和记录小鼠在缺氧环境中的生理反应和行为变化,深入了解缺氧对生物体的影响机制。
二、实验材料1、实验动物:健康昆明种小鼠若干只,体重 18 22g,雌雄不拘。
2、实验器材:密闭广口瓶、钠石灰、测氧仪、计时器、解剖器械等。
3、实验药品:生理盐水。
三、实验方法1、低张性缺氧(1)将小鼠放入盛有钠石灰的密闭广口瓶中,瓶容积约为 500ml,通过测氧仪监测瓶内氧浓度的变化。
(2)观察并记录小鼠的呼吸频率、深度、行为表现(如活动情况、精神状态)以及存活时间。
2、血液性缺氧(1)给部分小鼠腹腔注射亚硝酸盐溶液,剂量为 01ml/10g,建立血液性缺氧模型。
(2)观察注射后小鼠的皮肤黏膜颜色变化、呼吸状态和行为表现,并记录存活时间。
3、组织性缺氧(1)给另一部分小鼠腹腔注射氰化物溶液,剂量为 01ml/10g,造成组织性缺氧。
(2)同样观察并记录小鼠的各项生理指标和存活时间。
四、实验结果1、低张性缺氧(1)随着瓶内氧气逐渐减少,小鼠呼吸频率加快,深度加深,活动逐渐减少,精神状态变差。
(2)小鼠的存活时间个体之间存在一定差异,平均存活时间约为_____分钟。
2、血液性缺氧(1)注射亚硝酸盐溶液后,小鼠皮肤黏膜呈现青紫色,呼吸变得急促但浅弱。
(2)存活时间相对较短,平均约为_____分钟。
3、组织性缺氧(1)注射氰化物溶液后,小鼠很快出现呼吸困难,痉挛等症状。
(2)存活时间最短,平均仅为_____分钟。
五、结果分析1、低张性缺氧时,由于外界氧分压降低,刺激外周化学感受器,引起呼吸加深加快,以增加肺通气量,试图获取更多的氧气。
但随着缺氧时间延长,机体能量供应不足,导致活动减少和精神萎靡,最终因严重缺氧而死亡。
2、血液性缺氧是由于血红蛋白的性质改变,使其携氧能力下降,导致组织缺氧。
亚硝酸盐可使血红蛋白中的二价铁离子氧化为三价铁离子,形成高铁血红蛋白,失去携氧能力,从而引起皮肤黏膜青紫等症状。


一、实验目的1. 探究新生小鼠在不同缺氧条件下的生理反应。
2. 分析缺氧对新生小鼠呼吸系统、中枢神经系统及组织器官的影响。
3. 了解影响新生小鼠缺氧耐受性的因素。
二、实验原理本实验通过模拟不同缺氧条件,观察新生小鼠的生理反应,分析缺氧对新生小鼠的影响。
缺氧是指机体组织在氧气供应不足的情况下,无法满足正常代谢需求的一种生理状态。
本实验主要模拟以下几种缺氧条件:1. 乏氧性缺氧:通过降低氧浓度,模拟低氧环境。
2. 一氧化碳中毒性缺氧:通过一氧化碳暴露,模拟有毒气体引起的缺氧。
3. 血液性缺氧:通过改变血液中氧合血红蛋白的含量,模拟血液携氧能力下降。
三、实验材料与仪器1. 实验动物:新生小鼠(体重约10g)。
2. 仪器设备:缺氧箱、呼吸机、血氧饱和度仪、电子天平、显微镜等。
3. 试剂:生理盐水、一氧化碳、亚硝酸钠等。
四、实验方法1. 乏氧性缺氧实验:- 将新生小鼠放入缺氧箱中,逐渐降低氧浓度,直至达到预定水平。
- 观察并记录小鼠的呼吸频率、血氧饱和度、心率等生理指标。
- 在缺氧过程中,定期取出小鼠,观察其行为变化。
2. 一氧化碳中毒性缺氧实验:- 将新生小鼠放入一氧化碳暴露箱中,逐渐增加一氧化碳浓度,直至达到预定水平。
- 观察并记录小鼠的呼吸频率、血氧饱和度、心率等生理指标。
- 在一氧化碳暴露过程中,定期取出小鼠,观察其行为变化。
3. 血液性缺氧实验:- 将新生小鼠分为两组,一组注射生理盐水,另一组注射亚硝酸钠。
- 观察并记录两组小鼠的呼吸频率、血氧饱和度、心率等生理指标。
- 在注射过程中,定期取出小鼠,观察其行为变化。
五、实验结果1. 乏氧性缺氧实验:- 随着氧浓度的降低,新生小鼠的呼吸频率逐渐增加,血氧饱和度逐渐下降,心率逐渐加快。
- 当氧浓度降至一定程度时,小鼠出现行为异常,如活动减少、呼吸困难等。
- 随着缺氧时间的延长,小鼠的呼吸频率、血氧饱和度、心率等生理指标进一步恶化,最终导致死亡。
2. 一氧化碳中毒性缺氧实验:- 随着一氧化碳浓度的增加,新生小鼠的呼吸频率逐渐减少,血氧饱和度逐渐下降,心率逐渐加快。

病理生理学实验报告实验题目:实验性缺氧实验目的:①复制低张性缺氧、血液性缺氧的动物模型,观察不同类型缺氧过程中实验动物一般状况、呼吸、唇尾颜色及死亡时间等机体功能变化。
②加深对缺氧分类和缺氧机制以及不同类型缺氧特点的理解。
③了解常见类型缺氧的解救办法。
实验步骤:一、低张性缺氧成年小白鼠3只,新生鼠一只分别标号1~4,做以下处理:1号鼠腹腔注射一定量0.1ml/10g乌拉坦。
2号鼠腹腔注射等量0.05ml/10g/可拉明。
3、4号不做任何处理。
2、上述处理之后将1~4号老鼠同时放入等容积的广口瓶中,并盖好瓶塞,同时用导管把四个广口瓶连通。
3、观察计时,并五分钟观察记录一次。
直至成年鼠全部死亡。
4、解剖死亡小鼠尸体,并观察记录其肝脏颜色。
二、等张性缺氧1、一氧化碳中毒性缺氧①将装有小白鼠的广口瓶与一氧化碳发生装置连接。
②用吸管吸取适量甲酸加入试管中,再吸取适量的浓硫酸加入试管中,塞紧瓶塞,并加热。
仔细观察小鼠的变化并记录。
③待小鼠死亡后,取出小鼠,并解剖小鼠尸体,观察记录其肝脏颜色。
1、亚硝酸钠中毒性缺氧①取成年健康小白鼠一只,观察其正常表现后,向腹腔注射适量0.3ml/20g亚硝酸钠。
②观察并记录小鼠的表现,待其死亡后,解剖小鼠尸体,观察并记录其肝脏颜色。
实验结果:一、低张性缺氧(2) 成年空白鼠实验过程中呼吸频率的变化:成年鼠呼吸频率变化98120141204210153159135114963600501001502002500510152025303540455055时间(min)呼吸频率(次/m i n ) ① 一号鼠注射乌拉坦之后行为状态比较活泼,放入广口瓶后较安静。
之后呼吸频率加大, 并渐渐闭上眼睛,之后出现躁动不安现象。
最后趴下安静不动,急促呼吸,死亡。
解剖尸体,肝脏颜色鲜红。
② 二号鼠注射可拉明之后非常活泼,放入广口瓶之后也比较活泼,之后出现呼吸明显加快的现象,并开始上串下跳,最后急促呼吸,慢慢呼吸变缓,死亡。

机能实验学实验报告实验项目名称:不同类型缺氧模型小鼠制备1.实验目的①了解小鼠特性、解剖及应用;②熟练掌握小鼠的抓取、灌胃、腹腔注射、注射器使用及颈椎脱臼处死技术;③了解缺氧的分类,了解和复制不同类型缺氧模型(本次实验的缺氧模型包括低张性缺氧模型及血液性缺氧模型);④了解不同类型缺氧的表现特征,观察缺氧时呼吸节律和皮肤粘膜颜色的变化规律。
2.材料与方法(1)实验动物成年昆明种小鼠,10只,体重18~22g,雌雄不拘,由南方医科大学实验动物中心提供。
(2)实验器材与试剂器材:密封广口瓶,一氧化碳发生装置,酒精灯,注射器及针头,灌胃器,塑料盆,量杯等药品:钠石灰,甲酸,浓硫酸,5%亚硝酸钠,1%亚甲蓝,生理盐水(3)实验方法与步骤A.小鼠乏氧性缺氧模型的制备1)实验步骤①观察记录小白鼠正常呼吸频率、深度和皮肤、粘膜颜色等指标;②抓取小白鼠并放入装有钠石灰广口瓶中,观察,记录;③塞紧瓶塞,计时,拍摄,每3min重复观察上述指标1次,如有其它变化,随时记录,直至动物死亡,记录其存活时间。
2)注意事项①观察记录小白鼠一般状况(精神行为)、呼吸(频率节律深度,观察小鼠10s内腹部皮肤起伏)和皮肤(爪部)、粘膜(口唇)颜色(紫绀、苍白、樱桃红、棕褐色......)等指标;②将小鼠置于广口瓶内的技巧:将广口瓶平放,诱导小鼠进入,当小鼠全头进入时将广口瓶直立;③尸体处理:死后即取出放入塑料盆中,避免因小鼠尸体僵硬难以取出。
B.小鼠血液性缺氧模型的制备——一氧化碳中毒性缺氧1)实验步骤①准备一氧化碳发生装置;②将1只小白鼠放入广口瓶中,观察其正常表现后与一氧化碳发生装置连接;③用量杯取甲酸3ml放于试管内,沿试管壁缓慢加入浓硫酸2ml,塞紧瓶塞;④计时,拍摄并记录各项指标直至死亡。
2)注意事项①加液顺序为先加入甲酸,后加入浓硫酸;②大试管管口切勿朝向人,注意开窗通风,防止一氧化碳中毒。
如反应缓慢可用酒精灯加热,注意加热程度,通入CO过快则使小鼠死亡时间缩短,皮肤黏膜看不到颜色变化;③尸体处理:死后即取出放入塑料盆中,避免因小鼠尸体僵硬难以取出;④器材处理:实验完毕后尽快倒出剩余试剂并冲洗,清洗后将大试管倒置于试管架。



实验报告一、实验目的:(1)学习复制动物缺氧病理模型的方法掌握不同缺氧类型主要的发病原因和机制。
(2)观察不同类型缺氧时呼吸、皮肤粘膜颜色、活动的改变(3)了解机体功能、代谢特点与缺氧对机体影响的关系。
二、实验动物:小鼠三、实验方法:(1)不同年龄小鼠对缺氧耐受性影响①取新生幼鼠一只,放入青霉素小瓶内,瓶口塞少量棉花以免成年鼠伤害。
②将青霉素小瓶放入广口瓶内,再取一只成年小白鼠一同放入瓶中。
③密闭瓶塞,计时。
④观察小鼠在瓶内的活动、呼吸变化(2)低张性缺氧实验①选取两只体重相近的小鼠,用天平称重小鼠。
②分别将两只小鼠投入钠石灰瓶和玻璃珠瓶内。
③同时密闭瓶塞并开始计时。
④密切观察小鼠在瓶内的活动度、呼吸、皮肤粘膜的颜色等变化。
⑤小鼠死亡后进行尸检观察血液颜色的变化:先在试管中各加入5ml水备用;将小鼠仰卧位固定于手术台上,剪开小鼠胸部皮肤;用镊子提起剑突,剪断两侧肋骨,打开胸腔,剪破心脏;用滴管滴入2滴7%枸橼酸钠溶液;混匀后取出2滴抗凝血,滴入盛有蒸馏水的试管内,立即用封口膜封闭管口;摇匀,观察试管内溶液的颜色。
(3)亚硝酸钠中毒①取一只小白鼠,称重。
小鼠尾剪断取对照血样。
②抽取2%亚硝酸钠溶液(用量为每10克体重0.35毫升)。
③给小鼠皮下注射亚硝酸钠,计时。
④观察小鼠的活动度、呼吸、皮肤粘膜的颜色等变化。
⑤小鼠死亡后进行尸检观察血液颜色的变化:先在试管中各加入5ml水备用;将小鼠仰卧位固定于手术台上,剪开小鼠胸部皮肤;用镊子提起剑突,剪断两侧肋骨,打开胸腔,剪破心脏;用滴管滴入2滴7%枸橼酸钠溶液;混匀后取出2滴抗凝血,滴入盛有蒸馏水的试管内,立即用封口膜封闭管口;摇匀,观察试管内溶液的颜色。
(4)一氧化碳中毒①取一只小白鼠,将其放入三角烧瓶内。
小鼠尾剪断取对照血样。
②盖上瓶塞,连接通气管,打开气囊阀门,向瓶内通入一氧化碳气体并计时。
③观察皮肤粘膜颜色改变。
④小鼠死亡后进行尸检观察血液颜色的变化:先在试管中各加入5ml水备用;将小鼠仰卧位固定于手术台上,剪开小鼠胸部皮肤;用镊子提起剑突,剪断两侧肋骨,打开胸腔,剪破心脏;用滴管滴入2滴7%枸橼酸钠溶液;混匀后取出2滴抗凝血,滴入盛有蒸馏水的试管内,立即用封口膜封闭管口;摇匀,观察试管内溶液的颜色。

四型缺氧实验报告1. 引言缺氧是指生物体在寻常生活环境中缺乏足够的氧气供应。
人体缺氧会对正常生理功能产生较大影响,并可能导致各种严重病症的发生。
为了研究不同类型的缺氧对人体的影响,本实验设计了四种不同的缺氧模型,并对其进行研究和分析。
2. 实验目的- 探究四种不同类型缺氧对人体的影响;- 比较四种不同类型缺氧对人体的影响程度;- 分析四种不同类型缺氧对不同器官的影响。
3. 实验方法3.1 实验材料- 20只小鼠;- 缺氧装置;- 血气分析仪;- 组织切片染色试剂。
3.2 实验步骤1. 将小鼠随机分成四组,每组5只小鼠。
2. 对照组:置于正常环境中,供给足够的氧气。
3. 模型一组:将小鼠置于低氧环境,氧浓度为10%。
4. 模型二组:通过氮气置换,将小鼠置于缺氧环境,氧浓度为5%。
5. 模型三组:将血液中的氧气含量降低至正常的80%。
6. 观察每组小鼠的行为活动,并记录动态变化。
7. 在实验结束后24小时,采集每只小鼠的血液样本,使用血气分析仪测定血气参数。
8. 将小鼠处死,并取出心脏、肝、肺等主要组织进行切片染色,观察组织结构变化。
4. 实验结果4.1 小鼠行为活动观察- 对照组小鼠行为正常,精神状态良好;- 模型一组小鼠出现一定的活动减退,精力不足;- 模型二组小鼠活动明显减少,呼吸急促;- 模型三组小鼠活动极度减弱,行为明显异常。
4.2 血气分析结果组别PaO2(mmHg)SaO2(%)PaCO2(mmHg)pH -对照组95 97 40 7.4模型一60 92 50 7.35模型二50 89 60 7.3模型三70 94 45 7.354.3 组织切片染色结果- 对照组组织结构正常;- 模型一组组织结构出现轻微变化,血管扩张;- 模型二组组织结构明显受损,肝细胞坏死现象严重;- 模型三组组织结构有所改变,肺泡壁增厚。
5. 实验讨论从行为活动观察结果可以看出,随着缺氧程度的加深,小鼠的活动能力逐渐下降,甚至出现异常行为。

小鼠缺氧实验实验报告一、实验目的1、观察不同类型缺氧对小鼠的影响,了解缺氧的分类和特点。
2、掌握测定小鼠耗氧量和存活时间的方法,分析缺氧的机制。
二、实验原理当组织得不到充足的氧气供应或者不能充分利用氧气时,会发生缺氧。
缺氧分为低张性缺氧、血液性缺氧、循环性缺氧和组织性缺氧四种类型。
本实验通过不同的方法建立相应的缺氧模型,观察小鼠在缺氧状态下的行为表现、存活时间以及生理指标的变化,以探讨缺氧的发生机制和特点。
三、实验材料1、实验动物:健康小鼠若干只。
2、实验器材:广口瓶、测氧仪、钠石灰、一氧化碳发生装置、亚硝酸钠溶液、注射器等。
3、实验药品:生理盐水。
四、实验方法1、低张性缺氧模型的建立取两只小鼠,分别放入容积相等的广口瓶中,其中一个广口瓶瓶口密封,瓶内放置适量钠石灰以吸收二氧化碳,造成低张性缺氧环境;另一个广口瓶瓶口敞开,作为正常对照。
观察并记录小鼠的行为表现和存活时间。
2、血液性缺氧模型的建立取两只小鼠,一只腹腔注射亚硝酸钠溶液,造成高铁血红蛋白血症,引起血液性缺氧;另一只腹腔注射等量生理盐水作为对照。
观察并记录小鼠的行为表现和存活时间。
3、循环性缺氧模型的建立取两只小鼠,一只用丝线结扎其单侧颈动脉,造成脑循环障碍,引起循环性缺氧;另一只作为对照,不进行任何处理。
观察并记录小鼠的行为表现和存活时间。
4、组织性缺氧模型的建立取两只小鼠,一只放入充满一氧化碳的广口瓶中,造成组织性缺氧;另一只放入充满空气的广口瓶中作为对照。
观察并记录小鼠的行为表现和存活时间。
五、实验结果1、低张性缺氧缺氧组小鼠出现呼吸加深加快、活动减少、口唇发绀等症状,存活时间明显缩短。
正常对照组小鼠活动正常,存活时间较长。
2、血液性缺氧注射亚硝酸钠溶液的小鼠出现皮肤黏膜青紫、呼吸困难等症状,存活时间较对照组缩短。
3、循环性缺氧结扎单侧颈动脉的小鼠出现偏瘫、抽搐等症状,存活时间较对照组明显缩短。
4、组织性缺氧暴露于一氧化碳环境中的小鼠迅速出现昏迷、抽搐,存活时间极短。
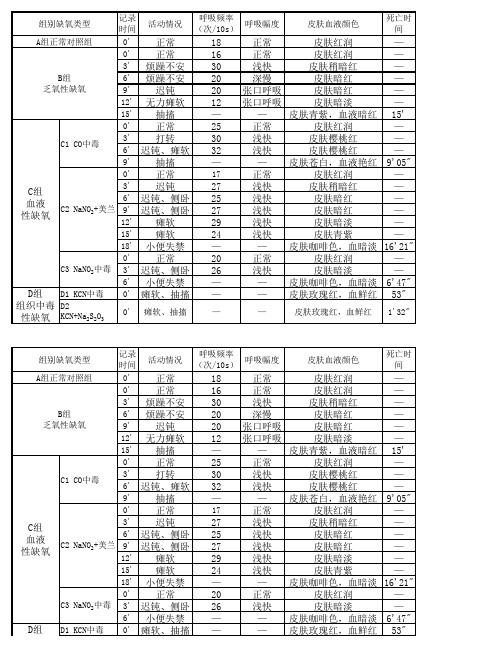



缺氧的类型及影响缺氧耐受性的因素高伟飞(浙江中医药大学滨江学院 10级临床专业临滨1班4组20102090114)一、实验目的:1.观察原因和条件在疾病发生发展中的作用2.复制几种类型缺氧的模型,观察血液颜色的特点,分析其机制根据大纲要求:掌握概念:缺氧、低张性缺氧、血液性缺氧、循环性缺氧和组织性缺氧,紫绀、肠源性紫绀。
熟悉并理解原因和条件在疾病发生发展中的作用。
熟悉反映血氧情况的一些指标(氧分压、氧含量、氧容量、氧饱和度,动静脉血氧含量差)。
掌握各型缺氧发生的原因及主要发病机制,掌握各型缺氧的特征(血氧变化的特点和皮肤黏膜颜色变化)。
二、实验原理:当组织供应组织的氧不足,或组织利用氧障碍时,机体的机能和代谢可发生异常变化,这种病理过程称为缺氧。
不同类型的缺氧,其机体的代偿适应性反应和症状也不同。
根据缺氧原因不同可将缺氧分为乏氧性缺氧、血液性缺氧、循环性缺氧和组织中毒性缺氧四种类型。
影响机体对缺氧耐受性的因素很多,如年龄、机体的代谢、功能状况以及锻炼适应等。
本实验才缺氧的不同环节入手观察呼吸变化及皮肤黏膜的颜色改变。
实验通过动物的不同代谢状况、中枢神经系统功能和动物所处环境温度,观察动物的缺氧耐受性。
三、实验对象:小鼠四、实验材料:电子秤、注射器、钠石灰、广口瓶、测耗氧量装置、剪刀、镊子、滤纸;生理盐水、美兰亚硝酸钠、氯丙嗪、冰块、量筒等五、实验方法:1、取2只小鼠,注射及处理:1号:亚硝酸钠及美兰0.2ml ,左下腹注射2号:亚硝酸钠及生理盐水各0.2ml ,左下腹注射注射完,观察,2号小鼠立即死亡,1号小鼠仍存活;然后处死解剖,剪下一片肝脏组织放于滤纸上,观察肝的颜色。
2、取2只小鼠称重,编号3、4注射及处理:3号:氯丙嗪 0.2ml,左下腹注射4号:生理盐水 0.2ml 左下腹注射将3、4号小鼠分别分别放入钠石灰的广口瓶,塞上塞子,记录下量筒的液面,连通耗氧装置,开始计时,直至小鼠死亡,记录下时间和量筒下降的液面刻度计算两只小鼠的耗氧量小鼠耗氧率R(ml/min/g) =A/(W*t.)六、实验结果:1、几种类型的缺氧序号注射及处理缺氧类型肝脏颜色1 NaNO2+美兰0.2ml 血液性缺氧暗红色2 NaNO2+生理盐水0.2ml 血液性缺氧青石板色2、不同条件下小鼠缺氧耐受性序号体重(g)注射及处理存活时间总耗氧量(ml)耗氧率(ml/min/g)3 18.8 氯丙嗪0.2ml(冰浴)27分8 0.0164 20.6 生理盐水(常温)27分18 0.032七、实验分析:1、血液性缺氧:由于血红蛋白的质或量的改变引起的缺氧。

