趋化因子家族及其受体基础研究进展
- 格式:docx
- 大小:101.57 KB
- 文档页数:4
趋化因子及其受体在免疫细胞中的作用研究概述趋化因子是目前成员最多的细胞因子家族,在人和小鼠中大概有50个内源性趋化因子。
这些因子大约结合20多个跨膜受体。
趋化因子的主要作用是控制免疫细胞的迁移模式,对细胞运动至关重要。
趋化因子系统在初始T细胞产生,决定细胞的分化(如效应细胞和记忆细胞),影响调节性T细胞的功能,调节免疫细胞迁移和定位,已达到体内平衡。
趋化因子在急性炎症和淋巴系统中对免疫反应的产生和调节具有重要作用。
趋化因子在炎性疾病及癌症中的作用使其成为新的药物靶点。
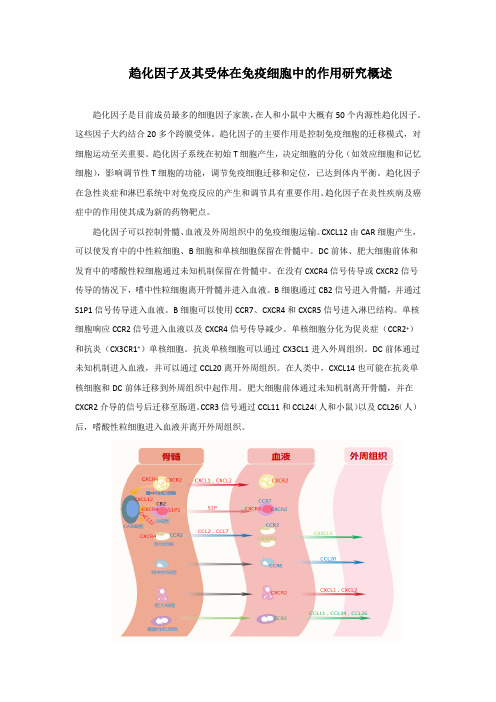
趋化因子可以控制骨髓、血液及外周组织中的免疫细胞运输。
CXCL12由CAR细胞产生,可以使发育中的中性粒细胞、B细胞和单核细胞保留在骨髓中。
DC前体、肥大细胞前体和发育中的嗜酸性粒细胞通过未知机制保留在骨髓中。
在没有CXCR4信号传导或CXCR2信号传导的情况下,嗜中性粒细胞离开骨髓并进入血液。
B细胞通过CB2信号进入骨髓,并通过S1P1信号传导进入血液。
B细胞可以使用CCR7、CXCR4和CXCR5信号进入淋巴结构。
单核细胞响应CCR2信号进入血液以及CXCR4信号传导减少。
单核细胞分化为促炎症(CCR2+)和抗炎(CX3CR1+)单核细胞。
抗炎单核细胞可以通过CX3CL1进入外周组织。
DC前体通过未知机制进入血液,并可以通过CCL20离开外周组织。
在人类中,CXCL14也可能在抗炎单核细胞和DC前体迁移到外周组织中起作用。
肥大细胞前体通过未知机制离开骨髓,并在CXCR2介导的信号后迁移至肠道。
CCR3信号通过CCL11和CCL24(人和小鼠)以及CCL26(人)后,嗜酸性粒细胞进入血液并离开外周组织。
趋化因子精细控制免疫细胞前体的发育及分化,发生在原发性淋巴器官-骨髓和胸腺。
在胸腺中,T细胞祖细胞产生的CCL21、CCL25和CXCL12与CCR7、CCR9和CXCR4相互作用决定胸腺中T细胞的发育。
在骨髓中,免疫细胞的稳态保留和发育在很大程度上依赖于CXCL12/CXCR4相互作用。


2020年第9期广东化工第47卷总第419期 · 129 ·趋化因子及其受体对卵巢癌发生发展的作用的研究进展向雨,张泽宇,辛华*(佳木斯大学附属第一医院,黑龙江佳木斯154007)[摘要]卵巢癌是常见的生殖系统恶性肿瘤之一,由于卵巢癌发病早期多无症状,死亡率占各类妇科肿瘤之首。
因此,寻找早期诊断卵巢癌的标志物意义重大。
趋化因子是一类炎症介质,它们能够在多种肿瘤发生发展过程中发挥重要作用。
本篇综述报道了趋化因子对卵巢癌发生发展的作用的研究进展。
[关键词]卵巢癌;趋化因子;肿瘤标志物[中图分类号]TQ [文献标识码]A [文章编号]1007-1865(2020)09-0129-02Research Progress on the Role of Chemokines and Their Receptors in theDevelopment of Ovarian CancerXiang Yu, Zhang Zeyu, Xin Hua*(First Affiliated Hospital, Jiamusi University, Jiamusi 154007, China)Abstract: Ovarian cancer is one of the common malignant tumors of the reproductive system. Because ovarian cancer is mostly asymptomatic in the early stages, the mortality rate is the highest in all types of gynecological tumors. Therefore, it is of great significance to find markers for early diagnosis of ovarian cancer. Chemokines are a class of inflammatory mediators, and they can play an important role in the development of many tumors. This review reports the research progress on the role of chemokines in the development of ovarian cancer.Keywords: ovarian cancer;chemokine;tumor markers1 引言上皮性卵巢癌是妇科肿瘤死亡的最常见原因。



趋化因子受体CCR研究概述趋化因子要发挥生物学作用,必须与相应的受体结合才行。
趋化因子受体(Chemokine Receptor)属于G蛋白偶联受体,具有7个富含疏水氨基酸的α螺旋穿膜区结构,主要表达于骨髓来源的各白细胞亚群,同时也表达于上皮细胞、血管内皮细胞、神经细胞等类型的细胞。
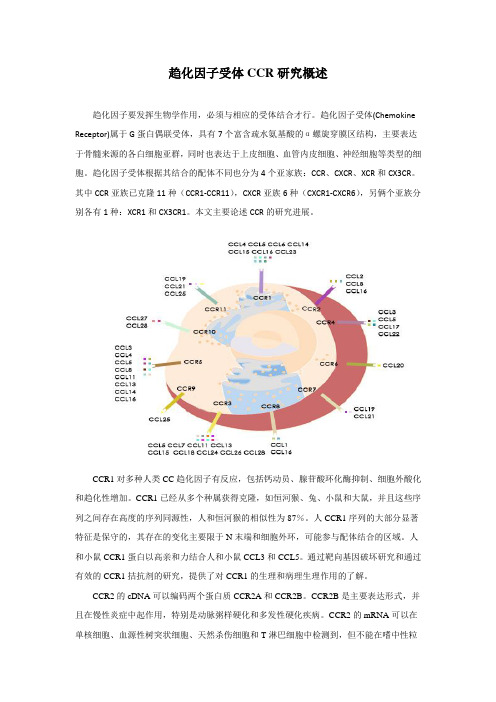
趋化因子受体根据其结合的配体不同也分为4个亚家族:CCR、CXCR、XCR和CX3CR。
其中CCR亚族已克隆11种(CCR1-CCR11),CXCR亚族6种(CXCR1-CXCR6),另俩个亚族分别各有1种:XCR1和CX3CR1。
本文主要论述CCR的研究进展。
CCR1对多种人类CC趋化因子有反应,包括钙动员、腺苷酸环化酶抑制、细胞外酸化和趋化性增加。
CCR1已经从多个种属获得克隆,如恒河猴、兔、小鼠和大鼠,并且这些序列之间存在高度的序列同源性,人和恒河猴的相似性为87%。
人CCR1序列的大部分显著特征是保守的,其存在的变化主要限于N末端和细胞外环,可能参与配体结合的区域。
人和小鼠CCR1蛋白以高亲和力结合人和小鼠CCL3和CCL5。
通过靶向基因破坏研究和通过有效的CCR1拮抗剂的研究,提供了对CCR1的生理和病理生理作用的了解。
CCR2的cDNA可以编码两个蛋白质CCR2A和CCR2B。
CCR2B是主要表达形式,并且在慢性炎症中起作用,特别是动脉粥样硬化和多发性硬化疾病。
CCR2的mRNA可以在单核细胞、血源性树突状细胞、天然杀伤细胞和T淋巴细胞中检测到,但不能在嗜中性粒细胞或嗜酸性粒细胞中检测到。
抗体研究显示CCR2B在单核细胞、活化记忆T细胞、B细胞和嗜碱性粒细胞中表达。
CCR2通过与配体结合,产生许多生物学信号,包括腺苷酸环化酶的抑制、细胞内钙动员和细胞趋化性的增加。
CCR2已从许多物种克隆,包括小鼠、大鼠和恒河猴。
序列高度同源并且显示与人CCR2的78-95%氨基酸一致。
小鼠CCR2特异性结合了具有高亲和力的与MCP-1和MCP-3。


趋化因子家族及其受体基础研究进展趋化因子(Chemokine)是一类小分子碱性蛋白,主要的功能是能够趋化细胞定向移动。
目前已经发现的趋化因子有50多种,随着研究的深入,趋化因子及其受体的结构、功能及在体内的作用已经被众多的研究者发现。
趋化因子及其受体的相互作用,可以参与多种生理功能,比如细胞的生长、发育、分化、凋亡和分布等,在病理过程中也具有重要作用,如炎症反应、病原体感染、创伤修复及肿瘤形成和转移等。
趋化因子一般由70-125个氨基酸组成,分子量较小(6-14KD)。
按照一级肽链结构特点,其N端半胱氨酸残基的位置和数目可将趋化因子分为4个亚族:CC、CXC、C和CX3C(C为半胱氨酸,X为任意氨基酸)。
四类趋化因子结构相似性较高,氨基酸序列具有一定的同源性。
根据趋化因子的表达方式以及其在免疫系统中的作用,可以将他们分为两类:内环境稳定性趋化因子和炎症性趋化因子。
内环境稳定性趋化因子主要在归巢场所表达,有着维持内环境稳态的功能,并且对淋巴细胞归巢及成熟有着明确的作用。
炎症性趋化因子由受到刺激的细胞表达,如炎性细胞因子的诱导、细菌毒素或其它破坏内环境稳定的因素的刺激,主要功能是募集效应细胞,在协调天然和获得性免疫反应中起重要作用。
大多数的趋化因子属于CC和CXC两个亚族族。
其中CC亚族有28个成员(CCL1-CCL28),主要对中性粒细胞、单核细胞、肥大细胞、树突细胞、NK细胞、T和B淋巴细胞等具有强大趋化活性,比较重要的有:单核细胞趋化蛋白(MCP-1/CCL2)、巨噬细胞炎症蛋白(MIP/CCL3)、正常T细胞表达和分泌,活化时表达下降的因子(RANTES/CCL5)等;CXC亚族有17个成员(CXCL1-CXCL17),CXC亚家族主要作用于中性粒细胞,这个亚族比较重要的趋化因子有:白细胞介素-8(IL-8/CXCL8)、γ干扰素诱生的单核因子(Mig/CXCL9)、γ干扰素诱生蛋白10(IP-10/CXCL10)、基质细胞来源因子1(SDF-1/CXCL12)等。

趋化因子及其受体在正常早期妊娠中的作用研究进展智亚楠1,2,甄诚1,3,刘娇1,3,侯涛涛1,李林青1,张萍萍1,李亚丽11 河北省人民医院生殖遗传科,石家庄050051;2 河北医科大学研究生院;3 华北理工大学研究生院摘要:趋化因子是一类结构相似的小分子家族,其与膜结合的G蛋白偶联受体结合而发挥作用,广泛参与细胞免疫、生长发育、炎症等多种生理功能。
趋化因子在母胎界面的胚胎滋养层、蜕膜基质细胞及蜕膜免疫细胞中普遍表达,并通过其受体发挥作用,一方面能够促进子宫内膜蜕膜化、提高子宫容受性,另一方面可以调控滋养层的增殖、迁移和侵袭,促进胚胎着床和发育;此外,趋化因子可以募集外周免疫细胞到达蜕膜,进一步分化诱导母胎免疫耐受,并且介导胎盘血管形成,多方面参与正常妊娠的建立和维持。
对趋化因子及其受体在正常早期妊娠中的作用机制进行总结,有利于更好地认识早期妊娠生理,并为治疗病理妊娠、妊娠合并症和并发症提供治疗新策略。
关键词:趋化因子;趋化因子受体;母胎界面;滋养层细胞;蜕膜细胞;免疫细胞;早期妊娠doi:10.3969/j.issn.1002-266X.2023.11.024中图分类号:R714.1 文献标志码:A 文章编号:1002-266X(2023)11-0093-04趋化因子属于细胞因子超家族,此家族由结构相似的小分子(8~14 kDa)组成,其通过膜结合的G 蛋白偶联受体激活各种信号通路而发挥作用[1]。
迄今为止,已发现总共超过100种趋化因子,根据N端附近保守的半胱氨酸残基的存在及其位置,临床将趋化因子分为C、CC、CXC和CX3C四个亚组,而发现的趋化因子受体只有20多种,受体的命名取决于其配体的结构[2]。
因受体的种类远少于配体的种类,所以一种趋化因子可以与多种受体结合,同时一种趋化因子受体也可以识别多种趋化因子,构成一个复杂的网络,广泛参与细胞免疫、生长发育、炎症等生理病理过程[3]。
囊胚植入并在孕期形成功能性的胎盘对于妊娠的维持至关重要,这是一个复杂而连续的过程,依赖于囊胚和子宫内膜之间的同步发育、免疫耐受调节以及滋养细胞的增殖、迁移和浸润等,需要母胎之间的双向信号传导之间高度协调。




趋化因子受体CCR5的研究进展朱长斌;蒋子恺;程枫;钱关祥【摘要】CCR5, as the member of CC receptor family, with its ligands being CCL3 (MIP-1α), CCL4 (MIP-1β) and CCL5 (RANTES), is categorized as 7 trans-membrane domain G-protein coupled receptor. CCR5 is expressed in monocytes/macrophages as well as lymphocytes inducing chemotaxis and recruitment in inflammatory response and is an important co-receptor of human immunodeficiency virus ( HIV) -1 virus, leading to the multifunction of CCR5 in progression of various kind of immunological diseases and invasion of HIV-1. Moreover, the expression of CCR5 on the surface of tumor cells and stromal cells contributes to mediating multiple biological behaviors of cancers such as proliferation and invasion. Advanced technologies also lead to the revealing of structure, function, signal transduction and roles of CCRS in the progression of related diseases.%CCR5为趋化因子CC受体家族成员,属7次跨膜G蛋白耦联受体,配体为CCL3 (MIP-1α)、CCL4( MIP-1β)、CCL5( RANTES).CCR5主要表达于单核/巨噬细胞和淋巴细胞,与其配体介导CCR5+免疫细胞的趋化、募集过程.因此,多种免疫性疾病的发生和发展过程均有CCR5参与.CCR5是人类免疫缺陷病毒Ⅰ型(HIV-1)入侵时的重要辅助受体,而在肿瘤细胞和各类肿瘤相关间质细胞的表面也可见其表达,并介导肿瘤增殖、浸润等多种生物学过程.随着相关研究技术的发展,进一步加深了对CCR5的结构、功能、信号通路及其在相关疾病中的作用的认识.【期刊名称】《上海交通大学学报(医学版)》【年(卷),期】2012(032)006【总页数】6页(P809-814)【关键词】趋化因子受体;CCR5;免疫性疾病;肿瘤【作者】朱长斌;蒋子恺;程枫;钱关祥【作者单位】上海交通大学医学院临床医学系,上海200025;上海交通大学医学院临床医学系,上海200025;上海交通大学基础医学院教学实验中心,上海200025;上海交通大学基础医学院生物化学与细胞分子生物学系,上海200025【正文语种】中文【中图分类】R730.2趋化因子是一类具有相似分子结构的超家族趋化性细胞因子,依其一级结构中N端高度保守序列的4个半胱氨酸残基中前2个的排列分布状况的不同被分为4类:C、CC、CXC和CX3C[1]。



趋化因子SDF-1及受体CXCR4研究进展第23卷第1期2OO6年2月生物学杂志JOURNALOFBIOLOGYV o1.23No.1Feb,2006趋化因子SDF一1及受体CXCR4研究进展储子彦,陈晓萍,方晶晶(浙江工业大学生物与环境工程学院,杭州I310014)摘要:趋化因子(chenmklne)是一类一级结构相似,以对白细胞等多种细胞具有趋化定向运动作用为特征的小分子蛋白.功能研究表明,趋化因子在胚胎发育,血管生成,炎症,肿瘤,史滋病等机体多种生理和病理过程中发挥重要作用,部分趋化因子的衍生物或抑制物具有潜在的临床应用前景.不久的将来,趋化因子及其受体可能成为疾病治疗的分子靶点.关键词:趋化因子;SDF一1;CXCR4中图分类号:4文献标识码:A文章编号:1008—9632(2006)Oi一0011—03趋化因子是一类重要的免疫调节因子,直接引导自细胞,包括多种免疫活性细胞进行有方向性迁移,不仅能精确地调节免疫系统的反应,还对组织,器官形成,造血系统功能有调节作用.1趋化因子与受体的结构趋化因子分子结构中有4个保守的半胱氨酸,形成2对二硫键,可分成4个亚类:(1)CC亚类,2对二硫键间无其它氨基酸间隔;(2)CXC亚类,间隔1个氨基酸;(3)Cx3C亚类,间隔3个氨基酸;(4)C亚类,仅有1对二硫键.SDF一1(stromalcell—derivedfactor1)基质细胞来源因子,属于趋化因子CXC亚家族,编码区含267bp,编码89个氨基酸残基多肽.CXCR4为SDF一1受体,高度保守,a螺旋跨膜7次,由352个氨基酸组成,在人体内,编码基因位于人染色体2q21,有一个胞外N端,3个胞内环,3个胞外环和1个胞内C端,SDF—l与CXCR4的N端结合,并与CX—CR4和第二胞外环ECI_2(secondextracelluarloop)相互作用才能启动下游信号通路.2SDF一1/CXCR4生物学意义2.1与HW病毒感染的关系CXCR4为嗜T细胞性SI株辅助受体,能与CD4协同作用,参与CD4抗原与HW表面糖蛋白gpl20结合介导病毒吸附侵入的过程,CXCR4的N端结构参与病毒结合,有多个CXCR4结构域特别是第二细胞外环结构能与HⅣ相互作用.趋化因子与受体的结合能阻断受体与HⅣ的结合位点防治HⅣ进入细胞,同时趋化因子对受体的封闭和下调作用也成为一个有效的防治手段,故趋化因子及其衍生物是辅助受体拮抗剂主要成分之一.Fig1Representationof313modelforSDF—ld(NMR}围1SDF一1n的3D模型除了SDF一1的衍生物,还发现CXCR4的其他抑制剂,如:AMD一3100通过与CXCR4的第二膜外环的负电荷区域结合,成为迄今为止与CXCR4结合最有效的非肽类抑制剂.2.2与造血细胞的关系2.2.1SDF一1对造血于/祖细胞增殖和分化的影响Lataillade等【J采用无血清培养基在CD34细胞体外培养中发现,SDF—la对造血干细胞有刺激其增殖的作用,并且与其他造血细胞生长因子(HCF)如干细胞因子(SCF)及白介素一3(IL一3)有协调作用,它还能促进更多的CD34细胞进入细胞周期,使s期和C2期/M期细胞明显多于对照组.2.2.2SDF一1介导造血干/祖细胞的动员过程研究表明,G—SCF动员外周血时,多种蛋白水解酶作用于胞外基质,粘附因子,细胞因子及趋化因子解除细胞与细胞之间形成的紧密结合,促进造血干细胞收稿日期:2005—05—08;修回日期:2005—08—04作者简介:储子彦(1982一),女,汉族,本科生;通讯作者:陈晓萍(1961一),女.汉族,副教授,博士,研究方向为趋化因子作用的分子机制,E—mail:ch)66@.基金项目:国家人事部留学择优基金和浙江省教育厅基金资助项目,项目号~20040586第23卷第1期2006年2月生物学杂志JOURNALOFBIOLOGYV o1.23No.1Feb,2006跨越内皮细胞的转运[21,裂解SDF一1及HSC表面的CXCR4的N端,使HSC失去对SDF一1的趋化作用.骨髓动员的鼠中,骨髓SDF一1浓度会下降,直接导致体内丝氨酸蛋白酶的积累,后者直接引起骨髓造血干/祖细胞的动员[3l.Fig2Cartoonrepresentationof3DmodelforCXCR4receptor图2CXCR4的3D模型图2.2.3对造血干/祖细胞的归巢的影响2.2.3.1SDF一1/CXCR4介导造血干/祖细胞的趋化转移效应来源于骨髓,脐血,动员外周血中的CD34造血干细胞表面表达SDF一1受体CXCR4,而骨髓基质表达的SDF一1能特异对CXCR4产生趋化作用【.因此表达CXCR4的造血干细胞就能够沿着SDF一1的浓度梯度迁移实现归巢过程.CXCR4抗体孵育后的干细胞无法实现归巢,诱导CXCR4在CD34上的表达,能提高造血干l细胞移植成功率.Benb0ubke一5J在研究造血干细胞活动能力与SDF一1基因多态性之间相关性时发现SDF一13'A等基因存在时唯一能预测CD34细胞具有良好动员能力的因素.2.2.3.2SDF一1/CXCR4诱导CD34细胞穿越内层黏附于骨髓基质的作用对CD34细胞进行趋化活性试验发现,SDF一1能引起造血干/祖细胞迁移率增20~1[6].人的骨髓内皮细胞连续表达SDF一1,SDF—l吸附在内皮细胞表面的蛋白多糖上,结合CD34细胞表面的CXCR4捕获造血干/祖细胞,在黏附分子参与下. HSC与内皮细胞产生黏附,SDF—la可增强HSPC与骨12髓基质的黏附作用,这与SDF—la的聚糖和葡萄糖胺聚糖的特性有关.2.3SDF一1/CXCR4在免疫功能上的作用SDF一1/CXCR4是B细胞生长发育成熟的关键细胞因子,骨髓中前B细胞形成需要CXCR4,而胚胎期SDF一1缺乏会损害胎肝前B细胞的发育【.研究发现,SDF一1缺乏鼠的淋巴细胞和骨髓系细胞不能正常发育,由于SDF一1和CxcR4对T细胞,单核细胞的迁移及B淋巴细胞生成中的生物学效应,可能在免疫监视过程中也发挥重要生理功能,在炎症反应中,白细胞向炎症部位集中也与此有关.利用双室模型中研究发现SDF一1的趋化活性较其他趋化因子高1O倍,局部有放射状细胞积聚现象,并观察其趋化活性有浓度梯度依赖性,SDF一1是CD4T细胞活化的共刺激因子,在类风湿性关节炎病变的滑膜中有CD4T细胞的积聚现象,提示SDF一1在免疫及局部炎症过程中是一个重要的调节因子.2.4SDF一1/CXCR4维持胚胎发育敲除小鼠SDF一1基因的2个等位基因,小鼠出生后即死亡,有B细胞增殖,骨髓细胞发育,神经系统发育受阻以及室间隔缺损等缺陷,基因敲除CXCR4小鼠与基因敲除SDF一1小鼠有几乎相同的表现,说明SDF 一1/CXCR4在胚胎发育过程中具有非常重要的作用.2.5sDF一1/CXCR4与肿瘤转移的关系很多研究报告指出,CXCR4在肿瘤细胞高度表达,而SDF一1在某器官的高浓度表达代表肿瘤细胞首先转移的目的地,实验证明CXCR4的抗体有效地阻断了肿瘤细胞向肺部转移的过程,可见SDF一1/CXCR4在肿瘤细胞扩散转移中起到重要作用.CXCR4是肿瘤细胞上很常见的趋化因子受体,同时是其他治疗癌症中的调节因子,例如血管内皮生长因子(VEGF)能诱导CXCR4大量表达,因此ⅦCF抗体能通过抑制CXCR4表达,达到控制肿瘤细胞转移的作用.已发现AMD3100为CXCR4的特异性拮抗剂,通过抑制CXCR4/SDF一1的结合,抑制肿瘤细胞的定向转移,另外,在乳腺癌患者中雌激素受体(ER)表达明显增高,雌激素的真正标靶为SDF—l,能迅速诱导SDF—hx,SDF一1l3的产生,这种效应可被纯ER拮抗剂ICⅡ82780拮抗.3SDF—l/CxCR4的信号转导SDF—l与CXCR4结合,激活了CxCR4受体耦联的c蛋白,通过激活磷脂酰激醇一3激酶(PI3),丝裂原结合蛋白酶(mitogen—associatedproteinkinase,MAPK)和第23卷第1期2006年2月生物学杂志JOURNALOFBIOLOGYV0J.23No,lFeb,2006转录因子NF—KB,为SDF一1/CxCR4一PI3一~LAJPK—NF一皿信号通路,具体如下:(1)SDF一1刺激可使PI一3激酶P85亚单位及PLC一了酪氨酸磷酸化,PLC一可激活PKC,PKC进一步激化一系列局部黏附蛋白,从而介导细胞迁移.SDF一1诱导的细胞趋化可被PI一3激酶抑制剂wortmannin和PKC抑制剂GF109203X所阻断.(2)SDF一1刺激引起核转录因子NF—B活化,支持SDF一1/CXCR4在细胞,增殖及维持生存中发挥作用. (3)SDF一1刺激还经MEK(MAPKandERKkinase)激活P44/42ERK(ExtraceUnlarSignal—regulatedki—nase),但不能激活p38或JNKMA_PK(Mito—activated proteinkinase).SDF一1诱导的细胞也不能被MEK抑制剂PD98059阻断,考虑MEK可能在SDF一1/CXCR4诱导的细胞内信号转导中起调节作用.4结束语SDF一1和CXCR4的特异性结合及其所启动的下游信号通路在细胞的胚胎发育,造血,免疫及HIV治疗上具有重要的意义,对具体的特异性识别过程及调控环节的详尽研究,将有助于我们深入理解细胞问相互作用以及人体中正常的生理功能,并有助于人们开发各种抑制齐IJ运用于临床治疗.参考文献:[1]LatailladeJJ,ClayD,DupuyC,cta1.ChemoHneSDF一1enhanc~ clreulatlngCD34cellprolifemdoninsynergywithcy[0nespossi—bleroleinrogenitorsurvival[JJ.Blood,2000,95:756—768.[2]Va&yGG,Lidey0.Extracelhlarmatrixmot/ct/s,Cytokines,anden—zymes,dymmiceffectsonimmunecellbe|mviorandinflammation [J].JI_eukecBiol,2000,67:149—159.[3]LevesqueJP,HendyT,TakamatsuY,eta1.DisruptionoftheCX—CR4/CXCLRchemotacticinteractionduringhematopoictiestemcell mobilizationinducedbyG—SCForcyclophosphamidelJJ.JElla Invest,2003,111:187—196.[4]WrightDE,BowtnanEP,WagersAJ,eta1.Hematopoictic8[eIilceils areuniquelyselectiveintheirmigratoryresponsetochemokines[JJ. JExpMed,2002,195:1145~1154[5]BenboubkerL,WarierH,CationA,eta1.BrJHaematol,2001,ll3 (1):247.[6]NaiyerAL.JodY,AhnJ,eta1.Stromalderivedfactor一1induced clleImnesofcordbloodCD34cells(1ongtermcuhttreinitiatingcells)th~ue,hendothelialcellsismediatesbyE一~lecfin[J】.Blood,1999,94:柏11一柏19.[7]Fe~T,KawabataK,KawamotoH,eta1.TheearlieststagesofB celldevelopmentrequireachemokinestromalcell—derivedfactor/pm—B础growth—stimulatingfactor[J].Immunity,2001,15(2):323334.ProgressesofchemokineSDF一1andCXCR4CHUZi—yah,CHENXiao—ping,FANGJing—jing (ZhejiangUniversityofTechnology,BiologicalandEnvimnmentalEngineeringCollege,H angzhou310014,China)Abstract:Chemokineisagroupofsmallmolecularproteinswithsimilarilyprimarystructure andchemotaxisactivity.Re—cendyresearchshowedtheirimportantregulatingeffectsonembryonicdevelopment,vascul ogenesis,inflammation,tumor,AIDSandmanypathologicprocess.Thederivantofchemokineoritsinhibitorsshowdgoodclinical applicationprospect.Nearlyfuture, chemokinesandtheirreceptorswillbethetherapeuticmoleculartargettodiseases. Keywords:chemokine;stromalcell—derivedfactor一1;CXCreceptor4(上接7页)[17]张伟.滚筒式填料筛板萃取器反胶团法萃取蛋白质[J]化工,2000.12(增刊):227~231.[18]赵雪雁,佟晓冬,孙颜.StreamlineSP膨胀床纯化溶菌酶[J].过程工程2004,4(2):104—110[19]MamanoJGSandTsotsisTT.CatalyticMembranesandMembraaeReactors[M].Wiley—VCHVerlagGmbH,WeinheimPress,2002. ProgressesofresearchonthepurificationandseparationofthelysozymeFENGOuan.NGBin(AnhuiUniversityofTechnologyandScience,Wuhu241000,China)Abstract:Recentresearchprogressesonthepurificationandseparationofthelysozymewerereviewed.suchasion—ex—changechromatography,ultrafiltmtion,reversedmicellarextraction,affinity—basedbioseparationandsoon.Atthesadietime,de. velopmentprospectsofwaysofthepurificationandseparationofthelysozymewerediscusse d-Keywords:lysozyme;purification;separation13。

趋化因子家族及其受体基础研究进展
趋化因子(Chemokine)是一类小分子碱性蛋白,主要的功能是能够趋化细胞定向移动。
目前已经发现的趋化因子有50多种,随着研究的深入,趋化因子及其受体的结构、功能及在体内的作用已经被众多的研究者发现。
趋化因子及其受体的相互作用,可以参与多种生理功能,比如细胞的生长、发育、分化、凋亡和分布等,在病理过程中也具有重要作用,如炎症反应、病原体感染、创伤修复及肿瘤形成和转移等。
趋化因子一般由70-125个氨基酸组成,分子量较小(6-14KD)。
按照一级肽链结构特点,其N端半胱氨酸残基的位置和数目可将趋化因子分为4个亚族:CC、CXC、C和CX3C(C为半胱氨酸,X为任意氨基酸)。
四类趋化因子结构相似性较高,氨基酸序列具有一定的同源性。
根据趋化因子的表达方式以及其在免疫系统中的作用,可以将他们分为两类:内环境稳定性趋化因子和炎症性趋化因子。
内环境稳定性趋化因子主要在归巢场所表达,有着维持内环境稳态的功能,并且对淋巴细胞归巢及成熟有着明确的作用。
炎症性趋化因子由受到刺激的细胞表达,如炎性细胞因子的诱导、细菌毒素或其它破坏内环境稳定的因素的刺激,主要功能是募集效应细胞,在协调天然和获得性免疫反应中起重要作用。
大多数的趋化因子属于CC和CXC两个亚族族。
其中CC亚族有28个成员(CCL1-CCL28),主要对中性粒细胞、单核细胞、肥大细胞、树突细胞、NK细胞、T和B淋巴细胞等具有强
大趋化活性,比较重要的有:单核细胞趋化蛋白(MCP-1/CCL2)、巨噬细胞炎症蛋白(MIP/CCL3)、正常T细胞表达和分泌,活化时表达下降的因子(RANTES/CCL5)等;CXC亚族有17个成员(CXCL1-CXCL17),CXC亚家族主要作用于中性粒细胞,这个亚族比较重要的趋化因子有:
白细胞介素-8(IL-8/CXCL8)、γ干扰素诱生的单核因子(Mig/CXCL9)、γ干扰素诱生蛋白10(IP-10/CXCL10)、基质细胞来源因子1(SDF-1/CXCL12)等。
另外,CXC亚家族根据其第1
个半胱氨酸前有无谷氨酸-亮氨酸-精氨酸序列(Glu-Leu-Arg)进一步分为ELR+和ELR-两类,
前者具有促进血管新生作用。
C亚家族包含两个趋化因子XCL1和XCL2,主要表达于胸腺,作用于CD8+ T淋巴细胞。
CX3C亚家族只有一个趋化因子CX3CL1,也称为不规则趋化因子(fractalkine)或神经元趋化因子(neurotactin),是唯一膜结合性趋化因子,主要作用于单核细胞和中性粒细胞。
趋化因子要发挥生物学作用,必须与相应的受体结合才行。
趋化因子受体(Chemokine Receptor)属于G蛋白偶联受体,具有7个富含疏水氨基酸的α螺旋穿膜区结构,主要表达
于骨髓来源的各白细胞亚群,同时也表达于上皮细胞、血管内皮细胞、神经细胞等类型的细胞。
趋化因子受体根据其结合的配体不同也分为4个亚家族:CCR、CXCR、XCR和CX3CR。
其中CCR亚族已克隆11种(CCR1-CCR11),CXCR亚族6种(CXCR1-CXCR6),另俩个亚族分别各有1种:XCR1和CX3CR1。
趋化因子与其受体之间交叉作用,形成复杂的网络关系,即一种趋化因子可与多个受体结合,一个受体也可以有多个高亲和的趋化因子配体。
如CCR1,可以表达于单核细胞、中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、巨噬细胞、T、B淋巴细胞等多种炎症细胞表面,其配体可有CCL2、CCL3、CCL4、CCL5、CCL6、CCL8、CCL15等,在炎症性疾病中CCR1可与其多种配体结合后,对表达该受体的多种炎症细胞进行趋化和激活,进而引起一系列生物学效应,参与多种炎症疾病的转归;同时,趋化因子CCL8除可与CCR1结合外,还可与CCR2、CCR5结合,充分体现了趋化因子受体与其配体相互作用的复杂性。
但CXC趋化因子及其受体不能与CC趋化因子及其受体交叉结合,只有DARC例外,它可以结合CXC亚家族中的IL-8、CXCL7、GRO -α和CC亚家族中的CCL2及CCL5。
趋化因子及其受体的生物学功能非常多。
起初,趋化因子及其受体是作为趋化性介质被发现,随着研究的深入,趋化因子及其受体的功能也被更多的发现,比如在免疫细胞和器官的发育、免疫应答过程、炎症反应、病原体感染、创伤修复及肿瘤形成和转移等方面发挥广泛的生理和病理作用。
趋化因子在骨髓血细胞生成中起关键作用,研究证明至少有25种趋化因子可以调节骨髓祖细胞增殖,CXCL12及其特异性受体CX2CR4表达缺乏的小鼠存在B淋巴细胞发生和成熟障碍并在围产期死亡。
胸腺是T淋巴细胞发育的重要器官,有许多特异性趋化淋巴细胞定向迁移的趋化因子mRNA 表达,包括CCL17、CCL19、CCL21、CCL25和CXCL12。
趋化因子及其受体在淋巴细胞成熟后向二级淋巴器官的归巢和定居过程中具有关键作用。
趋化因子还参与次级淋巴器官的发育和组建。
趋化因子通过作用于具有不同趋化因子受体表达谱的DC,控制和调节DC完成其迁移过程。
趋化因子通过促进炎症细胞在损伤和感染组织的浸润和活化参与炎症过程。
例如在细菌性肺炎,CXC趋化因子趋化中性粒细胞在炎症部位的聚集对于清除侵入微生物非常必需。
CXCL8、CXCL5和CXCL1、2、3,能促进兔角膜的血管生成。
CXCL4、CXCL10和CXCL9能拮抗ELR+趋化因子诱发的血管生成作用。
其他趋化因子如CCL1、CCL2、CCL11和CX3CL1也参与血管生成过程。
趋化因子及其受体与人类疾病的关系密切,如哮喘患者的支气管粘膜有CCR3及其配体的表达,有研究证明抗CXCR1和CXCR2的药物有助于治疗慢性支气管炎、重症哮喘和CCPD 的炎症反应。
趋化因子及其受体在慢性丙型肝炎中对淋巴细胞的迁移和募集起到至关重要的作用。
许多趋化因子通过细胞转化、血管发生、蛋白酶的分泌和器官特异性转移在肿瘤生长、侵犯和转移等方面发挥作用。
在肿瘤及癌症研究方面,已经证明许多人类癌症具有复杂的趋化因子网络,可能会影响白细胞浸润的程度和表型、血管生成、肿瘤细胞生长、存活和迁移。
最近的研究发现,特异性趋化因子的表达为多种肿瘤转移所必需。
例如,CCR4和CCR7在人乳腺癌细胞系、恶性乳腺肿瘤中高表达,而这些受体的配体CX2CL12和CCL21在肿瘤细胞转移的器官中高表达。
趋化因子及其受体在其他肿瘤转移中作用已有许多报道,包括黑素瘤、非霍奇金B细胞淋巴瘤、卵巢癌、胰腺癌等。
乳腺癌细胞的CCL5产生与肿瘤进展相关,只有在良性乳腺疾病中发现的微小趋化因子表达。
CCL2表达水平也与乳腺癌进展和巨噬细胞积累相关。
大多数霍奇金病例的特征是复合趋化因子网络,其包括吸引Th2淋巴细胞如CCL17、CCL11、CCL22以及Th1吸引趋化因子CXCL10、CXCL9、CCL2、CCL3、CCL5和CXCL1。
腹水形成是人上皮性卵巢癌的常见发生。
在腹水细胞和腹水中发现CCL2、CCL3、CCL4、CCL5、CCL8和CCL22的纳摩尔水平的蛋白质。
趋化因子及其受体具有其广泛的细胞来源和生物学效应,在多种疾病的发生和发展中起着重要的作用。
人类肿瘤中的趋化因子网络是复杂的,其作用仅有部分被报道,仍有大量未知的信息需要来研究。
随着在对细胞因子及其受体研究的深入,可能会为治疗人类的某些疾病如动脉粥样硬化病变、自身免疫病、器官移植、HIV感染和肿瘤等开辟新的途径,为临床上治疗各种疾病开辟新景象。