环烷烃的张力是四者之和。
环丙烷的结构:
弯曲键
纽蔓投影式
环丁烷和环戊烷的构象:
折 叠 式 构 象
信 封 式 构 象
扭 曲 式 构 象
3.3.2 环己烷的构象 椅式构象和船式构象:
椅式构象是无张力环,稳定
船式构象存在扭转张力 和非键张力,不稳定
直立键 (a键) 和平伏键(e键)
直立键
平伏键
直 立 键 『 键 』
顺反异构:
——当环上有两个碳原子各连有不同的原子或 基团时就存在顺反异构.
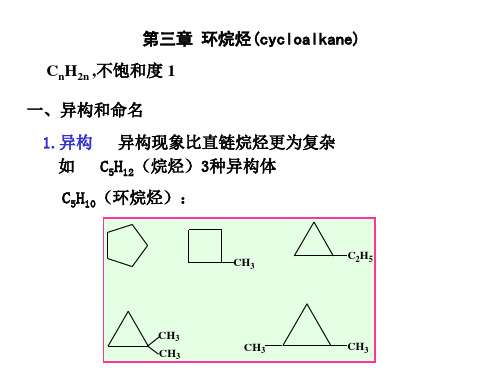
例如:n=5时单环烷烃的构造异构
单环烷烃命名:
① “环”字 ② 取代基的位次和最小 ③ 小的号码表示小的取代基
顺反异构的命名:
双环烷烃:
通式CnH2n-2 根据两个碳环的位置关系分为:
命名:
隔离型双环烷烃: 联环烷烃:
立体透视式
锯架式
例:1,2-二甲基环己烷
顺式:
a,e
反式:
e,e
a,a
稳 定
反式
顺式
顺-1-甲基-4-叔丁基环己烷
稳 定
优势构象
顺-4-叔丁基环己醇
稳 定
优势构象
顺-1-甲基-3-氯环己烷
多取代环己烷:
全顺式-1,2,4-三甲基环己烷
十氢化萘的结构:
稳 定
第三章
环烷烃
环烷烃的定义、分类、异构和命名 环烷烃的性质 环烷烃的环张力和稳定性 环己烷的构象
3.1 脂环烃的定义、分类、异构和命名
脂环烃——具有环状碳骨架,而性质上与脂肪
烃相似的烃类。分为饱和脂环烃和不饱和脂环烃.
环烷烃——饱和脂环烃
环烷烃分类: 单环烷烃 双环烷烃 多环烷烃