高考化学专题复习资料:反应热专项练习
- 格式:doc
- 大小:82.29 KB
- 文档页数:7


专题28反应热计算——键能1.【2022年6月浙江卷】标准状态下,下列物质气态时的相对能量如下表:物质(g)OHHOHOO2H 2O 22H O 2H O能量/-1kJ mol ⋅2492183910136-242-可根据22HO(g)+HO(g)=H O (g)计算出22H O 中氧氧单键的键能为-1214kJ mol ⋅。
下列说法不正..确.的是A .2H 的键能为-1436kJ mol ⋅B .2O 的键能大于22H O 中氧氧单键的键能的两倍C .解离氧氧单键所需能量:22HOO<H O D .-1222H O(g)+O(g)=H O (g)ΔH=-143kJ mol⋅2.(2021.1·浙江真题)已知共价键的键能与热化学方程式信息如下表:共价键H-H H-O 键能/(kJ·mol -1)436463热化学方程式2H 2(g)+O 2(g)=2H 2O(g)ΔH =-482kJ·mol -1则2O(g)=O 2(g)的ΔH 为A .428kJ·mol -1B .-428kJ·mol -1C .498kJ·mol -1D .-498kJ·mol -13.(2010·湖南高考真题)己知:HCN(aq)与NaOH(aq)反应的-1H=-12.1kJ mol ⋅ ;HCl(aq)与NaOH(aq)反应的-1H=-55.6kJ mol ⋅ 。
则HCN 在水溶液中电离的H 等于A .-1-67.7kJ mol ⋅B .-1-43.5kJ mol ⋅C .-1+43.5kJ mol ⋅D .-1+67.7kJ mol ⋅4.(2016·海南高考真题)油酸甘油酯(相对分子质量884)在体内代谢时可发生如下反应:C 57H 104O 6(s)+80O 2(g)=57CO 2(g)+52H 2O(l)。
已知燃烧1kg 该化合物释放出热量3.8×104kJ 。
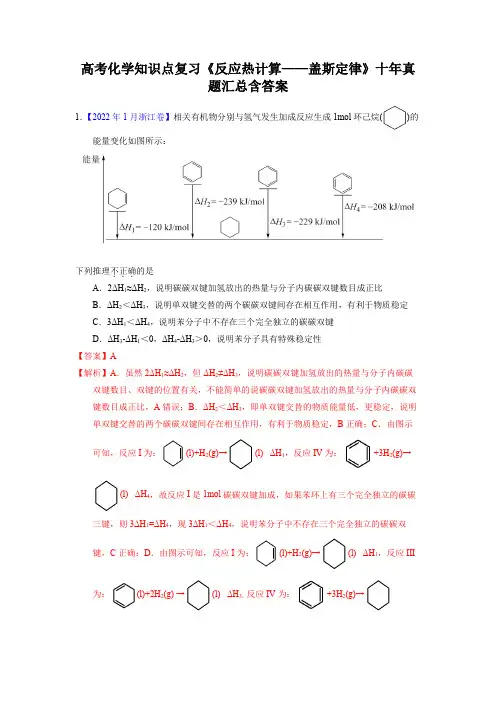
高考化学知识点复习《反应热计算——盖斯定律》十年真题汇总含答案1.【2022年1月浙江卷】相关有机物分别与氢气发生加成反应生成1mol环己烷()的能量变化如图所示:下列推理不正确...的是A.2ΔH1≈ΔH2,说明碳碳双键加氢放出的热量与分子内碳碳双键数目成正比B.ΔH2<ΔH3,说明单双键交替的两个碳碳双键间存在相互作用,有利于物质稳定C.3ΔH1<ΔH4,说明苯分子中不存在三个完全独立的碳碳双键D.ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子具有特殊稳定性【答案】A【解析】A.虽然2ΔH1≈ΔH2,但ΔH2≠ΔH3,说明碳碳双键加氢放出的热量与分子内碳碳双键数目、双键的位置有关,不能简单的说碳碳双键加氢放出的热量与分子内碳碳双键数目成正比,A错误;B.ΔH2<ΔH3,即单双键交替的物质能量低,更稳定,说明单双键交替的两个碳碳双键间存在相互作用,有利于物质稳定,B正确;C.由图示可知,反应I为:(l)+H2(g)→(l)ΔH1,反应IV为:+3H2(g)→(l)ΔH4,故反应I是1mol碳碳双键加成,如果苯环上有三个完全独立的碳碳三键,则3ΔH1=ΔH4,现3ΔH1<ΔH4,说明苯分子中不存在三个完全独立的碳碳双键,C正确;D.由图示可知,反应I为:(l)+H2(g)→(l)ΔH1,反应III 为:(l)+2H2(g) →(l)ΔH3,反应IV为:+3H2(g)→(l) ΔH 4,ΔH 3-ΔH 1<0即(l)+H 2(g) →(l) ΔH <0,ΔH 4-ΔH 3>0即+H 2(g)→(l) ΔH >0,则说明具有的总能量小于,能量越低越稳定,则说明苯分子具有特殊稳定性,D 正确;故答案为:A 。
2.(2021.6·浙江真题)相同温度和压强下,关于反应的ΔH ,下列判断正确的是A .12ΔH >0,ΔH >0B .312ΔH =ΔH +ΔHC .3212>ΔH ,ΔH ΔH >ΔHD .423=ΔH H +ΔΔH【答案】C 【解析】一般的烯烃与氢气发生的加成反应为放热反应,但是,由于苯环结构的特殊性决定了苯环结构的稳定性,苯与氢气发生加成反应生成1,3-环己二烯时,破坏了苯环结构的稳定性,因此该反应为吸热反应。

反应热的计算1.化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观象冰的甲烷水合物固体.甲烷气体燃烧和水汽化的热化学方程式如下:CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-802。
3 kJ·mol-1H2O(l)===H2O(g)ΔH=+44 kJ·mol-1则356 g“可燃冰”(分子式为CH4·9H2O)释放的甲烷气体完全燃烧生成液态水,放出的热量为____________________________________________________。
(2)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,其热化学方程式为______________________________________(3)家用液化气中主要成分之一是丁烷。
当丁烷完全燃烧并生成CO2和液态水时,放出热量50 kJ.试写出丁烷燃烧的热化学方程式______________________________。
2.已知两个热化学方程式:2H2(g)+O2(g)==2H2O(l); △H= -571.6 kJ/molC3H8(g) +5O2(g)==3CO2(g)+4 H2O(l); △H= —2220kJ/mol实验测得H2和C3H8混合气体共5mol,完全燃烧时放热3847kJ,则混合气体中H2与C3H8的体积比为()A。
1:3 B。
3:1 C。
1:4 D.1:13. CO、CH4均为常见的可燃性气体.(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是________。
(2)已知在101 kPa时,CO的燃烧热为283 kJ/mol。
相同条件下,若2 mol CH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6。
30 倍,CH4完全燃烧反应的热化学方程式是____________________________________________________.(3)120 ℃、101 kPa下,a mL由CO、CH4组成的混合气体在b mL O2中完全燃烧后,恢复到原温度和压强.若混合气体与O2恰好完全反应,产生b mL CO2,则混合气体中CH4的体积分数为________(保留2位小数).4.化学键的键能是指气态原子间形成1 mol化学键时释放的能量.如H(g)+I(g)===H—I(g)ΔH=-297 kJ/mol,即H—I键的键能为297 kJ/mol,也可以理解为破坏1 mol H—I键需要吸收297 kJ的能量.一个化学反应一般有旧化学键的断裂和新化学键的形成.如下表是一些键能数据(kJ/mol):回答下列问题:(1)由表中数据能否得出这样的结论:①半径越小的原子形成的共价键越牢固(即键能越大)________(填“能"或“不能”);②非金属性越强的原子形成的共价键越牢固________(填“能”或“不能").能否由数据找出一些规律,请写出一条:______________________________________________;试预测C—Br键的键能范围:________________________<C—Br键能<________.(2)由热化学方程式H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ/mol,并结合表上数据可推知一个化学反应的反应热(设反应物、生成物均为气态)与反应物和生成物的键能之间的关系是__________________________________________________________,________________________________________________________________________由热化学方程式2H2(g)+S2(s)===2H2S(g) ΔH=-224.5 kJ/mol和表中数值可计算出1 mol S2(s)汽化时将________(填“吸收”或“放出")________kJ的热量.5.下列说法正确的是()A.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度B.在101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量,H2的燃烧热为-285.8 kJ·mol-1C.在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110。
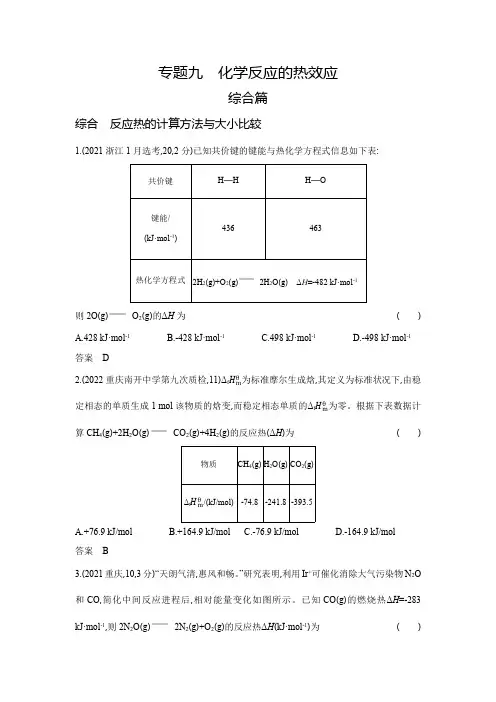
专题九化学反应的热效应综合篇综合反应热的计算方法与大小比较1.(2021浙江1月选考,20,2分)已知共价键的键能与热化学方程式信息如下表:共价键H—H H—O键能/436463(kJ·mol-1)热化学方程式2H2(g)+O2(g)2H2O(g)ΔH=-482kJ·mol-1则2O(g)O2(g)的ΔH为() A.428kJ·mol-1 B.-428kJ·mol-1 C.498kJ·mol-1 D.-498kJ·mol-1答案D2.(2022重庆南开中学第九次质检,11)Δf mθ为标准摩尔生成焓,其定义为标准状况下,由稳定相态的单质生成1mol该物质的焓变,而稳定相态单质的Δf mθ为零。
根据下表数据计算CH4(g)+2H2O(g)CO2(g)+4H2(g)的反应热(ΔH)为()物质CH4(g)H2O(g)CO2(g)Δf mθ/(kJ/mol)-74.8-241.8-393.5A.+76.9kJ/molB.+164.9kJ/molC.-76.9kJ/molD.-164.9kJ/mol答案B3.(2021重庆,10,3分)“天朗气清,惠风和畅。
”研究表明,利用Ir+可催化消除大气污染物N2O 和CO,简化中间反应进程后,相对能量变化如图所示。
已知CO(g)的燃烧热ΔH=-283 kJ·mol-1,则2N2O(g)2N2(g)+O2(g)的反应热ΔH(kJ·mol-1)为()A.-152B.-76C.+76D.+152答案A4.(2023届安徽江淮十校联考一,9)下列关于反应热的说法正确的是()A.a.A(g)+B(g)C(g)ΔH1;b.A(s)+B(g)C(g)ΔH2,若a、b反应均放热,则ΔH1<ΔH2B.已知2CH4(g)+4O2(g)2CO2(g)+4H2O(g)ΔH=-1780.6kJ·mol-1,则甲烷的燃烧热为890.3kJ·mol-1C.A4(s)4A(s)ΔH=-29.2kJ·mol-1,则常温下A4(s)比A(s)更稳定D.2X(g)+Y(g)3Z(g)ΔH>0,恒温恒压下达平衡后加入X,上述反应ΔH增大答案A5.(2019江苏单科,11,4分)氢气与氧气生成水的反应是氢能源应用的重要途径。

高考化学专题复习:化学反应的热效应一、单项选择题(共10小题)1.常温下,1mol化学键形成(或断裂)的能量变化用E表示。
下列说法不正确的是()化学键H-H Cl-Cl H-ClE/(mol/L)436243431A.1mol H-Cl化学键的形成,放出431kJ的能量B.H2和Cl2反应生成HCl的过程中,非极性键断裂,极性键形成C.H2(g)+Cl2(g)=2HCl(g)ΔH=−248kJ/molD.1mol H2(g)和1mol Cl2(g)的总能量高于2mol HCl(g)的总能量2.工厂的氨氮废水可用电化学催化氧化法加以处理,其中NH3在电极表面的氧化过程的微观示意如图:下列说法中,不正确的是()A.过程①②均有N-H键断裂B.过程③的电极反应式为:NH−e-+OH-═N+H2OC.过程④中有非极性键形成D.催化剂可以降低该反应的焓变3.已知热化学反应方程式:①C(s)+O2(g)═CO2(g)ΔH1=-393.5kJ/mol,②CO(g)+12O2(g)═CO2(g)ΔH2=-283.0kJ/mol,下列说法错误的是()A.反应①:E(反应物)>E(生成物)B.CO的燃烧热是283.0kJ/molC.C生成CO需要吸热D.盖斯定律可间接获得不方便测量的反应热4.H-H键键能为436kJ/mol,下列关于反应H2(g)+Cl2(g)═2HCl(g)ΔH=akJ/mol 的能量变化叙述正确的是()A.1molH-H断裂放出热量436kJ B.a值由键能决定,与状态无关C.光照和点燃条件下a的数值不同D.使用催化剂不能改变ΔH 5.下列一些诗句、成语、谚语等包含的反应过程为反应物总能量比生成物总能量低的是()①野火烧不尽,春风吹又生;②春蚕到死丝方尽,蜡炬成灰泪始干;③千锤万凿出深山,烈火焚烧若等闲;④爆竹声中一岁除,春风送暖入屠苏;⑤只要功夫深,铁杵磨成针;⑥火树银花。
A.只有③B.③④⑤C.⑤⑥D.①②④⑥6.三氟化氮(NH3)在微电子工业中是一种优良的等离子蚀刻气体,而且在芯片制造、高能激光器方面得到了大量的运用;三氟化氮也可以储存能量。


2023届高考化学第二轮专题复习真题试卷模拟——化学反应的热效应一、单选题A .铝片与稀24H SO 反应B .()22Ba OH 8H O ⋅与4NH ClC .氢气在2O 中的燃烧反应A .A 2(g)+B 2(g)=2AB(g)是一个放热反应B .A 2(g)与B 2(g)每生成2molAB(g)时吸收C .该反应中反应物的总能量低于生成物的总能量D .断裂1molA -A 键和1molB -B 键时放出3.(2023·全国·高三专题练习)由金属单质和氯气反应得到所示(M=Ca 、Ba)。
下列说法不正确的是A .∆H 1+∆H 3<0B .∆H 4>∆H 5C .∆H 2(Ba)<∆H 2(Ca)D .∆H 1+∆H 2+∆H 3+∆H 4+∆H 5+∆H 6=∆H4.(2023春·湖北武汉·高三校联考期中)如图是金属镁和卤素单质2X 反应的能量变化示意图。
下列说法正确的是A .2MgX 中热稳定性最好的是2MgIB .由2MgCl 制取Mg 是放热过程C .金属镁和卤素单质()2X g 的反应都是放热反应D .此温度下四种2MgX 中,()2MgI s 所含化学键的键能最大5.(2023·全国·高三专题练习)已知几种物质之间的能量关系如图所示,下列说法中不正确的是()A .使用合适催化剂,不能减小反应的焓变B .(g)+H 2(g)=()g 中,热能转化为产物内部的能量C .(g)+H 2(g)=(g)28.7kJ /molH ∆=+.(g)=((2023春高三宁南中学校考阶段练习)下列图示与对应的叙述相符的是A .(a)图表示反应物断键吸收的能量小于生成物成键放出的能量B .(b)图是金刚石与石墨分别被氧化生成2CO 的能量关系曲线,说明石墨转化为金刚石为吸热反应C .由(c)图可知,-13222SO (g)2SO (g)+O (g)ΔH=(b-a)kJ mol ⋅ D .(d)图是某反应:A→C(由两步反应A→B→C 完成,B 为中间产物)的能量曲线量),整个反应中4123ΔH=E -E -E -E 7.(2023春·河北邢台·高三河北南宫中学校考阶段练习)已知甲烷、氢气、一氧化碳的燃烧热H ∆依次为1kJ mol a --⋅、1kJ mol b --⋅、1kJ mol c --⋅(a 、b 、c 均大于0)。


2024届高三化学训练专题-化学反应的热效应一、单选题1.(23-24高二下·安徽六安·期中)已知:①()()()21Zn s +O g =ZnO s 2 -1ΔH=-348.3kJ mol①()()()2212Ag s +O g =Ag O s 2-1ΔH=-31.0kJ mol则()Zn s 与()2Ag O s 反应生成()ZnO s 和()Ag s 的热化学方程式为 A .()()()()2Zn s +Ag O s =ZnO s +2Ag s -1ΔH=+317.3kJ mol B .2O=Zn+Ag ZnO+2Ag -1ΔH=+317.3kJ molC .()()()()2Zn s +Ag O s =ZnO s +2Ag s -1ΔH=-317.3kJ molD .()()()()22Zn s +2Ag O s =2ZnO s +4Ag s -1ΔH=+634.6kJ mol2.(23-24高一下·重庆万州·期中)如图是金属和卤素单质X 2反应的能量变化示意图,下列说法正确的是A .稳定性:MgF 2(s)>MgCl 2(s)>MgBr 2(s)>MgI 2(s)B .由MgI 2(s)转化为MgCl 2(s)需要吸收能量C .22.4 L F 2(g)与足量Mg 反应生成MgF 2(s)放热1124 kJD .由图可知,MgBr 2(s)分解吸收的能量比MgCl 2(s)多3.(23-24高一下·北京·期中)已知:()()()2222H g O g 2H O g += 1kJ mol H a -∆=-⋅已知a 、b 、c 均大于零,下列说法正确的是 A .21molH 与2O 反应生成水放出的热量为akJ B .氢分子变为氢原子需要放出1kJ mol b -⋅的热量C .断开1molH O -键需要的能量为()/4kJ a b c ++D .可通过a 、b 、c 的具体数值判断H H -键与H O -键的相对牢固程度 4.(23-24高一下·山东泰安·期中)下列说法中,正确的有个①过氧化钠与水反应中,既有离子键、极性共价键和非极性共价键的断裂,也有这些化学键的生成①同位素的性质完全相同①两种原子构成的共价化合物分子中的化学键都是极性键 ①气体单质分子中一定含有共价键①5.6g 铁粉与足量的稀盐酸反应,为了加快反应速率而不改变H 2的产量,可以滴入几滴硫酸铜溶液①决定反应速率的主要因素是反应物本性①同温同压下,等物质的量的H 2(g),Cl 2(g),在光照和点燃条件下发生反应H 2(g)+Cl 2(g)=2HCl(g)时,放出的能量相同 A .5B .4C .3D .25.(23-24高一下·辽宁·期中)下列说法正确的是A .()()233O g 2O g = ΔH 0>,则完全破坏等质量的2O 和3O 中的化学键,需要的能量3O 大B .已知C (石墨,s )=C (金刚石,s )ΔH 0>,则金刚石比石墨稳定C .在一定条件下,将()21molSO g 和()20.5molO g 置于密闭容器中充分反应生成()3SO g ,放出热量79.2kJ ,则该反应的热化学方程式()()()2232SO g O g 2SO g + 1ΔH 158.4kJ mol -=-⋅D .已知()()()()2NaOH aq HCl aq NaCl aq H O l +=+ 1ΔH 57.3kJ mol -=-⋅,中和热测定实验中将稀盐酸换成稀醋酸,生成1mol 水时放出的热量小于57.3kJ6.(2024·广东·二模)一定条件下,4CH 与FeO +反应合成3CH OH 的反应历程如图所示。

高考化学常考知识点专练 04:反应热A卷姓名:________ 班级:________ 成绩:________一、单选题 (共9题;共18分)1. (2分) (2015高二下·红河期中) 下列与化学反应能量变化相关的叙述正确的是()A . 生成物总能量一定低于反应物总能量B . 放热反应的反应速率总是大于吸热反应的反应速率C . 应用盖斯定律,可计算某些难以直接测量的反应焓变D . 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同2. (2分) 2012年10月24日飓风“桑迪”袭击美国.一阵飓风过后,海面的巨浪上竟燃烧着熊熊大火.海水会燃烧的原因是()A . 飓风与海水发生剧烈摩擦,产生的巨大热能使水分子分解,引起氢气燃烧B . 飓风使海水温度升高,产生高温水蒸气,达到水的着火点,使海水燃烧C . 飓风产生高温,使氮气在空气中剧烈燃烧D . 以上说法均有可能3. (2分) (2018高二下·葫芦岛开学考) ①Na3N+3H2O=3NaOH+NH3↑,②NaH+H2O=NaOH+H2↑,③2Na+2H2O=2NaOH+H2↑,④ 2F2+2H2O=4HF+O2 ,有关上述反应叙述不正确的是()A . 离子半径: N3﹣>F﹣>Na+B . 上述反应除①外都是氧化还原反应C . 反应②③中的水做氧化剂,每生成1mol H2 ,转移的电子数为2NAD . 反应④中的水是还原剂4. (2分) (2017高二上·湛江期末) 在101kPa、25℃时,1.0g乙烷气体完全燃烧生成液态水时,放出热量52.0kJ,则乙烷燃烧的热化学方程式为()A . C2H6(g)+ O2(g)═2CO2(g)+3H2O(l)△H=﹣1560kJ•mol﹣1B . 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=﹣1560kJ•mol﹣1C . C2H6(g)+ O2(g)═2CO2(g)+3H2O(l)△H=﹣52.0kJ•mol﹣1D . 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=+3120 kJ•mol﹣15. (2分)已知热化学方程式:2A(g)+B(g)⇌2C(g)△H=﹣QkJ•mol﹣1(Q>0).下列说法正确的是()A . 相同条件下,2molA(g)和1molB(g)所具有的总能量小于2mol C(g)所具有的能量B . 增大压强或升高温度,该平衡都向逆反应方向移动C . 将2molA(g)和1molB(g)置于一密闭容器中充分反应后,放出热量为QkJD . 如将一定量A(g)和B(g)置于某密闭容器中充分反应放热Q kJ,则此过程中有2molA(g)被消耗6. (2分)下列关于热化学反应的描述中正确的是A . HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/molB . CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的△H=+566.0kJ/molC . 需要加热才能发生的反应一定是吸热反应D . 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热7. (2分) (2016高一下·武城期末) 下列各图所表示的反应既属于氧化还原反应,又属于吸热反应的是()A .B .C .D .8. (2分)一定条件下的密闭容器中:4NH3(g)+5O2(g)4NO(g)+6H2O(g)+3623KJ;下列叙述正确的是()A . 在密闭容器中充入4molNH3与足量氧气充分反应,达到平衡时放出热量为3623KJB . 平衡时v正(O2)= 4/5 v逆(NO)C . 平衡后降低压强,混合气体平均摩尔质量减小D . 平衡后升高温度,混合气体中NO含量增大9. (2分) (2018高三上·怀化期中) 下列四组热化学方程式,△H1>△H2的是()①C(s)+O2(g)=CO2(g)△H1 C(s)+ O2(g)=CO(g)△H2②S(s)+O2(g)=SO2(g)△H1 S(g)+O2(g)=SO2(g)△H2③CaCO3(s)=CaO(s)+CO2(g)△H1 CaO(s)+H2O(l)=Ca(OH)2(s)△H2④HCl+NaOH=NaCl+H2O△H1HCl+NH3·H2O=NH4Cl+H2O△H2A . ①③B . ①④C . ②③D . ②④二、综合题 (共6题;共35分)10. (4分) (2016高二上·简阳期中) 将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.煤转化为水煤气的主要化学反应为:C+H2O(g)CO+H2 . C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:①C(s)+O2(g)=CO2(g)△H1=﹣393.5kJ•mol﹣1;②H2(g)+ O2(g)=H2O(g)△H2=﹣242.0kJ•mol﹣1;③CO(g)+ O2(g)=CO2(g)△H3=﹣283.0kJ•mol﹣1;试回答:(1)请你根据以上数据,写出C(s)与水蒸气反应生成CO和H2的热化学方程式:________(2)比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和,比1molC(s)完全燃烧放出的热量________(填“多”或“少”).甲同学据此认为:“煤炭燃烧时加少量水,可以使煤炭燃烧放出更多的热量”.乙同学根据盖斯定律作出了下列循环图请你写出△H1、△H2、△H3、△H4之间存在的关系式________.乙同学据此认为:“将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同.”请分析:甲、乙两同学的观点正确的是________(填“甲”或“乙”)同学,另一同学出现错误观点的原因是________.11. (3分) (2017高二下·周口期末) 水煤气的主要成分是氢气和一氧化碳,由水蒸气和炽热的无烟煤或焦炭作用而得.是重要的化工原料,可用于合成甲醇和甲醚等有机化合物,已知:(1)△H1= ________(用△H2、△H3、△H4)。
高考化学总复习《化学反应的热效应》专项练习题及答案解析学校:___________班级:___________姓名:___________考号:___________一、单选题1.(2023春·辽宁沈阳·高三沈阳市第八十三中学校联考期中)下列说法正确的是 A .反应()()()34NH g HCl g NH Cl s +=在低温下能自发进行,说明该反应的Δ<0HB .2H 的热值(单位质量的燃料完全燃烧时所放出的热量,叫做燃料的热值)为1142.9kJ g -⋅,则氢气燃烧的热化学方程式可表示为:()()()2222H g O g 2H O l += 1Δ=285.8kJ mol H --⋅C .能自发进行的反应一定能迅速发生D .增大反应物浓度,可增大活化分子百分数,从而增加有效碰撞的次数2.(2023春·河南新乡·高三延津县第一高级中学校考期中)下列反应既属于氧化还原反应又属于吸热反应的是A .3NaHCO 与盐酸反应B .Na 与水反应C .22Ba(OH)8H O ⋅与4NH Cl 反应D .C 与2CO 反应3.(2023春·四川南充·高三校考期中)已知H 2O 2(aq)分解为H 2O(l)和O 2(g)的能量变化如图曲线A 所示,若在H 2O 2溶液中加入少量KI ,则H 2O 2的分解过程可表示为:①H 2O 2+I -=H 2O+IO -,①H 2O 2+IO -=H 2O+O 2+I -,其能量变化如图曲线B 所示。
下列有关说法不正确...的是A .上述反应①为吸热反应,反应①为放热反应B .2molH 2O 2(aq)具有的能量大于2molH 2O(l)和1molO 2(g)具有的总能量C .I -在H 2O 2分解过程中起到催化剂作用D .催化剂不参与化学反应,反应前后性质、质量不变4.(2023春·福建宁德·高三校联考期中)反应NO 2(g) +CO(g)NO(g) +CO 2 (g)的能量变化如图所示,下A .H(g)和O(g)形成H 2O(g)的过程要吸收能量B .等质量的H 2O(1)与H 2O(g)具有相同的能量C .2H 2(g)+O 2(g)=2H 2O(g)的能量关系可用上图表示D .在H 2(g)和O 2(g)的反应过程中,断开化学键吸收的总能量大于形成化学键释放的总能量7.(2023·全国·高三统考专题练习)工业上可以利用水煤气(2H 、CO )合成二甲醚(33CH OCH ),同时生成2CO 。
高考热练19反应热热化学方程式1. (2020·广东名校联考)下列化学反应符合图示的是()A. 冰雪融化B. 铝与氧化铁的反应C. 钠与水反应D. Ba(OH)2·8H2O和NH4Cl的反应2. (2020·河北邢台四模)下列说法正确的是()A. 灼热的炭与CO2的反应是放热反应B. 伴有能量变化的物质变化都是化学变化C. 通入大量的空气可以提高燃料燃烧时的能量利用率D. 化学反应过程中有物质的变化,同时又伴随有能量的变化3. (2020·福建漳州一模)下列关于化学反应与能量的说法正确的是()A. 已知正丁烷的燃烧热为2 878 kJ/mol,则表示正丁烷燃烧热的热化学方程式:2CH3CH2CH2CH3(g)+13O2(g)===8CO2(g)+10H2O(l)ΔH=-2 878 kJ/molB. 已知在一定条件下,2 mol SO2与1 mol O2充分反应后,释放出98 kJ的热量,则其热化学方程式:2SO2(g)+O2(g)2SO3(g)ΔH=-98 kJ/molC. 已知稀盐酸与稀NaOH溶液反应的中和热为57.3 kJ/mol,则表示稀硫酸与稀NaOH溶液反应的热化学方程式:12H2SO4(aq)+NaOH(aq)===12Na2SO4(aq)+H2O(l)ΔH=-57.3 kJ/molD. 已知CuSO4(s)+5H2O(l)===CuSO4·5H2O(s),该反应为熵增加的反应4. (2020·广州深圳二模)用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜。
已知:Cu(s)+2H+(aq)===Cu2+(aq)+H2(g)ΔH=+64.39 kJ/mol2H2O2(l)===2H2O(l)+O2(g)ΔH=-196.46 kJ/molH2(g)+12O2(g)===H2O(l)ΔH=-285.84 kJ/mol在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H2O(l)的反应热ΔH等于()A. -319.68 kJ/molB. -417.91 kJ/molC. -448.46 kJ/molD. +546.69 kJ/mol5. (2020·广东深圳3月)通过以下反应均可获取H2。
2025届高考化学一轮复习专题卷: 化学反应的热效应一、单选题1.下列图示与对应的叙述不相符合的是( )A.图甲表示燃料燃烧反应的能量变化B.图乙表示酶催化反应的反应速率随反应温度的变化C.图丙表示除去氧化膜的镁条投入到稀盐酸中,反应速率v 随时间t 的变化曲线D.图丁表示某温度下mLl.0mol/LHCl 溶液和mL1.5mol/L 的NaOH 溶液混合均匀后溶液温度随的变化趋势(+=50mL )2.和均为重要的化工原料,且每个原子都满足最外层8电子稳定结构。
已知:①,②。
相关化学键的键能如表所示:化学键键能abc下列说法中错误的是( )A.的结构式为B.的电子式为:C.1V 2V 1V 1V 2V 22S Cl 2SCl 122221S (l)Cl (g)S Cl (g)ΔkJ mol H x -+= ⋅122222S Cl (g)Cl (g)2SCl (g)ΔkJ mol H y -+= ⋅S S -S Cl -Cl Cl -()1/kJ mol-⋅2SCl Cl S Cl --22S Cl 2y b a c=--D.反应的3.已知:①;②;③;④;⑤。
下列关于上述反应焓变的判断不正确的是( )A. B.C.D.4.下列变化中,属于放热反应的是( )A.碳酸氢钠与盐酸反应 B.生石灰与水混合C.碳与水蒸气反应制备水煤气 D.煅烧石灰石5.下列叙述中不正确的是( )A.常温下,能够自发进行,则该反应的B.需加热才能进行的反应是吸热反应,不需加热就能进行的反应是放热反应C.C(金刚石,s)=C(石墨,s) ,则石墨比金刚石稳定D.常温下,6.NO 催化分解的反应机理与总反应为:第一步:第二步:222S (l)2Cl (g)2SCl (g)+1Δ()kJ mol H x y -=+ ⋅221S(g)O (g)SO (g)H +∆222S(s)O (g)SO (g)ΔH +22232H S(g)O (g)2S(s)2H O(l)ΔH ++222242H S(g)3O (g)2SO (g)2H O(l)ΔH ++2225SO (g)2H S(g)3S(s)2H O(l)ΔH ++12H H ∆<∆34ΔΔH H <532ΔΔΔH H H =-5342Δ3ΔΔH H H =-34NH (g)HCl(g)NH Cl(s)+ΔH 0<1ΔH 1.9kJ mol -=-⋅130.1mol L CH -⋅3O 3221O (g)NO(g)O (g)NO (g)H ++∆22NO (g)NO(g)O(g)H +∆第三步:总反应:其能量与反应历程的关系如图所示。
反应热1.下列对能量变化的认识不正确...的是()A.电解水时,电能转化为化学能B.绿色植物进行光合作用时,太阳能转化为化学能C.煤燃烧时,化学能主要转化为热能D.白炽灯工作时,电能全部转化为光能2.下列关于化学反应与能量变化的说法正确的是()A.燃烧属于放热反应B.中和反应是吸热反应C.断裂化学键放出能量D.反应物总能量与生成物总能量可能相等3.将铁粉和硫粉充分混合后加热,待反应一发生立即停止加热,反应仍可持续进行,直至反应完全,生成新物质硫化亚铁。
此现象说明()A.该反应是吸热反应B.该反应是放热反应C.铁粉和硫粉在常温下容易发生反应D.产物硫化亚铁的总能量高于反应物铁粉和硫粉的总能量4.下列说法中正确的是(中和反应反应热简称中和热)()A.中和热一定是强酸跟强碱反应放出的热量B.1 mol酸与1 mol碱完全反应放出的热量是中和热C.在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时所放出的热量叫作中和热D.测定中和热时可用稀硫酸和稀Ba(OH)2溶液5.下列反应既属于氧化还原反应,又属于吸热反应的是()A.铝片与稀盐酸反应B.Ba(OH)2·8H2O与NH4Cl反应C.灼热的炭与CO2反应D.甲烷在氧气中的燃烧反应6.下列有关叙述正确的是()A.测定中和反应的反应热时,需要用到天平B.若用50 mL 0.55 mol·L-1的氢氧化钠溶液,分别与50 mL 0.50 mol·L-1的盐酸和50 mL 0.50 mol·L-1的硝酸充分反应,两中和反应的反应热不相等C.用玻璃搅拌器是为了加快反应速率,减小实验误差D.只需做一次实验,再根据公式即可得出中和反应的反应热7.已知羰基硫(COS)是硫循环的重要中间体,反应H2(g)+COS(g)H2S(g)+ CO(g) ΔH的能量变化如图所示。
下列说法错误的是( )A.ΔH<0B.加入催化剂,ΔH的值不变C.反应物的总能量大于生成物的总能量D.反应物的键能总和大于生成物的键能总和8.下列关于热化学方程式的说法错误的是( )A.化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比B.热化学方程式中各物质前的化学计量数表示物质的量,可以用整数或者简单分数C.热化学方程式未注明温度和压强时,ΔH表示标准状况下的数据D.同一化学反应,反应条件不同ΔH可能相同9.下列说法中正确的是()A.在化学反应过程中,发生物质变化的同时不一定发生能量变化B.破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,该反应为吸热反应C.生成物的总焓大于反应物的总焓时,反应吸热,ΔH>0D.ΔH的大小与热化学方程式的化学计量数无关10.已知反应X+Y===M+N为吸热反应,下列说法中正确的是()A.X的能量一定低于M的能量,Y的能量一定低于N的能量B.因为该反应为吸热反应,故一定要加热反应才能进行C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量D.X和Y的总能量一定低于M和N的总能量11.由氢气和氧气反应生成1 mol水蒸气放出241.8 kJ的热量,1 g水蒸气转化为液态水放出2.45 kJ的热量,则下列热化学方程式书写正确的是()A.H 2(g)+12O 2(g)===H 2O(l) ΔH =-285.9 kJ·mol -1 B.H 2(g)+12O 2(g)===H 2O(l) ΔH =-241.8 kJ·mol -1 C.H 2(g)+12O 2(g)===H 2O(l) ΔH =285.9 kJ·mol -1 D.H 2(g)+12O 2(g)===H 2O(g) ΔH =241.8 kJ·mol -1 12.已知3.0 g 乙烷在常温下完全燃烧放出的热量为155.98 kJ ,则下列表示乙烷标准燃烧热的热化学方程式书写正确的是( )A.2C 2H 6(g)+7O 2(g)===4CO 2(g)+6H 2O(l) ΔH =-2 119.6 kJ·mol -1B.C 2H 6(g)+52O 2(g)===2CO(g)+3H 2O(l) ΔH =-1 559.8 kJ·mol -1 C.C 2H 6(g)+72O 2(g)===2CO 2(g)+3H 2O(g) ΔH =-1 559.8 kJ·mol -1 D.C 2H 6(g)+72O 2(g)===2CO 2(g)+3H 2O(l) ΔH =-1 559.8 kJ·mol -1 13.已知2H 2(g)+O 2(g)===2H 2O(l) ΔH =-571.6 kJ·mol-1,则下列关于方程式2H 2O(l)===2H 2(g)+O 2(g)的ΔH 的说法中正确的是( )A.方程式中的化学计量数表示分子数B.该反应ΔH 大于零C.该反应ΔH =-571.6 kJ·mol -1D.该反应可表示36 g 水分解时的热效应14.热化学方程式C(s)+H 2O(g)==CO(g)+H 2(g) △H =+131.3 kJ·mol-1表示( ) A .碳和水反应吸收131.3kJ 能量B .1mol 碳和1mol 水反应生成一氧化碳和氢气并吸收131.3kJ 热量C .1mol 固态碳和1mol 水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJD .1个固态碳原子和1分子水蒸气反应吸热131.1kJ15.今有如下三个热化学方程式:H 2(g)+l/2O 2(g)=H 2O(g) △H=akJ/molH 2(g)+l/2O 2(g)=H 2O(l) △H=bkJ/mol2H 2(g)+O 2(g)=2H 2O(l) △H=ckJ/mol关于它们的下列表述正确的是( )A. 2b=cB. a 、b 和c 均为正值C. a=bD. 它们都是吸热反应16.燃烧热是1 mol 可燃物完全燃烧生成稳定氧化物放出的热量。
反应热专项练习1、热化学方程式C(s)+H2O(g)CO(g)+H2(g);△H =+131.3kJ/mol表示()A.碳和水反应吸收131.3kJ能量B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJD.1个固态碳原子和1分子水蒸气反应吸热131.1kJ2、已知甲烷燃烧生成二氧化碳和液态水放出的热量为55.625kJ·g-1。
下列热化学方程式中不正确的是()A.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H =-890kJ/molB.CH4(g)+O2(g)=CO2(g)+H2O(l);△H=-445kJ/molC.D.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-55.625kJ/mol3、在烃分子中去掉2个氢原子形成一个双键是吸热反应,大约需117kJ/mol~125KJ/mol的热量,但1,3—环己二烯失去2个氢原子变成苯是放热反应,△H=-23.4kJ/mol,以上事实表明()A.1,3—环己二烯加氢是吸热反应B.苯加氢生成环己烷是吸热反应C.1,3—环己二烯比苯稳定D.苯比1,3—环己二烯稳定4、X、Y二元素的原子,当它们分别获得两个电子形成稀有气体元素原子层结构时,X放出的热量大于Y放出的热量;Z、W两元素的原子,当它们分别失去一个电子形成稀有气体元素原子的电子层结构时,吸收能量W大于Z。
则X、Y和Z、W分别形成的化合物中,离子化合物可能性最大的是()A.Z2X B.Z2Y C.W2X D.W2Y5、在同温同压下,下列各组热化学方程式Q2>Q1的是()A.2H2(g)+O2(g)=2H2O(l);△H=-Q12H2(g)+O2(g)=2H2O(g);△H=-Q2B.S(g)+O2(g)=SO2(g);△H=-Q1S(s)+O2(g)=SO2(g);△H=-Q2C.C(s)+O2(g)=CO2(g);△H=-Q2D.H2(g)+Cl2(g)=2HCl(g);△H=-Q16、100gC不完全燃烧所得产物中,CO所占体积为1/3,CO2为2/3,且:与这些碳完全燃烧相比,损失的热量为()A.39.292kJ B.3274.3kJ C.784.92kJ D.2489.44kJ7、强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,向1L0.5mol·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓H2SO4;③稀硝酸,恰好完全反应的热效应△H1、△H2、△H3的关系正确的是()A.△H1>△H2>△H3B.△H1<△H3<△H2C.△H1=△H3>△H2D.△H1>△H3>△H28、对下列化学反应热现象,不正确的说法是()A.放热的反应发生时不必加热B.化学反应一定有能量变化C.化学反应一般地说,吸热反应需要加热后才能发生D.化学反应热效应数值与反应物质多少有关9、以NA 代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+O 2=2CO2(g)+H2O(l);△H=-1300kJ/mol的说法中,正确的是()A.有10NA个电子转移时,该反应放出1300kJ的能量B.有NA个水分子生成且为液体时,吸收1300kJ的能量C.有2NA个碳氧共用电子对生成时,放出1300kJ的能量D.有8NA个碳氧共用电子对生成时,放出1300kJ的能量10、完全燃烧一定质量的无水乙醇,放出的热量为Q,已知为了完全吸收生成的二氧化碳,消耗掉8mol·L-1的氢氧化钠溶液50mL,则无水乙醇的燃烧热放出的热量不可能是()A.10Q B.10Q~5Q C.大于10Q D.小于5Q11、下列说法正确的是()A.需要加热才能发生的反应一定是吸热反应B.任何放热反应在常温条件下一定能发生反应C.反应物和生成物所具有的总能量决定了放热还是吸热D.吸热反应在一定条件下(如常温、加热等)也能发生反应12、1840年盖斯根据一系列实验事实得出规律,他指出:“若是一个反应可以分步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同。
”这是在各反应于相同条件下完成时的有关反应热的重要规律,称为盖斯定律。
已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:C(金刚石、s)+O2(g)=CO2(g);△H=-395.41kJ/mol,C(石墨、s)+O2(g)=CO2(g);△H=-393.51kJ/mol,则金刚石转化石墨时的热化学方程式为:___________。
由此看来更稳定的碳的同素异形体为:____________。
若取金刚石和石墨混合晶体共1mol 在O2中完全燃烧,产生热量为QkJ,则金刚石和石墨的物质的量之比为_____________(用含Q的代数式表示)。
13、0.3mol气态高能燃料乙硼烷(分子式B2H6),在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量,则其热化学方程式为________________。
又已知H2O(l)=H2O(g);△H=44kJ·mol-1,则11.2L标准状况下的乙硼烷完全燃烧生成气态水时放出的热量是_________kJ。
14、如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。
试回答下列回答:(1)实验中观察到的现象是____________________。
(2)产生上述现象的原因是____________________。
(3)写出有关反应的离子方程式________________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”“等于”)镁片和盐酸的总能量。
15、称取等质量为(ag)胆矾两份。
把一份溶于bg水中,测知其溶解时吸收Q 1kJ热量;把另一份脱水后溶于bg水中,测得其溶解时放热Q2kJ。
(1)胆矾的溶解热为______kJ·mol—1,是______(填”吸热”或“放热”)(2)无水硫酸铜的溶解热为______kJ·mol—1,是______过程。
(3)从以上数据可知,胆矾脱水是______过程,1mol胆矾脱水需______kJ·mol—1热量。
16、目前大部分城市居民所使用的燃料主要是管道煤气,使用天然气作为居用燃料对环境更为有利。
管道煤气的主要成分是CO、H2和少量烃类,天然气的主要成分是CH4。
它们的燃烧反应如下:根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是_________。
因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是_________进风口(填增大或减小),如不作改进可能产生的不良结果是_________________。
管道煤气中含有的烃类,除甲烷外,还有少量乙烷、丁烷等,它们的某些性质见下表:试根据以上某个关键数据解释冬天严寒的季节有时管道煤气火焰很小,并且呈断续状态的原因是_____________________。
17、在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol液态H2O。
(1)放出571.6kJ的热量,H2的燃烧热为________,表示H2燃烧热的热化学方程式为____________。
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为___________,表示其中和热的热化学方程式为____________________。
答案与提示1、C依据反应热的概念,表示按照方程式系数的物质的量反应时吸收或放出的热量,单位是kJ·mol-1,该方程式表示:1mol碳和1mol水蒸气反应生成1mol一氧化碳气体和1mol氢气,并吸收131.3kJ的热量。
特别要指明水的状态。
2、D题目中给出的数据意义是:燃烧1g的甲烷放出55.625kJ的热量,应该换算成燃烧1mol甲烷放出的热量为890kJ。
热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890kJ·mol-1其他系数与热量相对应的方程式均正确。
3、D由题可知:,因为苯的能量比环己二烯能量低,故苯比环己二烯稳定,故C错;环己二烯加氢是放热过程,A错;苯加氢到环己烷由上图可知是放热过程,B错。
4、AX、Y获得两个电子就达到稳定结构,故它们属于VIA族,由于X得到电子放出的热量多,故X形成的离子更稳定,即X的非金属性比Y强;Z、W失去一个电子达到稳定结构,它们属于IA族,W失去电子吸收的能量多,则W比Z难失电子,故金属性Z大于W。
形成离子化合物最可能是金属性强的与非金属性强的元素化合,即Z2X。
5、C反应放出或吸收的热量的多少,跟反应物和生成物的聚集状态有密切关系。
A中两式仅生成物中水的状态不同,由于生成液态水比生成气态水放热多,所以Q1>Q2;B中两式仅硫的状态不同,由于固态硫变成气态硫要吸收热量,所以Q1>Q2;C中固态碳与氧气完全反应生成二氧化碳,放出的热量Q2应大于不完全燃烧时生成一氧化碳放出的热量Q1;D中二式各物质的量不同,有Q1=2Q2的关系,故本题的答案应为C。
6、C在100gC中有变为CO,有变为CO2,故与C完全燃烧相比,损失的热量就是CO继续燃烧放出的热量,依据热化学方程式,知损失的热量为。
7、D因为稀醋酸是弱电解质,在电离时吸热,浓H2SO4溶于水时放热。
故中和时放出的热量Q(H2SO4)>Q(HNO3)>Q(HAc),又因放热反应中,△H为负值,即△H=-Q,故△H2<△H3<△H1。
8、ACA错。
在放热反应中有一些需加热以提供必需的能量来引发反应,如煤的燃烧。
C错在有些吸热反应并不需要加热,如Ba(OH)2晶体与NH4Cl的反应,HAc的电离等吸热过程,均不需要加热。
9、ADA项中的10NA个电子转移即有1molC2H2燃烧,所以放出的热量为1300kJ,D项中有8NA个碳氧共用电子对,即有2mol CO2 生成,故放出1300kJ的热量。
10、CDNaOH与CO2反应可生成Na2CO3,也可以生成NaHCO3,若生成Na2CO3,则n(NaOH)=0.4mol。
所以此时1mol乙醇完全燃烧放出5Q热量,若反应产物为Na2CO3和NaHCO3的混合物,则1mol乙醇完全燃烧放出的热量为5Q~10Q之间。
11.CD此类题可举例证明。
A、煤的燃烧需要加热才能发生,但,煤燃烧放热。
B、也可用A的例子说明。
C、当反应物的总能量>生成物的总能量时,反应放热;反之吸热。