蛋白质纯化经验总结
- 格式:docx
- 大小:15.74 KB
- 文档页数:4

摘要: 请问有哪些可能会出现这种原因?怎么解决?测过基因序列,没有问题。
细胞破碎后,融合蛋白在沉淀里,我用助溶剂提取后,可以用GST做亲和层析,但效率只有50~60%左右。
洗脱完融合蛋白不需要助溶剂,但这样的条件下切割完后目的蛋白会沉淀,我用0.5%CHAPS助溶可勉强溶解部分,目的蛋白疏水性比较强。
1)我现在手头有个融合蛋白,纯化的时候用助溶剂溶解后做了GST亲和层析,之后用蛋白酶切割后却发现目的蛋白没有活性。
请问有哪些可能会出现这种原因?怎么解决?测过基因序列,没有问题。
细胞破碎后,融合蛋白在沉淀里,我用助溶剂提取后,可以用GST做亲和层析,但效率只有50~60%左右。
洗脱完融合蛋白不需要助溶剂,但这样的条件下切割完后目的蛋白会沉淀,我用0.5%CHAPS助溶可勉强溶解部分,目的蛋白疏水性比较强。
既然是疏水性很强你可以加点甘油或者乙二醇降低极性,这样溶解就会好得多,此外你也直接加2%的PEG这样也降低极性,同时保护你的蛋白,你再做纯化就可以了,我以前遇到这样的蛋白是用10%的乙醇加3-5%的PEG5000,这样的情况下蛋白还是活性回收率很高,我觉得那些表面活性剂能不用还是不用的好,你失去活性你可以监测一下提取,纯化,酶切到底哪里失去了活性,这样更容易解决你的问题。
还有注意缓冲液PH值,看看改变它对溶解度有没有影响。
蛋白有沉淀那你可以稍微把蛋白的浓度降低点,这也是个办法。
2)请问有没有合成过配体为FMN的亲和胶?现在一般要自己合成亲和填料,有很多公司都提供活化好的介质,自己偶联就可以,其中比较常用的有溴化氰琼脂糖凝胶,环氧琼脂糖凝胶,氨基琼脂糖凝胶,羧基琼脂糖凝胶,活化酯琼脂糖凝胶,以及巯基琼脂糖凝胶等,但是如果是小分子的配基最好选择有3-10碳作为手臂的活化介质为好,此外也曾经有文献报导固定辅酶时,偶联位置不同,选择性有差别,因此你可以选择自己适合的活化介质。
不同的活化的介质对偶联的配基有不同的要求,所以要对自己的配基了解比较清楚就可以选择合适的活化介质。

总结
一、要求:活性、纯度、规模、经济性(工艺)
二、菌种: 原核、真核、胞内、胞外、变性、复性
三、蛋白性质:等电点、分子量、稳定性(PH/safl)等
四、纯度检测方法:SDS、HPLC
五、活性检测方法:
六、纯化
1、粗纯:硫酸铵(天然)等20%-40%-60%-80%,(不易加过快硫酸铵)
2、Ni-NTA、Ni-IDA ①PH值越大,柱子结合率越弱②不能有螯合剂的缓冲液③His标签未暴露,4-8M脲,4-6M盐酸胍变性④沉淀没有洗脱下,减少上样量,添加去污剂+氯化钠+尿素⑤杂蛋白去不掉,超声过程中添加2%Triton/2%Tween-20,加甘油⑥解离过程沉淀,降低上样量,添加精氨酸/表面活性剂(Triton,2%Tween-20)/尿素/甘油。

蛋白纯化年度工作总结汇报蛋白纯化是一项关键的科学研究工作,常用于生物医药领域的蛋白质结构与功能研究、新药研发和疾病诊断治疗等领域。
在过去的一年里,本实验室团队针对蛋白纯化的各个环节,进行了深入的研究和实践。
本文将对我们的年度蛋白纯化工作进行综述和总结。
1. 研究目标和背景首先,让我们回顾一下我们的研究目标和背景。
我们团队的主要目标是通过蛋白纯化技术,获得高纯度的蛋白样本,以进行相关的研究。
我们的研究重点是一种与肿瘤发生和发展密切相关的蛋白质,该蛋白质在肿瘤细胞中扮演着重要角色。
2. 选择合适的纯化方法在蛋白纯化的过程中,选择合适的纯化方法是至关重要的。
我们首先进行了蛋白质的整体性质分析,包括分子量、等电点和亲水性等特性。
根据这些特性,我们选择了亲和层析和离子交换层析作为蛋白纯化的关键方法。
我们使用了Ni-NTA亲和树脂用于结合靶蛋白,而离子交换树脂则用于分离目标蛋白与其他杂质的混合物。
3. 优化纯化条件为了提高蛋白纯化的纯度和产率,我们进行了大量的优化实验。
我们改变了各种条件,如洗脱缓冲液的PH值、盐浓度和洗脱浓度,以找到最适宜的条件。
此外,我们还测试了不同洗涤剂的效果,包括甲基-β-硫代半乳糖苷(β-甲基硫代葡萄糖苷酸)和十二烷基葡萄糖苷(十二烷基葡萄糖苷),以及多肽酶抑制剂的添加。
4. 结果和讨论经过多次实验和优化,我们成功地获得了高纯度的目标蛋白样本。
通过SDS-PAGE检测和Western Blot验证,我们确定了目标蛋白的存在,并排除了其他杂质的干扰。
此外,我们还使用质谱法对纯化蛋白进行了验证,并与已知质谱数据进行了比对。
5. 蛋白样本的应用最后,我们对获得的高纯度蛋白样本进行了一系列的功能性研究。
我们在细胞实验中检测了蛋白的生物活性,并评估了其对细胞功能的影响。
此外,我们还进行了一系列的结构研究,利用X射线晶体学和核磁共振技术,探索了蛋白的三维结构和相互作用。
综上所述,我们的年度蛋白纯化工作取得了可喜的成果。
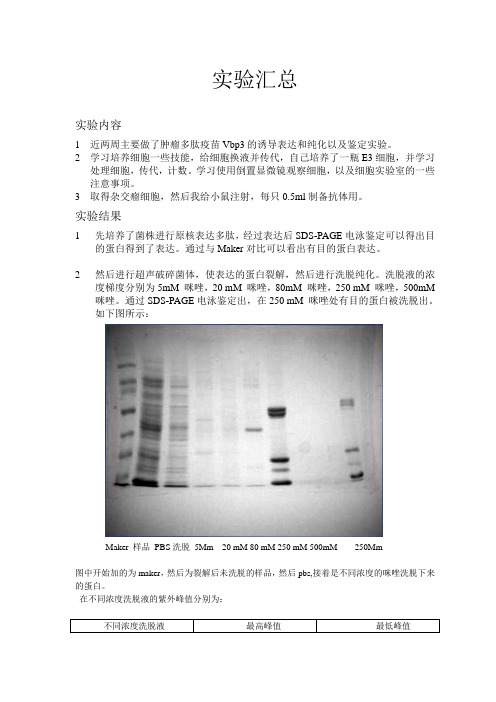
实验汇总实验内容1近两周主要做了肿瘤多肽疫苗Vbp3的诱导表达和纯化以及鉴定实验。
2学习培养细胞一些技能,给细胞换液并传代,自己培养了一瓶E3细胞,并学习处理细胞,传代,计数。
学习使用倒置显微镜观察细胞,以及细胞实验室的一些注意事项。
3 取得杂交瘤细胞,然后我给小鼠注射,每只0.5ml制备抗体用。
实验结果1先培养了菌株进行原核表达多肽,经过表达后SDS-PAGE电泳鉴定可以得出目的蛋白得到了表达。
通过与Maker对比可以看出有目的蛋白表达。
2然后进行超声破碎菌体,使表达的蛋白裂解,然后进行洗脱纯化。
洗脱液的浓度梯度分别为5mM 咪唑,20 mM 咪唑,80mM 咪唑,250 mM 咪唑,500mM 咪唑。
通过SDS-PAGE电泳鉴定出,在250 mM 咪唑处有目的蛋白被洗脱出。
如下图所示:Maker 样品PBS洗脱5Mm 20 mM 80 mM 250 mM 500mM 250Mm图中开始加的为maker,然后为裂解后未洗脱的样品,然后pbs,接着是不同浓度的咪唑洗脱下来的蛋白。
在不同浓度洗脱液的紫外峰值分别为:3以bFGF 为抗原包板做ELISA实验,以鼠单抗和人源化抗体为一抗,以羊抗鼠酶标抗体为二抗,进行检测鼠单抗的效价。
结果如下表所示:Measurement count: 1 Filter:4501 2 3 420000 0.121 0.121 2.563 2.733 0.121 2.648 0 0.120208 40000 0.105 0.116 2.52 2.533 0.1105 2.5265 0.007778 0.009192 80000 0.11 0.131 2.15 1.93 0.1205 2.04 0.014849 0.155563 160000 0.084 0.084 1.361 1.654 0.084 1.5075 0 0.207182 320000 0.109 0.131 0.824 1.082 0.12 0.953 0.015556 0.182434 640000 0.112 0.113 0.578 0.632 0.1125 0.605 0.000707 0.038184 1280000 0.115 0.126 0.429 0.423 0.1205 0.426 0.007778 0.004243 2560000 0.111 0.12 0.112 0.082 0.1155 0.097 0.006364 0.021213ELISA 结果结果分析图标准误差图图中1,2中一抗为人源化抗体,3,4中一抗为鼠单抗。

分离纯化某一特定蛋白质的一般程序可以分为前处理、粗分级、细分级三步。
1.前处理:分离纯化某种蛋白质,首先要把蛋白质从原来的组织或细胞中以溶解的状态释放出来并保持原来的天然状态(如果做不到呢?比如蛋白以包涵体形式存在),不丢失生物活性。
为此,动物材料应先提出结缔组织和脂肪组织,种子材料应先去壳甚至去种皮以免手单宁等物质的污染,油料种子最好先用低沸点(为什么呢)的有机溶剂如乙醚等脱脂。
然后根据不同的情况,选择适当的方法,将组织和细胞破碎。
动物组织和细胞可用电动捣碎机或匀浆机破碎或用超声波处理破碎。
植物组织和细胞由于具有纤维素、半纤维素和果胶等物质组成的细胞壁,一般需要用石英砂或玻璃粉和适当的提取液一起研磨的方法或用纤维素酶处理也能达到目的。
细菌细胞的破碎比较麻烦,因为整个细菌细胞壁的骨架实际上是一个借共价键连接而成的肽聚糖囊状大分子,非常坚韧。
破碎细菌细胞壁的常用方法有超声波破碎,与砂研磨、高压挤压或溶菌酶处理等。
组织和细胞破碎后,选择适当的缓冲液把所要的蛋白提取出来。
细胞碎片等不溶物用离心或过滤的方法除去。
如果所要的蛋白主要集中在某一细胞组分,如细胞核、染色体、核糖体或可溶性细胞质等,则可利用差速离心的方法将它们分开,收集该细胞组分作为下步纯化的材料。
如果碰上所要蛋白是与细胞膜或膜质细胞器结合的,则必须利用超声波或去污剂使膜结构解聚,然后用适当介质提取。
2. 粗分级分离:当蛋白质提取液(有时还杂有核酸、多糖之类)获得后,选用一套适当的方法,将所要的蛋白与其他杂蛋白分离开来。
一般这一步的分离用盐析、等电点沉淀和有机溶剂分级分离等方法。
这些方法的特点是简便、处理量大,既能除去大量杂质,又能浓缩蛋白溶液。
有些蛋白提取液体积较大,又不适于用沉淀或盐析法浓缩,则可采用超过滤、凝胶过滤、冷冻真空干燥或其他方法进行浓缩。
3.细分级分离:样品经粗分级分离以后,一般体积较小,杂蛋白大部分已被除去。
进一步纯化,一般使用层析法包括凝胶过滤、离子交换层析、吸附层析以及亲和层析等。

蛋白质的纯化的方法及原理蛋白质的纯化是从其来源中去除其他有机物和无机物,使其成为纯净的蛋白质样品的过程。
蛋白质纯化的方法可以根据需要选择,其中常用的方法包括盐析、凝胶过滤、电泳、金属柱层析、亲和层析、离子交换层析、逆相高效液相色谱等。
下面将详细介绍这些方法及其原理。
一、盐析盐析是利用不同浓度的盐溶液对蛋白质溶液进行逐渐稀释,从而使蛋白质发生沉淀的过程。
纯化蛋白质的关键是利用蛋白质与溶剂中离子之间的相互作用来控制蛋白质的溶解和沉淀过程。
在盐析中,通过选择离子强度和种类可以调整蛋白质溶液中所需溶剂化离子的浓度,达到沉淀和纯化蛋白质的目的。
二、凝胶过滤凝胶过滤是一种分子筛分离方法,利用不同孔径的凝胶进行分离。
凝胶的孔径能够排除较大分子,如核酸和细胞碎片,而较小分子,如蛋白质则能通过孔隙,实现纯化。
该方法简单易行,不需要任何特殊设备,适用于中小分子量的蛋白质纯化。
三、电泳电泳是利用蛋白质在电场中的移动性差异进行分离和纯化的方法。
常用的电泳方法有平板电泳、SDS-PAGE(聚丙烯酰胺凝胶电泳)和Western blotting (免疫印迹法)等。
电泳能够根据蛋白质的电荷、分子大小和不同的电场力,在凝胶中分离蛋白质,使其形成带状。
通过切割所需蛋白质的带状区域,可以实现对目标蛋白质的纯化。
四、金属柱层析金属柱层析是利用金属离子与蛋白质之间的亲和性进行分离的方法。
金属柱通常被配制成金属离子亲和基质,并固定在柱子上。
目标蛋白质通过与金属离子发生亲和作用而被保留在柱中,其他杂质则从柱中流出。
通过调节洗脱缓冲液的离子浓度和pH值,可实现对目标蛋白质的纯化。
五、亲和层析亲和层析是利用配体与其特异性结合的蛋白质进行分离和纯化的方法。
通常将配体固定在柱子上,待蛋白质样品通过柱子时,目标蛋白质与配体结合,其他杂质则流失。
通过改变洗脱缓冲液的条件,如离子浓度、pH值和络合剂的添加,可以实现目标蛋白质的纯化。
六、离子交换层析离子交换层析是一种利用蛋白质与离子交换基质之间的相互作用进行分离和纯化的方法。

蛋白质纯化策略并举例蛋白质纯化是研究蛋白质特性和功能的重要步骤之一、纯化蛋白质的目的是将目标蛋白从混合物中分离出来,并去除其他干扰物质,以便进一步研究和利用。
蛋白质纯化的策略可以根据蛋白质的性质和混合物的组成选择不同的方法。
下面将介绍几种常用的蛋白质纯化策略。
1.借助溶液性进行纯化一种常见的方法是根据蛋白质在不同溶液条件下的溶解性来纯化蛋白质。
例如,如果目标蛋白质在酸性条件下溶解,在中性或碱性条件下不溶解,可以通过调整溶液的pH值来实现纯化。
另一个例子是,一些蛋白质在高盐浓度条件下溶解,在低盐浓度条件下沉淀,可以通过逐渐降低盐浓度来实现纯化。
2.借助分子大小进行纯化一些蛋白质具有与其他成分相比较明显的不同分子大小。
利用这种特性,可以选择适当的分离方式进行纯化。
一种常用的方法是通过凝胶过滤层析(gel filtration chromatography)纯化蛋白质。
该方法利用分子大小的差异,使大分子物质通过凝胶较快,小分子物质则需要在凝胶中较长时间停留,从而实现纯化目标蛋白质。
3.借助电荷进行纯化一些蛋白质具有特定的电荷性质,可以根据其在不同条件下的电荷状态选择适当的分离方式。
例如,离子交换层析(ion exchange chromatography)可以通过调整缓冲液的 pH 值,利用蛋白质与离子交换树脂之间的相互作用,实现目标蛋白质的纯化。
还有一种常见的技术是等电聚焦(isoelectric focusing),该方法是利用蛋白质在不同 pH 值下的等电点移动来实现纯化。
4.借助亲和性进行纯化5.借助活性进行纯化一些蛋白质具有特定的酶活性、配体结合性等活性,可以通过专一酶活性或配体结合性来进行纯化。
例如,利用蛋白质的酶活性,可以通过亲和层析和酶反应来实现目标蛋白质的纯化。
还可以根据蛋白质与配体结合的特异性,利用亲和层析等方法实现纯化。
以上是常见的几种蛋白质纯化策略及其举例。
需要注意的是,每种策略都有其适用范围和局限性,因此在纯化蛋白质时需要根据具体情况选择合适的策略,并结合多种方法进行组合使用,以达到最佳的纯化效果。

蛋白质提取与纯化技术总结蛋白质提取与纯化技术1.蛋白质(包括酶)的提取大部分蛋白质都可溶于水、稀盐、稀酸或碱溶液,少数与脂类结合的蛋白质则溶于乙醇、丙酮、丁等有机溶剂中,因些,可采用不同溶剂提取分离和纯化蛋白质及酶。
水溶液提取法:稀盐和缓冲系统的水溶液对蛋白质稳定性好、溶解度大、是提取蛋白质最常用的溶剂,通常用量是原材料体积的1-5倍,提取时需要均匀的搅拌,以利于蛋白质的溶解。
提取的温度要视有效成份性质而定。
一方面,多数蛋白质的溶解度随着温度的升高而增大,因此,温度高利于溶解,缩短提取时间。
但另一方面,温度升高会使蛋白质变性失活,因此,基于这一点考虑提取蛋白质和酶时一般采用低温(5度以下)操作。
为了避免蛋白质提以过程中的降解,可加入蛋白水解酶抑制剂(如二异丙基氟磷酸,碘乙酸等)。
下面着重讨论提取液的pH值和盐浓度的选择。
1、pH值蛋白质,酶是具有等电点的两性电解质,提取液的pH值应选择在偏离等电点两侧的pH范围内。
用稀酸或稀碱提取时,应防止过酸或过碱而引起蛋白质可解离基团发生变化,从而导致蛋白质构象的不可逆变化,一般来说,碱性蛋白质用偏酸性的提取液提取,而酸性蛋白质用偏碱性的提取液。
2、盐浓度稀浓度可促进蛋白质的溶解,称为盐溶作用。
同时稀盐溶液因盐离子与蛋白质部分结合,具有保护蛋白质不易变性的优点,因此在提取液中加入少量NaCl等中性盐,一般以0.15摩尔。
升浓度为宜。
缓冲液常采用0.02-0.05M磷酸盐和碳酸盐等渗盐溶液。
有机溶剂提取法:一些和脂质结合比较牢固或分子中非极性侧链较多的蛋白质和酶,不溶于水、稀盐溶液、稀酸或稀碱中,可用乙醇、丙酮和丁等有机溶剂,它们具的一定的亲水性,还有较强的亲脂性、是理想的提脂蛋白的提取液。
但必须在低温下操作。
丁提取法对提取一些与脂质结合紧密的蛋白质和酶特别优越,一是因为丁亲脂性强,特别是溶解磷脂的能力强;二是丁兼具亲水性,在溶解度范围内(度为10%,40度为6.6%)不会引起酶的变性失活。

蛋白质纯化方式总结分离纯化某一特定蛋白质的一样程序能够分为前处置、粗分级、细分级三步。
1.前处置:分离纯化某种蛋白质,第一要把蛋白质从原先的组织或细胞中以溶解的状态释放出来并维持原先的天然状态(若是做不到呢?比如蛋白以包涵体形式存在),不丢失生物活性。
为此,动物材料应先提出结缔组织和脂肪组织,种子材料应先去壳乃至去种皮以避免手单宁等物质的污染,油料种子最好先用低沸点(什么缘故呢)的有机溶剂如乙醚等脱脂。
然后依照不同的情形,选择适当的方式,将组织和细胞破碎。
动物组织和细胞可用电动捣碎机或匀浆机破碎或用超声波处置破碎。
植物组织和细胞由于具有纤维素、半纤维素和果胶等物质组成的细胞壁,一样需要用石英砂或玻璃粉和适当的提取液一路研磨的方式或用纤维素酶处置也能达到目的。
细菌细胞的破碎比较麻烦,因为整个细菌细胞壁的骨架事实上是一个借共价键连接而成的肽聚糖囊状大分子,超级坚韧。
破碎细菌细胞壁的经常使用方式有超声波破碎,与砂研磨、高压挤压或溶菌酶处置等。
组织和细胞破碎后,选择适当的缓冲液把所要的蛋白提掏出来。
细胞碎片等不溶物用离心或过滤的方式除去。
若是所要的蛋白要紧集中在某一细胞组分,如细胞核、染色体、核糖体或可溶性细胞质等,那么可利用差速离心的方式将它们分开,搜集该细胞组分作为下步纯化的材料。
若是碰上所要蛋白是与细胞膜或膜质细胞器结合的,那么必需利用超声波或去污剂使膜结构解聚,然后用适当介质提取。
2. 粗分级分离:当蛋白质提取液(有时还杂有核酸、多糖之类)取得后,选用一套适当的方式,将所要的蛋白与其他杂蛋白分离开来。
一样这一步的分离用盐析、等电点沉淀和有机溶剂分级分离等方式。
这些方式的特点是简便、处置量大,既能除去大量杂质,又能浓缩蛋白溶液。
有些蛋白提取液体积较大,又不适于用沉淀或盐析法浓缩,那么可采纳超过滤、凝胶过滤、冷冻真空干燥或其他方式进行浓缩。
3.细分级分离:样品经粗分级分离以后,一样体积较小,杂蛋白大部份已被除去。

蛋白质纯化个人总结
蛋白质纯化是一项重要的实验技术,用于从复杂的混合物中分离出目标蛋白质,并去除杂质。
蛋白质纯化的主要目标是获得高纯度的目标蛋白质,以便进行后续的功能研究或应用。
在蛋白质纯化的过程中,我发现以下几点是关键的:
1. 选择合适的纯化策略:根据目标蛋白质的性质和目的,选择合适的纯化方法。
常用的方法包括亲和层析、离子交换层析、凝胶过滤层析等。
不同的方法适用于不同的目标蛋白质,要根据实际情况进行选择。
2. 优化纯化条件:在进行纯化实验时,需要不断优化纯化条件,以获得最佳的纯化效果。
优化条件可以包括缓冲液的pH值、离子强度、温度等,以及层析柱的选择和操作参数的控制。
3. 技术细节的注意:在进行实验时,要注意一些技术细节。
例如,在样品的制备过程中,要尽量避免蛋白质的降解和失活。
在进行层析过程中,要注意流速的控制,避免目标蛋白质与杂质混合。
4. 纯化过程的监控:在纯化过程中要进行定期的监控,以确保纯化的效果。
常用的监控方法包括SDS-PAGE分析、Western blot等。
这些方法可以帮助判断纯化效果,并及时调整实验条件。
综上所述,蛋白质纯化是一个技术要求较高的实验过程。
通过选择合适的纯化策略,优化纯化条件,注意技术细节和监控纯化过程,可以获得高纯度的目标蛋白质,并为后续的研究或应用提供可靠的实验基础。

蛋白质纯化实验技术报告蛋白质是生物体内最基本的组成成分之一,它在维持生命的各个方面都起着重要的作用,因此,研究蛋白质的纯化技术具有重要的科学意义和应用价值。
本文将从蛋白质的纯化目的、方法选择、实验步骤和结果分析等方面进行详细介绍。
一、纯化目的二、方法选择蛋白质的纯化方法多种多样,常用的包括盐析、凝胶过滤、离子交换、亲和层析、逆流层析等。
在选择方法时,需要根据蛋白质的特性、溶液条件和设备条件等因素进行综合考虑。
三、实验步骤1.细胞破碎和初步纯化:将含有目标蛋白质的细胞悬液经离心分离细胞碎片,得到上清液,进行初步纯化。
2.过滤和沉淀:使用滤膜或沉淀物去除杂质,得到蛋白质溶液。
3.层析纯化:根据蛋白质的性质选择适当的层析柱,如离子交换柱、亲和柱等,进行层析纯化。
4.打破和再层析:对于较复杂的蛋白质混合物,可以使用还原剂或表面活性剂等打破蛋白质复合物,然后再次进行层析纯化,以提高纯化效果。
5.纯化评价:使用聚丙烯酰胺凝胶电泳或质谱等方法对纯化后的蛋白质样品进行评价,确认其纯度和活性。
四、结果分析根据实验结果,可以评估所选纯化方法的有效性和适用性,判断所得纯化样品的纯度和活性。
同时,还需对纯化条件进行优化,以进一步提高纯化效果。
五、结论本实验采用了其中一种纯化方法成功地获得了目标蛋白质的高纯度和高活性样品,并对其进行了初步的理化性质分析。
结果表明,所选的纯化方法具有较高的有效性和适用性,可以应用于进一步的研究和应用。
综上所述,蛋白质纯化实验是一项复杂而重要的工作,需要根据蛋白质的特性和实验条件等因素进行综合考虑,以选择合适的纯化方法。
通过详细的实验步骤和结果分析,可以得出纯化效果的评价和结论,并为进一步的研究提供有价值的参考。

蛋白质的分离纯化实验报告一、实验目的1、掌握蛋白质分离纯化的基本原理和方法。
2、学会运用不同的技术手段对蛋白质进行提取、分离和纯化。
3、熟悉蛋白质纯度鉴定的常用方法。
二、实验原理蛋白质是生物体中重要的大分子化合物,其分离纯化是研究蛋白质结构和功能的重要前提。
蛋白质的分离纯化主要依据其物理化学性质的差异,如分子大小、电荷、溶解度、亲和力等。
常见的分离纯化方法包括:1、盐析法:通过向蛋白质溶液中加入中性盐,如硫酸铵,使蛋白质溶解度降低而沉淀析出。
2、凝胶过滤层析:利用凝胶颗粒的多孔网状结构,根据蛋白质分子大小进行分离。
3、离子交换层析:基于蛋白质所带电荷的不同,在离子交换树脂上进行吸附和解吸。
4、亲和层析:利用蛋白质与特定配体之间的特异性亲和力进行分离。
三、实验材料与设备1、材料新鲜的动物组织(如肝脏)各种试剂,包括硫酸铵、磷酸盐缓冲液、离子交换树脂、亲和配体等。
2、设备离心机层析柱紫外分光光度计电泳仪四、实验步骤1、蛋白质的提取将新鲜的动物组织剪碎,加入适量的磷酸盐缓冲液,在冰浴中匀浆。
低温离心(4℃,10000 rpm,20 min),收集上清液,即为粗提的蛋白质溶液。
2、盐析沉淀在上清液中缓慢加入硫酸铵粉末,边加边搅拌,使其饱和度逐渐增加到 50%。
搅拌 30 min 后,低温离心(4℃,10000 rpm,20 min),收集沉淀。
3、凝胶过滤层析装柱:将凝胶颗粒填充到层析柱中,用缓冲液平衡柱子。
上样:将盐析沉淀溶解后,缓慢上样到层析柱中。
洗脱:用缓冲液进行洗脱,收集不同洗脱峰的流出液。
4、离子交换层析装柱:将离子交换树脂填充到层析柱中,用起始缓冲液平衡柱子。
上样:将凝胶过滤层析收集的样品上样到离子交换层析柱中。
洗脱:采用梯度洗脱的方法,逐渐改变缓冲液的离子强度,收集洗脱峰。
5、亲和层析装柱:将亲和配体偶联到层析介质上,填充到层析柱中,用平衡缓冲液平衡柱子。
上样:将离子交换层析收集的样品上样到亲和层析柱中。

蛋白质纯化一.不同纯化技术的原理和标准条件1、亲和层析(AC)AC对蛋白质进行分离时基于一个蛋白(或者蛋白的一个基团)与层析介质相连的特异性配体之间的可逆性的相互作用而进行的。
这种技术适用于捕获或者中间体步骤,并且只要目的蛋白的合适配体是可得的,就可以随时使用这种方法。
AC具有高选择性,因此具有高分辨率,并且通常情况下具有高结合能力(对于目的蛋白)。
亲和层析通常是作为两步纯化流程中的第一步(捕获步骤)而使用,接下来的第二个层析步骤(抛光步骤)就是要除去剩余的杂质。
靶蛋白特异性地、可逆地与一种互补结合物质(配体)相连。
在有利于靶蛋白和配体之间特异性结合的条件下上样。
不能结合的物质被漂洗下来,而结合上去的靶蛋白通过改变条件以破坏靶蛋白与配体相互结合被回收下来。
这种破坏作用是使用一种竞争性配体而特异性地进行的,或者是通过改变pH、离子强度或者极性而非特异性地进行的。
样品在与柱材结合时被浓缩,并且以一种纯化的、浓缩的形式被收集起来2、离子交换层析(IEX)IEX能够高分辨率地分离表面电荷不同的蛋白质,该方法具有较高的样品结合能力。
这种分离方法是基于一个带电荷蛋白与带有相反电荷层析介质之间的可逆性相互作用而进行的。
上样时,蛋白结合到柱子上。
然后改变条件使得结合上去的物质能够差异性洗脱下来。
通常通过改变盐浓度或者改变pH来进行洗脱。
改变是阶段性或者连续性梯度进行的。
最为常用的方式是使用盐(NaCl)浓度梯度洗脱(图A1.2)。
靶蛋白在在与柱材结合时被浓缩,并且以一种纯化的、浓缩的形式被收集起来。
蛋白质的净表面电荷随周围pH变化而改变。
通常情况下,一个蛋白会在大于其等电点(pI)的条件下与阴离子交换树脂结合,而在低于其pI 时与阳离子交换树脂结合。
但是,应该注意的是,结合依赖于电荷,因此即便是与上述情况相反,表面电荷可能也足以用来结合。
通常,IEX用于结合靶分子,但是如果有需要,也用于结合杂质。
如图A1.3所示,在不同的pH条件下可以重复进行IEX以除去许多带有不同电荷性质的蛋白质。

一、实习背景随着生物技术的快速发展,蛋白纯化技术在生物制药、食品安全、疾病诊断等领域具有广泛的应用。
为了提高自身的实践能力,我们选择了蛋白纯化实习,深入了解蛋白纯化的原理、方法和设备,并实际操作进行蛋白纯化实验。
二、实习内容1. 蛋白纯化原理蛋白纯化是利用蛋白质在不同溶液中的溶解度、电荷、分子大小、亲和力等性质差异,通过层析、离心、电泳等手段将蛋白质从复杂混合物中分离出来的过程。
2. 蛋白纯化方法(1)层析法:根据蛋白质在固定相和流动相之间的分配系数不同,实现蛋白质的分离。
常用的层析方法有凝胶过滤、离子交换、亲和层析等。
(2)离心法:根据蛋白质的密度差异,通过离心力将蛋白质从混合物中分离出来。
(3)电泳法:根据蛋白质在电场中的迁移速度差异,实现蛋白质的分离。
3. 蛋白纯化设备(1)层析柱:用于进行层析实验,包括凝胶过滤、离子交换、亲和层析等。
(2)离心机:用于进行离心实验,分离蛋白质。
(3)电泳仪:用于进行电泳实验,分离蛋白质。
三、实习过程1. 准备实验材料:包括蛋白质样品、缓冲液、层析柱、离心机、电泳仪等。
2. 实验操作:(1)凝胶过滤:将蛋白质样品加入层析柱,用缓冲液进行洗脱,收集蛋白质洗脱峰。
(2)离子交换:将蛋白质样品加入层析柱,用不同pH值的缓冲液进行洗脱,收集蛋白质洗脱峰。
(3)亲和层析:将蛋白质样品加入亲和层析柱,用洗脱液进行洗脱,收集蛋白质洗脱峰。
(4)离心:将蛋白质样品加入离心管,进行离心分离。
(5)电泳:将蛋白质样品加入电泳槽,进行电泳分离。
3. 数据分析:通过紫外检测、比色法等方法,对纯化后的蛋白质进行定量分析。
四、实习总结通过本次蛋白纯化实习,我们掌握了蛋白纯化的原理、方法和设备,并实际操作进行了蛋白纯化实验。
在实习过程中,我们学会了如何选择合适的纯化方法、优化实验条件,以及如何进行数据分析和结果判断。
此次实习提高了我们的实验技能,为今后从事相关领域的研究奠定了基础。
五、实习体会1. 实践是检验真理的唯一标准。

蛋白纯化简历项目经验
在我的职业生涯中,我积累了丰富的蛋白纯化项目经验。
以下是我参与的几个蛋白纯化项目的经验总结:
项目一:蛋白表达与纯化
在这个项目中,我负责从表达宿主中获取目标蛋白。
我精心选择了适合表达需要的表达宿主,并优化了表达条件。
通过结合蛋白的生理特性和表达宿主的特点,我成功地实现了目标蛋白的高效表达。
接着,我进行了蛋白的纯化工作。
我运用了几种不同的色谱柱和纯化方法,如亲和层析、离子交换层析和凝胶过滤层析,来纯化目标蛋白。
最终,我得到了高纯度的目标蛋白,并通过质谱分析确保了蛋白的质量。
项目二:蛋白亲和纯化
另一个项目中,我使用了亲和层析技术来纯化目标蛋白。
我设计了适合目标蛋白的亲和柱,选择了适当的亲和配体,并优化了洗脱条件。
在亲和纯化过程中,我遇到了蛋白结合不牢固、干扰物过多等问题。
我运用调整洗脱条件和改变结合条件的方法,最终成功获得了高纯度的目标蛋白。
项目三:蛋白复性与活性恢复
最后一个项目是为了实现蛋白的活性恢复。
在这个项目中,我对蛋白进行了复性处理,并检测了蛋白的活性。
我尝试了多种复性条件,如逐步降低尿素浓度和改变缓冲液等方法。
通过对蛋白复性前后活性的比较,我找到了最适合的复性条件,使目标蛋白的活性得以有效恢复。
这个项目也加深了我对蛋白结构与功能之间关系的理解。
结语
通过以上几个蛋白纯化项目的经验,我积累了丰富的实践经验,不断提升了自己的技能水平。
在未来的工作中,我将继续努力学习,不断改进自己的技术,为科研工作做出更大的贡献。

初级职称申报蛋白纯化工作做总结1. 背景介绍在科研领域中,蛋白纯化是一项至关重要的实验工作。
蛋白纯化是将混合的蛋白质溶液中的目标蛋白分离出来,并获取高纯度的目标蛋白的过程。
这项工作对于研究蛋白质的结构和功能具有重要意义,也是生物制药工业中重要的一环。
在我申报初级职称时,我对蛋白纯化工作进行了总结和回顾,现在希望与大家共享我的经验和心得。
2. 实验设计在进行蛋白纯化工作时,首先需要设计合理的实验方案。
这包括确定采用何种纯化方法,如亲和层析、离子交换层析、凝胶过滤层析等,以及选择合适的纯化缓冲液和柱子。
在我的实验中,我根据不同蛋白的特性,选择了亲和层析和凝胶过滤层析两种方法进行纯化,同时优化了纯化缓冲液和柱子类型,以确保获得高纯度的目标蛋白。
3. 实验步骤在实验进行过程中,我严格按照实验设计的步骤进行操作。
首先是细胞裂解和初步纯化,然后进行层析纯化和浓缩,最后进行纯化效果的鉴定和分析。
在每一个步骤中,我都积极调整实验条件,如pH值、盐浓度、流速等,以优化纯化效果。
4. 结果分析在实验结束后,我对纯化后的蛋白质进行了分析。
通过SDS-PAGE凝胶电泳和Western blot等技术,我确认了目标蛋白的纯度和活性。
我也进行了蛋白质质谱分析,鉴定了目标蛋白的氨基酸序列和结构特征。
这些结果为我后续的研究工作提供了重要的基础数据。
5. 个人观点蛋白纯化工作是一项细致耐心的工作,需要对实验细节把握准确,同时也需要不断调整并优化实验条件。
这项工作对于我的职业发展具有重要意义,不仅提高了我的实验技能,也丰富了我的科研经验。
在今后的工作中,我将继续深入研究和优化蛋白纯化工作,为科研和生物制药领域的发展贡献自己的力量。
总结:通过对蛋白纯化工作的总结和回顾,我进一步深化了对这一实验技术的理解,并获得了丰富的实验经验。
在今后的工作中,我将继续注重实验细节和数据分析,不断提升自己的实验技能,为科研工作贡献更多的力量。
初级职称申报蛋白纯化工作的总结,将成为我职业发展道路上的宝贵财富。

疫苗后期蛋白纯化工作总结
随着疫苗研发的不断深入,疫苗后期蛋白纯化工作成为了疫苗生产过程中的关
键环节。
在疫苗生产中,蛋白纯化工作的质量和效率直接影响着疫苗的安全性和有效性。
因此,对疫苗后期蛋白纯化工作进行总结和优化显得尤为重要。
首先,疫苗后期蛋白纯化工作需要严格遵循GMP规范,确保生产过程的安全
和卫生。
在蛋白纯化工作中,需要对生物反应器中的发酵产物进行提取和纯化,同时要保证对病毒和细菌等有害物质的有效清除,以确保疫苗的纯度和安全性。
其次,疫苗后期蛋白纯化工作需要充分利用先进的分离和纯化技术,提高纯化
效率和产品质量。
目前,常用的蛋白纯化技术包括离心、超滤、层析等,这些技术能够有效地分离和提纯目标蛋白,同时保留其天然的构象和生物活性。
通过不断优化这些技术,可以提高疫苗后期蛋白纯化工作的效率和产量。
此外,疫苗后期蛋白纯化工作还需要对纯化工艺进行合理设计和优化,以降低
生产成本和提高经济效益。
在工艺设计中,需要综合考虑各种因素,包括原料成本、设备投资、能源消耗等,以确保生产过程的经济可行性。
同时,还需要对纯化工艺进行不断改进,以提高产量和降低废品率。
总的来说,疫苗后期蛋白纯化工作是疫苗生产过程中至关重要的一环,其质量
和效率直接关系到疫苗的安全性和有效性。
通过严格遵循GMP规范、充分利用先
进的分离和纯化技术、合理设计和优化纯化工艺,可以不断提高疫苗后期蛋白纯化工作的质量和效率,为疫苗生产提供有力保障。

疫苗后期蛋白纯化工作总结
随着疫苗研发技术的不断进步,疫苗后期蛋白纯化工作也变得愈发重要。
蛋白
纯化是疫苗生产过程中的关键环节,它直接影响着疫苗的质量和效果。
在疫苗研发过程中,科研人员们需要通过一系列的工作来纯化蛋白,以确保最终生产出的疫苗能够安全有效地应用于人群。
首先,疫苗后期蛋白纯化工作需要科研人员对疫苗中的蛋白进行分离和提纯。
这一过程需要利用生物化学技术和分离技术,如离心、柱层析、电泳等,将目标蛋白从其他杂质中分离出来。
在这一步骤中,科研人员需要精确控制各种条件,如温度、pH值、离心速度等,以确保蛋白的完整性和纯度。
其次,疫苗后期蛋白纯化工作还需要科研人员对蛋白进行结构和功能的分析。
他们需要利用各种生物化学和生物物理技术,如质谱分析、核磁共振、荧光光谱等,对蛋白的结构和功能进行深入研究。
这一步骤对于确保疫苗的安全性和有效性至关重要。
最后,疫苗后期蛋白纯化工作还需要科研人员对蛋白进行稳定性和保存条件的
研究。
他们需要确定最佳的保存条件,如温度、pH值、添加剂等,以确保蛋白的
稳定性和长期保存能力。
这一步骤对于疫苗的生产和储存至关重要。
总的来说,疫苗后期蛋白纯化工作是疫苗研发过程中不可或缺的一环。
科研人
员们通过精细的实验操作和深入的研究,确保疫苗中的蛋白能够达到最佳的纯度、结构和功能,从而保证疫苗的质量和效果。
随着疫苗技术的不断进步,我们相信疫苗后期蛋白纯化工作将会更加精细和高效,为人类健康做出更大的贡献。

蛋白质分离与纯化的方法一、蛋白质的粗分离破碎细胞后,所得的蛋白质混合液中除含有目的蛋白质外,还含有其他蛋白质、脂类、多糖及核酸等成分,利用简易、快速的方法除去这些杂质即为蛋白质的粗分离。
(一)盐析法蛋白质在低盐浓度下其溶解度随盐浓度的增加而增加,此现象为盐溶。
但随着盐浓度的继续升高,蛋白质的溶解度又会以不同程度下降,并先后析出,此现象为盐析。
此现象是由于当水中加入少量盐类时,盐离子与水分子对蛋白质分子上的极性基团产生影响,使其溶解度增大。
但当盐浓度增加到一定程度时,蛋白质所带的电荷被大量中和,水化膜被破坏,分子间相互聚集,而发生沉淀析出。
因此,可根据不同蛋白质在一定浓度的盐溶液中溶解度降低的程度不同,而将各种蛋白质彼此分离。
常用的中性盐有硫酸铵、硫酸钠、氯化钠等。
(二)有机溶剂分段沉淀法通过有机溶剂降低溶液的介电常数,破坏蛋白质的水化膜,导致溶解度的降低而发生沉淀析出,利用不同蛋白质在不同浓度的有机溶剂中的溶解度存在差异而分离的方法,称为有机溶剂分段沉淀法。
常用的有机溶剂有乙醇、丙酮、甲醇等。
(三)超速离心法超速离心法是利用物质的沉降系数、质量浮力等方面的差异,用强离心力使其分离的技术。
蛋白质在高达5000kg的重力作用下,在溶液中逐渐沉淀,直至其浮力与离心所产生的力相等,才停止沉降。
不同蛋白质其密度与形态各不相同,故应用离心的方法可将它们分开。
二、蛋白质的细分离待提纯的样品经过破碎及粗分离后,还难以达到纯品的要求时,则需进一步对其进行纯化处理。
(一)透析法利用蛋白质不能通过半透膜这一性质将大分子量蛋白质与小分子量化合物分开。
用具有超小微孔的膜制成透析袋,微孔可允许分子量为10000以下的化合物通过。
将蛋白质混合物装入袋中,再置于水中,则小分子物质如矿物质(无机盐)、单糖等可透过薄膜,不断更换袋外的水,可把袋内小分子物质全部去尽。
如在袋外放吸水剂,同时还可将袋内的水分去尽。
(二)层析法1.凝胶过滤层析凝胶过滤层析又称分子筛层析,是利用分子量的差异使物质彼此分离的方法。
摘要: 请问有哪些可能会出现这种原因?怎么解决?测过基因序列,没有问题。
细胞破碎后,融合蛋白在沉淀里,我用助溶剂提取后,可以用GST做亲和层析,但效率只有50~60%左右。
洗脱完融合蛋白不需要助溶剂,但这样的条件下切割完后目的蛋白会沉淀,我用0.5%CHAPS助溶可勉强溶解部分,目的蛋白疏水性比较强。
1)我现在手头有个融合蛋白,纯化的时候用助溶剂溶解后做了GST亲和层析,之后用蛋白酶切割后却发现目的蛋白没有活性。
请问有哪些可能会出现这种原因?怎么解决?测过基因序列,没有问题。
细胞破碎后,融合蛋白在沉淀里,我用助溶剂提取后,可以用GST做亲和层析,但效率只有50~60%左右。
洗脱完融合蛋白不需要助溶剂,但这样的条件下切割完后目的蛋白会沉淀,我用0.5%CHAPS助溶可勉强溶解部分,目的蛋白疏水性比较强。
既然是疏水性很强你可以加点甘油或者乙二醇降低极性,这样溶解就会好得多,此外你也直接加2%的PEG这样也降低极性,同时保护你的蛋白,你再做纯化就可以了,我以前遇到这样的蛋白是用10%的乙醇加3-5%的PEG5000,这样的情况下蛋白还是活性回收率很高,我觉得那些表面活性剂能不用还是不用的好,你失去活性你可以监测一下提取,纯化,酶切到底哪里失去了活性,这样更容易解决你的问题。
还有注意缓冲液PH值,看看改变它对溶解度有没有影响。
蛋白有沉淀那你可以稍微把蛋白的浓度降低点,这也是个办法。
2)请问有没有合成过配体为FMN的亲和胶?
现在一般要自己合成亲和填料,有很多公司都提供活化好的介质,自己偶联就可以,其中比较常用的有溴化氰琼脂糖凝胶,环氧琼脂糖凝胶,氨基琼脂糖凝胶,羧基琼脂糖凝胶,活化酯琼脂糖凝胶,以及巯基琼脂糖凝胶等,但是如果是小分子的配基最好选择有3-10碳作为手臂的活化介质为好,此外也曾经有文献报导固定辅酶时,偶联位置不同,选择性有差别,因此你可以选择自己适合的活化介
质。
不同的活化的介质对偶联的配基有不同的要求,所以要对自己的配基了解比较清楚就可以选择合适的活化介质。
我一般在合成的时候大多选择环氧琼脂糖凝胶,它能应用的范围广氨基巯基羟基都可以,而且合成的介质刚性好,非特异吸附少,所以不需要特殊处理未反应基团。
此外键合的键很稳定,配基脱落少。
我觉得是不错的选择。
包涵体的蛋白复性做得不多,但是我记得有个哥们说最管用的办法也是最简单的方法,他说在复性的时候尽量别想什么太高难的技术,那些时髦但不一定好用,常用的有透析复性,稀释复性,包括国外的专家也这么说.我觉得有时候开始摸不出来未必就是方法不行,关键要经常改变条件.
层析复性很时髦,但是真正能用的不很多,我觉得蛋白这东西难就在于大多都不相同,所以关键要多看文献,多琢磨自己蛋白的特性,多尝试。
3)Sephadex G-25(medium)柱脱盐时,盐浓度太高对柱效有影响吗?若有,一般对盐浓度限度如何?
大家别客气,除盐对于浓度应该也是有一定的限制的,同样的样品盐浓度高的自然要比浓度低的要在柱子上走的峰要宽些,相对需要的柱子的分辨率也要高点,但是在正常的范围如1-2M应该影响不大,不过要除得很干净还是尽量少上点样品,我觉得上样的体积毕竟比浓度的影响更大。
4)我的蛋白17kd左右,能跟肝素亲和,一般用离子交换和亲和层析纯化,
现在我用聚乙二醇修饰它,分子量增加5000左右,修饰率不可能达到100%,请问修饰后能用什么纯化方法可以把修饰的和未经修饰的分开?(当然修饰后还
残留有聚乙二醇,这个小分子也要除掉)
他们大多用凝胶过滤,我觉得这也不错的做法,毕竟PEG是链状的分子,在柱子上和普通蛋白行为不一样,修饰度越高那么出峰也越后,因此你的蛋白选择sephadex G50试试,它的范围在1000-30000,应该是不错的选择。
此外PEG是个疏水性的链,修饰后的蛋白疏水性增强,修饰度越高,疏水性越强,可以用这个原理分离。
离子交换也可以选择,因为同样道理,修饰度越高,电荷被屏蔽也越多,电荷也越少,因此应该修饰度越高越先出。
亲和也离子交换一样的道理,你可以试试,你手头的亲和能不能分开,你在这几个方法里选择看哪个更经济好用就可以。
5)我是个新手,谢谢楼主给我解决了许多难题。
我有个问题困绕很久,从细菌中提取酶,好象用常规的方法(超声波破壁,缓冲液提取),总是拿不到我要的蛋白。
是不是这种蛋白也是疏岁水性较强,需要加助溶剂才能提取出来?另外,我是不是也可以加点甘油或者PEG来提取?
其实这个问题我觉得是这样的,既然你是提取那肯定是有沉淀和上清,你的目标蛋白的分子量你是应该知道的,那么跑电泳先看它到底是在上清还是沉淀里,剩下的问题你再解决如何提取。
对于不同的酶要看酶稳定如何,你可以用不同的PH去提取,我曾经提取一个酶用水就是提取不出来,需要用盐才能提取出来,多试试,设计个方案,这样才能解决问题,所以不一定加甘油就管用,你还得注意破碎本身会不会有问题,倒回去做做也许能找到真正的原因。
有什么问题继续探讨。
6)HPLC是用来分析检测or分离纯化?
如果可以用来纯化,上样量那么小有什么意义呢?
如果是用来分析检测,怎样指导以后的分离纯化工作呢?
HPLC既可以做分析也可以做制备,纯化上样量小,这样分离效果好,就可能得到很纯的物质,同时配合质谱等就何以得到很多单一蛋白的特性包括序列等,这些纯度高的组分是用一般的纯化方法做不到的。
HPLC重现性好,定量准确,所以也可以用于定量和定性,是分析中不可缺少的工具.
分析出来后如果这个物质很稳定,直接线性放大就可以做大规模的制备,因此摸好了分析的条件也就相应有了制备的条件。