离子反应图像题专题训练
- 格式:doc
- 大小:244.50 KB
- 文档页数:5

压轴题13 水溶液中微粒变化图像题水溶液中的离子平衡是高考的重点,主要考查弱电解质的电离平衡、盐类的水解平衡、难溶电解质的溶解平衡的移动影响规律及应用,溶液中粒子浓度大小的比较,K sp、pH的计算,中和滴定的计算、指示剂的选择等。
近年来将离子反应与图像有机结合起来进行命题,很好地考查学生的观察能力、获取信息采集处理数据的能力、图形转化能力和推理判断能力。
题目不仅偏重考查粒子的浓度大小顺序,而且还侧重溶液中的各种守恒(电荷守恒、物料守恒、质子守恒)关系的考查,从而使题目具有一定的综合性、灵活性和技巧性。
预计2023年高考,对数、分布系数图象将成为水溶液中的离子平衡的高考新宠,命题设计更趋新颖灵活,综合性强,难度较大。
考查重点落在考生的读图识表能力、逻辑推理能力以及分析问题和解决问题的能力。
电解质溶液中粒子浓度大小的比较1.(2022•辽宁省选择性考试)甘氨酸(NH 2CH 2COOH)是人体必需氨基酸之一、在25℃时,NH 3+CH 2COOH 、NH 3+CH 2COO -和NH 2CH 2COO -的分布分数【如()()()()()2-2--2-2c A δA =c H A +c HA +c A 】与溶液pH 关系如图。
下列说法错误的是( )A .甘氨酸具有两性B .曲线c 代表NH 2CH 2COO -C .NH 3+CH 2COO -+H 2O NH 3+CH 2COOH+OH -的平衡常数K=10-11.65D .c 2(NH 3+CH 2COO -)<c (NH 3+CH 2COOH) · c (NH2CH 2COO -)2.将Cl 2缓慢通入1L0.1mol·L -1Na 2CO 3溶液中,反应过程中无CO 2逸出,用数字传感器测得溶液中pH 与c(HClO)的变化如图所示。
已知K a1(H 2CO 3)=10-6.3,K a2(H 2CO 3)=10-10.3。


考点07 离子反应图像1.(2016北京)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如右图所示。
下列分析不正确...的是A.①代表滴加H2SO4溶液的变化曲线B.b点,溶液中大量存在的离子是Na+、OH–C.c点,两溶液中含有相同量的OH–D.a、d两点对应的溶液均显中性认识离子反应的实质,加入的试剂先和哪个离子反应,再和哪个离子反应,最后与哪个离子反应,反应过程中产生了沉淀、还是沉淀质量不变、或是沉淀质量减少。
离子反应图像是考试常考知识点之一,主要考查离子反应的实质、先后顺序、离子反应的量的关系等。
1、考查离子反应的实质溶液中加入试剂首先要明确离子之间的反应原理,即离子之间是如何反应的,如NaHCO3溶液中加入石灰水,先发生反应OH-+ HCO3-=CO32-+ H2O,生成的CO32-再与Ca2+结合生成CaCO3沉淀;同样明矾溶液中加入Ba(OH)2溶液,同时发生反应:Ba2++SO42-BaSO4↓、Al3++3OH-Al(OH)3↓,当Al3+沉淀完全,SO42-还有剩余,当SO42-沉淀完全,Al3+转化为AlO2-。
典例1向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。
沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水)。
以下推断正确的是A.OA段产生的沉淀为BaSO4和Fe(OH)3B.据图计算原溶液中c(Cl-)=c(SO42-)C.AB段可能发生的反应是:2SO42-+ 2Ba2+ + Al3+ +3OH-=2BaSO4+Al(OH)3D.C点溶液呈碱性的原因是AlO2-水解,其离子方程式为:AlO2-+2H2O=Al(OH)3 +OH一2、考查离子反应的先后顺序当溶液中存在几种离子时,加入试剂要注意离子的反应的先后顺序,一般是中和反应优先。


高中化学离子反应答题技巧及练习题(含答案)1(2)一、高中化学离子反应1.下列实验与对应示意图的关系正确的是()A.向 NaAlO2溶液中逐滴滴加盐酸至过量B.向 AlCl3溶液中逐滴滴加氨水至过量C.向明矾溶液中逐滴滴加Ba(OH)2溶液至过量D.向澄清石灰水中缓缓通入 CO2至过量【答案】C【解析】【分析】【详解】A. NaAlO2溶液中滴加稀盐酸,有关反应为AlO2- + H+ + H2O = Al(OH)3 ↓和Al(OH)3 + 3H+ = Al3+ + 3H2O,逐渐产生沉淀,达到一定量后沉淀逐渐减少直至完全消失,图像应为,A错误;B. 向 AlCl3溶液中逐滴滴加氨水至过量,沉淀不溶解,图像错误,B错误;C. 向明矾溶液中逐滴滴加Ba(OH)2溶液至过量,根据反应式2KAl(SO4)2+3Ba(OH)2=K2SO4+3BaSO4↓+2Al(OH)3↓可知,当加入1.5mol氢氧化钡时生成1.5mol硫酸钡和1mol氢氧化铝。
根据反应式KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓+2H2O可知,当加入2mol氢氧化钡时,生成的氢氧化铝又溶解生成偏铝酸钠,此时硫酸钡的沉淀达到最大值,因此图像可表示为,,C 正确;D. 向澄清石灰水中缓缓 通入 CO 2 至过量,会生成能溶于水的碳酸氢钙,沉淀会消失,D 错误; 故答案选C 。
【点睛】在书写与量有关的离子方程式时,通常采用以少定多少为1的方式。
2.向0.02mol·L -1CuSO 4溶液中匀速滴加1mol·L -1氨水,先观察到有浅蓝色沉淀[Cu 2(OH)2SO 4]生成,后沉淀溶解,逐渐变为深蓝色溶液。
该实验过程体系的pH 和电导率随时间的变化如图所示。
下列说法正确的是A .c(Cu 2+):a 点=b 点B .bc 段生成浅蓝色沉淀的反应为-2-42+4222Cu +2OH +SO =Cu (OH)SO ↓ C .d 点时:()()+2-44c NH <2c SO D .导电能力:()2++434NH >Cu NH ⎡⎤⎣⎦ 【答案】D 【解析】 【分析】c 到d 溶液pH 突变,说明c 点沉淀达到最大值,a 到c 发生生成沉淀的反应:2-2++32422442Cu +2NH H O+SO =Cu (OH)SO 2NH ↓+⋅,c 到e 发生沉淀溶解反应:224Cu (OH)SO +328NH H O ⋅=2()234Cu NH +⎡⎤⎣⎦+8H 2O+SO 42-+2OH -,据此分析解答。



水溶液中的离子平衡图像分析题考试范围:xxx;考试时间:100分钟;命题人:xxx注意事项:1.答题前填写好自己的姓名、班级、考号等信息2.请将答案正确填写在答题卡上第Ⅰ卷选择题请点击修改第I卷的文字说明评卷人得分一.选择题共40小题1.常温下;将0.10mol•L﹣1盐酸慢慢加入到20.00mL浓度为0.10 mol•L﹣1 CH3COONa溶液中;所得溶液pH变化曲线如图所示忽略体积变化..下列说法不正确的是A.点①所示溶液中由水电离产生的cOH﹣=10﹣5.5 mol•L﹣1B.点②所示溶液中:cNa+=cCl﹣+cCH3COO﹣C.点③所示溶液中:cNa+>cCl﹣>cCH3COO﹣=cCH3COOHD.点④所示溶液中:cNa++cCH3COOH+cH+>0.10 mol•L﹣1第1页(共37页)第2页(共37页)2.常温下;100mL 0.1mol/L的H2A溶液中滴加0.1mol/L NaOH溶液;含A元素相关微粒物质的量随pH的变化如图所示;下列说法正确的是A.H2A在水中的电离方程式是:H2A=H++HA﹣;HA﹣⇌H+A2﹣B.等体积等浓度的NaOH溶液与H2A溶液混合后;其溶液中水的电离程度比纯水大C.Y点溶液中存在以下关系:cNa+>cHA﹣=cA2﹣>cOH﹣>cH+D.X点溶液中含A元素相关离子:cH2A+cHA﹣+cA2﹣=0.1mol/L3.常温下将NaOH溶液添加到己二酸H2X;为二元弱酸溶液中;混合溶液的pH与离子浓度变化的关系如图所示..下列叙述正确的是A.己二酸电离常数Ka1H2X约为10﹣4.4B.曲线M表示pH与lg的变化关系C.当溶液中cX2﹣=cHX﹣时;溶液为碱性D.当混合溶液呈中性时;cNa+>cHX﹣>cX2﹣>cOH﹣=cH+第3页(共37页)第4页(共37页)4.已知:pBa2+=﹣lgcBa2+;pK a=﹣lgK a.向20mL0.1 mol/L BaCl2溶液中滴加0.2mol/LNa2CO3溶液的滴定曲线如图所示;下列描述错误的是常温下;H2CO3的电离常数pK a1=6.4;pk a2=10.3:K sp BaSO4=1.1×10﹣10A.在碳酸钠溶液中;K h1CO32﹣=10×10﹣3.7B.根据曲线数据计算可知K sp BaCO3的数量级为10﹣9C.相同条件下;若改为0.15 mol/L BaCl2溶液;反应终点F移到K点D.相同条件下;若改为0.2 mol/L Na2SO4溶液;反应终点F移向H方向移动5.在25℃时;甘氨酸在水溶液中解离方程式如下:当调节溶液的pH使甘氨酸所带的净电荷为零;此时溶液的pH叫等电点..其物质的量分数α随溶液pH变化的关系如图所示..下列说法中正确的是A.K2=10﹣2.34;且K2对应的解离基团为﹣NH3+B.甘氨酸的等电点pH约为6;且存在cA±=cA+=cA﹣C.pH=7;cA±>cA+>cA﹣D.甘氨酸晶体熔点较高;主要是因为晶体中羧基与氨基之间形成内盐第5页(共37页)6.在25℃时;向20mL 0.2mol•L﹣1的氢氟酸中滴加0.2 mol•L﹣1的NaOH溶液时;溶液的pH变化如图所示..已知:H+aq+OH﹣aq=H2Ol△H=﹣a kJ•mol﹣1;HFaq=H+aq+F﹣ag△H=+b kJ•mol﹣1..下列说法不正确的是A.氢氟酸是一种弱酸B.在A处溶液中:cF﹣+cHF>0.1mol•L﹣1C.OH﹣aq+HFaq=H2Ol+F﹣aq△H=﹣a﹣bkJ•mol﹣1D.A点时水的电离程度大于B点时水的电离程度7.常温下;用0.01000 mol•L﹣1的盐酸滴定0.01000 mol•L﹣1 NaA溶液20.00mL.滴定曲线如图所示;下列说法正确的是A.a点到d点的过程中;等式cHA+cA﹣=0.01000 mol•L﹣1恒成立B.b点时;溶液中微粒浓度大小关系为:cA﹣>cCl﹣>cHA>cOH﹣>cH+第6页(共37页)C.c点时;溶液中微粒浓度存在关系:cNa++cH+=cHA+cOH﹣+2cA﹣D.d点时;溶液中微粒浓度存在关系:cOH﹣+cA﹣=cH+8.298K时;用0.1000mol•L﹣1盐酸滴定20.00mL0.1000mol•L﹣1ROH溶液;所得溶液的pH与lg的关系如图所示..下列说法正确的是A.298K时;ROH的电离常数K b=1.0×10﹣9.3B.本实验宜选用酚酞溶液作指示剂C.Z点为滴定终点D.Y点溶液中cCl﹣<cR+第7页(共37页)9.H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数平衡时某物种的浓度占各物种浓度之和的分数与pH 的关系分别如图1和图2所示:下列说法正确的是A.H3AsO3的pK a1=9.2pK a1=﹣lgK a1B.NaH2AsO3溶液中:cOH﹣=cH++cH3AsO3C.NaH2AsO4溶液中:cH+>cOH﹣D.H3AsO4溶液中滴入NaOH溶液至pH>11.5时;cAsO43﹣>H2AsO4﹣>c HAsO42﹣10.25℃时;向Na2CO3溶液中滴入盐酸;混合溶液的pH与离子浓度变化的关系如图所示..已知:lgX=lg或lg;下列叙述正确的是A.曲线m表示与pH与的变化关系B.NaHCO3溶液中cCO32﹣>cH2CO3C.当溶液呈中性时;cNa+=cHCO3﹣+2cCO32﹣D.25℃时;HCO3﹣+H2O⇌H2CO3+OH﹣的平衡常数为1.0×10﹣7.6第8页(共37页)第9页(共37页)11.常温下;向20mL0.2 mol•L﹣1H2A溶液中滴加0.2 mol•L﹣1 NaOH溶液;含A元素的有关微粒物质的量变化如图所示..根据图示判断;下列说法正确的是A.H2A在水中的电离方程式H2A=H++HA﹣;HA⇌H++A2﹣B.当VNaOH溶液=20mL时;溶液中各粒子浓度的大小顺序:cNa+>cHA﹣>cH+>cOH﹣C.当VNaOH溶液=30mL时;溶液中存在以下关系:2cH++cHA﹣+2cH2A=cA2﹣+2cOH﹣D.等体积等浓度的NaOH溶液与H2A溶液混合后;其溶液中水的电离程度比纯水大12.某温度下;HA和HB的电离常数分别为5.0×10﹣4和1.7×10﹣5.将pH和体积均相同的两种酸溶液分别稀释;其pH随加水体积的变化如图所示..下列叙述正确的是A.曲线Ⅰ对应的溶液中存在:HB═H++B﹣B.溶液中水的电离程度:b点>c点C.从c点到d点;溶液中保持不变第10页(共37页)D.相同体积a点的两溶液分别与NaOH恰好中和后;溶液中nNa+相同第11页(共37页)13.AlPO4的沉淀溶解平衡曲线如图所示..下列说法不正确的A.T1>T2B.AlPO4在b点对应的溶解度大于c点C.图中四个点的K sp:a=c=d<bD.T1温度下;在AlPO4的饱和溶液中加入ACl3可使溶液由c点变到a点14.室温下;向10mL0.1000mol•L﹣1NaOH溶液中逐滴加入0.1000mol•L﹣1的某一元酸HX;溶液pH变化曲线如图..下列说法不正确的是A.等浓度的HX、NaX混合溶液中;HX的电离程度大于X﹣的水解程度B.c点所示溶液中存在:2cH+﹣2cOH﹣=cX﹣﹣cHEC.a、b、c点所示溶液中;由水电离出的cH+•cOH﹣值不变第12页(共37页)D.a→c点所示溶液中;cX﹣+cHX+cNa+=0.1000mol•L﹣1始终成立第13页(共37页)15.常温下;向20.00mL 0.1mol•L﹣1的甲胺CH3NH2溶液中滴加0.1 mol•L﹣1的盐酸;混合溶液的pH与相关微粒浓度比值的对数关系如图所示..下列说法不正确的是A.滴加盐酸10.00mL时;CH3NH2•H2O的电离程度大于CH3NH3+的水解程度B.滴定过程中水的电离程度先增加后减小C.滴加盐酸20.00mL时;cCl﹣>cCH3NH3+>cCH3NH2•H2O>cH+>cOH﹣D.常温下;CH3NH2•H2O的电离常数为K b;则pK b=﹣1 g K b=3.416.H2C2O4为二元弱酸..20℃时;配制一组cH2C2O4+cHC2O4﹣+cC2O42﹣=0.100mol•L﹣1的H2C2O4和NaOH混合溶液;溶液中部分微粒的物质的量浓度随PH的变化曲线如图所示下列指定溶液中微粒的物质的量浓度关系一定正确的是A.K2H2C2O4的数量级为10﹣4B.cNa+=0.100mol•L﹣1的溶液中cH++cH2C2O4=cOH﹣+cC2O42﹣第14页(共37页)C.cHC2O4﹣=cC2O42﹣的溶液中c Na+>0.100 mol•L﹣1+cHC2O4﹣D.PH=7.0的溶液中:cNa+=2cC2O42﹣第15页(共37页)17.常温时;100mL 0.10 mol•L﹣1H2A溶液用0.10mol•L﹣1的NaOH溶液滴定;滴定曲线如图所示..已知:pK a =﹣lgK a.下列说法不正确的是A.可用酚酞作滴定指示剂B.NaHA溶液呈酸性C.反应H2A+A2﹣⇌2HA﹣的平衡常数K=105.6D.Y点溶液中:cNa+=cOH﹣+3cHA﹣﹣cH+18.室温下两种一元弱酸中分子的物质的量分数δδHA=随pH的变化关系如图所示..下列判断正确的是A.水的电离程度:M=NB.HX的电离常数K;HX=1.0×10﹣5.5C.P点溶液中存在:cHX>cOH﹣>cX﹣第16页(共37页)D.等浓度的HY和NaY混合溶液中存在:cH+>cOH﹣第17页(共37页)19.常温下;将NaOH溶液滴入某一元酸HA溶液中;测得混合溶液的pH与离子浓度变化关系如图所示已知p=﹣lg.下列叙述不正确的是A.K a HA的数量级为10﹣5B.滴加NaOH溶液的过程中;保持不变C.m点所示溶液中cH++cNa+=cHA+cOH﹣D.n点所示溶液中:cNa+=cA﹣+cHA20.室温下;将0.01mo•L﹣1的一元酸HA溶液逐滴滴入10mL 0.01mol•L﹣1 NaOH溶液中;测得溶液pH与所加HA溶液体积的关系如图所示..下列说法正确的是A.a点溶液中由水电离出的cOH﹣=1.0×10﹣2mol•L﹣1B.b点所示溶液中:cNa+=cA﹣+cHA=0.01mol•L﹣1C.c点所示溶液中:cA﹣>cNa+>cH+>cOH﹣D.水的电离程度c>b>a第18页(共37页)第19页(共37页)21.常温下;在25mL氢氧化钠溶液中逐滴加入0.2mol•L﹣1醋酸溶液;滴定曲线如图所示下列说法正确的是A.该氢氧化钠溶液的物质的量浓度为0.2 mol•L﹣1B.B点对应的醋酸溶液体积为12.5mLC.D点的溶液中cCH3COO﹣>cNa+>cH+>cOH﹣D.二者恰好完全反应的点位于曲线B、C之间的某点22.常温下向20mL 0.1mol•L﹣1 Na2CO3溶液中逐滴加入0.1mol•L﹣1 HCl溶液40mL;溶液中含碳元素的各种微粒CO2因逸出未画出物质的量分数纵轴随溶液pH变化的部分情况如图所示..下列说法正确的是A.在同一溶液中;H2CO3、HCO3﹣、CO32﹣不能大量共存B.当pH=7时;溶液中各种离子CO32﹣除外的物质的量浓度的大小关系为:cCl﹣>cNa+>cHCO3﹣>cH+=cOH﹣C.0.1mol/L Na2CO3溶液中cOH﹣﹣cH+=cH2CO3+cHCO3﹣D.当pH=8时;NaHCO3溶液的物质的量浓度为0.1mol/L第20页(共37页)23.在25℃时;甘氨酸在水溶液中解离情况如图:改变溶液pH值;三种甘氨酸相关离子的分布分数α;平衡时某物种的浓度占各物种浓度之和的分数变化如图所示..当调节溶液的pH值使甘氨酸所带的净电荷为零;此时溶液的pH叫等电点..下列说法正确的是A.曲线Ⅰ、Ⅱ、Ⅲ分别代表的微粒为A﹣、A±、A+B.K2=10﹣2.34;且K2对应的解离基团为﹣NH3+C.在pH=9.60的溶液中加盐酸;αA±+αA++αA﹣保持不变D.甘氨酸的等电点pH约为6;且存在cA±=cA+=cA﹣24.25℃时;用浓度为0.1000mol•L﹣1的NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L﹣1的HX、HY 溶液;溶液pH随NaOH溶液体积的变化关系如图..下列说法正确的是A.K a HY的数量级为10﹣6第21页(共37页)B.a点时:cY﹣+cHY=0.1000mol•L﹣1C.b点时:cHX>cNa+>cX﹣>cOH﹣>cH+D.当VNaOH=20.00mL时;将所得两溶液混合;则cX ﹣+cY﹣+cOH﹣=cH++2 cNa+第22页(共37页)25.常温下;pH均为2、体积均为V0的HA、HB、HC溶液;分别加水稀释至体积为V;溶液pH随lg的变化关系如图所示;下列叙述错误的是A.常温下:K a HB>K a HCB.HC的电离度:a点<b点C.当lg=4时;三种溶液同时升高温度;减小D.当lg=5时;HA溶液的pH为726.常温下;取三份浓度均为0.1mol/L;体积均为1L的醋酸钠溶液中分别加入氯化铵固体、醋酸铵固体、氯化氢气体后所得溶液pH变化曲线如图溶液体积变化忽略不计;下列说法不正确的是A.曲线a、b、c分别代表加入醋酸铵、氯化铵、氯化氢B.A点处CNa+>cCH3COO﹣>cNH4+>cOH﹣>cH+C.由B点可知KaCH3COOH=KbNH3•H2O第23页(共37页)D.C点处cCH3COO﹣+CCl﹣+cOH﹣>0.1mol/L第24页(共37页)27.25℃时;分别向等体积、等物质的量浓度的NaBr、Na2CrO4溶液中滴加0.01mol•L﹣1 AgNO3溶液;根据溶液中平衡时相关离子浓度的关系图;下列说法错误的是A.AgNO3溶液中;cH+>cOH﹣B.K sp AgBr的数量级为10﹣12C.若向物质的量浓度均为0.01mol•L﹣1的NaBr和Na2CrO4混合溶液中滴加0.01mol•L﹣1 AgNO3溶液;先产生AgBr沉淀D.Ag2CrO4s+2Br﹣aq⇌2AgBrs+CrO42﹣aq平衡常数很大;故该反应趋于完全28.t°C时;已知:K sp AgCl=10﹣10;Ag2CrO4的沉淀溶解平衡曲线如图所示;则下列说法正确的是A.t℃时;Ag2CrO4的K sp数量级为10﹣9B.无法计算Y点与Z点的K spC.Ag2CrO4s+2Cl﹣ag⇌2AgCls+CrO42﹣aq的平衡常数:K=108D.在饱和Ag2CrO4溶液中加入K2CrO4;可使溶液由Y点变到X点最终变到Z点第25页(共37页)第26页(共37页)29.常温下;向20mL0.1mol•L﹣1HA溶液中滴加0.1mol•L﹣1的氨水;溶液的pH随氨水的体积关系如图所示..下列说法不正确的是A.HA的电离方程式为HA=H++A﹣B.B点时加入HA和氨水恰好完全反应C.A点所示溶液中cA﹣=2cNH4++2cNH3•H2OD.C点所示溶液中:cNH4+>cA﹣>cNH3•H2O30.已知:常温下;1K a1H2CO3=4.3×10﹣7;K a2H2CO3=5.6×10﹣11;2H2R及其钠盐的溶液中;H2R、HR﹣、R2﹣分别在三者中所占的物质的量分数α随溶液pH的变化关系如图所示..下列叙述错误的是A.在pH=1.3的溶液中:cNa+<cH2R+2cR2﹣B.等体积等浓度的NaOH溶液与H2R溶液混合后;溶液中水的电离程度比纯水小C.在pH=2的溶液中存在=10﹣3D.向Na2CO3溶液中加入过量H2R溶液;发生反应:CO32﹣+H2R═HCO3﹣+HR﹣第27页(共37页)31.某温度下;向50 mL CuCl悬浊液中慢慢加入NaI固体并搅拌;溶液中cCu+随cI﹣的变化关系曲线如图忽略溶液体积变化;已知:K sp CuI=1.0×l0﹣12;则下列说法正确的是A.CuCl悬浊液中加入NaI固体立即有CuI生成B.x=l0﹣6C.CuI悬浊液中加入淀粉会出现蓝色D.若c点CuCl未完全溶解;则曲线bc段内;cCl﹣:cI﹣=10632.25℃时;将浓度均为0.1mol L、体积分别为V a和V b的HX溶液与NH3•H2O溶液按不同体积比混合;保持V a+V b=100mL;V a、V b与混合液的PH的关系如图所示..下列说法正确的是A.K a HX>K b NH3•H2OB.b点时cNH4+>cHX>cOH﹣=cH+C.a、b、d几点中;水的电离程度d>b>a第28页(共37页)D.a→b点过程中;可能存在cX﹣<cNH4+第29页(共37页)33.常温时;1mol•L﹣1的CH3NH2和1mol•L﹣1的NH2OHNH2OH+H2O⇌NH3OH++OHˉ两种碱溶液;起始时的体积均为10mL;分别向两溶液中加水进行稀释;所得曲线如图所示V表示溶液的体积;pOH=﹣lgcOH﹣..下列说法不正确的是A.NH2OH的电离常数K的数量级为10﹣9B.CH3NH3Cl盐溶液中水解离子方程式为:CH3NH2+H2O⇌CH3NH3++OH﹣C.当两溶液均稀释至lg=4时;溶液中水的电离程度:NH2OH>CH3NH2D.浓度相同的CH3NH3Cl和NH3OHCl的混合溶液中离子浓度大小关系:NH3OH+<cCH3NH3+ 34.25℃时;用0.1 mol•L﹣1NaOH溶液分别滴定10 mL 0.1 mol•L﹣1的一元酸HX和HY;滴定时溶液的pH随加入NaOH溶液体积的变化曲线如图所示..下列说法正确的是A.HX、HY均为弱酸;且K a HX<K a HYB.M、Q、N三点中水的电离:N>Q>MC.P点溶液中存在:cNa+>cY﹣>cHY>cOH﹣第30页(共37页)D.25℃时;Y﹣的水解常数的数量级为10﹣9第31页(共37页)35.已知:pc表示物质的量浓度的负对数..常温下;将amol一元弱酸HA与一定量盐酸或NaOH溶液混合;配制成100mL溶液;所得溶液pH与pcHA、pcA﹣的关系如图所示..下列叙述错误的是A.K a HA=10﹣5B.曲线L1;代表pH与pcA﹣的关系C.水的电离程度:X<Y<ZD.Y点为等物质的量浓度的HA和NaA的混合溶液36.25℃时;甲胺CH3NH2的电离常数pK b=3.38.甲胺是一元弱碱;碱性比NH3•H2O略强;在水中的电离方程式为CH3NH2+H2O⇌CH3NH3++OH﹣.25℃时;向20.0mLx mol﹣1稀硫酸中滴加0.10mol•L﹣1甲胺溶液;混合溶液中水电离的cH+与甲胺溶液体积之间的关系如图所示..下列说法正确的是A.x=0.10、V0=40.0第32页(共37页)B.25℃时;CH3NH32SO4的水解常数pK h=10.62C.N点对应的溶液中cCH3NH3+=2cSO42﹣D.Q点对应的溶液呈碱性第33页(共37页)37.水的电离平衡曲线如图所示;下列说法正确的是A.图中五点K W间的关系:B>C>A=D=EB.若从A点到D点;可采用在水中加入少量NaOH的方法C.若从A点到C点;可采用温度不变时在水中加入适量H2SO4 的方法D.若处在B点时;将pH=2的硫酸与pH=12的KOH等体积混合后;溶液显中性38.已知二元弱碱BOH2在水中存在如下电离平衡:BOH2 ⇌BOH++OH﹣;K b1=10﹣3.75;BOH+⇌B2++OH﹣;K b2=10﹣7.62.常温下;用0.1mol/L盐酸滴定25mL 0.1mol/L的BOH2溶液;得到如图所示的滴定曲线..下列说法不正确的是A.a点所得的溶液中:cBOH2=cBOH+B.b点所得的溶液中:cBOH2+cOH﹣=cB2++cH+C.c点所得的溶液中:cCl﹣<3cBOH+第34页(共37页)D.d点所得的溶液中:cB2+>cBOH+>cBOH2第35页(共37页)39.室温时;向100mL0.1mol/L NH4HSO4溶液中逐滴滴加0.1mol/L NaOH溶液;得到溶液pH与NaOH溶液体积的关系曲线如图所示假设溶液的体积有加和性..下列分析正确的是A.ab段和bc段发生的离子反应一定不同B.水的电离程度最大的是c点C.b点溶液中各离子浓度由大到小的排列顺序是:cNa+>cNH4+>cSO42﹣>cH+=cOH﹣D.NH4+的水解常数K b的能量级为10﹣1040.甲胺CH3NH2是一种一元弱碱;其电离方程式为:CH3NH2+H2O⇌CH3NH3++OH﹣常温下;向20.0mL0.10mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸;混合溶液的pH与相关微粒浓度的关系如图所示..下列说法中错误的是A.b点对应加入盐酸的体积V<20.00mLB.常温下;根据a点可知甲胺的电离平衡常数Kb=10﹣3.4C.b点可能存在关系:cCl﹣>cCH3NH3+>cH+=cOH﹣第36页(共37页)D.V=20.00mL时;溶液呈弱酸性第37页(共37页)。

专题07 离子反应图像1.已知向溶液X中滴加溶液Y可生成两种沉淀,所得沉淀的物质的量(n)与所加入的溶液Y的体积(V)的关系如图所示,则X、Y分别为()【答案】A2.下列示意图与对应的反应情况正确的是()A.含0.01 mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2B. NaHSO4溶液中逐滴加入Ba(OH)2溶液C. KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液D.向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸【答案】B【解析】A选项,首先CO2先与Ca(OH)2反应,再和KOH反应,当反应完全之后再和沉淀CaCO3反应,生成碳酸氢钙;B选项,NaHSO4溶液中逐滴加入Ba(OH)2溶液,只产生硫酸钡沉淀;C选项,1 mol KAl(SO4)2,加入1.5 mol的Ba(OH)2时生成1.5mol BaSO4和1 molAl(OH)3,沉淀的物质的量最大为2.5 mol,再加入0.5 mol Ba(OH)2,生成0.5 mol BaSO4,溶解1 mol Al(OH)3;D选项,含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸,盐酸先和氢氧化钠反应,在NaAlO2与HCl的物质的量之比为小于等于1︰1,此时只生成白色的氢氧化铝沉淀,如果继续加入盐酸,这是沉淀开始溶剂,当NaAlO2与HCl的物质的量之比达到1︰4时,所产生的氢氧化铝完全溶解。
A选项,首先CO2先与Ca(OH)2反应,产生CaCO3沉淀,此时沉淀量逐渐增大,CO2再和KOH反应,此时无沉淀,之后二氧化碳先会和K2CO3反应,生成酸式盐,当反应完全之后再和沉淀CaCO3反应,生成碳酸氢钙,从而沉淀出现溶解现象,所以图像应该是“等腰梯形”的形状,故A错误;B选项,NaHSO4溶液中逐滴加入Ba(OH)2溶液,只产生硫酸钡沉淀,当把硫酸根反应完全,再加氢氧化钡也不产生沉淀,所给图像恰好能表达该反应过程,故B选项正确;C选项,假设溶液中含1 mol KAl(SO4)2,加入1.5 mol的Ba(OH)2时生成1.5mol BaSO4和1 molAl(OH)3,沉淀的物质的量最大为2.5 mol,再加入0.5 mol Ba(OH)2,生成0.5 mol BaSO4,溶解1 mol Al(OH)3,故沉淀的总物质的量减少,最后只剩下硫酸钡沉淀,故C错误;D选项,含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸,盐酸先和氢氧化钠反应,在NaAlO2与HCl的物质的量之比为小于等于1︰1,此时只生成白色的氢氧化铝沉淀,如果继续加入盐酸,这是沉淀开始溶剂,当NaAlO2与HCl的物质的量之比达到1︰4时,所产生的氢氧化铝完全溶解,离子方程式如下,H++AlO2-+ H2O = Al(OH)3↓; Al(OH)3+3H+ = Al3+ + 3H2O故曲线应该是加入1份盐酸时沉淀达到最大,再加入3份盐酸沉底全部消失,图像应该是个“非等腰三角形”,与D所给图像不符合,故D错误。
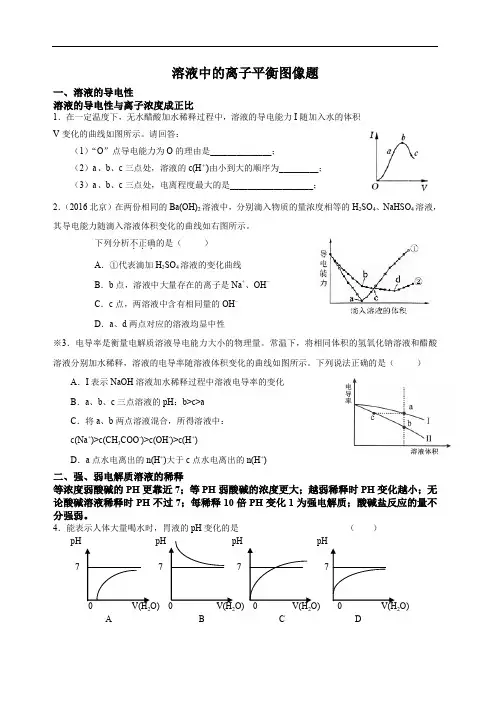
溶液中的离子平衡图像题一、溶液的导电性溶液的导电性与离子浓度成正比1.在一定温度下,无水醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。
请回答:(1)“O”点导电能力为O的理由是______________;(2)a、b、c三点处,溶液的c(H+)由小到大的顺序为_________;(3)a、b、c三点处,电离程度最大的是___________________;2.(2016北京)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如右图所示。
下列分析不正确...的是()A.①代表滴加H2SO4溶液的变化曲线B.b点,溶液中大量存在的离子是Na+、OH–C.c点,两溶液中含有相同量的OH–D.a、d两点对应的溶液均显中性※3.电导率是衡量电解质溶液导电能力大小的物理量。
常温下,将相同体积的氢氧化钠溶液和醋酸溶液分别加水稀释,溶液的电导率随溶液体积变化的曲线如图所示。
下列说法正确的是()A.I表示NaOH溶液加水稀释过程中溶液电导率的变化B.a、b、c三点溶液的pH:b>c>aC.将a、b两点溶液混合,所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)D.a点水电离出的n(H+)大于c点水电离出的n(H+)二、强、弱电解质溶液的稀释等浓度弱酸碱的PH更靠近7;等PH弱酸碱的浓度更大;越弱稀释时PH变化越小;无论酸碱溶液稀释时PH不过7;每稀释10倍PH变化1为强电解质;酸碱盐反应的量不分强弱。
4.能表示人体大量喝水时,胃液的pH变化的是()7 7 7O)2222A B C D5.0.1 mol·L -1的醋酸与0.1 mol·L -1的盐酸,分别稀释相同的倍数,随着水的加入,溶液中c (H +)的变化曲线(如下图)正确的是( )6.某温度下,相同pH 值的盐酸和醋酸溶液分别加水稀释,平衡pH 值随溶液体积变化的曲线如图所示。

易错专题14水溶液中离子平衡图像聚焦易错点:►易错点一稀释图像►易错点二滴定曲线►易错点三K W 、K sp 的图像►易错点四分布系数图像易错点一稀释图像【易错典例】例1(2023·浙江温州·三模)在一定温度下,冰醋酸稀释过程中溶液的导电能力与pH 的变化如图。
下列有关说法中正确的是A .a 点3CH COOH 溶液未达到电离平衡状态B .离子总浓度越大,溶液导电能力越强C .向a 、b 两点溶液中分别滴入同一NaOH 溶液至中性,溶液中的()3n CH COO -相同D .b 点后,溶液中加水稀释,所有离子浓度均减小B 【详解】A .加水稀释过程中,a 点、b 点都达到了电离平衡,故A 错误;B .导电能力与离子浓度和所带电荷数有关,因此离子总浓度越大,溶液导电能力越强,故B 正确;C .根据电荷守恒3n(CH COO )n(OH )n(Na )n(H )--+++=+,溶液呈中性,3n(CH COO )n(Na )-+=,a 点醋酸浓度大,向a 、b两点溶液中分别滴入同一NaOH 溶液至中性,a 点消耗的氢氧化钠溶液比b 点消耗的氢氧化钠溶液多,因此溶液中的()3n CH COO -是a 点大于b 点,故C 错误;D .b 点后,溶液中加水稀释,醋酸根、氢离子浓度减小,氢氧根浓度增大,故D 错误。
【解题必备】稀释图像(pH 与稀释倍数的线性关系)①HY为强酸、HX为弱酸②a、b两点的溶液中:c(X-)=c(Y-)③水的电离程度:d>c>a=b ①MOH为强碱、ROH为弱碱②c(ROH)>c(MOH)③水的电离程度:a>b【变式突破】1.(2023·北京房山·一模)某温度下,将pH和体积均相同的HCl和3CH COOH溶液分别加水稀释,其pH随加水体积的变化如图所示。
下列叙述不正确的是A.稀释前溶液的浓度:()()3HCl CH COOHc c<B.溶液中水的电离程度:b点<c点C.从b点到d点,溶液中()()c H c OH+-⋅逐渐增大D.在d点和e点均存在:()H c c+>(酸根阴离子)C【详解】A.稀释前两溶液的pH值相等,由于醋酸是部分电离,因此溶液的浓度:c(HCl)<c(CH3COOH),故A正确;B.b点pH值小于c点pH值,说明c点酸性弱,抑制水的电离程度小,水的电离程度大,因此溶液中水的电离程度:b点<c点,故B正确;C.从b点到d点,由于溶液的温度不变,因此溶液中c(H+)·c(OH-)不变,故C错误;D.在d点和e点均存在电荷守恒即c(H+)=c(酸根阴离子)+c(OH-),因此存在:c(H+)>c(酸根阴离子),故D正确。
水溶液中的电离平衡【原卷】1.(2021·江西高三二模)常温下,向1 L 浓度为0.4 mol·L -1的乙醇酸[CH 2(OH)COOH]溶液中加入8 g NaOH 固体得到X 溶液,将X 溶液平均分成两等份,一份通入HCl 气体,得到溶液Y ,另一份加入NaOH 固体得到溶液Z ,溶液Y 、Z 的pH 随所加物质的物质的量的变化情况如图所示(体积变化忽略不计)。
下列说法不正确的是( )A .c 点对应曲线代表的是加入HCl 的曲线B .溶液中水的电离程度:b >cC .a 点:c [CH 2(OH)COO -]>c (Na +)>c (H +)>c (OH - )D .稀释Y 溶液后,溶液中[]-2-2CH (OH)COO CH (OH)COOH (OH )c c c ⎡⎤⎣⎦⨯变大2.(2021·安徽马鞍山市·高三一模)室温下,体积均为20mL 、浓度均为0.1mol·L -1的HX 溶液、HY 溶液中分别滴加同浓度的NaOH 溶液,反应后溶液中水电离的c(H +)水的负对数[–lgc(H +)水]与滴加氢氧化钠溶液体积的关系如图所示。
下列说法正确的是( )A .室温时,Ka(HX)=10-6B .a 、b 、c 三点溶液均显中性C .b 、d 两点溶液的离子总浓度不同D .c 点溶液中c(X -)+c(HX)=0.1mol·L -13.(2021·山东潍坊市·高三一模)常温下,向含少量盐酸的0.1mol/L 的CrCl 3溶液中逐滴滴加NaOH 溶液,所加NaOH 溶液的体积与溶液pH 变化如图所示。
已知:Cr(OH)3为灰绿色的沉淀,当Cr 3+浓度为10-5mol/L 时,可认为沉淀完全,碱过量时生成[Cr(OH)4]-离子。
下列说法正确的是( )A .AB 段发生反应的离子方程式为:33Cr 3OH Cr(OH)+-+=↓B .A 到D 过程中,溶液中水的电离程度先减小后增大C .当溶液pH=5时,()3 3.81c Cr 110mol L +--=⨯⋅D .D 点溶液中()()()()4c Cl c Na c Cr(OH)c OH c H -+--+⎡⎤>>>>⎣⎦4.(2021·河北高三二模)常温下,向10.10mol L -⋅的二元弱酸2H A 溶液中滴加相同浓度的烧碱溶液,溶液中的22H A HA A --、、的物质的量分数(X)δ随pH 的变化如图所示[已知()()()22c(X)(X)c H A c HA c A δ--=++],下列说法错误的是( )A .()a22K H A 的数量级为510-B .常温下,10.1mol L -⋅的NaHA 溶液显酸性C .NaHA 溶液中:()()()()22OH A H H A c c c c --++=+D .pH 从1.2变化至4.2的过程中,()()22c H A c A -先增大后减小5.(2021·广东汕头市·高三一模)室温下,向 100mL 饱和 H 2S 溶液中通入 SO 2气体(气体体积换算成标准状况),发生反应: 222=2H S SO 3S 2H O +↓+,测得溶液 pH与通入 SO 2的关系如图。
溶液中离子反应图象题的答题技巧(选择题)1.室温下,将0.10 mol·L-1盐酸滴入20.00 mL 0.10 mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。
已知:pOH=-lg c(OH-),下列说法正确的是( )A.M点所示溶液中c(N)+c(NH3·H2O)=c(Cl-)B.N点所示溶液中溶质一定含NH4Cl,可能还含HClC.Q点消耗盐酸的体积等于氨水的体积D.Q点所示溶液中c(N)>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+)【解析】选B。
M点溶液呈碱性,为NH4Cl、NH3·H2O混合溶液,溶液中c(N)+c(NH3·H2O)>c(Cl-),故A错误;N点溶液呈酸性,溶液中溶质一定含NH4Cl,可能还含HCl,故B正确;恰好反应得到NH4Cl溶液呈酸性,Q点溶液呈中性,氨水稍过量,故C错误;Q 点溶液呈中性,则c(H+)=c(OH-),根据电荷守恒可知:c(N)=c(Cl-),正确的离子浓度大小为c(N)=c(Cl-)>c(H+)=c(OH-),故D错误。
2.常温下,浓度均为0.10 mol·L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,AG[AG=lg]随lg的变化如图所示。
下列叙述正确的是( )A.a、b溶液中导电离子数目相等B.水的电离程度:a<b<cC.d点所示溶液的AG=8D.与等浓度的NaOH溶液中和时,c点消耗NaOH溶液的体积大于a点【解析】选C。
a、b两点的pH相同,即氢离子浓度相同,由于溶液的体积不同,所以a、b溶液中导电离子数目不相等,故A错误;氢离子浓度越大,水的电离程度越小,则水的电离程度:a=b<c,故B错误;0.1 mol·L-1的HX中AG=12,则c(H+)=0.1 mol·L-1,完全电离,属于强酸,lg=2,则溶液的体积扩大100倍,所以c(H+)=0.001 mol·L-1,则d点所示溶液的AG=8,故C正确;开始时两种酸的浓度相同,等体积时,酸的物质的量相同,所以消耗的NaOH相同,故D错误。
专题跟踪检测(十五) 有关水溶液中离子平衡的图像分析1.某温度下,HNO 2和CH 3×10-4×10-5。
将pH 和体积均相同的两种酸溶液分别稀释,其pH 随加水体积的变化如图所示。
下列叙述正确的是( )A .曲线Ⅰ代表HNO 2溶液B .溶液中水的电离程度:b 点>c 点C .从c 点到d 点,溶液中c (HA )·c (OH -)c (A -)保持不变(其中HA 、A -分别代表相应的酸和酸根离子)D .相同体积a 点的两溶液分别与NaOH 恰好中和后,溶液中n (Na +)相同解析:选C 由K a (HNO 2)>K a (CH 3COOH)可知,酸性HNO 2>CH 3COOH 。
A 错:pH 相同的两种酸稀释相同倍数时,酸性强的酸pH 变化大,所以曲线Ⅱ为HNO 2。
B 错:b 、c 两点处,b 点酸性强,对水的电离抑制程度大,所以水的电离程度:c 点>b 点。
C 对:从c点到d 点,c (HA )·c (OH -)c (A -)=c (HA )·c (OH -)·c (H +)c (A -)·c (H +)=K W K a ,K W 和K a 是两个常数,只要温度不变,比值也不变。
D 错:a 点pH 相同,则CH 3COOH 的浓度大,恰好中和时消耗的NaOH 多,所以溶液中n (Na +)多。
2.电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点。
如图是某同学用0.1 mol·L-1 KOH 溶液分别滴定体积均为20 mL 、浓度均为0.1 mol·L -1的HCl 和CH 3COOH 溶液滴定曲线示意图(混合溶液体积变化忽略不计)。
下列有关判断不正确的是( )A .曲线①代表0.1 mol·L -1 KOH 溶液滴定CH 3COOH 溶液的滴定曲线,曲线②代表0.1 mol·L -1 KOH 溶液滴定HCl 溶液的滴定曲线B .在相同温度下,C 点水电离的c (H +)大于A 点水电离的c (H +)C .在A 点的溶液中有:c (CH 3COO -)+c (OH -)-c (H +)=0.05 mol·L -1D .在B 点的溶液中有:c (K +)>c (OH -)>c (CH 3COO -)>c (H +)解析:选B 由图像中A 、C 两点分别表示KOH 与CH 3COOH 、KOH 与HCl 恰好完全反应,由于CH 3COOK 水解使溶液呈碱性,促进了水的电离,而KCl 不水解,溶液呈中性,所以C 点水电离的c (H +)小于A 点水电离的c (H +),故B 错误。
专题07 离子反应图像1.已知向溶液X中滴加溶液Y可生成两种沉淀,所得沉淀的物质的量(n)与所加入的溶液Y的体积(V)的关系如图所示,则X、Y分别为()【答案】A2.下列示意图与对应的反应情况正确的是()A.含0.01 mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2B. NaHSO4溶液中逐滴加入Ba(OH)2溶液C. KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液D.向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸【答案】B【解析】A选项,首先CO2先与Ca(OH)2反应,再和KOH反应,当反应完全之后再和沉淀CaCO3反应,生成碳酸氢钙;B选项,NaHSO4溶液中逐滴加入Ba(OH)2溶液,只产生硫酸钡沉淀;C选项,1 mol KAl(SO4)2,加入1.5 mol 的Ba(OH)2时生成1.5mol BaSO4和1 molAl(OH)3,沉淀的物质的量最大为2.5 mol,再加入0.5 mol Ba(OH)2,生成0.5 mol BaSO4,溶解1 mol Al(OH)3;D选项,含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸,盐酸先和氢氧化钠反应,在NaAlO2与HCl的物质的量之比为小于等于1︰1,此时只生成白色的氢氧化铝沉淀,如果继续加入盐酸,这是沉淀开始溶剂,当NaAlO2与HCl的物质的量之比达到1︰4时,所产生的氢氧化铝完全溶解。
A选项,首先CO2先与Ca(OH)2反应,产生CaCO3沉淀,此时沉淀量逐渐增大,CO2再和KOH反应,此时无沉淀,之后二氧化碳先会和K2CO3反应,生成酸式盐,当反应完全之后再和沉淀CaCO3反应,生成碳酸氢钙,从而沉淀出现溶解现象,所以图像应该是“等腰梯形”的形状,故A错误;B选项,NaHSO4溶液中逐滴加入Ba(OH)2溶液,只产生硫酸钡沉淀,当把硫酸根反应完全,再加氢氧化钡也不产生沉淀,所给图像恰好能表达该反应过程,故B选项正确;C选项,假设溶液中含1 mol KAl(SO4)2,加入1.5 mol 的Ba(OH)2时生成1.5mol BaSO4和1 molAl(OH)3,沉淀的物质的量最大为2.5 mol,再加入0.5 mol Ba(OH)2,生成0.5 mol BaSO4,溶解1 mol Al(OH)3,故沉淀的总物质的量减少,最后只剩下硫酸钡沉淀,故C错误;D选项,含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸,盐酸先和氢氧化钠反应,在NaAlO2与HCl的物质的量之比为小于等于1︰1,此时只生成白色的氢氧化铝沉淀,如果继续加入盐酸,这是沉淀开始溶剂,当NaAlO2与HCl的物质的量之比达到1︰4时,所产生的氢氧化铝完全溶解,离子方程式如下,H++AlO2-+ H2O = Al(OH)3↓; Al(OH)3+3H+ = Al3+ + 3H2O故曲线应该是加入1份盐酸时沉淀达到最大,再加入3份盐酸沉底全部消失,图像应该是个“非等腰三角形”,与D所给图像不符合,故D错误。
离子反应图像题专题训练一、金属及其化合物反应图像【例1】把一块镁铝合金投入到1mol•L-1盐酸中,待合金完全溶解后,再往溶液里加入1mol•L-1NaO H溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是()A.盐酸的体积为80mL B.a的取值范围为0≤a<50C.n(Mg2+)<0.025mol D.当a值为30时,b值为0.01【例2】某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、Al O2—、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是( )A.原混合溶液中的CO32-与AlO2—的物质的量之比为1:2B.V1:V2=l:5 C.M点时生成的CO2为0、05molD.a曲线表示的离子方程式为:AlO2—+H++H2O=Al(OH)3↓1.下列实验过程中沉淀的物质的量Y与加入试剂的量X关系正确的是A.向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡ﻫB.向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡ﻫC.向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液直至过量ﻫD.向NaOH、Ba(OH)2、NaA1O2的混合溶液中逐渐通入二氧化碳至过量2.向含Al2(SO4)3和 AlCl3的混合溶液中逐滴加入1 mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )A.图中C点铝元素存在形式是AlO2-B.向D点溶液中通入CO2气体,立即产生白色沉淀C.原混合液中c[Al2(SO4)3]:c(AlCl3)=1:2D.OA段反应的离子方程式为:Ba2++2Al3++8OH-+3SO43-=BaSO4↓+2AlO2-+4H2O3.有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验: ①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g。
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。
根据上述实验,以下推测不正确的是 A.原溶液一定不存在H+、Cu2+、CO32- B.不能确定原溶液是否含有K+、NO3- C.实验所加的NaOH的浓度为2mol·L-1D.原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:24.如图表示Al Cl 3溶液与NaO H溶液相互滴加过程中微粒的量的关系曲线,下列判断错误的是( ) A.①线表示Al 3+的物质的量的变化 B.x 表示Al Cl 3的物质的量ﻫC.③线表示Al(OH )3的物质的量的变化 D.④线表示AlO 2-的物质的量的变化5.某稀溶液中含有等物质的量的Zn SO 4、Fe 2(SO 4)3、H 2SO 4、C uSO4,向其中逐渐加入铁粉。
下列各图表示溶液中F e2+的物质的量和加入铁粉的物质的量之间的关系,其中可能正确的是 123454321n (Fe 2+)123454321n (Fe 2+)123454321n (Fe 2+)123454321n (Fe 2+)A B C D6.1L某混合溶液中,溶质X 、Y 浓度都为0.1mo l/L ,向混合溶液中滴加某溶液Z (0.1mol/L 氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z 分别是A .氯化铝、氯化铁、氢氧化钠B .氯化铝、氯化镁、氢氧化钠C .偏铝酸钠、氢氧化钡、硫酸 D.偏铝酸钠、氯化钡、硫酸7.在某无色溶液中缓慢滴加Na OH 溶液直到过量,产生沉淀的质量与加入N aO H溶液体积关系如图。
由此确定,原溶液中含有的阳离子可能是A.Mg 2+、Al 3+、Fe 2+ B.H +、Mg 2+、A l3+ C.H +、B a2+、Al 3+ D.Mg 2+、Al 3+ 8.向NaOH 和NaAlO 2的混合液中不断滴加盐酸,下列图象中,能正确表示上述反应的是(横坐标表示加入HCl 溶液的体积,纵坐标表示反应生成沉淀的质量)( )A. B. C.D.9.将盐酸溶液逐滴滴入Na OH 、NaAlO 2、Na 2CO 3的混合溶液中,下列图象能正确表示溶液中反应的是( )ﻫA. B.C .D. 10. 在一定量的稀HNO 3中慢慢加入铁粉,得到的F e2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示。
请将正确答案的序号填在相应的横线上。
(1)AB 段铁元素以_____形式存在。
(2)BC 段铁元素以________形式存在。
(3)CD 段铁元素以________形式存在。
(1) ① (2)④ (3)③ﻫ二、非金属及其化合物的有关反应图像【例1】向100mLNaOH溶液中,通入一定量CO2后,然后向该溶液中逐滴加入1mol.L-1硫酸,所加入硫酸溶液体积与产生CO2体积关系如图所示:ﻫ(1)通一定量CO2后,溶液中溶质为______(填化学式). (2)AB段反应的离子方程式为______.(3)当加入45mL硫酸溶液时,产生CO2的物质的量为______.(4)计算原氢氧化钠浴液的物质的量浓度______.(1)NaOH、Na2CO3;(2)HCO3-+H+═H2O+CO2↑; (3)0.04mol; (4)0.9mol/L.【例2】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(已知硝酸被还原为NO气体).下列分析或结果错误的是( )ﻫA、原混合酸中NO3-物质的量为0.2molB、OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气ﻫC、第二份溶液中最终溶质为FeSO4D、H2SO4浓度为4mol·L-11.将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为()2.向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。
下列判断正确的是A.在0-a范围内,只发生中和反应B.ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑C.a=0.3 D.原混合溶液中NaOH与Na2CO3的物质的量之比为1:23.往含0.2molNaOH和0.1molCa(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为6.72L(标准状况下)时立即停止,则这一过程中,溶液中离子的物质的量和通入CO2气体的体积关系正确的图象是(气体的溶解忽略不计)( )A. B.C.D.4.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。
则下列有关说法中,不正确的是( ) A.还原性:I->Fe2+>Br-B.原混合溶液中FeBr2的物质的量为6molC.当通入2molCl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2==2Fe3++I2+4Cl- D.原溶液中:n(Fe2+)∶ n(I-)∶ n(Br-)=2∶1∶35.某反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质,在反应过程中测得ClO和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )A.还原剂是CN-,氧化产物只有N2B.氧化剂是ClO-,还原产物是HCO3-C.配平后氧化剂与还原剂的计量系数之比为5:2D.标准状况下若生成2.24LN2,则转移电子0.5mol6.将2.32g Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1 mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如下图所示,下列说法中错误的是( )A.OA段发生反应的离子方程式为:H++OH-===H2O CO32-+H+==HCO3-B.当加入35mL盐酸时,产生CO2的体积为224mLC.A点溶液中的溶质为NaC1、NaHCO3 D.混合物中NaOH的质量0.60g7.将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化如右图。
下列说法正确的是( )A.苛性钾溶液中KOH的质量是4.94gB.反应中转移电子的物质的量是0.21molﻩC.氧化性ClO-<ClO3- D.ClO3-的生成是由于温度升高引起的8.向100ml0.1mol/L的硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol的Ba(OH)2随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如右图所示.则下列说法中正确的是A.a点溶液中大量存在的离子有NH4+和SO42-B.b点溶液中c(NH3.H2O)约为0.1mol·L-1C.a→b过程中,参与反应的只有SO42-D.b→c过程中,参与反应的是Al(OH)3和NH4+9.将CO2气体缓缓地通入到含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示。
下列关于整个反应进程中的各种描述不正确的是( )A.O~A段反应的化学方程式是Ba(OH)2+CO2=BaCO3↓+H2OB.B~C段反应的离子方程式是2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-C.A~B段与C~D段所发生的反应相同D.D~E段沉淀的减少是由于碳酸钡固体的消失所致10已知向某碳酸盐溶液中滴加稀盐酸至过量,生成气体的质量(m)与加入盐酸的体积(V)的关系如图一所示.现将1.12g KOH和1.38g K2CO3混合并配成溶液,向其中滴加稀盐酸,图二是甲、乙、丙三位同学分别绘制的产生气体的质量(m)与稀盐酸的体积(V)的关系的示示意图.下面判断正确的是( )A.甲图正确ﻩB.乙图正确C.丙图正确ﻩ D.无法判断。