一次性使用无菌溶药注射器__带针
- 格式:doc
- 大小:109.35 KB
- 文档页数:10

一次性使用无菌溶药注射器说明书
[主要结构、性能] :本产品由外套、芯杆、橡胶活塞及一次性使用侧孔针或斜面针组成。
其物理、化学、生物性能符合xxxxxxxxxx标准的规定。
[适用范围] :供抽吸液体、溶解药液用。
产品规格有:20mL 、30mL 、50mL;
配针规格1.2mm、1.6mm。
注册号:X食药监械(准)字xxxx第xxxxx号
生产许可证号:
[禁忌症、注意事项、警示及提示说明] :
1、本品经环氧乙烷灭菌,无菌、无热原。
打开小包装应立即使用。
2、使用时,应检查小包装是否完整;如包装破损,禁止使用。
3、本品仅供一次性使用,用后销毁(用毁型器销毁)。
4、超过失效日期(失效日期见小包装封口处)禁止使用。
5、本品禁止抽取血液及人体注射用。
xxxxx医疗器械有限责任公司
(注册、生产)地址:xxxxxxxxxxxxxxxx
售后服务单位:xxxxxxxxxxxxxxxxxxxxxxxxxxxx
电话:xxxxxxxxxxxxx x
传真:xxxxxxxxxxxx 邮编:xxxxxxxxxxxx。
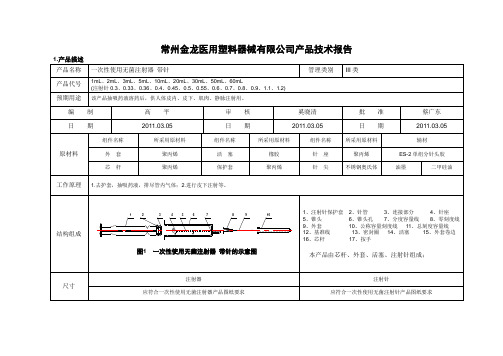
常州金龙医用塑料器械有限公司产品技术报告2.与已上市的产品比较序号项目内容春光已注册的一次性使用无菌注射器带针本公司申报的一次性使用无菌注射器带针01 标准医疗器械注册产品标准医疗器械注册产品标准02 材质主材:聚丙烯、活塞、不锈钢针管主材:聚丙烯、活塞、不锈钢针管辅材:ES-2单组分针头胶、油墨、二甲硅油辅材:ES-2单组分针头胶、油墨、二甲硅油03 结构组成芯杆、外套、活塞、注射针芯杆、外套、活塞、注射针04 工作原理 1.去护套,抽吸药液,排尽管内气体;2.进行皮下注射等。
1.去护套,抽吸药液,排尽管内气体;2.进行皮下注射等。
05 制造工艺流程注:1.本图为一次性使用无菌注射器带针工艺流程图;2.绿色□为十万级洁净区;3.□为一次性使用注射器配套用注射针生产工艺流程;4.外购协件为:PE包装、仿透析纸、PP、PE共挤医用包装膜、橡胶活塞;5.注塑、印刷、粗洗、组装为关键工序控制点;6.精洗、封口、灭菌为特殊过程7.原材料选择与组成见下表。
注:1.本图为一次性使用无菌注射器带针工艺流程图;2.绿色□为十万级洁净区;3.□为一次性使用注射器配套用注射针生产工艺流程;4.外购协件为:PE包装、仿透析纸、PP、PE共挤医用包装膜、橡胶活塞;5.注塑、印刷、粗洗、组装为关键工序控制点;6.精洗、封口、灭菌为特殊过程7.原材料选择与组成见下表。
3.产品命名一次性使用无菌注射器带针在国际、国内均属成熟产品,国际、国内标准化组织未制定一次性使用无菌注射器带针的相关标准;根据《中华人民共和国标准化法》规定,参照GB15810一次性使用无菌注射器修订稿、GB15811-2001一次性使用无菌注射针标准特制定《一次性使用无菌注射器带针医疗器械注册产品标准》,作为企业组织生产和经营活动的依据。
满足医疗器械行业及企业的检测及有效控制。
4.原材料控制4.1聚丙烯原材料名称聚丙烯供应商编号2011004化学结构式/分子式原材料代号GM1600E 符合标准YY/T0242-2007商品名聚丙烯树脂分子量分布不详供应商名称中国石化上海石油化工股份有限公司组成比例不详物理性能外观色粒0个/kg 弯曲模量:≥1.250Mpa 熔体质量流动速率±0.2n 悬臂梁缺口冲击强度(23℃) ≥2.0kj/m2密度≤0.91g/cm3雾度≤15拉伸屈服应力≥30Mpa化学性能生物性能重金属含量≤1.0镉含量<0.1细胞毒性、皮肤致敏、皮内反应、急性全身毒性、热原、溶血酸碱度≤1.0紫外吸光度≤0.084.2活塞原材料名称活塞供应商编号2011020 符合标准YY/T0243-2003 原材料代号不详化学结构式/分子式不详分子量分布不详商品名一次性使用无菌注射器用活塞原材料组成比例供应商名称常州京林医疗器械有限公司材料名称分子式比例% 材料名称分子式比例%物理性能外观1.不得有胶丝、胶屑、外来杂质、喷霜;天然橡胶(C5H8)n 55 氧化锌ZnO 3.02.外观色泽应均匀,表面不得有明显气泡、缺胶、切损、偏心;碳酸钙CaCO335抗氧剂2246C23H32O20.83.密封圈侧面顶部应有清晰的边缘基准线、基准线应完整、与注射器外套内表面接触应紧密;炭黑 C 4.0促进剂TMTMC6H12N2S30.54.修边部位的直径应不大于活塞密封圈直径;硫磺S 1.75.无泛黄现象。

一次性使用无菌溶药器带针生物学评价报告评价者:评价产品:一次性使用无菌溶药器带针1 产品简介1.1本产品合用于临床加药和溶药使用。
1.2本产品型式为偏头式,其结构为三件式,由外套、芯杆、橡胶活塞组成。
溶药针由针座、针管、护套组成。
1.3 产品与人体直接接触需进行生物学评价部分为:本产品不与人体直接接触,只是与药液接触。
采用医用聚丙烯、天然橡胶和医疗器械用不锈钢针管304 ( 0Cr18Ni9 ) 为主要原料、选用符合医用要求的聚二甲基硅氧烷润滑剂制成。
2 材料组成部份供方为XXXXX有限公司,该公司为塑料粒子的专营公司,其经营的聚丙烯符合YY/T0242 —2022 《医用输液、输血、注射器用聚丙烯专用料》的聚丙烯。
该材料采用医用级无毒塑料,对人体无害并能满足标准规定。
2.1原料型号:牌号为701.2.2原料来源: XXXX有限公司2.3技术要求各项性能指标应符合YY/T0242—2022 《医用输液、输血、注射器用聚丙烯专用料》标准中有关规定。
每批次进料,粒料供方均提供符合YY/T0242—2022 《医用输液、输血、注射器用聚丙烯专用料》标准3.1、3.2、3.3、3.4条要求的出厂检验报告,我公司对每批进料按YY/T0242—2022 《医用输液、输血、注射器用聚丙烯专用料》标准 3.1、3.2、3.3、3.4 条的规定进行检验。
3 材料理化特性信息3.1外观要求按SH/T1541进行,医用级聚丙烯为本色粒料。
3.2包装要求医用聚丙烯专用料应至少采用双层包装,包装应保证在产品运输、贮存时不被污染。
(聚丙烯的供方资质及《检验报告》见附件3。
针管不锈钢在最新标准中称为06Cr19Ni10 号钢。
0Cr18Ni9 钢(AISI304) 是奥氏体不锈钢,是在最初发明的18-8 型奥氏体不锈钢的基础上发展演变的钢种,该钢是不锈钢的主体钢种,钢的奥氏体结构赋予了它的良好冷、热加工性能、无磁性和好的低温性能。

初始污染菌验证方案、报告文件编号:起草人:质管部:日期:审核人:质管部:日期:批准人:日期:有限公司1 验证目的:为减少初始污染菌对产品的影响,更有效的控制产品质量,对一次性使用无菌溶药器、一次性使用无菌注射器带针、一次性使用输液器带针、一次性使用静脉输液针、一次性使用延长管产品的初始污染菌进行控制。
2 验证依据GB15980—1995《一次性使用医疗用品卫生标准》3 验证小组:负责验证过程的组织指导工作。
:负责验证现场人员的安排组织工作。
:负责验证过程检测工作。
4 验证方案在有效环境监控下,任意连续三批取产品进行初始污染菌检测5 验证方法使用仪器设备:压力蒸汽灭菌器、超净工作台、天平、HH.B11.360型电热恒温培养箱,202—A0型台式干燥箱(以上设备经上海市计量测试技术研究院检定合格)以及试管、培养皿Φ9cm、刻度吸管、有盖广口瓶、玻璃注射器、营养琼脂(均经无菌处理)。
操作步骤:制备检验液,取产品剪碎后浸泡在有100ml灭菌生理盐水的有盖广口瓶中,充分震荡后制备成1:10的检验液,用灭菌吸管吸取2ml,分别注入到两个灭菌平皿内,每皿1ml,另取1ml 注入到9ml灭菌生理盐水试管中,更换1支吸管,并充分混匀,使成1:100稀释液。
吸取2ml,分别注入到两个灭菌平皿内,每皿1ml,另取1ml注入到9ml灭菌生理盐水试管中,更换1支吸管,并充分混匀,使成1:1000稀释液.将溶化并冷至45℃—50℃的营养琼脂培养基傾注于平皿内,每皿约15ml,另倾注一个不加样品的灭菌空平皿,作空白对照。
随即转动平皿,使样品与培养基充分混合均匀,待琼脂凝固后翻转平皿,置30℃—35℃培养箱内培养48小时。
6 验证确认:通过3批对产品的初始污染菌检测,确认每批产品初始污染菌在有效的环境监控下是能达到要求的。
7 方案会签表1.验证目的:为减少初始污染菌对产品的影响,更有效的控制产品质量,对一次性使用无菌溶药器、一次性使用无菌注射器带针、一次性使用输液器带针、一次性使用静脉输液针、一次性延长管5个产品的初始污染菌进行控制。


YZB 医疗器械注册产品标准YZB/XXXX-2014 一次性使用无菌溶药器带针2014年5月2日发布2014年5月18日实施XXXX医疗器械有限公司发布前言本标准编写格式按GB/T1.1-2000《标准化工作导则第一部分:标准的结构与编写规则》编写。
本标准起草过程主要按照YY/T0821-2010《一次性使用配药用注射器》同时参照GB15810—2001《一次性使用无菌注射器》、GB15811-2001《一次性使用无菌注射针》和GB18457-2001《制造医疗器械用不锈钢针管》进行编写。
本标准与YY/T0821-2010《一次性使用配药用注射器》的主要技术差异:增加环氧乙烷残留量的要求、产品灭菌要求和检验规则。
附录A和附录B为规范性附录。
本标准由XXXX医疗器械有限公司提出。
本标准由XXXX医疗器械有限公司负责起草。
本标准主要起草人:Ⅱ目次前言 (Ⅱ)1、范围 (1)2、规范性引用文件 (1)3、术语和定义 (1)4、分类与命名 (1)5、要求 (2)6、试验方法 (3)7、标志 (5)8、贮存 (6)9、灭菌 (6)附录A (规范性附录)检验规则 (7)附录B (规范性附录)材料指南 (9)Ⅰ一次性使用无菌溶药器带针1 范围本标准规定了一次性使用无菌溶药器带针 (以下简称溶药器带针) 的分类与命名、要求、试验方法、检验规则、标志、贮存。
本标准适用于一次性使用无菌溶药器带针,该产品供临床溶药和加药使用。
2 规范性引用文件下列标准中的条款,通过本标准的引用而成为本标准的条款所包含的条文,凡是注明日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准。
然而,鼓励根据本标准达成协议的各方面研究是否可使用这些最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T191-2008 包装储运图示标志GB/T1962.1-2001 注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第1部分:通用要求GB/T1962.2-2001 注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第2部分:锁定接头GB/T2828.1-2003 计数抽样检验程序第1部分按接收质量限(AQL)检索的逐批检验抽样计划GB/T2829-2002 周期检验计数抽样程序及表(适用于对过程稳定性的检验)GB6682-2008 分析实验室用水规格和试验方法GB8368-2005 一次性使用输液器重力输液式GB/T14233.1-2008医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T14233.2-2005医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB15810-2001 一次性使用无菌注射器GB15811-2001 一次性使用无菌注射针GB/T16886.1-2011 医疗器械生物学评价第1部分:风险管理过程中评价与试验GB18279-2000 医疗器械环氧乙烷灭菌确认与常规控制GB18457-2001 制造医疗器械用不锈钢针管YY/T0242-2007 医用输液、输血、注射器用聚丙烯专用料YY/T0243-2003 一次性使用无菌注射器用活塞YY/T0296-1997 一次性使用注射针识别色标YY/T0313-1998 医用高分子制品包装、标志、运输和贮存YY/T0466.1-2009 医疗器械用于医疗器械标签、标记和提供信息的符号第1部分通用要求YY/T 0821-2010 一次性使用配药用注射器《医疗器械说明书、标签和包装标识管理规定》3 术语和定义溶药器带针应符合YY/T0821-2010 3的要求4 分类和命名1溶药器带针应符合YY/T0821-2010 4的要求5 要求5.1溶药器外观溶药器应符合YY/T0821-2010 5.1的要求。

1、目的通过检验产品的初始污染菌,了解产品在生产过程中受微生物的情况,以便更好地提高产品质量。
2、范围本方法适用于本公司生产的一次性使用静脉输液针(简称:输液针)、一次性使用无菌配药注射器带针(简称:配药注射器)、一次性使用无菌注射器带针(简称:注射器)、一次性使用输液器带针(简称:输液器)、一次性使用袋式输液器带针(简称:袋式输液器)及其配件、无菌产品初始包装等的初始污染菌的检验。
3、依据GB 15979-2002 一次性使用卫生用品卫生标准中华人民共和国药典2010版第二部GB 8368 一次性使用输液器GB/T 19973.1-2005 (ISO 11737-1:1995)医疗器械的灭菌微生物学方法第1部分:产品上微生物总数的估计GB 15980 一次性使用医疗用品卫生标准4、要求灭菌产品管道类内腔污染菌数:应≤10cfu/件次,外部应≤100cfu/件次;非管道类应≤100cfu/件次;敷料类应≤100cfu/g;消毒产品应≤1000cfu/件次或重量(g),具体见表1。
5 检验方法5.1卵磷脂、吐温80-营养琼脂培养基的配制:成份:蛋白胨 20 g牛肉膏药 3 g氯化钠 5 g琼脂 15 g卵磷脂肪 1 g吐温80 7 g蒸馏水 1000 g制法:先将卵磷脂加到少量蒸馏水中,加热溶解,加入吐温80,将其他成分(除琼脂外)加到其余的蒸馏水中,溶解。
加入已溶解的卵磷脂、吐温80,混匀,调pH值为7.1~7.4加入琼脂,121℃高压灭菌20min,储存于冷暗处备用。
5.2 样品采样数量:各类产品每批随机抽取10件样品。
5.3 供试液制备5.3.1.供试品是敷料、可以破坏性类可用无菌手续称取10g,放入100ml灭菌生理盐水中充分振荡后取样。
作为1:10的供试液。
5.3.2.供试品是液体取10ml加至100ml灭菌生理盐水中充分振荡后取样。
作为1:10的供试液。
5.3.3.对供试品不能采用破坏性取样可用浸有无菌生理盐水拭子涂抹采样,被采表面积为100cm2,加入灭菌生理盐水100ml。
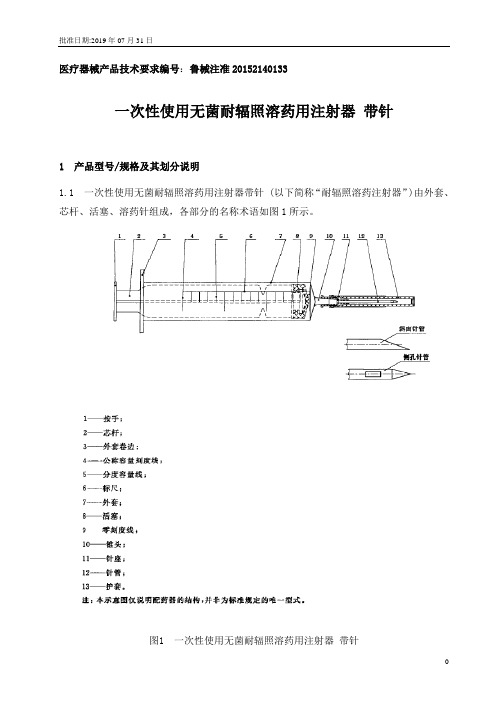
批准日期:2019年07月31日
医疗器械产品技术要求编号:鲁械注准20152140133
一次性使用无菌耐辐照溶药用注射器带针
1 产品型号/规格及其划分说明
1.1 一次性使用无菌耐辐照溶药用注射器带针 (以下简称“耐辐照溶药注射器”)由外套、芯杆、活塞、溶药针组成,各部分的名称术语如图1所示。
图1 一次性使用无菌耐辐照溶药用注射器带针
批准日期:2019年07月31日
1.2 针管按针尖型式分斜面针管(XZ)、侧孔针管(CZ);按管壁分薄壁(TW)、正常壁(RW)。
1.3 产品标记:耐辐照溶药注射器的标记以公称容量、针管公称外径、针管标称长度、针管管壁类型和针尖型式表示。
标记示例:1.2×33 TW CZ
溶药针针尖型式:侧孔溶药针
溶药针管壁类型:薄壁
溶药针标称长度:33mm
溶药针公称外径:1.2mm
1.4 材料
耐辐照溶药注射器和溶药针采用的主要材料见下表。
一次性使用无菌耐辐照溶药用注射器带针材料表
1.5 规格型号
耐辐照溶药注射器型式为中头式、偏头式。
耐辐照溶药注射器的公称容量为5mL、10mL、20mL、30mL、50mL。
溶药针的规格按公称外径分别为0.9mm、1.1mm、1.2mm、1.4mm、1.6mm、1.8mm、2.1mm、2.4mm、2.7mm、3.0mm、3.4mm。


A 注射输液类序号名称规格备注A1一次性使用无菌注射器(带针)1mlA2一次性使用无菌注射器(带针)2mlA3一次性使用无菌注射器(带针)5mlA4一次性使用无菌注射器(配齿科针)5ml配牙科冲洗用针头A5一次性使用无菌注射器(不带针)5mlA6一次性使用无菌注射器(带针)10mlA7一次性使用无菌注射器(配齿科针)10ml配牙科冲洗用针头A8一次性使用无菌注射器(不带针)10mlA9一次性使用无菌注射器(带针)20mlA10一次性使用无菌注射器(带针)30mlA11一次性使用无菌注射器(带针)50mlA12一次性使用无菌注射器(带针)60mlA13一次性使用溶药注射器20mlA14一次性使用溶药注射器50mlA15自毁式一次性使用无菌注射器A16一次性使用无菌避光注射器A17一次性使用胰岛素注射器A18胰岛素注射针头A19一次性使用无菌注射针A20一次性使用无菌侧孔注射针A21一次性使用静脉输液针A22普通一次性使用无菌输液器钢针、斜孔针A23普通一次性使用无菌输液器钢针、侧孔针A24普通一次性使用无菌输液器普通塑针A25一次性避光输液器A26一次性精密(精细)过滤输液器注明介质孔径和膜材质A27一次性精密(精细)过滤避光输液器注明介质孔径和膜材质A28一次性使用空气净化输液器 带针A29一次性自动止液输液器A30一次性使用输血器A31一次性使用静脉留置针有延长连接管路、普通型A32一次性使用静脉留置针无延长连接管路、普通型注明是否带翼,是否带药壶A33一次性使用静脉留置针防逆流A34一次性使用静脉留置针安全型A35一次性使用静脉留置针正压无针接头A36一次性使用动脉留置针A37普通输液接头A38无针输液接头A39输液恒速调节器A40一次性使用三通A41一次性使用肝素帽A42一次性使用输液延长管A43一次性使用微量泵延长管A44微量泵泵前管A45一次性使用无菌避光延长管A46一次性使用输液加压袋A47一次性使用输液器 重力输液式(带针)A48一次性使用静脉营养输液袋(营养液用输液器)注明容量A49一次性动脉血气针A50一次性使用皮肤点刺针序号名称规格描述B001一次性普通单腔导尿管儿童用标明材质(塑料、橡胶、硅胶、乳胶、PVC、硅橡胶等)B002一次性普通双腔气囊导尿管儿童用标明材质(塑料、橡胶、硅胶、乳胶、PVC、硅橡胶等)B003一次性普通三腔气囊导尿管儿童用标明材质(塑料、橡胶、硅胶、乳胶、PVC、硅橡胶等)B 医用高分子类B004一次性普通单腔导尿管成人用标明材质(塑料、橡胶、硅胶、乳胶、PVC、硅橡胶等)B005一次性普通双腔气囊导尿管成人用标明材质(塑料、橡胶、硅胶、乳胶、PVC、硅橡胶等)B006一次性普通三腔气囊导尿管成人用标明材质(塑料、橡胶、硅胶、乳胶、PVC、硅橡胶等)B007一次性无痛导尿管B008一次性抗菌超滑导尿管B009一次性使用无菌菌状头导尿管B010一次性T型引流管各种规格B011胸腔穿刺导管B012一次性使用吸痰管普通型标明材质(塑料、橡胶、硅胶、乳胶、PVC、硅橡胶等)B013一次性使用吸痰管可控型B014一次性使用吸痰管密闭型B015医用鼻吸氧管挂耳、单塞注明材质B016医用鼻吸氧管挂耳、双塞注明材质B017医用鼻吸氧管不挂耳、单塞注明材质B018医用鼻吸氧管不挂耳、双塞注明材质B019医用鼻吸氧管一体式鼻氧管、湿化液、湿化瓶等B020吸氧面罩普通面罩式B021吸氧面罩普通鼻式B022吸氧面罩高浓度面罩式B023吸氧面罩高浓度鼻式B024高压氧用吸氧面罩包括面罩、三通阀、波纹管等B025浮标式氧气吸入器B026一次性使用简易呼吸器B027口/鼻腔冲洗器、喷雾器B028雾化面罩B029口含式雾化瓶/雾化器B030面罩式雾化瓶/雾化器B031口/鼻咽通气管道B032呼吸通路滤器(人工鼻)B033一次性喉罩含单腔、双腔B034一次性牙垫B035一次性医用咬口雾化器咬口、胃镜咬口等B036麻醉呼吸回路儿童用可伸缩B037麻醉呼吸回路儿童用不可伸缩B038麻醉呼吸回路成人用可伸缩B039麻醉呼吸回路成人用不可伸缩B040筒式吸舒B041一次性使用普通胃管标明材质(塑料、橡胶、硅胶、乳胶、PVC、硅橡胶等)B042一次性新生儿(婴儿)胃管/鼻饲管注明是否含导丝B043三腔双囊胃管B044一次性使用鼻胃管注明是否含导丝B045一次性使用鼻肠管B046一次性使用肠营养管B047一次性使用肠外营养液袋B048胸管带针B049胸管不带针B050胸腔引流瓶单腔注明容量B051胸腔引流瓶双腔注明容量B052胸腔引流瓶三腔注明容量B053一次性医用连接管各种规格 各种用途B054一次性流产吸引管B055一次性吸引连接管B056一次性使用引流管各种形状B057一次性使用引流袋B058一次性使用抗反流引流袋B059一次性使用体外引流容器(球、瓶)B060一次性使用负压引流装置B061封闭式负压引流系统B062高负压引流医用海绵B063高负压引流瓶B064高负压引流三通B065高负压引流管B066高负压封闭敷料B067冲洗灌注器各种形状B068一次性灌肠器B069一次性肛管B070冲洗管路/冲洗器含预充式B071一次性使用无菌灌肠袋注明容量规格B072一次性灌肠器注明容量规格B073一次性普通尿袋注明容量规格B074一次性精密尿袋B075一次性防逆流尿袋B076医用负压体液收集器注明容量规格B077洗胃管B078一次性使用精细药液过滤器C 卫生材料类序号名称规格描述C001医用脱脂棉(球)灭菌C002医用脱脂棉(球)非灭菌C003医用脱脂纱布切片灭菌C004医用脱脂纱布切片非灭菌C005医用脱脂纱布叠片灭菌C006医用脱脂纱布叠片非灭菌C007纱布绷带C008医用脱脂棉垫C009纱布手术巾C010纱布手术巾(X光显影)C011碘仿纱布(条)C012灭菌凡士林纱布C013脑棉片C014灭菌普通棉签标明棒材质(竹棒、木棒、塑料棒等)和长度C015非灭菌普通棉签标明棒材质(竹棒、木棒、塑料棒等)和长度C016消毒碘棉签C017妇科长棉签C018医用弹性绷带标明平纹或皱纹,精装或简装C019医用自粘绷带C020医用石膏绷带C021医用石膏绵纸C022医用高分子绷带C023医用高分子夹板C024酒精棉球C025石蜡棉球C026医用橡皮膏(氧化锌胶布)C027医用无纺布透气胶带C028PE膜基材透气胶带C029真丝胶带C030医用输液贴(无纺布)C031医用输液贴(PE膜)C032医用输液瓶口贴C033一次性使用手术巾C034一次性使用粘贴手术巾C035一次性使用洞巾C036一次性使用治疗巾C037一次性使用医用床单/中单标明尺寸 含CT床单C038一次性使用护理垫(消毒垫)标明是否灭菌,含看护垫、冲洗垫、尿垫、妇垫等C039一次性使用普通口罩大、中、小,注明层数C040一次性手术口罩C041N95口罩C042一次性使用帽子大、中、小C043一次性口罩、帽子套装C044一次性使用无菌手术衣大、中、小C045医用弹力网帽C046医用手术手套大、中、小C047医用乳胶检查手套大、中、小C048塑料薄膜手套大、中、小C049妇科外用抗菌器C050医用胶C051清创胶C052银离子敷料/外用剂C053纳米银敷料/外用剂C054无机物敷料C055生物多糖敷料/外用剂C056透明质酸钠敷料/外用剂C057医用几丁糖(壳聚糖及其衍生物)C058胶原蛋白敷料/外用剂C059聚乳酸敷料/外用剂C060藻酸盐敷料/外用剂C061次氯酸敷料/外用剂C062氨基酸敷料/外用剂含复方氨基酸及其衍生物C063卡波姆敷料/外用剂C064其他伤口敷料其他活性成分的伤口敷料C065泡沫敷料/外用剂C066水胶体敷料/外用剂C067水凝胶敷料/外用剂C068透明敷料/外用剂C069医用粘贴敷料C070可吸收止血材料不含止血海绵C071不可吸收止血材料C072皮肤保护膜/剂C073脐带护理敷料C074眼部敷贴C075眼科用重水C076生物羊膜C077眼科手术用硅油C078羟基磷灰石骨质填充材料(义眼台)C079眼内冲洗灌注液C080青光眼引流阀C081眼用全氟丙烷气体C082超声眼科晶状体摘除和玻璃体切除设备附件含玻切头、积液盒、注吸管等C083眼用粘弹剂C084同种异体皮烧伤植皮用C085异种异体皮烧伤植皮用C086一次性换药碗C087一次性换药包/盒标明包内容物C088一次性镊子C089一次性备皮刀C090一次性备皮包标明包内容物C091一次性介入包标明包内容物C092一次性流产包标明包内容物C093一次性产包标明包内容物C094脐带结扎包标明包内容物C095一次性无菌导尿包标明包内容物C096一次性吸痰包标明包内容物C097一次性手术包标明包内容物C098一次性妇科检查包标明包内容物C099眼科手术包标明包内容物C100一次性口腔检查包标明包内容物C101一次性无菌胸腔穿刺包标明包内容物C102一次性无菌腹腔穿刺包标明包内容物C103造瘘口袋C104造口底盘C105造口过滤片C106造口灌洗系统C107造口防漏条/膏D消毒类耗材序号名称规格D001医用消毒洗手液D002免洗消毒凝胶/消毒液D003皮肤消毒液(葡萄糖酸氯已定和乙醇)D004过氧化氢灭菌剂D005新洁尔灭(苯扎溴铵)D006洗必泰(氯己定)D007医用含氯消毒片D008三效热原灭活消毒剂D009次氯酸钠消毒剂(84消毒液)D010氧氯灵消毒剂D011无菌石蜡油D012环氧乙烷消毒剂D013甲醛溶液D01495%乙醇D01575%乙醇D016白凡士林D017黄凡士林D018酶酚皂溶液D019碘伏类消毒剂D020过氧乙酸D021呋喃西林溶液D022双氧水D023戊二醛消毒剂D024含碘消毒液D025二氯异氰尿酸钠消毒片D026纸塑包装袋D027灭菌包装袋D028灭菌指示标签D029灭菌指示胶带D030环氧乙烷综合灭菌指示胶带D031灭菌指示卡D032环氧乙烷综合指示条D033化学综合灭菌指示条D034生物指示剂D035高压灭菌生物指示剂D036EO快速生物指示剂D037嗜热菌片D038枯草杆菌片D039等离子指示卡D040综合测试包D041生物指示包D042BD测试纸D043BD测试包D044戊二醛测试卡D045紫外线强度测试卡D046测氯试纸(卡)D047多酶清洗液D048速效多酶清洗液D049清洗剂D050润滑剂D051漂洁上光剂D052除锈剂D053透析机消毒液E 医用X射线附属耗材序号名称规格E001医用X光胶片(感蓝)E002医用X光胶片(感绿)E003医用CT(MR)胶片E004红外激光胶片E005干式胶片E006干式激光胶片E007激光彩色纸质胶片E008激光彩色PET胶片E009超声PACS医用诊断报告用胶片E010彩色多普勒波拉片E011乳腺定位针E012冲洗套药(显影、定影)液E013冲洗套药(显影、定影)粉E014一次性高压注射筒E015造影(高压)连接管E016医用DR胶片F 消化系统内窥镜诊断治疗用耗材编号产品名称规格说明及要求F001碎石网篮F002取石网篮F003内镜下高频电刀F004灌洗管F005鼻胆引流管F006鼻胰引流管F007造影导管含胆道等F008气囊导管F009一次性导丝F010气囊取石导管/取石器F011胆道气囊扩张导管F012金属胆道支架F013非金属胆道支架F014金属胰管内导管F015非金属胰管内导管F016非金属胰管支架F017金属胰管支架F018一次性加温毯F019碎石器手柄F020十二指肠乳头扩张装置F021十二指肠乳头测压装置F022金属捆绑支架F023非金属捆绑支架F024金属食道支架F025非金属食道支架F026金属肠道支架F027非金属肠道支架F028食道扩张球囊F029粘膜注射针F030止血夹子装置F031食道静脉曲张套扎器F032胰岛素泵输注装置及配套耗材F033三腔取石气囊F034内窥镜活检钳(取样钳)F035结扎器F036内镜下经皮胃造瘘器械(套)F037硬化治疗针F038食道超声保护套F039食道超声漂浮导管F040多囊多腔止血胃管F041PH监测导管F042支架推送器含胰管等F043支架回收器含胆道等F044胰管导丝F045细胞毛刷F046电凝管F047勒扎环F048异物钳F049一次性使用电圈套器F050喷洒导管F051勒扎圈丝F052透明粘膜吸套F053可变球囊扩张器F054贲门球囊扩张器F055食道探条式扩张器F056食道扩张导丝F057十二指肠金属支架F058结肠金属支架F059胰管内外引流支架F060胆道可变扩张球囊F061胆道扩张球囊F062胆道逐级扩张管F063探条式胰胆扩张管F064肠造瘘管F065PTCD内外引流管F066斑马导丝F067肠造瘘管推送导丝F068导丝锁定装置F069三腔切开刀F070针式切开刀F071一次性碎石器F072机械碎石篮套管F073结石取出器/取出球囊F074经皮穿刺套装F075胆道微穿刺系统F076内镜注射针F077电凝止血导管F078双腔脓肿引流管F079EMR粘膜透明套F080一次性使用套管穿刺器F081栓塞微粒球F082超薄球囊扩张导管F083腹腔外腔扩张器F084智能胶囊F085动脉取血栓导管F086颈动脉转流管G泌尿外科用耗材编号产品名称规格说明及要求G001活检针泌尿外科专用G002活检枪泌尿外科专用G003定位针G004套石篮G005球囊扩张导管输尿管球囊,肾造瘘球囊G006普通导丝G007斑马导丝G008尿道扩张器G009J型导管单J用于尿路支撑、引流G010J型导管双J用于尿路支撑、引流G011输尿管导管G012输尿导管套件G013输尿管双腔鞘G014输尿管支架G015环扎去除包皮专用器械G016一次性包皮环切吻合器G017气压弹道探针碎石用G018超声探杆碎石用G019膀胱穿刺造瘘针G020膀胱造瘘管G021等离子中置双极电极G022尿动力测压管G023肾导管G024剥皮鞘G025肾造瘘G026一次性导管鞘套装G027输尿管镜异物钳G028电切环G029支架推送器编号产品名称规格说明及要求H001一次性压舌板H002一次性止血带H003动脉止血带/止血器含桡动脉、股动脉止血H004一次性医用夹H005刮片标明材质(竹制、木制、塑料)H006男性拭子H007女性拭子H008节育器H009一次性使用阴道扩张器H010骨盆底修复系统H011无张力阴道悬吊带H012一次性肛门检查镜H013一次性导管/插管固定器H014一次性臭氧头H015电刀清洁片H016等离子刀头等离子系统配套用H017冷循环微波消融一次性刀头微波消融治疗仪配套H018各种仪器配套电极除省及卫生部集中采购的电极H019理疗敷贴各部位,止痛、止咳、冷热、中医、妇科、儿科等各种用途H020一次性血氧探头H021动态血糖探头与血糖系统配套H022超声耦合剂(I类注册证)注明包装规格H023超声耦合剂(II类注册证)H024润滑胶浆胃镜、肠镜用H025电切灌洗液H026等渗冲洗液H 其他耗材H027钠石灰H028钙石灰H029一次性针灸针H030一次性埋线针H031一次性使用活检针(全自动)除G001外H032一次性使用活检针(半自动)H033一次性使用活检针其他各种规格(包括超声导引、普通软组织、肝、肺、骨、乳腺等各种规格)H034一次性使用穿刺器H035射频针H036一次性使用外周神经丛刺激针与外周神经电刺激仪配套H037神经丛刺激针与神经丛刺激仪配套使用H038连续神经丛刺激针套件与神经丛刺激仪配套使用H039PTC-B针H040PTC-D针H041S型引流套管H042EV引流针导管H043弹力腰围H044腹带H045腰椎牵引带H046一次性胸带H047下肢牵引带H048锁骨固定带H049前臂吊带H050胫腓骨超踝支具H051肋骨固定带H052颈椎牵引架/带H053颈椎气囊牵引圈H054小腿牵引带H055前臂固定支具H056胫腓骨固定支具H057胫腓超踝支具H058桡骨腕部固定支具H059外翻桡骨固定支具H060股胫腓固定套H061超肩外科颈支具H062膝部下肢支具H063前臂超关节固定支具H064髁间托具H065肱骨外科颈支具H066踝骨固定支具H067掌背骨医用夹板H068铝合金指骨板H069胸部护板H070膝关节固定套H071胫腓超踝固定套H072加强型腕关节固定套H073克雷式固定套H074丁字鞋H075绑带(腕关节固定带/约束带)H076医用一次性消毒刷套H077静脉剥离器H078软组织扩张器H079耐高温真空泵机油等离子灭菌器用耗材H080一次性使用微创痔疮套扎器H081压力抗栓带(医疗压力带)H082一次性使用血液回收罐装置H083一次性氧气袋I 检验耗材编号产品名称规格说明及要求I001盖玻片I002载玻片I003痰杯I004尿杯I005竹签I006大便盒I007比色杯含:加比色膜I008比色管I009标本杯含:各种机型专用I010标本袋I011生化反应杯I012纤维杯I013血凝仪测量杯含:各种机型专用I014干化学稀释杯I015干化学仪器样品杯含:各种机型专用I016试管含:硬质、软质、单层、双层I017试管架I018离心管I019抗凝管I020甲胎蛋白异质体AFP-L3亲和吸附离心管I021冷冻管I022培养管含:带棉签I023培养皿I024一次性吸管I025一次性毛细吸管I026一次性吸头含:干化学仪器吸头及各种机型专用I027一次性移液枪吸嘴I028一次性使用定量采血吸管I029微量采血管I030真空采血器(玻璃)不同头盖颜色(红、黄、蓝、灰、黑、绿、紫等)及添加剂,应分别响应I031真空采血器(塑料)不同头盖颜色(红、黄、蓝、灰、黑、绿、紫等)及添加剂,应分别响应I032真空采血管配套用针I033普通采血针头含:泡沫采血针、可见回血针、输液式采血针、真空采血针(硬接、软I034加样系统一次性加样针I035大便留样管I036尿液采样管I037病毒采样管I038病毒采样盒I039PCR真空管I040血流变血沉压积管I041洗液瓶I042试剂瓶I043擦拭纸I044U型板I045平底板I046120孔梯形微板I047血型稀释板I048尿沉渣检测板I049尿沉渣管I050水处理机PP棉芯I051水处理机活性炭I052水处理机混床I053水处理机反渗透膜I054ADCL血凝盘I055干化学仪器保湿剂I056干化学仪器干燥剂I057试剂注射器I058全自动酶免分析及加样系统加样探针I059AXSYM-RV杯I060I2000-RV杯I061I2000特种蛋白比色杯I062I2000特种蛋白稀释杯I063显微镜油镜油I064二氧化碳生发管I065子弹头试管J 通用试剂编号产品名称英文缩写检验方法第一部分 凝血类试剂J001血浆凝血酶时间检测试剂TT手工法J002血浆凝血酶时间检测试剂TT仪器法J003血浆凝血酶原时间检测试剂PT手工法J004血浆凝血酶原时间检测试剂PT仪器法J006活化部分凝血酶原时间检测试剂APTT手工法J007活化部分凝血酶原时间检测试剂APTT仪器法J008抗凝血酶III活性检测试剂AT-IIIA手工法J009抗凝血酶III活性检测试剂AT-IIIA仪器法J010抗凝血酶III抗原检测试剂AT-IIIAg手工法J011抗凝血酶III抗原检测试剂AT-IIIAg仪器法J012纤维蛋白原检测试剂FIGJ013纤维蛋白检测试剂FgJ014血浆D-二聚体测试盒D-Dimer乳胶凝集法J015血浆D-二聚体测试盒D-Dimer各种免疫学方法J016葡萄糖-6-磷酸脱氢酶含NADP+氧化还原法第二部分 配血类试剂J017ABO血型鉴定试剂(含:儿童)J018ABO血型鉴定试剂(含:儿童)卡式法(含RhD)J019抗D(lgM)血型定型试剂J020凝聚胺试剂J021抗人球蛋白检测试剂(交叉配血卡)J022血型不完全抗体检测卡J023血型单特异性抗体鉴定试剂卡式法,抗红细胞不规则抗体筛查J024配血用低离子稀释液J025谱红细胞各种谱系J026标准ABO细胞第三部分 尿、粪、体液一般检查J027尿液干化学分析纸条多项J028尿糖试纸J029尿碘检测试剂J030尿钙检测试剂(含干化学法)J031尿锌检测试剂J032尿总蛋白检测试剂J033尿蛋白电泳试剂J034尿蛋白定性检测试剂J035尿蛋白定量检测试剂手工比色法J036尿蛋白定量检测试剂各种化学方法J037尿蛋白定量检测试剂免疫比浊法J038尿微量白蛋白检测试剂Malb各种免疫学方法J039尿微量白蛋白检测试剂Malb化学发光法J040尿微量白蛋白检测试剂Malb散射比浊法J041尿素氮检测试剂BUNJ042尿酸检测试剂UAJ043尿半乳糖检测试剂J044尿锭甙定量检测试剂J045粪便隐血检测OB化学法J046粪便隐血检测OB免疫法J047粪便隐血检测OB金标法J048N-乙酰-β-D氨基葡萄糖苷酶NAG第四部分 临床化学检查J049血清总蛋白检测试剂TP化学法J050血清总蛋白检测试剂TP干化学法J051血清白蛋白检测试剂ALb化学法J052血清白蛋白检测试剂ALb干化学法J053血清前白蛋白检测试剂PA免疫比浊法、化学发光法J054血清前白蛋白检测试剂PA其他方法J055血清转铁蛋白检测试剂TRF免疫比浊法、化学发光法J056血清转铁蛋白检测试剂TRF其他方法J057血清铁蛋白检测试剂Fer化学发光法J058血清铁蛋白检测试剂Fer各种免疫学方法J059脑脊液总蛋白检测试剂化学法J060脑脊液总蛋白检测试剂免疫比浊法、化学发光法J061脑脊液总蛋白检测试剂干化学法J062脑脊液白蛋白检测试剂免疫比浊法、免疫电泳法、化学发光法J063脑脊液总IgG检测试剂免疫比浊法、免疫电泳法、化学发光法J064脑脊液糖定量试剂(班氏试剂)J065α1-微量球蛋白检测试剂α1-MG各种免疫学方法J066α1-微量球蛋白检测试剂α1-MG化学发光法J067β2-微球蛋白检测试剂β2-MG各种免疫学方法J068β2-微球蛋白检测试剂β2-MG化学发光法J069尿胰蛋白酶原Ⅱ检测试剂J070葡萄糖检测试剂GLU各种酶法、酶电极法J071葡萄糖检测试剂GLU干化学法J072糖化血清蛋白检测试剂(血清果糖胺测定)GlyProJ073糖化血红蛋白检测试剂HbA1c各种免疫学方法J074糖化血红蛋白检测试剂HbA1c色谱法J075糖化血红蛋白检测试剂HbA1c金标法J076血红蛋白检测试剂其他方法J077血红蛋白检测试剂干式化学法J078血清β-羟基丁酸检测试剂BHB化学发光法J079血清β-羟基丁酸检测试剂BHB其他方法J080总胆固醇检测试剂TC干化学法J081总胆固醇检测试剂TC化学法、酶法J082甘油三酯检测试剂TG干化学法J083甘油三酯检测试剂TG化学法、酶法J084血清磷脂检测试剂PL干化学法J085高密度脂蛋白胆固醇检测试剂HDL-C干化学法J086高密度脂蛋白胆固醇检测试剂HDL-C其他方法J087低密度脂蛋白胆固醇检测试剂LDL-C干化学法J088低密度脂蛋白胆固醇检测试剂LDL-C其他方法J089血清脂蛋白电泳分析试剂其他方法J090血清脂蛋白电泳分析试剂凝胶法J091血清载脂蛋白AI检测试剂ApoAI免疫比浊法J092血清载脂蛋白AI检测试剂ApoAI其他方法J093血清载脂蛋白AⅡ检测试剂ApoAⅡ免疫比浊法J094血清载脂蛋白AⅡ检测试剂ApoAⅡ其他方法J095血清载脂蛋白B检测试剂ApoB免疫比浊法J096血清载脂蛋白B检测试剂ApoB其他方法J097血清载脂蛋白CⅡ检测试剂ApoCⅡ免疫比浊法J098血清载脂蛋白CⅡ检测试剂ApoCⅡ其他方法J099血清载脂蛋白CⅢ检测试剂ApoCⅢ免疫比浊法J100血清载脂蛋白CⅢ检测试剂ApoCⅢ其他方法J101血清载脂蛋白E检测试剂ApoE免疫比浊法J102血清载脂蛋白E检测试剂ApoE其他方法J103血清载脂蛋白α检测试剂LP(α)免疫比浊法J104血清载脂蛋白α检测试剂LP(α)其他方法J105视黄醇结合蛋白检测试剂J106钾检测试剂K其他方法J107钾检测试剂K干化学法J108钠检测试剂Na其他方法J109钠检测试剂Na干化学法J110氯检测试剂Cl其他方法J111氯检测试剂Cl干化学法J112钙检测试剂Ca其他方法J113钙检测试剂Ca干化学法J114镁检测试剂Mg其他方法J115镁检测试剂Mg干化学法J116无机磷检测试剂P其他方法J117无机磷检测试剂P干化学法J118铁检测试剂FeJ119全血铅测定PbJ120血清总铁结合力试剂J121锌检测试剂ZnJ122多种微量元素测定试剂包括铜、硒、锌、锶、镉、汞、铝、锰、钼、砷等J123血清碳酸氢盐检测试剂(含二氧化碳检测)CO2J124总胆红素检测试剂TBIL化学法、酶促法J125总胆红素检测试剂TBIL干化学法J126直接胆红素检测试剂DBIL化学法、酶促法J127直接胆红素检测试剂DBIL干化学法J128间接胆红素检测试剂IBIL手工法、速率法J129间接胆红素检测试剂IBIL干化学法J130总胆汁酸检测试剂TBA化学法、比色法、酶促法J131总胆汁酸检测试剂TBA干化学法J132血氨检测试剂NH3酶促法J133血氨检测试剂NH3干化学法J134丙氨酸氨基转移酶检测试剂ALT手工法、速率法J135丙氨酸氨基转移酶检测试剂ALT干化学法J136天门冬氨酸氨基转移酶检测试剂AST手工法、速率法J137天门冬氨酸氨基转移酶检测试剂AST干化学法J138天冬氨酸氨基转移酶线粒体同工酶检测试剂m-AST免疫抑制法J139γ-谷氨酰基转移酶检测试剂γ-GT手工法、速率法J140γ-谷氨酰基转移酶检测试剂γ-GT干化学法J141碱性磷酸酶检测试剂ALP/AKP手工法、速率法J142碱性磷酸酶检测试剂ALP/AKP干化学法J143骨型碱性磷酸酶质量检测试剂BALP放免法或酶免法J144骨型碱性磷酸酶质量检测试剂BALP化学发光法、干化学法J145酸性磷酸酶试剂ACP比色法、速率法J146酸性磷酸酶试剂ACP干化学法J147胆碱脂酶检测试剂CHE速率法J148胆碱脂酶检测试剂CHE干化学法J149单胺氧化酶试剂MAOJ1505ˊ-核苷酸酶检测试剂5-NTJ151α-L-岩藻糖苷酶检测试剂AFUJ152血清Ⅳ型胶原肽检测试剂Ⅳ-CJ153血清Ⅲ型胶原检测试剂Ⅲ-CJ154血清层粘连蛋白检测试剂LNJ155血清纤维连接蛋白检测试剂cFnJ156血清透明质酸酶检测试剂HAaseJ157腺苷脱氨酶检测试剂ADAJ158甘氨胆酸检测试剂CGJ159肌酸激酶检测试剂CK速率法。

医疗器械细菌内毒素合并检验方案研究摘要:系列产品细菌内毒素合并检验,每一份样品有两个作用,一是作为样品,二是作为其他样品的稀释剂,在所有产品稀释倍数不超过最大有效稀释倍数的前提下,整体样品的检测结果为阴性,则系列产品内样品均合格。
关键词:医疗器械;细菌内毒素;系列产品;合并检验细菌内毒素检查法系利用鲎试剂来检测或量化由革兰氏阴性菌产生的细菌内毒素,以判断供试品中细菌内毒素的限量是否符合规定的一种方法。
包括凝胶法和光度测定法。
其中凝胶法系通过鲎试剂与内毒素产生凝集反应的原理进行限度检测或半定量检测内毒素的方法。
大部分医疗器械需要在水溶液中浸提制成供试品溶液,供试品溶液不应该超过最大有效稀释倍数。
最大有效稀释倍数的确定按照公式L=MVD*λ来计算,其中L-供试品技术要求、MVD-为供试品最大有效稀释倍数、λ-鲎试剂灵敏度。
因此,只要产品的稀释倍数不超过最大有效稀释倍数,当细菌内毒素检查阴性结果,即表示产品内毒素含量不超过限值,则判产品合格。
将医疗器械分别浸提制成供试品溶液后,供试品溶液混合检验,形成合并样本,这样,参与合并检验的样品有两个作用,一是作为样品参与检验,二是成为其他样品稀释剂,因此,参与合并的供试品是被相互稀释了的样品供试液。
最坏的可能是所检合并样本内毒素只来自其中同一批样品,只要保证参与合并的样品溶液被稀释的倍数不超过最大有效稀释倍数,当合并样本结果阴性,则参与合并的每批样品一定均不能超过各自的限值规定,可判参与合并的所有批次均合格。
细菌内毒素凝胶试验是不超过规定限度的定性试验,适合合并检验的方法。
本研究材料进行系列产品的验证,验证结果如下:1 划分产品系列组,每一系列组选取代表样品根据产品原材料划分产品系列组,再根据产品组件、加工工艺、产品的评价来进行系列组内分类,从分类中选取配件种类最多,浸提浓度最高的产品作为代表样品。
本次验证做了两个产品系列组,如表一。
表一产品系列组2 将代表性样品随机组合进行验证根据表一的产品系列组选取系列组1的代表样品5个,进行2个、3个、4个、5个组合,形成26个试验组,分别对26个组合进行细菌内毒素干扰试验。

一次性使用无菌注射器带针产品使用说明书产品注册号:生产企业许可证:产品标准号:YZB/国××××—2012《一次性使用无菌注射器带针》主要结构、性能:本产品采用无毒塑料聚丙烯、聚乙烯制造,其结构为芯杆、活塞、外套、注射针组成,经环氧乙烷灭菌,无菌、无毒、无热原。
规格有1ml、2ml、5ml、10ml、20ml、30ml、60ml系列规格。
产品性能主要有:滑动性能、器身密合性、残留容量、可萃取金属含量、酸碱度、易氧化物、环氧乙烷残留量、急性全身毒性、溶血、无菌、无致热原等。
适用范围、用途:本产品适用于供抽吸液体或注射液体用。
本产品只适用于皮下或肌肉注射和静脉抽血检验,由医务人员使用,禁止作其它用途和非医务人员使用。
使用方法:撕开单包装袋,取出注射器,去掉注射针保护套,拉动芯杆作来回滑动,拧紧注射针,然后抽入药液,注射针向上,缓慢上推芯杆排除空气,进行皮下或肌肉注射或进行抽血。
注意事项、警示及提示性说明:本产品为”一次性使用”产品。
禁止重复使用,用后销毁。
本产品经环氧乙烷灭菌,须在失效年月内使用.单包装破损、护套脱落,禁止使用。
并作报废处理。
本产品应储存在相对湿度小于80%,通风、干燥的室内。
正常使用后的处理,请按相关法规要求执行。
有限公司地址:邮编:电话:传真:主要结构、性能:本产品采用无毒塑料PVC、ABS制造,其结构为瓶塞穿刺器护套、瓶塞穿刺器、滴管、滴斗、流量调节器、药液过滤器、软管、静脉输液针组成。
、产品性能主要有:微粒污染、密封性、连接强度、滤除率、还原物质、金属离子、酸碱度、环氧乙烷残留量、无菌、无热原、溶血、急性全身毒性等。
适用范围、用途:本产品用作临床输液.本产品在重力作用下用于静脉输液,由医务人员使用,禁止作其它用途和非医务人员使用。
使用方法:沿启封口拆开单包装,取出输液器带针产品,拧紧静脉输液针,关闭流量调节器,去除护套,将穿刺器插入输液瓶,挤压滴斗使其抽液至少1/3滴斗高度,再打开流量调节器,排尽软管内空气,将静脉输液针刺入静脉血管,调节到所需流量即可进行输液。

医疗器械风险管理报告110527医疗器械风险管理报告产品名称:一次性使用溶药器产品型号:10mL、20mL、50mL溶药针:斜面型、侧孔型哈尔滨鑫瑞医疗器械有限公司2011年11月26日目录第一章综述………………………………………………………………………………2 第二章风险管理输入……………………………………………………………………5 第三章风险管理评审……………………………………………………………………8 第四章风险管理结论……………………………………………………………………9 附件:1《风险分析记录》2《风险评价记录》3《风险控制记录》4《综合剩余风险评价记录》1第一章综述1、产品简介一次性使用无菌溶药器(以下简称溶药器)及一次性使用无菌溶药针(以下简称溶药针)的结构、各部件名称如图1所示。
本产品的所有部件及加工材料均采用符合医用要求的材料。
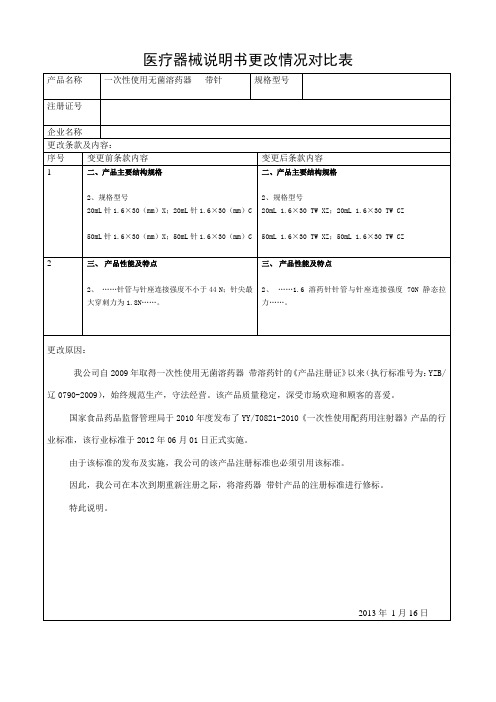
溶药注射器各部分的名称术语如图1所示1-零刻度线,2-分度容量线,3-公称容量刻度线,4-总刻度容量线,5-基准线,6-外套卷边, 7-锥头孔,8-锥头,9-针座,10-连结部,11-针管,12-护套,13-外套,14-活塞, 15-芯杆,16-按手注:本示意图仅说明溶药注射器的结构~并非为标准规定的唯一型式。
图1 溶药注射器,带溶药针,示例2、风险管理计划和实施情况简述于2011年10月开始策划立项。
立项的同时。
我们针对该产品进行了风险管理活动的策划~制定了风险管理计划。
该风险管理计划确定了的风险可接受准则~对产品设计开发阶段,包括试生产阶段,的风险管理活动、风险管理活动有关人员的职责和权限以及生产和生产后信息的获得方法的评审要求进行了安排。
公司组成了风险管理小组~确定了该项目的风险管理负责人。
确保该项目的风险管理活动按照风险管理计划有效的执行。
在产品的设计和项目开发阶段~风险管理小组共进行了一次风险管理评审~形成了相关的风险管理文档。
3、此次风险管理评审目的本次风险管理的评审目的是通过对产品在上市前各阶段风险管理活动进行总体评价~确保风险管理计划已经圆满地完成~并且通过对该产品的风险分析、风险评价和风险控制~以及综合剩余风险的可接受性评价~和对生产和生产后信息获得方法的2评审~证实对产品的风险已进行了有效管理~并且控制在可接受范围内。

一次性使用无菌溶药注射器带针产品技术报告一、产品简介1.概述1.1 一次性使用无菌溶药注射器(以下简称溶药注射器)及一次性使用无菌溶药针(以下简称溶药针)的结构、各部件名称如图1所示。
本产品的所有部件及加工材料均采用符合医用要求的材料。
1.2 溶药注射器各部分的名称术语如图1所示1-零刻度线;2-分度容量线;3-公称容量刻度线;4-总刻度容量线;5-基准线;6-外套卷边; 7-锥头孔;8-锥头;9-针座;10-连结部;11-针管;12-护套;13-外套;14-活塞; 15-芯杆;16-按手注:本示意图仅说明溶药注射器的结构,并非为标准规定的唯一型式。
图1 溶药注射器(带溶药针)示例1.3 主要材料聚丙烯、橡胶活塞、不锈钢管2. 结构组成产品的所有部件及加工材料均采用符合医用要求的材料,其结构组成如图1(示例)构成3. 预期用途主要用于供临床配制药液、加药、溶药以及抽取药液时使用。
4.工作原理溶药注射器的工作原理与普通注射器相同,是利用活塞和针筒的抽吸和注射原理,依靠手工进行配制药液工作。
5.产品特点溶药注射器具有使用方便、安全等优点,已被广泛地应用到临床当中,产品经环氧乙烷灭菌,为一次性使用无菌产品。
二、技术指标或主要性能要求确定的依据GB6682—1992 分析实验室用水规格和试验方法GB15810—2001 一次性使用无菌注射器GB15811—2001 一次性使用无菌注射针GB/T1962.1—2001 注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第1部分通用要求GB/T1962.2—2001 注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第2部分锁定接头GB/T2828.1—2003 计数抽样检验程序第1部分:按接收质量限(AQL)检索的逐批检验抽样计划GB/T2829—2002 周期检验计数抽样程序及表C适用于对过程稳定性的检验GB/T14233.1—1998 医用输液输血注射器具检验方法第1部分:评价与试验GB/T14233.2—2005 医用输液输血注射器具检验方法第2部分:生物试验方法GB/T18457—2001 制造医疗器械用不锈钢针管GB 9969.1-1998 工业产品使用说明书总则GB/T16886.1-2001 医用器械生物学评价第1部分:评价与试验YY 0242—1996 医疗输液输血注射器用聚丙烯专用料YY/T0243—2003 一次性使用无菌注射器用活塞YY/T0296—1997 一次性使用注射针识别色标YY/T0313—1998 医用高分子制品包装、标志、运输和贮存YY0466-2003 医疗器械用于医疗器械标签、标记和提供信息的符号三、产品设计控制、开发、研制过程1. 项目来源及前景一次性使用注射器是国内外广泛使用的产品,主要适用于供抽吸液体或在注入液体后立即注射用的手动注射器,但在实际临床工作中,医护人员需用一些大规格的注射器配用大规格注射针来配制药液,国内企业生产的一次性使用无菌溶药注射器在临床上以得到广泛应用,社会效益和经济效益明显。


一次性使用无菌注射器(针)产品技术报告一次性使用无菌注射器(带针),是按照YZB/国××××—2006标准规定生产制造而成。
用于给患者注射用输送药液,该产品以无菌状态提供给用户,仅供一次性使用,可有效避免患者之间的交叉感染。
产品均采用符合医用级要求的材料及零部件,芯杆、外壳由医用级聚丙烯加工而成,橡胶活塞选用天然橡胶、配套用针采用医用级不锈钢针管等,产品经检验和试验均符合标准要求,一、产品用途、性能:主要用于预防和临床肌肉静脉注射用。
产品性能主要有:滑动性能、器身密合性、残留容量、可萃取金属含量、酸碱度、易氧化物、环氧乙烷残留量、急性全身毒性、溶血、无菌、无致热原等。
二、产品的基本结构形式:结构:由芯杆、外套、胶塞、配套用注射针组成。
形式:中头式,偏头式。
三、产品的基本规格:1ml, 2ml, 5ml,10ml,20ml,30ml,50ml。
四、产品的主要原辅材料:1.符合YY0242《医用输液、输血、注射用聚丙烯专用料》标准的PP料。
2.符合YYT0243《一次性使用无菌注射器用橡胶活塞》的活塞。
五、产品执行标准:执行YZB/国××××---2006《一次性使用无菌注射器针》六、适用范围、用途:本产品适用于供抽吸液体或注射液体用。
本产品只适用于皮下或肌肉注射和静脉抽血检验,由医务人员使用,禁止作其它用途和非医务人员使用。
七、物理指标:1、注射器有良好的滑动性能,其推、拉作用力符合下表的规定。
2.器身密合性将注射器吸入公称容量的水,用下表规定的轴向压力及侧向力,对芯杆作用30s,外套与活塞接触的部位无漏液现象。
在88kPa负压作用下保持60s±5s外套与活塞接触部位不产生漏气现象,且活塞与芯杆不脱离。
3.容量允差:小于二分之一公称容量和大于二分之一公称容量的最大允差符合上表中的有关规定。
4.残留容量:当芯杆完全推入到外套封底时,其残留在外套内的液体体积不超过上表的规定。
一次性使用无菌溶药注射器带针产品技术报告一、产品简介1.概述1.1 一次性使用无菌溶药注射器(以下简称溶药注射器)及一次性使用无菌溶药针(以下简称溶药针)的结构、各部件名称如图1所示。
本产品的所有部件及加工材料均采用符合医用要求的材料。
1.2 溶药注射器各部分的名称术语如图1所示1-零刻度线;2-分度容量线;3-公称容量刻度线;4-总刻度容量线;5-基准线;6-外套卷边; 7-锥头孔;8-锥头;9-针座;10-连结部;11-针管;12-护套;13-外套;14-活塞; 15-芯杆;16-按手注:本示意图仅说明溶药注射器的结构,并非为标准规定的唯一型式。
图1 溶药注射器(带溶药针)示例1.3 主要材料聚丙烯、橡胶活塞、不锈钢管2. 结构组成产品的所有部件及加工材料均采用符合医用要求的材料,其结构组成如图1(示例)构成3. 预期用途主要用于供临床配制药液、加药、溶药以及抽取药液时使用。
4.工作原理溶药注射器的工作原理与普通注射器相同,是利用活塞和针筒的抽吸和注射原理,依靠手工进行配制药液工作。
5.产品特点溶药注射器具有使用方便、安全等优点,已被广泛地应用到临床当中,产品经环氧乙烷灭菌,为一次性使用无菌产品。
二、技术指标或主要性能要求确定的依据GB6682—1992 分析实验室用水规格和试验方法GB15810—2001 一次性使用无菌注射器GB15811—2001 一次性使用无菌注射针GB/T1962.1—2001 注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第1部分通用要求GB/T1962.2—2001 注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第2部分锁定接头GB/T2828.1—2003 计数抽样检验程序第1部分:按接收质量限(AQL)检索的逐批检验抽样计划GB/T2829—2002 周期检验计数抽样程序及表C适用于对过程稳定性的检验GB/T14233.1—1998 医用输液输血注射器具检验方法第1部分:评价与试验GB/T14233.2—2005 医用输液输血注射器具检验方法第2部分:生物试验方法GB/T18457—2001 制造医疗器械用不锈钢针管GB 9969.1-1998 工业产品使用说明书总则GB/T16886.1-2001 医用器械生物学评价第1部分:评价与试验YY 0242—1996 医疗输液输血注射器用聚丙烯专用料YY/T0243—2003 一次性使用无菌注射器用活塞YY/T0296—1997 一次性使用注射针识别色标YY/T0313—1998 医用高分子制品包装、标志、运输和贮存YY0466-2003 医疗器械用于医疗器械标签、标记和提供信息的符号三、产品设计控制、开发、研制过程1. 项目来源及前景一次性使用注射器是国内外广泛使用的产品,主要适用于供抽吸液体或在注入液体后立即注射用的手动注射器,但在实际临床工作中,医护人员需用一些大规格的注射器配用大规格注射针来配制药液,国内企业生产的一次性使用无菌溶药注射器在临床上以得到广泛应用,社会效益和经济效益明显。
2.生产条件江苏恒康医疗器材有限公司是国家主管部门批准的一次性使用无菌医疗器械专业生产企业,生产一次性使用无菌注射器、一次性使用输液器等产品,其质量管理体系、生产、检测设备、技术能力等均能满足开发生无菌溶药注射器要求。
3.研制情况公司组织生产,质量,技术人员通过认真学习、理解相关标准,研究市场上同类产品的技术指标,临床应用情况,制定了本产品的质量标准,技术指标,工艺要求、关键技术等,试制的样品符合国家,行业标准。
4.关键技术关键技术为外套标尺的印刷和外套与橡胶活塞的配合两套工序。
外套标尺的印刷即配药注射器的标尺应印刷清晰,分度容量粗细均匀,零位线的印刷位置应与外套封底的内边缘线相切,误差在企业注册标准范围内。
外套与橡胶活塞的配合要求精度高,装配严格,我们通过提高注塑模具加工精度要求和橡胶活塞尺寸要求来实现高精度配件的生产,同时严格工艺要求和部件进厂验收规程,保证部件生产稳定性。
四、工艺流程图及工艺要求1.工艺流程图(见附件1)此生产工艺经实际生产验证,设计合理,能保证产品各项性能要求。
2、工艺要求2.1.环境要求溶药注射器要求无毒、无菌、无热原,所以必须在10万级净化车间内生产、包装。
2.2.技术工艺要求2.2.1注塑配件注塑件完整、无毛刺飞边、无色点、焦点,尺寸符合要求。
2.2.2装配粘接各零部件无缺陷,针尖应粘接到位、牢固、粘接剂均匀、无堵塞。
2.2.3印刷溶药注射器的标尺应印在外套卷边短轴的任意一侧,分度容量线应粗细均匀,零位线的印刷位置应与外套封底的内边缘线相切,当芯杆完全推入外套封底端时,零位线应与活塞上的基准线重合,其误差必须在最小分度间隔的四分之一范围内。
2.2.4 包装单包装合格、清晰、无杂质;中包装折叠整齐、印刷正确、清晰;外包装装箱数量准确、包装箱无破损现象。
实践证明,按照上述方法和工艺要求制造产品,能够最大限度地保证产品各项性能指标符合设计要求。
3、原材料及外购件要求3.1 主要材料:聚丙烯、橡胶活塞、不锈钢管。
3.2 用于制造溶药注射器的材料应与其消毒过程相适应。
在ISO/TC198中有关于进行医疗器械消毒工作的内容。
用于制造溶药注射器的材料在常规使用过程中,不得产生物理的或化学的等有害的影响,用于构造溶药注射器外套壁的材料应具有足够的透明度以确保可毫无困难地读取刻度值。
3.3 用于制造溶药注射器的外购件均有产品注册证(见附件2),质量符合国家、行业标准。
五、产品性能及技术指标1.外观1.1 在300 lx—700 lx的照度下,溶药注射器应清洁、无微粒和异物。
1.2 溶药注射器不得有毛边、毛刺、塑流、缺损等缺陷。
1.3 溶药注射器的外套应有足够的透明度,能清晰地看到基准线。
1.4 溶药注射器的内表面(包括橡胶活塞),不得有明显可见的润滑剂汇聚。
1.5 溶药针针管应清洁、无杂物,针管应平直。
1.6 针座应无明显毛边、毛刺、塑流及气泡等注塑缺陷。
1.7 针座的锥孔应无微粒和杂质。
1.8 针尖应无毛刺、弯钩、平头等缺陷。
2 溶药注射器的标尺2.1 溶药注射器有一个标尺或一个以上相同的标尺,且标尺应符合表1的规定。
表1 公称容量及对应要求溶药注射器的公称容量v ml容量允差最大残留容量ml至公称容量标记处分度的最小全长mm最大分度值ml计量数字间的最大增量ml泄漏试验所用力小于公称容量的一半等于或大于公称容量的一半侧向力(±5%)N轴向压力(表压)(±5%)kPa20 ±(V的1.5%+排出体积的1%)排出体积的±4%0.15 52 2.0 10 3.0 20030 ±(V的1.5%+排出体积的1%)排出体积的±4%0.17 67 2.0 10 3.0 20050 ±(V的1.5%+排出体积的1%)排出体积的±4%0.20 75 5.0 10 3.0 2002.2溶药注射器允许在公称容量标尺外延长附加标尺,其延长的附加标尺与公称容量标尺应加以区别,其区别方法如:a.把公称容量的计量数字用圆圈圈起来;b.附加标尺的计量数字用更小的计量数字来表示;c.附加标尺的分度容量线用更短的刻度线表示;d.附加标尺长度的垂直线用虚线表示。
3 标尺的刻度容量线3.1 标尺应按表1规定的分度值表明刻度容量线。
3.2 零位线的印刷位置应与外套封底的内边缘线相切,当芯杆完全推入外套封底端时零位线应与活塞上的基准线重合,其误差必须在最小分度间隔的四分之一范围以内。
3.3 刻度容量线应在零位线至总容量刻度容量线之间,沿外套长轴均匀分隔。
3.4 当溶药注射器保持垂直位置时,所有等长的刻度容量线的一端应在垂直方向上相互对齐。
3.5 次刻度容量线长度约为主刻度容量线的二分之一。
4 标尺上的计量数字4.1 将溶药注射器垂直握住,锥头向上,计量数字应成正立字形。
4.2 标尺上的计量数字应与相应的刻度容量线末端的延长线相交,但不得接触。
4.3 计量数字的排列顺序,应从外套封底端的零位线开始,“零”字可以省略,各种规格的溶药注射器计量数字标示的举例见图2。
注:标尺的垂直线可省略。
图2 标尺刻度的举例5 标尺的印刷5.1 偏头式溶药注射器:其标尺应印在锥头的对面一侧。
5.2 中头式溶药注射器:其标尺应印在外套卷边短轴的任意一侧。
5.3 标尺的分度容量线及计量数字印刷应完整,字迹清楚,线条清晰,粗细均匀。
6 外套6.1 溶药注射器外套的最大可用容量的长度至少比公称容量长度长10%。
6.2 溶药注射器外套的开口处应有卷边,以确保溶药注射器任意放置在与水平成10°夹角的平面上时不得转过180°。
7 按手间距当芯杆完全推入到外套封底时,使活塞的基准线与零位线重合,从卷边内表面到按手外表面的优选最小长度应符合表2规定的间距。
详见图3表2 按手尺寸公称容量V,ml 间距D,mmV≥5 12.5图3 按手尺寸示意图8 活塞8.1 橡胶活塞应无胶丝、胶屑、外来杂质、喷霜,应符合YY/T 0243的规定,其他材料制成的活塞应符合相应标准的规定。
8.2 活塞与外套的配合,当溶药注射器被注入水后,保持垂直时,芯杆不得因其自身重量而移动。
9 锥头9.1 锥头孔直径应不小于1.2mm。
9.2 溶药注射器锥头的外圆锥接头应符合GB/T 1962.1或GB/T 1962.2的规定。
9.3 中头式溶药注射器,锥头应位于外套封底端的中央,与外套在同一轴线上。
9.4 偏头式溶药注射器,锥头在外套封底端偏离中心,应位于外套卷边短轴一侧的中心线上,且锥头轴线与外套内壁表面最近点之间距离不得大于4.5mm。
10 物理性能10.1 溶药注射器应有良好的滑动性能,其推、拉作用力应符合表3的规定。
表 3 滑动性能溶药注射器的公称容量Vml 启始力Fsmax.N平均力Fmax.N回推最大力FmaxN回推最小力FminN2≤V<50 V≥50 25301015≤(2.0×测量F)或(测量F+1.5N)中较高者≤(2.0×测量F)或(测量F+1.5N)中较高者≥(0.5×测量F)或(测量F-1.5N)中较低者≥(0.5×测量F)或(测量F-1.5N)中较低者10.2 器身密合性将溶药注射器吸入公称容量的水,用表1规定的轴向压力及侧向力,对芯杆作用30s,外套与活塞接触的部位不得有漏液现象。
在88kPa负压作用下保持60s±5s,外套与活塞接触部位不得产生漏气现象,且活塞与芯杆不得脱离。
10.3 容量允差:小于二分之一公称容量和大于二分之一公称容量的最大允差应符合表1中的有关规定。
10.4 残留容量:当芯杆完全推入到外套封底时,其残留在外套内的液体体积不得超过表1的规定。