试验动物与细胞系
- 格式:doc
- 大小:165.00 KB
- 文档页数:12



猪FSP27基因过表达脂肪细胞系的构建与验证潘洪彬;孙泽威;李春雨;赵素梅;黄英;杨明华;高士争;秦贵信【摘要】脂肪特异蛋白27 (FSP27)是一种新发现的定位在脂滴的蛋白质,在调控脂肪细胞内脂类贮存等方面起着重要作用.本试验用含有猪FSP27基因的慢病毒,感染鼠3T3-L1前脂肪细胞,建立猪FSP27基因过表达的前脂肪细胞系,为进一步研究猪FSP27基因在脂肪细胞中调控脂类代谢提供实验素材.根据猪的FSP27基因序列设计目的基因引物序列,并分别添加酶切位点NheI和AgeI及保护碱基,克隆到pMD18-T载体做NheI和AgeI双酶切,将酶切产物回收并将双酶切后的目的片段与GV341载体连接,转入293T细胞,包装成慢病毒,收集、浓缩、纯化病毒上清并用来感染3T3-L1前脂肪细胞,筛选稳定系,并检测感染效率和脂肪细胞表型变化.结果显示,猪FSP27基因过表达3T3-L1脂肪细胞中FSP27基因的相对表达量显著高于对照组(P<0.01),在过表达脂肪细胞培养第8天,脂肪细胞形成脂滴数量明显多于对照组(P<0.05),表明猪FSP27基因过表达3T3-L1脂肪细胞系构建成功.【期刊名称】《云南农业大学学报》【年(卷),期】2015(030)004【总页数】6页(P588-593)【关键词】猪;FSP27基因;过表达;3T3-L1细胞系【作者】潘洪彬;孙泽威;李春雨;赵素梅;黄英;杨明华;高士争;秦贵信【作者单位】吉林农业大学动物科技学院,吉林长春130118;云南农业大学动物科技学院,云南省动物营养与饲料重点实验室,云南昆明650201;吉林农业大学动物科技学院,吉林长春130118;广东农工商职业技术学院,广东广州510507;云南农业大学动物科技学院,云南省动物营养与饲料重点实验室,云南昆明650201;云南农业大学动物科技学院,云南省动物营养与饲料重点实验室,云南昆明650201;云南农业大学动物科技学院,云南省动物营养与饲料重点实验室,云南昆明650201;云南农业大学动物科技学院,云南省动物营养与饲料重点实验室,云南昆明650201;吉林农业大学动物科技学院,吉林长春130118【正文语种】中文【中图分类】S828.133动物的脂肪组织在维持其机体的能量代谢平衡和糖、脂肪代谢稳态中起着重要作用,当脂肪代谢紊乱时会导致机体的过渡肥胖、脂肪肝等一系列代谢疾病。

万方数据8期张寰等:昆虫细胞系的培养和建立技术835胞系建立的方法、细胞系的特征和鉴定等研究现状及存在的问题,作一综合性的概述。
1历史回顾20世纪初,许多昆虫学家尝试过使用体外培养的昆虫细胞作为科学研究的工具。
最早进行昆虫组织体外培养的是RichardGoldschmiedt(1915),他使用惜比古天蚕蛾肌fop^Dmc∞rop施的精子进行体外培养,用来观察精子的发育(GoldschmidtaIldKaiser,1915)。
首次成功建立连续培养的昆虫细胞系的是Grace,于1961年建立了桉蚕蛾A舭n凹new口z印矗卵巢细胞系(Grace,1962)。
从此,昆虫细胞系的建立工作在世界范围内广泛展开,新建立的细胞系(株)不断出现。
到目前为止,全世界建立的昆虫细胞系有800株以上,分别来源于鳞翅目、双翅目、鞘翅目、蜚蠊目、膜翅目、直翅目、同翅目和半翅目等8个目的170多种昆虫,然而其中大部分来自鳞翅目和双翅目,来源于其他目的昆虫细胞系仅占1/10左右(图l,个人统计)。
由于草地贪夜蛾却。
却把r口.向留咖e以。
细胞株sf9和Sf21,以及粉纹夜蛾孤c^印fwi口ni细胞株Tn5814(商品名Highnve)对模式病毒苜蓿银纹夜蛾核型多角体病毒AⅡ£ogn印胁coz扣micnmultic印sidnucleopolyhedrovims(AcMNPV)非常敏感,因而成为各实验室普遍采用的细胞系(Gmnados以oZ.,1994)。
图1已经建立的昆虫细胞系来源于8个目的昆虫Fig.1EstablishedinsectceⅡlinesf而meightin∞ctorders在我国,1958年高尚荫首次尝试体外培养家蚕勘舶协瑚矗血细胞,并用之进行家蚕核型多角体病毒(BmNPv)的感染实验(Gaw以ⅡZ.,1959)。
随后,有近50株昆虫细胞系由国内的研究者建立并公开报道,分别分布于鳞翅目和双翅目昆虫中(个人统计)。

稳定表达山羊 SLAM 受体的 Vero 细胞系的建立高华峰;赵文华;严欢;杨仕标【摘要】信号淋巴激活分子(signalling lymphocyte activation molecule ,SLAM )又称CD150,是小反刍兽疫病毒(peste des petits ruminants virus ,PPRV )和犬瘟热病毒(canine distemper virus ,CDV )等麻疹病毒属病毒感染淋巴细胞的主要受体,在病毒侵入细胞中发挥着重要作用。
为了建立稳定表达山羊SLAM 真核细胞系,本研究将全基因合成的 gSLAM基因克隆至真核表达质粒pIRES2‐GFP中,构建了重组质粒pIRES2‐gSLAM。
将该重组质粒转染非洲绿猴肾细胞(Vero),经G418筛选后,筛选到稳定表达 gSLAM基因的细胞系Vero‐gSLAM ,该细胞系在传代至第10代,仍能稳定表达 gSLAM基因,PPRV N75/1病毒株可以感染且能形成明显的细胞病变(CPE),相比在Vero细胞上10-4.65 TCID50/0.1 mL的毒价,在Vero‐gSLAM上为10-5.75 TCID50/0.1 mL ,其毒价有所提高。
该细胞系可用于PPRV强毒分离和致弱机制等相关研究。
%Signalling lymphocyte activation molecule (SLAM ,also called CD150) serves as a main cell receptor for PPRV (peste des petits ruminantsvirus) .This study was aimed to establish a cell line ,using Vero cells as the parental cell ,to express goat SLAM stably ,w hich could be used to isolate and propagate PPRV .The gene encoding goat SLAM in vitro was synthesized and cloned into eukaryotic expression vector pIRES2‐GFP ,and the recombinant expression plasmid pIRES2‐gSLAM was obtained .The positive stably transfectant Vero‐gSLAM cells were screened by G418 and identified by immunofluorescence (IF) and RT‐PCR .The result of virus titration by Vero‐gSLAM cell line showed that PPRV strain N75/1 had atitre of 10-4 .65 TCID50 per 0 .1 mL in Vero cell at 5 day after infection and the titre of PPRV N75/1 strain was 10-5 .75 TCID50 per 0.1 mL in Vero‐gSLAM cells .The cell line would play an active role in virusisolation ,biological characteris‐tics study and vaccine virus producti on of PPRV .【期刊名称】《中国畜牧兽医》【年(卷),期】2016(043)008【总页数】6页(P2047-2052)【关键词】小反刍兽疫病毒;受体;信号淋巴细胞激活分子;Vero-gSLAM细胞【作者】高华峰;赵文华;严欢;杨仕标【作者单位】云南省热带亚热带动物病毒病重点实验室,昆明650224;云南省热带亚热带动物病毒病重点实验室,昆明650224;云南农业大学,昆明650201;云南省热带亚热带动物病毒病重点实验室,昆明650224【正文语种】中文【中图分类】S858.27小反刍兽疫病毒(peste des petits ruminants virus,PPRV)是副黏病毒科麻疹病毒属的成员,因主要感染小反刍动物而得名,特别是山羊高度易感。
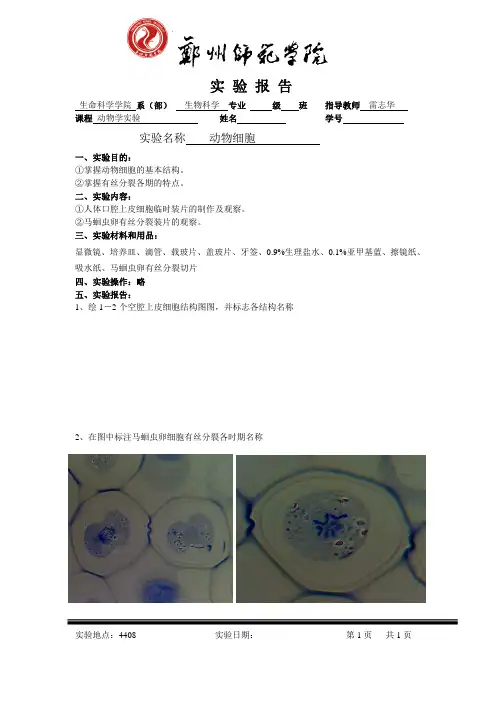
实验报告生命科学学院系(部)生物科学专业级班指导教师雷志华课程动物学实验姓名学号实验名称动物细胞一、实验目的:①掌握动物细胞的基本结构。
②掌握有丝分裂各期的特点。
二、实验内容:①人体口腔上皮细胞临时装片的制作及观察。
②马蛔虫卵有丝分裂装片的观察。
三、实验材料和用品:显微镜、培养皿、滴管、载玻片、盖玻片、牙签、0.9%生理盐水、0.1%亚甲基蓝、擦镜纸、吸水纸、马蛔虫卵有丝分裂切片四、实验操作:略五、实验报告:1、绘1-2个空腔上皮细胞结构图图,并标志各结构名称2、在图中标注马蛔虫卵细胞有丝分裂各时期名称实验地点:4408 实验日期:第1页共1页实验报告生命科学学院系(部)生物科学专业级班指导教师雷志华课程动物学实验姓名学号实验名称多细胞动物的胚胎发育和基本组织一、实验目的:①通过对蛙胚胎发育的模型和切片、封片的观察,了解动物胚胎发育的基本概念和一般规律。
②通过对上皮组织、结缔组织、肌肉组织和神经组织四类动物基本组织切片标本的观察,熟悉这些组织的结构特点、机能和分布,为理解动物器官形成打下基础。
二、实验内容:①蛙胚胎发育切片观察。
②上皮组织、结缔组织、肌肉组织和神经组织装片的观察。
三、实验材料和用品:显微镜、蛙胚胎发育早期各阶段装片、四大组织装片四、实验操作:略五、实验报告:通过观察各玻片结构,在图中标注各结构名称实验地点:4206 实验日期:第1页共1页实验报告生命科学学院系(部)生物科学专业级班指导教师雷志华课程动物学实验姓名学号实验名称原生生物的观察与鉴定一、实验目的:通过已掌握的知识分辨出各种原生生物的类别,进一步掌握原生生物各纲的结构特点。
二、实验内容:(一)鉴别洄水中不同的原生生物,重点观察草履虫结构(二)团藻、草履虫生殖及整体装片的观察。
三、实验材料和用品:显微镜、培养皿、滴管、载玻片、盖玻片、洄水、棉花(蛋白或胶水)、1%醋酸、碘液、擦镜纸、吸水纸、团藻装片、草履虫整体装片,草履虫生殖装片、各种原生生物实体显微观察图四、实验操作:略五、实验报告:绘草履虫结构图并标注各部分结构名称实验地点:4206 实验日期:第1页共1页实验报告生命科学学院系(部)生物科学专业级班指导教师雷志华课程动物学实验姓名学号实验名称腔肠动物一、实验目的:①通过对水螅的外部形态及内部结构的观察,了解具二胚层的腔肠动物的基本特征。

稳定高效表达猪CD163的Marc-145细胞系的构建与鉴定吴香菊;李芳韬;陈蕾;丛晓燕;孙文博;于江;陈智;郭立辉;吴家强【摘要】试验旨在构建一株高效表达猪CD163(pCD163)的Marc-145细胞系,为猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)的临床分离和疫苗生产奠定基础.根据GenBank中序列设计引物从猪肺泡巨噬细胞(PAM)中扩增pCD163基因,将其插入真核表达载体pCI-neo构建真核表达质粒pCI-pCD163,将该重组质粒转染Marc-145细胞,通过G418筛选、单克隆化并扩大培养筛选获得表达pCD163的Marc145细胞系,IFA、Western blotting鉴定其表达情况.IFA结果显示,构建的pCD163-Marc细胞系中荧光明显亮于普通Marc-145细胞;Western blotting结果显示,pCD163-Marc细胞系中CD163蛋白表达量约为对照Marc-145细胞中CD163蛋白表达量的8.7倍.且该细胞系可稳定传至20代,各代次之间表达量无差异.证明高效表达猪CD163的Marc-145细胞系构建成功.【期刊名称】《中国畜牧兽医》【年(卷),期】2015(042)008【总页数】7页(P2074-2080)【关键词】Marc-145;CD163;稳定细胞系【作者】吴香菊;李芳韬;陈蕾;丛晓燕;孙文博;于江;陈智;郭立辉;吴家强【作者单位】山东农业大学动物科技学院,山东省动物生物工程与疾病防治重点实验室,泰安271000;山东省畜禽疫病防治与繁育重点实验室,济南250100;山东农业大学动物科技学院,山东省动物生物工程与疾病防治重点实验室,泰安271000;山东省畜禽疫病防治与繁育重点实验室,济南250100;山东省农业科学院畜牧兽医研究所,济南250100;山东省畜禽疫病防治与繁育重点实验室,济南250100;山东省农业科学院畜牧兽医研究所,济南250100;山东省畜禽疫病防治与繁育重点实验室,济南250100;山东省农业科学院畜牧兽医研究所,济南250100;山东省畜禽疫病防治与繁育重点实验室,济南250100;山东省农业科学院畜牧兽医研究所,济南250100;山东省畜禽疫病防治与繁育重点实验室,济南250100;山东省农业科学院畜牧兽医研究所,济南250100;山东省畜禽疫病防治与繁育重点实验室,济南250100;山东省农业科学院畜牧兽医研究所,济南250100;山东省畜禽疫病防治与繁育重点实验室,济南250100;山东省农业科学院畜牧兽医研究所,济南250100【正文语种】中文【中图分类】Q813猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS),俗称“猪蓝耳病”,由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)引起,病毒感染后可以导致母猪流产、返情、产死胎或弱仔、仔猪死亡及各种年龄的猪不同程度的呼吸道症状,并且能破坏猪的免疫系统,引起混合感染或继发感染[1-2]。

小鼠腹水型肝癌淋巴道转移实验【署名】指导教师:于晓棠【摘要】目的:通过可移植性小鼠腹水型肝癌淋巴道转移实验,从感性上认识肿瘤侵袭与淋巴道转移的生物学特性,了解肿瘤动物实验模型建立的过程及意义。
方法:使用近交系615小鼠皮下接种腹水型肝癌高淋巴道转移菌株(HCa-F)进行肿瘤淋巴道转移实验,取其淋巴结观察是否有淋巴道转移以及检测瘤株淋巴结转移能力。
取肺肝肾组织切片以观察是否有血道转移。
结果:小鼠腹水型肝癌发生淋巴道转移,转移率为40%,并可造成相关器官发生病变。
结论:此方法操作简单,结果直观,小鼠腹水型肝癌淋巴道转移率较高。
【关键词】小鼠腹水型肝癌淋巴道转移【前言】为更好地了解肿瘤的发病机制、肿瘤与宿主的关系、肿瘤侵袭与转移的过程和治疗措施的有效性,需要建立合适的动物模型。
小鼠与人类在遗传学、病理学、生物学许多特性方面相似,是肿瘤研究的理想动物模型。
而且目前的技术能够在鼠的基因水平上设计与人类疾病相关的基因突变而获得相关疾病模型[1]。
小鼠模型是目前可以整合基础和临床肿瘤研究的武器[2],已应用于肿瘤研究的各个领域。
随着对肿瘤认识的不断深入,以及实验动物学的发展和一些新技术的运用,小鼠肿瘤模型的研究取得了重要进展,并已得到广泛应用。
肿瘤转移是导致恶性肿瘤患者死亡的主要原因之一,淋巴结转移是癌早期最常见的转移方式,且淋巴转移还可以成为进一步血道转移的桥头[3]。
小鼠腹水型肝癌淋巴道转移试验是研究肝癌的淋巴道转移的生物学特性的试验。
因为新近流行病学资料表明,我国的原发性肝癌病人数占全世界肝癌病人的一半以上。
由于乙型肝炎、肝炎后肝硬化病人众多,致使我国的肝癌发病率和死亡率居高不下,其死亡率占所有恶性肿瘤的第二位。
在上个世纪我国进行大规模的现场筛查,通过早期发现早期治疗,在临床治疗方面取得了巨大进步,使肝癌有不治之症变成了部分可治之症。
近来综合治疗技术的发展,大肝癌缩小后二部切除,又使部分病人获得了可治愈机会。


·研究论文·Chinese Journal of Animal Infectious Diseases中国动物传染病学报摘 要:为获得稳定表达猪德尔塔冠状病毒(PDCoV )核衣壳(N )蛋白的非洲绿猴肾(Vero )细胞系,本研究将PDCoV-N 基因克隆入慢病毒载体中,获得重组质粒pLVX-PDCoV-N ,利用慢病毒包装系统转染293T 细胞,包装成表达N 蛋白的慢病毒颗粒,慢病毒感染Vero 细胞,嘌呤霉素加压筛选目的细胞。
RT-PCR 扩增N 基因和测序表明细胞系基因组中存在N 蛋白编码序列,Western blot 和IFA 试验表明N 蛋白可在细胞系中稳定表达。
应用制备的细胞系对临床PDCoV 阳性血清样品进行检测,与ELISA 检测结果符合率达到100%。
本研究成功建立了稳定表达PDCoV N 蛋白的Vero 细胞系,为PDCoV N 蛋白生物学特性研究和PDCoV 的临床检测、流行病学调查奠定了基础。
关键词:猪德尔塔冠状病毒;核衣壳(N )蛋白;慢病毒;稳转细胞系中图分类号:S858.28 文献标志码:A 文章编号:1674-6422(2024)01-0056-06Establishment and Characterization of a Vero Cell Line Stably Expressing NProtein of Porcine DeltacoronavirusQIAN Bingxu 1,2, BO Zongyi 1,3, BAI Xueyan 1, ZHANG Chengcheng 1, GUO Mengjiao 1, LI Mengjiao 1,LIAO Kai 1,2, XUE Feng 2, WU Yantao 1, ZHANG Xiaorong 1(1. College of V eterinary Medicine of Y angzhou University, Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Y angzhou 225000, China; 2. International Cooperative Laboratory for Animal Health and Food Safety, Nanjing Agricultural University, Nanjing 210095, China; 3. Joint International Research Laboratory of Agriculture and Agri-Product Safety, Ministry ofEducation of China, Y angzhou University, Y angzhou 225000, China)收稿日期:2021-08-23基金项目:扬州大学高端人才支持计划;江苏高校优势学科建设工程资助项目作者简介:钱炳旭,男,博士研究生,主要从事动物传染病防控研究;薄宗义,男,助理研究员,主要从事动物传染病防控研究通信作者:张小荣,E-mail:***********.cn稳定表达猪德尔塔冠状病毒N 蛋白的Vero 细胞系的建立及鉴定钱炳旭1,2,薄宗义1,3,白雪雁1,张成成1,郭梦娇1,李梦娇1,廖 凯1,2,薛 峰2,吴艳涛1,张小荣1(1.扬州大学兽医学院 江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州225000;2.南京农业大学动物健康与食品安全国际合作实验室,南京210095;3.扬州大学农业科技发展研究院教育部农业与农产品安全国际合作联合实验室,扬州225000)2024,32(1):56-61Abstract: To obtain a African green monkey kidney cell (Vero) line stably expressing nucleocapsid (N) protein of Porcine deltacoronavirus (PDCoV), the PDCoV N gene was cloned into a lentiviral vector to obtain the recombinant plasmid PLVX-PDCoV-N. Then, the recombinant plasmid PLVX-PDCoV-N was transfected into 293T cells by lentivirus packaging system and packaged into lentivirus particles for N protein expression. Vero cells were infected then with the lentivirus and the target cells were screened by puromycin. The results of RT-PCR and sequencing of PCR product showed the genome of the resulting Vero cell line containing N gene. The N protein that was stably expressed in the Vero cell line was confi rmed by Western blot and IFA. The Vero cell line was used to detect clinical PDCoV positive serum samples and the coincidence with the results of ELISA was 100%. The study successfully established a· 57 ·钱炳旭等:稳定表达猪德尔塔冠状病毒N 蛋白的Vero 细胞系的建立及鉴定第32卷第1期猪德尔塔冠状病毒(Porcine delta coronavirus, PDCoV)是近年来新发的冠状病毒,2012年在中国香港被首次报道[1],2014年在美国首次出现大规模流行[2-3]。

常用实验动物的种类和品系根据我国实验动物的使用情况和国外文献报道的常使用的实验动物,最常用的实验动物品种为:小鼠、大鼠、地鼠、豚鼠、兔、犬、猫和非人灵长类中猕猴。
有些专业或课题或教学用的实验动物有:蛙、蟾蜍、鸡、鸭、鸽、长爪沙鼠、棉鼠、雪貂、羊、猪和树鼩等。
一、小鼠(mouse,musmusculus)小鼠是最常用的实验动物。
品系多,可供选用的范围广,性周期短,生育力强,产量大,饲养管理方便,一次可以获得数量较多、健康素质一致的动物,价较廉。
加上对小鼠的生物学特性比较了解,遗传学工作做得比较深入和广泛,实验积累的资料也较丰富,因而素为科研工作者所乐用。
小鼠形体小,听嗅觉好,视觉差,生来有五怕:怕过冷过热、怕饿怕渴、怕强光噪音、怕惊吓疾病、怕挤拥暴力。
室温差2~3℃就能引起它们生理上的改变,低温性周期延缓、食量增加,深低温易感冒或冻死。
过热生育能力下降,母鼠不哺育幼鼠,雄鼠睾丸萎缩,成精能力下降,高温则死亡。
怕饥饿,供水量不足造成脱水,精神萎靡不振。
强光造成视网膜损伤,影响生殖能力。
噪音、超声波小鼠烦躁不安,小鼠能听到超声波段音响、DBA/2出现听源性癫痫、有些品系则瘫痪不能走动。
小鼠的疾病颇多,病毒性疾病就有20多种,细菌性疾病10多种。
挤拥做成小鼠应激,影响脑垂体-肾上腺系统反应。
对小鼠饲养管理、实验操作粗暴都会带来小鼠应激和异常反应,改变其生理状态,给饲养繁殖生产、实验研究带来不良的影响。
按照遗传学的要求和饲养繁殖的不同方法,实验动物小鼠可分为近交系(inbredstrain),封闭群(远交系)(closedcolony,outbredstock),和突变系(mutant)小鼠。
(一)近交系1985年小鼠标准化遗传命名国际委员会第8次公布近交系233个品系,其中有我国TA1,TA2,6153个品系,被列为国际公认的品系。
一个品系或基因型相似的品系,经过连续20代全同胞兄妹或亲代与子代交配培育的品系称为近交系。
绪言一、实验课目的本学科是一门实验性很强的学科,其实验课教学是整个教学的重要组成部分。
目的有如下几方面:(一)验证理论。
通过对理论课所学理论的验证,进一步加深对教学内容的理解、巩固和提高。
(二)通过基本技能的训练以及对实验结果的观察分析,使学生了解并掌握细胞生物学有关的实验技术方法,进而培养学生动手实践、观察分析和解决问题的能力。
(三)培养学生实事求是的科学态度和科学的思维方法,为其后续课的实验及今后的医学研究打下基础。
二、实验课要求(一)学生在实验前应认真预习实验指导及教材中与实验有关的章节,对实验课的原理、内容及方法有初步的了解。
(二)在实验中要认真操作、仔细观察、分析并及时做好记录。
(三)要注重动手能力的培养。
(四)在实验中要注重基本技能的训练及实验仪器、器械的使用方法。
对基本的实验技能要反复训练直至基本掌握。
(五)实验结束后,要根据实验过程中的记录和实验指导的要求,实事求是、认真的写好实验报告,不得抄书或借阅他人的报告参考。
三、实验室规则(一)遵守实验纪律,不迟到、不早退或无故缺席。
(二)进入实验室要穿好白大衣。
(三)进实验室后要按学号对号入座,不能随意更换座位。
要保持肃静。
(四)要严肃认真地进行实验。
实验期间不得进行任何与实验无关的活动。
(五)实验中各种用品使用后应放回原处。
示教标本应按顺序观察,不能任意移动标本,以免妨碍他人观察。
(六)要爱护仪器、标本和器械,如有损坏,应及时报告老师,以便修理或更换。
损坏仪器、器械和标本者应按规定进行赔偿。
(七)要注意节约实验材料、药品和水、电等资源。
(八)保持实验室内清洁整齐。
实验废物及纸屑应放到指定地点,不得随意乱丢。
实验结束后要认真清理各自的实验台面,将器械清洗后点清数目并摆放整齐。
值日生负责清扫实验室,清扫结束后要关好水、电、门窗等,经教师允许方可离开实验室。
附:实验课绘图要求学生每人准备一支HB铅笔、直尺和橡皮。
四、实验教学的内容实验顺序实验内容实验一普通光学显微镜的结构和使用实验二动物细胞的基本形态观察和显微测量实验三细胞组分的化学反应实验四线粒体的活体染色实验五液泡系的活体染色实验六细胞膜通透性的观察实验七细胞计数实验八细胞超微结构电镜照片的识别实验九细胞分裂实验十细胞的原代和传代培养实验十一细胞融合第一次实验:普通光学显微镜的结构和使用动物细胞的基本形态观察和显微测量第二次实验:细胞组分的化学反应线粒体的活体染色液泡系的活体染色第三次实验:细胞膜通透性的观察细胞计数第四次实验:细胞超微结构电镜照片的识别细胞分裂细胞的原代和传代培养录像常用实验动物的了解和解剖器械的使用一、常用实验动物常用的实验动物有蟾蜍、小白鼠、大白鼠、豚鼠、猫、兔和狗等。
实验一动物细胞、原生动物一、目的细胞是生物体形态和功能的基本单位。
细胞形态虽然不同,但结构上都是由细胞膜、细胞质和细胞核三部分构成。
通过观察组织细胞切片、草履虫及示范,要求了解:(1)细胞在光镜下的基本结构;(2)细胞形态的多样性与其机能的关系;(3)细胞的主要增殖方式——有丝分裂的过程;(4)通过对草履虫的观察,了解原生动物的形态及生理的一般特征。
二、材料及用具动物细胞切片、草履虫培养液、蓝黑墨水、醋酸洋红、1%氯化钠溶液、蒸馏水、脱脂棉、吸水纸、显微镜、载片、盖片。
三、观察(一)光镜下细胞的基本结构与形态的多样性(图1-1):注意比较观察卵细胞与其他细胞在结构上的共同点。
联系机能比较卵细胞与精子细胞的形态差异,及神经细胞、平滑肌细胞、白细胞的形态差异及其对机能的适应。
图1-1 各种动物细胞 (1 卵细胞,2 精子,3 神经元,4 平滑肌细胞,5 白细胞)1. 卵细胞(ovum)——狗卵巢,H.E染色重点观察卵巢皮质初级卵泡的细胞形态,细胞体积大,呈圆球形。
细胞膜(cell membrane)在卵细胞表面有一层很薄的膜,不易分辨。
细胞质(cytoplasm)丰富,分布均匀,染成粉红色。
细胞核(nucleus)呈圆形,位于中央或稍偏的位置,细胞核周围包着一层染色较深的核膜,是细胞核和细胞质的分界。
细胞核内染色质细小分散,呈空泡状,核仁大而明显。
2. 精子(spermatozoon)——人精液涂片,结晶紫(crystal violet)染色。
活跃运动的精子形状像蝌蚪,由头、中段和尾部组成。
头部扁圆,大部分由浓缩的细胞核占有;尾部由细胞质构成细长的鞭毛。
精子靠鞭毛运动。
3. 神经元(neuron)——狗脊髓,H.E染色神经元具有接受刺激、传导神经冲动的功能。
注意观察位于脊髓灰质腹角的多极运动神经元的胞体和突起两部分。
胞体呈星形。
细胞核较大,呈圆形,内含少量异染色质,核膜清楚;核仁明显,呈圆球形,染成深蓝色,位于核的中央。
尾加压素II在2型糖尿病小鼠骨骼肌组织中的表达情况作者:张思凡单位:北京市陈经纶中学辅导老师: 黄臣田超指导专家:王学江目录摘要 (2)前言 (3)实验目的 (3)材料与方法 (4)实验结果 ........................................... 错误!未定义书签。
讨论 . (9)结论 (11)参考文献 ........................................... 错误!未定义书签。
附录 ............................................... 错误!未定义书签。
致谢 ............................................... 错误!未定义书签。
1摘要目的探讨T2DM时小鼠骨骼肌组织UII/UT系统的表达变化情况。
方法采用免疫组化、RT-PCR实验观察骨骼肌组织中UII/UT系统的表达;采用血糖测定仪检测2型糖尿病的特征。
结果 1. 在遗传性2型糖尿病小鼠模型上,证实2型糖尿病小鼠骨骼肌组织中UII/UT系统高表达。
用放免法测定到2型糖尿病小鼠血浆UII含量明显高于对照小鼠;骨骼肌组织UII含量和释放到孵育液中的UII含量分别较对照动物高;免疫组化染色发现T2DM小鼠骨骼肌组织中UII的含量较对照组增高。
结论 1. 2型糖尿病小鼠骨骼肌UII/UT系统上调。
2. UII抑制胰岛素刺激的骨骼肌的糖摄入,提示骨骼肌UII可能以旁/自分泌方式作用于骨骼肌参与了胰岛素抵抗的发病关键词尾加压素II;2型糖尿病;胰岛素抵抗2前言胰岛素抵抗指各种原因使胰岛素促进葡萄糖摄取和利用的效率下降,机体代偿性分泌过多胰岛素产生高胰岛素血症,以维持血糖的稳定。
胰岛素抵抗是2型糖尿病的重要表现之一,主要是肝脏、肌肉和脂肪组织对胰岛素的敏感性和反应性降低。
胰岛素抵抗发病机制目前并不完全清楚,不仅与遗传因素高度相关,而且与胰岛素信号传导缺陷、多种脂肪源性细胞因子表达异常、物质代谢异常、炎症介质和氧化应激等诸多因素有关。
越来越多的研究提示血管活性因子、尤其是缩血管因子的调节紊乱参与胰岛素抵抗及糖尿病的发病,如血管紧张素II、内皮素等。
尾加压素II也是体内重要的血管活性肽,具有与内皮素相似或更强的收缩血管和促进血管平滑肌细胞增殖效应。
尾加压素II最早是从鱼的脊髓尾部下垂体中分离出的生长抑素样环肽,后证实从软体动物到哺乳动物的神经系统均存在UII,并且目前已经从人体中克隆出来。
UII的特异性受体是人体内一种孤立的G蛋白耦联受体,又称为UT。
UII与UT结合后引起一系列生物学效应,参与多种疾病的发生。
例如,在中枢神经系统中,可以引起交感神经兴奋,释放肾上腺素和促肾上腺皮质激素,对心率、呼吸和血压也具有一定的调节作用。
在心血管系统,UII可以引起冠状动脉收缩和反射性心动过速。
在外周血管中,UII是迄今为止发现的最强的缩血管物质,可引起内皮炎症,导致内皮损伤。
在肾脏,UII可以减少肾脏血流,使上皮细胞增殖。
近来研究发现,UII对胰腺也具有一定的作用,可以减少胰岛素的分泌。
由于UII是迄今为止发现的最强的缩血管物质,因此人们对它的研究最初主要集中在心血管方面。
在心血管系统中,UII参与了心力衰竭和心肌肥大,冠心病和冠状动脉粥样硬化,肾功能衰竭等这些疾病。
近年大量实验资料显示UII还参与糖代谢的调节、在糖尿病及其并发症的发病中具有重要作用,尤其是2型糖尿病。
2型糖尿病占糖尿病总数的90%以上,它的发生主要与胰岛素抵抗有关。
目前有大量数据表明炎症因子是骨骼肌胰岛素抵抗的一个病因,而它与骨骼肌中UII/UT系统有何关系并不清楚。
本工作旨在观察T2DM时骨骼肌组织中UII/UT系统内源性表达的变化及其意义,及影响这种表达的因素。
3实验材料与方法一、实验动物与细胞系KK小鼠是日本学者培育的一种轻度肥胖型T2DM动物,KK小鼠有明显的多食,从5周龄起,血糖、血胰岛素水平逐步升高,1岁龄时,多食、高血糖、高胰岛素血症、肥胖及肝脏对胰岛素的敏感性可自发恢复正常,但其生命明显缩短。
对照组小鼠(C57BL/6J)体重20-30g,12周龄。
所有小鼠实验当日清晨空腹自尾静脉采血测定其空腹血糖,随后自由饮食,1-2小时后测其随机血糖。
分离双下肢的比目鱼肌,用中性福尔马林固定用于免疫组化。
肌原细胞C2C12细胞株购自中国医学科学院基础研究所。
二、主要试剂和仪器(表1、表2)表1 主要试剂Table 1 Main regents试剂生产厂家DMEM高糖培养基美国Hyclone公司特级胎牛血清美国Gibco公司青霉素-链霉素溶液美国Gibco公司胰蛋白酶(trypsin) 美国Gibco公司二甲基亚砜(DMSO) 美国Sigma公司UII放免试剂盒UII多克隆一抗UII多肽Honenix Pharmaceuticals Honenix Pharmaceuticals Honenix Pharmaceuticals山羊抗兔IgG 北京中杉金桥生物技术有限公司DAB染色试剂盒北京中杉金桥生物技术有限公司45表2 主要仪器Table 2 Main instruments仪器生产厂家 电子天平德国Sartorius 公司 超速低温离心机美国Sigma 公司 紫外可见分光光度计Unico 公司 二氧化碳培养箱美国Revco 公司 PB-600 型恒温水浴箱BOEKELScientific 倒置显微镜日本Olympus 公司 石蜡切片机北京东方仪器厂 制冰机日本三洋公司 pH 计德国Sartorius 公司 超纯水制备装置美国Millipore 公司 微量移液器德国Eppendorf 公司 超净工作台硝酸纤维素膜 天津泰斯特公司 Waters 公司二、实验方法1.C2C12细胞的培养及传代该细胞系用含15%胎牛血清,青霉素100 U/ml ,链霉素100 U/ml 的高糖DMEM培养基在37℃,5% CO2条件下培养。
(1)细胞复苏①紫外照射超净台30min,擦②于-80℃低温冰箱中取卵圆细胞一支,37℃水浴中迅速融化,加至8ml完全培养基中,1200r离心8min。
③弃上清,沉淀用3ml完全培养基重悬,接种至细胞培养瓶中,放入孵箱培养。
(2)细胞传代①紫外照射超净台30min,擦拭超净台台面。
②弃原培养基,PBS洗两次。
③加入胰酶消化至细胞变圆,细胞间隙变宽,弃胰酶,加入3ml培养基终止消化。
④吹打细胞使细胞呈悬浮状态,分瓶,补足培养基,放入孵箱培养。
(3)细胞冻存①紫外照射超净台30min,擦拭超净台台面。
②弃原培养基,PBS洗两次。
③加入胰酶消化至细胞变圆,细胞间隙变宽,弃胰酶,加入3ml培养基终止消化。
④1200r离心8min,弃上清,沉淀用冻存液重悬(冻存液配制:血清:DMSO=9:1)。
⑤度降温:4℃放置1h,-20℃放置30min,-40℃放置30min,放入-80℃低温冰箱保存。
(4)细胞计数6将稀释后的细胞悬液滴于计数板上,使悬液自由充满盖片下方间隙,勿留气泡,稍候片刻,镜下观察并计算出四角大格内的细胞数。
压线者只计上线和右线的细胞,然后按下式计算出细胞浓度:(4大格中的细胞数/4)*10000*稀释倍数=细胞数/ml。
2. 免疫组织化学染色1)切片常规脱蜡至水2)缓冲液洗3min/2次3) 为了降低内源性过氧化物酶造成的非特异性北京染色,将切片放在3%过氧化氢中孵育30分钟5)抗原修复:15min95℃,室温45-60min6)滴加一抗工作液 4℃孵育过夜7)缓冲液洗5min/2次8)滴加酶标二抗,在室温下孵育30min9)缓冲液洗5min/2次10)向1mlDABPlus Substrate中滴加1-2滴DAB Plus Chromogen,混匀后滴加到切片上,孵育3-15min11)自来水充分冲洗,复染,脱水,透明,封片。
研究过程1 检测T2DM组和对照组小鼠血糖、血浆中胰岛素含量8只KK小鼠和8只C57BL小鼠。
实验前禁食2-4h,自由饮水。
使用罗氏血糖测定仪自尾部采血测定小鼠空腹血糖及随机血糖含量。
采用放免法测定血浆中7胰岛素含量。
2检测小鼠骨骼肌组织中UII的表达取两组小鼠骨骼肌组织做石蜡切片进行免疫组织化学染色检测两组小鼠骨骼肌组织中UII蛋白的表达及其组织细胞定位3分离双下肢的比目鱼肌,取10mg左右的组织。
37°C孵育4h,孵育结束后,取孵育液放免方法测定其UII含量。
实验结果1kk小鼠呈典型T2DM表现kk小鼠为轻度肥胖型T2DM动物,具有多食、高血糖、高胰岛素血症、肥胖特征。
我们的实验结果显示:与对照组比较,kk小鼠组成的T2DM组动物更肥胖,体重重93.6%;空腹血糖高91.3%;血浆胰岛素含量高86.6%。
表明kk小鼠呈典型T2DM表现,与文献报道一致,见表1。
Control T2DMBody weight(g)20.2±1.6 39.1±2.4*8Casual blood glucose(mmol/L) 9.5±2.4 23.0±1.9*Fasting blood glucose(mmol/L) 4.6±1.1 8.8±0.5*Plasma insulin(pmol/mL) 299.3±39.4 558.5±71.0*2免疫组化结果显示对照组小鼠骨骼肌细胞有棕黄色的颗粒,主要分布于胞浆中;而T2DM组可见到较强的UII蛋白的表达,提示T2DM时骨骼肌组织中UII/UT系统高表达。
3T2DM小鼠骨骼肌分泌释放UII增加以往的文献已报道T2DM时,动物及人血浆中UII含量升高,但其升高的来源并不清楚,有文献报道血管内皮细胞时血浆中UII的一个来源。
骨骼肌占体重的70%,而且骨骼肌组织作为一个内分泌器官受到了越来越多的重视,那么骨骼肌是否能够产生和释放UII,且T2DM时骨骼肌产生和释放的UII是否是血浆中UII升高的一个来源并不清楚。
我们的结果发现,与对照组相比较,T2DM组血浆中UII含量高51.4%,与文献报道相一致;骨骼肌组织UII含量高21.8%,但差异无统计学意义,表明骨骼肌组织能够产生UII。
Control mice T2DM mice Plasma UII content(pg/mL) 137.5±31.4 208.1±28.7*Skeletal muscle(pg/mg protein) 3.3±0.3 4.0±0.5*Cell incubation liquid(pg/mg36.0±8.4 51.8±4.2*protein)*P<0.05 vs. control group讨论本工作采用遗传性T2DM小鼠为观察对象,发现由KK小鼠组成的T2DM组呈现肥胖、空腹高血糖、随机血糖及血浆中胰岛素的含量均明显高于有C57BL 小鼠组成的对照组,呈典型T2DM表现,与文献报道一致。