钠的重要化合物B含答案
- 格式:docx
- 大小:273.51 KB
- 文档页数:3

第三章 金属及其化合物 第一节 钠及其重要化合物一、钠 1、物理性质银白色金属光泽,质软(可用小刀切割),密度比水小比煤油大(保存在煤油中),熔沸点低,具有良好的导热性和导电性。
2、化学性质(1)与非金属反应:如O 2、Cl 2、S 等。
①钠与氧气反应常温下生成Na 2O (白色),化学方程式为: 4Na+O 2=2Na 2O燃烧时生成Na 2O 2(黄色),化学方程式为: 2Na+O 2 Na 2O 2 ②钠与氯气反应化学方程式为:2Na+Cl 2 2NaCl ③钠与硫反应化学方程式为: 2Na+S Na 2S (2)与水、酸反应(反应顺序:先酸后水)①钠与水、酸反应的实质上均是和H +反应,离子方程式分别为: 2Na+2H 2O=2Na ++2OH —+H 2↑、2Na +2H +=2Na ++H 2↑ ②钠与水反应(加酚酞)的实验现象和解释(3)Na 与盐溶液的反应(反应顺序:先与水反应,再考虑NaOH 是否与盐反应) ①钠投入到NH 4Cl 溶液中,有H 2和NH 3逸出,化学方程式为: 2Na+2NH 4Cl=2NaCl+2NH 3↑+H 2↑②投入到CuSO 4溶液中,有气体放出和蓝色沉淀生成,化学方程式: 2Na+2H 2O=2NaOH+H 2↑ 、 CuSO 4+2NaOH =Na 2SO 4+Cu(OH)2↓ 思考:金属钠露置在空气中的变化过程是怎样的?点燃点燃加热切开金属钠,呈银白色(钠的真面目)→变暗(生成Na2O)→变白色固体(生成NaOH)→成液(NaOH 潮解)→结块(吸收CO2成Na2CO3·10H2O)→最后成白色粉末(Na2CO3·10H2O风化为Na2CO3)。
3、钠的保存、制取及用途⑴金属钠的保存及取用少量金属钠可保存在煤油里,大量的金属钠则存入在铁筒中用石蜡密封。
取用时一般先用镊子把钠从煤油中夹出来,并用滤纸把表面的煤油吸干,然后用小刀切下绿豆大小的一块再做有关实验。

钠及其重要化合物一、选择题1.下列关于金属钠的叙述错误的是( )A.金属钠保存在煤油中B.钠元素只能以化合态存在于自然界C.实验室取用金属钠至少需要3种用品D.钠元素在自然界主要以NaCl的形式存在【解析】选C。
金属钠在空气中就会发生变化,由于钠的密度比煤油大,故钠可以保存在煤油中,A项正确;金属钠性质活泼,在自然界无游离态,B项正确;实验室取用金属钠时,需要用镊子取钠、用滤纸吸干煤油或液体石蜡、用小刀切割、用玻璃皿盛放,所以所需的用品至少有4种,C项错误;海水中含有大量的食盐,钠元素在自然界主要以NaCl的形式存在,D项正确。
2.(2019·大庆模拟)下列有关钠及其化合物的性质说法正确的是( )A.CO2气体使Na2O2固体变白,CO2气体被还原B.除去NaHCO3固体中的Na2CO3,可以将固体加热至恒重C.Na2O2吸收CO2产生O2,所以Na2O2可用作呼吸面具供氧剂D.钠与水反应Na+2H2O Na++2OH-+H2↑【解析】选C。
A、CO2与Na2O2固体反应生成白色固体碳酸钠,其中Na2O2既作氧化剂又作还原剂,二氧化碳中化合价没有变化,所以没有被氧化或被还原,故A错误;B、Na2CO3的热稳定性强于NaHCO3,NaHCO3和Na2CO3混合固体加热至恒重,最终只剩Na2CO3固体,达不到实验目的,故B错误;C、Na2O2吸收CO2产生O2,所以Na2O2可用作呼吸面具供氧剂,故C正确;D、该选项中的离子反应没有配平,将其配平后为2Na+2H2O2Na++2OH-+H2↑,故D错误。
3.为除去括号内的杂质,所选用的试剂或方法不正确的是( )A.Na2CO3溶液(NaHCO3),选用适量的NaOH溶液B.NaHCO3溶液(Na2CO3),应通入过量的CO2气体C.Na2O2粉末(Na2O),将混合物在氧气中加热D.Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤【解析】选D。

高一化学学习:高一化学钠的重要化合物四(实用版)编制人:______审核人:______审批人:______编制单位:______编制时间:__年__月__日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的实用资料,如工作总结、述职报告、心得体会、工作计划、演讲稿、教案大全、作文大全、合同范文、活动方案、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor.I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!And, this store provides various types of practical materials for everyone, such as work summaries, job reports, insights, work plans, speeches, lesson plans, essays, contract samples, activity plans, and other materials. If you want to learn about different data formats and writing methods, please pay attention!高一化学学习:高一化学钠的重要化合物四为大家提供高一化学学习:高一化学钠的重要化合物四一文,供大家参考使用:高一化学学习:高一化学钠的重要化合物四(能力提升)5Na2O2与足量NaHCO3混合后在密闭容器中充分加排除气体物质后冷却残留的是A.Na2CO3和Na2O2B.只有Na2CO3C.Na2CO3和NaOHD.Na2O和NaHCO36、要除去CO2中的HCl气体最好的方法是将混合气体通过A.饱和NaHCO3 B饱和Na2CO3溶液 C饱和石灰水 D氨水7欲除去小苏打溶液中的苏打杂质加入的物质最适宜的是A.通CO2 B加HCl C加CaCl2后过滤 D加Ca(OH)2后过滤8在一定温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原温,下列说法正确的是(_)A.溶液中Na+浓度增大,有O2放出B.溶液的OH-浓度不变,有H2放出C.溶液中Na+数目减少,有O2放出D.OH-浓度增大,有O2放出以上就是高一化学学习:高一化学钠的重要化合物四的所有内容,希望对大家有所帮助!。

⼈教版⼈中化学必修⼈2.1《钠及其化合物》练习题含答案2.1《钠及其化合物》练习含答案⼀、选择题(单选题,共14个⼀题,每⼀题4分,共56分)1、⼀属钠是⼀种活泼⼀属,除了具有⼀属的⼀般性质外,还具有⼀⼀的特性。
下列关于钠的叙述中,正确的是()A.钠是银⼀⼀⼀属,熔点低,硬度⼀B.钠放置在空⼀中,会迅速被氧化⼀⼀成淡黄⼀的氧化钠C.在氧⼀中加热时,⼀属钠剧烈燃烧,发出黄⼀⼀焰D.⼀属钠着⼀可以⼀泡沫灭⼀器或⼀⼀燥的沙⼀灭⼀解析A中,钠的硬度⼀,可⼀⼀⼀切割;B中,放置在空⼀中,钠被缓慢氧化⼀成⼀⼀Na2O;D中,钠着⼀时⼀成Na2O2,泡沫灭⼀器释放的泡沫中有CO2、H2O会与Na和Na2O2反应⼀成H2、O2,故不能⼀泡沫灭⼀器灭⼀。
答案C2、将⼀块银⼀⼀的⼀属钠放在空⼀中会发⼀⼀系列的变化:表⼀迅速变暗―→“出汗”―→变成⼀⼀固体(粉末),下列有关叙述中正确的是()A. 表⼀迅速变暗是因为钠与空⼀中的氧⼀反应⼀成了过氧化钠B. “出汗”是因为⼀成的氢氧化钠吸收空⼀中的H2O在表⼀形成了溶液C. 最后变成碳酸氢钠粉末D. 该过程中的所有化学反应均为氧化还原反应解析钠露置在空⼀中表⼀迅速变暗,是因为Na与O2反应⼀成了Na2O,A项错误;Na2O与⼀反应⼀成NaOH,NaOH⼀吸收空⼀中的H2O和CO2,⼀成Na2CO3·10H2O,Na2CO3·10H2O逐渐风化脱⼀,最后变成Na2CO3粉末,B正确;该过程中只有钠的氧化是氧化还原反应,C错误,应该是碳酸钠,碳酸氢钠不稳定,D项错误。
答案B3、下列叙述中正确的是() A.过氧化钠是淡黄⼀固体,久置于空⼀中变成⼀⼀氢氧化钠固体B.过氧化钠中阴阳离⼀⼀例为1∶2 C.⼀过氧化钠漂⼀织物、麦秆等⼀久⼀逐渐变成黄⼀ D.Na2O与Na2O2都能和⼀反应⼀成碱,它们都是碱性氧化物解析过氧化钠久置于空⼀中变成⼀⼀碳酸钠固体,A错误;过氧化钠漂⼀是由于它的氧化性将有⼀物质永久漂⼀,C错误;碱性氧化物与酸反应⼀成盐和⼀,Na2O2与酸反应⼀成盐、⼀和氧⼀,不是碱性氧化物,属于过氧化物,D错误。

主题5:钠及其重要化合物命题钠的性质和应用一1.判断下列叙述的正误(正确的打“√”,错误的打“×”)。
(1)(2018年浙江11月选考,9)金属钠着火时,可用细沙覆盖灭火。
( )(2)(2018年浙江11月选考,13)Na与CuSO 4水溶液反应的离子方程式为2Na+Cu2+ Cu+2Na+。
( )(3)(2017年江苏,6改编)钠与水反应的离子方程式为Na+2H 2O Na++2OH-+H2↑。
( )(4)(2017年全国Ⅱ卷,13改编)将金属钠放在燃烧匙中点燃,迅速伸入集满CO2的集气瓶,集气瓶中产生大量白烟,瓶内有黑色颗粒产生,证明CO2具有氧化性。
( )(5)(2016年全国Ⅱ卷,13改编)为比较水与乙醇中氢的活泼性,可分别将少量钠投入盛有水和乙醇的烧杯中。
( )(6)(2016年浙江理综,8)钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火。
( )(7)(2015年全国Ⅱ卷,10)钠在空气中燃烧可生成多种氧化物,23 g 钠充分燃烧时转移电子数为N A。
( )【解析】(3)钠和水反应生成氢氧化钠和氢气,离子方程式要遵循原子守恒、电荷守恒和得失电子守恒,离子方程式为2Na+2H 2O2Na++2OH-+H2↑,错误。
(4)瓶内有黑色颗粒产生,说明二氧化碳被还原,生成碳,反应中二氧化碳表现氧化性,正确。
(5)将相同质量、大小的钠投入同温同压下的水和乙醇中,根据产生气泡的快慢可以比较水和乙醇中氢的活泼性,正确。
(6)钾、钠、镁等活泼金属会与水反应生成氢气,氢气会燃烧甚至爆炸,不能用泡沫灭火器灭火,正确。
(7)23 g Na在空气中完全反应,无论生成Na2O还是Na2O2,钠元素的化合价均由0价→+1价,均转移1 mol 电子,正确。
【答案】(1)√(2)×(3)×(4)√(5)√(6)√(7)√2.(2018年海南,17)某小组在实验室中探究金属钠与二氧化碳的反应。
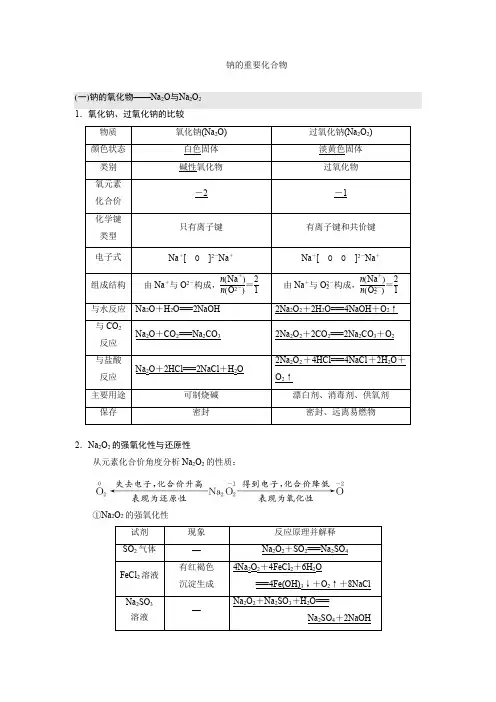
钠的重要化合物(一)钠的氧化物——Na2O与Na2O21.氧化钠、过氧化钠的比较Na+[O]2-Na+Na+[O O]2-Na+2.Na2O2的强氧化性与还原性从元素化合价角度分析Na2O2的性质:①Na2O2的强氧化性②遇KMnO4等强氧化剂时,表现出还原性,氧化产物为O2。
③遇CO2、H2O、H+时则会发生自身的氧化还原反应。
(二)Na2CO3与NaHCO31.Na2CO3与NaHCO3的性质比较CO2-3+H2O HCO-3+OH-HCO-3+H2O H2CO3+OH-2.Na2CO3、NaHCO3的用途(1)Na 2CO 3是一种非常重要的化工原料,在玻璃、肥皂、合成洗涤剂、造纸、纺织、石油、冶金、食品等工业中有着广泛的应用。
(2)NaHCO 3是焙制糕点所用的发酵粉的主要成分之一;在医疗上,它是治疗胃酸过多的一种药剂。
3.联合制碱法——侯氏制碱法 (1)制备原料食盐、氨气、二氧化碳——合成氨厂用水煤气制取氢气时的废气;其反应为C +H 2O(g) =====高温,CO +H 2,CO +H 2O(g)=====高温CO 2+H 2。
(2)工艺流程(3)反应原理①产生NaHCO 3的反应:NH 3+NaCl +CO 2+H 2O===NaHCO 3↓+NH 4Cl 。
②产生Na 2CO 3的反应:2NaHCO 3=====△Na 2CO 3+CO 2↑+H 2O 。
(4)绿色思想:循环使用的物质为CO 2、饱和食盐水。
[细练过关]题点(一) 钠的氧化物性质及探究 1.下列说法正确的是( ) A .Na 2O 2吸收CO 2、H 2O 可产生O 2,可用作呼吸面具供氧剂 B .Na 2O 与Na 2O 2与H 2O 反应均生成NaOH ,故二者均为碱性氧化物 C .Na 2O 2与Na 2O 中阴、阳离子个数比不同 D .Na 2O 2与CO 2反应时,CO 2作还原剂被氧化解析:选A B 项,Na 2O 2不是碱性氧化物;C 项,二者阴、阳离子个数比均为1∶2;D 项,CO 2为一般反应物,不是还原剂。

高考化学课时作业14钠的重要化合物一、选择题1.下列对于Na2O、Na2O2的比较正确的一项是()A.Na2O2、Na2O都是钠的氧化物,都是碱性氧化物B.Na2O、Na2O2都是易溶于水(与水反应)的白色固体C.Na2O2在和CO2的反应中既是氧化剂又是还原剂D.Na2O2、Na2O均可作供氧剂【解析】Na2O2与水反应时除了生成碱外,还生成了O2,故Na2O2不属于碱性氧化物,故A项错;Na2O2是淡黄色固体,故B项错;Na2O2与CO2和H2O反应时,是Na2O2中的氧元素之间发生了氧化还原反应,CO2、H2O既不是氧化剂又不是还原剂,Na2O2既作氧化剂又作还原剂,故C项正确;Na2O反应中无氧气产生,不能作供氧剂,D项错误。
【答案】 C2.向紫色石蕊溶液中加入过量Na2O2粉末,振荡,正确的叙述是()A.最后溶液变蓝色B.溶液先变蓝色最后褪色C.溶液仍为紫色D.因为Na2O2与石蕊发生氧化还原反应而无气泡产生【解析】氧化还原反应是一个比较慢的过程,而酸碱之间的反应较快。
紫色石蕊溶液中加入过量Na2O2粉末,首先会与水反应生成NaOH和H2O2,H2O2部分分解生成O2,生成的NaOH使紫色石蕊溶液变蓝色;由于H2O2有强氧化性,会慢慢将有机色素氧化为无色物质,所以最后溶液变为无色。
【答案】 B3.下列对于过氧化钠的叙述中,正确的是()A.过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物B.过氧化钠能与水反应,所以过氧化钠可以作很多气体的干燥剂C.过氧化钠与水反应时,过氧化钠是氧化剂,水是还原剂D.Na2O2与CO2反应时,1 mol Na2O2转移1 mol电子【答案】 D4.用光洁的铂丝蘸取某无色溶液在无色火焰上灼烧,直接观察时看到火焰呈黄色,下列判断正确的是( )A .只含Na +B .一定含Na +,可能含有K +C .既含有Na +,又含有K +D .可能含有Na +,可能还含有K +【解析】 钠的焰色是黄色,钾的焰色是紫色,观察钾的焰色时需要透过蓝色钴玻璃,以滤去黄色光的干扰,该实验中没有透过蓝色钴玻璃观察说明一定含Na +,不能确定是否含K +。

第8讲 钠及其化合物【考纲要求】 1.把握钠的主要性质及其应用。
2.把握钠的重要化合物的主要性质及其应用。
考点一|钠的性质和应用 焰色反应(基础送分型——自主学习) 授课提示:对应同学用书第37页[巩固教材学问] 1.物理性质(1)软——质软,硬度小,能用小刀切割 (2)亮——银白色,有金属光泽。
(3)轻——密度比水小,比煤油大。
(4)低——熔点低。
(5)导——可导电、导热。
2.化学性质 (1)完成化学方程式:Na ⎩⎪⎪⎨⎪⎪⎧与非金属单质反应⎩⎪⎨⎪⎧O 2⎩⎨⎧ 常温:4Na +O 2===2Na 2O 点燃:2Na +O 2=====点燃Na 2O 2Cl 2:2Na +Cl 2=====点燃2NaCl与水反应:2Na +2H 2O===2NaOH +H 2↑与盐溶液(如CuSO 4溶液)反应:2Na +CuSO 4+2H 2O===Cu (OH )2↓+Na 2SO 4+H 2↑与酸(如盐酸)反应离子方程式:2Na +2H +===2Na ++H 2↑(2)钠与含有酚酞的水反应的现象及解释3.钠的制取、保存(1)制取:化学方程式为2NaCl(熔融)=====电解2Na +Cl 2↑。
(2)保存:密封保存,通常保存在液态石蜡或煤油中。
4.钠的用途(1)制取Na 2O 2等化合物。
(2)钠、钾合金(液态)可用于原子反应堆的导热剂。
(3)用作电光源,制作高压钠灯。
(4)冶炼某些金属。
如4Na +TiCl 4=====熔融4NaCl +Ti 。
5.焰色反应 (1)概念:很多金属或它们的化合物在灼烧时都会使火焰呈现特殊颜色的现象。
属于元素的物理性质。
(2)操作步骤:铂丝――→酒精灯灼烧无色――→蘸取待测物――→酒精灯灼烧观看火焰颜色――→用稀盐酸洗涤铂丝――→酒精灯灼烧无色 (3)常见元素焰色反应的颜色:钠元素:黄色;钾元素:紫色(透过蓝色钴玻璃观看)。
6.正误推断,正确的打“√”,错误的打“×”。

《重要的金属化合物》知识清单一、钠的重要化合物1、氧化钠(Na₂O)和过氧化钠(Na₂O₂)氧化钠是白色固体,属于碱性氧化物,具有碱性氧化物的通性。
它能与水反应生成氢氧化钠:Na₂O + H₂O = 2NaOH;与二氧化碳反应生成碳酸钠:Na₂O + CO₂= Na₂CO₃。
过氧化钠是淡黄色固体,与氧化钠不同,它不是碱性氧化物。
过氧化钠与水反应会生成氢氧化钠和氧气:2Na₂O₂+ 2H₂O = 4NaOH + O₂↑;与二氧化碳反应生成碳酸钠和氧气:2Na₂O₂+ 2CO₂=2Na₂CO₃+ O₂。
过氧化钠因为能产生氧气,常用在呼吸面具和潜水艇中作为氧气的来源。
2、碳酸钠(Na₂CO₃)和碳酸氢钠(NaHCO₃)碳酸钠俗名纯碱或苏打,为白色粉末,易溶于水,水溶液呈碱性。
它能与盐酸反应:Na₂CO₃+ 2HCl = 2NaCl + H₂O + CO₂↑ 。
碳酸钠还能与氯化钙溶液反应生成碳酸钙沉淀:Na₂CO₃+ CaCl₂=CaCO₃↓ + 2NaCl 。
碳酸氢钠俗名小苏打,为白色细小晶体,能溶于水,水溶液的碱性比碳酸钠弱。
它与盐酸反应更剧烈:NaHCO₃+ HCl = NaCl + H₂O+ CO₂↑ 。
碳酸氢钠受热易分解:2NaHCO₃加热 Na₂CO₃+ H₂O + CO₂↑ 。
碳酸钠和碳酸氢钠在生活和工业中都有广泛的应用。
碳酸钠用于玻璃、造纸、纺织等工业;碳酸氢钠用于发酵粉、治疗胃酸过多等。
二、铝的重要化合物1、氧化铝(Al₂O₃)氧化铝是一种白色固体,属于两性氧化物,既能与酸反应又能与碱反应。
与盐酸反应:Al₂O₃+ 6HCl = 2AlCl₃+ 3H₂O ;与氢氧化钠溶液反应:Al₂O₃+ 2NaOH = 2NaAlO₂+ H₂O 。
氧化铝熔点很高,可用于制造耐火材料。
2、氢氧化铝(Al(OH)₃)氢氧化铝是白色胶状沉淀,具有两性。
与盐酸反应:Al(OH)₃+3HCl = AlCl₃+ 3H₂O ;与氢氧化钠溶液反应:Al(OH)₃+ NaOH = NaAlO₂+ 2H₂O 。

核心素养测评(七) 钠及其重要化合物一、选择题:本题包括12个小题,每小题仅有1个选项符合题意。
1.(2021·湖南衡阳一模)南朝陶弘景在《本草经集注》中记载有鉴别消石(KNO 3)与朴消(Na 2SO 4)之法:“以火烧之,紫青烟起,云是真消石也”。
该鉴别方法利用的原理是( )A .受热升华B .颜色反应C .焰色试验D .丁达尔效应解析:C 含有钾元素的物质在火焰上灼烧,火焰呈现紫色(透过蓝色钴玻璃片),该原理为焰色试验,C 正确。
2.化学与科学、技术、社会、环境密切相关。
下列有关说法中正确的是( )A .小苏打可用于生产玻璃,也可用来除去物品表面的油污B .过氧化钠可用于食品、羽毛和织物等的漂白C .医用酒精、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的D .使用含有氯化钠的融雪剂会加快桥梁的腐蚀解析:D 常用于生产玻璃和除油污的是碳酸钠,A 错误;过氧化钠具有强氧化性,因而具有漂白性,但不可用于漂白食品,B 错误;医用酒精使病毒的蛋白质变性而消毒,并非是将病毒氧化,C 错误;氯化钠溶液可以充当原电池的电解质溶液,使桥梁形成无数个微小的原电池,从而加速腐蚀,D 正确。
3.(2022·辽宁大连八中模拟)等质量的两块钠,第一块在足量氧气中加热,第二块在足量氧气中在常温下充分反应,则下列说法正确的是( )A .第一块钠失去电子多B .两块钠失去电子一样多C .第二块钠的反应产物质量大D .两块钠的反应产物质量一样大解析:B 金属钠失电子均变为+1价的阳离子,等质量的两块钠,失去电子的数目是一样的。
根据反应4Na +O 2===2Na 2O 可知,1 mol 金属钠完全反应得氧化钠的质量是31 g ,根据反应2Na +O 2=====△Na 2O 2可知,1 mol 金属钠完全反应得过氧化钠的质量是39 g ,等质量的两块钠的物质的量相等,所以生成过氧化钠的质量大,即第一块钠的反应产物质量大。
钠及其重要化合物一、单选题(共15题)1.一定温度下,向饱和碳酸钠溶液中通入足量的CO 2气体,忽略溶液体积的变化,所得溶液中有关量一定变大的是A .c (H +)B .c (Na +)C .n (H 2O)D .n ()2.下列关于钠及其化合物的说法正确的是A .与都具有强还原性B .和长期露置于空气中最终产物不相同C .将足量的、和分别加入含有酚酞的水中,最终溶液均变为红色D .将少量和分别投入溶液中,均既有沉淀生成又有气体放出3.以NaCl 为原料,可制取Na 、Na 2O 2、NaOH 和Na 2CO 3等。
Na 2CO 3,可用侯氏制碱法制取,主要涉及如下反应:N 2(g)+3H 2(g)2NH 3(g) ΔH=-92.4kJ·mol -1NaCl+NH 3+CO 2+H 2O=NaHCO 3↓+NH 4Cl 2NaHCO 3Na 2CO 3+CO 2↑+H 2O在指定条件下,下列选项所示的物质间转化不能实现的是A .Na(s)Na 2O 2(s)B .Na 2O 2(s)Na 2CO 3(s)C .NaCl(aq)Cl 2(g)D .NaOH(aq)Al(OH)3(s)4.下列过程不涉及氧化还原反应的是A .电解熔融氯化钠制备金属钠B .用氯气制消毒液C .过氧化钠做供氧剂D .用NaHCO 3治疗胃酸过多5.“铷(Rb)原子钟”被誉为卫星的“心脏”。
下列说法正确的是A .金属铷的熔点高于钾B .的中子数为48C .和化学性质不同D .铷元素属于ⅠB 族6.纯碱是重要的化工原料之一。
下列有关Na 2CO 3的说法错误的是A .Na 2CO 3的溶解度比NaHCO 3小B .Na 2CO 3是生产玻璃的原料之一23CO -Na Na +2Na O 22Na O Na 2Na O 22Na O Na 22Na O 4CuSO A A †‡AA Δ2O (g)Δ−−−→2CO (g)−−−→电解−−−−→Al(s)−−−→8537Rb 8537Rb 8737RbC .Na 2CO 3属于离子晶体D .Na 2CO 3的焰色反应呈黄色7.下列关于的叙述不正确的是A .是碱性氧化物B .能与发生反应C .可以作供氧剂D .能与发生反应8.向100mLNaOH 溶液中通入一定量的CO 2气体,充分反应后,再向所得溶液中逐滴加入0.2mol/L 的盐酸,产生CO 2的体积与所加盐酸体积之间关系如图所示。
第1节 钠及其化合物[考试说明] 1.掌握钠的主要性质及其用途。
2.了解钠的重要化合物的主要性质及其用途。
3.了解钠及其重要化合物的制备方法。
[命题规律] 钠及其化合物是高考化学中的基本知识之一,是高考的常考点,主要的考查形式有:结合阿伏加德罗常数、氧化还原反应以选择题形式考查Na 与H 2O 、Na 与O 2及Na 2O 2与H 2O 、CO 2反应的特点及电子转移情况;以选择题型考查Na 2O 2与H 2O 、CO 2反应的有关计算和Na 2CO 3与NaHCO 3稳定性的比较等;以Na 2O 2与H 2O 、Na 2O 2与CO 2、Na 2CO 3和NaHCO 3与盐酸反应为载体,设计实验以填空题型考查。
考点1 钠的性质及应用知识梳理 1.钠的物理性质2.钠的化学性质从原子结构认识钠的化学性质:Na――→Cl 2、O 2、H 2O 、H +等Na +(1)主要化学性质(2)钠与水(含酚酞)反应的实验现象及解释3.钠的制取及保存(1)制取:化学方程式为□232NaCl(熔融)=====电解2Na +Cl 2↑。
(2)保存:密封保存,通常保存在□24煤油中。
4.钠的用途(1)制取Na 2O 2等化合物。
(2)钠、钾合金(液态)可用于原子反应堆的导热剂。
(3)用作电光源,制作□25高压钠灯。
(4)冶炼某些金属。
金属钠具有强的□26还原性,熔融状态下可以用于制取金属,如4Na+TiCl 4=====熔融4NaCl +Ti 。
5.焰色反应(1)金属钠着火,不能用水、泡沫灭火器灭火,应用干燥的沙土盖灭。
(2)钠与水、酸、盐溶液反应的本质与顺序:本质上均是与H +的反应,反应顺序是“有酸酸在前、无酸水为先”。
(3)工业上在850 ℃,钠与熔融状态的KCl 反应可以制取金属钾:Na(l)+KCl(l)=====850 ℃NaCl(l)+K(g),反应发生是因为在反应温度下,体系中只有钾是气体,能从体系中逸出,利于反应进行,该反应不能说明金属钠的还原性强于金属钾。
高三化学钠及其化合物试题答案及解析1.某碱金属R与其氧化物R2O的混合物2.16g,跟足量水充分反应后,将所得溶液蒸干,得固体3.2 g,由此判定金属是()A.锂B.钠C.钾D.铷【答案】B【解析】设金属R的相对原子质量为a,若2.16g混合物全为R,由R~ROH的关系可知:可产生ROH的质量为21.6×(a+17)/ag,若2.16g混合物全为R2O,则有: M2O~2MOH2a+16 2(a+17)可知产生MOH的质量为了2.16×(a+17)/(a+8)g<3.2g<2.16×(a+17)/ag,解得16.69<a<35.3, 因此R为Na元素(相对原子质量为23),答案选 B.【考点】考查化学计算方法的应用2.下列各组中的两种物质作用,反应条件(温度或反应物用量)改变,不会引起产物种类改变的是A.Na和O2B.NaOH和CO2C.Na2O2和CO2D.AlCl3和NaOH【答案】C【解析】A、钠与氧气在常温下与加热条件下生成的产物不同,常温下生成氧化钠,加热生成过氧化钠,错误;B、氢氧化钠与少量二氧化碳反应生成碳酸钠,与过量二氧化碳反应生成碳酸氢钠,产物不同,错误;C、过氧化钠与二氧化碳反应生成碳酸钠和氧气,与量无关,正确;D、氯化铝与少量氢氧化钠反应生成氢氧化铝沉淀,与过量氢氧化钠反应生成偏铝酸钠,产物不同,错误,答案选C。
【考点】考查物质之间的反应与量的关系3.不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是A.分别在这两种物质的溶液中,加入少量澄清石灰水B.分别加热这两种固体,将生成的气体通入澄清石灰水中C.分别在这两种物质的溶液中,加入少量氯化钙溶液D.分别在这两种物质的等浓度的溶液中,加入少量的稀盐酸【答案】A【解析】A、碳酸钠与碳酸氢钠均与澄清石灰水反应生成沉淀碳酸钙,所以不能鉴别,正确;B、碳酸氢钠对热不稳定,受热分解生成二氧化碳气体,使澄清石灰水变浑浊,可以鉴别,错误;C、碳酸钠与氯化钙反应生成沉淀,碳酸氢钠不能,可以鉴别,错误;D、碳酸氢钠与盐酸反应产生气体的速率快,而碳酸钠与盐酸反应产生气体的速率慢,可以鉴别,错误,答案选A。
钠及其重要化合物【考情分析】在近几年的高考中,主要以钠及化合物为知识载体考查学生的思维能力、实验能力、计算能力。
钠的化合物在日常生活和工农业生产中扮演着重要角色,随着高考试题与社会生活联系的日益密切,钠、过氧化钠的性质,NaHCO 3、Na 2CO 3与酸、碱、盐溶液的反应仍然是高考命题的热点。
预计今后仍将以钠及其化合物之间的转化为载体,结合生活、生产及物质的应用,以工业流程题、实验题、选择题和鉴别题等形式出现的可能性较大,也可能出现综合性计算题。
【核心素养分析】1.宏观辨识与微观探析:认识钠及其化合物的性质和应用。
能从钠的原子结构及其重要化合物的微观结构理解其性质,领悟结构决定性质。
2.科学探究与创新意识:了解钠及其化合物的性质探究方案,并积极参与实验探究过程,得出相关结论。
【网络构建】【知识梳理】智能点一 钠的性质及应用 1.钠的物理性质银白色,有金属光泽的固体,质地柔软,熔点低(小于100 ℃),密度比水的小,但比煤油的大,即ρ(H 2O)>ρ(Na)>ρ(煤油)。
2.从钠原子的原子结构认识钠的化学性质——还原性Na―――――――――――→O 2、Cl 2、H 2O 、H +等失去e-Na +(1)与非金属单质(如O 2、Cl 2)的反应O 2:常温:4Na +O 2===2Na 2O,加热:2Na +O 2Na 2O 2 Cl 2:2Na +Cl 2=====点燃2NaCl (2)与水反应①离子方程式:2Na +2H 2O===2Na ++2OH -+H 2↑。
②与滴加酚酞的水反应的现象及解释(3)与盐酸反应离子方程式:2Na +2H +===2Na ++H 2↑。
(4)与盐反应 a .与熔融盐反应 如:4Na +TiCl 44NaCl +TiNa +KClNaCl +K ↑(制取金属钾,因为钾的沸点比钠的沸点低,使钾成为蒸汽而逸出)b .与盐溶液反应Na 与CuSO 4溶液反应的化学方程式2Na +CuSO 4+2H 2O===Na 2SO 4+H 2↑+Cu(OH)2↓。
钠的重要化合物B
二、非选择题
13.把a g固体NaHCO3加热分解一段时间后,固体质量变为b g。
(1)尚未分解的NaHCO3质量为________g。
(2)生成的Na2CO3,质量为________g。
(3)当b为________g时,表明NaHCO3完全分解。
14.在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。
请选用适当的化学试剂和实验用品、用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。
(1)A是制取CO2的装置。
写出A中发生反应的化学方程式:
_______________________________。
(2)填写表中空格:
(4)试管F中收集满气体后,下一步实验操作是:
_________________________________________。
15.“套管实验”是将一支较小的玻璃仪器装入另一玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验。
因其具有许多优点,近年被广泛开发并应用于化学实验中。
请观察下列实验装置,分析实验原理,并回答下列问题:
(1)从点燃酒精灯开始,试管及烧杯A 、B 中能观察到的现象有
_____________________________。
(2)整个实验结束时,在操作上需要特别注意的问题是
__________________________________。
(3)通过该实验可以得到的结论是(结合化学方程式来说明)__________________ __
__________
____________________________________________________________________________。
16.将Na 2CO 3和NaHCO 3混合物19g ,充分加热后,收集到的CO 2有1.12L(标准状况),冷却后将
剩余固体溶于300mL 水中,配成一定浓度的溶液。
求:
(1)原混合物中Na 2CO 3的质量。
(2)所配制的溶液的物质的量浓度。
13.【答案】 (1)84b -53a 31 (2)5331 (a -b ) (3)53a 84
【点拨】 本题采用差量法。
设已经分解的NaHCO 3的质量为x ,生成的Na 2CO 3的质量为y
2NaHCO 3=====△
Na 2CO 3+CO 2↑+H 2O↑ Δm
2×84 106 62
x y (a -b )g
解得x =84a -b
31 g
y =5331(a -b ) g 即分解的NaHCO 3为
84a -b
31g ,尚未分解的 NaHCO 3为[a -84a -b
31] g =84 b -53 a 31
g 若NaHCO 3完全分解,则b 为:
NaHCO 3=====△
NaHCO 3+H 2O +CO 2↑
168 106
a b
b =106a 168 g =53a 84 g
14.【答案】 (1)CaCO 3+2HCl===CaCl 2+H 2O +CO 2↑
(2)
222232(4)把E 中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,将试管正立,松开拇指,立即把带火星的木条伸入。
15.【答案】 (1)开始两烧杯中均有气泡冒出,加热一段时间后,大试管中无明显变化,小试管内壁上有水珠出现;烧杯A 中无明显变化,烧杯B 中出现白色浑浊
(2)先把导气管从烧杯中取出,再移去酒精灯
(3)NaHCO 3的热稳定性不如Na 2CO 3,
2NaHCO 3=====△
Na 2CO 3+CO 2↑+H 2O
16.【答案】 (1)10.6 g (2)0.5mol/L。