
第6章单组元相图及纯晶体的凝固
由一种元素或化合物构成的晶体称为单组元晶体或纯晶体,该体系称为单元系。对于纯晶体材料而言,随着温度和压力的变化,材料的组成相随之而变化。从一种相到另一种相的转变称为相变,由液相至固相的转变称为凝固,如果凝固后的固体是晶体,则又可称之为结晶。而由不同固相之间的转变称为固态相变,这些相变的规律可借助相图直观简明地表示出来。单元系相图表示了在热力学平衡条件下所存在的相与温度和压力之间的对应关系,理解这些关系有助于预测材料的性能。本章将从相平衡的热力学条件出发来理解相图中相平衡的变化规律。在这基础上,进一步讨论纯晶体的凝固热力学和动力学问题,以及内外因素对晶体生长形态的影响,鉴于单组元高分子(均聚物)的某些特殊性,本章专列一节"高分子的结晶特征"。
6.1单元系相变的热力学及相平衡
6.1.1 相平衡条件和相律
组成一个体系的基本单元,例如单质(元素)和化合物,称为组元。体系中具有相同物理与化学性质的,且与其他部分以界面分开的均匀部分称为相。通常把具有n个组元都是独立的体系称为n元系,组元数为一的体系称为单元系。
处于平衡状态下的多相(P个相)体系,每个组元(共有C个组元)在各相中的化学势都必须彼此相等。处于平衡状态的多元系中可能存在的相数将有一定的限制。这种限制可用吉布斯相律表示之:
f=C-P+2
式中,f为体系的自由度数.它是指不影响体系平衡状态的独立可变参数(如温度、压力、浓度等)的数目;C为体系的组元数;P为相数。
对于不含气相的凝聚体系,压力在通常范围的变化对平衡的影响极小,一般可认为是常量。因此相律可写成下列形式:
f=C-P+1
相律给出了平衡状态下体系中存在的相数与组元数及温度、压力之间的关系,对分析和研究相图有重要的指导作用。
6.1.2 单元系相图
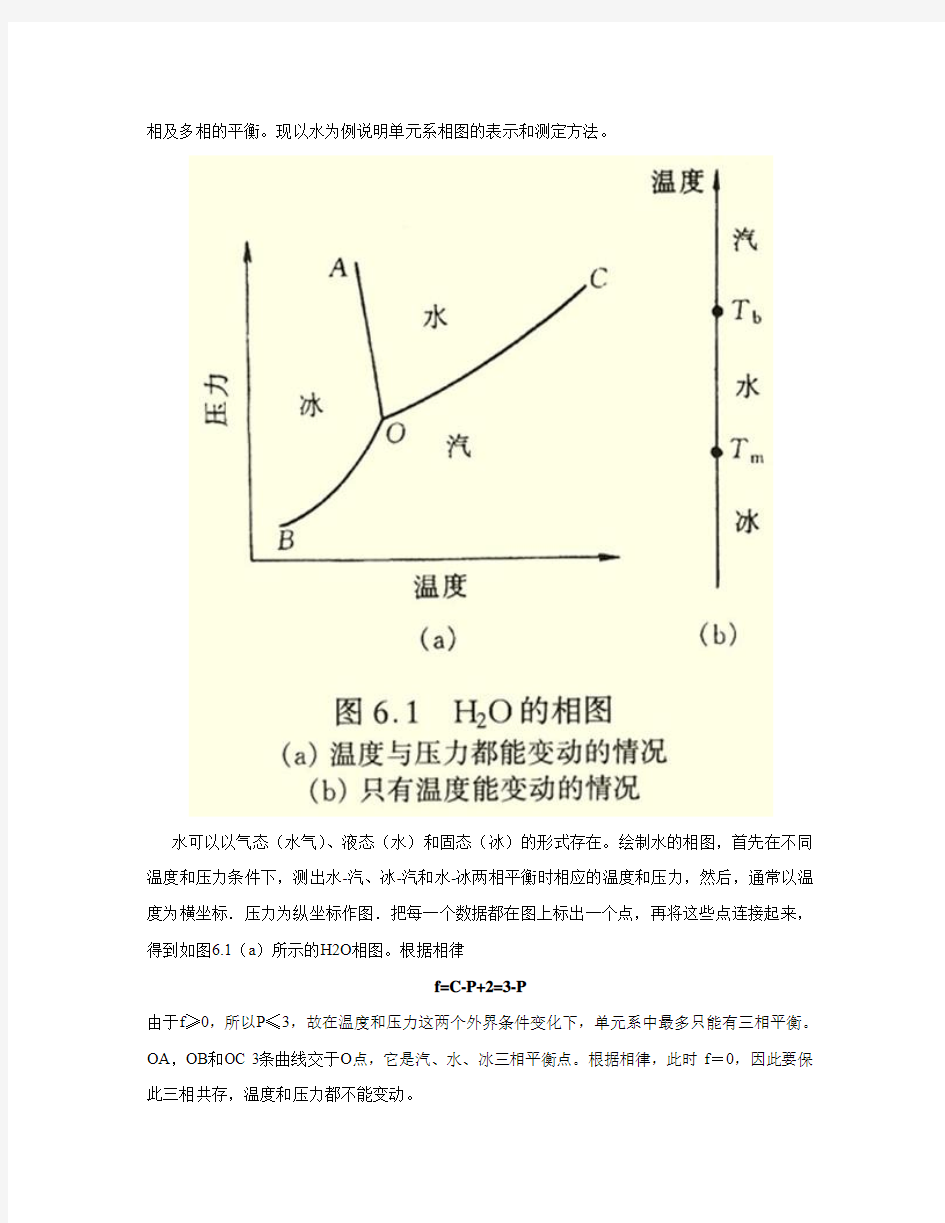
单元系相图是通过几何图形描述由单一组元构成的体系在不同温度和压力条件下所可能存在的
相及多相的平衡。现以水为例说明单元系相图的表示和测定方法。
水可以以气态(水气)、液态(水)和固态(冰)的形式存在。绘制水的相图,首先在不同温度和压力条件下,测出水-汽、冰-汽和水-冰两相平衡时相应的温度和压力,然后,通常以温度为横坐标.压力为纵坐标作图.把每一个数据都在图上标出一个点,再将这些点连接起来,得到如图6.1(a)所示的H2O相图。根据相律
f=C-P+2=3-P
由于f≥0,所以P≤3,故在温度和压力这两个外界条件变化下,单元系中最多只能有三相平衡。OA,OB和OC 3条曲线交于O点,它是汽、水、冰三相平衡点。根据相律,此时f=0,因此要保此三相共存,温度和压力都不能变动。
如果外界压力保持恒定(例如一个标准大气压),那么单元系相图只要一个温度轴来表示,如水的情况见图6.1(b)。根据相律,在汽、水、冰的各单相区内(f=1),温度可在一定范围内变动。在熔点和沸点处,两相共存,f=0,故温度不能变动,即相变为恒温过程。
在单元系中,除了可以出现气、液、固三相之间的转变外,某些物质还可能出现固态中的同素异构转变。
除了某些纯金属,如铁等具有同素异构转变之外,在某些化合物中也有类似的转变,称为同分异构转变或多晶型转变。
6.2 纯晶体的凝固
6.2.1 液态结构
凝固是指物质由液态至固态的转变。因此,了解凝固过程首先应了解液态的结构。由X射线衍射对金属的径向分布密度函数的测定表明.液体中原子间的平均距离比固体中略大;液体中原子的配位数比密排结构晶体的配位数减小,通常在8~11的范围内。上述两点均导致熔化时体积略为增加,但对非密排结构的晶体如Sb,Bi,Ga,Ge等,则液态时配全数反而增大,故熔化时体积略为收缩。除此以外,液态结构的最重要特征是原子排列为长程无序,短程有序,并且短程有序原子集团不是固定不变的,它是一种此消彼长,瞬息万变,尺寸不稳定的结构,这种现象称为结构起伏,这有别于晶体的长程有序的稳定结构。
6.2.2 晶体凝固的热力学条件
晶体的凝固通常在常压下进行,从相律可知,在纯晶体凝固过程中,液固两相处于共存,自由度等于零,故温度不变。按热力学第二定律,在等温等压下,过程自发进行的方向是体系自由能降低的方向。自由能G用下式表示:
G=H-TS,
式中,H是焓;T是绝对温度;S是熵,可推导得
dG=Vdp-SdT。
在等压时,dp=0,故上式简化为:
由于熵恒为正值,所以自由能是随温度增高而减小。
纯晶体的液、固两相的自由能随温度变化规律如图6.5所示。这样,两条斜率不同的曲线必然相交于一点,该点表示液、固两相的自由能相等,故两相处于平衡而共存,此温度即为理论凝固温度,也就是晶体的熔点Tm。事实上,在此两相共存温度,既不能完全结晶,也不能完全熔化,要发生结晶则体系必须降至低于Tm温度,而发生熔化则必须高于Tm。
在一定温度下,从一相转变为另一相的自由能变化为
式中,ΔT=Tm-T,是熔点Tm与实际凝固温度T之差。
由上式可知,要使ΔGv<0,,必须使Δ T>0,即T<Tm,故ΔT称为过冷度。晶体凝固的热力学条件表明,实际凝固温度应低于熔点Tm,即需要有过冷度。
6.2.3 形核
1.均匀形核
a.晶核形成时的能量变化和临界晶核晶体熔化后的液态结构从长程来说是无序的,而在短程范围内却存在着不稳定的,接近于有序的原子集团(尤其是温度接近熔点时)。由于液体中原子热运动较为强烈,在其平衡位置停留时间甚短,故这种局部有序排列的原子集团此消彼长,即前述的结构起伏或称相起伏。当温度降到熔点以下,在液相中时聚时散的短程有序原子集团,就
可能成为均匀形核的"胚芽"或称晶胚,其中的原子呈现晶态的规则排列,而其外层原子与液体中不规则排列的原子相接触而构成界面。因此,当过冷液体中出现晶胚时,一方面由于在这个区域中原子由液态的聚集状态转变为晶态的排列状态,使体系内的自由能降低(ΔGv<0),这是相变的驱动力;另一方面,由于晶胚构成新的表面,又会引起表面自由能的增加,这构成相变的阻力。在液—固相变中,晶胚形成时的体积应变能可在液相中完全释放掉,故在凝固中不考虑这项阻力。但在固—固相变中,体积应变能这一项是不可忽略的。假定晶胚为球形,半径为r,当过冷液中出现一个晶胚时,总的自由能变化面G应为
式中,σ为比表面能,可用表面张力表示。
在一定温度下,|¤Gv和σ是确定值,所以|¤G是r的函数。|¤G在半径为r*时达到最大值。当晶胚的r<r*时,则其长大将导致体系自由能的增加,故这种尺寸晶胚不稳定,难以长大,最终熔化而消失。当r>r*时,晶胚的长大使体系自由能降低,这些晶胚就成为稳定的晶核。因此,半径为r*的晶核称为临界晶核,而r*为临界半径。
临界半径由过冷度上T决定,过冷度越大,临界半径r"越小,则形核的几率增大,晶核的数目增多。液相必须处于一定的过冷条件时方能结晶,而液体中客观存在的结构起伏和能量起伏是促成均匀形核的必要因素。
b.形核率
当温度低于Tm时,单位体积液体内在单位时间所形成的晶核数(形核率)受两个因素的控制,即形核功因子
6.2.4 晶体长大
形核之后,晶体长大,其涉及到长大的形态,长大方式和长大速率。形态常反映出凝固后晶体的性质,而长大方式决定了长大速率,也就是决定结晶动力学的重要因素。1.液-固界面的构造晶体凝固后呈现不同的形状,如水杨酸苯脂呈现一定晶形长大,由于它的晶边呈小平面,称为小平面形状,如图6.11 所示。硅、锗等晶体也属此类型。而环己烷长成树枝形状,如图6.12所示,大多金属晶体属此类型,它不具有一定的晶形,称非小平面形状。
图6.11 透明水样苯酯晶体的小面形态×60 图6.12 透明环己烷凝固成树枝形晶体×60 经典理论认为,晶体长大的形态与液、固两相的界面结构有关。晶体的长大是通过液体中单个并按照晶面原子排列的要求与晶体表面原子结合起来。按原子尺度,把相界面结构分为粗糙界
面和光滑界面两类,如图6.13所示。
杰克逊(K.A.Jackson)提出决定粗糙及光滑界面的定量模型。他假设液-固两相在界面处于局部
平衡,故界面构造应是界面能最低的形式。如果有N个原子随机地沉积到具有NT个原子位置的固-液界面时,则界面自由能的相对变化ΔGS由下式表示:
式中,k是玻尔兹曼常数;Tm是熔点;x是界面上被固相原子占据位置的分数;而,其中Lm 为熔化热,,η是界面原子的平均配位数;v是晶体配位数。ξ恒小于1。
将(6.29)式按与x的关系作图,并改变a值,得到一系列曲线,如图6.14所示,由此得到如下的结论:
1).对于a≤2的曲线,在x=0.5处界面能具有极小值,即界面的平衡结构应是约有一半的原子被固相原子占据而另一半位置空着,这时界面为微观粗糙界面。
2).对于a≥2时,曲线有两个最小值,分别位于x接近0处和接近1处,说明界面的平衡结构应是只有少数几个原子位置被占据,或者极大部分原子位置都被固相原子占据,即界面基本上为完整的平面,这时界面呈光滑界面。
金属和某些低熔化熵的有机化合物,a≤2时,其液一固界面为粗糙界面;多数无机化合物,以及亚金属铋、锑、镓、砷和半导体锗、硅等,当a>2时,其液一固界面为光滑界面。但以上的预测不适用于高分子,由于它们具有长链分子结构的特点,其固相结构不同于上述的原子模型。2.晶体长大方式和生长递率晶体的长大方式与上述的界面构造有关,可有连续长大、二维形核、螺型位错长大等方式。a.连续长大对于粗糙界面,由于界面上约有一半的原子位置空着,故液相的原子可以进入这些位置与晶体结合起来,晶体便连续地向液相中生长,故这种生长方式为垂直生长。对于大多数金属来说,由于动态过冷度很小,因此其平均生长速率与过冷度成正比,即
式中,u1为比例常数,视材料而定,单位是m/s×K。有人估计u1约为10-2m/s×K,故在较小的过冷度下,即可获得较大的生长速率。但对于无机化合物如氧化物,以及有机化合物等粘性材料,随过冷度增大到一定程度后,生长速率达到极大值后随后下降。b.二维形核二维晶核是指一定大小的单分子或单原子的平面薄层。若界面为光滑界面,二维晶核在相界面上形成后,液相原子沿着二维晶核侧边所形成的台阶不断地附着上去,使此薄层很快扩展而铺满整个表面。c.藉螺型位错生长若光滑界面上存在螺型位错时,垂直于位错线的表面呈现螺旋形的台阶,且不会消失。因为原子很容易填充台阶,而当一个面的台阶被原子进入后,又出现螺旋型的台阶。在最接近位错处,只需要加入少量原子就完成一周,而离位错较远处需较多的原子加入。这样就使晶体表面呈现由螺旋形台阶形成的蜷线。
6.2.5 结晶动力学及凝固组织
1.结晶动力学
由新相的形核率N及长大速率v
可以计算在一定温度下随时间改变的转变量,导得结晶
g
动力学方程
为上式称为约翰逊-梅尔(Johnson-Mehl)动力学方程,并可应用于在四个条件( 均匀形核,N和v
g
常数,以及小的|ó值)下的任何形核与长大的转变。当N与时间相关时,阿弗拉密(Avrami)考虑形核率与时间呈指数关系变化后,得到
上式称为阿弗拉密方程。式中n称为阿弗拉密指数,与相变机制相关,一般在1~4范围内取值,式中k为常数。阿弗拉密方程是描述结晶和固态相变中转变动力学的唯象方程。
2.纯晶体凝固时的生长形态
纯晶体凝固时的生长形态不仅与液-固界面的微观结构有关,而且取决于界面前沿液相中的温度分布情况,温度分布可有两种情况:正的温度梯度和负的温度梯度,分别如图6.21(a),(b)所示。
a.在正的温度梯度下的情况
正的温度梯度指的是随着离开液-固界面的距离z的增大,液相温度T随之升高的情况,即dT/dz>0。在这种条件下,结晶潜热只能通过固相而散出,相界面的推移速度受固相传热速度所控制。晶体的生长以接近平面状向前推移,这是由于温度梯度是正的,当界面上偶尔有凸起部分而伸入温度较高的液体中时,它的生长速度就会减缓甚至停止,周围部分的过冷度较凸起部分大而会赶上来,使凸起部分消失,这种过程使液-固界面保持稳定的平面形态。
b.在负的温度梯度下的情况
负的温度梯度是指液相温度随离液-固界面的距离增大而降低,即dT/dz<0。当相界面处的温度由于结晶潜热的释放而升高,使液相处于过冷条件时,则可能产生负的温度梯度。此时,相界面上产生的结晶潜热即可通过固相也可通过液相而散失。相界面的推移不只由固相的传热速度所控制,在这种情况下,如果部分的相界面生长凸出到前面的液相中,则能处于温度更低
(即过冷度更大)的液相中,使凸出部分的生长速度增大而进一步伸向液体中。在这种情况下液-固界面就不可能保持平面状而会形成许多伸向液体的分枝(沿一定晶向轴),同时在这些晶枝上又可能会长出二次晶技,在二次晶技再长出三次晶枝,如图6.23所示。晶体的这种生长方式称为树枝生长或树枝状结晶。树技状生长时,伸展的晶枝轴具有一定的晶体取向,这与其晶体结构类型有关,例如:
面心立方<100>
体心立方<100>
排六方<1010>
6.2.6 高分子的结晶特征
高分子中的晶体像金属、陶瓷及低分子有机物一样,在三维方向上具有长程有序排列,因此,高分子的结晶行为在许多方面与它们具有相似性。但由于高分子是长链结构,要使高分子链的空间结构均以高度的规整性排入晶格,这比低分子要困难得多,这使得高分子结晶呈现出不完全性和不完善性、熔融升温和结晶速度慢的特点。本节将简要描述高分子在结晶方面与低分子的异同性。
1.相似性
1).晶粒尺寸受过冷度影响。结晶高分子从熔点(Tm)以上冷却到熔点和玻璃化转变温度(Tg)之间的任何一个温度下都能结晶。结晶需要过冷度,并随着过冷度的增加,形核率增加。高分子从熔体(液)冷却结晶时,通常形成球晶。
2).高分子的结晶过程包括形核与长大两个过程。形核又分为均匀(均相)形核和非均匀(异相)形核两类。均匀形核是由熔体中的高分子链段靠热运动形成有序排列的链束为晶核;而非均匀形核则以外来的杂质,未完全熔化的残余结晶高分子,分散的小颗粒或容器的型壁为中心,吸附熔体中的高分子链作有序排列而形成晶核。
3).非均匀形核所需的过冷度较均匀形核小。
4).高分子的等温结晶转变量也可用阿弗拉密方程来描述。高分子熔体冷却结晶时,体积不断收缩,通常可用膨胀仪测定高分子结晶过程中的体积收缩量。如果用Vn,Vt和V?T分别表示高分子在起始时刻、t时刻和结晶终止时刻未结晶的质量体积,那么阿弗拉密方程为
式中,u为未结晶的体积分数;k为结晶速率常数;n为阿弗拉密指数。
2.差异性
高分子结晶具有不完全性。最易结晶的聚乙烯,其最高结晶度为95%,而一般高分子大多只有50%左右。高分子结晶的不完全性及其结晶能力的大小起因于大分子链结构特征。影响高分子结晶能力的结构因素有:
(1) 链的对称性。高分子链的结构对称性越高,越容易结晶。例如,聚乙烯和聚四氟乙烯的分子,主链上全部是碳原子,碳原子上都是氢原子或氟原子,对称性高,故最容易结晶。(2) 链的规整性。对于主链型完全是无规的,不具有对称中心的高分子,一般都失去结晶能力。例如,自由基聚合的聚苯乙烯,聚甲基丙烯酸甲酯等就是完全不能结晶的非晶高分子。(3) 共聚效应。两种或两种以上不同单体分子形成的高分子称为共聚物。无规共聚通常会破坏链的对称性和规整性,从而使结晶能力降低甚至丧失殆尽。但是,如果两种共聚单元的均聚物(均聚物由一种单体生成的高分子)有相同类型的结晶结构,那么共聚物也能结晶。
(4)链的柔顺性。链的柔顺性是结晶时链段向结晶表面扩散和排列所必须的,因此,使链柔顺性降低的结构因素,均会影响高分子的结晶能力。例如,聚乙烯的主链柔顺性很好,如果含苯环后使聚对苯二甲酸乙二醇酯链的柔顺性降低,结晶能力显著减弱。
结晶高分子与低分子另一个差异是熔融过程中通常出现升温现象(边熔融边升温)。图
6.28(a),(b)分别示出了结晶高分子和低分子熔融过程质量体积-温度曲线。由图可知,结晶高分子的熔融过程与低分子没有本质上的差异,热力学函数(如质量体积、比热容等)发生突变,只是程度上有差异,这一过程不像低分子那样发生在0.2℃的狭窄的温度范围,而存在一个较宽的熔融温度范围,这个温度范围称为熔限。在这个温度范围内,发生熔融升温的现象,这不像低分子那样几乎在液、固两相热力学平衡的恒温下结晶。
Chapter 6 Phase diagram of single-component and Solidification for pure metal 作业1:The solid-liquid interfacial energy of pure silver is 0.126J/m 2. The latent heat of melting is 104.6J/g. The melting point of pure silver is 961℃. The density of solid/liquid silver at the melting point is 10.5g/cm 3 . (15points) (1) What is the value of the critical radius at 700℃? (2) What is the value of ΔG * at this radius? 作业2:This diagram is for a hypothetical embryo of silver growing against an arbitrary mold wall. With the aid of this diagram, (a) Compute the angle of contact, θ, of the embryo with the mold wall. (b) Determine the magnitude of the factor that may be used to convert the homogeneous free energy needed to obtain a nucleus into that of the corresponding heterogeneous free energy. 作业3: 已知纯铜的熔化潜热为1.88×109J/M 2,熔点为1089℃,点阵常数为3.4167?, 发生 均匀形核过冷度为230K ,21SL /10*44.1m J -=σ 。求铜的临界晶核半径?γ及临界晶核中所含的铜原子数。 作业4:已知锌的熔点为419℃,其结晶潜热为7×108J/m 3,液固界面能2/06.0m J =σ, 锌的原子量为65.4,密度为7.18g/cm 3,试计算锌在350℃结晶后的临界晶核半径,并说明晶核内有多少个锌原子? 作业5:金的熔点为1064℃,溶化潜热为12.8KJ/mol, 若液态金在1000℃时发生结晶,其 临界晶核半径m 10*10*3.43-=γ ,试计算金属的液固界面能。 作业6:解释金属结晶时,为什么会产生过冷? 作业7:在均匀形核时,若设晶核形状为边长a 的立方体,试求其临界晶核半径及形核功。
实验二探究晶体的熔化和凝固规律 1、下图是某种晶体的熔化曲线,从图中可以看出: (1)这种晶体的熔点是__________℃。 (2)其熔化过程共经历了min。 (3)第4min时,该晶体处于态。 (4)第8min时,该晶体处于___________态。 (5)第10min时,该晶体处于___________态。 答案:80,4,固、固液共存、液态 2、下表为小丽在探究某种物质的熔化规律时记录的实验数据,请你根据表中的实验数据回答下列问题: (1)该物质的熔点是_________℃; (2)该物质是__________(选填“晶体”或“非晶体”); (3)温度为-3℃时,该物质处于___________态。 (4)温度为0℃时,该物质处于___________态。 (5)温度为1℃时,该物质处于___________态。 (6)该物质熔化过程中吸收热量温度__________选填(“升高”或“不变”) (7)该物质熔化时需要对它加热,这是通过改变其内能(选填“做功”或“热传递”)的。 (8)5至8分钟,该物质的温度保持不变,其内能。(选填“不变”或“增大”) (9)下表是小明在标准大气压下探究某种物质的凝固特点时记录的实验数据,从开始计时起,到第min时的数据有明显错误 答案:0,晶体,固、固液共存、液、不变、增大、热传递、1.5 3、如图13甲所示,是探究萘熔化过程中温度变化规律的实验。请回答下列问题: ①将装有萘的试管放入水中加热,而不是用酒精灯直接对试管加热,在加热过程中还进行搅拌,这样做是为了使试管中的萘受热,而且萘的温度上升较(选填“快”或“慢”),便于及时记录各个时刻的温度。 ②除图13甲所示实验器材外,还需要的实验器材有火柴和。 ③萘的温度随加热时间变化的图像如图13乙所示,由图可知,给萘加热到8min末,试管中的萘所处的物态是态。 答案:均匀、慢、秒表、固液共存
第五章 三元合金相图 1 根据Fe -C -Si 的3.5%Si 变温截面图(5-1),写出含0.8%C 的Fe-C-Si 三元合金在平衡冷却时的相变过程和1100℃时的平衡组织。 图5-1 2 图5-2为Cu-Zn-Al 合金室温下的等温截面和2%Al 的垂直截面图,回答下列问题: 1) 在图中标出X 合金(Cu-30%Zn-10%Al )的成分点。 2) 计算Cu-20%Zn-8%Al 和 Cu-25%Zn-6%Al 合金中室温下各相的百分含量,其中α相成分点为Cu-22.5%Zn-3.45%Al ,γ相成分点为 Cu-18%Zn-11.5%Al 。 3) 分析图中Y 合金的凝固过程。 Y
% 图5-2 3 如图5-3是A-B-C 三元系合金凝固时各相区,界面的投影图,A 、B 、C 分别形成固溶体α、β、γ。 1) 写出P p '',P E '1和P E '2单变量线的三相平衡反应式。 2) 写出图中的四相平衡反应式。 3) 说明O 合金凝固平衡凝固所发生的相变。
图5-3 图5-4 4 图5-4为Fe-W-C三元系的液相面投影图。写出e1→1085℃,P1→1335℃,P2→1380℃单变量线的三相平衡反应和1700℃,1200℃,1085℃的四相平衡反应式。I,II,III三个合金结晶过程及室温组织,选择一个合金成分其组织只有三元共晶。 5 如图5-5为Fe-Cr-C系含13%Cr的变温截面 1)大致估计2Cr13不锈钢的淬火加热温度(不锈钢含碳量0.2%, 含Cr量13%) 2)指出Cr13模具钢平衡凝固时的凝固过程和室温下的平衡组织(Cr13钢含碳量2%)3)写出(1)区的三相反应及795 时的四相平衡反应式。 图5-5 图5-6 6 如图5-6所示,固态有限溶解的三元共晶相图的浓度三角形上的投影图,试分析IV区及VI区中合金之凝固过程。写出这个三元相图中四相反应式。
物质的熔沸点的高低与构成该物质的晶体类型及晶体内部粒子间的作用力有关,其规律如下: 1、在相同条件下,不同状态的物质的熔、沸点的高低是不同的,一般有:固体>液体>气体。例如:NaBr(固)>Br2>HBr(气)。 2、不同类型晶体的比较规律 一般来说,不同类型晶体的熔沸点的高低顺序为:原子晶体>离子晶体>分子晶体,而金属晶体的熔沸点有高有低。这是由于不同类型晶体的微粒间作用不同,其熔、沸点也不相同。原子晶体间靠共价键结合,一般熔、沸点最高;离子晶体阴、阳离子间靠离子键结合,一般熔、沸点较高;分子晶体分子间靠范德华力结合,一般熔、沸点较低;金属晶体中金属键的键能有大有小,因而金属晶体熔、沸点有高(如W)有低(如Hg)。例如:金刚石>食盐>干冰 3、同种类型晶体的比较规律 A、原子晶体:熔、沸点的高低,取决于共价键的键长和键能,键长越短,键能越大共价键越稳定,物质熔沸点越高,反之越低。如:晶体硅、金刚石和碳化硅三种晶体中,因键长C—C
B 、离子晶体:熔、沸点的高低,取决于离子键的强弱。一般来说,离子半径越小,离子所带电荷越多,离子键就越强,熔、沸点就越高,反之越低。 例如:MgO>CaO ,NaF>NaCl>NaBr>NaI 。 KF >KCl >KBr >KI ,CaO >KCl 。 C 、金属晶体:金属晶体中金属阳离子所带电荷越多,半径越小,金属阳离子与自由电子静电作用越强,金属键越强,熔沸点越高,反之越低。如:Na <Mg <Al ,Li>Na>K 。 合金的熔沸点一般说比它各组份纯金属的熔沸点低。如铝硅合金<纯铝(或纯硅)。 D 、分子晶体:熔、沸点的高低,取决于分子间作用力的大小。分子晶体分子间作用力越大物质的熔沸点越高,反之越低。(具有氢键的分子晶体,熔沸点反常地高) 如:H 2O >H 2Te >H 2Se >H 2S ,C 2H 5OH >CH 3—O —CH 3。 (1)组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔沸点越高。如:CH 4<SiH 4<GeH 4<SnH 4。 (2)组成和结构不相似的物质(相对分子质量相近),分子极性越大,其熔沸点就越高。如熔沸点 CO >N 2,CH 3OH >CH 3—CH 3。 (3)在高级脂肪酸形成的油脂中,不饱和程度越大,熔沸点越低。 如:C 17H 35COOH >C 17H 33COOH ;硬脂酸 > 油酸 (4)烃、卤代烃、醇、醛、羧酸等有机物一般随着分子里碳原子数增加,熔沸 点升高,如C 2H 6>CH 4, C 2H 5Cl >CH 3Cl ,CH 3COOH >HCOOH 。 (5)同分异构体:链烃及其衍生物的同分异构体随着支链增多,熔沸点降低。如: CH 3(CH 2)3CH 3 (正)>CH 3CH 2CH(CH 3)2(异)>(CH 3)4C(新)。 芳香烃的异构体有两个取代基时,熔点按对、邻、间位降低沸点按邻、间、对位降低) 针对性训练 一、选择题 1.下列性质中,可以证明某化合物内一定存在离子键的是( ) (A )溶于水 (B )有较高的熔点 (C )水溶液能导电 (D )熔融状态能导电 2.下列物质中,含有极性键的离子化合是( ) (A )CaCl 2 (B )Na 2O 2 (C )NaOH (D )K 2S 3.Cs 是IA 族元素,F 是VIIA 族元素,估计Cs 和F 形成的化合物可能是( ) (A )离子化合物 (B )化学式为CsF 2 (C )室温为固体 (D )室温为气体 4.某物质的晶体中含A 、B 、C 三种元素,其排列方式如图所示(其中前后两面心上的B 原子未能画出),晶体中A 、B 、C 的中原子个数之比依次为( ) (A )1:3:1 (B )2:3:1 (C )2:2:1 (D )1:3:3 6.在NaCl 晶体中与每个Na +距离等同且最近的几个Cl -所围成的空间几何构型为( ) (A )正四面体 (B )正六面体 (C )正八面体 (D )正十二面体 7.如图是氯化铯晶体的晶胞(晶体中最小的重复单元),已知晶体中2个最近的Cs +离子核间距为a cm ,氯化铯的式量为M ,NA 为阿伏加德罗常数,则氯化铯晶体的密度为( ) (A )3 8a N m A ?g·cm -3 (B )A N Ma 83 g·cm -3 (C )3 a N M A ?g·cm -3 (D )A N Ma 3 g·cm -3
知识点晶体的熔化和凝固图像及其特点 科学思维 我们可以用4个步骤来解释和验证物理学问题。这4个步骤是“科学思维”,“模型建构”,“质疑创新”,“科学论证”。 例如用手在树上摘下一个苹果,是否会落到地下呢?这个可以用万有引力定律来分析,这就是模型建构。然而如果离开了地球,没有了万有引力,那就要切换到用相互作用力模型来分析,这个就是科学思维。最好的科学论证方法就是用实验探究,简单讲实践是检验真理的唯一标准。 情境 如图所示是“探究某晶体熔化和凝固规律”的实验图像。 讨论 (1)根据图像分析晶体熔化和凝固过程持续了多长时间? 分析:晶体的熔化和凝固图像中均有一段与横轴保持平行,这个保持平行的一段就是熔化和凝固过程,在这个过程中温度保持不变,这一平行段维持的时间为熔化或凝固所需的时间,所以是3min。 【理解-保持平行】晶体熔化和凝固过程表现在图像中是与时间轴平行的一段,表示在这一段时间里温度保持不变,这一平行段维持的时间为熔化或凝固所需
的时间。 (2)晶体熔化和凝固图像中平行段对应的温度是什么? 【理解-熔点】晶体熔化和凝固图像中平行段对应的温度是该种晶体的熔点(凝固点),熔点=凝固点。 (3)晶体的熔化和凝固图像有什么不同的地方? 分析:晶体熔化过程中不断吸热,表现在图像中温度持续上升;而凝固过程不断放热,表现在图像中温度持续下降。 【理解-区分】晶体的熔化图像中温度持续上升,而凝固图像中温度持续下降。 (4)晶体在熔化和凝固过程中处于什么状态? 【理解-状态】晶体在熔化和凝固过程中处于固液共存状态。 实战演练 导学号 47152225)如图是晶体的凝固图像,下列分析正确的是() (导学号
【初二】3.2晶体熔化和凝固图像详解 同学们在学完晶体熔化和凝固的实验后,一定需要把物体在各个阶段的状态、吸放热情况、及温度变化等相关特征进行理解掌握。下面张老师以下面的图像为例作为一个讲解: 1.该物质属于晶体。因为其在熔化和凝固过程中,尽管不断吸热和放热,其温度都保持不变。我们将这两个保持不变的温度分别称为熔点和凝固点。 2.ABCD过程为晶体的熔化曲线,该过程持续吸热。DEFG过程为晶体的凝固曲线,该过程持续放热。 3.AB过程晶体为固态。吸热,温度升高。B点晶体开始熔化,为固态。物体温度达到熔点(230℃);BC过程为晶体的熔化过程,固液共存态。此过程吸热但温度保持不变。晶体熔点为230℃,晶体熔化时间为4min;C点晶体刚好熔化结束,为液态。CD过程晶体为液态,吸热,温度升高。 4.DE过程晶体为液态。液态晶体放热,温度降低。E点晶体开始凝固,为液态。物体达到凝固点(230℃)。EF过程为晶体凝固过程,为固液共存态。此过程放热但温度保持不变。晶体凝固点为230℃,晶体凝固时间为2min;F点晶体刚好凝固结束,为固态。FG过程晶体为固态,放热,温度降低。 5.一般而言,同一种晶体的熔点等于凝固点。 例题1:如图所示是-10℃的冰受热后在熔化过程中温度随时间变化的图象。
(1)开始加热的最初5min内冰是______态。 (2)5—15min内冰逐渐______,此过程中是______态与______态共存的状态。 (3)到20min时,冰全部变成了______℃的水。 (1)固(2)熔化,固,液(3)10 例题2:下图是某种晶体加热时,温度随时间变化的图象(加热在一标准大气压下进行,每分钟供热不变)。根据图象可知:这种晶体的名称是_________,其熔点是_________,液态名称是_________,加热2分钟物体处于________状态,加热6分钟时,物体处于________状态,加热8分钟时的温度是_______,这种晶体熔化经历了_______分钟。 冰 0℃水固液共存液态100℃3min
第5章 凝 固 题 解 1. 估计1cm 3的铜在熔点温度含10个原子和60个原子的原子团数目。液态下铜原子体积为1.6×10-29 m 3,σSL 为0.177J ?m -2,T m =1356K 。 解:根据n n G kT i i =????? ? exp ? 先求10个原子及60个原子集团的能量?G i 。原子集团的体积V =N ×?,N 是原子数,?是原子体积。设集团是球状,半径为r 。则 143(π ?=N r 集团的表面积A r N ==4434223 πππ ()? 在熔点产生10个原子及60个原子集团的能量变化为 ????G A N G A N 10102323 2923 20606023 23 29 22043443101610401772521043443601610 4017783310===××××=×===××××=×????γππγππγπ πγππ()()(.)..()()( .)..J J 每cm 3有Cu 的原子数n = = ×=×??11 1610 6251023 223?..cm 在1cm 3中10个原子及60个原子集团数 n n G kT n n G kT 101022 2023 163606022 2023 362510252101381013568851062510833101381013562905=???????=×?×××=×=???????=×?×××=??????exp .exp(..).exp .exp(..??cm cm 2. 镍的平衡熔点为1728K ,固相的V S =6.6cm 3/mol ,液/固相界面能γ=2.25×10-5 J ?cm - 2 ,如球 形粒子半径是1cm 、1μm 、0.01μm 时,熔点各降低多少?设?H =18066J/mol 。 解:熔点与曲率半径的关系为T T V T H m =?2κγS m m ? 现讨论的是球体,曲率半径就是球体半径r 。把各不同半径数据代入得 r r r 1cm 1m 0.01m K K K =?×××××≈=?×××××≈=?×××××≈???17282166225101728 18066 1728172821066225101728 18066 172771172821066225101728 18066 1699554565........μμ 3. 镍在获得过冷度为平衡熔点(K)的0.18倍时均匀形核,问在大气压下的平衡熔点温度下能均匀形核所要求的压力多大?凝固的体积变化为?V =?0.26cm 3 /mol 。 解:题给出 ?T K =×=0181728311. 因 d d m m T p T V H =???, 故 ????p H T T V =?m m 把数据代入。得
《材料结构》习题:纯晶体的凝固 1.设均匀形核时其晶核为球形,试证明临界形核功ΔG c 与临界晶核体积V c 的关系为: 12 c c V G V G ?=-? 2.设非均匀形核时其晶核为球冠形,试证明临界形核功*c G ?与临界晶核体积*c V 的关系为: 12c c V G V G * *?=-? 3.当临界晶核为球形和小立方体形时,试分别求 出各临界晶核中的原子数n 的表达式: n =f (ΔG V , σ,V ) 式中V 为每个原子的体积。 4.试说明金属结晶时粗糙型液-固界面的微观结构特点,指出该界面在结晶过程中的作用。 5.综述金属结晶的热力学条件、动力学条件、能量条件和结构条件。 6.已知金的熔点T m 为1063℃,熔化潜热L m 为12.8kJ/mol ,密度为19.3g/cm 3 ,摩尔质量为197g/mol 。若液态金在1000℃均匀形核时的临界晶核半径r =43.3×10-10m ,试计算金的液固界面能σ和临界形核功。 7.根据克拉珀龙方程可以推导出液-固或固-固相变温度与压力的关系式: T V T H P m m m ???=? 式中,ΔH m 为相变潜热;T m 为相变温度;ΔV m 为摩尔体积变化。试分别计算: (1) 已知α-F e →γ-Fe 在1大气压下T m =912℃,若外加压力增加到1000大气压时,转变温度应是多少(已知ΔH m =920.5J/mol ,α-F e 的密度为7.57g/cm 3,γ-Fe 的密度为7.63g/cm 3,Fe 的摩尔质量为55.85g/mol )。 (2) 已知纯铁熔化时体积变化为膨胀3%,求10个大气压下的熔点(已知L m =15.2kJ/mol ,T m =1803K ,密度为 7.6g/cm 3,摩尔质量为55.85g/mol )。
几种常见晶体结构分析文档编制序号:[KK8UY-LL9IO69-TTO6M3-MTOL89-FTT688]
几种常见晶体结构分析 河北省宣化县第一中学 栾春武 邮编 075131 栾春武:中学高级教师,张家口市中级职称评委会委员。河北省化学学会会员。市骨干教师、市优秀班主任、模范教师、优秀共产党员、劳动模范、县十佳班主任。 联系电话: E-mail : 一、氯化钠、氯化铯晶体——离子晶体 由于离子键无饱和性与方向性,所以离子晶体中无单个分子存在。阴阳离子在晶体中按一定的规则排列,使整个晶体不显电性且能量最低。离子的配位数分析如下: 离子数目的计算:在每一个结构单元(晶胞)中,处于不同位置的微粒在该单元中所占的份额也有所不同,一般的规律是:顶点上的微粒属于该 单元中所占的份额为18,棱上的微粒属于该单元中所占的份额为1 4,面上 的微粒属于该单元中所占的份额为1 2,中心位置上(嚷里边)的微粒才完 全属于该单元,即所占的份额为1。 1.氯化钠晶体中每个Na +周围有6个Cl -,每个Cl -周围有6个Na +,与一个Na +距离最近且相等的Cl -围成的空间构型为正八面体。每个Na +周围与其最近且距离相等的Na +有12个。见图1。 图1 图2 NaCl
晶胞中平均Cl-个数:8×1 8 + 6× 1 2 = 4;晶胞中平均Na+个数:1 + 12×1 4 = 4 因此NaCl的一个晶胞中含有4个NaCl(4个Na+和4个Cl-)。 2.氯化铯晶体中每个Cs+周围有8个Cl-,每个Cl-周围有8个Cs+,与一个Cs+距离最近且相等的Cs+有6个。 晶胞中平均Cs+个数:1;晶胞中平均Cl-个数:8×1 8 = 1。 因此CsCl的一个晶胞中含有1个CsCl(1个Cs+和1个Cl-)。 二、金刚石、二氧化硅——原子晶体 1.金刚石是一种正四面体的空间网状结构。每个C 原子以共价键与4个C原子紧邻,因而整个晶体中无单 个分子存在。由共价键构成的最小环结构中有6个碳原 子,不在同一个平面上,每个C原子被12个六元环共用,每C—C键共6 个环,因此六元环中的平均C原子数为6× 1 12 = 1 2 ,平均C—C键数为 6×1 6 = 1。 C原子数: C—C键键数= 1:2; C原子数: 六元环数= 1:2。 2.二氧化硅晶体结构与金刚石相似,C被Si代替,C与C之间插 氧,即为SiO 2晶体,则SiO 2 晶体中最小环为12环(6个Si,6个O), 图3 CsCl 晶 图4 金刚石晶
实验三晶体的熔化与凝固实验研究 一、预习与思考问题 l 阅读初中物理“物态变化”的教材内容,了解教材中晶体的熔化与凝固探究活动的设计思路。 2.使用“水浴法”有何优点,怎样正确使用这种方法? 二、阅读 根据晶体物态变化的特性,晶体在加热熔化和冷却凝固时保持温度不变,即有固定的熔点和凝固点,且熔点温度与凝固点温度相同。 以前常选用萘晶体进行实脸,典型的熔化和凝固曲线如图所示。 这个实验做起来比较困难,在熔化和凝固过程中,测量的温度难以保持不变.由于萘有剌激性气味,对身体有害,在中学物理实验中已不再使用。 现在选用的晶体是硫代硫酸钠(俗称海波),它具有熔点较低(48C0左) 没有剌激性气味、溶于水易于清洗等特点。但在凝固时会出现过冷现像.即温度降至熔点时不凝固(想一想:如何应对这一情况),如果能保证冰块的供应,用水来做凝固和熔化的实验也比较理想. 三、实验内容与过程指导 (一)海波的熔化和凝固实验 实验器材:温度计,烧杯.试管.酒精灯,石棉网,铁架台、秒表,硫代硫酸钠晶体(海波)。
1 .按图所示.选纯净的海波20g左右,碾成粉未装入试管中.插入温度计,请思考温度计应如何放置? 2.在烧杯中倒入温度在35C0左右的水,水量以能够浸没试管中的海波粉为准。 3.点燃洒精灯,间隔lmin 读取1 次温度(接近45C0时每隔0.5min读取l 次),读到60C0为止。实验中控制水和海波的温差是成功的关键,可用移动酒精灯的方法来控制烧杯中的水温,使之上升不太快。当水温升到48C0左右时,就应加以控制,使水温高于正在熔化的海波的温度1.5C0以下。 接近45C0时每隔0.5min读取l 次 4到60C0时将酒精灯盖灭、撤去.使熔化的海波和烧杯中的水一起在空气中冷却,在降温的同时,每隔1min记录1次温度,读到40C0左右。 5 .将升温和降温的记录列表.并在方格坐标上画出随时间变化的曲浅.从而确定海波的熔点, 你绘制的熔化曲线和凝固曲线有何特点?所得到的熔点和凝固点是否相同?如果不相同.是什么原因造成的? 6 .阅读:搅伴的注意事项 温度计插入海波中的位置应靠近管壁.但不要碰到管壁 在实验中搅拌器进行搅拌是十分必要的,其搅拌是使海波受热均匀,尽快达到热平衡;在固液共存的阶段,应搅拌使其成为糊状.达到固、液均匀混合,熔化成液体;在凝固过程中应沿试管管壁搅拌,以破坏首先沿试管壁形成的妨碍热交换顺利进行的凝固层。使海波均匀冷却,搅拌器最好做成螺旋状,这种搅拌器比棒式的搅拌器效果更好 三、报告与作业 1.通过“海波的熔化与凝固实验”,你体会实验成功的关键是什么? 2.你认为通过这个实验应培养学生哪些实验能力?在指导学生实验时应提出些什么要求? 3.试分析晶体熔解前后曲线斜率显著不同的原因。
第6章单组元相图及纯晶体的凝固 6.1 复习笔记 一、单元系相变的热力学及相平衡 1.相平衡条件和相律 组元:组成一个体系的基本单元,如单质(元素)和稳定化合物,称为组元。 相:体系中具有相同物理与化学性质的且与其他部分以界面分开的均匀部分,称为相。 相律 : F=C-P+2;式中,F为体系的自由度数,它是指不影响体系平衡状态的独立可变参数(如温度、压力、浓度等)的数目;C为体系的组元数;P为相数。 常压下,F=C-P+1。 2.单元系相图 单元系相图是通过几何图像描述由单一组元构成的体系在不同温度和压条件下可能存在的相及多相的平衡。 图6-1 水的相图
图6-2 Fe在温度下的同素异构转变 上述相图中的曲线所表示的是两相平衡时温度和压力的定量关系,可由克劳修斯(Clausius)一克拉珀龙(Clapeyron)方程决定,即 式中,为相变潜热;为摩尔体积变化;T是两相平衡温度。 有些物质在稳定相形成前,先行成自由能较稳定 相高地亚稳定相。 二、纯晶体的凝固 1.液态结构 (1)液体中原子间的平均距离比固体中略大; (2)液体中原子的配位数比密排结构晶体的配位数减小; (3)液态结构的最重要特征是原子排列为长程无序,短程有序,存在结构起伏。 2.晶体凝固的热力学条件
(6.1)式中,,是熔点T m与实际凝固温度T之差;L m是熔化热 。晶体凝固的热力学条件表明,实际凝固温度应低于熔点T m,即需要有过冷度△T。 3.形核 晶体的凝固是通过形核与长大两个过程进行的,形核方式可以分为两类:均匀形核和非均匀形核。 (1)均匀形核 ①晶核形成时的能量变化和临界晶核 新相晶核是在母相中均匀地生成的,即晶核由液相中的一些原子团直接形成,不受杂质粒子或外表面的影响 假定晶胚为球形,半径为r,当过冷液中出现一个晶胚时,总的自由能变化: (6.2)由,可得晶核临界半径: (6.3)代入公式(1),可得: (6.4)由式可知,过冷度△T越大,临界半径则越小,则形核的几率越大,晶核数目增多。将(3)式代入(2)式,得临界形核功: (6.5)将(1)式代入(5)式,可得: (6.6)临界晶核表面积为: (6.7)将(7)式代入(6)式,可得:
几种常见晶体结构分析 河北省宣化县第一中学 栾春武 邮编 075131 栾春武:中学高级教师,张家口市中级职称评委会委员。河北省化学学会会员。市骨干教师、市优秀班主任、模范教师、优秀共产党员、劳动模范、县十佳班主任。 联系电话::: 一、氯化钠、氯化铯晶体——离子晶体 由于离子键无饱和性与方向性,所以离子晶体中无单个分子存在。阴阳离子在晶体中按一定的规则排列,使整个晶体不显电性且能量最低。离子的配位数分析如下: 离子数目的计算:在每一个结构单元(晶胞) 中,处于不同位置的微粒在该单元中所占的份额也有 所不同,一般的规律是:顶点上的微粒属于该单元中 所占的份额为18 ,棱上的微粒属于该单元中所占的份额为14,面上的微粒属于该单元中所占的份额为12 ,中心位置上(嚷里边)的微粒才完全属于该单元,即所占的份额为1。 1.氯化钠晶体中每个Na +周围有6个C l -,每个Cl -周围有6个Na +,与一个Na +距离最近且相等的 Cl -围成的空间构型为正八面体。每个N a +周围与其最近且距离相等的Na + 有12个。见图1。 晶胞中平均Cl -个数:8×18 + 6×12 = 4;晶胞中平均Na +个数:1 + 12×14 = 4 因此NaCl 的一个晶胞中含有4个NaCl (4个Na +和4个Cl -)。 2.氯化铯晶体中每个Cs +周围有8个Cl -,每个Cl -周围有8个Cs +,与 一个Cs +距离最近且相等的Cs +有6个。晶胞中平均Cs +个数:1;晶胞中平 均Cl -个数:8×18 = 1。 因此CsCl 的一个晶胞中含有1个CsCl (1个Cs +和1个Cl -)。 二、金刚石、二氧化硅——原子晶体 1.金刚石是一种正四面体的空间网状结构。每个C 原子以共价键与4 个C 原子紧邻,因而整个晶体中无单个分子存在。由共价键构成的最小 环结构中有6个碳原子,不在同一个平面上,每个C 原子被12个六元环 共用,每C —C 键共6个环,因此六元环中的平均C 原子数为6× 112 = 12 ,平均C —C 键数为6×16 = 1。 C 原子数: C —C 键键数 = 1:2; C 原子数: 六元环数 = 1:2。 2.二氧化硅晶体结构与金刚石相似,C 被Si 代替,C 与C 之间插氧,即为SiO 2晶体,则SiO 2晶体中最小环为12环(6个Si ,6个O ), 最小环的平均Si 原子个数:6×112 = 12;平均O 原子个数:6×16 = 1。 即Si : O = 1 : 2,用SiO 2表示。 在SiO 2晶体中每个Si 原子周围有4个氧原子,同时每个氧原子结合2个硅原子。一个Si 原子可形 图 1 图 2 NaCl 晶体 图3 CsCl 晶体 图4 金刚石晶体
6.1复习笔记 一、单元系相变的热力学及相平衡 1.相平衡条件和相律 组元:组成一个体系的基本单元,如单质(元素)和稳定化合物,称为组元。 相:体系中具有相同物理与化学性质的且与其他部分以界面分开的均匀部分,称为相。 相律:F=C-P+2;式中,F为体系的自由度数,它是指不影响体系平衡状态的独立可变参数(如温度、压力、浓度等)的数目;C为体系的组元数;P为相数。 常压下,F=C-P+1。 2.单元系相图 单元系相图是通过几何图像描述由单一组元构成的体系在不同温度和压条件下可能存在的相及多相的平衡。 图6-1水的相图
图6-2Fe在温度下的同素异构转变 上述相图中的曲线所表示的是两相平衡时温度和压力的定量关系,可由克劳修斯(Clausius)-克拉佩龙克拉珀龙(Clapeyron)方程决定,即 式中,为相变潜热;为摩尔体积变化;T是两相平衡温度。 有些物质在稳定相形成前,先形成自由能较稳定相高的亚稳定相。 二、纯晶体的凝固 1.液态结构 (1)液体中原子间的平均距离比固体中略大; (2)液体中原子的配位数比密排结构晶体的配位数减小; (3)液态结构的最重要特征是原子排列为长程无序,短程有序,存在结构起伏。 2.晶体凝固的热力学条件 (6-1) 与实际凝固温度T之差;L m是熔化热。晶体凝固的热 式中,,是熔点T 力学条件表明,实际凝固温度应低于熔点T m,即需要有过冷度△T。 3.形核
晶体的凝固是通过形核与长大两个过程进行的,形核方式可以分为两类:均匀形核和非均匀形核。 (1)均匀形核 ①晶核形成时的能量变化和临界晶核 新相晶核是在母相中均匀地生成的,即晶核由液相中的一些原子团直接形成,不受杂质粒子或外表面的影响 假定晶胚为球形,半径为r,当过冷液中出现一个晶胚时,总的自由能变化: (6-2) 由,可得晶核临界半径: (6-3)代入公式(6-1),可得: (6-4)由式可知,过冷度△T越大,临界半径则越小,则形核的几率越大,晶核数目增多。将(6-3)式代入(6-2)式,得临界形核功: (6-5)将(6-1)式代入(6-5)式,可得: (6-6)临界晶核表面积为: (6-7)将(6-7)式代入(6-6)式,可得: (6-8)因此,形成临界晶核时体积自由能的减少只能补偿表面能的2/3,而不足的1/3则需依
四种晶体类型的比较 HEN system office room 【HEN16H-HENS2AHENS8Q8-HENH1688】
四种晶体类型的比较 物质熔沸点高低的比较方法 物质的熔沸点的高低与构成该物质的晶体类型及晶体内部粒子间的作用力有关,其规律如下: 1、在相同条件下,不同状态的物质的熔、沸点的高低是不同的,一般有:固体> >HBr(气)。 液体>气体。例如:NaBr(固)>Br 2 2、不同类型晶体的比较规律 一般来说,不同类型晶体的熔沸点的高低顺序为:原子晶体>离子晶体>分子晶体,而金属晶体的熔沸点有高有低。这是由于不同类型晶体的微粒间作用不同,其熔、沸点也不相同。原子晶体间靠共价键结合,一般熔、沸点最高;离子晶体阴、阳离子间靠离子键结合,一般熔、沸点较高;分子晶体分子间靠范德华力结合,一
般熔、沸点较低;金属晶体中金属键的键能有大有小,因而金属晶体熔、沸点有高(如W)有低(如Hg)。例如:金刚石>食盐>干冰 3、同种类型晶体的比较规律 A、原子晶体:熔、沸点的高低,取决于共价键的键长和键能,键长越短,键能越大共价键越稳定,物质熔沸点越高,反之越低。如:晶体硅、金刚石和碳化硅三种晶体中,因键长C—C
《材料结构》习题:纯晶体的凝固 1. 设均匀形核时其晶核为球形,试证明临界形核功ΔG c 与临界晶核体积V c 的关系为: 12 c c V G V G ?=-? 2. 设非均匀形核时其晶核为球冠形,试证明临界形核功*c G ?与临界晶核体积* c V 也存在上列关系式。 3. 当临界晶核为球形和小立方体形时,试分别求出各临界晶核中的原子数n 的表达式: n =f (ΔG V , σ,V) 式中V 为每个原子的体积。 4. 试说明金属结晶时粗糙型液-固界面的微观结构特点,指出该界面在结晶过程中的作用。 5. 综述金属结晶的热力学条件、动力学条件、能量条件和结构条件。 6. 已知金的熔点Tm 为1063℃,熔化潜热Lm 为12.8kJ/mol ,密度为19.3g/cm3,摩尔质量为197g/mol 。若液态金在1000℃均匀形核时的临界晶核半径r =43.3×10-10m ,试计算金的液固界面能σ和临界形核功。 7. 根据克拉珀龙方程可以推导出液-固或固-固相变温度与压力的关系式: T V T H P m m m ???=? 式中,ΔH m 为相变潜热;T m 为相变温度;ΔV m 为摩尔体积变化。试分别计算: (1) 已知α-F e →γ-Fe 在1大气压下T m =912℃,若外加压力增加到1000大气压时,转变温度应是多少(已知ΔH m =920.5J/mol ,α-F e 的密度为7.57g/cm 3,γ-Fe 的密度为7.63g/cm 3,Fe 的摩尔质量为55.85g/mol )。 (2) 已知纯铁熔化时体积变化为膨胀3%,求10个大气压下的熔点(已知L m =15.2kJ/mol ,T m =1803K ,密度为7.6g/cm 3,摩尔质量为55.85g/mol )。
熔化和凝固(提高) 【学习目标】 1.知道物质的三种状态,固态、液态、气态,能描述三种物态的基本特征; 2.知道熔化过程要吸热,凝固过程要放热; 3.知道晶体和非晶体的区别; 4.理解晶体的熔点和凝固点; 5.掌握熔化和凝固过程的温度时间图像; 6.通过探究活动,使学生了解图象是一种比较直观的表示物理量变化的方法。 【要点梳理】 要点一、物态变化 1、物态变化:物质各种状态间的变化叫做物态变化。 2 状态形状、体积的 固态(冰)有固定的形状,很难被压缩 液态(水)没有固定的形状,很难被压缩 气态(水蒸气)没有固定的形状,容易被压缩 要点诠释: 1、固态、液态、气态是物质常见的三种状态,在常温下呈现固态的物体一般称固体,如:钢铁、食盐等;在常温下呈现液态的物质,一般称为液体,如:水、酒精等;在常温下呈现气态的物质,一般称为气体,如:氧气、二氧化碳等。 2、自然界中的物质通常情况下都有三种状态,如:常温下铁是固态,加热至1535℃时变成液态;加热至2750℃时,变成气态。 要点二、熔化和凝固 1、熔化:物质从固态变成液态叫熔化。 2、凝固:物质从液态变成固态叫凝固。 3、晶体与非晶体: (1)晶体:有些固体在熔化过程中不断吸热,温度却保持不变,这类固体有固定的熔化温度。如:冰、海波、各种金属。 (2)非晶体:有些固体在熔化过程中,不断吸热,温度不断上升,没有固定的熔化温度。如:蜡、松香、玻璃、沥青。 4、熔点和凝固点: (1)熔点:晶体熔化时的温度叫熔点。 (2)凝固点:晶体凝固时的温度叫凝固点。 要点诠释: 1、晶体熔化的条件是:(1)温度达到熔点(2)继续吸热 2、晶体凝固的条件是:(1)达到凝固点(2 )继续放热 3、晶体和非晶体的区别: (1)相同点:都是从固态变成液态的过程;在熔化过程中都需要吸热。 (2)不同点:晶体有熔点,非晶体没有熔点;晶体和非晶体的熔化图象不同。 4、晶体熔化凝固图象:
熔化和凝固 一、知识要点 1、物态变化 通常情况下,物质存在的形态有固态、液态和气态。物质的三种状态在一定条件下可以相互转化,这样变化 称为物态变化。 2、固体的分类 (1)晶体:有确定的熔化温度(熔点)。如海波、冰、食盐、萘、石英、各种金属等。 (2)非晶体:没有固定的熔化温度(无熔点)。如蜡、松香、玻璃、沥青等。 注:判断晶体和非晶体的关键是,看物体有没有固定的熔点,晶体有一定的熔点,而非晶体没有,初中考得最 多的非晶体是:玻璃、蜡烛的蜡。 3、熔化【重点】 (1)熔化:物质从固态变成液态的过程叫做熔化。熔化的过程需要吸热。 注:融化是一个持续的过程,而不是一个结果,比如冰化成水这个过程,我们说冰在融化,这个过程是吸 热过程,好比冰需要吸收热量才能融化一样。 (2)熔化现象:春天“冰雪消融”,炼钢炉中将铁化成“铁水”。 (3)熔化规律: ①晶体在熔化过程中,要不断地吸热,但温度保持在熔点不变。 ②非晶体在熔化过程中,要不断地吸热,且温度不断升高。 例:晶体的熔化图像(ABCD段)和晶体的凝固图像(DEFG) 分析: AB:固态(吸热升温) BC:固液共存(熔化过程,温度不变,继续吸热) CD:液态(吸热升温) DE:液态(放热降温) EF:固液共存(凝固过程,温度不变,继续放热) FG:固态(放热降温) 该图说明:①该物质是晶体。②晶体的熔点等于凝固点。③该物质熔化和凝固过程温度都不变。 (4)晶体熔化必要条件:温度达到熔点、不断吸热。 (5)有关晶体熔点(凝固点)知识: ①萘的熔点为80.50C。当温度为790C时,萘为固态。当温度为810C时,萘为液态。当温度为80.50C时,萘 是固态或液态或固、液共存状态都有可能。 ②下过雪后,为了加快雪熔化,常用洒水车在路上洒盐水(降低雪的熔点)。 ③在北方,冬天温度常低于-390C,因此测气温采用酒精温度计而不用水银温度计。(水银凝固点是-390C, 在北方冬天气温常低于-390C,此时水银已凝固;而酒精的凝固点是-1170C,此时保持液态,所以用酒精温度计)。 (6)熔化吸热的事例: ①夏天,在饭菜的上面放冰块可防止饭菜变馊(冰熔化吸热,冷空气下沉)。 ②化雪的天气有时比下雪时还冷(雪熔化吸热)。 ③鲜鱼保鲜,用00C的冰比00C的水效果好(冰熔化吸热)。 ④“温室效应”使极地冰川吸热熔化,引起海平面上升。 4、凝固【重点】 (1)凝固:物质从液态变成固态的过程叫做凝固,凝固的过程需要放热。 (2)凝固现象:①“滴水成冰”②“铜水”浇入模子铸成铜件 (3)凝固规律 ①晶体在凝固过程中,要不断地放热,但温度保持在熔点不变。 ②非晶体在凝固过程中,要不断地放热,且温度不断降低。 (4)晶体凝固必要条件:温度达到凝固点、不断放热。 (5)凝固放热 ①北方冬天的菜窖里,通常要放几桶水。(利用水凝固时放热,防止菜冻坏) ②炼钢厂,“钢水”冷却变成钢,车间人员很易中暑。(钢水凝固放出大量的热) 5、热传递:热量总是从温度高的物体传给温度低的物体;热传递的条件是要有温度差。 注:热传递必须要有温度差,就像开空调的卧式没有关门,而客厅的“热空气”就传递到卧式,使得卧式的温 度上升。所以为了节能,我们开空调时要关好门窗,早上要开窗通风。