高考化学压题无机框图推断题答案
- 格式:doc
- 大小:289.50 KB
- 文档页数:9

高考化学高无机综合推断综合试题及答案解析一、无机综合推断1.I.化合物X含有三种元素,其中两种为非金属元素,且原子个数比为1:1,X不溶于水,能溶于强酸。
某研究小组为探究其组成和性质,设计并完成了如下实验。
(1)X的化学式是____________________。
(2)写出检验黄色溶液中金属阳离子的实验操作:__________。
(3)黄色溶液中加入铜片,铜片表面被腐蚀,则对应的离子方程式是:_____________________。
II.已知黑色固体中不含单质。
为进一步探究其组成,研究小组将上述所得固体全部溶于稀盐酸,配成100mL溶液,每次取20.00mL待测液于锥形瓶中,用2.000×10-2mol∙L-1 KMnO4标准溶液进行滴定,并记录实验的结果如下表:组次1234V标(mL)20.0020.0219.9919.99(4)如何判断滴定终点:__________________。
(5)待测液中c(Fe2+) = ____________________。
(6)该黑色固体的化学式用Fe x O y形式可表示为_______________。
【答案】FeOCl 取少量黄色溶液置于洁净试管中,滴加几滴KSCN溶液,若溶液呈血红色,则说明有Fe3+ 2Fe3+ + Cu = 2Fe2+ + Cu2+当最后一滴标准KMnO4溶液滴入锥形瓶时,溶液恰好变浅紫(红)色,且半分钟内不变色 0.1000mol.L-1 Fe4O5【解析】【详解】I.根据流程中信息可知,2.15gX与适量硫酸反应得到黄色溶液为含有铁离子及硫酸根离子等的溶液,黄色溶液与足量氢氧化钠溶液作用生成红褐色氢氧化铁沉淀,氢氧化铁沉淀加热后生成红棕色固体1.60g,即氧化铁1.60160/gg mol=0.01mol,故X中含有0.02 molFe3+,质量为0.02 mol56g/mol=1.12g,与足量氢氧化钠溶液反应的溶液再与足量硝酸钡溶液反应生成硫酸钡沉淀6.99g,即为6.99g233/g mol=0.03mol,但硫酸根离子来自于所加硫酸,反应所得溶液继续与足量硝酸酸化的硝酸银溶液反应得到白色沉淀氯化银2.87g,即为2.87g 143.5/g mol =0.02mol ,故可推知X 中含有0.02molCl -,质量为0.02 mol 35.5g /mol ⨯=0.71g ,化合物X 含有三种元素,其中两种为非金属元素,且原子个数比为1:1,故另一非金属元素也为0.02 mol ,且质量为2.15g-1.12g-0.71g=0.32g ,则摩尔质量为0.32g 0.02mol=16g/mol ,应为O 元素,故X 为FeOCl ; (1)X 的化学式是FeOCl ; (2)检验黄色溶液中金属阳离子Fe 3+的实验操作为:取少量黄色溶液置于洁净试管中,滴加几滴KSCN 溶液,若溶液呈血红色,则说明有Fe 3+;(3)黄色溶液中加入铜片,铜片表面被腐蚀,反应生成Fe 2+和Cu 2+,对应的离子方程式是:2Fe 3+ + Cu= 2Fe 2+ + Cu 2+;II .(4)黑色固体溶于盐酸后所得溶液中含有亚铁离子,遇酸性高锰酸钾溶液使其褪色,故判断滴定终点为:当最后一滴标准KMnO 4溶液滴入锥形瓶时,溶液恰好变浅紫(红)色,且半分钟内不变色;(5)根据表中数据可知,滴定消耗的标准液的平均体积为20.00mL ,根据反应5Fe 2+ + MnO 4-+ 8H +=5Fe 3+ + Mn 2+ +4H 2O 可知,待测液中c(Fe 2+)=2332.00010/20.0010/50.1000/20.0010/mol L mL L mL mol L mL L mL---⨯⨯⨯⨯=⨯; (6)黑色固体中含有的Fe 2+物质的量为0.1000/0.10.01mol L L mol ⨯=,铁的总物质的量为0.02 mol ,则n(Fe 2+) : n(Fe 3+) =0.01 mol: 0.01 mol=1:1,该黑色固体的化学式用Fe x O y 形式表示,根据化合物各元素化合价代数和为0,则有23222x x y ⨯+⨯=,得x:y=4:5,Fe x O y 可表示为Fe 4O 5。

备战高考化学高无机综合推断综合题附详细答案一、无机综合推断1.A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性。
它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题:(1)A所含元素在周期表中的位置为________________,C的电子式为________。
(2)A与H在加热条件下反应的化学方程式为__________________________。
(3)将A溶于沸腾的G溶液中可以制得化合物I,I在酸性溶液中不稳定,易生成等物质的量的A和E,I在酸性条件下生成A和E的离子方程式为___________________,I是较强还原剂,在纺织、造纸工业中作为脱氯剂,向I溶液中通入氯气可发生反应,参加反应的I和氯气的物质的量之比为1∶4,该反应的离子方程式为_____________。
(4)向含有0.4 mol F、0.1 mol G的混合溶液中加入过量盐酸,完全反应后收集到a L气体C(标准状况),过滤,向反应后澄清溶液中加入过量FeCl3溶液,得到沉淀3.2 g,则a=________L。
【答案】第三周期第ⅥA族 3S+6NaOH 2Na2S+Na2SO3+3H2O 2H+ +S2O32-=S↓+ SO2↑+H2O 4Cl2+S2O32-+5H2O=8Cl-+2SO42-+10H+ 2.24【解析】【分析】A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,则A为S;B、D是气体,均与硫单质反应,E为D与硫反应生成的有漂白性的物质,则D为O2,E为SO2,F、G、H的焰色反应均为黄色,均含有Na元素,水溶液均显碱性,结合转化关系可知,H为NaOH、G为Na2SO3,F为Na2S,B为H2,C为H2S,以此解答该题。
【详解】根据上述分析可知:A为S,B为H2,C为H2S,D为O2,E为SO2,F为Na2S,G为Na2SO3,H为NaOH。

高考化学高无机综合推断综合题含答案解析一、无机综合推断1.A、B、C、W均为中学常见的物质,它们之间有如图所示的转化关系(其他产物及反应条件已略去,反应可以在水溶液中进行)。
(1)若A、B、C三种物质的焰色反应均为黄色,A俗称苛性钠,W为无色无味气体,C受热分解可转化为B。
①向B溶液中通入W生成C的离子方程式为__________________________________。
②A溶液与C溶液反应的化学方程式为______________________________________。
(2)若A、B、C三种物质都含有一种金属元素,且B为两性物质,W俗称苛性钠。
①A、B、C三种物质中所含有的金属元素单质与W反应的化学方程式为_____________。
②A溶液一步转化为C溶液的反应离子方程式为________________________________。
(3)若A、B、C、W四种物质均为气体,其中A、W为单质,C的摩尔质量为46g·mol-1。
①B的化学式为________________。
②实验室制取B时,_____________(填“能”或“不能”)用向上排空气法收集B。
③一定条件下B与CO反应的化学方程式为_____________________________。
(4)若A为淡黄色固体单质,W为气体单质,B、C均为酸性氧化物。
则C溶于水形成化合物D,在加热的情况下,D的浓溶液与A反应的化学方程式为________________________。
【答案】CO32-+H2O+CO2=2HCO3- NaOH+NaHCO3=Na2CO3+H2O 2Al+2NaOH+2H2O =2NaAlO2 +3H2↑ Al3-+ 4OH- =AlO2- + 2H2O NO 不能 2NO+2CO2CO2+N2S+2H2SO4(浓)3SO2↑+2H2O【解析】【分析】(1) 若A、B、C 三种物质的焰色反应均为黄色,均含Na元素,A俗称苛性钠,则A为NaOH,W为无色无味气体,C受热分解可转化为B,则W为CO2、B为Na2CO3,C为NaHCO3;(2)若A、B、C三种物质都含有一种金属元素,且B为两性物质,W俗称苛性钠,则B为Al(OH)3,A为AlCl3、C为NaAlO2;(3) 若A、B、C、W四种物质均为气体,其中A、W为单质,C的摩尔质量为46g•mol-1,则A为N2、W为O2、B为NO、C为NO2;(4) 若A 为淡黄色固体单质,W 为气体单质,B、C均为酸性氧化物,则A为S,W为O2、B为SO2、C为SO3 。

2020-2021高考化学综合题专题复习【高无机综合推断】专题解析附详细答案一、无机综合推断1.化合物A由三种元素组成,某兴趣小组进行了如下实验:已知:气体甲为纯净物且只含两种元素,在标况下体积为672 mL;溶液乙为建筑行业中常用的粘合剂。
请回答下列问题:(1)A的组成元素为________(用元素符号表示);(2)写出气体甲与NaOH(aq)反应的离子方程式________;(3)高温下,A与足量氯气能发生剧烈爆炸,生成三种常见化合物试写出相应的化学方程式________。
【答案】Mg、Si、H Si2H6 + 4OH- + 2H2O = 2 SiO32- + 7H2↑ MgSi2H4 + 7Cl2 = MgCl2 + 2SiCl4 + 4HCl【解析】【分析】因溶液乙为建筑行业中常用的粘合剂,则为硅酸钠,根据元素守恒可知,气体甲中含有硅元素,与氢氧化钠恰好完全反应生成气体单质乙,所消耗的氢氧化钠的物质的量为1mol/L×120×10-3 L = 0.12 mol,根据硅酸钠中Na元素与Si元素的原子个数比为2:1,可知气体甲中含Si的物质的量为0.12mol/2 = 0.06 mol,又知气体甲为纯净物且只含两种元素,在标况下体积为672 mL,即36721022.4/LL mol-⨯= 0.03 mol,则易知A为0.03 mol,其摩尔质量为2.52 0.03gmol= 84 g/mol,且1个气体甲分子中含2个硅原子,同时气体甲与氢氧化钠按物质的量为0.03 mol:0.12 mol = 1:4的反应生成硅酸钠与气体单质乙,根据元素守恒可知气体单质乙中含氢元素,即为氢气。
因此气体甲中的另一种元素不能为氧元素,可推知气体甲中的两种元素为硅元素与氢元素。
另外,结合溶液甲只有一种溶质,且加入过量的氢氧化钠生成白色沉淀,沉淀受热不易分解,推出白色沉淀为难溶氢氧化物,所用盐酸的物质的量为3 mol/L×20×10-3 L = 0.06 mol, A的质量为2.52 g,化合物A由三种元素组成,推测所含的金属元素为镁,根据Mg~2HCl可知,一个分子A中含1个镁原子,再根据分子组成可确定A中所含氢原子的个数为84-1×24-2×28 = 4,据此分析作答。

无机推断1、根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E 的反应。
(1)单质L是_______________。
(2)化合物B是______ _______。
(3)图中除反应①外,还有两个用于工业生产的反应是___ ___和_____ __(填代号)化学反应方程式分别是_____________ ___和_______ _____________。
2、物质的转化关系如下图所示(有的反应可能在水溶液中进行)。
其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
(1)若A为硫酸工业的重要原料,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。
则①工业上反应II在中进行(填设备名称),工业上反应III用于吸收E的试剂是。
②D的水溶液呈性(填“酸”、“碱”或“中”)③反应I的化学方程式是。
(2)若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液,并使它们接近,有大量白烟生成。
则①金属乙的原子结构示意图。
②写出B和甲反应的离子方程式:。
③写出A与O2反应的化学方程式:。
3、已知X、Y、Z为三种由短周期元素构成的粒子,每mol粒子都有10mol电子,其结构特点如下:X Y Z原子核数单核四核双核粒子的电荷数1个单位正电荷0 1个单位负电荷物质A由X、Z构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:(1)A的化学式为;D的名称为。
(2)完成下列反应的离子方程式:反应①。
反应④。
(3)若J气体浓度过高可导致高铁血红蛋白血症,且污染大气等。
但J也有不少的用途,如(举出一例)。
4、无机框图下图为中学化学中几种常见物质的转化关系(部分产物已略去)。
已知:A 、C 、D 是常见的气体单质,F 气体极易溶于水,且液态常做致冷剂。

备战高考化学高无机综合推断综合题汇编附详细答案一、无机综合推断1.下列各物质中只有A、B、C三种单质,A的焰色反应为黄色,主要以G形式存在于海水中,F是一种淡黄色的固体,H是一种常见的无色液体,I是造成温室效应的“元凶”,各物质间的转化关系图如下:回答下列问题:(1)A是:_____,C是:_____,L是:______,I是:____(填化学式)。
(2)写出反应①②③的化学反应方程式:①:____________________________________;②:____________________________________;③:____________________________________;【答案】Na Cl2HCl CO22Na+2H2O=2NaOH+H2↑2Na2O2+2H2O=4NaOH+O2↑2NaHCO3Na2CO3+CO2↑+H2O【解析】【分析】焰色反应为黄色的单质是钠,钠元素在自然界主要以氯化钠的形式存在,淡黄色固体是过氧化钠,常见的无色液体是水,造成温室效应的“元凶”是二氧化碳。
因此,A是钠,B是氧气,C是氯气,D是氢氧化钠,E是氧化钠,F是过氧化钠,G是氯化钠,H是水,I是二氧化碳,J是碳酸氢钠,K是碳酸钠,L是盐酸。
【详解】(1)A是钠,化学式为Na,C是氯气,化学式为Cl2,L是氯化氢,化学式为HCl,I是二氧化碳,化学式为CO2;(2)①是钠与水的反应,化学方程式为:2Na+2H2O=2NaOH+H2↑;②是过氧化钠与水的反应,化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;③是碳酸氢钠的受热分解,化学方程式为:2NaHCO3Na2CO3+CO2↑+H2O;【点睛】无机框图推断题要找出题眼,关键点,熟记特殊物质的颜色,特殊的反应,工业生产等等,找出突破口,一一突破。
2.已知A、B、C、D是元素周期表中的四种短周期元素,A分别与B、C、D结合生成三种化合物:甲、乙、丙。
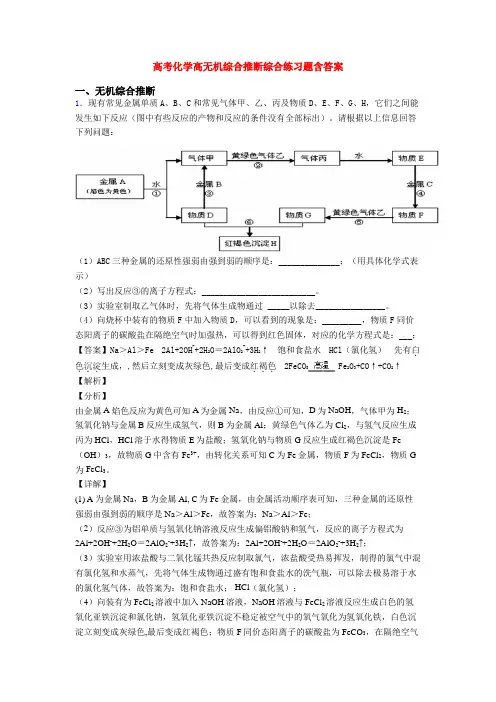
高考化学高无机综合推断综合练习题含答案一、无机综合推断1.现有常见金属单质A、B、C和常见气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:(1)ABC三种金属的还原性强弱由强到弱的顺序是:______________;(用具体化学式表示)(2)写出反应③的离子方程式:__________________________。
(3)实验室制取乙气体时,先将气体生成物通过_____以除去________________。
(4)向烧杯中装有的物质F中加入物质D,可以看到的现象是:_________,物质F同价态阳离子的碳酸盐在隔绝空气时加强热,可以得到红色固体,对应的化学方程式是:___;【答案】Na>Al>Fe2Al+2OH-+2H2O=2AlO2-+3H2↑饱和食盐水HCl(氯化氢)先有白.色沉淀...2FeCO3Fe2O3+CO↑+CO2↑...生成,,然后立刻变成灰绿色,最后变成红褐色【解析】【分析】由金属A焰色反应为黄色可知A为金属Na,由反应①可知,D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,则B为金属Al;黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸;氢氧化钠与物质G反应生成红褐色沉淀是Fe (OH)3,故物质G中含有Fe3+,由转化关系可知C为Fe金属,物质F为FeCl2,物质G 为FeCl3。
【详解】(1) A为金属Na,B为金属Al, C为Fe金属,由金属活动顺序表可知,三种金属的还原性强弱由强到弱的顺序是Na>Al>Fe,故答案为:Na>Al>Fe;(2)反应③为铝单质与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;(3)实验室用浓盐酸与二氧化锰共热反应制取氯气,浓盐酸受热易挥发,制得的氯气中混有氯化氢和水蒸气,先将气体生成物通过盛有饱和食盐水的洗气瓶,可以除去极易溶于水的氯化氢气体,故答案为:饱和食盐水; HCl(氯化氢);(4)向装有为FeCl2溶液中加入NaOH溶液,NaOH溶液与FeCl2溶液反应生成白色的氢氧化亚铁沉淀和氯化钠,氢氧化亚铁沉淀不稳定被空气中的氧气氧化为氢氧化铁,白色沉淀立刻变成灰绿色,最后变成红褐色;物质F同价态阳离子的碳酸盐为FeCO3,在隔绝空气时加强热,得到红色固体为Fe2O3,化学方程式为2FeCO3Fe2O3+CO↑+CO2↑,故答案为:先有白色沉淀生成,,然后立刻变成灰绿色,最后变成红褐色;2FeCO3Fe2O3+CO↑+CO2↑。

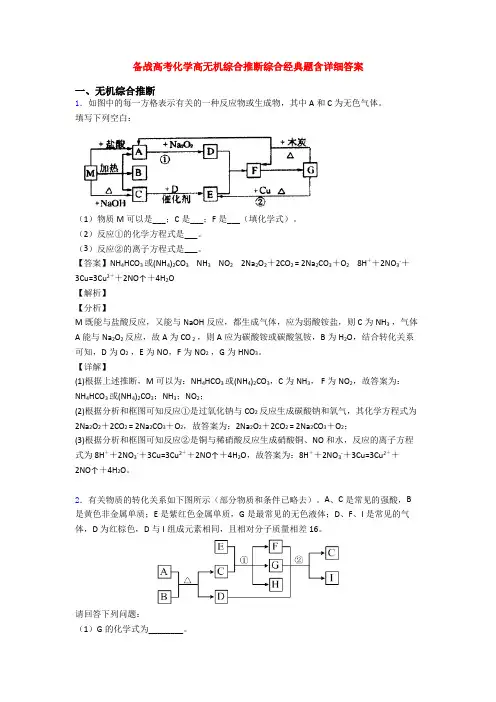
备战高考化学高无机综合推断-经典压轴题附答案一、无机综合推断1.A、B、C、W均为中学常见的物质,它们之间有如图所示的转化关系(其他产物及反应条件已略去,反应可以在水溶液中进行)。
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系:(1)若A、B、C三种物质都含有一种金属元素,且B为两性物质,W俗称苛性钠。
①A、B、C三种物质中所含有的金属元素单质与W反应的化学方程式为_______________。
②A溶液一步转化为C溶液的反应离子方程式为________________。
(2)若X是一种黄绿色的气体,Y的饱和溶液滴入沸水中能生成红褐色胶体。
①检验溶液Z是否变质最灵敏的一种试剂是____________________(名称);②一定条件下W与水反应的化学方程式_______________________________。
(3)X常温下为气体化合物,Z是一种红棕色气体,X气体的检验方法____________________,X转化为Y的化学方程式为______________________;(4)X为一元强碱溶液,W是形成酸雨的主要气体。
①则Y到Z的离子方程式为________________________________________;②请画出向含0.01molX和0.01molY的溶液中逐滴加入0.1mol/L稀盐酸的体积和生成气体的物质的量的关系的图像___________。
【答案】2Al+2NaOH+2H2O =2NaAlO2 +H2 Al3-+ 4OH- =AlO2- + 2H2O 硫氰化钾溶液 3Fe + 4H2O(g) === Fe3O4 + 4H2使湿润的红色石蕊试纸变蓝(或遇蘸有浓盐酸的玻璃棒产生白烟)4NH3+5O24NO+6H2O SO32-+SO2+H2O=2HSO3-【解析】【分析】W为NaOH。
B为两性物质且含有一种金属元素,确定该金属元素为铝元素,因在溶液中产生了B,所以B为Al(OH)3。
备战高考化学高无机综合推断综合经典题含详细答案一、无机综合推断1.如图中的每一方格表示有关的一种反应物或生成物,其中A和C为无色气体。
填写下列空白:(1)物质M可以是___;C是___;F是___(填化学式)。
(2)反应①的化学方程式是___。
(3)反应②的离子方程式是___。
【答案】NH4HCO3或(NH4)2CO3 NH3 NO2 2Na2O2+2CO2 = 2Na2CO3+O2 8H++2NO3-+3Cu=3Cu2++2NO↑+4H2O【解析】【分析】M既能与盐酸反应,又能与NaOH反应,都生成气体,应为弱酸铵盐,则C为NH3,气体A能与Na2O2反应,故A为CO 2,则A应为碳酸铵或碳酸氢铵,B为H2O,结合转化关系可知,D为O2,E为NO,F为NO2,G为HNO3。
【详解】(1)根据上述推断,M可以为:NH4HCO3或(NH4)2CO3,C为NH3, F为NO2,故答案为:NH4HCO3或(NH4)2CO3;NH3;NO2;(2)根据分析和框图可知反应①是过氧化钠与CO2反应生成碳酸钠和氧气,其化学方程式为2Na2O2+2CO2 = 2Na2CO3+O2,故答案为:2Na2O2+2CO2 = 2Na2CO3+O2;(3)根据分析和框图可知反应②是铜与稀硝酸反应生成硝酸铜、NO和水,反应的离子方程式为8H++2NO3-+3Cu=3Cu2++2NO↑+4H2O,故答案为:8H++2NO3-+3Cu=3Cu2++2NO↑+4H2O。
2.有关物质的转化关系如下图所示(部分物质和条件已略去)。
A、C是常见的强酸,B 是黄色非金属单质;E是紫红色金属单质,G是最常见的无色液体;D、F、I是常见的气体,D为红棕色,D与I组成元素相同,且相对分子质量相差16。
请回答下列问题:(1)G的化学式为________。
(2)反应①的化学方程式为_____________________________。
(3)E与A的浓溶液反应的离子方程式为_________________________________。

备战高考化学与高无机综合推断有关的压轴题附答案一、无机综合推断1.已知A、B、C、D原子序数依次递增的短周期主族元素,常温常压下AB2是一种红棕色气体,B与C同主族,则:(1)C元素在周期表中的位置____________。
(2)画出D元素的简单离子结构示意图_______________________。
(3)将CB2与D2以体积比1:1混合后通入品红溶液中,品红溶液不褪色,请用一个化学方程式来解释:_________________________________。
(4)AB2与水反应的化学方程式为___________,在一定温度和压强下,将一个容积为15mL 的试管充满AB2后,倒置于一个盛水的水槽中,当试管液面上升至一定高度不再变化时,相同条件下再通入O2,若要使试管液面仍保持在原高度,则应通入的O2为___________mL。
(5)甲、乙、丙均为含A元素的化合物,丁为单质,甲、乙、丙、丁四种物质有如下转化关系(反应条件及部分产物已略去)①若丁为一种常见的非金属单质,甲为氢化物,乙为氧化物,则一个乙分子所含有的电子数目___________。
②若丁为一种常见的金属单质,常温下丁在甲的浓溶液中能反应但很快停止,则丙的化学式___________。
【答案】第三周期ⅥA族 SO2 +Cl2+2H2O=H2SO4 +2HCl 3NO2 + H2O=2HNO3 + NO8.75 15 Fe(NO3)2【解析】【分析】由常温常压下AB2是一种红棕色气体可知,A为N元素、B为O元素;由B与C同主族可知,C为S元素;由A、B、C、D是原子序数依次递增的短周期主族元素可知,D为Cl元素。
【详解】(1) C为S元素,位于周期表第三周期ⅥA族,故答案为第三周期ⅥA族;(2)D为Cl元素,Cl原子得到一个电子形成Cl—,离子结构示意图为,故答案为;(3)SO2与Cl2以体积比1:1反应生成硫酸和盐酸,反应的化学方程式为SO2 + Cl2 +2H2O =H2SO4 + 2HCl,故答案为SO2 + Cl2 +2H2O = H2SO4 + 2HCl;(4)NO2与水反应生成硝酸和一氧化氮,反应的化学方程式为3NO2 +H2O =2HNO3 +NO;在一定温度和压强下,将一个容积为15mL的试管充满NO2后,倒置于一个盛水的水槽中,当试管液面上升至一定高度不再变化时,试管中NO体积为1153ml⨯=5mL,相同条件下通入O2,NO先与O2发生反应4NO+3O2+2H2O =4HNO3使试管中无气体溶液全充满,此时通入O2的体积为354ml⨯=3.75mL,再通入5mLO2使试管液面仍保持在原高度,则通入O2的体积为(5mL+3.75mL)=8.75mL,故答案为3NO2 +H2O =2HNO3 +NO;8.75;(5)由题意甲、乙、丙均为含N元素的化合物。

高考化学高无机综合推断综合题汇编附答案解析一、无机综合推断1.I.化合物X含有三种元素,其中两种为非金属元素,且原子个数比为1:1,X不溶于水,能溶于强酸。
某研究小组为探究其组成和性质,设计并完成了如下实验。
(1)X的化学式是____________________。
(2)写出检验黄色溶液中金属阳离子的实验操作:__________。
(3)黄色溶液中加入铜片,铜片表面被腐蚀,则对应的离子方程式是:_____________________。
II.已知黑色固体中不含单质。
为进一步探究其组成,研究小组将上述所得固体全部溶于稀盐酸,配成100mL溶液,每次取20.00mL待测液于锥形瓶中,用2.000×10-2mol∙L-1 KMnO4标准溶液进行滴定,并记录实验的结果如下表:组次1234V标(mL)20.0020.0219.9919.99(4)如何判断滴定终点:__________________。
(5)待测液中c(Fe2+) = ____________________。
(6)该黑色固体的化学式用Fe x O y形式可表示为_______________。
【答案】FeOCl 取少量黄色溶液置于洁净试管中,滴加几滴KSCN溶液,若溶液呈血红色,则说明有Fe3+ 2Fe3+ + Cu = 2Fe2+ + Cu2+当最后一滴标准KMnO4溶液滴入锥形瓶时,溶液恰好变浅紫(红)色,且半分钟内不变色 0.1000mol.L-1 Fe4O5【解析】【详解】I.根据流程中信息可知,2.15gX与适量硫酸反应得到黄色溶液为含有铁离子及硫酸根离子等的溶液,黄色溶液与足量氢氧化钠溶液作用生成红褐色氢氧化铁沉淀,氢氧化铁沉淀加热后生成红棕色固体1.60g,即氧化铁1.60160/gg mol=0.01mol,故X中含有0.02 molFe3+,质量为0.02 mol56g/mol=1.12g,与足量氢氧化钠溶液反应的溶液再与足量硝酸钡溶液反应生成硫酸钡沉淀6.99g,即为6.99g233/g mol=0.03mol,但硫酸根离子来自于所加硫酸,反应所得溶液继续与足量硝酸酸化的硝酸银溶液反应得到白色沉淀氯化银2.87g,即为2.87g 143.5/g mol =0.02mol ,故可推知X 中含有0.02molCl -,质量为0.02 mol 35.5g /mol ⨯=0.71g ,化合物X 含有三种元素,其中两种为非金属元素,且原子个数比为1:1,故另一非金属元素也为0.02 mol ,且质量为2.15g-1.12g-0.71g=0.32g ,则摩尔质量为0.32g 0.02mol=16g/mol ,应为O 元素,故X 为FeOCl ; (1)X 的化学式是FeOCl ; (2)检验黄色溶液中金属阳离子Fe 3+的实验操作为:取少量黄色溶液置于洁净试管中,滴加几滴KSCN 溶液,若溶液呈血红色,则说明有Fe 3+;(3)黄色溶液中加入铜片,铜片表面被腐蚀,反应生成Fe 2+和Cu 2+,对应的离子方程式是:2Fe 3+ + Cu= 2Fe 2+ + Cu 2+;II .(4)黑色固体溶于盐酸后所得溶液中含有亚铁离子,遇酸性高锰酸钾溶液使其褪色,故判断滴定终点为:当最后一滴标准KMnO 4溶液滴入锥形瓶时,溶液恰好变浅紫(红)色,且半分钟内不变色;(5)根据表中数据可知,滴定消耗的标准液的平均体积为20.00mL ,根据反应5Fe 2+ + MnO 4-+ 8H +=5Fe 3+ + Mn 2+ +4H 2O 可知,待测液中c(Fe 2+)=2332.00010/20.0010/50.1000/20.0010/mol L mL L mL mol L mL L mL---⨯⨯⨯⨯=⨯; (6)黑色固体中含有的Fe 2+物质的量为0.1000/0.10.01mol L L mol ⨯=,铁的总物质的量为0.02 mol ,则n(Fe 2+) : n(Fe 3+) =0.01 mol: 0.01 mol=1:1,该黑色固体的化学式用Fe x O y 形式表示,根据化合物各元素化合价代数和为0,则有23222x x y ⨯+⨯=,得x:y=4:5,Fe x O y 可表示为Fe 4O 5。
备战高考化学压轴题之高无机综合推断(备战高考题型整理,突破提升)及详细答案一、无机综合推断1.下列各物质中只有A、B、C三种单质,A的焰色反应为黄色,主要以G形式存在于海水中,F是一种淡黄色的固体,H是一种常见的无色液体,I是造成温室效应的“元凶”,各物质间的转化关系图如下:回答下列问题:(1)A是:_____,C是:_____,L是:______,I是:____(填化学式)。
(2)写出反应①②③的化学反应方程式:①:____________________________________;②:____________________________________;③:____________________________________;【答案】Na Cl2HCl CO22Na+2H2O=2NaOH+H2↑2Na2O2+2H2O=4NaOH+O2↑2NaHCO3Na2CO3+CO2↑+H2O【解析】【分析】焰色反应为黄色的单质是钠,钠元素在自然界主要以氯化钠的形式存在,淡黄色固体是过氧化钠,常见的无色液体是水,造成温室效应的“元凶”是二氧化碳。
因此,A是钠,B是氧气,C是氯气,D是氢氧化钠,E是氧化钠,F是过氧化钠,G是氯化钠,H是水,I是二氧化碳,J是碳酸氢钠,K是碳酸钠,L是盐酸。
【详解】(1)A是钠,化学式为Na,C是氯气,化学式为Cl2,L是氯化氢,化学式为HCl,I是二氧化碳,化学式为CO2;(2)①是钠与水的反应,化学方程式为:2Na+2H2O=2NaOH+H2↑;②是过氧化钠与水的反应,化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;③是碳酸氢钠的受热分解,化学方程式为:2NaHCO3Na2CO3+CO2↑+H2O;【点睛】无机框图推断题要找出题眼,关键点,熟记特殊物质的颜色,特殊的反应,工业生产等等,找出突破口,一一突破。
2.X、Y、Z三种主族元素,原子序数依次增大且原子序数小于10,它们的单质在常温下都是常见的无色气体,在适当条件下,三者之间可以两两发生反应生成分别是双原子、三原子和四原子的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为2∶3。
高考化学高无机综合推断(大题培优)附答案一、无机综合推断1.下列各物质中只有A、B、C三种单质,A的焰色反应为黄色,主要以G形式存在于海水中,F是一种淡黄色的固体,H是一种常见的无色液体,I是造成温室效应的“元凶”,各物质间的转化关系图如下:回答下列问题:(1)A是:_____,C是:_____,L是:______,I是:____(填化学式)。
(2)写出反应①②③的化学反应方程式:①:____________________________________;②:____________________________________;③:____________________________________;【答案】Na Cl2HCl CO22Na+2H2O=2NaOH+H2↑2Na2O2+2H2O=4NaOH+O2↑2NaHCO3Na2CO3+CO2↑+H2O【解析】【分析】焰色反应为黄色的单质是钠,钠元素在自然界主要以氯化钠的形式存在,淡黄色固体是过氧化钠,常见的无色液体是水,造成温室效应的“元凶”是二氧化碳。
因此,A是钠,B是氧气,C是氯气,D是氢氧化钠,E是氧化钠,F是过氧化钠,G是氯化钠,H是水,I是二氧化碳,J是碳酸氢钠,K是碳酸钠,L是盐酸。
【详解】(1)A是钠,化学式为Na,C是氯气,化学式为Cl2,L是氯化氢,化学式为HCl,I是二氧化碳,化学式为CO2;(2)①是钠与水的反应,化学方程式为:2Na+2H2O=2NaOH+H2↑;②是过氧化钠与水的反应,化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;③是碳酸氢钠的受热分解,化学方程式为:2NaHCO3Na2CO3+CO2↑+H2O;【点睛】无机框图推断题要找出题眼,关键点,熟记特殊物质的颜色,特殊的反应,工业生产等等,找出突破口,一一突破。
2.已知A、B、C、D原子序数依次递增的短周期主族元素,常温常压下AB2是一种红棕色气体,B与C同主族,则:(1)C元素在周期表中的位置____________。
备战高考化学压轴题之高无机综合推断(备战高考题型整理,突破提升)附详细答案一、无机综合推断1.某新型无机材料A3M4由两种非金属元素组成,元素M位于第二周期V A族。
D、E、H 均为难溶于水的白色固体:化合物C、E均含A元素。
其余物质均为中学化学中常见物质。
请回答:(1)写出H的化学式:________________。
(2)化合物A3M4中含有的化学键类型为:________________。
(3)写出反应②的离子方程式:________________。
【答案】AgCl共价键SiO2+2OH- = SiO32-+H2O【解析】根据题中各物质转化关系,D受热得E,E能与氢氧化钠反应生成F,F与过量的二氧化碳反应生成D,说明D为弱酸且能受热分解;新型无机材料A3M4由两种非金属元素组成,元素M位于第二周期VA族,应为N元素,A元素为四价元素,C、E均为含A元素,可知A3M4应为Si3N4,可以确定A为Si,E为SiO2,F为Na2SiO3,则D为H2SiO3,G与硝酸银反应生成不溶于稀硝酸的沉淀H,则可知G中有Cl-,H为AgCl,故C为SiCl4,B为Cl2;由SiCl4+3H2═4HCl+H2SiO3,生成G:HCl;(1)H的化学式为AgCl;(2)化合物Si3N4中含有的化学键类型为共价键;(3)SiO2溶解于NaOH溶液发生反应的离子方程式为SiO2+2OH- = SiO32-+H2O。
2.为探究某黄色固体的组成和性质,设计如下实验:请回答:(1)X 的化学式是_______。
(2)X 在空气中充分灼烧的化学方程式为_______。
(3)溶液 A 与烧碱反应生成 B 和浅黄色沉淀(0.01mol)的化学方程式为_______。
【答案】CuFeS2 4CuFeS2+13O2=4CuO+2Fe2O3+8SO2 3Fe2(SO4)3+12NaOH=Na2Fe6 (SO4)4(OH)12+5Na2SO4【解析】【分析】根据流程图,11.04gX在空气中灼烧,生成的气体使品红溶液褪色的气体是二氧化硫,生成的黑色固体氧化物应该为CuO,得到红褐色固体氧化物应该为 Fe2O3,根据图示中提供的数据计算含有S、Cu、Fe元素的物质的量确定X的化学式以及物质的量;氧化铁加入适量稀硫酸溶解得到含一种溶质的溶液为Fe2(SO4)3溶液,再加入NaOH反应生成溶液为7.1g,单一溶质且只含一种金属元素,B为Na2SO4,结合元素守恒和电荷守恒分析判断黄色沉淀所含成分,据此分析解答。
高三化学无机推断试题答案及解析1.A、J是日常生活中常见的两种金属,这两种金属和NaOH溶液组成原电池,A作负极;F常温下是气体,各物质有以下的转化关系(部分产物及条件略去)。
回答以下问题:(1)A的原子结构示意图为,M的化学式为。
(2)A与NaOH溶液反应的离子方程式为。
(3)写出②的化学方程式。
(4)含A元素的某盐X常做净水剂,X做焰色反应时,透过蓝色钴玻璃观察火焰呈紫色。
X的水溶液与NaHCO3溶液混合,反应的离子方程式为。
【答案】(1),FeS;(2)2Al + 2OH- + 6H2O=2[Al(OH)4]- + 3H2↑;(3)4NH3+5O24NO+6H2O;(4)Al3+ + 3HCO3-= Al(OH)3↓ + 3CO2↑。
【解析】根据题意知,A、J是日常生活中常见的两种金属,这两种金属和NaOH溶液组成原电池,A作负极,则A为铝;结合流程图知,C为偏铝酸钠,E为氢氧化铝,H为氧化铝,J为铁,M为硫化亚铁,D为氢气,F为氮气,G为氨气,I为一氧化氮,K为二氧化氮,L为硝酸。
(1)A为铝,原子结构示意图为,M为硫化亚铁,化学式为FeS;(2)铝与NaOH溶液反应生成四羟基合铝酸钠和氢气,离子方程式为2Al + 2OH- + 6H2O==2[Al(OH)4]- + 3H2↑;(3)反应②为氨的催化氧化,化学方程式4NH3+5O24NO+6H2O;(4)含A元素的某盐X常做净水剂,X做焰色反应时,透过蓝色钴玻璃观察火焰呈紫色。
X为明矾,其水溶液与NaHCO3溶液混合,反应的离子方程式为Al3+ + 3HCO3-="=" Al(OH)3↓ + 3CO2↑。
【考点】考查无机推断,涉及铝和氮元素单质及其化合物的性质及相互转化关系、化学方程式的书写。
2.A、B、C分别是元素甲、乙、丙的单质,它们都是常见的金属或非金属,D、E、F是常见的三种氧化物,且有如图所示转化关系,则下列说法不正确的是()A.D、E中一定都含有甲元素B.单质B肯定是氧化剂C.A、B、C中一定有一种是氧元素的单质D.若A是非金属,则B一定为金属【答案】B【解析】A是甲的单质,根据图示,E中必含甲元素,B是乙元素单质,与D反应生成A,该反应是置换反应,所以D中必含甲元素,A项正确;B项,D是氧化物,与B单质反应,一般B是还原剂,错误;C项,A与C单质反应生成氧化物E,所以必有一种是氧气,正确;D项,若A是非金属,则D与B的反应一般是类似于水与钠间的置换,即D项正确。
高考化学高无机综合推断的综合复习附详细答案一、无机综合推断1.下列各物质是中学化学中常见的物质,甲为常见金属单质,乙、丙、丁是非金属单质,其它为化合物,B、D分别为黑色粉末和黑色晶体,G为淡黄色固体,J为生活中常见的调味品,I为红褐色固体,①是实验室制取丁的反应之一,F为棕黄色溶液。
各物质间的转化如下图所示,回答下列各问题(部分生成物未列出):(1)A的电子式:___________________;(2)写出甲与C反应的化学方程式:________________________________;(3)在F和E的混合溶液中用___________试剂(填化学式)检验E中阳离子;(4)整个转换过程中属于氧化还原反应的有___________个;(5)写出反应③E与G按物质的量之比2:1的反应的离子方程式___________________。
【答案】3Fe + 4H2O(g) Fe3O4 + 4H2KMnO46个6Fe2+ + 3Na2O2 + 6H2O = 4Fe(OH)3↓ + 2Fe3+ + 6Na+【解析】【分析】由题意可知,G为淡黄色固体化合物,J为生活中常见的调味品,则G是Na2O2, J为NaCl;I为红褐色固体,则I是氢氧化铁,甲是Fe单质;B、D分别为黑色粉末和黑色晶体,Fe与物质C发生置换反应生成另一种非金属单质,根据Fe与水蒸气在高温条件下反应生成氢气和黑色固体四氧化三铁可知C是水,乙是氢气,D是Fe3O4;A与B反应生成水和一种非金属单质,且①是实验室制取丁的反应之一,判断A是过氧化氢,B是二氧化锰,过氧化氢在二氧化锰做催化剂作用下发生分解反应生成水和氧气,所以丁是氧气;四氧化三铁与K反应生成两种物质E、F,可以相互转化,则K是盐酸,盐酸与四氧化三铁反应生成氯化亚铁和氯化铁,F与Fe反应生成E,则F是氯化铁,E是氯化亚铁,氯化铁与过氧化钠反应生成氢氧化铁、氯化钠、氧气,氯化亚铁与一定量的过氧化钠反应生成氯化铁、氢氧化铁、氯化钠。
备战高考化学压轴题之高无机综合推断(备战高考题型整理,突破提升)附答案一、无机综合推断1.X、Y、Z三种主族元素,原子序数依次增大且原子序数小于10,它们的单质在常温下都是常见的无色气体,在适当条件下,三者之间可以两两发生反应生成分别是双原子、三原子和四原子的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为2∶3。
请回答下列问题:(1)元素X的名称是______,丙分子的电子式为______。
(2)若甲与Y单质在常温下混合就有明显现象,则甲的化学式为________。
丙在一定条件下转化为甲和乙的反应方程式为____________________________________________。
(3)化合物丁含X、Y、Z三种元素,丁是一种常见的强酸,将丁与丙按物质的量之比1∶1混合后所得物质戊的晶体结构中含有的化学键为________(选填序号)。
a.只含共价键 b.只含离子键 c.既含离子键,又含共价键【答案】氢 NO 4NH3+5O24NO+6H2O C【解析】【分析】由X、Y、Z三种主族元素,原子序数依次增大且原子序数小于10,它们的单质在常温下都是常见的无色气体可知,三种气体单质为氢气、氮气、氧气,X为H元素、Y为N元素、Z 为O元素,由在适当条件下,三者之间可以两两发生反应生成分别是双原子、三原子和四原子的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为2∶3可知,甲为NO、乙为H2O、丙为NH3。
【详解】(1)元素X为H元素,名称为氢;丙为共价化合物NH3,电子式为,故答案为氢;;(2)甲为无色气体NO,NO与氧气反应生成红棕色的二氧化氮;氨气与氧气发生催化氧化反应生成一氧化氮和水,反应的化学方程式为4NH3+5O2 4NO+6H2O,故答案为4NH3+5O24NO+6H2O;(3)由化合物丁是一种含H、O、N三种元素的强酸可知,丁为HNO3,HNO3与NH3按物质的量之比1:1混合反应生成NH4NO3,NH4NO3为离子化合物,含有离子键和共价键,故答案为C。
高考化学压题-无机框图推断题题目主要来源于北京、浙江、江苏、湖南、湖北等地区最新模拟试题1.(14分)中学化学中几种常见物质的转化关系如图所示(图中部分反应物或生成物及反应条件未列出)。
已知:A、B、C、D是单质,其余是化合物。
其中B、D是常见金属,且组成B的元素属于过渡元素。
又知A在C中点燃有苍白色火焰,M既可溶于盐酸又可溶于NaOH溶液。
请回答下列问题:(1)W的电子式是_______________。
(2)写出N的化学式,并任写一种N的主要用途。
(3)写出下列反应的离子方程式:反应①,反应③__________________________________________________________,K溶液和过量氨水反应__________________________________________________。
1.(14分)(1)(2分)(2)FeCl3(2分),N可用作催化剂、净水剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1分)(3)2Cl-+2H2O 2OH- + H2↑+ Cl2↑,Al3+ + 3AlO2-+6H2O === 4Al(OH)3↓,Al3+ + 3NH3·H2O === Al(OH)3↓+ 3NH4+(方程式各3分)2.(12分)27.(14分).A.B.C.D.E是中学化学常见单质,构成它们的元素的原子序数分别为α、b. c.d.е;且3 (a+b) = 2 (a+c) = 3 (d-a);X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(图中反应物和产物中的H2O已略去):(1)Y的电子式为,构成D单质的元素在周期表中位于周期族(2)反应③的离子方程式为E的氧化物与D在一定条件下反应的化学方程式为:。
(3)固体N常温下即挥发,183℃升华,几乎溶于所有的有机溶剂和H2O中,据此判断N为型晶体(4)25℃时,PH=5的W和N的水溶液中由H2O电离出来的H+离子浓度之比为2.(12分)⑴;三;ⅢA⑵Al3++3AlO2-+6H2O = 4Al(OH)3Fe2O3+2Al 2Fe + Al2O3 (Fe2O3若写成FeO或Fe3O4并配平也可以)⑶分子⑷ 1∶1043.(14分)、A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G 含有同种元素。
已知:(Ⅰ)A为金属单质; B为红褐色固体;E为密度最小的气体;G为浅绿色溶液。
(Ⅱ)D为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀。
(Ⅲ)D能将某种氧化物氧化为F,F是含有三种元素的化合物。
请回答下列问题:(1)上述反应中属于置换反应的是(填序号)。
(2)G生成B有多种途径。
若在G的溶液中加入与G等物质的量的Na2O2,恰好使G转化为B,写出该反应的离子方程式:反应③(即D 将某种氧化物氧化为F )的离子方程式 (3)D 的水溶液显酸性,请用离子方程式解释原因 (4)实验室制取C 的化学方程式为 对气体C 进行如下实验。
已知整个反应过程中,每消耗0.1mol KI,转移的电子数约为3.612×1023个。
请按照要求填空: 实验步骤 实验现象用化学用语解释将少量气体通入淀粉KI 溶液 溶液最初变成 色(用离子方程式表示)继续通入气体溶液逐渐变成无色 (用化学方程式表示)(1) ②⑤ (2分) (2) 4Fe 2++4Na 2O 2+6H 2O =4Fe(OH)3↓+O 2↑+8Na +(2分) 2Fe 3++SO 2+2 H 2O =2Fe 2++SO 42-+4 H +(2分)(3)Fe 3++3 H 2O Fe(OH)3+3 H +(2分)(4)MnO 2 + 4 HCl (浓) Mn Cl 2+Cl 2↑+2 H 2O (2分)实验步骤 实验现象用化学用语解释蓝(1分) Cl 2+ 2I -= I 2+2Cl -(1分)5Cl 2+ I 2+6H 2O= 2HIO 3+10 HCl (2分)4.(14分)短周期元素组成的单质X 2、Y ,标准状况下X 2的密度为3.17g ·L -1,;常温下,Y 为浅黄色固体。
Z 是一种化合物,焰色反应呈浅紫色(透过钴玻璃);0.1mol ·L -1Z 的水溶液pH=13 。
X 2、Y 和Z 之间有如下转化关系(其他无关物质已略去):(1X 2与Z 反应的离子方程式: (2)已知16g 单质Y 完全燃烧放出148kJ 热量。
写出热化学方程式: (3)已知C 能与硫酸反应生成能使品红溶液褪色的气体①D 的化学式是: ;D 的水溶液pH>7,原因是(用离子方程式表示): ;D 的水溶液中离子浓度大小顺序为②将20mL 0.5mol ·L -1C 溶液逐滴加入到20 mL 0.2mol ·L -1KMnO 4溶液(硫酸酸化)中,溶液恰好褪为无色。
写出反应的离子方程式:(4)石墨和铁做电极,用隔膜电解槽电解A 的溶液,阳极产生X 2 。
写出电解A 溶液的离子方程式: 4.(14分)(1) Cl 2+2OH -==Cl -+ClO -+H 2O(2)S(s)+O 2(g)==SO 2(g);△H=-296KJ/molZB DX 2Y△AC(3)○1 K 2S 、 S 2-+H 2OHS -+OH - ,c(K +)>c(S 2-)>c(OH -)>c(HS -)>c(H +)○2 5SO 32-+2MnO 4-+6H +==5SO 42-+2Mn 2++3H 2O (4) 2Cl -+2H 2O==Cl 2↑+H 2↑+2OH -(每空2分)5. (16分)下列16种物质之间有如下转化关系,部分产物已省略:己知:(a) W 、P 、N 、X 、F 是单质,其中F 是金属单质,其它均是化合物。
(b) A 是金黄色矿物。
M 是浅绿色的晶体。
K 与Y 均是10电子分子。
(c)B 与C 两种化合物均由同主族的两种短周期元素组成。
(d)W 元素的原子最外层电子数是次外层的两倍。
(e )反应②、③、④分别是工业制K 、D 、F 的重要反应。
反应⑤是实验室制M的重要反应。
请回答下列问题:(1) 元素F 在周期表中的位置是 ▲ 。
(2) 写出M 的化学式 ▲ 。
要从M 的溶液中得到M 晶体,其操作方法是 ▲ 。
(3)下列说法正确的是 ▲①M 是离子晶体。
②稳定性:K<Y ③构成X 、P 、W 、N 的原子半径依次减小④K 气体易液化是由于液态K 分子间存在氢键 (4) 仿照过氧化钠的电子式写出A 的电子式 ▲ , (5) 写出实验室制K 的化学方程式: ▲ (6) 写出反应④的化学方程式 ▲(7) H 的酸性溶液在空气中很容易变质,写出其变质过程的离子方程式: ▲ 。
(8己知()21F s +O (g)=FO(s) 2△H=-272.0KJ ·mol -122332Al(s)+O (g)=Al O (s) 2△H=-1675.7KJ ·mol -1写出Al 的单质和FO 反应的热化学方程式 ▲ 。
5.(16分)(各2分)(1)第四周期第Ⅷ族 (2)(NH 4)2SO 4·FeSO 4·6H 2O 蒸发浓缩、冷却结晶、抽滤 (3)①②④ (4)略 (5) 2NH 4Cl+Ca(OH)2CaCl 2+2NH 3↑+2H 2O(6)Fe 2O 3+2CO2Fe+3CO 2 (7)4Fe 2++O 2+4H +=4 Fe 3++2H 2O(8) (8)3FeO(s) + 2Al(s)Al 2O 3(s) + 3Fe(s) △H =-859.7KJ ·mol -16.(16分)已知化合物A 与B 、丙与丁的元素组成相同,且四种物质中都含有同一种元素。
A 与B 在常温下均呈液态。
D 与F 都为固体单质,且D 、 F 与甲的浓溶液在常温作用都无明显现象,加热时有大量气体产生。
(相关转化部分反应条件和生成物未标出)。
(I )A 的结构式 , E 与F 的反应是 (填反应名称),在工业生产中此反应有什么用途? 、 。
(II )若反应①除生成甲外,还生成丙,回答(1)、(2)小题:(1)写出过量D 与甲稀溶液反应的离子方程式: (2)以D 、F 为电极,NaOH 溶液为电解质溶液可以组成原电池,原电池正极的电极反应为:(III )若A 与丙可以化合生成甲;甲与D 加热条件下可以生成三种化合物乙、丙、B ,乙、丙、B 常温下又可以反应生成甲和另一化合物X 。
回答(2)、(3)小题:(3)写出下列方程式 ②: ③: (4)将含有1.2molX 的水溶液调至中性,通入足量C 充分反应,生成红褐色沉淀且溶液呈黄色,经过滤、洗涤、灼烧至恒重,称量所得固体的质量为 。
6. (16分)(I )H-O-O-H (2分),铝热反应(2分),焊接铁轨、冶炼金属(2分); (II )(1)3Fe+8H ++2NO 3—=3Fe 2++2NO↑+4H 2O (2分)(2)6H 2O +6e- =3H 2↑+6OH-(2分)(III )(3)②:2SO 2+O 22SO 3(2分)③:2Fe+6H 2SO 4(浓)Fe 2(SO 4)3+3SO 2↑+6H 2O (2分)(3)32g (2分) 7.(14分)A 、B 、C 、D 、E 均为中学化学的常见单质或化合物,它们之间的反应关系如图所示:(1)若A 是短周期中原子半径最大的元素构成的单质,E 既可溶于盐酸又可溶于NaOH 溶液,E 溶于NaOH 溶液的离子方程式是 ;工业上冶炼A 的化学反应方程式是 。
A 的水溶液B CMnO 2丁甲 DGFE丙乙 B②③①固 体 AB 的溶液D 白色沉淀E气体C(2)若C是既含有极性键又含有非极性键的四原子分子,则实验室制取C的化学方程式是;1 mol C完全燃烧生成液态水时放热1300 kJ·mol-1,则C完全燃烧的热化学方程式是。
A与盐B的溶液反应时只生成气体C、碳酸钙沉淀和水,则B的化学式是。
7.(14分)(1)Al(OH)3 + OH- = AlO2- + 2 H2O(3分);2 NaCl(熔融)电解2 Na + Cl2↑(3分);(2)CaC2 + 2 H2O → C2H2↑+ Ca(OH)2(3分);2 C2H2(g) +5 O2(g) = 4 CO2(g) + 2 H2O(l) ΔH= - 2600 kJ·mol-1(3分);Ca(HCO3)2(2分)8.(15分)A—J是中学化学中常见的几种物质,它们之间的转化关系如图所示。