推测反应机理2
- 格式:doc
- 大小:391.00 KB
- 文档页数:8

有机反应机理的研究方法有机反应机理的研究是有机化学方面的重要研究内容,它对于揭示化学反应过程、提高反应效率以及设计新型反应具有重要意义。
本文将介绍一些常用的有机反应机理研究方法,帮助读者更好地理解有机反应机理的探究。
一、核磁共振波谱(NMR)核磁共振波谱是一种常用的研究有机反应机理的方法。
通过核磁共振波谱,我们可以获得反应物、中间体和产物的详细信息,进而推测反应过程中的各个步骤。
核磁共振波谱可以提供分子结构的信息,包括化学位移、耦合常数和积分强度等。
这些信息可以用于确定反应物的质子数目和它们在不同化学环境下的化学位移。
同时,核磁共振波谱还可以通过跟踪标记原子或同位素的化学位移变化,揭示反应中的键重排或聚合等步骤。
因此,核磁共振波谱是研究有机反应机理的重要工具之一。
二、质谱(MS)质谱是另一种常用的研究有机反应机理的方法。
质谱可以提供化合物分子的质量及其分子结构的信息。
通过质谱技术,我们可以将反应物、中间体和产物的质谱图与数据库中的已知物质进行比对,从而确定化合物的分子结构。
此外,质谱还可以通过分析碎片离子的质谱图,推测反应中的键裂解方式和生成反应产物的途径。
质谱是一种高灵敏度和高分辨率的技术,广泛应用于有机反应机理的研究。
三、红外光谱(IR)红外光谱是一种用于研究有机反应机理的常见方法。
红外光谱通过检测化合物吸收、透射和散射红外辐射的能力来提供分子的振动信息。
有机化合物中的键振动和分子结构与红外吸收峰的位置和强度密切相关。
通过红外光谱的分析,我们可以了解反应物、中间体和产物之间的键变化以及它们的相对含量。
红外光谱在有机反应机理研究中起着重要的辅助作用。
四、动力学研究动力学研究是揭示有机反应机理的重要手段之一。
通过测定反应速率与反应物浓度、温度和反应物结构的关系,我们可以推测反应中的步骤和反应物之间的相互作用方式。
常用的动力学实验技术包括体系的速率方程研究、随时间变化曲线的监测和测定活化能等。
这些数据可以用来确定反应活性物质和反应过程中的中间体,从而帮助我们理解有机反应的机制。

化学合成反应机理化学合成是一种常用的化学方法,通过组合或转化原子、分子或离子来制备目标产物。
在化学合成中,反应机理是非常重要的。
了解反应机理可以帮助我们理解反应的原理,引导我们设计高效的合成方法,并提供有关反应条件和产物选择的信息。
一、反应机理的概念反应机理是指描述化学反应中原子、分子、离子之间发生的具体步骤和反应路径的理论模型。
它通过分析反应物和产物之间的键断裂、键形成和中间体的形成来揭示反应的本质。
反应机理可以从实验数据、理论计算和理论分析中得到。
二、核心概念:活化能和反应中间体活化能是指化学反应中反应物要通过能垒才能转变为产物的能量差。
活化能高低直接影响反应速率,活化能越高,反应速率越慢。
了解反应机理可以帮助我们了解活化能的来源,从而设计合适的反应条件来提高反应速率。
反应中间体是指在反应中暂时形成的中间产物,它们通常是不稳定的,往往很快转化为更稳定的物质。
反应中间体的存在对于理解反应机理和选择适当的合成路径非常重要。
三、反应的基本步骤1. 取代反应取代反应是一种常见的化学合成方法,包括亲核取代反应和电子取代反应。
亲核取代反应是指亲核试剂攻击电子密度较高的化合物,将原有官能团取代掉,形成新的官能团。
电子取代反应则是通过电子试剂来引发反应,改变化合物的电子分布。
2. 加成反应加成反应是指两个或多个分子之间发生共有电子对(键)的结合,形成一个新的化合物。
加成反应可以通过共轭体系的形成或破坏来实现。
加成反应在天然产物的合成中经常被使用,可以实现复杂分子骨架的构建。
3. 消除反应消除反应是指通过消除某些原子或基团,使反应物减少一个或多个分子,生成一个或多个新的化合物。
常见的消除反应包括酯中的酸或酸酐的消除,或芳香醚中的碱或醇的消除。
消除反应可以减小反应物的分子量,有助于化合物的精简合成。
四、反应机理的研究方法1. 实验方法实验方法是研究反应机理的关键手段之一。
通过实验可以获得反应物和产物的转化率、速率常数等重要数据,从而推测反应的机理模型。

化学反应机理的解析方法化学反应机理是指描述化学反应过程中发生的分子、原子、离子之间的变化方式和速率的详细步骤。
深入了解化学反应机理对于理解和控制化学反应过程具有重要意义。
本文将介绍几种常用的化学反应机理解析方法,帮助读者更好地理解和研究化学反应机理。
一、动力学研究法动力学研究法是通过实验数据和数学模型研究化学反应过程的速率规律,从而推测出反应的机理。
其基本原理是根据实验测得的反应速率与反应物浓度、温度等相关因素之间的关系,推导出反应的速率方程。
根据速率方程的形式和反应物的性质,可以初步确定反应的机理步骤和物质间的相互作用方式。
二、分子动力学模拟法分子动力学模拟法利用计算机模拟分子和原子之间的相互作用,以及它们在不同条件下的运动轨迹,来揭示化学反应的机理。
通过分子动力学模拟,可以模拟出化学反应发生时分子的结构变化、能量变化以及反应中间体的生成过程。
这种方法在有机合成、催化反应等领域得到了广泛应用,并取得了许多重要的研究成果。
三、同位素示踪法同位素示踪法是一种利用同位素标记研究化学反应机理的方法。
通过将反应物中的某种原子或分子用同位素进行标记,进而追踪标记原子或分子在反应过程中的转化情况。
通过测量同位素的分布和比例变化,可以得到反应中间体的生成和反应路径的信息。
同位素示踪法在生物化学、环境科学等领域的研究中被广泛应用。
四、谱学方法谱学方法是通过测量反应物和产物在不同能量和频率范围内的光谱数据,以及对光谱数据进行定量分析,来解析化学反应机理的方法。
包括红外光谱、拉曼光谱、质谱等多种谱学技术。
这些光谱方法可以用于研究反应中间体的结构、反应路径的选择以及发生的速率等信息。
五、X射线晶体学方法X射线晶体学方法是通过测定反应物和产物中的晶体结构,来解析化学反应机理的方法。
通过确定分子在空间中的排列方式和结构特征,可以揭示反应过程中键断裂、键生成等细节信息。
X射线晶体学在有机反应、配位化学等领域得到了广泛应用。

有机反应机理反应机理(又称反应历程)是研究反应的实际过程,哪个键先断裂、哪个键先形成、键断裂和形成的顺序、每步的相对速率、原子或基团在反应过程中的键合情况及空间位置变化等等。
由于分子的振动和碰撞是在10-12~10-14 s内完成,目前还没有能直接观察在这样短的时间内分子和原于运动情况的手段或仪器,而只能根据反应中观察的现象推测反应可能经历的过程。
因此,日前关于反应机理的描述都是根据实验的结果和观察到的现象进行间接推理或假设。
20世纪80年代末,ZewailA H研究成功了—种激光脉冲式的超高速闪光照相机,它的脉冲时间只有几十个飞秒(f s=10-15s),可以让人们通过超高速照相机拍摄的“慢动作”观察化学反应过程中原子与分子的化学键形成和断裂的转变形态,跟踪显示化学反应的全过程。
为研究反应机理和预测化学反应提供了一种新方法,这一成果最先用于研究简单气态分子的化学反应,现在已推广到液态和固态的化学变化,并由此诞生了一门称之为“飞秒化学”的新学科,zewnil也因其卓越贡献荣获1999年诺贝尔化学奖。
此外,量子化学的不断发展和超高速大容量计算机的飞速换代也为计算化学反应的全过程提供了可能。
虽然目前用计算机计算和描述化学反应的全过程还比较遥远,但已有了成功的苗头。
1、有机反应分类有机反应的数目和范围十分庞大,根据反应中键的断裂及形成方式可将有机反应分为:自由基反应、离子反应和分子反应。
有机反应也有按照原料和产物之间的关系进行分类,把几乎所有的有机反应分成六类,分别是取代反应、消去反应、加成反应、重排反应、氧化还原反应及几种反应类型的结合。
2、有机反应中试剂分类在有机反应试剂中,除双自由基外绝大部分具有偶数电子的试剂属于离子试剂;另一部分具有奇数电子的试剂则称为自由基试剂。
离子试剂又可进一步分为亲电试剂和亲核试剂。
亲电试剂:在反应过程中接受电子或共享电子(这个电子原属于另一个反应物分子)的试剂称为亲电试剂;亲核试剂:在反应过程中供给电子进攻反应物中带部分正电荷原子的试剂称为亲核试剂。

有机反应机制的研究方法有机化学中用来解释反应机理的传统方法主要集中在Kinetics和Dynamics两方面,即理解势能面、深入研究分子运动和碰撞、测定活化参数、测定速率常数、确定某个反应机理中一系列化学步骤的顺序、确定反应限速步骤和决速步骤。
研究机理的关键目的是反应机理知识可以对如何在原子或分子水平上操纵物质给出最快速的洞察,而不是依靠运气来获得偶然性的变化从而获得想要的结果。
由于动力学在辨别机理方面起着关键作用,所以动力学是整个有机反应机理研究领域中最重要的分支之一。
传统的反应机理研究方法除了动力学分析之外,还有同位素效应、结构-功能分析等。
这些都是研究有机反应机理的标准实验工具,然后实验化学家可以根据其想象力和化学创造性,设计出一些完全不同于之前出现过的研究方法。
因此,本文总结了一些最为常见的方法.首先分析最简单的实验,例如产物和中间体的鉴定。
但也会分析一些更为微妙、精细的实验,如交叉和同位素置乱(cross—over and isotope scrambling)实验。
1.改变反应物结构以转变或捕获预想的中间体有时可以通过合成一种类似于所研究的反应物的新反应物来破译中间体的性质,但是这需要所预测的中间体能以一种可预想的方式进行反应。
没有标准的方式来处理这一类实验,所以实验者必须根据具体实验情况来设计实验。
下面以酶反应作为此方法的应用实例。
Lin[1]等人设计了一种转变中间体的方法.扁桃酸消旋化酶可使扁桃酸根离子的对映体(2-羟基苯甲酸)互换.位于羧酸跟α位的碳负离子被认为是中间体。
为了测试此中间体是否存在,作者合成设计了扁桃酸跟离子的类似物i,并用酶对其进行了外消旋化.其过程是首先形成碳负离子,然后经过溴化物的1,6-消除,最后经过互变异构化,分离得到产物ii。
此结果支持了在扁桃酸根离子路径中碳负离子中间体iii的存在。
2.捕获实验和竞争实验鉴定中间体的一种常见方法是通过加入额外的试剂来捕获中间体。

化学反应机理的研究方法化学反应机理的研究方法是研究反应过程中化学物质如何发生转化的重要手段。
了解反应机理对于设计新的催化剂、优化反应条件以及改进工业生产过程具有重要的意义。
本文将介绍化学反应机理研究的常用方法和技术。
一、实验方法1. 反应动力学研究反应动力学研究是了解反应速率随时间变化的过程。
实验条件下,在不同的温度、浓度和压力下,测定反应物的浓度或产物的生成速率,然后利用动力学方程拟合数据,得出反应级数和速率常数。
这些数据可以用于推测反应机理。
2. 稳态方法稳态方法是通过接近反应体系稳定状态来研究反应机理。
一般通过连续流动反应器或恒温恒压反应器进行实验,在稳态条件下测定反应物浓度的变化,通过化学平衡和速率方程得出反应机理。
3. 化学陪床法化学陪床法通过引入某些催化剂对反应过程进行调控和观察。
通过引入催化剂,可以显著改变反应速率和反应物产物的选择性,从而推测反应机理。
常用的化学陪床法有Lewis酸碱对方法、酶催化法等。
二、理论计算方法1. 第一性原理计算第一性原理计算是通过量子力学原理进行计算,从头计算分子体系的电子结构和能量,从而推测反应机理。
常用的第一性原理计算方法包括密度泛函理论、量子力学分子动力学模拟等。
2. 分子力学方法分子力学方法是一种经典力学算法,可以模拟分子体系的运动和相互作用。
通过建立分子力学模型,模拟反应物在潜在能面上的运动,推测反应过程中的转化路径和反应机理。
三、表征技术1. 光谱学技术光谱学技术包括红外光谱、紫外光谱、核磁共振等,可以用于测定分子结构、成键情况、物质的表面结构等,从而对反应中的电荷转移、中间态等进行表征。
2. 质谱技术质谱技术可以用于分析和鉴定化学物质的组成和结构,对于研究反应机理中的中间体、反应过渡态以及催化剂中的活性位点等起到重要作用。
3. 表面分析技术表面分析技术包括扫描电子显微镜、X射线衍射等,可以研究反应物与催化剂之间的相互作用以及表面状态的变化,从而揭示反应机理。

化学反应是物质变化的过程,其中反应机理是描述反应中各个步骤、分子之间的相互作用和能量变化的过程。
对于理解和掌握化学反应,理解和解析反应机理是非常重要的。
在反应机理解析中,我们通常使用反应速率定律和反应性质来推断反应机理。
反应速率定律描述了反应速率与反应物浓度的关系,反应性质则涉及到反应物和产物的性质,以及反应中可能存在的中间物种和过渡态。
通过实验数据和观察现象,我们可以分析得出一个反应的机理。
首先,分析反应速率定律是解析反应机理的一个重要方法。
研究反应速率随各个反应物浓度的变化情况,有助于确定化学反应中负责决定反应速率的步骤。
例如,对于一个二级反应,如果实验数据表明反应速率正比于两个反应物的浓度的乘积,那么反应的机理可能是一个双分子反应步骤。
通过进一步的实验和分析,可以确定这个反应过程中可能存在的中间体。
其次,观察和分析反应物和产物的性质是解析反应机理的另一个重要方法。
通过观察反应物的结构和性质,我们可以推测可能发生的反应类型和反应步骤。
例如,研究一个反应涉及到氧化还原反应的金属离子,我们可以推断可能涉及到电子转移的步骤。
同时,观察产物的结构和性质,可以推测反应机理中可能存在的中间物种和过渡态。
例如,通过质谱、红外光谱等实验技术的应用,可以寻找反应机理中的中间物质和反应路径。
此外,理论计算和模拟也是解析反应机理的重要工具。
基于量子化学计算的理论方法可以预测反应机理的路径和能垒,以及在反应过程中可能形成的中间体。
通过计算电子结构、能量和反应通道的势垒高度,可以确定反应机理的步骤和可能的中间物种。
通过模拟反应过程,在计算机上重现反应动力学,可以进一步理解反应的机理和动力学。
综上所述,化学反应中的反应机理解析是通过实验数据、观察现象和理论计算,推测和探究物质之间的相互作用和变化过程。
反应机理的解析有助于我们理解和预测化学反应过程,同时也为催化剂的设计和反应条件的优化提供了指导。
因此,掌握反应机理解析的方法和技术对于化学研究和工业应用都具有重要意义。

由反应速率方程推测反应机理的经验规则反应机理是化学反应过程中各种物理化学过程之间的规律性关系,揭示了反应如何进行的问题,是研究化学反应动力学的核心。
因此,反应机理的研究一直是化学反应动力学研究的一个重要内容,尤其是快速反应过程中,如何推测反应机理及其反应过程成为化学反应动力学研究的重要课题。
一般来说,推测反应机理的方法可以分为两大类:一类是从化学反应本身出发,从化学元素及其组合式的变化出发,从理论上推测反应机理;另一类是利用反应动力学实验数据,根据反应动力学模型,推测反应机理。
在推测反应机理的实际工作中,常常以经验规则为基础,从反应动力学实验数据出发,利用反应速率方程推测反应机理。
反应速率方程是一种以反应进程中各参与物质的浓度及其变化情况为变量的速率表达式。
它描述了反应所涉及的反应物、产物和机理步骤之间的关系,是表征反应机理的重要指标。
因此,反应速率方程可以用来推测反应机理。
从反应速率方程中推测反应机理的一般经验规律主要有以下几点:(1)若反应分子的活化能越高,反应速率及反应方程式中含相应变量的次数越多,活化能越低,反应速率及反应方程式中含相应变量的次数越少;(2)若反应分子的活化能低,即反应速率及反应方程中含该变量的次数少,则反应过程具有单步机理,而若活化能较高,即反应速率及反应方程中含该变量的次数较多,则反应过程具有多步机理,如果特定变量出现变量的次数大于2次,则可能存在交叉反应;(3)若发生反应的双方量子数相同,则反应速率及反应方程式中含该变量的次数为1次,若发生反应的双方量子数不同,反应速率及反应方程式中含该变量的次数等于2次;(4)在反应速率及反应方程式中,若某变量出现2次,且反应分子的活化能较低,则表明反应过程可能存在催化机理;若某变量出现3次及以上,则可能存在多步反应机理,其中可能含有催化作用。
根据以上经验规则,可以从反应速率方程中推测反应机理。
然而,在实际工作中,从反应速率方程推测反应机理有一定的局限性,即反应速率方程只能提供一定程度的空间维度指导,对于反应机理的深入探究尚不足够。

由反应速率方程推测反应机理的经验规则1 由反应速率方程推测反应机理反应速率方程提供了反应机理的关键线索,是由反应物和生成物的初始浓度,反应的速率常数,温度和催化剂的信息来推断反应机理的经验规则。
它可用于预测非平衡反应机理、识别反应物和根据反应条件如温度、压力和催化剂变化而引起的反应速率变化等来判断反应机理。
在推测反应机理时,不管多复杂,最基本的就是通过反应速率表达式,去推测反应机理有多少次转化过程,每个级别的反应机理都有其独特的特征。
2 基本原理在反应机理的推测过程中,根据反应速率的表达式,通过比较反应的动力学机制,确定其反应机理的一般策略是尽可能地使用尽可能少的步骤,这就是经典的“最小步骤原理”。
如果使用较多的步骤,每步的反应速率都可忽略不计,反应速率方程中的比例系数可以视为反应物浓度之比,因而,不同反应物之间的限制即是推测反应机理最重要的线索。
另外,可以根据反应机理中存在的拦截剂情况,推断其反应机理,这也是用反应速率方程推测反应机理的经验规则之一。
3 反应机理推理方法反应机理推理方法是根据反应速率表达式,把反应中发生的变化转化为机理命题,根据给定的机理说明,用反应的物质的耦合方式来表达反应机理。
同时,根据反应机理中的拦截剂所提供的信息,判断反应物和生成物是否参与反应,能够多元醇化,是否会发生分歧反应,从而逐步引出反应物和生成物,建立一个相对完整的反应机理网络。
有时,通过测定反应物和生成物的初始浓度是否影响反应的动力学机制,这是用反应速率方程推测反应机理的经验规则之一。
4 总结因此,可以看出,用反应速率方程推测反应机理的经验规则,是由反应物和生成物的初始浓度,反应的速率常数,温度和催化剂的信息来推断反应机理的经验规则,通过比较反应动力学机制确定机理,根据反应中存在的拦截剂进行判断,以及测试反应物和生成物的初始浓度是否影响反应的动力学机制,通过以上方法推测反应的机理。
另外,通过反应的物质耦合和给定的机理说明,建立相对完整的反应机理网络,也是推断反应机理的重要方法。

由反应速率方程推测反应机理的经验规则反应机理的推断是一门科学,它主要研究的是反应的化学过程,和反应的速率。
它是理解反应的基础,有助于解释反应机理、推导反应方程式以及预测反应的结果。
反应机理的推断也可以通过研究反应的动力学及其速率来完成。
反应速率方程推测反应机理的经验规则是推断反应机理的有效方法之一。
直接从反应速率方程推测反应机理,即使在复杂反应中也是有效的。
反应速率方程是一个数学方程,它描述了反应速率与反应物浓度的关系。
它是由吉布斯和胡克在20世纪50年代的论文中提出的,是一种独特的方法,它将反应速率的变化分解为反应物浓度的有限变化。
此外,它还提出了一组经验规则,以根据反应速率和反应物浓度之间的关系,推测反应机理。
主要的经验规则有:如果反应速率与反应物浓度之间是二次函数,可以推测反应含有第一级反应;如果反应速率与反应物浓度之间是三次函数,则反应含有二级反应;如果反应速率与反应物浓度之间是四次函数,则可以推测反应含有三级反应等。
此外,还有几种情况需要特别注意:如果反应速率和反应物浓度之间是正比关系,则反应具有单步反应机理。
此外,如果反应速率和反应物浓度之间是反比关系,则可以推断出反应具有可逆性,可以利用玻尔兹曼方程来解释反应机理。
反应机理的推断,可以利用反应速率方程推测反应机理的经验规则来确定。
它的优点之一是可以简化反应机理的推断,可以减少需要考虑的参数。
例如,可以根据反应速率方程的形式来分析反应的动力学,从而推导出反应的方程式和反应机理。
此外,它还可以用于分析催化量子效应,从而提高反应速率、优化反应条件和预测反应结果。
总之,反应速率方程推测反应机理的经验规则是一种有效的反应机理推断方法,它可以有效简化反应机理的推断,提高反应的效率,减少反应的复杂性。
同时,此方法还可以提高分析催化量子效应的能力,以改善反应效率和反应结果。

由反应速率方程推测反应机理的经验规则反应机理的掌握是所有化学反应研究的基础和重要内容,它提供了反应发生的原理,关系到反应条件、反应路径和反应速率等问题,因此特别重要。
自20世纪50年代以来,反应机理研究已取得重大进展,形成了一套完善的理论体系,关于反应机理如何推测等问题也达成了多方面的共识。
目前,最常用的方法是根据反应速率方程来推测反应机理。
一般而言,反应速率方程是根据反应进行动力学推导出来的,可以定量地描述反应的速率变化。
它可以根据反应物的激活能、催化剂的作用以及表征反应物间作用力的参数而形成。
因此,反应速率方程可以反映反应机理中各反应阶段之间的相互作用,反应机理的推测也可以从反应速率方程出发。
由于反应机理的推测离不开反应速率方程,因此这里提出一些用于推测反应机理的经验规则。
首先,根据反应速率方程定律,可以推测出反应是否有激活能和催化剂的作用,也可以推测反应物之间的影响。
其次,反应速率方程可以表明反应的温度敏感性,从而可以推测是否存在活性中间体,以及不同活性中间体之间的活性相对性。
再次,反应速率方程可以通过绘制反应速率变化曲线,来识别反应机理中可能存在的反应途径。
最后,反应速率方程可以提供反应物间作用力参数的估算,可以帮助判断最后反应结果为否定反应或者偶联反应。
以上就是由反应速率方程推测反应机理的经验规则。
正确理解反应机理的重要性及反应速率方程的有效性,可以有效地推测反应机理,为反应机理的研究提供依据。
反应机理的研究还可以运用实验室技术,如质谱、NMR等,进行可靠的独立验证,以验证反应机理的准确性。
因此,要准确推测反应机理,就必须从多方面综合考虑,从反应速率方程出发,充分利用经验规则,结合实验室技术,以进行准确的反应机理推测。
综上所述,由反应速率方程推测反应机理的经验规则可以有效地推测反应机理,为反应机理的研究提供重要的信息支撑,但最终还是要结合实验室技术来验证推测出来的结果。

探究化学反应机理的实验方法化学反应机理是化学反应的核心,深入了解反应机理可以帮助我们更好地掌握反应过程,预测反应的结果和优化反应条件。
本文将探究化学反应机理的实验方法。
1. 理论分析在开始实验之前,我们需要先对反应机理进行理论分析。
理论分析可以帮助我们了解反应中可能发生的反应,产物的生成路径,反应物和产物之间的能量变化等重要信息。
化学反应的机理通常可以使用分子轨道理论、电子亲和性、活化能、反应动力学分析等方法进行研究。
其中,分子轨道理论通常用于描述分子结构,解释分子光学性质和电子结构;活化能指的是反应开始和自发反应之间的能量差异,是衡量化学反应进程的指标;反应动力学分析则可以帮助我们了解反应速率、反应参量的变化规律等信息。
2. 实验方法有多种实验方法可以用于探究化学反应机理。
下面我们将介绍几种常见的实验方法。
2.1 同位素标记实验同位素标记实验是一种常用的分子轨道理论实验方法。
此法将一个化合物中的标记同位素(如14C、3H等)替换成未标记同位素,然后检测反应产物中的标记同位素的情况。
这种方法可以使我们确定分子中的键和原子在反应中的命运。
例如,我们可以使用14C同位素标记一种酯化反应的反应物。
在反应过程中,14C将分到产物的哪些部位?产物的15N同位素标记结果如何?可以通过比较实验结果和理论上模拟的结果来寻找答案。
2.2 中间体诱导实验中间体诱导实验是一种常用的电子亲和性实验方法,它通过采用能够诱导生成反应中间体(过渡态)的化合物,来推断中间体的存在与否。
例如,可以通过使用DPPH(2,2-二苯基-1-苦基肼)或结构相似的自由基试剂作为铜离子的可溶性配体,在复杂的铜含溴混合物中诱导出Cu+Br-配体以研究铜汞合金的形成机制。
通过此法,我们可以确定中间体的生成,也可以进一步推测反应机理。
2.3 动力学探究实验动力学探究实验是通过测定反应体系在不同物质组合下的反应速率和反应过程的其他性质来研究化学反应机理的一种方法。

化学反应中的反应机理与反应途径化学反应中的反应机理与反应途径是化学反应过程中非常重要的概念。
反应机理是指化学反应发生的过程,包括反应物之间的相互作用、中间产物的形成与消失以及最终产物的生成。
反应途径则是指反应物转化为产物所经历的路径,包括反应步骤、活化能和反应速率等。
1.反应机理化学反应的机理通常包括以下几个步骤:•碰撞:反应物分子之间发生碰撞,是反应发生的前提。
•吸附:反应物分子与催化剂表面发生吸附,形成吸附层。
•活化和中间产物:吸附后的反应物分子在催化剂表面发生活化,形成中间产物。
•反应步骤:中间产物经过一系列的化学变化,转化为最终产物。
•解吸:最终产物从催化剂表面解吸,释放到溶液中。
2.反应途径反应途径是指反应物转化为产物所经历的路径。
反应途径包括以下几个方面:•直接途径:反应物直接转化为产物,不经过中间产物的过程。
•间接途径:反应物通过中间产物转化为产物,包括多步反应。
•催化途径:催化剂参与反应,降低反应活化能,加速反应速率。
•可逆途径:反应物和产物之间可以相互转化,存在正反两个方向的反应途径。
3.影响因素反应机理与反应途径受到多种因素的影响,主要包括:•反应物浓度:反应物浓度的增加会增加反应物之间的碰撞频率,从而加快反应速率。
•温度:温度的升高会增加反应物分子的平均动能,使反应物分子更容易发生碰撞并活化,从而加快反应速率。
•催化剂:催化剂可以提供新的反应路径,降低反应活化能,加速反应速率。
•压力:对于气态反应物,压力的增加会使反应物分子之间的碰撞频率增加,从而加快反应速率。
4.研究方法研究化学反应中的反应机理与反应途径通常采用以下几种方法:•实验方法:通过实验观察和测量反应速率、活化能等参数,推测反应机理和反应途径。
•理论计算:利用化学动力学和量子力学等理论计算方法,分析和预测反应机理与反应途径。
•催化剂表征:通过催化剂的表征技术,研究催化剂的活性、选择性和稳定性等性质,推断反应机理与反应途径。

化学反应的机理解析方法化学反应机理解析是研究化学反应中分子间相互作用、物质转化和化学键的形成与断裂等过程的科学方法。
它对理解化学反应的基本机理和控制化学反应具有重要意义。
本文将介绍化学反应机理解析的几种常用方法。
一、光谱方法光谱方法是研究化学反应机理解析的重要手段之一。
通过观察反应物和产物在不同波长的光线照射下的吸收、发射或散射等现象,可以推测反应过程中的物质转化和中间产物的形成。
常用的光谱方法包括红外光谱、紫外-可见光谱、核磁共振光谱等。
例如,在研究酸催化的酯化反应中,通过红外光谱可以观察到酯共振峰的强度随反应时间的变化,从而了解反应的进行和产物的生成。
二、动力学方法动力学方法是通过观察化学反应的速率随温度、浓度和压力等条件的变化规律,推断反应的机理。
其中,常用的动力学方法包括速率常数测定、活化能计算、反应机理建模等。
例如,利用Arrhenius方程可以根据不同温度下反应速率常数的变化,计算反应的活化能,从而推测反应过程中可能存在的中间态和反应路径。
三、计算化学方法计算化学方法是利用计算机模拟和量子化学理论等手段,探究分子的结构、能量和反应过程,以预测反应机理。
通过分子力学、分子动力学模拟、密度泛函理论等方法,可以计算出反应物和产物之间的结合能、反应势垒、电子云分布等物理化学性质,从而揭示反应的机理。
例如,利用分子动力学模拟可以模拟分子在不同温度下的运动轨迹,推断分子的热力学和动力学行为。
四、同位素示踪法同位素示踪法是一种基于同位素标记的方法,通过观察同位素标记的反应物与产物之间的同位素分布变化,揭示化学反应的机理。
同位素示踪法广泛应用于有机合成、生物分子的代谢途径研究等领域。
例如,利用氘代试剂标记反应物,通过同位素示踪技术可以追踪反应物中的原子在反应过程中的转移和转化情况,对反应中的中间产物和反应路径进行解析。
综上所述,化学反应的机理解析方法包括光谱方法、动力学方法、计算化学方法和同位素示踪法等。

化学反应的反应路径研究方法化学反应的反应路径研究方法对于揭示反应过程、理解反应机理以及指导合成新化合物具有重要意义。
本文将介绍几种常用的化学反应反应路径研究方法。
一、光谱学方法光谱学方法是化学反应研究中常用的一种方法,包括红外光谱、紫外光谱、核磁共振等。
1. 红外光谱法:红外光谱法可以观察反应前后样品的分子振动情况,从而得到反应的信息。
通过红外光谱的峰位和峰型的变化,可以判断化学键的形成与破裂,进而推测反应机理。
2. 紫外光谱法:紫外光谱法可以通过观察反应物和产物的吸光度变化来研究反应的路径。
随着反应的进行,部分物质可能会发生共轭体系的变化,导致吸光度的增加或减小。
3. 核磁共振法:核磁共振法可以通过观察特定核的共振信号来研究反应路径。
通过核磁共振谱图的变化,可以判断化学键的形成与破裂,以及反应物与产物之间的关系。
二、动力学方法动力学方法用于研究反应速率与反应物浓度、温度等因素之间的关系,从而推测反应的反应路径。
1. 热动力学法:热动力学法通过测定反应速率随温度变化的关系,可以得到反应的活化能、反应级数等信息。
根据活化能的大小,可以推测反应中的限速步骤,进而揭示反应的反应路径。
2. 催化剂研究法:催化剂研究法通过引入催化剂来提高反应速率,从而研究反应的反应路径。
通过比较在有催化剂和无催化剂条件下的反应速率和产物选择性,可以判断催化剂对反应路径的影响。
三、计算化学方法计算化学方法通过计算分子结构、能量以及反应活化能等参数,来预测反应的反应路径。
1. 密度泛函理论:密度泛函理论是计算化学中常用的一种方法,可以用于预测反应物和产物的结构、能量等。
通过比较反应物和产物之间的能量差异,可以推测反应的反应路径和机理。
2. 分子动力学模拟:分子动力学模拟是一种基于物理力学原理的计算方法,可以模拟反应物分子在一定温度下的运动轨迹。
通过观察反应物分子的运动和相互作用,可以推测反应的反应路径和机理。
以上所述的方法仅是化学反应反应路径研究中的几种常用方法,科学家们还在不断探索新的方法和技术来更好地理解反应过程。

化学反应的平衡常数与反应机理在化学的世界里,化学反应的平衡常数和反应机理是两个至关重要的概念。
它们就像是化学反应的密码,揭示了反应进行的程度和方式。
让我们一起来揭开它们神秘的面纱,探索其中的奥秘。
首先,咱们来聊聊什么是化学反应的平衡常数。
想象一下,在一个封闭的容器里,有一个化学反应正在进行,反应物不断转化为生成物,生成物也会逆向转化为反应物。
经过一段时间后,反应达到了一种动态平衡,也就是反应物和生成物的浓度不再发生明显的变化。
而这个平衡状态下,反应物和生成物浓度之间存在着一个特定的数学关系,这个关系就是平衡常数。
平衡常数的表达式是用生成物浓度的幂次方乘积除以反应物浓度的幂次方乘积。
这里的幂次方是根据化学反应方程式中各物质的化学计量系数来确定的。
平衡常数的大小反映了反应进行的程度。
如果平衡常数很大,那就意味着反应倾向于生成大量的生成物,反应进行得比较彻底;如果平衡常数很小,那说明反应很难进行到很大程度,反应物大部分还是保持原来的状态。
比如说,对于一个简单的反应 A + B ⇌ C + D,其平衡常数 K 的表达式就是 C×D /(A×B) ,其中 A、B、C、D 分别代表它们各自在平衡时的浓度。
接下来,咱们再深入了解一下反应机理。
反应机理说的是化学反应到底是怎么一步一步发生的。
它描述了反应过程中的每一个微观步骤,包括原子、分子之间的碰撞、结合、分解等等。
很多化学反应看起来很简单,但实际上是由一系列复杂的小步骤组成的。
这些小步骤被称为基元反应。
比如,氢气和氧气反应生成水,这个看起来简单的反应,其实包含了多个基元反应。
了解反应机理对于理解化学反应的本质非常重要。
通过研究反应机理,我们可以知道反应的速率是由哪些步骤决定的,从而找到控制反应速率的关键。
那么,平衡常数和反应机理之间又有什么关系呢?其实,平衡常数可以帮助我们推断反应机理的可能性。
如果我们知道了一个反应的平衡常数很大,那么可以推测反应的机理中可能存在一些容易进行的步骤,使得生成物能够大量生成。

化学反应中的反应机理和中间体的定性和定量分析化学反应是许多化学过程中不可或缺的重要环节。
要深入理解化学反应的过程和机制,我们需要对反应机理和中间体进行定性和定量的分析。
本文将介绍化学反应的反应机理和中间体的定性和定量分析的方法和原理。
一、反应机理的定性分析反应机理是表示化学反应中各个步骤的详细过程和反应路径。
定性分析反应机理的关键是确定反应的速率决定步骤(rate-determining step)和中间体(intermediate)。
以下是几种常见的定性分析方法:1. 反应速率法反应速率法是通过实验测定不同反应物浓度随时间的变化来确定反应级数和速率常数。
通过观察速率随浓度的变化趋势,可以初步推测反应的机理。
2. 反应活性法反应活性法是根据不同反应物活性的变化来推断反应机理。
通过引入具有不同活性的试剂,观察反应速率的变化,可以判定反应的机理类型,如酸碱催化、自由基等。
3. 产物分析法产物分析法是通过检测反应结束后所生成的产物种类和数量来推断反应机理。
分析反应产物的物理性质、结构和组成,可以推测出中间体的存在和反应路径。
二、中间体的定性分析中间体是反应中暂时生成且随即消失的化合物,是反应机理的重要组成部分。
中间体的研究对深入理解反应机理具有重要意义。
以下是几种常见的中间体的定性分析方法:1. 跟踪标记法跟踪标记法是通过标记参与反应的分子中的特定原子或基团,以追踪它们在反应中的位置和命运。
利用同位素标记、辅助试剂标记等方法,可以鉴定中间体的形成和消失过程。
2. 过渡态理论过渡态是指在反应进行过程中,反应物和产物之间的高能级中间状态。
过渡态理论通过研究反应过渡态的结构和性质,可以推断反应的机理。
3. 反应动力学法反应动力学法是通过测定反应的速率随温度、浓度、压力等条件的变化,推测中间体的存在。
利用反应温度和浓度对反应速率的影响,可以初步判断中间体的生成和消失。
三、中间体的定量分析中间体的定量分析是对反应机理中所涉及的中间体数量、浓度变化等进行定量研究的方法。
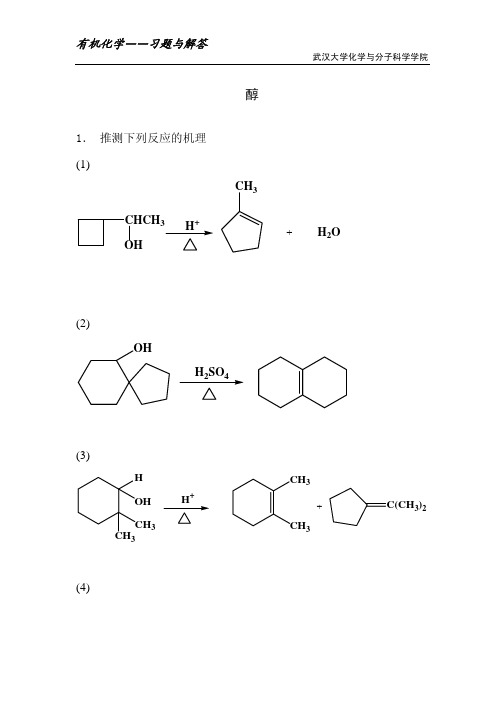
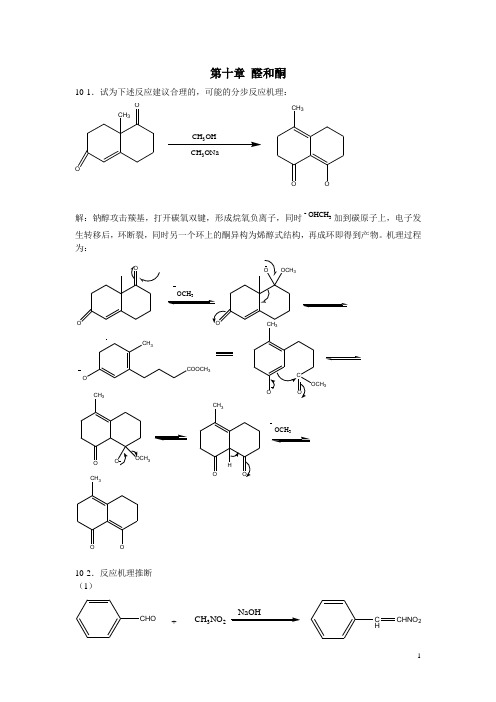
推测反应机理
第一类:羰基化合物:酸催化引起的重排历程
例1
O
+
O
O
+
OH
OH
+
O
例2
C O CPh 3
C
C OH Ph
Ph Ph
例3
O
+
OH
例4 O
稀硫酸
例4历程:
O
+
- H +
HO
例5
O
OH +
OH OH
例5历程:
+
OH
OH
OH
O
OH
OH
- H +
OH
OH
第二类:烯类化合物:亲电加成、亲电取代、氧化反
应的联合应用
例6
C=CH 2
H +
C 6H 5
CH 3
例6历程
+C6H5
C6H5
+
CH3
CH3
C6H5C6H5例7
H2SO4
CH3
CH3
CH(CH3)2
(CH3)3COH
+
例7历程
H3C C(CH3)2
3
3
-H+
H3C32
CH3
H2SO4
(CH3)3OH C
CH3
CH3
H3C-H+
C
CH3
CH2
H3C
H3C
CH3
CH3
C
CH3
CH3
3
例8
C
Ph
Ph
3
2. H
O
Ph
Ph
例8机理
C Ph Ph
PhCOOOH C
Ph Ph
O +Ph Ph
OH
Ph Ph
OH
Ph Ph
+
O
Ph Ph
例
9 KMnO 4 / OH
-+
O
例9历程:
KMnO 4/OH -
- H +
O
H
+
H 2O
HO
HO
第三类 酮、酯等碱催化引起的缩合、逆缩合、加成
-消去反应 例 10
O
O
25
O
COCH 3
O
O
NaOC 2H 5
-
O
CH 2-O
HOC H O
CH 3O
例 11
O C O
CH 3C CH 32O
OH
O
O
例 12
O H 3C O
OH -
OH
O
例12机理:
C
O H 3C O
-H -
例
13
O
CO 2Et CH 2CO 2H
CH 2CO 2Et CH 2CO 2Et
1. t_BuOK
2.H 3O
例
13
HC
C
O-OEt
CH 2CO 2Et
O-OEt EtO 2CCH 2
O
22CO 2Et CH 2CO 2H
CH 2CO 2Et CH 2CO 2Et -OH
EtO 2CCH 2
O
OH
1) H+
例14
O
O
C2H5ONa 例14机理
2
H5
O O
C
C2
例15
Br
O Br
CO2Et
EtONa
例15机理
O
Br
Br-
OR
OR
C
C
O
COOR
H
第四类醇、醚质子化引起的重排、共振等过程例16
CH 3C OCH 3
CH 3
CH 2OBs
H 2O
CH 3CH CH 3
CHO
例16机理
H 3C C CH 3
S
H 2O 邻基参与
CH 2
O C
H 3C
H 3C
CH 3C O C H 3CH 3
H 3C
H H
C O CH H 3C
CH 3
H 3C
H
H 3C
CH H 33
H O
H 3C
CH H 3C
CH=O
例17
Ph C Ph
OH
C CH H 2SO 4
Ph
C Ph
CH CHO
例17机理
Ph
C Ph
OH
C CH H SO -H 2O
Ph
C CH
H 2O
Ph Ph
Ph
C CH OH Ph
Ph
CH CHO
例18
O O
+ Br 2
O O
Br
O O
H
+
O
OH
O OH O OH
O OH O OH Br
- H +
O O
Br
- H +
++
+。