(人教版)化学选修四思维导图:2-3化学平衡(含答案)
- 格式:doc
- 大小:1.65 MB
- 文档页数:6


第二章化学反应速率和化学平衡第三节化学平衡【思维导图】【微试题】1.[2018·全国卷] 合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )A.增加压强B.降低温度 C.增大CO的浓度 D.更换催化剂【答案】B2.向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。
由图可得出的正确结论是()A.反应在c点达到平衡状态B.反应物浓度:a点小于b点C.反应物的总能量低于生成物的总能量D.△t1=△t2时,SO2的转化率:a~b段小于b~c段【答案】D3.(2018·安徽卷)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)2CO2(g)+S(l) ΔH<0若反应在恒容的密闭容器中进行,下列有关说法正确的是( )[:A.平衡前,随着反应的进行,容器内压强始终不变B.平衡时,其他条件不变,分离出硫,正反应速率加快C.平衡时,其他条件不变,升高温度可提高SO2的转化率D.其他条件不变,使用不同催化剂,该反应的平衡常数不变【答案】D4.(2018山东理综)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1∆H < 0 (I)2NO(g)+Cl2(g)2ClNO(g) K2∆H < 0 (II)(1)4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入 NO和 Cl2,10min时反应(II)达到平衡。


第2课时 影响化学平衡移动的因素1.明确化学平衡移动的概念,会根据反应速率变化判断化学平衡的移动方向。
2.理解外界条件(浓度、温度、压强等)对化学平衡的影响。
3.了解催化剂在生活、生产和科学领域中的重要作用。
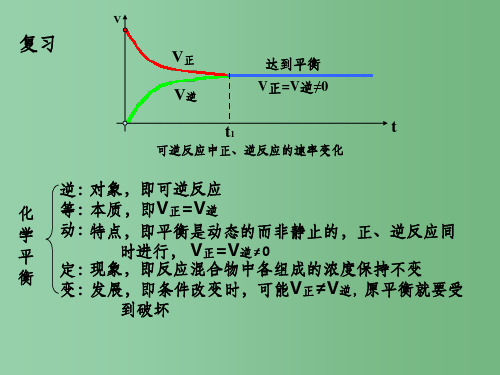
化学平衡的移动 浓度、压强对化学平衡的影响一、化学平衡的移动 1.定义在一定条件下,可逆反应达到化学平衡状态,如果改变影响平衡的条件(如浓度、温度、气体反应的压强等),化学平衡状态被破坏,直至正、逆反应速率再次相等,在新的条件下达到新的化学平衡状态。
这种现象叫做平衡状态的移动,简称平衡移动。
2.图示表示v (正)>v (逆)――→正向反应一定时间v (正)=v (逆)――→改变条件v (正)≠v (逆)――→一定时间v ′(正)=v ′(逆)二、浓度对化学平衡的影响 1.实验探究探究1 依据K 2Cr 2O 7溶液中存在的平衡:Cr 2O 2-7(橙色)+H 2O 2CrO 2-4(黄色)+2H +,完成实验。
3对可逆反应Fe 3++3SCN-Fe(SCN)3,分别增大c (Fe 3+)和c (SCN -)后,Fe(SCN)3的浓度均增大,即化学平衡均向正反应方向移动; 滴加NaOH 溶液,由于3OH -+Fe 3+===Fe(OH)3↓,减小了Fe 3+的浓度,Fe(SCN)3的浓度也减小了,即化学平衡向逆反应方向移动(1)其他条件不变时,增大反应物浓度或减小生成物浓度,平衡向正反应方向移动。
(2)其他条件不变时,增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动。
三、压强对化学平衡(有气体参与的反应)的影响 1.2.对于反应前后气体分子数不变的反应[如H 2(g)+I 2(g)2HI(g)],改变压强,化学平衡不发生移动。
1.判断正误(正确的打“√”,错误的打“×”)。
(1)平衡移动的原因是v (正)≠v (逆)。
( )(2)若外界条件改变引起平衡中v (正)>v (逆),则平衡正向移动。




第三节 化学平衡第1课时 可逆反应与化学平衡状态1.了解化学反应的可逆性,了解可逆反应的概念。
2.通过化学平衡状态的建立过程,知道化学平衡是一种动态平衡。
3.能根据化学平衡状态的特征,判断化学平衡状态的标志。
可逆反应与不可逆反应1.可逆反应(1)概念:在相同条件下,既能向正反应方向进行同时又能向逆反应方向进行的化学反应。
(2)表示方法:采用“”连接,把从左向右进行的反应称作正反应,把从右向左进行的反应称作逆反应。
例如:SO 2和O 2的反应可表示为2SO 2+O 2催化剂△2SO 3。
2.不可逆反应有些反应的逆反应进行程度太小因而可忽略,把这类反应称作不可逆反应,用“===”连接。
例如:Ba 2++SO 2-4===BaSO 4↓。
1.判断正误(正确的打“√”,错误的打“×”)。
(1)酯化反应属于可逆反应。
( )(2)NH 3和HCl 生成NH 4Cl 与NH 4Cl 分解生成NH 3和HCl 互为可逆反应。
( )(3)可逆反应中反应物的转化率能达到100%。
( )答案:(1)√ (2)× (3)×2.下列各组两个反应互为可逆反应的是( )①H 2+Cl 2=====点燃2HCl 与2HCl=====电解H 2↑+Cl 2↑②H 2SO 4(浓)+2HBr===2H 2O +Br 2+SO 2↑与Br 2+SO 2+2H 2O===2HBr +H 2SO 4③2NO 2===N 2O 4与N 2O 4===2NO 2④2SO 2+O 2=====催化剂△2SO 3与2SO 3=====催化剂△2SO 2+O 2 A .①②B .②③C .③④D .②④ 解析:选C 。
可逆反应必须是在相同条件下同时向正、逆两个方向都能进行的反应,③④互为可逆反应。
可逆反应的特征(1)双向性:可逆反应分为方向相反的两个反应:正反应和逆反应。
(2)双同性:正、逆反应在相同条件下是同时进行的。

第二章化学反应速率和化学平衡第三节化学平衡【思维导图】【微试题】1.[2018·全国卷] 合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )A.增加压强B.降低温度 C.增大CO的浓度 D.更换催化剂【答案】B2.向绝热恒容密闭容器中通入SO 2和NO2,在一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。
由图可得出的正确结论是()A.反应在c点达到平衡状态B.反应物浓度:a点小于b点C.反应物的总能量低于生成物的总能量D.△t1=△t2时,SO2的转化率:a~b段小于b~c段【答案】D3.(2018·安徽卷)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)2CO2(g)+S(l) ΔH<0若反应在恒容的密闭容器中进行,下列有关说法正确的是( )[:A.平衡前,随着反应的进行,容器内压强始终不变B.平衡时,其他条件不变,分离出硫,正反应速率加快C.平衡时,其他条件不变,升高温度可提高SO2的转化率D.其他条件不变,使用不同催化剂,该反应的平衡常数不变【答案】D4.(2018山东理综)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:2NO2(g)+NaCl(s )NaNO3(s)+ClNO(g) K1 ?H < 0 (I)2NO(g)+Cl2(g )2ClNO(g) K2 ?H < 0 (II)(1)4NO2(g)+2NaCl(s )2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入 NO和 Cl2,10min时反应(II)达到平衡。

第二章化学反应速率和化学平衡第三节化学平衡【思维导图】【微试题】1.[2012·全国卷] 合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)CO2(g)+H2(g)ΔH<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是()A.增加压强B.降低温度C.增大CO的浓度D.更换催化剂【答案】B2.向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。
由图可得出的正确结论是()A.反应在c点达到平衡状态B.反应物浓度:a点小于b点C.反应物的总能量低于生成物的总能量D.△t1=△t2时,SO2的转化率:a~b段小于b~c段【答案】D3.(2012·安徽卷)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)2CO2(g)+S(l)ΔH<0若反应在恒容的密闭容器中进行,下列有关说法正确的是()A.平衡前,随着反应的进行,容器内压强始终不变B.平衡时,其他条件不变,分离出硫,正反应速率加快C.平衡时,其他条件不变,升高温度可提高SO2的转化率D.其他条件不变,使用不同催化剂,该反应的平衡常数不变【答案】D4.(2014山东理综)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)K1∆H < 0 (I)2NO(g)+Cl2(g )2ClNO(g)K2∆H < 0 (II)(1)4NO2(g)+2NaCl(s )2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。



(人教版)化学选修四思维导图:2-3化学平衡(含答案)
work Information Technology Company.2020YEAR
第二章化学反应速率和化学平衡
第三节化学平衡
【思维导图】
【微试题】
2
1.[2018·全国卷] 合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0
反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
A.增加压强B.降低温度 C.增大CO的浓度 D.更换催化剂
【答案】
B
2.向绝热恒容密闭容器中通入SO
2和NO
2
,在一定条件下使反应SO
2
(g)+NO
2
(g)SO
3
(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如
下所示。
由图可得出的正确结论是()
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
3
C.反应物的总能量低于生成物的总能量
D.△t
1=△t
2
时,SO
2
的转化率:a~b段小于b~c段
【答案】
D
3.(2018·安徽卷)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)2CO2(g)+S(l) ΔH<0
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )[:
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应的平衡常数不变
【答案】D
4
5
4.(2018山东理综)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应: 2NO 2(g )+NaCl (s )NaNO 3(s )+ClNO (g ) K 1 ∆H < 0 (I ) 2NO (g )+Cl 2(g )2ClNO (g ) K 2 ∆H < 0 (II )
(1)4NO 2(g )+2NaCl (s )
2NaNO 3(s )+2NO (g )+Cl 2(g )的平衡常数K= (用K 1、K 2表示)。
(2)为研究不同条件对反应(II )的影响,在恒温条件下,向2L 恒容密闭容器中加入0.2mol NO 和0.1mol Cl 2,10min 时反应(II )达到平
衡。
测得10min 内v (ClNO )=7.5×10-3mol•L -1•min -1,则平衡后n (Cl 2)= mol ,NO 的转化率а1= 。
其它条件保持不变,反应(II )在恒压条件下进行,平衡时NO 的转化率а2 а1(填“>”“<”或“=”),平衡常数K 2 (填“增大”“减小”或“不变”。
若要使K 2减小,可采用的措施是 。
【答案】(1)
2
1
2
K
K
(2)2.5×10-2;75%;>;不变;升高温度
【解析】(1)方程式(I)×2-(II)即可得到:4NO
2(g)+2NaCl(s)2NaNO
3
(s)+2NO(g)+Cl
2
(g),所以平衡常数K=
2
1
2
K
K
;
(2)ClNO的浓度变化△c(ClNO)=7.5×10-2mol•L,所以ClNO的物质的量变化△n(ClNO)=0.15mol,所以Cl
2
的物质的量变化率△n
(Cl2)=0.075mol,则平衡后n(Cl2)=0.1mol-0.075mol=0.025mol;转化的n(NO)=0.15mol,则NO的转化率а1=0.15mol
100%
0.2mol
⨯=75%;其他
条件保持不变,反应(II)在恒压条件下进行,则反应(II)的压强大于反应(I)的压强,则平衡有利于向正方向移动,所以平衡时NO的转化率а2>а1;因为温度不变,所以化学平衡常数不变;因为反应(II)的∆H < 0,为放热反应,所以要减小化学平衡常数,就要使平衡向逆方向移动,可以采取加热的方法;
6。