高考化学总复习资料
- 格式:pdf
- 大小:5.75 KB
- 文档页数:3
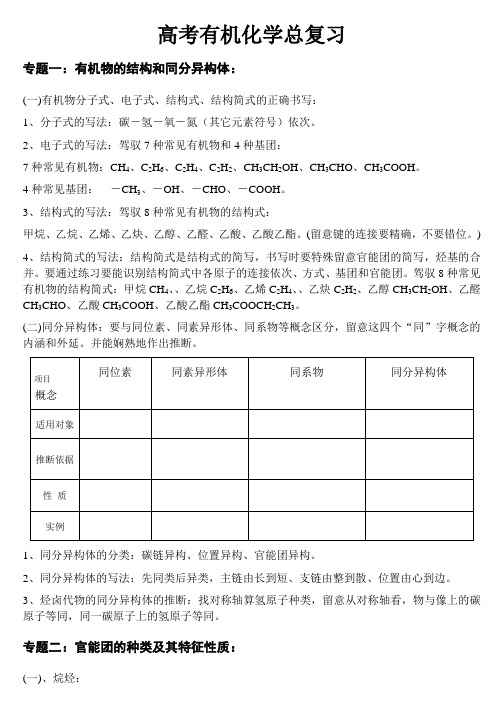
高考有机化学总复习专题一:有机物的结构和同分异构体:(一)有机物分子式、电子式、结构式、结构简式的正确书写:1、分子式的写法:碳-氢-氧-氮(其它元素符号)依次。
2、电子式的写法:驾驭7种常见有机物和4种基团:7种常见有机物:CH4、C2H6、C2H4、C2H2、CH3CH2OH、CH3CHO、CH3COOH。
4种常见基团:-CH3、-OH、-CHO、-COOH。
3、结构式的写法:驾驭8种常见有机物的结构式:甲烷、乙烷、乙烯、乙炔、乙醇、乙醛、乙酸、乙酸乙酯。
(留意键的连接要精确,不要错位。
)4、结构简式的写法:结构简式是结构式的简写,书写时要特殊留意官能团的简写,烃基的合并。
要通过练习要能识别结构简式中各原子的连接依次、方式、基团和官能团。
驾驭8种常见有机物的结构简式:甲烷CH4、、乙烷C2H6、乙烯C2H4、、乙炔C2H2、乙醇CH3CH2OH、乙醛CH3CHO、乙酸CH3COOH、乙酸乙酯CH3COOCH2CH3。
(二)同分异构体:要与同位素、同素异形体、同系物等概念区分,留意这四个“同”字概念的内涵和外延。
并能娴熟地作出推断。
1、同分异构体的分类:碳链异构、位置异构、官能团异构。
2、同分异构体的写法:先同类后异类,主链由长到短、支链由整到散、位置由心到边。
3、烃卤代物的同分异构体的推断:找对称轴算氢原子种类,留意从对称轴看,物与像上的碳原子等同,同一碳原子上的氢原子等同。
专题二:官能团的种类及其特征性质:(一)、烷烃:(1)通式:C n H2n+2,代表物CH4。
(2)主要性质:①、光照条件下跟卤素单质发生取代反应。
②、在空气中燃烧。
③、隔绝空气时高温分解。
(二)、烯烃:(1)通式:C n H2n(n≥2),代表物CH2=CH2,官能团:-C=C-(2)主要化学性质:①、跟卤素、氢气、卤化氢、水发生加成反应。
②、在空气中燃烧且能被酸性高锰酸钾溶液氧化。
③、加聚反应。
(三)、炔烃:(1)通式:C n H2n-2(n≥2),代表物CH≡CH,官能团-C≡C-(2)主要化学性质:①、跟卤素、氢气、卤化氢、水发生加成反应。
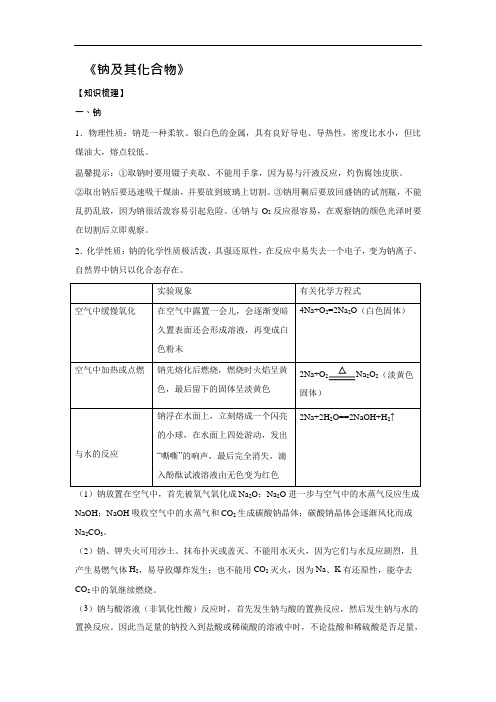
《钠及其化合物》【知识梳理】一、钠1.物理性质:钠是一种柔软、银白色的金属,具有良好导电、导热性,密度比水小,但比煤油大,熔点较低。
温馨提示:①取钠时要用镊子夹取、不能用手拿,因为易与汗液反应,灼伤腐蚀皮肤。
②取出钠后要迅速吸干煤油,并要放到玻璃上切割。
③钠用剩后要放回盛钠的试剂瓶,不能乱扔乱放,因为钠很活泼容易引起危险。
④钠与O2反应很容易,在观察钠的颜色光泽时要在切割后立即观察。
2.化学性质:钠的化学性质极活泼,具强还原性,在反应中易失去一个电子,变为钠离子。
自然界中钠只以化合态存在。
2Na+O2Na2O2(淡黄色固体)(1)钠放置在空气中,首先被氧气氧化成Na2O;Na2O 进一步与空气中的水蒸气反应生成NaOH;NaOH 吸收空气中的水蒸气和CO2 生成碳酸钠晶体;碳酸钠晶体会逐渐风化而成Na2CO3。
(2)钠、钾失火可用沙土、抹布扑灭或盖灭。
不能用水灭火,因为它们与水反应剧烈,且产生易燃气体H2,易导致爆炸发生;也不能用CO2灭火,因为Na、K 有还原性,能夺去CO2 中的氧继续燃烧。
(3)钠与酸溶液(非氧化性酸)反应时,首先发生钠与酸的置换反应,然后发生钠与水的置换反应。
因此当足量的钠投入到盐酸或稀硫酸的溶液中时,不论盐酸和稀硫酸是否足量,金属钠均能完全反应,产生氢气的多少由金属钠决定。
(4)钠与盐溶液反应时,首先发生钠与水的反应,生成NaOH 和H2;然后发生NaOH 溶液与盐溶液的反应。
如钠与硫酸铜溶液的反应,现象为:钠浮在水面上,迅速地熔化为小球,在水面上四处游动,并发出嘶嘶响声,同时溶液中生成蓝色沉淀。
反应过程为:2Na+2H2O =2NaOH+H2↑、CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;总反应为:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑。
3.保存:钠很容易跟空气中的氧气和水起反应,因此在实验室中,通常将钠保存在煤油里,由于ρ(Na)>ρ(煤油),钠沉在煤油下面,将钠与氧气和水隔绝。



素养说明:化学核心素养要求考生能从物质结构与性质,物质性质与应用的关系,分析物质性质,合理利用物质。
H 2O 2与O 3作为绿色氧化剂和消毒剂,在日常生活中发挥着巨大的作用。
1.氧气的同素异形体臭氧(O 3)(1)化学性质①不稳定性:2O 3=====一定条件3O 2②强氧化性:Ag 、Hg 等金属在臭氧中可以被氧化,O 3能使湿润的淀粉-KI 试纸变蓝,其反应的化学方程式如下:O 3+2KI +H 2O===I 2+2KOH +O 2③漂白和消毒:许多染料受到臭氧的强烈氧化会褪色,臭氧还能杀死许多细菌。
(2)生产方式:3O 2=====放电2O 3(3)臭氧层:能吸收来自太阳的大部分紫外线,是人类和其他生物的保护伞。
氟氯烃是破坏臭氧层的“元凶”。
(4)臭氧的用途:脱色剂、消毒剂等。
2.过氧化物(1)过氧化氢①结构化学式:H 2O 2电子式:结构式:H —O —O —H ,H 、O 原子个数比为1∶1,H 2O 2是既含极性键,又含非极性键的共价化合物。
②化学性质Ⅰ.不稳定性:2H 2O 2=====MnO 22H 2O +O 2↑。
Ⅱ.还原性:遇强氧化剂时,显还原性,如:2KMnO4+5H2O2+3H2SO4===K2SO4+2MnSO4+5O2↑+8H2O。
Ⅲ.氧化性:遇较强还原剂时,显氧化性,如H2O2+2HI===I2+2H2O。
(2)金属过氧化物①金属过氧化物都是强氧化剂,过氧化钠、过氧化钾可以和水反应,生成相应的氢氧化物和氧气,另外还存在带结晶水的金属过氧化物。
如:过氧化钡、过氧化钙。
②过氧化物和稀酸反应生成过氧化氢。
BaO2+H2SO4===H2O2+BaSO4。
过氧化钠与空气中的二氧化碳作用放出氧气:2Na2O2+2CO2===2Na2CO3+O2。
[题型专练]1.(2019·郑州一中高三月考)臭氧(O3)可应用于游泳池、生活用水、污水的杀菌和消毒,大气中的臭氧层能有效阻挡紫外线。

高考化学学科常考复习考点资料整理高中化学知识点一、物质结构理论1.用原子半径、元素化合价周期性变化比较不同元素原子或离子半径大小2.用同周期、同主族元素金属性和非金属性递变规律判断具体物质的酸碱性强弱或气态氢化物的稳定性或对应离子的氧化性和还原性的强弱。
3.运用周期表中元素“位--构--性”间的关系推导元素。
4.应用元素周期律、两性氧化物、两性氢氧化物进行相关计算或综合运用,对元素推断的框图题要给予足够的重视。
5.晶体结构理论⑴晶体的空间结构:对代表物质的晶体结构要仔细分析、理解。
在高中阶段所涉及的晶体结构就源于课本的就几种,高考在出题时,以此为蓝本,考查与这些晶体结构相似的没有学过的其它晶体的结构。
⑴晶体结构对其性质的影响:物质的熔、沸点高低规律比较。
⑴晶体类型的判断及晶胞计算。
二、化学反应速率和化学平衡理论化学反应速率和化学平衡是中学化学重要基本理论,也是化工生产技术的重要理论基础,是高考的热点和难点。
考查主要集中在:掌握反应速率的表示方法和计算,理解外界条件(浓度、压强、温度、催化剂等)对反应速率的影响。
考点主要集中在同一反应用不同物质表示的速率关系,外界条件对反应速率的影响等。
化学平衡的标志和建立途径,外界条件对化学平衡的影响。
运用平衡移动原理判断平衡移动方向,及各物质的物理量的变化与物态的关系,等效平衡等。
1.可逆反应达到化学平衡状态的标志及化学平衡的移动主要包括:可逆反应达到平衡时的特征,条件改变时平衡移动知识以及移动过程中某些物理量的变化情况,勒夏特列原理的应用。
三、电解质理论电解质理论重点考查弱电解质电离平衡的建立,电离方程式的书写,外界条件对电离平衡的影响,酸碱中和反应中有关弱电解质参与的计算和酸碱中和滴定实验原理,水的离子积常数及溶液中水电离的氢离子浓度的有关计算和pH的计算,溶液酸碱性的判断,不同电解质溶液中水的电离程度大小的比较,盐类的水解原理及应用,离子共存、离子浓度大小比较,电解质理论与生物学科之间的渗透等。


高三化学知识点资料书推荐在高三化学学习过程中,理解和记忆化学知识点是非常重要的。
为了帮助同学们更好地学习化学,本文将推荐几本高质量的化学知识点资料书。
一、《高考化学知识点大全》《高考化学知识点大全》是一本以高中化学知识为基础,涵盖了高考化学全部知识点的资料书。
该书以模块化的方式编排,将各个知识点进行了系统的整合,便于同学们查阅和复习。
每个知识点都有详细的解析,并配有例题和习题,帮助同学们更好地掌握知识和应用。
该书还提供了高考历年真题的解析,帮助同学们了解考点和考题类型,为备考高考化学提供有力支持。
此外,书中还有一些重要知识点的思维导图,能够帮助同学们更好地理清知识结构和思路。
二、《高中化学考点速记手册》《高中化学考点速记手册》是一本简明扼要地总结了高中化学知识点的资料书。
该手册以轻松易懂的语言,对每个知识点进行了简要介绍,并列举了其中的关键内容和要点。
通过浓缩知识点,该手册帮助同学们快速理解和记忆化学知识。
该手册还提供了一些实例和常见问题的解答,帮助同学们理解知识点的应用和思考方式。
同时,该手册还附带了一些练习题,供同学们巩固所学的知识。
三、《高中化学复习指导书》《高中化学复习指导书》是一本对高中化学知识进行全面系统总结的资料书。
该书以章节的形式,详细介绍了各个知识点的定义、性质、实验和应用等内容。
每章结尾还附有一些高考类型的练习题,帮助同学们复习和巩固知识。
该书还附带了一些实验操作步骤和注意事项,对于实验课的学习和备考也非常有帮助。
此外,该书还提供了一些学习方法和技巧,并介绍了一些考试技巧和答题技巧。
四、《高考化学必备知识点》《高考化学必备知识点》是一本针对高考化学的重点知识进行提炼和总结的资料书。
该书以图文并茂的方式,对每个知识点进行了详细的解释,并辅以实例和图表,帮助同学们更好地理解。
同时,该书还提供了一些典型例题和高考真题,帮助同学们进行针对性复习。
此外,该书还附带了一些复习要点和记忆口诀,帮助同学们迅速回忆和记忆知识点。



证对市爱幕阳光实验学校化学根本概念复习三――常用的化学计量[知识归纳]物质的量贯穿于整个高中化学的始终,是化学计算中处于核心地位的重要概念。
它是掌握物质的质量、体积(状况下)、物质的量浓度、反热、化学方程式计算的前提,是高考的必考点之一。
要掌握这一考点,除抓概念的内涵与外,还要及时总结小规律。
一、以物质的量为中心的相互关系二、阿伏加德罗律及推论1.律:同温同压下,相同体积的任何气体都含有相同数目的分子。
2.推论:(1)同温同压下,气体的体积之比于气体的物质的量之比,即V1:V2=n1:n2。
(2)同温同压下,两种不同气体的密度之比于气体的摩尔质量之比,即ρ1:ρ2=M1:M2。
(3)同温同压下,同体积的任何气体其质量之比于气体的摩尔质量之比,即m1:m2=M1:M2。
(4)同温同压下,同质量任何气体的体积之比于其摩尔质量倒数之比,即V1:V2=M2:M1。
(5)同温同体积下,气体的压强之比于气体的物质的量之比:P1:P2==n1:n2。
三、物质的量与气体平均相对分子质量之间的计算1.(m总为气体总质量,n总为气体总物质的量) (此公式也适合非气态物质)2.混合气体的体积分数或摩尔分数求平均相对分子质量。
其中M A、M B、……,为组分气体的相对分子质量;a%、b%、……,为组分气体对的体积分数或摩尔分数。
3.其中ρ为气体在状况下的密度。
4.其中D相对为混合气体对某已经气体的相对密度,M为气体的相对分子质量。
四、物质的量浓度及有关计算原理1.关于物质的量浓度概念的计算主要包括:(1)溶质的质量、溶液的体积和物质的量浓度之间的计算。
可运用公式:n =m/M,c=n/V ,所以。
(2)气体溶质的体积(状况下)、溶剂的体积和溶液的密度,计算溶液中溶质的物质的量浓度。
先运用n=V/2L·mol—1,求出溶质的物质的量;再运用V〔溶液〕=m/ρ求出溶液的体积,其中m为气体和水的质量和,即溶液的质量,ρ为溶液的密度,V〔溶液〕的单位为L;最后用物质的量浓度公式计算。

高中化学高考总复习---酸碱中和滴定知识讲解及巩固练习题(含答案解析)【考纲要求】1.初步掌握中和滴定的原理、了解实验仪器的使用方法、滴定实验的操作步骤。
2.了解中和滴定的误差分析方法。
3.能运用滴定原理对其他类型反应进行定性、定量分析。
【考点梳理】考点一、中和滴定原理1、定义:用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)浓度的实验方法。
2、原理:以一元强酸与一元强碱反应为例,C1、V1、C2、V2分别代表酸碱的浓度和体积,二者完全中和时存在定量关系:H++OH-=H2O1mol1molC1V1C2V2C1V1=C2V2利用以上关系,测出其中的V1或V2,即可得未知酸或碱溶液的浓度C2或C1。
说明:(1)完全中和的含义为:n H+=n OH—,而不一定是pH=7。
(2)其它酸碱中和都有相应的定量关系,均可利用中和滴定原理测定浓度。
HCl NaOH,H2SO42NaOH,H3PO43NaOH考点二.滴定终点的确定:1、指示剂的变色范围:石蕊试液红色5紫色8蓝色酚酞试液无色8.2粉红10红色甲基橙红色 3.1橙色 4.4黄色2、选择合适的指示剂:指示剂的变色范围与酸碱中和后的溶液的pH越接近越好,且变色要明显,一般来说,酸碱用甲基橙为佳;碱酸用酚酞为佳。
若酸碱有一方是弱的,则应根据中和所得盐的pH来确定选用哪种指示剂,一般来说,强酸与弱碱用甲基橙,强碱与弱酸用酚酞。
要点诠释:①石蕊试液不宜做中和滴定的指示剂(因变色不明显)。
②指示剂变色的pH值范围尽可能与生成盐的水解得到溶液的pH值吻合。
③酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法。
滴定管中装有已知物质的量浓度的酸(或碱)溶液,锥形瓶中盛放一定量未知浓度、待测定的碱(或酸)溶液,待测液中预先加有几滴酸碱指示剂,如酚酞或甲基橙。
把滴定管中溶液逐滴加入到锥形瓶中,酸碱中和反应完全时,随着酸碱中和百分数的上升,溶液的pH会发生变化,对于强酸、强碱的中和,开始时由于被中和的酸或碱浓度较大,加入少量的碱或酸对其pH的影响不大。
2019年高考化学总复习资料
化学是一门历史悠久而又富有活力的学科,查字典化学网为大家推荐了高考化学总复习资料,请大家仔细阅读,希望你喜欢。
常见物质的俗名及成分
1.硫酸盐类
(1)皓矾:ZnSO4·7H2O
(2)重晶石(钡餐):BaSO4
(3)绿矾:FeSO4·7H2O
(4)芒硝:Na2SO4·10H2O
(5)明矾:KAl(SO4)2·12H2O
(6)蓝矾(胆矾):CuSO4·5H2O
(7)熟石膏:2CaSO4·H2O
2.矿石类
(1)电石:CaC2
(2)磁铁矿石:Fe3O4
(3)赤铁矿石:Fe2O3
(4)石英:SiO2
(5)刚玉(蓝宝石,红宝石):Al2O3
3.气体类
(1)高炉煤气:CO、CO2等混合气体
(2)水煤气:CO、H2
(3)天然气(沼气):CH4
4.有机类
(1)福尔马林:35%~40%的HCHO水溶液
(2)蚁酸:HCOOH
(3)尿素:CO(NH2)2
(4)氯仿:CHCl3
(5)甘油:CH2OH—CHOH—CH2OH
(6)硬脂酸:C17H35COOH
(7)软脂酸:C15H31COOH
(8)油酸:C17H33COOH
(9)肥皂:C17H35COONa
(10)银氨溶液:Ag(NH3)2OH
(11)葡萄糖:C6H12O6
(12)蔗糖:C12H22O11
(13)淀粉:(C6H10O5)n
(14)石炭酸:苯酚
5.其他类
(1)石灰乳:Ca(OH)2
(2)铜绿:Cu2(OH)2CO3
(3)王水:浓盐酸、浓HNO3(按体积比3∶1混合)
(4)泡花碱:Na2SiO3
(5)小苏打:NaHCO3
(6)纯碱、苏打:Na2CO3
(7)大苏打:Na2S2O3·5H2O
(8)光卤石:MgCl2·6H2O
(9)生理盐水:0.9%的氯化钠溶液
(10)漂白液:有效成分NaClO,非有效成分NaCl
(11)漂白粉:有效成分Ca(ClO)2,非有效成分CaCl2
(12)碱石灰:CaO、NaOH。