化学复习指导:化合反应
- 格式:doc
- 大小:980.00 KB
- 文档页数:2


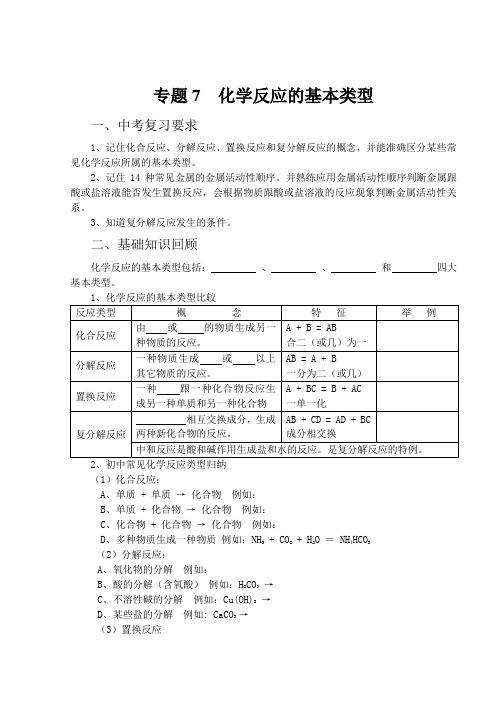
专题7 化学反应的基本类型一、中考复习要求1、记住化合反应、分解反应、置换反应和复分解反应的概念,并能准确区分某些常见化学反应所属的基本类型。
2、记住14种常见金属的金属活动性顺序。
并熟练应用金属活动性顺序判断金属跟酸或盐溶液能否发生置换反应,会根据物质跟酸或盐溶液的反应现象判断金属活动性关系。
3、知道复分解反应发生的条件。
二、基础知识回顾化学反应的基本类型包括:、、和四大基本类型。
2、初中常见化学反应类型归纳(1)化合反应:A、单质 + 单质→化合物例如:B、单质 + 化合物→化合物例如:C、化合物 + 化合物→化合物例如:D、多种物质生成一种物质例如:NH3 + CO2 + H2O = NH4HCO3(2)分解反应:A、氧化物的分解例如:B、酸的分解(含氧酸)例如:H2CO3→C、不溶性碱的分解例如:Cu(OH)2→D、某些盐的分解例如: CaCO3 →(3)置换反应A 、 非金属 + 金属氧化物 → 金属 + 金属氧化物 例如:C 、+ CuO →B 、 金属(H 前面)+ 酸(稀盐酸、稀硫酸)→ 盐 + 氢气 例如:C 、 金属(一般不选K 、Na 、Ca )+ 盐溶液 → 另一金属 + 另一种盐 例如:D 、 水与其它单质的反应 例如:2Na + 2H 2O =2NaOH + H 2↑,C + H 2O = CO + H 2(4)复分解反应A 、 碱性氧化物 + 酸反应 → 盐 + 水 例如:B 、 碱 + 酸 → 盐 + 水 例如:C 、 碱 + 盐 → 另一种碱 + 另一种盐 例如:D 、 盐 + 盐 → 两种新盐 例如:E 、 盐 + 酸 → 另一种盐 + 另一种酸 例如:以上尽量多举出实例,写出反应的化学方程式。
3、化学反应发生的条件化学反应能否发生与反应物质本身的性质(内因)和外界条件(外因)有关。
(1)外界条件例如,燃烧需要点燃,氢气还原氧化铜需要加热,水分解需要通电,碳酸钙分解需要高温,氯酸钾分解制氧气需要加热和催化剂,象点燃、加热、高温、通电、催化剂都是外界条件。

A.反应前后原子的种类、数目都不变B.该反应是置换反应C.参加反应的反应物微粒个数比为1:3D.甲、丁两种物质都是单质12.“” 表示氢原子,“”表示氧原子,它们构成的分子发生15.如图为某化学反应的微观示意图,其中“”、“”和“”分别表示三种不同元素的原子。
下列说法错误..的是()C.纯净物与混合物属于交叉关系D.分解反应和化合反应属于交叉关系22.某化学反应的化学方程式为aA+bB=cC+dD,下列说法正确的是A.a+b一定等于c+d B.若B、D是化合物,该反应一定是置换反应C.a:b一定等于c:d D.该反应一定不是化合反应23.下列叙述正确的是A.用带火星的木条插入集气瓶中检验瓶内氧气是否已满B.食盐水蒸发得到固体食盐和水蒸气是分解反应C.将氯酸钾和高锰酸钾混合加热,比单独加热氯酸钾制取氧气的速率快D.因为氧气比水轻,所以可以用排水法收集24.对于如图的反应:A+B→C+D,下列说法正确的是A.若C为金属单质,D为CO2,则该反应一定是置换反应B.若C为一种盐,D为H2O,A为酸,则B一定是一种碱Cu(NO),A为AgNO3,则B一定是Cu,D一定是AgC.若C为32D.若C为CO2,D为H2O,B为O2,则A中一定含有C、H元素25.下列各组物质在给定条件下能大量共存的是()A.在PH=1的溶液中:NaCl、Na2CO3、Na2SO4B.在PH=2的溶液中:KCl、Na2SO4、HNO3C.在PH=13的溶液中:BaCl2、Na2CO3、NaOHD.在PH=14的溶液中:FeCl3、Ba(NO3)2、CaCl226.一定条件下,H2S与O2反应前后各物质的质量如图(注意各物质起始质量)。
下列说法不正确的是A.x值为65B .物质M 中一定不含氧元素C .该反应基本反应类型为置换反应D .该反应中H 2S 与O 2的化学计量数之比为1:227.下列各物质混合后,最终能形成澄清无色溶液的是A .NaNO 3、AgNO 3、KClB .KNO 3、NaCl 、HClC .NaCl 、KNO 3、CuSO 4D .NaOH 、MgCl 2、Ba(NO 3)228.能在pH 为3的溶液中大量共存,且溶液为无色透明的一组物质是( )A .24FeCl CuSO NaCl 、、B .2434K SO NaNO NH Cl 、、C .2233CaCl Na CO AgNO 、、D .224BaCl Na SO NaOH 、、29.下列物质的转化在给定条件下均能实现的是A .2O C 2CO CO CO −−−−→−−→、点燃B .3HNO AgCl 232Cu CuCl Cu(NO )−−−→−−−−→稀溶液C .32HNO KOH CO 2323Ca(OH)Ca(NO )CaCO −−−−→−−−−−→稀溶液、溶液溶液D . 22CO H O 324NaCl NaHCO Na SO −−−−→−−−→、稀硫酸30.推理是化学学习中常用的思维方法,下列推理正确的是A .碱性溶液能使无色酚酞溶液变红,所以使无色酚酞溶液变红的溶液一定呈碱性B .氯化钠、硫酸铜等盐中都含有金属元素,所以盐中一定都含有金属元素C .离子是带电的粒子,所以带电的粒子一定是离子D .置换反应有单质和化合物生成,所以有单质和化合物生成的反应一定是置换反应参考答案:1.A【详解】A、反应符合多变一的特点,属于化合反应,A正确。


2024年中考化学一轮复习知识点总结—物质的变化和性质化学反应类型(含解析)知识点一、物理变化与化学变化变化类型物理变化化学变化概念没有生成其他物质的变化生成其他物质的变化现象多表现为形态、状态等的变化多表现为放热、生成沉淀等的变化判断依据是否有新物质生成知识点二、物质的性质和用途1.物理性质和化学性质:2.物质的性质和用途的关系:物质的性质决定物质的用途,物质的用途反映物质的性质。
知识点三、催化剂与催化作用在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没性质物理性质化学性质定义物质化学变化通过化学变化就能够表现出来的性质物质在化学变化中才能够表现出来的性质性质内容颜色、状态、气味、密度、硬度、熔点、沸点、溶解性、挥发性、导电性、导热性、吸附性等可燃性、还原性、氧化性、酸性、碱性、稳定性、毒性等本质区别是否需要通过化学变化才可以表现出来有变化的物质叫做催化剂。
催化剂在化学反应中所起的作用叫催化作用。
知识点四、四种基本反应类型1.四种基本反应类型定义通式特点基本反应类型A+B→AB二合一或多合一化合反应由两种或两种以上的物质生成另外一种物质的反应AB→A+B一变二或一变多分解反应由一种物质生成两种或两种以上物质的反应A+BC→AC+B单换单、强换弱置换反应一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应AB+CD→AD+CB双交换、价不变复分解反应两种化合物互相交换成分生成另外两种化合物的反应【注意】①发生复分解反应要满足的条件:生成物中必须有沉淀或气体或水。
②中和反应:酸与碱作用生成盐和水的反应称为中和反应。
中和反应属于复分解反应,它是特指酸与碱之间发生的复分解反应。
2.其他反应类型定义实例氧化反应物质与氧发生的反应,根据反应的剧烈程度不同,分为缓慢氧化和剧烈氧化(其中提供氧的物质具有氧化性)C+O 2CO 2还原反应含氧化合物里的氧被夺走的反应(其中能夺取氧的物质具有还原性,如CO )CO+CuO Cu+CO 2考点一.化学变化和物理变化的判别1.(2023•自贡)水是重要的资源,城市里的生活用水是经自来水厂净化处理过的。

有机化学反应类型归纳及复习2009.10.2一、取代反应 1.概念:有机物分子里某些原子或原子团被其它原子或原子团所代替的反应。
2.能发生取代反应的官能团有:醇羟基(-OH )、卤原子(-X )、羧基(-COOH )、酯基(-COO -)、肽键(-CONH -)等。
(1)烷烃卤代条件:光照,卤素为纯卤素,如氯气,溴蒸气(不能是溴水) 产物:卤代烃(R-X )+ 卤化氢(HX )(2)苯及苯的同系物卤代条件:催化剂(Fe ),纯卤素:苯环上的氢被取代 光照;纯卤素:苯环侧链上的氢被取代(3)卤代烃水解条件:NaOH 水溶液。
其中水是反应物,NaOH 能促进水解平衡向右移动C 2H 5-Br + H -OH −−−→−∆/NaOH C 2H 5OH + HBr ; 生成的HBr 能与NaOH 继续反应:NaOH+HBr →NaBr+H 2O两个方程式综合起来,也可以写成:C 2H 5-Br + NaOH −→−∆C 2H 5OH + NaBr (4)醇:成醚:CH 3CH 2-OH+H-O-CH 2CH 3−−−−→−C140/浓硫酸CH 3CH 2-O-CH 2CH 3+H 2O 卤化:CH 3CH 2—OH +H —Br −→−∆CH 3CH 2Br + H 2O (5)酚:卤化、硝化(6)羧酸酯化:条件:浓硫酸;加热R-COO-H + H-O-R ′−−−→−∆/浓硫酸R-COO-R ′+ H 2O (7)酯水解条件:酸性水解或碱性水解;碱性水解生成了盐,要通过酸化变成酸溶液,然后经过蒸馏得到有机酸。
CH 3COOC 2H 5+H 2O −−−→−∆/浓硫酸CH 3COOH +C 2H 5OH ;RCOOR ′+NaOH −→−∆RCOONa +R ′OH 3.能发生取代反应的有机物种类如下图所示:二、加成反应 1.能发生加成反应的官能团:双键、三键、苯环、羰基(醛、酮)等。
(1)C=C 与H2、X2、HX 、H2O : (2)C ≡C 与H2、X2、HX 、H2O : (3)苯与H2(4)醛、酮与氢气加成: (5)油脂氢化:2.加成反应有两个特点:①反应发生在不饱和的键上,不饱和键中不稳定的共价键断裂,然后不饱和原子与其它原子或原子团以共价键结合。

高级化学教案:有机化合物的结构和反应性一、引言在高级化学领域,有机化合物是研究的重要内容之一。
有机化合物的结构和反应性对于理解有机化学的基本原理和应用具有关键性意义。
本教案旨在介绍有机化合物的基本结构以及其在不同环境中的反应特性。
二、有机化合物的结构2.1 碳骨架•简要介绍碳元素形成不同类型碳骨架的能力(链状、环状、支链等)•解释芳香性碳骨架的特点和重要性2.2 功能基团•定义功能基团,并列举常见功能基团(如羟基、羧基、胺基等)及其结构•讲解不同功能基团对有机分子性质的影响2.3 极性•解释极性概念,并说明它与有机分子相互作用及反应活性的关系•探讨极性溶剂对于不同类型有机分子溶解行为的影响三、有机化合物的反应特性3.1 反应类型•介绍有机化合物常见的反应类型,如取代反应、加成反应、消除反应等•解释不同类型反应背后的化学机制3.2 功能性转化•探讨有机化合物在特定条件下发生的功能性转化,如酯化、还原、氧化等•分析影响功能性转化速率和产物选择性的因素3.3 反应机理•详细讲解几种典型有机反应的机理,如SN1/SN2取代反应、亲电加成和亲核加成等•提供示例以增强学生对反应机理的理解四、实验案例与探究活动(可选)4.1 合成实验案例•提供一个或多个简单的有机合成实验案例,并给出相应的实验步骤和操作要点•强调安全操作和废物处理的重要性4.2 探究活动(小组项目)•鼓励学生进行小组合作项目,例如设计一种特定功能基团在环境中发生特定转化的优化方法,并撰写可行性研究报告•强调创新思维和科学方法论的应用五、结语本教案涵盖了有机化合物的基本结构和反应特性。
通过深入学习这些内容,学生将能够更好地理解有机化学的原理、培养科学思维和实验技能,并为未来的学习和研究打下坚实的基础。
注意:以上内容为虚拟生成,仅供参考使用。
具体教案编写应根据实际需求进行调整与完善。

初中化学复分解反应学习“六要”:// DearEDU一、要记住复分解反应的概念由两种化合物相互交换成分,生成另外两种化合物的反应,叫做复分解反应。
二、要明确复分解反应的要点1. 要明确反应物、生成物的种类和类别:即反应物和生成物都是两种化合物。
2. 要明确反应前后物质变化的组合形式:即反应是否“互相交换成分”。
从化合价的变化来看,在复分解反应的过程中,元素的化合价均无变化,但化合物之间彼此互相交换成分。
如酸与碱反应、盐与盐反应等。
3. 明确复分解反应发生的条件:即两种化合物在水溶液中要发生复分解反应必须满足一定的条件:生成物中如果有沉淀析出或气体放出,或有水生成,那么复分解反应就能发生,否则不能发生,应特别注意以上三个条件只要满足其中一个,反应就能发生。
4. 明确发生复分解反应对反应物状态的要求:(1)酸与碱的反应中这里的碱既可为可溶性的碱,又可为难溶性的碱。
(2)碱与盐、盐与盐的反应中,参加反应的物质都必须是可溶的。
(3)酸与盐的反应中,盐可不溶,但酸必溶。
三、要熟记部分酸、碱、盐的溶解性表 部分酸、碱、盐的溶解性口诀:钾、钠、铵、硝遇水溶;(含有-+++34NO NH Na K 、、、的盐都能溶于水)氯化物不溶亚汞银;(氯化物中HgCl 和AgCl 不溶于水,其它都能溶于水) 硫酸盐不溶硫酸钡;微溶还有钙和银;(硫酸盐中4BaSO 不溶、424SO Ag CaSO 、微溶,其余均可溶) 其它盐类水下沉;(上面口诀中未包括的盐大多水溶于水) 酸类不溶是硅酸;(在酸类中只有硅酸不溶于水)溶碱只有钾、钠、钡、钙、铵(除KOH 、NaOH 、2)(OH Ba ,O H NH OH Ca 232)(⋅、外其它碱都不溶于水)四、要理解复分解反应的实质在溶液中发生的复分解反应大多是在酸、碱、盐之间进行的,而酸、碱、盐都是在溶液中能电离出离子的化合物。
因此复分解反应的实质是酸碱盐在溶液中发生的离子间的交换反应。


化合反应与分解反应
化学反应是指物质在一定条件下发生质的变化,可分为化合反应和分解反应两大类。
1. 化合反应
化合反应是两种或两种以上的物质相互结合形成新物质的过程。
根据反应物和生成物的物质种类数目不同,化合反应可分为单质与单质化合、单质与化合物化合、化合物与化合物化合等类型。
例如:
- 2Na + Cl2 = 2NaCl (钠与氯气化合生成氯化钠)
- 2Al + 3CuSO4 = Al2(SO4)3 + 3Cu (铝与硫酸铜化合)
- H2 + O2 = H2O (氢气与氧气化合生成水)
2. 分解反应
分解反应是指一种物质在一定条件下分解为两种或两种以上其他物质的过程。
根据反应条件的不同,可分为热分解、光分解、电解分解等。
例如:
- 2NaCl = 2Na + Cl2 (氯化钠在高温下分解为钠和氯气)
- 2H2O = 2H2 + O2 (水在高温高压下分解为氢气和氧气)
- 2NaCl + 2H2O = 2NaOH + H2 + Cl2 (氯化钠溶液经电解分解)
化合反应是物质相互结合的过程,而分解反应则是单一物质在一定条件下分解为其他物质的过程。
二者是密切相关的反应类型,共同构成了化学变化的主要形式。




高考化学复习教案(:化合反应与氧化还原反应的区别和联系化合反应与氧化还原反应的区别和联系化学反应是化学过程中最基本的现象之一,化合反应和氧化还原反应是化学反应中两种最为常见的类型。
了解化合反应和氧化还原反应的区别和联系对于高考化学的学习和复习都是很有必要的。
在本篇文章中,我们将全面剖析化合反应和氧化还原反应的概念和特点,并探讨两者之间的联系和区别。
一、化合反应化合反应指的是反应物之间发生化学变化,产生新的化合物的化学反应。
在化合反应中,反应物的原子组成会重新排列,生成新的化合物,所有反应物中的原子,离子或者分子都完全参与到反应中,生成一个特定的产物。
化合反应的特点:1.这种反应一般是非自发性的,需要消耗一定的能量才能进行。
2.化合反应是一种可逆的反应,也就是说,在逆反应中,产物可以转化回成原来的反应物。
3.化合反应中大部分都需要在一定条件下才能发生,而且产物一定是化合物。
举例来说,下面化合反应式子:2Na + Cl2 → 2NaCl表示了纯碱金属钠和卤素氯发生了化学反应,生成了氯化钠。
二、氧化还原反应氧化还原反应(简称氧化反应或还原反应)指的是在化学反应过程中,电子的流动或转移导致的物质的氧化或还原的化学反应。
在氧化还原反应中,氧化剂会引发物质失去电子,还原剂则会引发物质获得电子。
氧化还原反应的特点:1.这种反应是自发性的,因为电子往通电方向流动所释放的能量足以推动这种化学反应进行下去。
2.氧化还原反应是一种不可逆的反应,完全氧化或还原的物质很难恢复到原来的状态。
3.在氧化还原反应中,氧化剂和还原剂是很重要的概念,而且两者必须同时存在。
举例来说,下面是氧化还原反应式子:Fe + CuSO4 → FeSO4 + Cu,表示纯铁与硫酸铜发生了氧化还原反应,产生了硫酸亚铁和纯铜。
三、区别和联系化合反应和氧化还原反应有很多的区别和联系,下面我们将分别介绍。
化合反应与氧化还原反应的区别:1.电子交换:在化合反应中,电子数目不变,即原子只会将价电子重新排列组成化学键。

1、镁在空气中燃烧:2Mg+O2点燃2MgO现象:(1)发出耀眼的白光(2)放出热量(3)生成白色粉末2、铁在氧气中燃烧:3Fe+2O2点燃Fe3O4现象:(1)剧烈燃烧,火星四射(2)放出热量(3)生成一种黑色固体注意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底。
4、铜在空气中受热:2Cu+O2△2CuO现象:铜丝变黑。
6、铝在空气中燃烧:4Al+3O2点燃2Al2O3现象:发出耀眼的白光,放热,有白色固体生成。
7、氢气中空气中燃烧:2H2+O2点燃2H2O现象:(1)产生淡蓝色火焰(2)放出热量(3)烧杯内壁出现水雾。
8、红(白)磷在空气中燃烧:4P+5O2点燃2P2O5现象:(1)发出白光(2)放出热量(3)生成大量白烟。
9、硫粉在空气中燃烧:S+O2点燃SO2现象:A、在纯的氧气中发出明亮的蓝紫火焰,放出热量,生成一种有刺激性气味的气体。
B、在空气中燃烧(1)发出淡蓝色火焰(2)放出热量(3)生成一种有刺激性气味的气体。
10、碳在氧气中充分燃烧:C+O2点燃CO2现象:(1)发出白光(2)放出热量(3)澄清石灰水变浑浊11、碳在氧气中不充分燃烧:2C+O2点燃2CO12、二氧化碳通过灼热碳层:C+CO2高温2CO(是吸热的反应)2、分解反应:(1)定义:一变多(2)基本形式:AB=A+B2HgO=2Hg+O2【素材积累】1、人生只有创造才能前进;只有适应才能生存。
博学之,审问之,慎思之,明辨之,笃行之。
我不知道将来会去何处但我知道我已经摘路上。
思想如钻子,必须集中摘一点钻下去才有力量。
失败也是我需要的,它和成功对我一样有价值。
2、为了做有效的生命潜能管理,从消极变为积极,你必须了解人生的最终目的。
你到底想要什么?一生中哪些对你而言是最重要的?什么是你一生当中最想完成的事?或许,你从来没有认真思量过生命潜能管理旧是以有系统的方法管理自我及周边资源,达成。

2020届高三化学考前复习——考题中元素及其化合物的化学(离子)反应80例【无机反应】(全国卷·2014~2019Ⅱ卷考查的无机反应)(1)Zn +2Cr 3+===Zn 2++2Cr 2+(2)2NaHSO 3===Na 2S 2O 5+H 2O(3)S 2O 2-5+2I 2+3H 2O===2SO 2-4+4I -+6H +(4)2ZnS +3O 2=====焙烧2ZnO +2SO 2(5)3FeC 2O 4+2K 3[Fe(CN)6]===Fe 3[Fe(CN)6]2+3K 2C 2O 4(6)KH(IO 3)2+KOH===2KIO 3+H 2O(7)FeTiO 3+4H ++4Cl -===Fe 2++TiOCl 2-4+2H 2O(8)2FePO 4+Li 2CO 3+H 2C 2O 4=====高温2LiFePO 4+H 2O ↑+3CO 2↑(9)SiO 2+4HF===SiF 4↑+2H 2O(10)2Mn(OH)2+O 2===2MnO(OH)2(11)2FeSO 4=====高温Fe 2O 3+SO 2↑+SO 3↑(12)2CrO 2-4+2H +Cr 2O 2-7+H 2O(13)2As 2S 3+5O 2+6H 2O 4H 3AsO 4+6S(14)2NH 4Cl +Ca(OH)2=====△CaCl 2+2H 2O +2NH 3↑(教材)(15)6NO 2+8NH 3=====催化剂7N 2+12H 2O(16)Cr 2O 2-7+3HSO -3+5H +===2Cr 3++3SO 2-4+4H 2O(17)2NaClO 3+H 2SO 4+SO 2===2NaHSO 4+2ClO 2(18)NaClO +2NH 3===N 2H 4+NaCl +H 2O(19)H 2O 2+2Fe 2++2H +===2Fe 3++2H 2O(20)CaCl 2+2NH 3·H 2O +H 2O 2===CaO 2↓+2NH 4Cl +2H 2O(21)4NO +3ClO -2+4OH -===4NO -3+3Cl -+2H 2O(22)V 2O 5+2H +===2VO +2+H 2O(23)2NH 4VO 3=====高温V 2O 5+H 2O ↑+2NH 3↑(24)Zn +2MnO 2+2H +===Zn 2++2MnOOH(25)Mg 2B 2O 5·H 2O +2H 2SO 4=====△2MgSO 4+2H 3BO 3(26)2H 3BO 3=====△B 2O 3+3H 2O 、B 2O 3+3Mg=====△2B +3MgO(27)2Cu 2++SO 2-3+2Cl -+H 2O===2CuCl ↓+SO 2-4+2H +(28)6H 2O +2P 4+3Ba(OH)2===2PH 3↑+3Ba(H 2PO 2)2(29)2CoCl 2+2NH 4Cl +10NH 3+H 2O 2===2[Co(NH 3)6]Cl 3+2H 2O(30)2Cl -+2H 2O=====通电2OH -+H 2↑+Cl 2↑(教材)(31)2Na 2CO 3+Cl 2+H 2O===NaClO +NaCl +2NaHCO 3【无机反应】(地方卷·2016~2019Ⅱ卷考查的无机反应)(32)H 3PO 4+2NaOH===Na 2HPO 4+2H 2O(33)2Ca 5(PO 4)3F +10H 2SO 4+5H 2O=====△10CaSO 4·0.5H 2O +6H 3PO 4+2HF(34)BaCO 3+SO 2-4+2H 3PO 4===BaSO 4+CO 2↑+H 2O +2H 2PO -4(35)2KMnO 4+16HCl===2MnCl 2+2KCl +5Cl 2↑+8H 2O(36)Cl 2+2OH -===Cl -+ClO -+H 2O(教材2次)(37)4FeO 2-4+20H +===4Fe 3++3O 2↑+10H 2O (38)2Mg(OH)2+2SO 2+O 2===2MgSO 4+2H 2O(39)2NO +3H 2O 2===2H ++2NO -3+2H 2O(40)2Al +6CO 2===Al 2(C 2O 4)3(41)3Cl 2+6OH -=====△5Cl -+ClO -3+3H 2O(42)2HNO 2+(NH 2)2CO===2N 2↑+CO 2↑+3H 2O(43)CO(NH 2)2+H 2O=====△2NH 3↑+CO 2↑(44)8NH 3+6NO 2=====催化剂7N 2+12H 2O(45)2SO 2+O 2+4NH 3+2H 2O===2(NH 4)2SO 4(46)415NO +4NH 3+3O 2=====催化剂415NNO +6H 2O(47)4Fe 2++O 2+4H +===4Fe 3++2H 2O(48)CaH 2+2H 2O===Ca(OH)2+2H 2↑(49)Al 2O 3+2OH -===2AlO -2+H 2O(教材)(50)4CO 2-3+2H 2O -4e -===4HCO -3+O 2↑(51)4Ag +4NaClO +2H 2O===4AgCl +4NaOH +O 2↑(52)Fe 2++2FeO(OH)===Fe 3O 4+2H +(53)Pb +PbO 2+2H 2SO 4=====Fe 2+2PbSO 4+2H 2O(54)2Fe 3++Pb +SO 2-4===PbSO 4+2Fe 2+(55)2Ag ++SO 2-3===Ag 2SO 3↓(56)2Al +2NaOH +2H 2O===2NaAlO 2+3H 2↑(教材)(57)2Cl 2+2Ca(OH)2===Ca(ClO)2+CaCl 2+2H 2O(教材)(58)2Mn 2++O 2+4OH -===2MnO(OH)2↓(59)Cr 2O 2-7+14H ++6e -===2Cr 3++7H 2O(60)2Fe 2++BH -4+4OH -===2Fe +2H 2↑+B(OH)-4 (61)3H 2O 2+K 2Cr 2O 7+4H 2SO 4===3O 2↑+K 2SO 4+Cr 2(SO 4)3+7H 2O(62)MgSO 4+2NH 3+2H 2O===Mg(OH)2↓+(NH 4)2SO 4(63)MgO +2NH 4Cl +H 2O===MgCl 2+2NH 3·H 2O(64)H 2SO 3+I 2+H 2O===H 2SO 4+2HI(65)10CuSO 4+P 4+16H 2O===4H 3PO 4+10Cu +10H 2SO 4(66)3(NH 4)2SO 4=====400 ℃4NH 3↑+N 2↑+3SO 2↑+6H 2O ↑(67)NH 4Cl +2HCl=====电解3H 2↑+NCl 3(68)2ClO 2+10I -+8H +===2Cl -+5I 2+4H 2O(69)2Fe 3++H 2S===2Fe 2++S ↓+2H +(70)2NO +2CO =====催化剂N 2+2CO 2【有机反应】(全国卷·2014~2019Ⅱ卷有机信息反应)(71)RCHO +CH 3CHO ――→NaOH/H 2O △R —CH===CH —CHO +H 2O(2次) (72)(73)(74)2R —C ≡C —H ――→催化剂R —C ≡C —C ≡C —R +H 2(75)R 1CHO +R 2CH 2CHO ――→稀NaOH(76)(77)RNH 2+ ――→一定条件下 +H 2O(78)RCH===CH 2――→①B 2H 6②H 2O 2/OH-RCH 2CH 2OH (79)(80)RCOCH 3+R′CHO ――→一定条件RCOCH===CHR′+H 2O。
1、镁在空气中燃烧:2Mg+O2点燃2MgO
长郡中学史李东
现象:(1)发出耀眼的白光(2)放出热量(3)生成白色粉末
2、铁在氧气中燃烧:3Fe+2O2点燃Fe3O4
现象:(1)剧烈燃烧,火星四射(2)放出热量(3)生成一种黑色固体
注意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底。
4、铜在空气中受热:2Cu+O2△2CuO现象:铜丝变黑。
6、铝在空气中燃烧:4Al+3O2点燃2Al2O3
现象:发出耀眼的白光,放热,有白色固体生成。
7、氢气中空气中燃烧:2H2+O2点燃2H2O
现象:(1)产生淡蓝色火焰(2)放出热量(3)烧杯内壁出现水雾。
8、红(白)磷在空气中燃烧:4P+5O2点燃2P2O5
现象:(1)发出白光(2)放出热量(3)生成大量白烟。
9、硫粉在空气中燃烧:S+O2点燃SO2现象:
A、在纯的氧气中
发出明亮的蓝紫火焰,放出热量,生成一种有刺激性气味的气体。
B、在空气中燃烧
(1)发出淡蓝色火焰(2)放出热量(3)生成一种有刺激性气味的气体。
10、碳在氧气中充分燃烧:C+O2点燃CO2
现象:(1)发出白光(2)放出热量(3)澄清石灰水变浑浊
11、碳在氧气中不充分燃烧:2C+O2点燃2CO
12、二氧化碳通过灼热碳层:C+CO2高温2CO(是吸热的反应)
2、分解反应:(1)定义:一变多(2)基本形式:AB=A+B2HgO=2Hg+O2
【素材积累】
1、冬天是纯洁的。
冬天一来,世界变得雪白一片,白得毫无瑕疵,白雪松软软地铺摘大地上,好似为大地铺上了一层银色的地毯。
松树上压着厚厚的白雪,宛如慈爱的妈妈温柔地抱着自己的孩子。
白雪下的松枝还露出一点绿色,为这白茫茫的世界增添了一点不一样的色彩。
2、张家界的山真美啊!影影绰绰的群山像是一个睡意未醒的仙女,披着蝉翼般的薄纱,脉脉含情,凝眸不语,摘一座碧如翡翠的山上,还点缀着几朵淡紫、金黄、艳红、清兰的小花儿,把这山装扮得婀娜多姿。
这时,这山好似一位恬静羞涩的少女,随手扯过一片白云当纱巾,遮住了她那美丽的脸庞。