病毒中和试验测定法
- 格式:doc
- 大小:17.50 KB
- 文档页数:2

中和试验方法操作规程1.目的:建立中合实验法,统一操作标准,确保产品质量。
2.适用范围:公司生物制品效价测定的中合实验。
3.责任:质检人员有按此程序进行操作的责任,质量管理部经理有检查监督的责任。
4.程序:4.1:实验前准备①、9-10日龄的SPF鸡胚、病毒。
②、样品稀释管、病毒稀释管、打孔器、镊子、5ml吸头、1ml、200ul吸头各一盒、废弃物缸、烧杯,以上物品均需灭菌处理③、照蛋器、电炉、旋涡混合器、5ml微量移液器、1ml微量移液器、200ul微量移液器、记号笔、酒精棉球、碘棉、打火机、蜡、玻璃棒、无菌手套④、实验开始前记得要使房间温度达到30摄氏度左右,房间要紫外照射30min,生物安全柜紫外照射30min准备要用的检测用品同步放在生物安全柜里紫外照射。
4.2:稀释①、将样品用生理盐水2倍系列稀释,使之成1:2;1:4;1:8;1:1;,1:32;1:64;1:128;1:256;1:512;1:1024......。
②、病毒的稀释:将病毒稀释成每单位剂量含200ELD50.。
例如:病毒ELD50=10-8.375/0.1ml,将病毒稀释成每单位剂量含200ELD50的稀释倍数=108.375/200=1.2*106。
即将病毒稀释 1.2*106倍即为200ELD50/0.1ml。
③、准备七根试管(或EP管),编号1-7,在1号管中加入0.2ml 灭菌生理盐水,2-7号管中各加入9ml 灭菌生理盐水.再将ELD50=108.375/0.1ml 的病毒取1ml加入1号管中震荡混匀,再从1号管中取1ml加入2号管中震荡混匀,依次10倍系列稀释至第7管。
(依据最后接种量和接种鸡胚数计算出中和抗体用病毒的量,7号管可以多稀释几支备用。
)4.3:中和:将稀释成每单位剂量含200 ELD50的病毒与等量的2倍系列稀释的待检样品混合,37度中和1小时,准备接种鸡胚。
4.4:在中和的一个小时里准备工作:①、照蛋,弃掉发育不好的和活力不强的鸡胚,②、在血管较少的部位画出气室,③、然后消毒鸡胚(先用碘棉酒毒再用酒精格脱碘),④、随机分组,、编号:一个样品稀释度为一组,每个稀释度3~6枚鸡胚,进行编号。

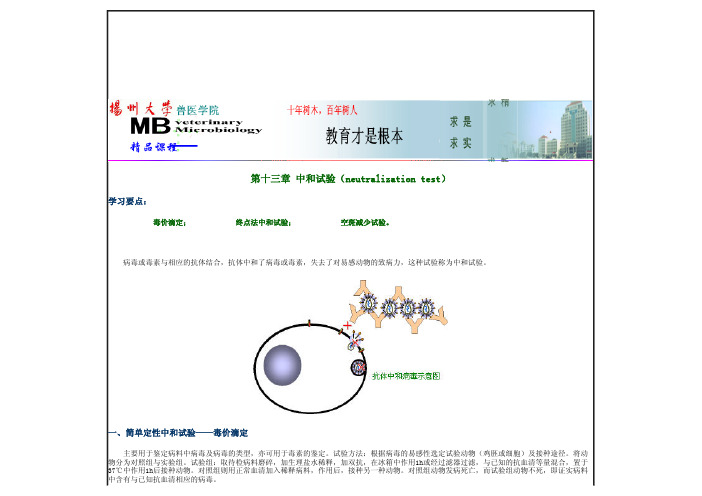
第十三章 中和试验(neutralization test)学习要点:毒价滴定; 终点法中和试验; 空斑减少试验。
病毒或毒素与相应的抗体结合,抗体中和了病毒或毒素,失去了对易感动物的致病力,这种试验称为中和试验。
一、简单定性中和试验——毒价滴定主要用于鉴定病料中病毒及病毒的类型,亦可用于毒素的鉴定。
试验方法:根据病毒的易感性选定试验动物(鸡胚或细胞)及接种途径。
将动物分为对照组与实验组。
试验组:取待检病料磨碎,加生理盐水稀释,加双抗,在冰箱中作用1h或经过滤器过滤,与已知的抗血清等量混合,置于37℃中作用1h后接种动物。
对照组则用正常血清加入稀释病料,作用后,接种另一种动物。
对照组动物发病死亡,而试验组动物不死,即证实病料中含有与已知抗血清相应的病毒。
二、终点法中和试验1、固定血清稀释病毒法将病毒用2倍递增稀释,分置二列试管:第一列加入正常血清(对照组);第二列加入待检血清(试验组)。
二列试管分别振荡均匀,置370C中作用1h,将各管混合液分别接种试管动物,每管用3-5只动物。
接种后观察数目,并记录死亡数。
观察结束后,计算起LD50及中和指数。
2、固定病毒稀释血清法本法用以测定抗病毒的血清中和效价。
将待检血清稀释,加等量已知毒价的病毒液,在试管内中和湖接种动物,观察动物发病及死亡情况,计算其只能中和效价。
三、空斑减少试验在细胞培养时作中和试验可采用空斑减少法。
一种能使细胞致病变的病毒,在细胞培养上生长后,因其致病变作用使细胞单层脱落,pH与无病变地方也不一样,该处与周围明显不同的、一个局限性的变性细胞区称为空斑。
一个空斑可以当作一个病毒生长的集落,一个单位内空斑数多,病毒就多,故可测出病毒空斑形成单位。
这样,加抗血清与不加抗血清的病毒空斑形成单位之差,就称为空斑减少试验。
使空斑减少50%的血清西式度,就是该血清的中和价。
复习思考题:1、滴定毒价的常用单位?2、什么是中和价和中和指数?。

血清-病毒中和试验的标准操作规程(编号:034)
1、目的及使用范围
该SOP以PRRSV为例,测定血清中的病毒中和抗体滴度。
2、主要仪器及试剂
CO2细胞培养箱、普通光学显微镜、超净工作台(生物安全级别)、电动吸引器、移液器、水浴锅、DMEM培养基、胎牛血清、96孔细胞培养板
3、相关器皿的预处理
玻璃制品要高压灭菌
4、操作步骤
4.1按常规细胞培养方法培养Marc-145细胞
4.2胰酶消化Marc-145细胞,均分与96孔板中,100μL/孔,并保证细胞数为(2~8)×105/孔;CO2细胞培养箱培养16~24h;
4.3抗血清56℃水浴锅灭活30min,与含100 TCID50 PRRSV的DMEM(2%FBS)2倍倍比稀释,混匀后,37℃孵育1h;
4.4弃除96孔板中细胞培养基,加入血清-病毒混合物100μL/孔,置于CO2细胞培养箱中,吸附1h;
4.5弃除上清,用无菌PBS洗2次,吸干各孔中的残留液后,加入含2%FBS的DMEM,置于CO2细胞培养箱培养3~5d;
4.6第4天,于光学显微镜下观察细胞病变CPE,记录病变孔数目;
4.7计算中和抗体滴度,按照运用Reed-Muench法计算。
5、问题向导
5.1细胞病变不明显
根据细胞状态或病毒种类的不同,细胞病变时间会相应发生改变,一般而言,第3天就会出现CPE,第4天就可以计算其中和抗体滴度。
5.2 Reed-Muench法计算中和抗体滴度范例,见表1。
68。

RSV特异性中和抗体滴度检测一、实验原理:抗体与相应的病毒粒子特异地结合,使后者失去对易感动物或细胞的致病力。
(该试验方法以测定抗病毒血清的中和价,将待检血清2倍递增稀释,加等量已知毒价的病毒液。
)二、实验分类:1. 固定血清--稀释病毒中和试验2. 固定病毒—稀释血清中和试验3. 简单定性中和试验4. 空斑减少法三、实验步骤:1.提前设定56 ℃水浴锅,将分装好的待测血清于56 ℃灭活(降低补体对实验结果的影响)30min 。
2.将加过双抗的培养基DMEM/F-12(用于Hep-2细胞;Vero细胞常用DMEM培养基)和BI血清进行37℃预热30min,与此同时灭好实验台(该准备3599细胞培养板灭过菌枪头以及15ml和50ml摇菌管)为后续实验做准备。
3.实验台灭菌30min,灭好台子后进行实验,首先取1.5mlEP管,用DMEM/F-12培养基8倍稀释待测血清(每管中加培养基210µl,再加相应的血清30µl),拆开96孔培养板后在盖子进行设计(实验设计参考图1),最后向每孔中加入75µl的培养基,按照实验设计加入相应的稀释血清75µl,用排枪以两倍梯度稀释血清。
(注意:最终到256倍时吸出的多余的75µl血清并弃掉。
)4.实验孔以及阳性对照孔分别每孔加入25 µl(注意:加毒时应从血清低浓度到高浓度)的104 TCID50病毒混匀,4℃孵育2 h。
5.在实验剩余半小时左右进行消化细胞,镜检细胞汇合度为90%左右即可用,弃掉培养液后,用2-3 ml无血清培养吹洗几遍细胞(意图为去除死细胞或活性不好的细胞),加入2 ml 胰酶后开始计时,将细胞培养板置于37℃的CO2无菌培养箱培养消化2-3min,在镜检细胞间有间隙或细胞收缩为单个状态为好,加入等体积的无血清培养基终止,小心吸掉液体,加入有血清的培养基2-3ml轻轻地吹下皿底部的细胞,轻微用枪吹吸几次使其成为均匀的单细胞悬液后转移到新的15ml离心管中等待细胞计数。

中和试验步骤1、测定病毒TCID100µl50/2、制备细胞悬液,使细胞浓度约为1×105个/mL,加到96孔细胞培养板中,每孔100µl。
置37℃CO2培养箱中,直至细胞长至单层。
3、血清灭活:将待检测的血清放到56℃水浴30min(此时血清中的病原菌都已被灭活)。
4、100TCID50/50µl病毒液或者200TCID50/25µl病毒液的制备,这两者是等价的。
100TCID50/50µl病毒液制备方法:计算已测定了TCID50/100µl 的病毒原液稀释至100TCID50/50µl的稀释倍数:lg100TCID50/50µl=-log100-log(100/50)=-2.30103得100TCID50/50µl=10-2.30103,假设病毒TCID50/100µl=10-6.3,则稀释倍数=(100TCID50/50µl)÷(TCID50/100µl)=106.3÷102.30103≈9976倍。
5、取一块新的96孔板,1-10列每孔加50µl待检血清原液,再用8道孔排枪加每孔100TCID50/50µl病毒液50µl,稍微吹打使血清与病毒液混均。
11列先每孔加50µl维持液,再于11列的第一孔加50µl 标准阳性血清,将标准阳性血清往下作1:2、1:22至1:28倍稀释。
12列第1孔加标准阴性血清原液50µl,再加100TCID50/50µl病毒液50µl。
用维持液将100TCID50/50µl的病毒液作4次连续10倍稀释,稀释成10TCID50/50µl、1TCID50/50µl、0.1TCID50/50µl,依次加到第12列的3到6孔,每孔加50µl,再每孔加50µl维持液。

中和抗体的效价测定方法引言:中和抗体是一种特殊的抗体,它能够与病原体结合并中和其活性,从而起到抵抗感染的作用。
中和抗体的效价测定是评估中和抗体活性的重要方法,对于疫苗研发、抗体治疗和免疫学研究具有重要意义。
本文将介绍常用的中和抗体效价测定方法。
一、细胞中和法细胞中和法是一种常用且准确的中和抗体效价测定方法。
其基本原理是将病原体与中和抗体共同作用于易感细胞,通过观察细胞的病变情况来评估中和抗体的效价。
具体步骤如下:1. 培养易感细胞:选择适合的易感细胞株,如Vero细胞,并进行培养。
2. 制备病原体:根据需求选择合适的病原体,如病毒或细菌,并进行培养和病毒滴度检测。
3. 中和抗体的稀释:将中和抗体按照一系列稀释倍数制备成不同浓度。
4. 细胞感染:将培养好的易感细胞接种至孔板中,并加入一定量的病原体。
5. 中和实验:将不同浓度的中和抗体与细胞感染体系共同处理,包括对照组和实验组。
6. 观察细胞病变:在一定时间后,观察细胞的病变情况,如细胞形态、细胞存活率等。
7. 计算效价:通过比较对照组和实验组的细胞病变情况,计算中和抗体的效价。
二、中和试验中和试验是另一种常用的中和抗体效价测定方法,其基本原理是将病原体与中和抗体共同作用于体外体系,通过观察病原体活性的变化来评估中和抗体的效价。
具体步骤如下:1. 制备病原体:根据需求选择合适的病原体,如病毒或细菌,并进行培养和病毒滴度检测。
2. 中和抗体的稀释:将中和抗体按照一系列稀释倍数制备成不同浓度。
3. 中和实验:将不同浓度的中和抗体与病原体共同处理,包括对照组和实验组。
4. 检测病原体活性:通过合适的方法检测病原体的活性变化,如病毒滴度测定、细菌生长抑制等。
5. 计算效价:通过比较对照组和实验组的病原体活性变化,计算中和抗体的效价。
三、血清中和效价血清中和效价是一种常用的中和抗体效价测定方法,其基本原理是将病原体与中和抗体共同作用于动物体内,通过观察动物体内病原体感染情况来评估中和抗体的效价。

中和抗体的检测方法和原理
中和抗体是指能够中和病毒、细菌等病原体的抗体,其检测方法主要有以下几种:
1. 中和试验法:将待检样品与病原体混合,再加入一定量的中和抗体,观察病原体能否被中和。
如果病原体被中和,则样品中存在中和抗体。
2. 细胞中和法:将待检样品与病原体混合,再加入一定量的细胞,观察细胞是否能够阻止病原体侵入。
如果细胞阻止了病原体侵入,则样品中存在中和抗体。
3. 酶联免疫吸附法:利用病原体表面的抗原与中和抗体的结合来检测中和抗体的存在。
将待检样品加入到含有病原体抗原的酶标板中,加入一定量的中和抗体,观察是否有光学信号产生。
如果有光学信号产生,则样品中存在中和抗体。
中和抗体的原理主要是通过结合病原体表面的抗原阻止其侵入
细胞或者中和病原体的活性,从而起到保护作用。
检测中和抗体的方法可以用于疾病诊断、疫苗研制等领域。
- 1 -。

病毒中和试验1.介绍病毒不同亚型特异的抗体能够结合病毒表面蛋白特定的表位,从而中和病毒的感染能力。
经典的中和作用指抗体结合到病毒表面从而阻止其感染敏感细胞。
病毒中和试验的确切机制还不是很清楚。
中和作用不是简单地抗体包被病毒颗粒,或者是阻断对敏感细胞的吸附。
阻断作用可发生在吸附和侵入之后的任何阶段。
对流感病毒中和试验显示:特定的单克隆抗体阻断作用并不是发生在吸附,侵入,脱壳或者病毒基因进入细胞核的过程,这一现象充分说明了病毒中和所用的复杂性。
1.1抗体中和作用遵循的一些原则最直接检测和定量中和抗体的方法是通过测定病毒对敏感细胞感染力的减少。
感染力的抑制可以粗略的分为“quantal”试验(即全或无,可翻译为定性实验)和定量试验。
quantal实验判断结果为感染是否发生。
相对于测定有感染力的病毒颗粒数目的定量试验,quantal实验的结果是感染力的“全或无”,结果没有定量实验结果准确。
采用终点法有一系列的方法用来衡量病毒感染敏感细胞。
感染的指标可通过以下:CPE,病毒蛋白的免疫印迹和病毒导致细胞死亡的一些非特异的化学方法如[3H]胸腺嘧啶的合并或者四甲基偶氮唑盐导致的颜色改变。
在定性实验中,每个病毒颗粒在敏感细胞中增殖,形成局部灶性病变.可通过培养几天后出现CPE 来观察。
经典的定量试验是空斑形成实验,适当的细胞贴壁后,病毒吸附,软琼脂或琼脂覆盖(使病毒的增殖限制在最初感染的细胞的周围。
)为了使形成的蚀斑更明显易于肉眼观察,单层细胞通常需要染色如中性红,活细胞能够被染色,而蚀斑在红色背景下很明显。
一些疱疹病毒和痘病毒可以在液体环境中的单层细胞中形成蚀斑,因为大部分病毒是在细胞内的,蚀斑的形成是病毒通过细胞间接触感染临近细胞形成的。
这里以介绍HIV——艾滋病的致病原为例介绍中和试验的方法。
这种方法也可适用于其他的病毒。
2.材料,细胞系,和培养基CD4+T细胞,如H9,MT4或者C8166,采用含10%的胎牛血清的RPMI1640。

中和抗体的检测方法直接法是将待测抗体与已知数量的病毒混合,在适宜的条件下进行培养。
通过观察混合物中是否出现病毒滴度降低的现象来评价抗体的中和活性。
直接法主要包括限制性扩增试验和滴度法。
限制性扩增试验是将待测抗体与一定数量的病毒在培养基中混合,培养一段时间后,根据是否形成病毒感染所需的细胞残留判断病毒的中和活性。
对于病毒的感染,细胞需要接受病毒的侵染并产生病毒感染所需的细胞影响。
如果抗体中和了病毒,细胞可幸免于此效应,而未与病毒感染严重依赖的细胞则不会受明显影响。
限制性扩增试验适用于高增殖病毒如乙型肝炎病毒、丙型肝炎病毒、人类免疫缺陷病毒等的中和活性评价。
滴度法是一种半定量评价方法,采用多步稀释法,通过判断其中一稀释度下病毒感染所需的细胞形成情况,确定中和活性。
滴度法可用于评价各类病毒和其他病原体的中和活性。
间接法则是在没有能产生明显形态变化的细胞影响的条件下,利用中和抗体对待测病毒的中和作用来检测。
在间接法中,待测抗体与特定病原体相混合,然后再与易受感染的细胞(一般来自动物体内)共同孵育。
处理一定时间后,通过检测细胞病原体感染情况,进而判断抗体的中和活性。
间接法主要包括荧光抗体附着性中和试验(FAVN)和放射性中和试验。
FAVN方法是一种常用的间接法,通过病毒与特异性荧光标记抗体的结合来检测。
该方法可以定性和定量评价抗体对病毒的中和活性。
在FAVN方法中,将病毒与去除抗原的细胞或重组表面抗原的细胞混合,之后加入待测抗体。
然后,用荧光素标记的第二抗体来检测是否存在病毒与抗体的结合情况。
如果抗体中和了病毒,病毒感染的细胞将不会显示病毒结合的荧光。
FAVN方法适用于狂犬病毒、禽流感病毒等的中和活性评价。
放射性中和试验是用放射性标记的病毒与待测抗体混合,然后通过膜过滤的方式来评价抗体的中和活性。
该方法通过检测病毒在细胞上的结合情况来确定抗体的中和能力。
放射性中和试验适用于中和活性评价如肺炎支原体、流感病毒等。

中和抗体的效价测定方法引言:中和抗体是一种能够与病原体结合并阻止其入侵宿主细胞的抗体。
对于评估中和抗体的效力,确定其效价是非常重要的。
本文将介绍几种常用的中和抗体效价测定方法。
一、细胞中和实验法细胞中和实验法是一种常见的测定中和抗体效价的方法。
该方法通过将病原体与中和抗体混合,然后与特定宿主细胞进行培养,观察细胞是否受到病原体的感染来评估中和抗体的效力。
这种方法可以定量测定中和抗体的效价,并且可以用于不同病原体的效价测定。
二、病毒中和实验法病毒中和实验法是一种常用的测定病毒中和抗体效价的方法。
该方法通过将病毒与中和抗体混合,然后与特定宿主细胞进行培养,观察细胞是否受到病毒的感染来评估中和抗体的效力。
这种方法可以定量测定中和抗体的效价,并且可以用于不同病毒的效价测定。
三、ELISA法ELISA法是一种常用的测定中和抗体效价的方法。
该方法通过将病原体与中和抗体混合,然后将混合物加入包含特定抗原的酶标板孔中,将抗体与抗原结合后,用酶标法检测酶活性来评估中和抗体的效力。
这种方法可以定量测定中和抗体的效价,并且可以用于不同抗原的效价测定。
四、中和试验法中和试验法是一种常用的测定中和抗体效价的方法。
该方法通过将病原体与中和抗体混合,然后将混合物加入宿主细胞中,观察细胞是否受到病原体的感染来评估中和抗体的效力。
这种方法可以定量测定中和抗体的效价,并且可以用于不同病原体的效价测定。
五、中和效力指数计算法中和效力指数计算法是一种常用的测定中和抗体效价的方法。
该方法通过将中和抗体与病原体进行反应,然后根据中和效果的程度来计算中和效力指数。
这种方法可以定量测定中和抗体的效价,并且可以用于不同病原体的效价测定。
结论:中和抗体的效价测定是评估中和抗体效力的重要方法。
细胞中和实验法、病毒中和实验法、ELISA法、中和试验法和中和效力指数计算法是常用的中和抗体效价测定方法。
在进行中和抗体效价测定时,应选择合适的方法和实验条件,以确保测定结果的准确性和可靠性。

实验八病毒学中和实验(NeutralizationTest of Virus)【实验目的】掌握病毒中和试验的基本原理、意义及方法。
掌握固定病毒—稀释血清法的操作步骤、计算方法及含义。
【实验原理】特异性抗病毒抗体(中和抗体)与相应的病毒作用后,可阻止病毒对敏感细胞的吸附和穿入,从而抑制了病毒的繁殖,使病毒失去感染性,即所谓病毒被“中和”。
中和试验是以测定病毒的感染力为基础,因此试验结果必须通过病毒的敏感动物、鸡胚或组织培养观察,以比较病毒被中和后的残余感染力。
【实验材料】(一)试剂1.脊髓灰质炎病毒:试验前经TCID50测定。
2.血清:抗病毒免疫血清、正常血清及待检血清(经56o C 30min灭活)。
3.Vero细胞、DMEM(二)器械细胞培养瓶、吸管、倒置显微镜【实验步骤】中和试验有两种方法,一种是固定病毒-稀释血清法,另一种是固定血清-稀释病毒法。
本试验介绍固定病毒-稀释血清法。
(一)用Hank’s液倍比稀释待检血清为1:4至1:128,每管量为0.5ml。
(二)每管均加入0.5ml病毒液(100TCID50/0.1ml),充分混匀,37o C水浴1h。
(三)选择已长好的单层细胞,用Hank’s 液洗2次,分别接种上述中和物0.2ml,每个稀释度接种4瓶,置37o C 温箱1h。
(四) 补足维持液至4ml,置37o C培养,逐日观察细胞病变,并记录结果。
一般观察1周左右。
如为出现细胞病变较慢的病毒,应延长观察时间。
(五)结果判断:50%血清中和终点为能保护50%细胞不产生病变的血清最高稀释度,即为中和终点,按Reed-Muench法计算结果,见表1-8-1。
表1-8-1 50%血清中和终点的计算血清稀释度细胞病变瓶数/总瓶数细胞病变分布累计比数百分比(%)(+)瓶(-)瓶(+)↓(-)↑1:4 (10-0.6)1:8 (10-0.9)1:16(10-1.2)1:32(10-1.5)1:64(10-1.8)1:128(10-2.1)0/40/40/41/43/44/41344443114816128410/160/120/81/54/58/82080100由表可知,能保护50%细胞不发生病变的血清最高稀释度,在1:32~1:64。

中和抗体测定方法
中和抗体测定方法是一种可以用来检测病毒感染的方法。
中和抗体是一种特殊的抗体,它可以与病毒结合并阻止病毒在细胞内或体内复制和感染其他细胞。
因此,中和抗体的测定可以用来判断病毒是否在体内,以及人体是否对病毒具有抵抗力。
中和抗体测定通常采用体外细胞培养法或小鼠腹腔注射法,以获取中和抗体。
常用的中和抗体测定方法包括中和试验、酶联免疫吸附法和荧光中和抗体测定法。
这些方法对于病毒感染的诊断和治疗非常重要,可以有效地指导临床医生制定合理的治疗方案。
但是,中和抗体测定方法也存在一些局限性,例如需要耗费大量时间和资源进行实验,同时也存在一定的误差。
因此,在实际应用中需要综合考虑各种因素,选择最适合的中和抗体测定方法。
- 1 -。

病毒中和试验测定法1.固定病毒稀释血清法(α法) 本法用于抗血清的中和价。
试验需先滴定病毒毒价,试验时将其稀释成每一单位剂量含200个TCID50,再将待检血清倍比稀释加等量200个TCID50/ml的病毒液,混匀后37℃1h,每一稀释度接种24孔细胞培养板4孔,每孔0.2ml。
5%C02培养箱培养一定时间后,记录出现CPE孔数,以不出现CPE数和接种数的比为中和比值。
按Karber法计算中和价。
其公式如下:Log TCID50=L+d(S-0.5)(TCID50用对数计算,L为病毒最低稀释度的对数。
d为组距,即稀释系数,在10倍系列稀释则为-1,S为各组CPE与接种数比值之和)50%中和试验举例L=-1,d=-0.3,S=4/4+4/4+4/4+4/4+2/4=4.5代入Karber公式:LogND50= -1-0.3*(4.5-0.5)=2.2该抗血清ND50(半数中和单位)为10-2.2,即1/160,则其中和价为160 ND50/ml,可以简写成160。
2.固定血清稀释病毒法(β法) 本法用于测定抗血清的中和指数。
将病毒原液10倍系列稀释,分列于2排无菌管,第一排加等量正常血清(对照组);第二排加待检血清(中和组),混匀后,置37℃1h,分别接种细胞板孔(或鸡胚、实验动物)进行培养,记录CPE(鸡胚、动物死亡数),计算TCID50(或LD50),按下式计算中和指数。
中和组TCID50(或LD50)中和指数= ————————————对照组TCID50(或LD50)查反对数,即得该待检血清的中和指数。
通常中和指数>50者判为阳性,10-49为可疑,<10者为阴性。
例如:对照组滴度的LD=10-6.550=10-4.5中和组滴度的LD50中和指数=10(6.5-4.5)=102.0=100中和指数的对数Log=Log100=2.0一般来说,以10倍稀释进行滴度测定,Log10=1。

中和试验根据抗体能否中和病毒的感染性而建立的免疫学实验称为中和试验。
中和试验极为特异性和敏感,主要用于病毒感染的血清学诊断、病毒分离株的鉴定、不同病毒株的抗原关系研究、疫苗免疫性的评价、免疫血清的质量评价和测定动物血清抗体的检测等。
中和试验的基本过程是,先将抗血清与病毒混合,经适当时间作用。
然后接种于宿主系统检测混合液中的病毒感染力。
宿主系统可以是鸡胚、动物或细胞培养,根据病毒性质而定,目前大多采用细胞中和试验。
最后根据其产生的保护效果差异,可判断该病毒释放已被中和,并根据一定的方法计算出中和的程度(中和指数),即代表抗体的效价。
根据测定方法的不同,中和试验主要有两种。
一是测定能使动物或细胞死亡数目减少至50%(半数保护率,PD50)血清稀释度,即终点法中和实验。
二是测定是病毒在细胞上形成的空斑数目减少至50%时的血清稀释度,即空斑减少法中和试验。
毒素和抗毒素亦可进行中和试验,其方法与病毒的中和试验基本相同。
终点法中和试验本法是滴定使病毒感染力减少至50%的血清中和效价或中和指数。
有固定病毒稀释血清及固定血清稀释病毒两种滴定方法。
固定病毒稀释血清法将抑制的病毒量固定,血清作倍比稀释,常用于测定抗血清的中和抗体效价。
病毒的毒价测定毒力或毒价单位过去多用最小致死量(MLD),即病毒接种实验动物后在一定时间内全部致死的最小病毒剂量。
此法比较简单,但由于剂量递增与死亡率递增的关系不是一条直线,而是呈S形曲线,在愈接近100%死亡时,对剂量的递增愈不敏感。
而死亡率愈接近50%时,剂量与死亡率呈直线关系,故现基本上采用半数致死量(LD50)表示毒价单位。
而且LD50的计算应用了统计学方法,减少了个体差异的影响,因此比较正确。
以感染发病作为指标的,可用半数感染量(ID50);以体温反应作指标者,可用半数反应量(RD50)。
用鸡胚测定时,可用鸡胚的半数致死量(ELD50)或鸡胚半数感染量(EID50);在细胞培养上测定时,则用组织培养半数感染量(TCID50)。

中和试验一.定血清-稀释病毒法(病毒中和试验)1.病毒毒价的测定毒价单位:衡量病毒毒价(毒力)的单位过去多用最小致死量(MLD),即经规定的途径,以不同的剂量接种试验动物,在一定时间内能致全组试验动物死亡的最小剂量。
但由于剂量的递增与死亡率递增不呈线性关系,在越接近100%死亡时,对剂量的递增越不敏感。
而一般在死亡率越接近50%时,对剂量的变化越敏感,故现多改用半数致死量(LD50)作为毒价测定单位,即经规定的途径,以不同的剂量接种试验动物,在一定时间内能致半数试验动物死亡的剂量。
用鸡胚测定时,毒价单位为鸡胚半数致死量(ELD50)或鸡胚半数感染量(EID50)。
用细胞培养测定时,用组织细胞半数感染量(TCID50)。
在测定疫苗的免疫性能时,则用半数免疫量(IMD50)或半数保护量(PD50)。
(1) LD50的测定(以流行性乙型脑炎病毒为例)。
测定方法:将接种病毒,并已发病濒死的小鼠,无菌法取脑组织,称重、加稀释液充分研磨,配制成10-1悬液,3 000r/min离心20分钟,取上清液,以10倍递次稀释成10-1、10-2、10-3 ……10-9,每个稀释度分别接种5只小鼠,每只脑内注射0.03ml,逐日观察记录各组的死亡数。
表2-24LD50的计算(接种剂量为0.03ml)病毒稀释度接种鼠数活鼠数死鼠数积累总计死亡比死亡率(%)10-4 5 0 5 0 15 15/15 10010-5 5 0 5 0 10 10/10 10010-6 5 1 4 1 5 5/6 8310-7 5 4 1 5 1 1/6 1710-8 5 5 0 10 0 0/10 010-9 5 5 0 15 0 0/15 0LD50的计算:按Reed和Muench氏法计算。
高于50%的死亡分数-50%83%-50%距离比例= ────────────────────= ──────= 0.5高于50%的死亡百分数-低于50%的死亡百分数83%-17%LD50的对数=高于50%病毒稀释度的对数+距离比例×稀释系数的对数本例高于50%病毒稀释度的对数-6,距离比例为0.5,称释系数的对数为-1。

细胞培养中和试验TCID50原理方法细胞培养是一种在体外条件下培养和增殖细胞的技术。
细胞培养也被广泛应用于药物筛选、病毒检测和细胞生物学研究中。
其中,中和试验和TCID50是两种常用的方法,用于检测和评估病毒感染。
中和试验是通过将病毒与抗体进行反应,以评估抗体对病毒感染的阻断作用。
该方法主要包括以下步骤:1.准备病毒和抗体:选择所需的病毒株,并通过细胞培养等方法进行增殖。
准备足够的病毒悬液。
同样,选择合适的抗体,并制备一定浓度的抗体溶液。
2.混合病毒和抗体:将一定量的病毒溶液与一定浓度的抗体溶液混合。
混合后,使其在适当的温度和时间下进行反应。
3. 检测病毒感染:将混合物加入到适合病毒感染的细胞培养板中。
细胞培养板可使用动物细胞,如Vero细胞。
细胞在感染后,将会出现病毒感染的特征,如细胞破裂或形成病毒斑点。
4.评估感染程度:观察细胞培养板中的感染程度,并与对照组进行比较。
能够有效阻断病毒感染的抗体,将会降低病毒感染的程度。
TCID50(50%组织细胞感染量)是一种用于估算病毒颗粒浓度的方法。
该方法主要包括以下步骤:1.制备10倍稀释液:首先,取一定量的病毒悬液,并添加到稀释液中以制备10倍稀释液。
逐步将病毒悬液依次稀释。
2.感染细胞:将稀释后的病毒悬液添加到含有细胞的孔板中。
通常,每个浓度的病毒溶液都会制备多个重复,并有一个对照组。
3.检测细胞感染:观察细胞在病毒感染后的变化。
可以通过显微镜观察,或使用染色方法来检测感染程度。
4.计算TCID50:根据对照组和感染组的细胞变化情况,使用统计学方法计算出TCID50值。
TCID50值代表在一定稀释度下,使50%的细胞感染的病毒颗粒浓度。
通过中和试验和TCID50方法,可以定量评估病毒和抗体之间的相互作用,并研究感染和抗感染机制。
此外,这些方法还可以用于病毒治疗和疫苗研发中的效力评估。
病毒中和试验测定法
1.固定病毒稀释血清法(α法) 本法用于抗血清的中和价。
试验需先滴定病毒
毒价,试验时将其稀释成每一单位剂量含200个TCID
50
,再将待检血清倍比稀释
加等量200个TCID
50
/ml的病毒液,混匀后37℃1h,每一稀释度接种24孔细胞
培养板4孔,每孔。
5%C0
2
培养箱培养一定时间后,记录出现CPE孔数,以不出现CPE数和接种数的比为中和比值。
按Karber法计算中和价。
其公式如下:
Log TCID
50
=L+d()
(TCID50用对数计算,L为病毒最低稀释度的对数。
d为组距,即稀释系数,在10倍系列稀释则为-1,S为各组CPE与接种数比值之和)
50%中和试验举例
每一接种剂量含病毒 100TCID50或 100LD50或100EID50或100ID50
L=-1,d=,S=4/4+4/4+4/4+4/4+2/4=
代入Karber公式:LogND
50= -1-* 该抗血清ND
50
(半数中和单位)为,即1/160,
则其中和价为160 ND
50
/ml,可以简写成160。
2.固定血清稀释病毒法(β法) 本法用于测定抗血清的中和指数。
将病毒原液10倍系列稀释,分列于2排无菌管,第一排加等量正常血清(对照组);第二排加待检血清(中和组),混匀后,置37℃1h,分别接种细胞板孔(或鸡胚、实验
动物)进行培养,记录CPE(鸡胚、动物死亡数),计算TCID
50(或LD
50
),按下
式计算中和指数。
中和组TCID
50(或LD
50
)
中和指数= ————————————
对照组TCID
50(或LD
50
)
查反对数,即得该待检血清的中和指数。
通常中和指数>50者判为阳性,
10-49为可疑,<10者为阴性。
例如:
对照组滴度的LD
=
50
=
中和组滴度的LD
50
中和指数=10 中和指数的对数Log=Log100=
一般来说,以10倍稀释进行滴度测定,Log10=1。
因此小于10(1<Log)则认为中和指数无意义,10-50之间的值()则为可疑,超过50((Log>则是有意义的.。