过氧化氢制取氧气教程文件
- 格式:ppt
- 大小:1.32 MB
- 文档页数:27

【同步实验课】 过氧化氢制取氧气实验【实验目的】1.学习实验室用过氧化氢制取氧气的方法。
2.了解化学反应需要一定的条件,知道催化剂对化学反应的重要作用。
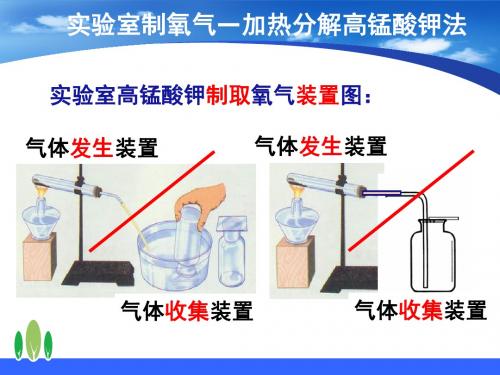
【实验仪器】锥形瓶、分液漏斗、双孔橡胶塞、胶皮管、玻璃导管、集气瓶、水槽、玻璃片、弹簧夹、火柴【实验试剂】 过氧化氢溶液、二氧化锰【实验步骤】 (1)连接装置并 。
(2)向锥形瓶中加入 。
(3)塞好带有分液漏斗和导管的双孔塞。
(4)向分液漏斗中加入 。
(5)滴加液体:打开分液漏斗活塞,慢慢滴加过氧化氢溶液。
(6)用排水集气法收集。
1. 反应原理(1)文字表达式: (2)符号表达式:2. 催化剂(1)定义:在化学反应中能 其他物质的化学反应速率,而本身的 和 在反应前后都没有发生变化的物质。
(2)特点:“一变两不变”①一变: ;(可以加快也可以减慢) ①两不变: 。
(物理性质可以改变) 【注意】①催化剂 (填“能”或“不能”)改变生成物的质量; ①催化剂 (填“能”或“不能”)控制反应的发生与停止;①同一化学反应 (填“一定”或“不一定”)只有一种催化剂;同一物质可以在 的化学反应中起催化作用。
(3)验证某物质是催化剂的方法①改变反应速率:设计 实验,观察加入该物质前后化学反应速率是否改变。
01实验梳理 02实验点拨 03典例分析 04对点训练 05真题感悟①反应前后质量不变:称量该物质在的质量是否发生变化。
①化学性质不变:一般进行实验,观察重新加入反应物的现象和原来的现象是否相同。
3. 分液漏斗检查装置气密性的方法方法①:连接装置后,先关闭分液漏斗活塞,再将导管的末端放入水中,双手紧握锥形瓶,若,松开手后导管中形成一段水柱,说明装置气密性良好。
方法①:连接装置后,夹紧止水夹,关闭分液漏斗活塞,向分液漏斗中加水,打开活塞,一段时间后,,说明装置气密性良好。
4.发生装置的评价1.(2023春·湖南永州·九年级校考期中)下列有关催化剂的说法正确的是()A.在化学反应中催化剂只能加快其他物质的反应速率B.二氧化锰是催化剂C.催化剂只能改变化学反应速率,不能增加或减少生成物的质量D.要使过氧化氢溶液分解出氧气必须加入二氧化锰,否则就不能发生分解反应2.(2023秋·全国·九年级随堂练习)小乐利用如图所示装置和药品进行实验,下列有关该实验的分析正确的是()A.实验中的反应物是过氧化氢和二氧化锰B.小乐想多次重复该实验以获得普遍规律,但是实验中的二氧化锰不能重复利用C.由于反应时快速产生氧气使得集气瓶内压强不断增大,充气气球会变小,红墨水会左移D.装有过氧化氢溶液的仪器是长颈漏斗3.(2023春·山东滨州·九年级统考期中)15%的H2O2溶液在二氧化锰催化作用下会剧烈反应产生O2.实验室欲利用15%的H2O2溶液制取O2,则下列装置中,仪器选择和药品放置最合理的是()A.B.C.D.4.(2023秋·福建泉州·九年级统考期末)如图所示,用酵母粉催化分解双氧水进行氧气的制取和检验的家庭小实验,下列说法正确的是()A.触摸瓶身明显发烫,说明该反应放热B.塑料瓶膨胀,只是因为反应产生气体C.将燃着木条伸入瓶内检验有氧气生成D.加入酵母粉会使生成氧气的质量增多5.(2023秋·湖南岳阳·九年级校联考期末)如图是过氧化氢在催化剂的作用下,分解放出大量氧气的实验装置,下列现象正确的是()A.气球胀大,红墨水左移B.气球缩小,红墨水右移C.气球胀大,红墨水右移D.气球缩小,红墨水左移6.(2023·安徽芜湖·校考模拟预测)下图是实验室制取气体的常用装置,请回答下列问题。

过氧化氢制取氧气的步骤
氧气是生命存在的必要物质,利用过氧化氢制取氧气的方法从技术上说,不仅
仅是在实验室里可以实现,也可以在家里居家环境自行实现,现在我们就一起分析一下利用过氧化氢制取氧气的步骤:
首先,准备工作包括:
1、准备好实验器材,实验材料,如重酸(如HCl)、氨水(NH3)、硼酸水溶液等,以及取氧容器,如玻璃瓶等;
2、准备配好H2O2溶液,应用在过氧化氢氧化反应中;
3、准备好接氧用的橡胶管,以及用于收集氧气的容器,如瓶子;
其次,过氧化氢的制备及取氧流程:
1、将重酸(如HCl) 、氨水(NH3)、硼酸水溶液混合,将混合溶液从实验室的
滴定架中滴定进去;
2、将混合液中的HCl溶解后,再加入H2O2;
3、将可溶性混合液和非溶性混合液放入立方体容器中;
4、把橡胶管插入容器,并用玻璃瓶容器收集产生的气泡;
5、等小颗粒结晶完全溶解时,会出现白色烟气,并有助于氧气产生;
6、等气泡收集到瓶中,便可取得氧气;
最后,实验完成后,需要注意几点:
1、实验室要保持通风良好的环境;
2、过氧化氢具有强烈的氧化性和强毒性,所以应做到定期检查,以免出现意
想不到的意外;
3、实验时,要多留意安全操作,如穿防腐手套,工作室用木头工具等;
4、收集好取氧容器,并保存于实验室合适的位置;
以上就是通过过氧化氢制取氧气的步骤,本实验的安全性和可行性较高,但需
要加强安全性,不能忽略任何安全操作,以免出现意外。
总之,认真对待这个过程,可以顺利的制取出氧气,真正的实现利用氧气的目的。




过氧化氢溶液制取氧气的实验步骤一、实验目的:通过过氧化氢溶液的分解,制取氧气。
二、实验原理:过氧化氢(H2O2)在催化剂的作用下可以分解成氧气(O2)和水(H2O)。
三、实验器材:1. 过氧化氢溶液(浓度约为3%)2. 水槽或水浴3. 水银封管4. 导管5. 水平木板6. 镊子7. 清水四、实验步骤:1. 准备实验器材,确保器材干净、无水迹。
2. 将水槽或水浴中装满适量的水。
3. 将水银封管的一端放入水中,确保封管的另一端露出水面。
4. 使用镊子将一小块过氧化氢固体放入水银封管中。
5. 将导管一端插入水银封管中,另一端放入水槽或水浴中。
6. 等待一段时间,观察水银封管内的气体变化。
7. 当水银封管内的气体排出后,将导管的另一端移至水槽或水浴外的空气中。
8. 在导管的另一端放有清水的容器,以收集制取的氧气。
9. 继续观察气体的变化,直到氧气收集完毕。
五、实验注意事项:1. 实验过程中要小心操作,避免发生意外。
2. 实验室中要保持通风良好,防止氧气积聚导致安全问题。
3. 需要使用适量的过氧化氢溶液,过多或过少都会影响实验结果。
4. 水银封管要保持垂直,并且封管露出水面的部分要足够长,以确保气体排出顺利。
5. 在实验过程中要注意观察气体的变化,及时调整导管的位置。
六、实验结果与分析:1. 实验过程中,过氧化氢溶液分解生成氧气。
2. 通过导管将氧气收集到水中,观察到水中出现气泡,气泡的体积逐渐增大。
3. 收集的气泡经过一段时间后,停止产生,说明氧气已经完全制取。
4. 实验结果符合理论预期,证明了过氧化氢溶液可以制取氧气。
七、实验总结:通过本实验,我们成功地制取了氧气。
实验过程中,我们学习到了过氧化氢的分解反应,并通过实验验证了该反应的产物为氧气。
同时,我们也学会了一些实验技巧和注意事项,提高了实验操作的能力。
这个实验不仅增加了我们对化学反应的了解,也加深了我们对氧气的认识。


分解过氧化氢溶液制氧气过氧化氢溶液制取氧气分解过氧化氢溶液制氧气:分解过氧化氢制取氧气实验活动报告氧气的实验室制取与性质报告姓名_____学校_____班级_____【实验名称】氧气的实验室制取与性质(分解过氧化氢制取氧气)【实验目的】1.学习实验室制取氧气的方法。
2.加深对氧气性质的认识。
【实验用品】锥形瓶、双孔橡胶塞、长颈漏斗、集气瓶、玻璃导管、胶皮管、水槽、二氧化锰,过氧化氢溶液、木炭、澄清石灰水、细铁丝。
【实验步骤、现象及结论】分解过氧化氢溶液制氧气:分解过氧化氢制取氧气实验的改进分解过氧化氢制取氧气实验的改进1.原实验失败的原因分析(1)过氧化氢在没有催化剂的情况下进行分解的速率是非常小的,即使在加热的情况下,其分解速率仍然非常小,想让其在短时间内分解出足以使带火星的木条复燃的氧气是困难的。
(2)原实验采用的加热方式是使用酒精灯直接加热,这样虽然温度高,能加速过氧化氢的分解,但同时使水蒸发产生水蒸气,随氧气一起放出,这必然会使带火星的木条很快熄灭,使实验现象与预期效果背道而驰。
2.分解过氧化氢实验的改进基于上述原因,笔者认为取消此实验应为上策。
如果要追求在加热与不加热情况下过氧化氢分解的效果不同,笔者也对其进行了改进。
方法A:(1)将5%的过氧化氢溶液改为20%的过氧化氢溶液。
(2)如图,在加热过氧化氢产生的氧化装置后面增加一个除水装置,消除水蒸气促使火星熄灭的因素,干燥剂可以使用浓硫酸,也可以使用碱石灰。
方法B:(1)将5%的过氧化氢溶液改为20%过氧化氢溶液。
(2)如图所示,在盛放过氧化氢溶液的试管塞上一个带导管的塞子,其目的是使水蒸气重新冷凝,并防止产生的氧气在流动的空气中散失。
(3)使用水浴中热,防止水沸腾产生大量水蒸气。
水浴温度在80 ℃时为宜。
(4)使用水浴加热10分钟,然后将试管从水浴中取出冷却,取下橡皮塞,用带火星的木条伸入试管进行检验,并用带火星的木条伸入未经加热的过氧化氢溶液的试管进行对比。

课题:第四单元第三节氧气(第1课时)一、课标要求:1、通过对氧气的实验室制法的探究,得出实验室制取氧气的最佳方法;.对催化剂的概念有一定的理解。
2、初步掌握实验室制取氧气的方法、反应原理、装置二、学情分析:学生已经知道了氧气的某些用途方面的知识,比如:氧气可以供给呼吸和支持燃烧等。
对于“在实验室里如何制取氧气”的问题还不了解。
认识和解决这些问题不但是课标要求的,也是学生期望学习的。
三、学习目标:知识与技能:1、通过对氧气的实验室制法的探究,得出实验室制取氧气的最佳方法;.对催化剂的概念有一定的理解。
2、初步掌握实验室制取氧气的方法、反应原理、装置和操作。
过程与方法:对比较典型的题目掌握一定的解题方法和技巧。
情感、态度与价值观:通过本节课学习,就学会了观察实验、准确描述实验现象、分析实验现象、活的结论、乐于主动参与实验探究。
四、知识点(重点、难点):重点:实验室制取氧气的方法、反应原理、装置和操作难点:通过对氧气的实验室制法的探究,得出实验室制取氧气的最佳方法;.对催化剂的概念有一定的理解。
五、实验准备:多媒体、实验所需仪器及药品六、学习过程:或演示实验:制取一瓶氧气实验步骤:1、组装并检查装置的气密性2、打开瓶塞,向锥形瓶中加入0.5克(约半药匙)二氧化锰,并塞紧瓶塞3、将集气瓶装满水,从侧面轻推盖上毛玻璃片,翻转后,扣在水槽中;4、向分液漏斗中倒入过氧化氢溶液,打开活塞。
5、在水底将毛玻璃片盖紧,取出,正放;讨论:如何检验一瓶气体就是氧气排水法收集氧气向上排空气法收集氧气观察实验交流反思,师生总结,分液漏斗的优点,长颈漏斗的用法。
学生回答:将带火星的木条七、板书设计:§4.3 氧气一、氧气的实验室制法药品:过氧化氢、二氧化锰装置:固液不加热型二、反应原理:过氧化氢水+氧气排水法:氧气不易溶于水三、收集方法:向上排空气法:氧气的密度比空气的大教学反思:本节课是学生练习了实验操作后接触到的第一个系统的、综合的气体制取实验,是学生具体地从化学的角度出发,学习和研究制备物质的开始。
