第13章过渡元素(一)
- 格式:ppt
- 大小:822.50 KB
- 文档页数:48



第13章 过渡元素 习题参考答案1.解:(1) TiO 2+ H 2SO 4(浓) −→−∆TiOSO 4+ H 2O (2) TiCl 4 + 3H 2O → H 2TiO 3↓ + 4HCl↑ (3) VO 43-+ 4H +(过量) → VO 2+ +2H 2O(4) 2VO 2++ SO 32-+ 2H + → 2VO + +SO 42-+H 2O (5) 5VO 2++ MnO 4-+H 2O→ 5VO 2+ + Mn 2++ 2H + (6)V 2O 5 + 6H + + 2Cl - → 2VO 2+ + Cl 2↑+ 3H 2O(浓HCl)(7) V 2O 5 + 6OH -−→−冷2VO 43- + 3H 2O V 2O 5 + 2OH -−→−热2VO 3- + H 2O 2.解: 最终产物分别为VO 2+、V 3+ 、V 2+3.解:(1) 2[Cr(OH)4]- + 3Br 2+ 8OH -→ 2CrO 42- + 6Br -+ 8H 2O(浓HCl)(2) Cr 2O 72- + 3H 2S+ 8H + → 2 Cr 3+ + 3S ↓+ 7H 2O (3) Cr 2O 72-+ 6I -+ 14H + → 2 Cr 3+ + 3I 2 + 7H 2O (4) Cr 2O 72- + 14H + + 6Cl - →2 Cr 3++ 3Cl 2↑ + 7H 2O(浓HCl)(5) Cr 2O 3+ 3K 2S 2O 7+ 6H + → 2Mn 2+ +5O 2↑+ 8H 2O (6) 2Cr 3++ 3S 2-+ 6H 2O → 2 Cr(OH)3↓+ 3H 2S ↑ 4.解:5.解: f K ([Fe(bipy)3]2+)=4.32⨯1018; 即[Fe(bipy)3]2+更稳定 6.解:A 是K 2MnO 4(1)3 MnO 42- + 2CO 2 → MnO 2↓+ 2MnO 4- + 2CO 32-(A) (B) (C) MnO 2 + 4HCl(浓) → MnCl 2 + Cl 2↑+ 2H 2O (B) (D)(2)3Mn 2+ + 2MnO 4- + 2H 2O → 5MnO 2↓ + 4H +(C) (B)Cl 2 + 2MnO 42- → 2MnO 4- + 2Cl - (D) (A) (C) 7.解:(1) 2MnO 4- + 16H + + 10Cl - → 2Mn 2+ +5Cl 2↑+ 8H 2O(浓HCl)(2) 2MnO 4- + 3NO 2- + H 2O → 2MnO 2↓+ 3NO 3- + 2OH -(3) 2Mn 2+ + 5NaBiO 3 + 14H + → 2MnO 4- + 5Bi 3+ + 5Na + + 7H 2O (4) 2MnO 4- + NO 2- + 2OH - → 2MnO 42-+ NO 3- + H 2O (5) 2MnO 4- + 5H 2O 2 + 6H + → 2Mn 2+ +5O 2↑+ 8H 2O 8.解:此棕黑色粉末为MnO 2。

第一过渡元素二铁钴镍实验报告一、引言二铁钴镍合金是一种重要的金属材料,具有高强度、高韧性、高温稳定性等优点,被广泛应用于航空、航天、汽车等领域。
本实验旨在制备二铁钴镍合金,并研究过渡元素对合金性能的影响。
二、实验方法1.实验材料:铁、钴、镍粉末。
2.实验设备:熔融法制备设备、高温炉、电子显微镜、扫描电子显微镜等。
3.实验步骤:(1)将铁、钴、镍粉末按一定比例混合均匀。
(2)将混合粉末放入熔融法制备设备中,在氩气氛围下进行熔融处理,保持温度为1650℃,时间为2h,使其充分熔融混合。
(3)将熔融合金放入高温炉中,在氩气氛围下进行加热处理,升温速度为5℃/min,将温度升至1000℃保持10h,随后降温处理。
(4)用电子显微镜和扫描电子显微镜对制备的二铁钴镍合金进行形貌和组织结构分析。
三、实验结果经过制备和分析,得到的二铁钴镍合金的形貌和组织结构如下:1.形貌分析:合金表面呈灰黑色,略带光泽,无氧化现象,颗粒较细。
2.组织结构分析:经电子显微镜观察,发现合金中含有大量的球形和棒状的晶粒,晶粒大小约为1-10μm。
通过扫描电子显微镜,发现晶界清晰,无明显的孔洞、裂纹等缺陷。
四、实验分析二铁钴镍合金是由铁、钴、镍三种金属元素组成,其中铁为主要成分,钴和镍是过渡元素。
过渡元素的添加对合金的性能有重要的影响。
实验结果表明,制备的二铁钴镍合金表面光泽度高,无氧化现象,晶粒分布均匀,晶界清晰。
这表明合金制备工艺优良,达到了预期的效果。
钴和镍的添加可以提高二铁钴镍合金的热稳定性和耐腐蚀性,同时对其力学性能和磁性能也有影响。
在合金中添加适量的过渡元素,可以调节晶粒尺寸、组织结构和晶格畸变等因素,从而优化合金的性能。
五、结论本实验成功制备了二铁钴镍合金,并对其形貌和组织结构进行了分析。
实验结果表明,过渡元素的添加可以调节合金的性能,优化其力学性能和磁性能等。
通过本实验的研究,对二铁钴镍合金的制备和性能分析有了更加深入的认识,为进一步研究和应用该材料奠定了基础。

第一过渡系元素(一)(钛、钒、铬、锰)第一过渡系元素是指周期表中第3至第12族的元素,它们在化学性质上有相似之处。
其中,钛(Ti)、钒(V)、铬(Cr)和锰(Mn)是第一过渡系元素中的前四个元素,它们具有一些共通的特性,同时也存在一些区别。
本文将从以下几个方面来介绍这四个元素:元素性质、物理性质、化学性质以及地质应用。
一、元素性质1.钛(Ti)钛是一种质轻、高强度、高耐腐蚀性、抗疲劳性能好的金属。
它具有优异的机械性能,被广泛应用于航空、航天、化工、海洋开发等领域。
同时,钛也是一种生物医用材料,被用于制作人体骨骼支架、人造关节、人工心脏瓣膜等。
2.钒(V)钒是一种银白色金属,比铁硬但稍加工艺处理后可以获得良好的延展性和强度。
它还有广泛的应用,用于制造钢、化学试剂和合金等。
不仅如此,钒还是一种强化剂,在钢铁生产过程中起到重要的作用。
3.铬(Cr)铬是一种具有高度耐腐蚀性的银白色金属,它主要应用于不锈钢、电子元器件、航空航天、制药等领域。
除此之外,铬还是一种环保型材料,可以用于净水和净化技术。
4.锰(Mn)锰是金属元素中的一种,它是一种银灰色的金属,具有良好的延展性和韧性。
锰还是钢铁生产中的一种重要元素,可以增强钢的硬度和韧性。
二、物理性质钛是一种具有低密度和高强度的金属,密度为4.54克/厘米立方。
它具有较高的熔点(1668℃)和沸点(3287℃),同时也具有较高的热导率和电导率。
三、化学性质钛是一种化性非常稳定的金属,在常温下不会被大多数酸和碱腐蚀。
它可以与氧、氮、氢反应,产生相应的氧化物、氮化物和氢化物。
此外,钛还可以和卤素反应,如氯、溴和碘等,生成相应的卤化物,例如TiCl4、TiBr3等。
锰可以和许多元素和化合物发生反应。
它可以与氧、氯、酸、弱碱等反应,生成各种不同的化合物。
在大气环境下,锰会逐渐氧化形成氧化锰,该过程是一种蓝黑色的化学反应。
四、地质应用钒是一种重要的工业金属,在地球上的丰度较低,但在一些特定的矿物中含量较高。


过渡元素第一电离能
过渡元素是指元素周期表中第四周期至第七周期的d区元素,包括钛(Ti)、铜(Cu)、锌(Zn)等。
这些元素具有独特的电子结构,即存在部分填充的d轨道。
过渡元素的第一电离能是指从中性原子中移除一个价电子所需要的最小能量。
过渡元素第一电离能的一般规律如下:
1. 同一周期内,从左到右,第一电离能呈逐渐增加的趋势。
这是因为从左到右,原子核的正电荷增加,对外层电子的吸引力增强,因此需要更大的能量才能将电子从原子中移除。
2. 同一主族内,从上到下,第一电离能呈逐渐减小的趋势。
这是因为从上到下,原子半径增大,外层电子离核距离加大,核外电子所受到的库仑引力减小,因此需要较小的能量才能将电子从原子中移除。
3. 过渡元素的第一电离能通常高于相邻的主族元素。
这是由于过渡元素的最外层电子所处的能级较低,结合能较大,需要更多的能量才能将电子移除。
4. 同一过渡元素族内,第一电离能的变化趋势不太规律,主要受到电子亲和能、电子排斥等因素的影响。
过渡元素的第一电离能不仅反映了元素的化学性质,也与元素的许多物理性质密切相关,如熔点、沸点、导电性等。
因此,了解过渡元素第
一电离能的规律对于研究和理解这些元素的性质和应用具有重要意义。

元素周期表中的过渡元素元素周期表是化学中一张重要的“地图”,该表按照化学元素的原子序数,显示了各元素的基本信息和特性。
其中,过渡元素是周期表中的一类重要元素,具有特殊的电子排布和化学性质。
本文将从过渡元素的定义、周期表中的位置、特性以及应用等方面进行探讨。
一、过渡元素的定义过渡元素是指周期表中d区的元素,它们的d轨道电子不满足“2n^2”原则。
具体来说,过渡元素的外层电子排布为(n-1)d^1-10ns^1-2,其中n为外层电子壳层的主量子数。
过渡元素特有的电子排布使其具有独特的物理和化学性质。
二、周期表中的过渡元素过渡元素主要分布在周期表的d区,从第3周期开始,一直延伸到第7周期。
常见的过渡元素包括钛(Ti)、铁(Fe)、铜(Cu)、银(Ag)等,共有38个元素。
在周期表中,它们有着相似的电子排布和共同的化学性质。
三、过渡元素的特性1. 高熔点和高密度:过渡元素具有较高的熔点和密度,这归功于它们结构中复杂的d电子排布和较强的金属键。
2. 多样的氧化态:过渡元素的d电子容易参与化学反应,具有多样的氧化态。
例如,铁可以呈现+2、+3和+6等多种氧化态。
3. 彩色化合物:过渡元素的d电子能级跃迁引起了它们的彩色性质,使得许多过渡金属化合物呈现出各种各样的颜色。
4. 优良的催化性能:过渡元素广泛应用于催化反应中,其复杂的电子结构和多样的氧化态使其具有较强的催化活性和选择性。
四、过渡元素的应用1. 金属合金:许多金属合金中含有过渡元素,通过调节过渡元素的含量和种类,可以改变合金的硬度、强度和导电性等性质。
2. 催化剂:过渡元素广泛应用于化工和能源领域的催化反应中,如催化剂的合成、汽车尾气净化等。
3. 生物学:一些过渡元素在生物学中发挥重要的作用,如铁在血红蛋白中的载氧功能、锌在酶催化中的作用等。
4. 电子行业:许多过渡金属元素在电子行业中具有重要的应用,如铜用于导线、钛用于制造电池等。
综上所述,过渡元素是周期表中一类特殊的元素,具有独特的电子排布和化学性质。
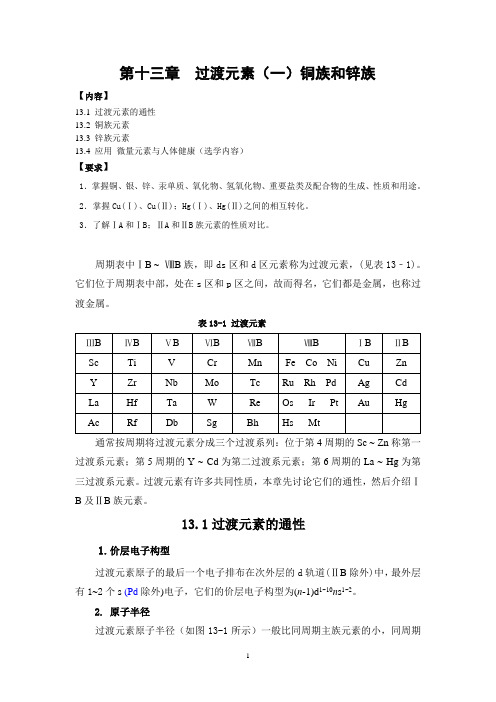
第十三章过渡元素(一)铜族和锌族【内容】13.1 过渡元素的通性13.2 铜族元素13.3 锌族元素13.4 应用微量元素与人体健康(选学内容)【要求】1.掌握铜、银、锌、汞单质、氧化物、氢氧化物、重要盐类及配合物的生成、性质和用途。
2.掌握Cu(Ⅰ)、Cu(Ⅱ);Hg(Ⅰ)、Hg(Ⅱ)之间的相互转化。
3.了解ⅠA和ⅠB;ⅡA和ⅡB族元素的性质对比。
周期表中ⅠB ~ⅧB族,即ds区和d区元素称为过渡元素,(见表13﹣1)。
它们位于周期表中部,处在s区和p区之间,故而得名,它们都是金属,也称过渡金属。
表13-1 过渡元素通常按周期将过渡元素分成三个过渡系列:位于第4周期的Sc ~ Zn称第一过渡系元素;第5周期的Y ~ Cd为第二过渡系元素;第6周期的La ~ Hg为第三过渡系元素。
过渡元素有许多共同性质,本章先讨论它们的通性,然后介绍ⅠB及ⅡB族元素。
13.1过渡元素的通性1.价层电子构型过渡元素原子的最后一个电子排布在次外层的d轨道(ⅡB除外)中,最外层有1~2个s (Pd除外)电子,它们的价层电子构型为(n-1)d1~10n s1~2。
2. 原子半径过渡元素原子半径(如图13-1所示)一般比同周期主族元素的小,同周期元素从左到右原子半径缓慢减小,到铜族前后又稍增大。
同族元素从上往下原子半径增大,但第二、第三过渡系(除ⅢB外)由于镧系收缩使同族元素原子半径十分接近,导致元素性质相似。
图13-1过渡元素原子半径3. 氧化态过渡元素有多种氧化态,因其最外层s电子和次外层部分或全部d电子都可作为价电子参与成键,一般可由+2依次增加到与族数相同的氧化态(Ⅷ族除Ru、Os外,其它元素尚无Ⅷ氧化态),这种氧化态的显著特征以第一过渡系最为典型。
表13-2第一过渡系元素的氧化数(下划线表示常见的氧化态)由13-2表可看出随着原子序数的增加,氧化数先是逐渐升高,后又逐渐降低。
这种变化主要是由于开始时3d轨道中价电子数增加,氧化数逐渐升高,当3d轨道中电子数达到5或超过5时,3d轨道逐渐趋向稳定。






第十三章过渡元素13-1 过渡元素概述广义的过渡元素是指长式周期表中从ⅢB族到ⅡB的所有元素。
它们在长式周期表中位于s区元素和p区元素之间,因而称为过渡元素。
过渡元素单质都是金属,共分为四个系列。
第一过渡系:Sc→Zn;第二过渡系Y →Cd ;第三过渡系Lu →Hg;第四过渡系Lr→Uub。
13-1-1 过渡元素原子的特征一、价层电子构型为n-1)d1-10n s1-2。
二、原子半径变化规律1.过渡元素原子半径一般比同周期主族元素小2.同一周期元素从左到右原子半径缓慢减小,到铜族前后又稍增大。
3.同族元素从上往下原子半径增大,但五、六周期(除ⅢB)外由于镧系收缩使其同族元素原子半径十分接近,导致其元素性质相似。
13-1-2 单质的物理性质1.过渡金属外观多呈银白色或灰白色,有光泽。
2. 除钪和钛属轻金属外,其余均属重金属。
3.数过渡金属(ⅡB族元素除外)的熔点、沸点高,硬度大。
13-1-3 金属活泼性过渡金属在水溶液中的活泼性,可根据标准电极电势来判断。
1.第一过渡系金属,除铜外,Eθ(M2+/M)均为负值,其金属单质可从非氧化性酸中置换出氢。
2. 同一周期元素从左向右过渡,总的变化趋势是Eθ(M2+/M)值逐渐变大,其活泼性逐渐减弱。
3.同族元素(除Sc分族外)自上往下金属活泼性降低。
13-1-4 氧化数过渡元素除最外层s电子可以成键外,次外层d电子也可以部分或全部参加成键,所以过渡元素的特征之一是具有多种氧化数。
1.期从左到右,元素最高氧化数升高, ⅦB后又降低。
2.从上往下,高氧化数化合物稳定性增加3.过渡元素可形成氧化数为0、-1、-2、-3的化合物.13-1-5 非整比化合物过渡元素的另一个特点是易形成非整比(或称非化学计量)化合物。
13-1-6 化合物的颜色过渡元素所形成的配离子大都显色,这主要与过渡元素离子的d轨道未填满电子有关。
其中d0、d10构型的离子无色。
13-1-7 配合性和催化性一、元素容易形成配合物。


