无机材料科学基础答案第八章
- 格式:docx
- 大小:50.47 KB
- 文档页数:8

无机材料科学基础作业习题第一章晶体结构基础1-1 定义下述术语,并注意它们之间的联系和区别:晶系;点群;空间群;平移群;空间点阵1-2 简述晶体的均一性、各向异性、对称性三者的相互关系。
1-3 列表说明七个晶系的对称特点及晶体定向规则。
1-4 四方晶系晶体a=b,c=1/2a。
一晶面在X、Y.Z轴上的截距分别为2a, 3b 和6c。
给出该晶面的密勒指数。
1-5 在立方晶系中画出下列晶面:a)(001)b)(110)c)(111)1-6 在上题所画的晶面上分别标明下列晶向:a(210) b(111) c(101)1-7 立方晶系组成{111}单形的各晶面构成一个八面体,请给出所有这些晶面的密勒指数。
1-8 试在完整的六方晶系晶胞上画出(1012)晶面的交线及〔1120〕〔2113〕晶向,并列出{1012}晶面族中所有晶面的密勒指数。
1-9 a≠b≠c α=β=γ=90℃的晶体属什么晶系?a≠b≠c α≠β≠γ≠90℃的晶体属什么晶系?你能否据此确定这二种晶体的布拉维点阵?1-10 下图示正交面心格子中去掉上下底心后的结点排列情况。
以图中的形状在三维空间无限重复,能否形成一空间点阵?为什么?1 –11 图示单斜格子的(010)面上的结点排布。
试从中选出单位平行六面体中的a和c。
1 –12 为什么等轴晶系有原始、面心、体心而无底心格子?1 –13 为什么在单斜晶系的布拉维格子中有底心C格子而无底心B格子?1-14 试从立方面心格子中划分出一三方菱面体格子,并给出其晶格常数。
说明为什么造选取单位平行六面体时不选后者而选前者?1 –15 写出立方面心格子的单位平行六面体上所有结点的座标,注明其中哪些属于基本点。
1 –16 给出(111)面和(111)面交棱的晶棱符号。
1 –17 试证(123)(112)和(110)诸晶面属于同一晶带,并给出其晶带符号。
1-18 证明立方晶系〔111〕晶向垂直于(111)晶面。

《无机材料科学基础》习题和思考题第一章晶体1.球体按立方最紧密堆积方式堆积,取出立方晶胞,画出立方晶胞中的四面体空隙和八面体空隙的位置分布图。
2.用鲍林规则分析氧化镁晶体结构。
已知镁离子半径为0.65Å,氧离子半径为1.40Å。
(1)确定晶胞中质点的位置坐标;(2)计算每个晶胞中含氧化镁“分子”数,(3)已知晶胞常数a=4.20 Å,求氧化镁堆积系数和密度,(4)氧化镁晶体中最邻近的两个镁离子中心距为多少?次邻近的两个镁离子中心距为多少?最邻近和次邻近的两个氧离子中心距为多少?(5)画出氧化镁晶胞的(111)、(110)、(100)面的质点分布图并在图上标出氧离子的密排方向,求个面的面密度。
3.已知纤锌矿结构中存在两套硫离子和两套锌离子的六方底心格子,并已知锌离子填充在硫离子最紧密堆积体的四面体空隙中,现以一套硫离子的等同点为基准取六方晶胞,画出晶胞中的质点分布图,计算晶胞中所含式量分子数。
4.完成下表5. 六方最紧密堆积与四方最紧密堆积的堆积密度相同,为什么许多氧化物是以氧离子的立方最紧密堆积为基础,而较少以六方最紧密堆积为基础?6. 用鲍林规则分析镁橄榄石的结构:P48 图2-18(1)标记为50的Mg2+与哪几个氧离子配位形成[MgO6]八面体?写出O2+的标高;(2)标记为25的两个O2+与哪几个镁离子配位?写出Mg2+离子的标高;(3)标记为75的O2+离子与哪几个镁离子配位?写出Mg2+离子的标高;(4)标记为0和50的两个Mg2+的[MgO6] 八面体共用几个顶点?写出O2+的标高;(5)[SiO4] 和 [MgO6] 之间、[MgO6]和[MgO6] 八面体之间有那些连接方式?(6)镁橄榄石的晶胞是什么形状?计算晶胞中含有的式量分子数。
第二章晶体缺陷1.氧化镁为氯化钠型结构,氧化锂为反萤石型结构,在两种结构中氧离子都作立方最紧密堆积,为什么在氧化镁中主要的热缺陷是肖特基型,而在氧化锂中却是弗伦克尔型?萤石型结构的氧化物晶体中常见的热缺陷估计主要是什么类型?为什么?2.已知氯化钠晶体中肖特基缺陷形成焓为2.2ev,而氧化镁晶体中肖特基缺陷形成焓为6ev,试分别计算400℃时氯化纳晶体与氧化镁晶体中肖特基缺陷的浓度。

无机材料科学基础课后习题答案宋晓岚黄学辉版无机材料科学基础课程组第二章答案2-1略。
2-2(1)一晶面在x、y、z轴上的截距分别为2a、3b、6c,求该晶面的晶面指(2)一晶面在x、y、z轴上的截距分别为a/3、b/2、c,求出该晶面的晶面指数。
答:(1)h:k:l==3:2:1,∴该晶面的晶面指数为(321);(2)h:k:l=3:2:1,∴该晶面的晶面指数为(321)。
2-3在立方晶系晶胞中画出下列晶面指数和晶向指数:(001)与[],(111)与[],()与[111],()与[236],(257)与[],(123)与[],(102),(),(),[110],[],[]答:2-4定性描述晶体结构的参量有哪些?定量描述晶体结构的参量又有哪些?答:定性:对称轴、对称中心、晶系、点阵。
定量:晶胞参数。
2-5依据结合力的本质不同,晶体中的键合作用分为哪几类?其特点是什么?答:晶体中的键合作用可分为离子键、共价键、金属键、范德华键和氢键。
离子键的特点是没有方向性和饱和性,结合力很大。
共价键的特点是具有方向性和饱和性,结合力也很大。
金属键是没有方向性和饱和性的的共价键,结合力是离子间的静电库仑力。
范德华键是通过分子力而产生的键合,分子力很弱。
氢键是两个电负性较大的原子相结合形成的键,具有饱和性。
2-6等径球最紧密堆积的空隙有哪两种?一个球的周围有多少个四面体空隙、多少个八面体空隙?答:等径球最紧密堆积有六方和面心立方紧密堆积两种,一个球的周围有8个四面体空隙、6个八面体空隙。
2-7n个等径球作最紧密堆积时可形成多少个四面体空隙、多少个八面体空隙?不等径球是如何进行堆积的?答:n个等径球作最紧密堆积时可形成n个八面体空隙、2n个四面体空隙。
不等径球体进行紧密堆积时,可以看成由大球按等径球体紧密堆积后,小球按其大小分别填充到其空隙中,稍大的小球填充八面体空隙,稍小的小球填充四面体空隙,形成不等径球体紧密堆积。

第八章烧结过程8-1 名词解释:烧结烧结温度泰曼温度液相烧结固相烧结初次再结晶晶粒长大二次再结晶(1)烧结:粉末或压坯在低于主要组分熔点的温度下的热处理,目的在于通过颗粒间的冶金结合以提高其强度。
(2)烧结温度:坯体在高温作用下,发生一系列物理化学反应,最后显气孔率接近于零,达到致密程度最大值时,工艺上称此种状态为"烧结",达到烧结时相应的温度,称为"烧结温度"。
(3)泰曼温度:固体晶格开始明显流动的温度,一般在固体熔点(绝对温度)的2/3处的温度。
在煅烧时,固体粒子在塔曼温度之前主要是离子或分子沿晶体表面迁移,在晶格内部空间扩散(容积扩散)和再结晶。
而在塔曼温度以上,主要为烧结,结晶黏结长大。
(4)液相烧结:烧结温度高于被烧结体中熔点低的组分从而有液相出现的烧结。
(5)固相烧结:在固态状态下进行的烧结。
(6)初次再结晶:初次再结晶是在已发生塑性变形的基质中出现新生的无应变晶粒的成核和长大过程。
(7)晶粒长大:是指多晶体材料在高温保温过程中系统平均晶粒尺寸逐步上升的现象.(8)二次再结晶:再结晶结束后正常长大被抑制而发生的少数晶粒异常长大的现象。
8-2 烧结推动力是什么?它可凭哪些方式推动物质的迁移,各适用于何种烧结机理?解:推动力有:(1)粉状物料的表面能与多晶烧结体的晶界能的差值,烧结推动力与相变和化学反应的能量相比很小,因而不能自发进行,必须加热!!(2)颗粒堆积后,有很多细小气孔弯曲表面由于表面张力而产生压力差,(3)表面能与颗粒之间形成的毛细管力。
传质方式:(1)扩散(表面扩散、界面扩散、体积扩散);(2)蒸发与凝聚;(3)溶解与沉淀;(4)黏滞流动和塑性流动等,一般烧结过程中各不同阶段有不同的传质机理,即烧结过程中往往有几种传质机理在起作用。
8-3 下列过程中,哪一个能使烧结体强度增大,而不产生坯体宏观上的收缩? 试说明理由。
(1)蒸发-冷凝;(2)体积扩散;(3)粘性流动;(4)晶界扩散;(5)表面扩散;(6)溶解-沉淀解:蒸发-凝聚机理(凝聚速率=颈部体积增加)烧结时颈部扩大,气孔形状改变,但双球之间中心距不变,因此坯体不发生收缩,密度不变。

第7章扩散一、名词解释1.扩散:2.扩散系数与扩散通量:3.本征扩散与非本征扩散:4.自扩散与互扩散:5.稳定扩散与不稳定扩散:名词解释答案:一、扩散是指在梯度的作用下,由于热运动而使粒子定向移动的过程二、扩散通量:单位时间内通过单位面积粒子的数目扩散系数:单位浓度梯度下的扩散同俩个三、本征扩散:由热缺陷所引起的扩散非本征扩散:由于杂质粒子的电引入而引起的扩散四、自扩散:原子或粒子在本身构造中的扩散互扩散:两种的扩散通量大小相等,方向相反的扩散五、稳定扩散:单位时间内通过单位面积的粒子数一定不稳定扩散:单位面积内通过单位面积的粒子数不一定二、填空与选择1.晶体中质点的扩散迁移方式有:、、、和。
2.当扩散系数的热力学因子为时,称为逆扩散。
此类扩散的特征为,其扩散结果为使或。
3.扩散推动力是。
晶体中原子或离子的迁移机制主要分为两种:和。
4.恒定源条件下,820℃时钢经1小时的渗碳,可得到一定厚度的外表碳层,同样条件下,要得到两倍厚度的渗碳层需小时.5.本征扩散是由而引起的质点迁移,本征扩散的活化能由和两局部组成,扩散系数与温度的关系式为。
6.菲克第一定律适用于,其数学表达式为;菲克第二定律适用于,其数学表达式为。
7.在离子型材料中,影响扩散的缺陷来自两个方面:〔1〕肖特基缺陷和弗仑克尔缺陷〔热缺陷〕,〔2〕掺杂点缺陷。
由热缺陷所引起的扩散称,而掺杂点缺陷引起的扩散称为。
〔自扩散、互扩散、无序扩散、非本征扩散〕8.在通过玻璃转变区域时,急冷的玻璃中网络变体的扩散系数,一般一样组成但充分退火的玻璃中的扩散系数。
〔高于、低于、等于〕9.在UO2晶体中,O2-的扩散是按机制进展的。
〔空位、间隙、掺杂点缺陷〕填空题答案:1、易位扩散、环形扩散、空位扩散、间隙扩散、准间隙扩散2、1+〔δln γi 〕/〔δlnNi 〕<0、由低浓度向高浓度扩散、偏聚、分相3、化学位梯度、空位机制、间隙机制4、45、热缺陷、空位形成能、空位迁移能、)(RT Q D D -=e0 6、稳定扩散 、 x C D J ∂∂-= 、不稳定扩散、22x C D tC ∂∂=∂∂ 7、本征扩散、非本征扩散8、高于9、间隙四、试分析离子晶体中,阴离子扩散系数-般都小于阳离子扩散系数的原因。

材料科学基础西南科技大学智慧树知到答案2024年第一章测试1.选用材料应该遵循()原则。
A:工艺性能 B:使用性能 C:环境协调性 D:经济性答案:ABCD2.耐火材料是指耐火度不低于()℃的无机非金属材料。
A:1300 B:1000 C:1800 D:1580答案:D3.材料按其化学作用(或基本组成)分为:A:无机非金属材料 B:复合材料 C:金属材料 D:高分子材料(聚合物)答案:ABCD4.传统的无机非金属材料主要是指由SiO2及其硅酸盐化合物为主要成分制成的材料,包括:A:陶瓷 B:耐火材料 C:水泥 D:玻璃答案:ABCD第二章测试1.如果等大球体在空间形成密排六方结构,则按如下方式()的层序堆积。
A:ABBABB•••••• B:AABAAB•••••• C:ABCABC•••••• D:ABAB••••••答案:D2.在一个面心立方晶胞中,共存在()。
A:4个四面体空隙,8个八面体空隙 B:8个四面体空隙,4个八面体空隙C:8个四面体空隙,8个八面体空隙 D:4个四面体空隙,4个八面体空隙答案:B3.在一个密排六方晶胞中,晶胞的质点数为()。
A:2 B:8 C:6 D:4答案:C4.当6个等大的球体作面心立方堆积时,每个球周围形成的四面体空隙个数为( )。
A:12 B:6 C:2 D:18答案:C5.离子晶体的配位数决定主要取决于正、负离子半径比,当配位多面体为八面体时,正负离子的半径比()。
A:正负离子半径比应处于0.155~0.225范围 B:正负离子半径比应处于0.732~1.0范围 C:正负离子半径比应处于0.225~0.414范围 D:正负离子半径比应处于0.414~0.732范围答案:D6.在某MX离子晶体中,若其中的阴离子易被极化,则下列说法正确的是:()。
A:阴阳离子间距增大、配位数增加。
B:阴阳离子间距增大、配位数降低。
C:阴阳离子间距降低、配位数降低。
D:阴阳离子间距降低、配位数增加。

材料科学基础知到章节测试答案智慧树2023年最新长春理工大学绪论单元测试1.以下材料属于结构材料的是()参考答案:工程塑料2.以下材料属于功能材料的是()参考答案:激光晶体3.光学塑料属于无机非金属材料()。
参考答案:错4.应用在太阳能领域的GaAs成本高,这个不利于其大规模推广。
()参考答案:对5.判断以下哪些物质属于材料()参考答案:水泥;陶瓷1.晶胞的形状可以是?()参考答案:四方柱2.晶体是?()参考答案:具有格子构造的固体3.晶体的基本性质由晶体的格子构造决定的()。
参考答案:对4.晶体的对称性也是晶体异向性的体现()。
参考答案:对5.晶胞的形状可以是()。
参考答案:菱形柱;立方体;四方柱1.当不等价离子置换形成固溶体时,说法不正确的是()参考答案:补偿缺陷只能是阳离子空位。
2.关于非化学计量化合物的说法正确的是()参考答案:可以看作是高价化合物与低价化合物的固溶体。
3.两种晶体结构不同或相互取代的离子半径差别较大,只能生成有限固溶体。
()参考答案:对4.形成固溶体,对晶体性质的影响可以表现在提高材料的强度和硬度,一般置换式溶质原子的强化效果更显著。
()参考答案:对5.非化学计量化合物Zn1+x O,正确的说法是()参考答案:电导率随温度的升高而呈指数规律增加。
;Zn1+x O是一种n型半导体。
第三章测试1.当熔体组成不变时,随温度降低,低聚物数量?粘度?()参考答案:降低,增加2.硅酸盐熔体的粘度随O/Si降低而?随温度升高而?()参考答案:增大,降低3.高价金属氧化物加入硅酸盐熔体中,根据加入量的多少来判断对粘度的影响。
()参考答案:对4.氧化钙加入硅酸盐熔体中,会降低熔体的粘度。
()参考答案:错5.硅酸盐熔体中各种聚合程度的聚合物浓度(数量)受因素的影响有()。
参考答案:组成;温度第四章测试1.为提高固液界面的结合强度,不可以采取的方式是()参考答案:通过形成表面吸附膜,降低表面能,实现增加固液结合强度。

材料科学基础课后习题答案讲解简述一次键和二次键区别答:根据结合力的强弱可把结合键分成一次键和二次键两大类。
其中一次键的结合力较强,包括离子键、共价键和金属键。
一次键的三种结合方式都是依靠外壳层电子转移或共享以形成稳定的电子壳层,从而使原子间相互结合起来。
二次键的结合力较弱,包括范德瓦耳斯键和氢键。
二次键是一种在原子和分子之间,由诱导或永久电偶相互作用而产生的一种副键。
6、为什么金属键结合的固体材料的密度比离子键或共价键固体为高?答:材料的密度与结合键类型有关。
一般金属键结合的固体材料的高密度有两个原因:(1)金属元素有较高的相对原子质量;(2)金属键的结合方式没有方向性,因此金属原子总是趋于密集排列。
相反,对于离子键或共价键结合的材料,原子排列不可能很致密。
共价键结合时,相邻原子的个数要受到共价键数目的限制;离子键结合时,则要满足正、负离子间电荷平衡的要求,它们的相邻原子数都不如金属多,因此离子键或共价键结合的材料密度较低。
9、什么是单相组织?什么是两相组织?以它们为例说明显微组织的含义以及显微组织对性能的影响。
答:单相组织,顾名思义是具有单一相的组织。
即所有晶粒的化学组成相同,晶体结构也相同。
两相组织是指具有两相的组织。
单相组织特征的主要有晶粒尺寸及形状。
晶粒尺寸对材料性能有重要的影响,细化晶粒可以明显地提高材料的强度,改善材料的塑性和韧性。
单相组织中,根据各方向生长条件的不同,会生成等轴晶和柱状晶。
等轴晶的材料各方向上性能接近,而柱状晶则在各个方向上表现出性能的差异。
对于两相组织,如果两个相的晶粒尺度相当,两者均匀地交替分布,此时合金的力学性能取决于两个相或者两种相或两种组织组成物的相对量及各自的性能。
如果两个相的晶粒尺度相差甚远,其中尺寸较细的相以球状、点状、片状或针状等形态弥散地分布于另一相晶粒的基体内。
如果弥散相的硬度明显高于基体相,则将显著提高材料的强度,同时降低材料的塑韧性。
10、说明结构转变的热力学条件与动力学条件的意义,说明稳态结构和亚稳态结构之间的关系。

第一章8.计算下列晶体的离于键与共价键的相对比例(1)NaF (2)CaO (3)ZnS解:1、查表得:X Na =0.93,X F =3.98根据鲍林公式可得NaF 中离子键比例为:21(0.93 3.98)4[1]100%90.2%e ---⨯=共价键比例为:1-90.2%=9.8%2、同理,CaO 中离子键比例为:21(1.00 3.44)4[1]100%77.4%e---⨯= 共价键比例为:1-77.4%=22.6%3、ZnS 中离子键比例为:21/4(2.581.65)[1]100%19.44%ZnS e --=-⨯=中离子键含量共价键比例为:1-19.44%=80.56%10说明结构转变的热力学条件与动力学条件的意义.说明稳态结构与亚稳态结构之间的关系。
答:结构转变的热力学条件决定转变是否可行,是结构转变的推动力,是转变的必要条件;动力学条件决定转变速度的大小,反映转变过程中阻力的大小。
稳态结构与亚稳态结构之间的关系:两种状态都是物质存在的状态,材料得到的结构是稳态或亚稳态,取决于转交过程的推动力和阻力(即热力学条件和动力学条件),阻力小时得到稳态结构,阻力很大时则得到亚稳态结构。
稳态结构能量最低,热力学上最稳定,亚稳态结构能量高,热力学上不稳定,但向稳定结构转变速度慢,能保持相对稳定甚至长期存在。
但在一定条件下,亚稳态结构向稳态结构转变。
第二章1.回答下列问题:(1)在立方晶系的晶胞内画出具有下列密勒指数的晶面和晶向:(001)与[210],(111)与[112],(110)与[111],(132)与[123],(322)与[236](2)在立方晶系的一个晶胞中画出(111)和(112)晶面,并写出两晶面交线的晶向指数。
(3)在立方晶系的一个晶胞中画出同时位于(101).(011)和(112)晶面上的[111]晶向。
解:1、2.有一正交点阵的a=b,c=a/2。
某晶面在三个晶轴上的截距分别为6个、2个和4个原子间距,求该晶面的密勒指数。

第一章几何结晶学一、名词解释①晶体、②等同点、③空间点阵、④结点、⑤对称、⑥对称型、⑦晶类、⑧单形、⑨聚形、⑩晶体定向、○11晶体常数、○12布拉菲格子、○13晶胞、○14晶胞参数、○15空间群。
二、(1)根据对称型国际符号写出对称型,并指出各对称要素的空间方位关系。
①2/m ;②mm2;③422;④6/mmm 。
(2)写出下列对称型的国际符号①3L23pc 、②L4PC 、③Li4、④L33P (3)下列晶形是对称型为L4PC 的理想形态,判断其是单形或是聚形,并说明对称要素如何将其联系起来的。
(4)下列单形能否相聚而成聚形①四方柱、四方双锥②菱面体、六方柱 ③四角三八面体、平行双面④四方四面体、四方双锥 ⑤四面体、八面体 ⑥斜方柱、四方双锥 三、计算题(2)一个立方晶系晶胞中,一晶面在晶轴X 、Y 、Z 上的截距分别为2a 、1/2a 、2/3a ,求此晶面的晶面指数。
(2)一个四方晶系晶体的晶面,在X 、Y 、Z 轴上的截距分别为3a 、4a 、6c ,求该晶面的晶面指数。
四、填空题(1) 晶体的对称要素中点对称要素种类有_____、_____、_____ 、_____ ,含有平移操作的对称要素种类有_____ 、_____ 。
它们分别是 _____、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 。
(2) 晶族、晶系、对称型、结晶学单形、几何单形、布拉菲格子、空间群的数目分别是 _____、_____ 、_____ 、_____ 、_____ 、_____ 。


SOLUTIONS FOR CHAPTER 81. FIND: When a phase transformation occurs such as a liquid phase transforming to asolid below its melting temperature, what are the two steps involved in the process?Briefly describe each.SOLUTION: During a phase transformation such as a liquid transforming to solid, there are two steps involved in the process. They are:1. nucleation of the new phase, and2. growth of the phase.Nucleation relates to the formation of the new phase and the development of theinterface seperating the two phases. Nucleation can either occur randomly throughout the structure - termed homogeneous nucleation or at specific sites such as interfaces - termed heterogeneous nucleation.Growth - Once the phases has nucleated, it begins to grow. The growth process iscontrolled by diffusion and undercooling. As in the nucleation step, there may becompeting processes that lead to a maximum growth rate at an intermediate temperature.2. FIND: We presented a derivation in Section 8.2.3 showing that the barrier for nucleation,∆G*, decreases with increasing undercooling following the proportionalityBy starting with an expression for the free energy of a distribution of spherical particles of radius r, derive equation 8.2-9a. Explain each step in the derivation. Explain anyassumptions that are made.SOLUTION: To determine the barrier to the nucleation process, ∆G* we begin bynoting that the free energy as a function of particle size for homogeneous nucleation has two terms, one that increases with r2, the interfacial energy per unit volume term, and one that decreases with r3. A maximum occurs in ∆G(r) at some r*. These graphicalrelationships are sketched below.The dependence of the various free energy terms associated with nucleation as a function of temperature: (a) the relationship between cluster radius and surface energy of agrowing spherical solid phase in liquid, (b) the relationship between the cluster radius and(c) the sum of (a) and (b). Instal l Equa tion E ditor a nd do uble -click h ere to view equat ion.The change in free energy can be written as:In this equation we assume that the nuclei can be considered as a random distribution of spheres. To locate the maximum of a function we equate the first derivative of thefunction with respect to the parameter which is the variable to zero. Here we assume thatr is the only variable. The is SL is independent of size and orentation.Using equation 8.2-4 for Instal l Equa tion E ditor a nd do uble -click h ere to view equat ion.we have:In writingwe have assumed that the heat capacity difference between the liquid and solid phases is zero. (Note: Although this may be a reasonable assumption at small undercoolings, i.e.small ∆T’s, at the large under coolings that are typical for homogeneous nucleation thatapproximation may not be valid and a more complex term is required. But for a firstorder approximation this assumption is reasonable.)In order to determine the value of ∆G(r) at r*, we introduce the expressionintoRearranging,If all the terms in parentheses are constant then,3. FIND: Explain the simultaneous influence that undercooling has on the barrier tonucleation and the atomic rearrangements necessary to initiate the transformation. Show how these competing effects lead to classical C-curve behavior in the nucleation ofdiffusional transformations.SOLUTION: With larger undercoolings, both r* and ∆G* decrease, suggesting thatsimply lowering the temperature of the system allows nucleation to occur ever morereadily. However, there are practical kinetic limits to this effect. For example, withdecreased temperature there is a corresponding reduction in atomic mobility. The random fluctuations in the local arrangements of atoms is the process that provides the clusters.Since the formation of the clusters depends on atomic mobility, a reduction in thetemperature reduces the rate of clustering. Thus, as shown in Figure (a) below, theoverall nucleation rate exhibits a maximum at an intermediate temperature. Themaximum in the nucleation rate leads to a minimum in the time required to nucleate aphase, as shown in Figure b. Because of its shape, this curve is known as a C-curve.(a) The influence of temperature on the mobility term and the nucleation barrier term.The opposing processes result in a maximum in the nucleation rate at anintermediate temperature.(b) Since the time for nucleation is inversely related to the nucleation rate, the timecurve exhibits a minimum at an intermediate temperature. Because of its shape,this curve is often referred to as a C-curve.4. FIND: Explain how the value of interfacial energy between the parent phase and thetransforming phase affects the critical radius and the barrier to nucleation.SOLUTION: Equation 8.25 gives the change in free energy as a function of r when aliquid transforms to a solid, for example. In the development of that equation it wasassumed that the transforming phase was spherical and the interfacial energy, γSL, wasisotropic. That equation consists of two terms on the right hand side, i.e.∆G(r) = (4πr2) γSL + 4/3 πr3 (∆G v)Since γSL > 0 and ∆G V < 0 for ∆T > 0, the first term increases with radius, and the second decreases. Figure 8.2-3 illustrates that there is a maximum that occurs at some r wedesignated as r* and a corresponding ∆G, we designated as ∆G* wherer* = (-2γSL)/∆G vandBoth the critical radius, r*, and the barrier to the nucleation process contain γSL in thenumerator. Thinking in terms of the barrier to nucleation, ∆G*, there is a cubicdependence on interfacial energy. The larger the S-L interfacial energy, the larger thebarrier to nucleation and hence the more difficult. The use of nucleating agents is basedon the principle of introducing particles with lower interfacial energies to stimulatenucleation.5. FIND: Compare homogeneous nucleation and heterogeneous nucleation.SOLUTION: The process of homogeneous nucleation occurs at random locations in the parent phase. The distribution of the transforming phase occurs without regard to specific sites, such as mold walls in solidification. Heterogeneous nucleation occurs at specificsites. In the case of solidification they can be at mold walls, unintentional additions such as ceramic inclusions from crucibles or it may occur at nucleating agents which areintentionally added to control the solidification microstructure.6. FIND: What is the difference between the following interfaces?a. coherentb. partially coherent, andc. incoherentSOLUTION: A coherent interface is one in which there is a one-to-one correspondence of atomic planes across the interface. This type of interface occurs when the latticeparameters in the two phases are the same or very close. When the lattice parameters are different in the two phases, the increase in strain energy that will occur as the particlegrows necessitates the periodic insertion of dislocations at the interface to accommodatethe misfit. This type of interface is referred to as partially coherent. An incoherentinterface occurs between two phases of different crystal structures and sufficientlydifferent atomic spacings that can not be accommodated by dislocations.7. FIND: How does interfacial energy vary with coherency?SOLUTION: Interfacial energy is sensitive to the nature of the interface separating thetwo phases. The interfacial energy increases going from coherent to partially coherent to incoherent, i.e. γincoh. > γpart.coh. . γcoh..8. FIND: Based upon your answer to question 7, explain how the probability forheterogeneous nucleation changes as the type of interface changes from coherent to partially coherent to incoherent.SOLUTION: Since the barrier to nucleation, ∆G*, is related to γα/β in the following way:∆G* ∝γα/β3increasing γα/β would increase the barrier to homogeneous nucleation. Consequently, the probability for heterogeneous nucleation would increase as interfacial energy increases. 9. FIND: Figure 5.3-5 contains a schematic illustration of a twin boundary in a crystal.From the point of view of coherency, what is the nature of the type of twin boundaryillustrated in the figure? Comment on the relative energy of a twin boundary compared with a random grain boundary in a polycrystalline material.GIVEN:Figure 5.3-5 illustrates a schematic of a twin in a matrix showing the two twin boundaries separating the matrix from the twin and Figure 8.2-10 illustrates an incoherent interface separating the matrix from a precipitate.Schematic of a twinMatrixPrecipitateSchematic of an incoherent boundarySOLUTION: Atoms that are on the twin plane are part of the stacking sequence in the matrix above the twin plane as well as the stacking of atoms below the twin plane. Sincea coherent interface is an interface that occurs when there is a one-to-one correspondenceacross the interface, then the twin illustrated in this figure would be classified as acoherent twin boundary. Array The incoherent boundary illustrated above occurs in asystem when there is not amatch across the boundaryseparating two phases. Since a general grain boundaryrepresents a situation where theorientation of two grains across a boundary are not the same, we would therefore expect that there would not be a match ofatoms across the boundary.Thus, a coherent twin plane would have lower interfacial energy than the interfacialenergy associated with grain boundary separating two randomly oriented grains.10. FIND: In certain nickel-base superalloys, a second phase can precipitate coherently fromthe matrix during aging because the lattice parameters of the two phases are very closeand both phases are cubic. For a coherent precipitate in this system, what is the mostlikely relationship between the crystallographic axes in the matrix phase and that of theprecipitate? Explain, using sketches.GIVEN: The matrix and precipitate are both cubic with similar lattice parameters.SOLUTION: The best match between two similar cubic structure with similar latticeparameters occurs when the two cubes are aligned with the two sets of orthogonal axesparallel to one another. Thus, the x-axis in the matrix, x m, would be parallel to the x-axis in the precipitate, x p, and the y-axis in the matrix, y m, parallel to the y-axis in theprecipitate, y p. This orientation relationship is sometimes referred to as cube//cubeorientation. That is, the two cubes defining the two crystal structures are oriented x-axisto x-axis and y-axis to y-axis.Furthermore, because the lattice parameters of the two phases are very close, the distances between the atoms in the matrix and theprecipitate match very closely.11. FIND: The transition precipitate γ'(Al2Ag) in the aluminum-silver system is a hexagonalclose-packed structure. The a axis of the HCP phase is 0.2858 nm, and the c axis is0.4607 nm. What crystallographic plane and direction in the aluminum matrix definesthe coherent interface between matrix and precipitate?GIVEN: Crystal structure of aluminum is fcc and that for γ' is hcp. Atomic radius foraluminum is 0.143 nm from Appendix C and the a and c lattice parameters for γ' are0.2858 nm and 0.4607, respectively.SOLUTION: Both structures are close-packed structures. The two structures have the same packing factor and coordination number. Both have sets of planes with the highest possible planar density, the close-packed planes. In the fcc structure these are the {111} and in the hcp they are the {0001}. Both structures have directions with the highestpossible linear density. In the fcc the highest linear density is in the 〈110〉 and in the hcp structure 〈1000〉 . The best potential match between the two structures is across the two highest packing planes. Thus the {0001} of the precipitate and the {111} of thealuminum matrix would form a boundary.Recall that the packing sequence for an fcc structure is ......ABCABCABC....., and thatfor the hcp structure is .....ABABABABAB...... . A schematic of the two structures with a common plane would be:To complete the analysis, the atomic spacings in a 〈111〉 direction of the fcc aluminummatrix must be calculated to determine if a match can be made with these planes andthose of the dense packed planes in the 〈0001〉 directions in the hcp structure of γ'.From Appendix C the atomic radius for aluminum is 0.143 nm, since the atoms touchalong 〈110〉 directions, see accompanying figure, in a fcc structure the lattice parameter, a o , for aluminum is:a o = 0.4045 nm.Schematic showing the dense packed arrangement of atoms in an fcc material like aluminum.For fcc stacking ( .....ABCABCABC.....) the distance between equivalent positions A positions can be determined using the above sketch:= ( 2a o 2 + a o2 ) ½ = a o √3 = 0.7006 nmThus the spacing between the adjacent dense packed layers in the fcc structure is= 0.7006/3 = 0.2335 nm.A schematic showing a comparison between the fcc aluminum and the hcp γ' structures are shown below.Thus the atomic spacing in the dense packed planes are similar, and the spacing between the dense packed planes for the two structures are similar.12. FIND: The expression: X = 1 - exp [ - (kt)n ] , equation 8.2-1, in the text, is a powerfulempirical function that is useful in describing the kinetics of diffusional transformations.In the equation, X is the fraction transformed, k is a rate constant having units ofreciprocal time, t is time and n is a unitless constant. Sketch the behavior of this function over a range of times that demonstrate why this expression is useful for describingmicrostructural changes like recrystallization, or the decomposition of austenite to form pearlite.SOLUTION: At the start of the transformation, t = 0, we expect no transformed phase, hence, X = 0. At very long transformation times, t →∞, we expect thetransformation to be complete, i.e. X= 1. Examining equation 9.2-1 at these twoextremes:At t = 1X = 1 - exp - (k ⋅ 0)n= 1 - 1 = 0, andAt t →∞X = 1 - exp - (k ⋅∞)n= 1 - 0 = 1.Over a range of values the function would behave like the sketch shown below:13.The value of n and k for the decomposition of a particular steel has been investigated by following the fraction transformed versus time. From the experimental data, values for n and k were determined at two temperatures. Plot the fraction transformed as a function ofo o SOLUTION: Using the equation:where X is fraction transformed, and k and n are as given in the table, to calculate the fraction transformed as a function of time.Typical values are summarized in the table below and the behavior of the function is plotted and shown on the next page.-1-114. FIND: Explain how the data from problem 10 could be used to determine the location ofthe start and finish times for the transformation.SOLUTION: Since it is often difficult to decide exactly when a reaction begins and iscompleted, the "start" and "finish" points on an isotherm transformation diagram areusually chosen when, for example, 1% of the parent phase has transformed to indicate thestart of transformation, and 99% has transformed for the finish.The start of the transformation:At 400o C0.01 = 1 - exp [ - (0.028)2 t s2]0.01 - 1 = - exp [ - (0.028)2 t s2]0.99 = exp [ - (0.028)2 t s2]- 0.01 = - (0.028)2 t s20.01 = 0.000784 t s212.75 = t22 ;t = 3.6 sec.At 360o C0.01 = 1 - exp [ - (0.085)2 t s2]0.01 = 0.007 2 t s2t s = 1.4 Sec.For the finish of the transformationAt 400o C0.99 = 1 - exp [ - (0.028)2 t f2]4.605 = 0.0078 t f2t f = 76.6 Sec.At 360o C0.99 = 1 - exp [ - 0.085)2 t f2]4.605 = 0.0072 t f2t f = 25.4 Sec.15. FIND: When fraction transformed as a function of the logarithm of time, plotted at twodifferent temperatures, results in two curves that are parallel (same n but different k), the mechanisms for the transformation are the same. Sometimes we refer to the process asbeing isokinetic. For the kinetic data shown below, plot fraction transformed versus time for the two temperatures. Does the process appear to be isokinetic?Isothermal Transformation Isothermal Transformationo oSOLUTION: The data are plotted in the form of fraction transformed versus time and shown belowSince the curves are parallel the processes appear to be isokinetic.16. FIND: The value of k in equation 8.2-12, for a set of kinetic data, can be determined bynoting:X = 1 - exp - (kt)n, andwhen kt = 1X = 1 - exp (-1) - 1 - 1/e orX = 0.632.What are the values for the rate constants for the data in problem 12 ?SOLUTION: To find the value of k, we need to find the time (t*) at which kt =1. The data is nearly linear at X = .632, therefore we can find this time by@ 415o Ct* = 10.5 sec.kt* = 1 k (10.5) = 1 k = 0.095@ 375o Ct* = 23.9 kt* = 1 k = 0.04217. FIND: When the mechanisms controlling a particular transformation are independent oftemperature, we can define an empirical activation energy, Q, for the process by noting:k = A exp (-Q/RT).Determine the empirical activation energy for the data given in problem 12 .SOLUTION: Since we have two value of k for two different temperatures we can solvetwo equations for Q.from problem 13:k 1 = .042 k 2 = .095 T 1 = 648 K T 2 = 688 KR = 8.314 J/(mole K)Q = 75,600 J/mole.18. FIND: The value of n from a set of data can be found by noting:X = 1 - exp - (kt)n 1-X = exp - (kt)n ln (1 - x) = - (kt)n-ln (1 - x) = ln (1/(1-x)), then ln (1/(1-x)) = (kt)nln ln (1/(1-x)) = n lnt + n lnk.Determine n at the two temperatures from the data in problem 12.SOLUTION: We have data for X vs t and we have already determined k at each temperature (problem 13). Computeand ln(t) for each data point. The slope of a plot of Instal l Equa tion E ditor a nd do uble -click h ere to view equat ion. vs ln(t) is equal ton.@ 415o C n = 2.08@ 375o Cn = 2.0819.FIND: In a diffusion-controlled transformation, the time t at different temperatures to yield the same fraction transformed X is as follows:uble -SOLUTION: By noting that the time for a given fraction transformed is inversely related to the rate of the reaction if the processes have the same activation energy. Then using the Arrhenius:Rate = constant exp (-Q/RT)where Q is the required activation energy, R the gas constant and T the absolute temperature, the activation energy is determined graphically by plotting, ln 1/t versus 1/T.From the graph: slope = - 3629.9Then, Q/R = 3629.9R = 8.314 Joules/mole⋅KQ = 30,180 Joules/mole⋅K20. FIND: Using the data from Problem 19, calculate the time required to yield the samefraction transformed at 125︒C.GIVEN: Data from problem 19.SOLUTION: Least squares fit of the experimental data give an equation of the form y (ln(reciprocal of the time)) = m⋅x (1/T) + bWith the values the expression becomes:y = -3630 ⋅ ( 1/ T ) + 9.8572To calculate the time at 125︒Cy = -3630 ⋅ ( 1/ (125 + 273)) + 9.8572y = 0.7366Taking the inverse ln gives:1/t = 2.089,or, t = .4787 hours21. FIND: The precipitation of carbides in certain steels can increase their strength. Shownbelow are data relating time to reach peak strength and the isothermal hold temperature.From the data, determine the activation energy for the precipitation process. Compareyour results with the activation energy for diffusion of carbon in bcc iron. Explain why the similarities between the two activation energies are not too surprising.T (︒C)Time to Peak Hardness (min.)353 0.9375 3.0400 4.0425 10.0450 20.0Applications to Engineering Materials (8.3)22. FIND: Sketch an isothermal transformation (IT) diagram for a plain carbon eutectoid steel. Label theSOLUTION: An IT diagram for a plain carbon eutectoid steel should contain thefollowing information:1. The temperature of the eutectoid - 727o C.2. The start and finish lines for the diffusional reactions:γ→ pearlite and γ→ bainite.3. The start and finish lines for the athermal martensitetransformation.Shown below is the IT diagram.23. FIND: Sketch a section of the Fe - Fe3C diagram over the composition range 0 to 2 wt%carbon and over the temperature range from 900o C to room temperature. Label the phase fields and compare the information that can be extracted from the phase diagram and the IT diagram.SOLUTION: An IT diagram such as that for a steel provides kinetic information that is, how rapidly austenite decomposes into a particular microstructure. It also provides theinformation regarding the morphology of the phases present. For example, dependingupon the quench temperature either coarse pearlite or fine pearlite may form. These are the same microstructures except for the scale. The lower the transformation temperature, the finer the lamellar spacing. Alternatively, rather than pearlite forming the austenitemight decompose into an alternative two phase structure of finely dispersed carbides in ferrite.Also noted on an IT diagram is the presence of metastable phases such as martensite. On an IT diagram, the temperature range (M s - M f) of the metastable phase is presented.In contrast, the equilibrium diagram provides no information regarding kinetics,morphology or the the presence of metastable phases. Since the diagram is constructed on the requirement of equilibrium, only equilibrate phases will be present.24. FIND: Explain experimentally how you would determine an IT diagram for a particularsteel.SOLUTION: Isothermal transformation (IT) diagrams are constructed by following the isothermal changes in microstructure at different temperatures. Since it is difficult todecide exactly when a reaction starts and is completed the start and finish lines on an IT diagram are arbitrarily defined. The microstructural changes occurring can be followed by monitoring microstructural changes directly using metallographic techniques ortracking a property such as electrical resistivity which is affected by the amount of solute in solution or hardness, which is controlled by the nature of the microstructure. As many microstructure sensitive properties as possible are used to provide sufficient collaborative information for a desired degree of accuracy.25. FIND: Based upon the methods you outlined in question 19, explain the limitations ofusing such a diagram. In particular, explain why the application of an IT diagram isrestricted and may not be applied directly to the production environment.SOLUTION: Since an IT diagram is constructed from numerous samples transformed under isothermal conditions, they can only be used that way. In general, the data for ITdiagrams are collected using thin specimens in order to assure that the requirement ofinstantaneous quench are realized. When larger pieces are considered, especially when considering a production environment where a variety of cross-sections are cooled,instantaneous temperature changes can not be realized. Depending upon the mass of the part, slow cooling may be achieved at the center, whereas rapid cooling may occur near the surface. If the cooling rate is slow, then some microstructural changes will occur as the sample cools down to the desired temperature. Consequently, the continuous cooling (CC) curves were established. These curves recognize that the effects of time andtemperature must be integrated.26. FIND: In our discussions in Chapter 7, we introduce the concept of a phase, and in thischapter we have been concerned with the microstructure of an alloy and ultimately how a particular microstructure affects properties. Explain the difference between the concept of a phase and the phases that are present, and the microstructure of the material.SOLUTION: A phase is a homogeneous portion of matter. A particular microstructure such as 100% martensite can be a single phase microstructure. The microstructure iscomposed of martensite and only martensite. However, a microstructure can bemultiphase. For example, pearlite is a two-phase microstructure which consists oftwophases that form as alternate lamellae of ferrite and cementite. So the concept of amicrostructure includes information about the phase or phases present and theirdistribution.27. FIND: Using the concepts associated with phases and microstructure, explain what ismeant by the terms:a. austeniteb. ferritec. pearlited. bainitee. martensitef. cementite, andg. spheroiditeSOLUTION:(a) austenite - The face-centered cubic (FCC) form of iron.(b) ferrite - The body-centered cubic (BCC) form of iron.(c) pearlite - A two-phase microstructure of alternate ferrite and cementite lamellaeoccurring in some steels. Pearlite forms by the decomposition of austenite.(d) bainite - A two-phase microstructure of ferrite and cementite. Bainite forms whenan austenitic steel is quenched to a temperature below the pearlite region, butabove the martensite start, M s, temperature.(e) martensite - Metastable body-centered tetragonal (BCT) iron phase that issaturated in carbon. Iron carbon martensite forms when austenite is rapidlyquenched to low temperatures. (Note: A wide variety of martensite-liketransformations occur in other systems. Consequently, the term martensite hastaken on a more general concept.)(f) cementite - An iron carbide phase, Fe3C.(g) spheroidite - A two-phase microstructure consisting of spheroidized carbide inferrite, which is formed by heat-treating pearlite, bainite, or martensite at atemperature below the eutectoid temperature.It should be noted that in this list of terms there is a distinction between single-phasematerials - austenite, ferrite, martensite and cementite and microstructures which can be combinations of phases such as pearlite and spheroidite.Problems 28 - 31 can be solved using Figures 8.3-6 and 8.3-11.28. FIND: Thin specimens of a plain carbon steel having eutectoid composition are held at800o C and have been at that temperature long enough to have achieved a complete andhomogeneous austenitic structure. Describe the phases present and the microstructuresthat would occur using the quench paths given below.a. Instantaneous quench to 650o C, hold at that temperature for 200 seconds, andquench to room temperature.b. Instantaneous quench to 300o C, hold for 1000 seconds, and quench to roomtemperature.c. Instantaneous quench to room temperature.d. Instantaneous quench to 500o C, hold for 3 seconds and quench to roomtemperature.SOLUTION: When a eutectoid steel containing approximately 0.8 wt% carbon is taken to 800o C and held, whatever microstructure was present prior to the 800o C exposure isreplaced by single phase, austenite containing 0.8% C.(a) When austenite containing 0.8 wt% carbon is instantaneously quenched to 650o Cand held for 200 seconds it forms the two-phase pearlite microstructure. Since allthe austenite has transformed to pearlite at this temperature and time, no othermicrostructures can form on the quench to room temperature. Consequently, themicrostructure consists of alternate ferrite and cementite lamellae - termed pearlite.The microstructure contains 100% pearlite.(b) When austenite containing 0.8% C is quenched to 300o C and held for 1000seconds approximately 75% of the austenite has transformed to bainite. Theremaining austenite transforms to martensite when the material is quenched toroom temperature. Consequently, the microstructure contains 75% bainite and25% martensite.(c) When the 0.8% C alloy is quenched from 800o C to room temperatureinstantaneously, all the austenite transforms to martensite. Consequently, themicrostructure is 100% martensitic.(d) When the 0.8% C alloy is instantaneously quenched from 800o C to 500o C andheld for 3 seconds, approximately 50% of the austenite transforms to amicrostructure that consists of fine pearlite. The remaining austenite transformsto martensite when the material is quenched to room temperature. Consequently,the microstructure is a mixture of 50% fine pearlite and 50% martensite.29. FIND: Using the same initial conditions outlined in problem 23, describe the phasespresent and the microstructures that would occur using the quench paths given below.a. Instantaneous quench to 650o C, hold for 15 seconds, and quench to roomtemperature.b. Instantaneous quench to 500o C hold for 60 seconds and quench to roomtemperature.c. Instantaneous quench to 170o C hold for 100 seconds and quench to roomtemperature.d. Instantaneous quench to 170o C and hold at that temperature.SOLUTION:。

第一章答案20、(1)略;(2)四面体空隙数/O2-数=2:1,八面体空隙数/O2-数=1:1;(3)(a)CN=4,z+/4×8=2,z+=1,Na2O,Li2O;(b)CN=6,z+/6×6=2,z+=2,FeO,MnO;(c)CN=4,z+/4×4=2,z+=4,ZnS,SiC;(d)CN=6,z+/6×3=2,z+=4,MnO2。
21、解:岛状;架状;单链;层状(复网);组群(双四面体)。
22、解:(1)有两种配位多面体,[SiO4],[MgO6],同层的[MgO6]八面体共棱,如59[MgO6]和49[MgO6]共棱75O2-和27O2-,不同层的[MgO6]八面体共顶,如1[MgO6]和51[MgO6]共顶是22O2-,同层的[MgO6]与[SiO4]共顶,如T[MgO6]和7[SiO4]共顶22O2-,不同层的[MgO6]与[SiO4]共棱,T[MgO6]和43[SiO4]共28O2-和28O2-;(3)z=4;(4)Si4+占四面体空隙=1/8,Mg2+占八面体空隙=1/2。
23、解:透闪石双链结构,链内的Si-O键要比链5的Ca-O、Mg-O键强很多,所以很容易沿链间结合力较弱处劈裂成为纤维状;滑石复网层结构,复网层由两个[SiO4]层和中间的水镁石层结构构成,复网层与复网层之间靠教弱的分之间作用力联系,因分子间力弱,所以易沿分子间力联系处解理成片状。
24、解:石墨中同层C原子进行SP2杂化,形成大Π键,每一层都是六边形网状结构。
由于间隙较大,电子可在同层中运动,可以导电,层间分子间力作用,所以石墨比较软。
25、解:(1)Al3+可与O2-形成[AlO4]5-;Al3+与Si4+处于第二周期,性质类似,易于进入硅酸盐晶体结构中与Si4+发生同晶取代,由于鲍林规则,只能部分取代;(2)Al3+置换Si4+是部分取代,Al3+取代Si4+时,结构单元[AlSiO4][ASiO5],失去了电中性,有过剩的负电荷,为了保持电中性,将有一些半径较大而电荷较低的阳离子如K+、Ca2+、Ba2+进入结构中;(3)设Al3+置换了一半的Si4+,则O2-与一个Si4+一个Al3+相连,阳离子静电键强度=3/4×1+4/4×1=7/4,O2-电荷数为-2,二者相差为1/4,若取代超过一半,二者相差必然>1/4,造成结构不稳定。

第一章晶体几何基础欧阳家百(2021.03.07)1-1 解释概念:等同点:晶体结构中,在同一取向上几何环境和物质环境皆相同的点。
空间点阵:概括地表示晶体结构中等同点排列规律的几何图形。
结点:空间点阵中的点称为结点。
晶体:内部质点在三维空间呈周期性重复排列的固体。
对称:物体相同部分作有规律的重复。
对称型:晶体结构中所有点对称要素(对称面、对称中心、对称轴和旋转反伸轴)的集合为对称型,也称点群。
晶类:将对称型相同的晶体归为一类,称为晶类。
晶体定向:为了用数字表示晶体中点、线、面的相对位置,在晶体中引入一个坐标系统的过程。
空间群:是指一个晶体结构中所有对称要素的集合。
布拉菲格子:是指法国学者 A.布拉菲根据晶体结构的最高点群和平移群对称及空间格子的平行六面体原则,将所有晶体结构的空间点阵划分成14种类型的空间格子。
晶胞:能够反应晶体结构特征的最小单位。
晶胞参数:表示晶胞的形状和大小的6个参数(a、b、c、α 、β、γ ).1-2 晶体结构的两个基本特征是什么?哪种几何图形可表示晶体的基本特征?解答:⑴晶体结构的基本特征:① 晶体是内部质点在三维空间作周期性重复排列的固体。
②晶体的内部质点呈对称分布,即晶体具有对称性。
⑵14种布拉菲格子的平行六面体单位格子可以表示晶体的基本特征。
1-3 晶体中有哪些对称要素,用国际符号表示。
解答:对称面—m,对称中心—1,n次对称轴—n,n次旋转反伸轴—n螺旋轴—ns ,滑移面—a、b、c、d1-5 一个四方晶系的晶面,其上的截距分别为3a、4a、6c,求该晶面的晶面指数。
解答:在X、Y、Z轴上的截距系数:3、4、6。
截距系数的倒数比为:1/3:1/4:1/6=4:3:2晶面指数为:(432)补充:晶体的基本性质是什么?与其内部结构有什么关系?解答:①自限性:晶体的多面体形态是其格子构造在外形上的反映。
②均一性和异向性:均一性是由于内部质点周期性重复排列,晶体中的任何一部分在结构上是相同的。


一、是非题:(正确的打,错误的打) 1、金斯特林格方程可适用至转化率100%。
()2、大多数固相反应是由扩散速度所控制的。
()3、狭义上讲,相变过程是一个化学变化过程。
()4、浓度梯度是扩散的推动力,物质总是从高浓度处向低浓度处扩散。
()5、晶胚的临界半径rk 随着ΔT 的增大而减小,相变愈易进行。
()6.逆扩散的推动力是浓度梯度。
()是化学位梯度。
7.成核--生成相变亚稳区G"< 0 ,斯宾那多分解的不稳区G">0。
()相反。
8.过冷度愈大,晶体生长速率愈快,则晶粒就愈粗大。
()9.对扩散系数D 0的影响因素主要是温度及扩散激活能。
()10.相同条件下晶体的非均相成核比均相成核更难。
()11.杨德尔方程比金斯特林格方程的适用范围大。
()12.间隙扩散活化能包括间隙形成能和间隙原子迁移能。
()二、填空题1、根据扩散的热力学理论,扩散的推动力是 (A ) ,而发生逆扩散的条件是 (B ) 。
(A )化学位梯度 (B )热力学因子小于零2、熔体是物质在液相温度以上存在的一种高能量状态,在冷却的过程中可以出现 (A ) 、 (B ) 和 (C ) 三种不同的相变过程。
(A )结晶化 (B )玻璃化 (C )分相3、马氏体相变具有以下的一些特征: (A ) 、 (B ) 、 (C ) 和(D ) 等。
(A )存在习性平面 (B )无扩散性 (C )相变速度高 (D )无特定相变温度4、从熔体中析晶的过程分二步完成,首先是 (A ) ,然后就是 (B ) 过程。
均匀成核的成核速率Iv 由 (C ) 和 (D ) 因子所决定的。
(A )成核 (B )晶体生长 (C )受核化位垒影响的成核率因子 (D )受原子扩散影响的成核率5、 马氏体相变的特征有(A ) 、 (B ) 、 (C ) 和(D )。
存在习性平面、保持一定的取向关系、无扩散性、相变速度快、相变没有一个特定的温度。

1.1 名词解释:等同点、结点、空间点阵、晶体、对称、对称型、晶系、晶类、布拉菲格子、晶胞、晶胞参数、晶体定向、晶面指数、晶向指数、晶带轴定律1.2 略述从一个晶体结构中抽取点阵的意义和方法?空间点阵与晶体结构有何对应关系?1.3 什么叫对称性?晶体的对称性有何特点,为什么?1.4 晶体中有哪些对称要素,用国际符号表示。
1.5 试找出正四面体、正八面体和立方体中的所有对称元素,并确定其所属点群、晶系。
1.6 根据什么将14种布拉维点阵分成七个晶系?各晶系特点如何?为什么14种布拉维点阵中有正交底心而无四方底心和立方底心点阵型式?以图说明。
说明七个晶系的对称特点及晶体几何常数的关系。
1.7 什么叫单位平行六面体(或单位)?在三维点阵中选取单位平行六面体应遵循哪些原则?为什么?1.8 a≠b≠c, α=β=γ=90℃的晶体属于什么晶系?a≠b≠c, α≠β≠γ≠90°的晶体属什么晶系?能否据此确定这二种晶体的布拉维点阵?1.9 一个四方晶系晶体的晶面,其上的截距分别为3a、4 a,6c,求该晶面的晶面指数。
1.10 四方晶系晶体a=b,c=1/2a。
一晶面在X、Y、Z轴上的截距分别为2a, 3b和6c。
给出该晶面的密勒指数。
1.11 某一晶面在x、y、z三个坐标轴上的截距分别为1a,∞b,3c,求该晶面符号。
1.12 在正交简单点阵、底心点阵、体心点阵、面心点阵中分别标出(110)、(011)、(101)三组晶面,并指出每个晶面上的结点数。
1.13 在立方晶系中画出下列晶面:a)(001);b)(110);c)(111)。
在所画的晶面上分别标明下列晶向:a)[210];b)[111];c)[101]。
1.14 试说明在等轴晶系中,(111)、(111)、(222)、(110)与(111)面之间的几何关系。
1.15 在立方晶系晶胞中画出下列晶面指数和晶向指数:(001)与[210],(111)与[112],(110)与[111],(322)与[236],(257)与[111],(123)与[121],(102),(112),(213),[110],[111],[120],[ 321]。
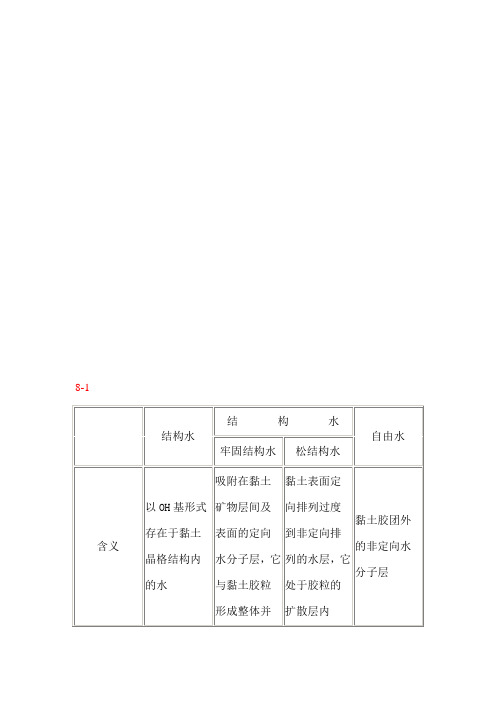
8-1
8-2黏土胶粒分散在水中时,因吸附层与扩散层各带有相反的电荷,所以相对移动时两者之间就存在着电位差,这个电位差称电动电位或ζ-电位。
其数值对黏土泥浆的稳定性有重要的作用。
8-3 大小
(1)离子置换能力
(2)黏土的ζ-电位
(3)泥浆的流动性
(4)泥浆的稳定性
(5)黏土的结合水
8-4 泥浆的流动性是指泥浆含水量低,黏度小而流动度大的性质。
泥浆的触变性是泥浆静止不动时似凝固体,一经扰动或摇动,凝固的泥
浆又重新获得流动性。
如再静止又重新凝固,这样可以重复无数次。
泥浆从流动状态到触变状态是逐渐的,非突变的,并伴随着黏度的增高。
8-5 Na2CO3稀释的泥浆对黏土边面结合的结构拆散的得不完全,因而泥浆流动差而注浆速度高,触变性大,坯体致密度低。
8-6 影响因素:1)含水量,2)电解质,3)颗粒大小,4)黏土的矿物组成,5)泥料处理工艺,6)腐殖质含量,添加剂。
泥料经过真空练泥排除气体;经过一定时间陈腐使水分均匀;适宜的腐殖质含量;添加朔化剂等方法提高瘠性物料的朔化。
8-7 黏土层面上的负电荷:黏土晶格内离子的同晶置换造成电价不平衡使之面板上带负电;
在一定条件下,黏土的边棱由于从介质中接受质子而使边棱带正电荷。
由于黏土的负电荷一般都大于正电荷,因此黏土是带有负电荷的。
8-8 为使非黏土瘠性材料呈现可朔性而解决制品成型得其进行朔化。
天然朔化剂:黏土。
有机朔化剂:聚乙烯醇,羟甲基纤维素,聚醋酸乙烯脂等。
8-1 若由MgO和Al2O3球形颗粒之间的反应生成MgAl2O4是通过产物层的扩散进行的,
(1)画出其反应的几何图形,并推导出反应初期的速度方程。
(2)若1300℃时D Al3+>D Mg2+,O2-基本不动,那么哪一种离子的扩散控制着MgAl2O4的生成?为什么?
解:(1)假设:
a)反应物是半径为R0的等径球粒B,x为产物层厚度。
b)反应物A是扩散相,即A总是包围着B的颗粒,且A,B同产物C是完全接触的,反应自球表面向中心进行。
c)A在产物层中的浓度梯度是线性的,且扩散截面积一定。
反应的几何图形如图8-1所示:
根据转化率G的定义,得
将(1)式代入抛物线方程中,得反应初期的速度方程为:
(2)整个反应过程中速度最慢的一步控制产物生成。
D小的控制产物生成,即D Mg2+小,Mg2+扩散慢,整个反应由Mg2+的扩散慢,整个反应由Mg2+的扩散控制。
8-2 镍(Ni)在0.1atm的氧气中氧化,测得其质量增量(μg/cm2)如下表:
(1)导出合适的反应速度方程;(2)计算其活化能。
解:(1)将重量增量平方对时间t作图,如图8-2所示。
由图可知,重量增量平方与时间呈抛物线关系,即符合抛物线速度方程式。
又由转化率的定义,得
将式(1)代入抛物线速度方程式中,得反应速度方程为:
图8-2 重量增量平方与时间关系图(2)取各温度下反应1h时进行数据处理拟合,如图8-3所示,
G(%)
图8-3 数据处理
由杨德尔方程可得,
对数据作线性回归,得(相关系数为0.98839)
由上式得活化能kJ/mol
8-3 由Al2O3和SiO2粉末反应生成莫来石,过程由扩散控制,如何证明这一点?已知扩散活化能为209 kJ/mol,1400℃下,1h完成10%,求1500℃下,1h和4h各完成多少?(应用杨德方程计算)
解:如果用杨德尔方程来描述Al2O3和SiO2粉末反应生成莫来石,经计算得到合理的结果,则可认为此反应是由扩散控制的反应过程。
由杨德尔方程,得
又,故
从而1500℃下,反应1h和4h时,由杨德尔方程,知
所以,在1500℃下反应1h时能完成15.03%,反应4h时能完成28.47%。
8-4 比较杨德方程、金斯特林格方程优缺点及适应条件。
解:两个方程都只适用稳定扩散的情况。
杨德尔方程在反应初期具有很好的适应性,但杨氏模型中假设球形颗粒截面始终不变。
因而只适用反应初期转化率较低的情况。
而金斯格林方程考虑了在反应进程中反应截面面积随反应过程变化这一事实,因而金氏方程适用范围更广,可以适合反应初、中期。
8-5 粒径为1μm球状Al2O3由过量的MgO微粒包围,观察尖晶石的形成,在恒定温度下,第1h有20%的Al2O3起了反应,计算完全反应的时间。
(1)用杨德方程计算;(2)用金斯特林格方程计算。
解:(1)用杨德尔方程计算:
代入题中反应时间1h和反应进度20%,得
h-1
故完全反应(G=1)所需的时间h
(2)用金斯格林方程计算:
同理,代入题中反应时间1h和反应进度20%,得
h-1
故完全反应(G=1)时,
所以完全反应所需的时间h
8-6 当测量氧化铝-水化物的分解速率时,发现在等温反应期间,质量损失随时间线性增加到50%左右,超过50%时质量损失的速率就小于线性规律。
速率随温度指数增加,这是一个由扩散控制的反应,还是由界面一级反应控制的反应?当温度从451℃增至493℃时,速率增大到10倍,计算此过程的活化能。
(利用表8-2及图8-22进行分析)
解:根据表8-2部分重要的固相反应动力学方程及图8-22各种类型反应中G-t/t0.5曲线分析,由题意,知
G<50%,G-t呈线性关系
G>50%,G-t小于线性规律,是由扩散控制的反应,且G2=kt
又因为,代入T1 =451℃,T2=493℃,G1=G,G2=10G,得
kJ/mol
8-7 由Al2O3和SiO2粉末形成莫来石反应,由扩散控制并符合扬德方程,实验在温度保持不变的条件下,当反应进行1h的时候,测知已有15%的反应物发生了反应。
(1)将在多少时间内全部反应物都生成产物?(2)为了加速莫来石的生成,应采取什么有效措施?
解:(1)由杨德尔方程,得
反应完全(G=1)所需的时间为h
(2)可以采用一切有利扩散的因素来加速莫来石的生成:减小粒度,采用活性反应物(如Al2O3·3H2O),适当加压等等
8-8 试分析影响固相反应的主要因素。
解:(1)反应物化学组成与结构的影响:反应物中质点作用力越大,反应能力越小;同一反应体系中,固相反应速度与各反应物间的比例有关;矿化剂的特殊作用。
(2)颗粒度和分布影响:粒径越小,反应速度越快;同一反应体系中由于物料尺寸不同,反应速度会属于不同动力学范围控制;少量较大尺寸的颗粒存在会显著延缓反应过程的完成。
(3)反应温度的影响:温度越高,质点热运动增强,反应能力和扩散能力增强。
(4)压力、气氛的影响:两固相间的反应,增大压力有助颗粒的接触面积,加速物质传递过程,使反应速度增加;对有液汽相参加的固相反应,提高压力不表现积极作用,甚至适得其反。
(5)矿化剂的影响:晶格能越大,结构越完整和稳定,反应活性越低。
加入矿化剂可以提高固相反应。
8-9 如果要合成镁铝尖晶石,可供选择的原料为MgCO3、Mg(OH)2、MgO、Al2O3·3H2O、γ-Al2O3、α-Al2O3。
从提高反应速率的角度出发,选择什么原料较好?请说明原因。
解:应选用MgCO3,Mg(OH)2和Al2O3·3H2O作原料较好。
因为MgCO3,Mg(OH)2在反应中可以发生热分解,Al2O3·3H2O发生脱水反应和晶型转变,将获得具有较大比表面和晶格缺陷的初生态或无定形物质从而提高了反应活性,加剧了固相反应的进行。