酸碱盐专题复习一
- 格式:ppt
- 大小:92.50 KB
- 文档页数:5

酸碱盐复习提纲一、物质分类及其概念1、单质:由一种元素组成的纯净物。
例如;铁,氧气2、氧化物:由两种元素组成且一种元素是氧元素的化合物。
例如:二氧化碳3、酸:电离时生成的阳离子全部都是氢离子的化合物如:HCl==H+ + Cl -HNO3==H+ + NO3-H2SO4==2H+ + SO42-4、碱:电离时生成的阴离子全部都是氢氧根离子的化合物如:KOH==K+ + OH -NaOH==Na+ + OH -Ba(OH)2==Ba2+ + 2OH -5、盐:电离时生成金属阳离子(或铵根阳离子)和酸根离子的化合物如:KNO3==K+ + NO3-Na2SO4==2Na+ + SO42-BaCl2==Ba2+ + 2Cl –NH4NO3==NH4+ +NO3-6、有机物:含碳的化合物。
CO,CO2,碳酸盐除外。
练习:下列物质由C H O Na 中的一种或几种元素组成,写物质的化学式①常温下呈固态的单质,②金属氧化物,常温下呈液态的氧化物③酸,④碱,⑤盐,⑥有机物二、盐酸浓盐酸是的水溶液,有性,打开浓盐酸的瓶塞,看到现象,原因是。
练习1一瓶敞口放置在空气一段时间的浓盐酸,下列量是如何变化的?(填“变大”或“变小”或“不变”)溶液溶质质量;溶液溶剂质量;溶液质量;溶液浓度。
练习2实验室制取二氧化碳选取的药品是和。
为什么不选择浓盐酸?三、硫酸1、浓硫酸有性,常作为某些气体的干燥剂。
练习2一瓶敞口放置在空气一段时间的浓硫酸,下列量是如何变化的?(填“变大”或“变小”或“不变”)溶液溶质质量;溶液溶剂质量;溶液质量;溶液浓度。
2、浓硫酸溶于水放热。
小结:物质溶于水放热的是、、。
练习下列物质溶于水时,溶液温度明显降低的是()A.氯化钠B.硝酸铵C.浓硫酸D.氢氧化钠3、浓硫酸具有强烈的(脱水性),能将皮肤、衣服、木材中的氢氧元素以水的形式脱去,使其变。
4、浓硫酸不慎沾到皮肤或衣服上的处理方法。
5、浓硫酸的稀释方法是。

九年级化学酸碱盐断题专题复习一、初中三大离子的检验Cl-:______________________________________________2SO-:_____________________________________________42CO-:_____________________________________________3二、鉴别题1.现有三瓶失去标签的无色溶液:氯化钙、碳酸钠、盐酸,为鉴别它们所作的实验现象记录如下:甲+乙→有无色气体产生,甲+丙→无明显现象;试判断:甲_______、乙________、丙________;乙和丙反应的化学方程式是:___________________________________。
2.某氧化物RO和单质A都是黑色粉末,若将RO与A共热可得红色固体物质B和无色气体,若将RO溶于稀硫酸则得蓝色溶液C,向C中加入NaOH溶液可得到蓝色沉淀D,由上述条件判断有关物质的化学式:A________,B________,C________,D________;写出有关反应的化学方程式_______________________________。
3.在盛有无色氢氧化钡溶液的烧杯中,逐一加入A,B,C三种溶液,依次发生下列实验现象:氢氧化钡中加A产生蓝色沉淀,在蓝色沉淀中加B沉淀溶解,加C产生白色沉淀:若A,B,C可以从硫酸、盐酸、氯化铜三种溶液中选择,根据实验现象判断:A________,B________,C_________,蓝色沉淀________,白色沉淀_________。
4.A,B,C,D各表示一种化合物,它们之间发生了如下的化学反应:(1)B+H2SO4→D+H2O (2)A+D→C+KNO3 已知C既不容于水也不溶于稀硝酸,B电离后产生的阴离子全部是OH-,判断A,B,C,D的化学式:A______,B______,C_______,D_______.5.有三瓶无色溶液,已知它们分别是碳酸钠溶液、氢氧化钠溶液和稀硫酸;为了鉴别它们,分别取三种溶液注入三支试管中,再各滴入_______溶液,有气泡产生的则是_______,又各取两种剩余溶液于试管中,再分别滴入_________试液,呈红色的是_______,无明显现象的是________。

酸碱盐总复习一、酸1、常见的酸的特性注意:⑴浓硫酸溶于水时会放出大量的热。
因此,稀释浓硫酸时,一定要使浓硫酸沿器壁慢慢注入水里,并不断搅拌,使产生的热量迅速扩散,切不可把水倒入浓硫酸里。
⑵浓硫酸的脱水原理指它能把木材、纸张、蔗糖等物质中的氢元素和氧元素按水分子的组成比夺取出来,使它们变黑、碳化,是化学变化。
2、酸的化学性质酸溶液中都含有__________,所以酸具有相似的化学性质。
(1)酸溶液与指示剂作用酸溶液能使_____________________变_________。
(2)酸+活泼金属反应→盐+H2↑Mg + HCl =Al + HCl =Fe + HCl =Zn + HCl =Mg+ H2SO4 =Al + H2SO4 =Zn + H2SO4 =Fe+ H2SO4 =(3)酸+碱→盐+水(中和反应属于复分解反应)HCl+ NaOH=HCl+ Al(OH)3=HCl+ Mg(OH)2﹦HCl+ Fe(OH)3﹦H2SO4+ Mg(OH)2﹦H2SO4+ Cu(OH)2﹦(4)酸+金属氧化物→盐+水CuO + H2SO4 =Fe2O3+ H2SO4 =(5)酸+某些盐→新盐+新酸CaCO3 + HCl =Na2CO3 + HCl =AgNO3+ HCl =Na2CO3 + H2SO4 =CaCO3 + H2SO4 =BaCl2+ H2SO4 =二、碱1.常见的碱的性质2.碱的化学性质碱溶液中都有_________,所以碱具有相似的化学性质。
(1)碱溶液与指示剂作用碱溶液能使______________________变_____,能使________________________变______。
(2)酸+碱→盐+水(中和反应属于复分解反应)(3)碱溶液+非金属氧化物→盐+水实验室检验CO2气体: CO2 + Ca(OH)2 =实验室吸收CO2气体:CO2 + NaOH =SO2 + Ca(OH)2 =SO2 + NaOH=(4)碱溶液+某些盐溶液反应→新盐+新碱NaOH + FeCl3 =Ca(OH)2 + CuCl2 =Ca(OH)2 + Na2CO3 =三、盐2、盐的化学性质(1)可溶性盐+较活泼金属→新盐+较不活泼金属湿法炼铜:Fe+ CuSO4=Cu+ AgNO3=Fe+ AgNO3=(2)酸+某些盐→新盐+新酸(3)碱溶液+某些盐溶液反应→新盐+新碱(4)可溶性盐+可溶性盐→另外两种盐NaCl+ AgNO3=Na2CO3+ CaCl2=CuSO4+ BaCl2=四、金属活动性顺序表K、Ca、Na、_____、_____、_____、_____、Sn、Pb、(H)_____、Hg、_____、Pt、Au金属活性依次减弱注意:Fe发生置换反应后显+2价;五、复分解反应⑴定义:两种化合物互相交换成分,生成另外两种化合物,这样的反应叫做复分解反应。

中考化学酸碱盐专题复习一.酸、碱、盐的初步概念1 电离时生成的阳离子全部是氢离子的化合物叫做酸。
如 H2SO4、HNO3、HCl等都属于酸类.2 电离时生成的阴离子全部是氢氧根离子的化合物叫做碱。
如 NaOH、Ca(OH)2、Ba(OH)2等。
3 电离时生成金属离子和酸根离子的化合物叫做盐。
如 NaCl、KNO3、CuSO4·5H20等都属于盐类。
铵根离子虽不是金属离子,但因其具备金属离子的特征,因此铵根离子和酸根离子构成的化合物应属盐类。
二.酸性氧化物和碱性氧化物(1)金属氧化物大多为碱性氧化物,非金属氧化物大多为酸性氧化物.(2)碱性氧化物中只有 K2O、Na2O、BaO、CaO能与水化合生成可溶性碱;酸性氧化物如 CO2、SO2、SO3、P2O5等能与水化合生成对应的含氧酸。
(3)酸性氧化物与碱的反应可看作先是酸性氧化物与水化合生成含氧酸,含氧酸再与碱相互交换成分得出生成物,即:二、酸、碱、盐的性质1.酸的通性酸的通性。
酸的通性实质上是氢离子的性质。
方法指导:“通性"是指某类物质所共有的一般规律,是具有一定条件和运用范围的,“酸"──常用盐酸、稀硫酸,而不能用具有强氧化性的硝酸、浓硫酸,因为它们跟金属反应一般不生成氢气.2.酸溶液与酸性溶液酸溶液是酸的水溶液,酸性溶液是指呈酸性(PH<7)的溶液。
酸溶液一定呈酸性,但呈酸性的溶液其溶质不一定是酸。
有些盐溶液,如NaHSO4溶液、NH4Cl 溶液也呈酸性,也能使紫色石蕊试液变红.3.碱的通性碱在水溶液中电离生成的阴离子都是氢氧根离子,因而碱类都具有一些相似的化学性质,即碱的通性.方法指导:学习碱的性质时既要掌握OH—具有的一般规律即通性,又要明确不同的阳离子所具有的特殊性。
如 Ca(OH)2溶液能与Na2CO3溶液反应,而 NaOH溶液却不与 Na2CO3溶液反应。
4.难溶性碱如Cu(OH)2、Fe(OH)3等的特性(1)大多数难溶性碱受热容易分解,如:Cu(OH)2=CuO+ H2O 。

酸碱盐专题复习一【复习目标】1.熟练掌握酸、碱、盐的化学性质。
2.理解并掌握复分解反应发生的条件及离子共存问题。
一、【知识梳理】完成下列知识梳理(5分钟),2分钟错点订正,然后识记并互相识记。
1酸的化学性质(1)与指示剂作用,使紫色石蕊试液变,无色酚酞(2)与反应,如HCl + Zn=(3)与反应,如HCl + Fe2O3=(4)与反应,如HCl + NaOH=(5)与反应,如HCl + CaCO3=2.碱的化学性质(1)与作用,使紫色石蕊试液变,无色酚酞变(2)与反应,如NaOH + CO2 =(3)与反应,如:NaOH + H2SO4=(4)与反应,如,NaOH + CuSO4=3.盐的化学性质(1)与反应,如:Na2CO3 + HCl =(2)与反应,如Na2CO3+ Ca(OH)2=(3)与反应,如:Na2CO3 + CaCl2=(4)与反应,如,CuSO4 + Fe =二、尝试构建知识网络(酸碱盐的化学性质)三【重点探究、疑难突破】探究点一:酸碱盐的化学性质例1:(2011•芜湖)归纳是学习的重要方法,小红在复习盐酸的性质时,归纳出盐酸的五条化学性质(如右图所示,连线表示相互反应).(1)为了验证性质①,小红将紫色石蕊试液滴加到盐酸溶液中,溶液变色;(2)图中A所表示的物质类别是(3)盐酸的性质③决定了盐酸可用于清除铁锈(主要成分Fe2O3),该反应的化学方程式是;(4)为了验证性质⑤,可选用的物质是练习:把相互能反应的物质连线(两两连线)Fe Fe2O3CO2H2SO4NaOH BaCl2CuSO4小结:熟练掌握酸碱盐的化学性质是解决该类型题的关键。
探究点二:复分解反应及发生的条件复分解反应及发生的条件(1)生成物:两种化合物相互交换成分后有或有或有生成时,复分解反应才能发生。
(2)反应物:若反应物中没有酸参加(盐与盐、盐与碱的反应),除上述条件外,还要求反应物练习1. 判断下列反应能否发生,写出能反应的化学方程式(1)Na2CO3 + H2SO4——(2)FeCl3 + NaOH ——(3)H2SO4 + Ca(OH)2——(4)Cu(OH)2 + KNO3——(5)K2SO4 + BaCl2——(6)KNO3 + NaCl ——(7)CaCO3 + BaCl2——(8)BaSO4 + HNO3——探究点三:离子共存问题例2:(2011济宁中考)许多物质在溶液中都以离子形式存在。
中考化学总复习《酸碱盐》专项试题一、单选题1.下列有关说法不正确的是A.要证明氢氧化钠溶液是否变质不能用酚酞试液B.要证明氢氧化钠与二氧化碳能否发生反应,可以向生成物中加入少量的稀盐酸C.要证明氢氧化钠和盐酸能否发生反应,可以借助酸碱指示剂D.要区分海水和蒸馏水可以用氯化钡溶液2.逻辑推理是化学学习中常用的思维方法。
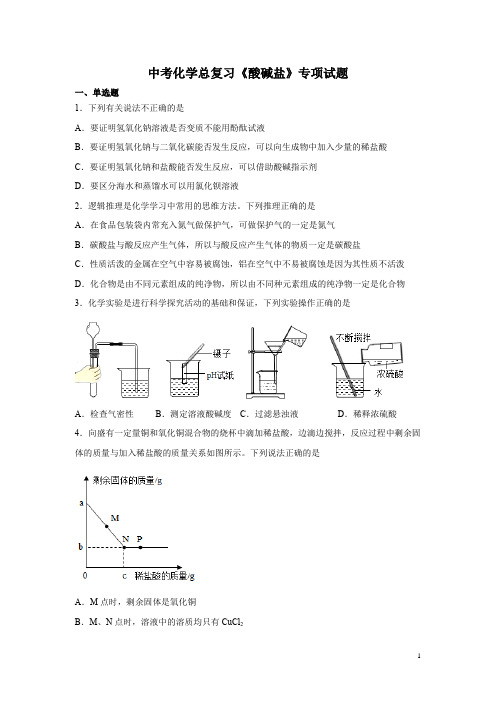
下列推理正确的是A.在食品包装袋内常充入氮气做保护气,可做保护气的一定是氮气B.碳酸盐与酸反应产生气体,所以与酸反应产生气体的物质一定是碳酸盐C.性质活泼的金属在空气中容易被腐蚀,铝在空气中不易被腐蚀是因为其性质不活泼D.化合物是由不同元素组成的纯净物,所以由不同种元素组成的纯净物一定是化合物3.化学实验是进行科学探究活动的基础和保证,下列实验操作正确的是A.检查气密性B.测定溶液酸碱度C.过滤悬浊液D.稀释浓硫酸4.向盛有一定量铜和氧化铜混合物的烧杯中滴加稀盐酸,边滴边搅拌,反应过程中剩余固体的质量与加入稀盐酸的质量关系如图所示。
下列说法正确的是A.M点时,剩余固体是氧化铜B.M、N点时,溶液中的溶质均只有CuCl2C.N、P点时,溶液的pH:N<PD.混合物中铜的质量为(a﹣b)g5.下列实验方案中,合理的是A.制取Cu(OH)2:将CuO与NaOH溶液混合B.分离MgCl2和K2SO4的混合物:加水溶解、过滤、干燥C.检验BaCl2中是否含有BaCO3:取样品,加稀盐酸看是否有气泡产生D.除去CO2中的水蒸气和HCl气体:依次通过NaOH溶液和浓硫酸6.下列关于海水晒盐的说法不正确的是A.结晶池中氯化钠质量分数大于海水中氯化钠质量分数B.由于水分蒸发,蒸发池中氯化钠质量分数逐渐增大到一定数值C.母液是NaCl的饱和溶液,也是MgCl2、CaCl2的饱和溶液D.气温高、风力大、雨量少、阳光充足有利于海水“晒盐”7.下列相关比较中,关系正确的是A.熔点:武德合金<铅B.相同条件下密度:氢气>氧气C.热稳定性:碳酸氢钠>碳酸钠D.氢氧化钙的溶解度:20℃<60℃8.下列鉴别或除杂能达到实验目的的是A.A B.B C.C D.D 9.下列有关实验现象的描述,错误..的是A.红磷在氧气中燃烧,产生大量白烟B.铁丝在空气中剧烈燃烧,火星四射C.木炭在氧气中燃烧发出白光,同时放出热量D.硫酸铜溶液和氢氧化钠溶液反应有蓝色沉淀生成10.除去下列各物质中少量杂质,选用的方案合理的是A.A B.B C.C D.D11.要使图装置中的小气球鼓起来,使用的固体和液体可以是℃固体碳酸钠和盐酸℃铁和稀硫酸℃固体氢氧化钠和水℃固体硝酸铵和水A.℃℃℃℃ B.℃℃℃ C.℃℃℃ D.℃℃℃12.下列图像能正确反映其对应关系的是A B C DA.相同质量和相同质量分数的稀硫酸与足量的两种金属,分别反应B.向一定量的稀盐酸中滴入水C.向一定量的稀盐酸中加入石灰石D.在密闭容器中用红磷测定空气中氧气含量13.高铁酸钾(K2FeO4)可用于净水,也可用作电池的电极材料,可通过下列反应制备:℃MnO2+4HCl(浓)ΔMnCl2+Cl2↑+2H2O℃3Cl 2+2Fe (OH )3+xKOH=2K 2FeO 4+6KCl +yH 2O ,下列说法正确的是 A .在反应℃中,只有氯元素化合价改变 B .反应℃中,可得到纯净的氯气 C .反应℃中 x=10,y=6D .上述反应不属于四种基本反应类型中的任何一种 14.下列物质的应用中,体现物质化学性质的是 A .生石灰做食品干燥剂 B .洗洁精乳化油污 C .稀有气体通电发光D .分离液态空气制氧气15.下图所示的有关化学实验操作正确的是A .向试管中加入铁钉B .检查装置气密性C .稀释浓硫酸D .倾倒少量盐酸16.向溶液X 中加入稀盐酸,产生的气体能使澄清石灰水变浑浊。

课题:酸碱盐复习1学习目标:1、掌握物质的分类方法,对常见物质进行分类。
2、掌握酸碱盐的化学性质及应用。
3、掌握典型化学反应方程式的书写及应用。
课前延伸:在下列各类物质中,找出酸、碱、盐,分别写在相应的横线上SO2 NaOH Cu HCl NaCl CaCO3Zn NH4NO3 Fe2O3 Na2CO3Fe HNO3CuSO4AgNO3 CuO Ca(OH)2 H2SO4CO2酸:__________________________________________________________________碱:__________________________________________________________________盐:__________________________________________________________________课内探究(一)酸的通性:1、酸溶液PH_____7,能使紫色石蕊试液变_______,无色酚酞试液遇到酸___________。
2、先补充化学方程式,然后在下列的物质中,选出能与稀盐酸、稀硫酸反应的物质,在下面的空格写出反应的化学方程。
注意:1、部分“活泼金属”是指:金属活动顺序表中氢前且除了钾、钙、钠。
2、铁与稀盐酸、稀硫酸反应生成的是+2价铁。
(二)碱的通性:1、碱溶液PH_____7,使紫色石蕊试液变_______,无色酚酞试液遇到碱___________。
2、先补充化学方程式,然后在下列的物质中,选出能与碱反应的物质,在下面空格写出反应的化学方程。
SO2 AgCl注意:1、碱与盐反应时,反应物必须均可溶,且还要符合复分解反应发生的条件(↑↓H2O)。
2、难溶碱:Mg(OH)2和Al(OH)3(白色)、Fe(OH)3(红褐色)、Cu(OH)2(蓝色)。
(三)盐的性质先补充化学方程式,然后在下列的物质中,选出能与盐反应的物质,在下面的空格写出反应的化学方程式。

酸碱盐专题一、几种常见的酸1.盐酸是HCl的水溶液。
纯净的浓盐酸是无色。
盐酸具有挥发性,浓盐酸在空气里会形成白雾。
2.浓硫酸:无色液体、无味;(1)有吸水性,在实验室中常用它作干燥剂。
(2)浓硫酸具有强腐蚀性,使用时必须十分小心。
它能夺取纸张、木材、布料、皮肤里的水分,生成黑色的炭。
(3)稀释浓硫酸的正确操作:将浓硫酸沿着烧杯壁缓慢地注入盛有水的烧杯里,用玻璃棒不断搅动。
3.常见的酸有盐酸、硫酸、硝酸、碳酸、醋酸等。
浓盐酸和浓硝酸都具有挥发性。
浓硫酸具有吸水性、脱水性和强氧化性,醋酸也具有挥发性。
4.酸有一些相似的化学性质(1)能使酸碱指示剂显示不同的颜色酸溶液使使紫色的石蕊试液变红色,可使无色的酚酞试液不变色;(2)能与多种活泼金属反应,生成氢气。
Fe+ 2HCl ==FeCl2 + H2↑ Zn+ H2SO4 ==ZnSO4 + H2↑2Al+ 6HCl==2AlCl3 + 3H2↑ 2Al+ 3H2SO4== Al2(SO4)3 + 3H2↑(3)能与某些金属氧化物反应,生成水。
铁锈+盐酸:Fe2O3 + 6HCl====2FeCl3 + 3H2O(黄色溶液);铁锈+硫酸Fe2O3 + 3H2SO4====Fe2(SO4)3 + 3H2O(4)酸与碱反应(写化学方程式)⑴盐酸中和氢氧化钠:NaOH + HCl = NaCl + H2O (中和反应)(5)酸与某些盐反应生成新盐和新酸。
HCl+ AgNO3 ==AgCl↓+ HNO3H2SO4 + BaCl2==BaSO4↓+ HClCaCO3 + 2HCl = CaCl2 + H2O + CO2↑例题1.(07山东)下列质量增加的变化有一种与其它三种存在本质的区别,这种变化是A.长期放置在空气中的氢氧化钠质量增加B.长期敞口放置的浓硫酸质量增加C.久置的生石灰质量增加D.久置的铁钉生锈质量增加例题2.(07济南).某同学设计的下列各实验方案中,你认为不能达到实验目的的是A.用燃着的木条鉴别二氧化碳和氧气B.加入适量的澄清的石灰水,以除去CaCl2溶液中的HClC.用浓硫酸除去氢气中混有的水蒸气D.用石蕊试液鉴别澄清的石灰水和氢氧化钠溶液例题3.下列含氧酸中,易挥发的是( )A.浓盐酸B.浓硫酸C.浓硝酸D.稀硫酸二、几种常见的碱1、常见的碱:NaOH 、Ca(OH)2、 KOH 、氨水(NH3·H2O)潮解:氢氧化钠暴露在空气中时容易吸收水分,表面潮湿并逐渐溶解,这种现象叫做潮解。

酸碱盐复习建议一、必须熟练掌握的知识1、元素符号、化合价、书写化学式2.酸、碱、盐的认识:二、写出下列物质的俗名和化学式石灰石______;纯碱、苏打________食盐_________;干冰________;铁锈__________;胃舒平____________;生石灰____________;草木灰___________;小苏打____________;氯化亚铁硫酸铵沼气___________;酒精_____________;碱石灰__________;食醋_________;三、酸、碱、盐、氧化物的概念:1、判断下列物质化学式属酸、碱、盐:NaHCO3 ()BaCl2()NaOH()HClO()KMnO4()NH3·H2O()Ca(OH)2()2、(1)由H、C、O、Na三种元素按要求写出化学式:气体单质固体单质非金属氧化物金属氧化物酸碱盐。
四、必须记忆的颜色黄色溶液:含的溶液如、、蓝色溶液:含的溶液如、、浅绿色溶液:含的溶液如、、红褐色沉淀:蓝色沉淀:白色沉淀:、(不溶于稀硝酸)白色沉淀:、、可溶于稀硝酸)黑色固体粉末:、、等红色固体粉末:、等五、反应类型:1、四大基本反应类型的定义并各举一例:化合反应:分解反应:置换反应:复分解反应:中和反应的实质并一例:2、判断下列反应是哪一类反应:C + CuO─NaOH + H2SO4─CO2 + H2O —H2O2─六、反应条件:金属活动顺序表:1、金属与酸反应:判断是否反应生成氢气:Cu + H2SO4——Zn + HNO3——Fe + H2SO4——Al + HCl——Mg + H2SO4——Ag + HCl——(1)反应条件是?(2)哪些酸与金属反应不能生成氢气2、金属与盐溶液反应:判断下列反应是否反应:Fe + CuSO4 、Mg + HCl 、Cu + AgNO3、Cu + FeSO4、Fe + AgNO3反应的条件?例、判断下列反应中不正确的是()①Zn+2HCl==ZnCl2+H2↑②2Fe+3H2SO4==Fe2(SO4)+3H2↑3③Cu+Hg(NO3)==Cu(NO3)+Cu ④Cu+2AgCl==CuCl2+2Ag2 23、复分解反应的定义酸、碱、盐发生复分解反应的条件是。

01 酸碱盐的综合复习一、基础知识复习知识点一:酸的复习1.常见的酸(1)浓盐酸①盐酸的物理性质:盐酸是_____色透明的液体,有_____气味,具有_____性。
【拓展】通常盐酸为无色液体,工业盐酸因含FeCl3而显黄色。
②挥发性:盐酸浓度越大,挥发性越_____。
浓盐酸瓶口出现_____,这是由于___________________________________________的缘故。
保存时必须__________,敞口放在空气中,溶质质量_______,溶液浓度会_______。
(2)浓硫酸①物理性质:纯净的硫酸是无色、粘稠、油状的液体,不易挥发,易溶于水并放出大量的热。
浓硫酸稀释时,需把浓H2SO4沿容器壁慢慢注入水中且边倒边搅拌,切不可将水倒入浓硫酸。
※②吸水性、脱水性、强氧化性。
③硫酸的用途:用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等,在实验室中还可作干燥剂。
2.稀酸的通性酸的组成中均含有________,因此酸具有相似的性质。
(1)酸溶液与指示剂反应。
(2)中和反应:酸+ 碱→ 盐+ 水①定义:酸和碱反应,生成盐和水并放出热量的反应称为中和反应。
如盐酸与氢氧化铁的反应,实验现象是:再如H2SO4 +2NaOH = Na2SO4 + 2H2O;无明显现象,需要使用酸碱指示剂判定反应的发生。
②中和反应的应用:a.___________:改良酸性土壤。
b.___________:治疗胃酸过多。
(4)酸+ 活泼金属(活动性顺序表中排在H前的金属)→盐+ H2↑铁钉和盐酸反应:;现象:;【注意】一般采用稀硫酸或者稀盐酸,浓盐酸挥发性太强,产生的氢气中含有大量氯化氢气体,浓硫酸或硝酸与金属反应不产生氢气。
(5)酸与某些盐反应:①与碳酸盐反应生成二氧化碳:实验现象:有气泡产生②与一些盐反应生成沉淀用氯化钡溶液检验硫酸:_________________________________;用硝酸银溶液检验盐酸:_________________________________;【酸的基础小练习】1.下列物质与盐酸反应,既不生成沉淀,又无气体放出,且溶液显无色的是()A.Na2CO3B.AgNO3C.MgO D.Cu(OH)22.经测定某溶液的pH=1,下列物质中不能在该溶液中大量存在的是()A.氯化钠B.氯化铜C.氢氧化钾D.稀硫酸3.已知甲、乙分别是盐酸溶液和氢氧化钠溶液中的一种。

酸碱盐专题一:【中考导航仪】【教材放大镜】1、酸碱指示剂⑴概念:跟或的溶液起作用而的物质。
⑵常见的指示剂:2①浓硫酸具有的特性:a.脱水性;b.吸水性;c.强烈的;②浓硫酸的稀释:一定要把沿着器壁慢慢注入中,并不断,切不可将倒进里。
3、溶液的导电性:HCl=H++Cl-水溶液能导电不同的酸溶液中都含有相同的,故酸有相H2SO4=2H++SO42- 似的化学性质。
4、中和反应:⑴定义:与作用生成和的反应叫中和反应(属于反应)⑵中和反应的本质:⑶应用:⑴改变土壤的酸碱性;⑵处理工厂的废水;⑶用于医药,等等。
5、溶液酸碱度的表示法——pH⑴溶液的酸碱性用来检验。
溶液的酸碱度用来表示。
pH的范围通常在0~14之间。
⑵测定pH值最简单的方法是使用。
方法:在白瓷板或玻璃片上放一小片,用蘸取待测溶液,滴在上,然后把试纸显示的颜色与对照,便可测出溶液的pH值。
⑶酸雨:正常雨水的pH约为5.6(因为溶有CO2),pH<5.6的雨水为酸雨重点疑点讨论1.浓盐酸敞口放置为什么瓶口上方会出现白雾?原因:浓盐酸挥发出来的HCl气体与空气中的水蒸气接触,形成盐酸的小液滴【故浓盐酸应密封保存】。
2.稀释浓硫酸时为什么必须把浓硫酸沿烧杯内壁慢慢地注入水中,并不断搅拌?原因:浓硫酸溶于水时放出大量的热。
且由于浓硫酸的密度比水大。
3.显酸性的溶液(pH<7)一定是酸溶液吗?原因:硝酸铵溶液呈酸性【备考精练】1.盐酸、稀硫酸在水溶液中都能产生H+,故有许多共同的性质,下列有关叙述正确的是()A. 打开盛有浓盐酸、浓硫酸的试剂瓶瓶塞,在瓶口都有白雾B.稀盐酸和稀硫酸都可用于除铁锈C. 浓盐酸、浓硫酸都可用来干燥O2D.在稀盐酸、稀硫酸中滴加氢氧化钡溶液,都有白色沉淀产生2.稀盐酸、稀硫酸是初中化学常用的酸,对这两种酸知识的归纳正确的是()A.pH都小于7,加水稀释后pH会变得更小B.都可以与大理石反应并用于实验室制二氧化碳C.用于除铁锈时,可能会观察到有气泡产生D.都能与氢氧化铜发生中和反应,但无明显现象3.下列实验方法错误的是()A.用水鉴别硝酸铵固体和氢氧化钠固体 B.用紫色石蕊溶液鉴别二氧化碳气体和一氧化碳气体C.用浓硫酸除去二氧化碳中混有的少量水蒸气 D.用稀盐酸除去铜粉中混有的少量铁粉4.硫酸和盐酸既是实验室常用的试剂,也是重要化工原料。

酸碱盐专题复习一、酸、碱、盐的组成二、酸、碱、盐的化学性质三、反应条件练习1. 判断下列反应能否发生,写出能反应的化学方程式(1)Na2CO3 + H2SO4——(2)FeCl3 + NaOH ——(3)H2SO4 + Ca(OH)2——(4)Cu(OH)2 + KNO3——(5)K2SO4 + BaCl2——(6)KNO3 + NaCl ——(7)CaCO3 + BaCl2——(8)BaSO4 + HNO3——2.从H、O、C、Ca、Cl六种元素中选择适当元素,分别组成酸、碱、盐、氧化物和单质等类别的物质,并按要求写出这些物质间相互反应的化学方程式(除酸类外,其它反应物只能用一次)。
①化合反应_________________ ②分解反应______________________③置换反应________________ ④复分解反应(中和反应_________________⑤复分解反应(不属中和反应)____________________________3.在M+H2SO4(稀)→Fe2(SO4)3+N(M、N分别代表一种物质)反应中,M可能是下列物质中的①Fe;②Fe2O3;③Fe(OH)3;④FeCl2A.①② B.②③ C.①②③ D.全部4.现有甲、乙、丙、丁四种化合物,甲能跟BaCl2溶液反应生成两种盐;乙能跟NaOH溶液反应生成盐和水;丙能跟盐酸反应生成盐和水;丁呈中性并能跟CaO反应生成碱。
则下列推断正确的是()A. 甲是任何一种硫酸盐 B. 乙一定是酸C. 丙是所有的非金属氧化物和碱D. 丁一定是H2O5.猪肉的新鲜度可通过测试PH来判断,PH 5.8-6.2为新鲜肉,PH 6.3-6.6为次鲜肉,PH在6.7以上为变质肉,则新鲜肉变质后,其酸性变()A、强B、弱C、不变D、无法确定6.多数花卉喜欢微酸性土壤,某花卉长势不佳,经测定盆中土壤PH为7.6,在施用较稀FeSO4溶液浇灌后长势良好,这说明FeSO4溶液的PH()A、大于7B、小于7C、等于7D、无法判断7. 下图给出三种物质,如果按概率统计,它们之间应该有六种相互转化的可能。
