13-碳酸氢钠片生产工艺规程
- 格式:doc
- 大小:162.50 KB
- 文档页数:12
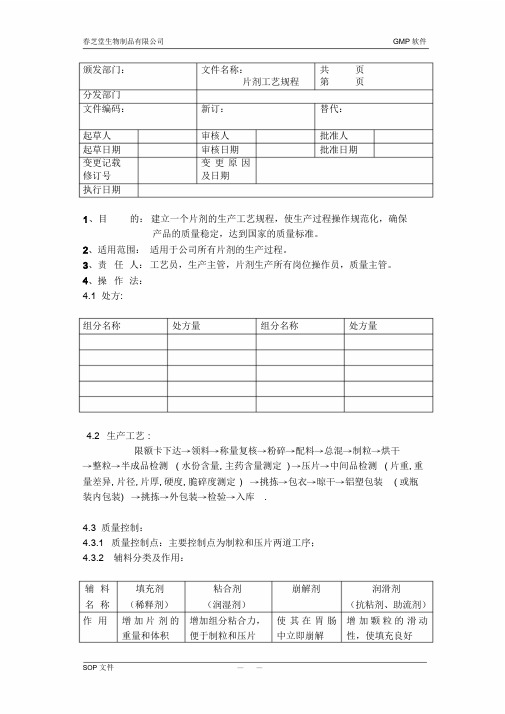

片剂工艺规程————————————————————————————————作者: ————————————————————————————————日期:ﻩ颁发部门:文件名称:片剂工艺规程共页第页分发部门文件编码: 新订:替代:起草人审核人批准人起草日期审核日期批准日期变更记载修订号变更原因及日期执行日期1、目的:建立一个片剂的生产工艺规程,使生产过程操作规范化,确保产品的质量稳定,达到国家的质量标准。
2、适用范围:适用于公司所有片剂的生产过程。
3、责任人:工艺员,生产主管,片剂生产所有岗位操作员,质量主管。
4、操作法:4.1 处方:组分名称处方量组分名称处方量4.2 生产工艺:限额卡下达→领料→称量复核→粉碎→配料→总混→制粒→烘干→整粒→半成品检测(水份含量,主药含量测定)→压片→中间品检测(片重,重量差异,片径,片厚,硬度,脆碎度测定)→挑拣→包衣→晾干→铝塑包装(或瓶装内包装) →挑拣→外包装→检验→入库.4.3质量控制:4.3.1质量控制点:主要控制点为制粒和压片两道工序;4.3.2 辅料分类及作用:辅料名称填充剂(稀释剂)粘合剂(润湿剂)崩解剂润滑剂(抗粘剂、助流剂)作用增加片剂的重量和体积增加组分粘合力,便于制粒和压片使其在胃肠中立即崩解增加颗粒的滑动性,使填充良好文件名称片剂工艺规程共页第页4.3.3 常用辅料:辅料名称常见类别常用辅料填充剂(稀释剂)1、水溶性填充剂;2、水不溶性填充剂;3、直接压片用填充剂;4、油类吸收剂;1、乳糖、蔗糖、甘露醇、山梨醇;2、淀粉、微晶纤维素、硫酸钙、磷酸氢钙;3、喷雾干燥乳糖、改良淀粉;4、硫酸钙、磷酸氢钙、氧化镁、氢氧化铝。
粘合剂(润湿剂) 1、作成水溶液或胶浆才具粘性;2、干燥粘合剂;3、经非水溶剂溶解或润湿才具粘性;1、淀粉、明胶、羧甲基纤维素钠;2、高纯度糊精、改良淀粉;3、乙基纤维素、聚乙烯吡咯烷酮、羟丙基甲基纤维素;4、常见润湿剂:水和以醇溶液。

技术标准本品为碳酸氢钠的灭菌水溶液。
1品名:碳酸氢钠注射液2 剂型: 大容量注射剂3 规格: 250ml:12.5g4 代码:Y1055 处方:5·1基准处方碳酸氢钠50.0 g注射用水加至1000ml5·2 标准生产量:2000000 ml/批所用的原辅料及数量名称代码数量碳酸氢钠Y113 100 Kg依地酸钙钠F109 100g针用活性炭F101 400g注射用水F108 加至2000000 ml6 生产工艺及操作要求:6·1 配制(万级、温度18~26℃、湿度45~65%):本工序包括称量、配制等。
6·1·1 称量:在备料间根据指令核对原辅料品名、规格、批号、生产厂家、数量,本厂检验报告单或合格证(绿色合格证)、递交单。
称量前校准天平、电子称并检查是否在效期内。
按处方要求进行原辅料的称量,填写物料标示卡附于容器内外各一张,注明品名、规格、批号、重量、日期和操作者。
经复核后填写称量记录。
剩余原辅料扎紧袋口,标明原辅料名称、批号、剩余量、使用人,放置于暂存架。
换品种清场时,将剩余料密封,贴上卡片,标明名称、规格、批号、数量、日期,退回脱包间,返至仓库。
6·1·2配制:在稀配间向SH-Ⅰ稀配罐中加注射用水至全量的约80%,水温降至30~35℃,加规定量碳酸氢钠, ,加0.005%(g/ml,以稀配体积计)的依地酸钙钠,补加注射用水至全量,搅拌溶解,再加0.02%(g/ml,以稀配体积计)的针用活性炭,搅拌、回流15分钟,药液通入纯净的二氧化碳至pH值(7.8~8.2),测PH值(7.8~8.2)、含量(99.0%~102.5%)符合规定后,用钛棒过滤器和0.22μm的膜滤芯加压过滤,终端用0.22μm的膜滤芯过滤至灌装。
生产结束后,操作者做好清场卫生工作(按清场操作规程和配制灌装系统清洗消毒规程),并做好记录。
6·2 制袋灌封(万级下的百级,温度18~26℃、相对湿度45~65%),用RDY4A 型非PVC膜软袋大输液生产线操作。

目的:建立盐酸小檗碱片的生产工艺规程。
范围:盐酸小檗碱片的生产职责:生产管理部经理、质量管理部经理、车间主任、工艺员、班长、操作工、QA。
规程:1.品名、剂型与处方依据1.1通用名称:盐酸小檗碱片汉语拼音:Yansuan Xiaobojian Pian英文名:Berberine Hydrochloride Tablets1.2剂型:糖衣片1.3处方与处方依据项的说明1.3.1处方(共制成10000片)盐酸黄连素 1000g淀粉 250g75%乙醇 350g*硬脂酸镁 6.25g3%明胶糖浆 256g70%单糖浆672g(相当于蔗糖470.4 g)滑石粉900g3%柠檬黄糖浆504g川蜡10g1.3.2 处方依据项说明:药品的生产批文:批准时间:质量标准编号:2.生产工艺流程:←↓→→←←↓←→↓ →← →一般生产区 三十万级生产区3.生产工艺操作与工艺技术参数中关键的注意事项: 3.1操作过程与生产过程质量控制 3.1.1配料工序:● 按SOP-MN/G-001-00原辅料处理岗位标准操作规程要求对主药、淀粉分别进行粉碎过筛(100目筛)处理,硬脂酸镁过80目筛,放备料间备用。
● 润湿剂(75%乙醇)的制备:以生产100万片计,往95%乙醇约29.5kg ,加入纯化水到规定量,混和搅拌,用酒精计测定,搅拌均匀即可。
●将处理好的主药、淀粉准确称量,按SOP-MN/G-004-00湿法制粒岗位标准操作规程,以生产100万片计,以每料35 kg分别置于湿法混合制粒机的搅拌锅中,按SOP- EQ/G-005-00 HLSG110型湿法混合颗粒机标准操作规程开动搅拌桨和切碎刀运作两分钟后加入适量粘合剂,将软材切割成均匀的湿颗粒(约八分钟)。
●按SOP-MN/G-005-00干燥岗位标准操作规程,湿颗粒置于热风循环干燥柜,按SOP-EQ/G-006-00 FL-IIIA热风循环干燥柜标准操作规程,开启蒸汽阀、风机,箱内温度控制在55-65℃之间,以生产100万片计,约为4.5小时。

碳化岗位操作规程第一章碳化工序的生产任务本工序的生产以天然碱为原料制得的清碱液与窑气和炉气混合后的混合气在碳化塔内进行碳化反应制得合格的重碱液,重碱液送滤过工序生产重碱。
第二章工艺流程及指标一、工艺流程由精制工序送来的清碱液经泵打入各碳化塔,混合气由塔底进入与清液逆流接触,其中碳酸钠与二氧化碳反应生成碳酸氢钠,由于碳酸氢钠溶解度较小,析出结晶形成悬浮液,反应方程式为:Na2CO3(I)+CO2(g)+H2O=2NaHCO3(s)+Q该反应为放热反应,反应产生的热量通过冷却水箱由循环冷却带走,以达到合格的出塔液温度。
三、主要工艺指标清碱液总碱(以Na2CO3计):≥125g/l清碱液中NaHCO3含量≤60g/l清碱液浊度<30ppm清碱液温度:45~65℃混合气浓度:40-60%混合气温度:<40℃尾气浓度(CO2):<15%出塔液温度:50-65℃循环上水温度:≤32℃循环水压力:0.3-0.5MPa出塔液固液比:30-60%碳化转化率:70-98%煮塔温度:80-100℃碳化塔塔压:0.26-0.32MPa四、工艺流程简图第三章开停车操作一、开车操作(一)联系工作DCS操作工做好与外界联系工作,并做好内部各岗位间的协调指挥工作。
碳化操作工及时与主控室联系,做好开车前的准备工作。
(二)开车前的检查工作1、检查各润滑部位润滑是否良好。
2、各安全设施齐全牢固,符合安全要求。
3、各控制仪齐全完好,自调阀灵活好用。
4、排除影响设设备运转的障碍物,并通知设备内及周围的人员离开设备。
(三)开车步骤1、按气体液体流向调节好各阀门的开关位置。
2、接调度令后联系精制送液,开清液泵送清液进塔。
生产塔压升至0.1MPa时通知压缩送气,打开塔底进气阀通气,同时继续进液。
3、当塔压升至0.28MPa时暂停进液.4、调节进气流量,连续通气半小时以上,视塔的温度情况开始取出。
5、调节好进液流量,使塔内液位及塔压维持稳定。


1、产品名称及剂型:1.1产品名称法定名:血液透析浓缩液汉语拼音名:Xueyetouxi Nongsuoye1.2剂型透析液2、产品概述本品为无色或几乎无色的澄明液体;味甜。
本品可供给能量,营养全身,并具有解毒作用。
其等渗溶液有补充水分,维持体液平衡的作用,可作为一些药物的稀释剂。
本品为静脉滴注,用量视病情需要而定。
3、处方及依据3.1处方A液氯化钠210.70 g氯化钾 5.22 g氯化钙9.00 g氯化镁 3.56 g冰醋酸 6.06 ml纯化水加至1000.00 mlB液碳酸氢钠84.00 g纯化水加至1000.00 ml3.2依据中华人民共和国医药行业标准YY 0598—2006血液透析及相关治疗用浓缩物4、生产工艺流程见附图5 操作过程及工艺条件5.1 配制将配料罐用纯化水充分洗净,罐中放入约总投料量80%的经加热至40℃的纯化水,打开循环及搅拌后,按处方量称取各原料并依次投入到配料罐中,补充纯化水至全量,按(30分钟/100万)循环搅拌使其溶解后,再按打开臭氧机(30分钟/100万)循环搅拌灭菌,取样测定各成分含量,合格后用0.45μm微孔滤膜过滤,灌装,封盖,即得。
5.2包装桶处理将塑料桶在准备室除去外包装后,用经0.45μm微孔滤膜滤过后的纯化水清洗三次,再用臭氧灭菌30秒钟,上生产线,待用。
5.3封口膜处理将封口膜逐张捻开后,加95%药用乙醇浸泡24小时以上,用经0.45μm微孔滤膜滤过后的纯化水清洗三次,洗至无乙醇味,再用经0.45μm滤膜过滤的纯化水反复清洗至洗涤水中无白块、纤维、小白点为止,将水沥干,即得。
5.4 灌装、放膜、封盖将洗净灭菌的塑料桶送入生产线中,药液经0.45μm微孔滤膜滤过装灌后、手工放膜旋紧外盖、用电磁封口机封口等工序,即得。
5.5包装贴签:在包装桶上规定位置贴上产品标签及批号签。
5.6纯化水制备5.6.1机械过滤:打开进水阀和石英砂过滤器排气阀,接通电源,启动增压泵进水,待石英砂过滤器排气阀出水一段时间后,打开活性碳过滤器排气阀和进水阀,关闭石英砂过滤器的排气阀,当活性碳过滤器排气阀出水5~10分钟后,打开通往下级的阀门。

GMP管理文件
一、目的:为规定碳酸氢钠片生产过程中的质量控制和检验操作
要求,特制定此操作规程。
二、适用范围:适用于碳酸氢钠片成品的检验。
三、责任者:生产部经理、检验员、生产人员
四、正文:
质量标准:见碳酸氢钠片(成品)内控质量标准
操作内容:
【性状】本品为白色片.
【鉴别】取本品的细粉适量,加水振摇,滤过,滤液显钠盐与碳酸氢盐的鉴别反应.
【检查】碳酸盐取本品,研细,精密称取适量(相当于碳酸氢钠1.00g),加新沸过并用冰冷却的水100ml,轻轻旋摇使碳酸氢钠溶解,加酚酞指示液4~5滴,如显红色,立即加盐酸滴定液(0.5mol/l)1.30 ml,应变为无色.
其他除崩解时限不检查外,应符合片剂项下有关的各项规定.
【含量测定】取本品10片,精密称定,研细,精密称取适量(约相当于
碳酸氢钠1g),加水50 ml,振摇使碳酸氢钠溶解,加甲基红-溴甲酚绿混合指示液10滴,用盐酸滴定液(0.5mol/l)滴定至溶液由绿色变为紫红色,煮沸2分钟,放冷,继续滴定至溶液由绿色变为暗紫色.每1 ml盐酸滴定液(0.5 mol/l)相当于42.00mg的NaHCO.。

1 目的建立消咳宁片生产工艺,规范生产的全过程,确保产品质量。
2 范围适用于消咳宁片生产全过程。
3 职责生产副总经理、生产技术科、质量管理科、固体制剂车间、前处理车间4 内容4.1 药品名称通用名称:消咳宁片汉语拼音:Xiaokening Pian代码:C0134.2 产品概述剂型:片剂成份:盐酸麻黄碱、苦杏仁、石膏、甘草浸膏、碳酸钙。
性状:本品为淡黄褐色的片;味甜后微苦。
功能主治:止咳祛痰。
用于感冒,咳嗽,气管炎,支气管哮喘等症。
规格:复方。
用法用量:口服,一次1~2片,一日3次。
包装规格:12片/板,100片/瓶。
贮藏要求:密闭保存。
有效期:36个月批准文号:国药准字Z150218144.3执行标准卫生部标准(中药12册)WS3-B-2412-97(见附件1)4.4 处方及批量4.4.1批量:240万片4.4.2处方4.5生产工艺流程图4.5.1前处理生产工艺流程图4.5.2制剂生产工艺流程图4.6前处理工艺过程及要求4.6.1 净制:生产前检查:操作间有“清场合格证”副本,设备有“完好”证及“已清洁”状态标记,容器有“已清洁”状态标记且在清洁有效期内,物料有“物料卡”及“交接单”,计量器具有“检定合格证”且在周检有效期内。
生产操作:根据生产指令单从仓库中领取规定数量的苦杏仁或石膏至净选工序,在净选工作台上剔除掺入苦杏仁或石膏药材中的硬壳、泥块等杂质,用10目筛除去掺杂其中的泥沙等细小杂质。
拣选完成后分装在清洁容器内,每个桶上分别挂上“物料卡”注明品名、代号、规格、工序、批号、重量及生产日期、操作人员等。
填写“交接单”将加工完成的药材交下工序。
操作完毕后,应及时的按规定清场,方可转入下一品种的操作,二种药材不能同时进行操作,填写批记录,计算物料平衡,整个过程由QA人员进行监控。
4.6.2粉碎:生产前检查:操作间有“清场合格证”副本,设备有“完好”证及“已清洁”状态标记,容器有“已清洁”状态标记且在清洁有效期内,物料有“物料卡”及“交接单”,计量器具有“检定合格证”且在周检有效期内。
![一种药品级碳酸氢钠的生产工艺[发明专利]](https://img.taocdn.com/s1/m/be3eb412ae45b307e87101f69e3143323968f5db.png)
(10)申请公布号 CN 102476815 A(43)申请公布日 2012.05.30C N 102476815 A*CN102476815A*(21)申请号 201010556296.7(22)申请日 2010.11.24C01D 7/10(2006.01)(71)申请人江苏省勤奋药业有限公司地址226017 江苏省南通市经济技术开发区三孔桥工业区(72)发明人梁全超 童海英 朱海林(54)发明名称一种药品级碳酸氢钠的生产工艺(57)摘要本发明提供了一种药品级碳酸氢钠的生产工艺,其特征在于包括:取食用纯碱、食用碳酸氢钠、烧碱、纯水若干或母液,配制成pH 值在10~11(5%浓度时),密度在11.5~12.5的碱性溶液,温度在70~90℃。
保温沉淀数小时后精密过滤,必要时用活性炭脱色。
把溶液放入碳化反应器内。
从反应器底部导入二氧化碳和本反应的尾气,控制气体流量在5~30m 3/hr ,尾气流量在5~30m 3/hr ,反应10~60min 后,将料液取出。
将料液放入离心机内分离,根据氯化物浓度的高低用适量纯水洗涤固体,直至氯化物合格。
把经过洗涤的固体送入气流干燥器或沸腾干燥器内干燥即得成品。
(51)Int.Cl.权利要求书1页 说明书4页(19)中华人民共和国国家知识产权局(12)发明专利申请权利要求书 1 页 说明书 4 页1/1页1.一种药品级碳酸氢钠的生产工艺,其特征在于包括:取食用纯碱、食用碳酸氢钠、烧碱、纯水若干或母液,配制成pH 值在10~11(5%浓度时),密度在11.5~12.5的碱性溶液,温度在70~90℃。
保温沉淀数小时后精密过滤,必要时用活性炭脱色。
把溶液放入碳化反应器内。
从反应器底部导入二氧化碳和本反应的尾气,控制气体流量在5~30m 3/hr ,尾气流量在5~30m 3/hr ,反应10~60min 后,将料液取出。
将料液放入离心机内分离,根据氯化物浓度的高低用适量纯水洗涤固体,直至氯化物合格。

温馨小提示:本文主要介绍的是关于碳酸氢钠片的湿法制粒工艺流程的文章,文章是由本店铺通过查阅资料,经过精心整理撰写而成。
文章的内容不一定符合大家的期望需求,还请各位根据自己的需求进行下载。
本文档下载后可以根据自己的实际情况进行任意改写,从而已达到各位的需求。
愿本篇碳酸氢钠片的湿法制粒工艺流程能真实确切的帮助各位。
本店铺将会继续努力、改进、创新,给大家提供更加优质符合大家需求的文档。
感谢支持!(Thank you for downloading and checking it out!)阅读本篇文章之前,本店铺提供大纲预览服务,我们可以先预览文章的大纲部分,快速了解本篇的主体内容,然后根据您的需求进行文档的查看与下载。
碳酸氢钠片的湿法制粒工艺流程(大纲)一、原料准备1.1原料选择1.2原料检验1.3原料预处理二、制粒工艺流程2.1混合2.1.1原料混合2.1.2添加剂混合2.2制粒2.2.1湿法制粒原理2.2.2制粒设备选择2.2.3制粒过程控制2.3干燥2.3.1干燥原理2.3.2干燥设备选择2.3.3干燥过程控制2.4筛分与整粒2.4.1筛分原理2.4.2整粒设备选择2.4.3筛分与整粒过程控制三、质量控制3.1制粒过程中的质量控制3.1.1混合均匀度3.1.2制粒合格率3.1.3干燥程度3.2成品质量控制3.2.1物理性质3.2.2化学性质3.2.3微生物检测四、设备与工艺优化4.1设备选型与配置4.1.1设备选型原则4.1.2设备配置方案4.2工艺优化4.2.1工艺参数优化4.2.2工艺流程优化4.2.3生产效率提高五、安全生产与环保5.1安全生产5.1.1安全操作规程5.1.2安全防护措施5.1.3紧急事故处理5.2环保措施5.2.1废水处理5.2.2废气处理5.2.3固体废弃物处理六、包装与储存6.1包装材料选择6.2包装工艺流程6.3储存条件与有效期一、原料准备在碳酸氢钠片的湿法制粒工艺流程中,原料准备是至关重要的环节。

本技术提供了一种碳酸氢钠片的制粒方法,包括原料准备、粘合剂制备、碳酸氢钠片制粒、成品收集四个步骤,其中加浆装置包括计量泵、喷枪、存料箱,所述计量泵的底部设置支架,所述计量泵的进料口设置有第一软管,所述计量泵的出料口设置有第二软管,所述喷枪穿过所述沸腾干燥制粒流化床的喷料口设置在所述沸腾干燥制粒流化床的内部。
本技术降低劳动强度,节约生产成本;设备无死角,装卸料轻便快速,易清洁,且无粉尘飞扬,满足GMP规范;本技术改善颗粒的均匀性、流动性,制得了理想的、均匀的颗粒,保障了产品质量。
权利要求书1.一种碳酸氢钠片的制粒方法,其特征在于:包括如下步骤:步骤1,原料准备:准备制备碳酸氢钠片所需的原料,称重备用;步骤2,粘合剂制备:准备淀粉与清洁水源,制备出淀粉浆备用;步骤3,碳酸氢钠片制粒:将步骤1准备的碳酸氢钠片所需的原料投入沸腾干燥制粒流化床的内部,通过在沸腾干燥制粒流化床的外部设置加浆装置,抽取步骤2中准备的粘合剂,喷入沸腾干燥制粒流化床的内部,若干物料粒子聚集成含有粘合剂的团粒,热空气对物料的不断干燥,使团粒中水分蒸发,粘合剂凝固,此过程不断重复进行,形成均匀的颗粒;步骤4,成品收集:制备完成之后,对沸腾干燥制粒流化床内部制得的碳酸氢钠颗粒进行收集,得到成品碳酸氢钠颗粒。
2.如权利要求1所述的一种碳酸氢钠片的制粒方法,其特征在于:所述步骤3中使用的沸腾干燥制粒流化床外部设置有观察窗口、喷料口,所述观察窗口的边缘设置有固定件,所述固定件包括固定圆环、螺钉,所述固定圆环的内部设置有透明玻璃,所述螺钉均匀设置在所述固定圆环的外部,所述螺钉穿过所述固定圆环固定连接所述沸腾干燥制粒流化床,所述喷料口设置在所述沸腾干燥制粒流化床的外壁上。
3.如权利要求2所述的一种碳酸氢钠片的制粒方法,其特征在于:所述步骤3中设置的加浆装置包括计量泵、喷枪、存料箱,所述计量泵的底部设置支架,所述计量泵的进料口设置有第一软管,所述计量泵的出料口设置有第二软管,所述喷枪穿过所述沸腾干燥制粒流化床的喷料口设置在所述沸腾干燥制粒流化床的内部,所述喷枪固定连接所述第二软管的另一端,所述存料箱设置在所述支架的下方,所述存料箱链接所述第一软管的另一端。

碳酸氢钠注射液产品生产工艺规程编号PI-XZ-0206-01规格:10ml:0.5g批量:300万mlXX市亚神制药目录1 生产处方12 生产工艺流程图33 生产操作要求14 工艺控制点215 质量标准256 原辅料、成品储存考前须知297 中间产品、成品容器、包装材料的要求及贮存方法298 技术经济指标计算及原辅包材的消耗定额299 工序损耗限度与物料平衡3010 主要生产设备3311 技术平安与劳动保护3412 工艺卫生3513 劳动组织、岗位定员与生产周期3614 综合利用和环境保护39附件40目的:建立10ml:0.5g碳酸氢钠注射液产品生产工艺规程,确保产品生产中所用的处方工艺符合注册要求、产品的生产过程符合2010年版GMP要求、最终的产品质量符合质量标准。
围:适用于规格为10ml:0.5g、批量为300万ml的碳酸氢钠注射液产品的生产全过程。
责任人:生产部负责人、质保部负责人、注射剂车间负责人。
正文:1 生产处方1.1 产品概述1.2 标准处方:批量100000ml处方〔每万支〕1.3 生产处方:批量300万ml生产处方〔30万支〕2 生产工艺流程图D 级 C 级B脱外包成品入库3 生产操作要求3.1 配制3.1.1 生产前检查QA人员和岗位负责人首先对称量间〔房间编号:404〕、配制间〔房间编号:208〕上次清场情况进展确认,肯定清场合格且在有效期,那么由岗位负责人挂上本批生产状态卡,否那么应重新清场。
3.1.2 备料3.1.2.1 车间物料员根据“批生产指令〞开具领料单,到仓库领取原辅料,仓库保管发料时应认真核对物料代码、品名、规格、批号、生产厂家、重量等标识信息,确保所发物料正确无误。
3.1.2.2 送料工在物料进入车间清外包间〔房间编号:401〕前检查并清洁原辅料外包装,应无可见粉尘、无污物、无水渍,合格后进入清外包间,脱去原辅料外包装,并在包装上粘贴标识,容包括品名、物料代码、批号、重量、生产厂家等信息。

碳酸氢钠片生产工艺规程目录1 概述2 处方及依据3 生产工艺流程及环境区域划分4 生产工艺的操作要求5 本产品工艺过程中所需SOP名称及要求6 原辅材料、半成品和成品的质量标准和贮存注意事项7 半成品检查方法及控制8 需要验证的关键工序及其工艺验证的具体要求9 包装袋、标签、包装箱的质量标准和检验方法及储存10 物料平衡及技术经济指标计算11 设备一览表及主要设备生产能力12 生产技术安全及劳动保护13 劳动组织与岗位定员14 综合利用和环境保护附件1常用理化常数、换算表附件2 附页(供登记批准日期、文号等内容用)一、目的:建立碳酸氢钠片生产工艺流程,用于该产品的生产指导。
二、适用范围:适用于碳酸氢钠片产品的生产和管理。
三、责任者:生产管理人员,各生产车间。
四、内容:1 概述1.1 产品名称【通用名】:碳酸氢钠片【英文名】:Sodium Bicarbonate Tablets【汉语拼音】: Tansuanqingna Pian1.2 【性状】:本品为白色片1.3 【作用与用途】:酸碱平衡调节药。
用于酸血症,调节酸碱平衡;内服治疗胃肠卡他;碱化尿液。
1.4 【用法与用量】:内服:一次量,马15~60g,牛30~100g,羊5~10g,猪2~5g,犬0.5~2g。
1.5 【含量规格】:0.3g1.6 【包装规格】:0.3g/片×100片/袋×20袋/中包×10中包/箱1.7 【有效期】:二年1.8 【贮藏】:密封,干燥处保存2 处方和依据碳酸氢钠50kg淀粉5kg硬脂酸镁0.15kg10%淀粉浆适量处方依据:《中国兽药典》2010年版一部武汉纽科源生物科技有限公司GMP管理文件3 生产工艺流程及环境区域划分3.1工艺流程图:3.2 环境区域划分:本品生产在30万洁净生产区域进行。
3.2.1 生产控制区:3.2.1.1 主要生产区,如原辅料处理至分装工序,均应在30万级的洁净环境下进行。

氢氧化钠加二氧化碳制碳酸氢钠工艺流程1.氢氧化钠溶液先与二氧化碳反应生成碳酸钠。
Sodium hydroxide solution reacts with carbon dioxide to form sodium carbonate.2.在此过程中,碳酸钠继续与氢氧化钠反应,生成碳酸氢钠。
During this process, sodium carbonate continues to react with sodium hydroxide to produce sodium bicarbonate.3.碳酸氢钠是一种重要的工业原料,用于制备泡打粉和制酸剂等产品。
Sodium bicarbonate is an important industrial raw material used to produce baking powder and acid regulators.4.工艺流程中需要控制反应温度和压力,以确保反应能够有效进行。
The process requires control of reaction temperature and pressure to ensure that the reaction proceeds effectively.5.碳酸氢钠可以在潮湿的环境中发生脱水反应,生成碳酸钠和二氧化碳。
Sodium bicarbonate can undergo a dehydration reaction ina humid environment, producing sodium carbonate and carbon dioxide.6.工艺中需要选择合适的反应容器和搅拌设备,以保证反应物质充分混合和接触。
The process requires the selection of appropriatereaction vessels and agitation equipment to ensure thorough mixing and contact of reactants.7.反应产物经过过滤、干燥和粉碎等处理后,可以得到纯净的碳酸氢钠产品。

宁波市XX制药有限公司生产部管理文件1.目的:编制规范化、标准化的工艺规程,作为全面指导生产和控制质量的基准性技术文件。
2.范围:多索茶碱片剂生产和质量控制的全过程。
3.责任:3.1 片剂车间负责生产全过程。
3.2 质量管理部门负责质量控制全过程。
3.3 工程部负责辅助设施、公用工程,在生产中进行全力配合。
4.管理内容:4.2 操作过程及工艺条件十万级洁净区:在洁净级别为十万级的控制区内,将多索茶碱原料、羟丙纤维素、淀粉、糊精过80目筛,取处方量的多索茶碱原料、羟丙纤维素、淀粉、糊精在湿法混合制粒机中混合均匀,加入7%淀粉浆适量混合制成软材,接着用16目摇摆式颗粒机制湿颗粒,在50-60℃条件下干燥,至含水分1.0-5.0℅后,用16目摇摆式颗粒机整粒并检测颗粒的粒度,加处方量硬脂酸镁在V型混合机中混匀,送样检验,控制主药多索茶碱含量在64.64-79.85%,在高速压片机中压片并观察外观、检测平均片重、崩解度、脆碎度,压好后的素片再铝塑包装。
一般生产区:在一般生产区进行外包后入库。
4.2.1 原辅料的复核生产用的原、辅料脱去外包装后经传递柜传入,仔细核对品名、规格、批号、检验报告单等,然后对它的重量进行认真复核。
4.2.2 原料原料多索茶碱过80目筛,过筛后的原料应盛装于洁净容器内,并放上物料状态标志。
4.2.3 辅料辅料羟丙纤维素、淀粉、糊精过80目筛,过筛后的辅料应分别盛装于洁净容器内,并放上物料状态标志。
配制7%淀粉浆。
4.2.4 原、辅料混合制软材将原、辅料在湿法混合制粒机中混合15分钟,并将7%淀粉浆加入适量制成软材,由出料口出料盛放在清洁的不锈钢盆里。
4.2.5 制粒混合均匀的软材,用16目摇摆式颗粒机制粒,制成的湿颗粒盛放于垫有烘布的不锈钢盘中,并需平铺开,盘中湿颗粒厚度不超过2cm。
4.2.6 干燥4.2.6.1 湿颗粒制成后应立即干燥,放置时间过久易受压变形结块。
温度应逐渐升高,并严格控制干燥温度,防止颗粒融熔、变质,定时记录干燥温度。

碳酸氢钠质量标准(原料)TansuanqingnaSodium BicarbonateNAHCO3 84.01 本品含NaHC03应为99.5%-100.5%(供注射、血液透析用),或不得少于99.0%(供口服用)【性状】本品为白色结晶性粉末;无臭,味咸;在潮湿空气中即缓缓分解;水溶液放置稍久,或振摇,或加热,碱性即增强。
本品在水中溶解,在乙醇中不溶。
【鉴别】本品的水溶液显钠盐与碳酸氢盐的鉴别反应(附录111)。
【检査】碱度取本品0.20g,加水20ml使溶解,依法测定(附录VI H),PH值应不髙于8.6。
溶液的澄清度取本品].1.Og,加水20ml溶解后,溶液应澄清(供注射、血液透析用);或与2号浊度标准液(附录IX B)比较,不得更浓(供口服用)。
氯化物取本品1.5g(供注射、血液透析用)或0.15g(供口服用),加水溶解使成25ml,滴加硝酸使成微酸性后,置水浴中加热除尽二氧化碳,放冷,依法检査(附录W A),与标准氯化钠溶液3.0ml制成的对照液比较,不得更浓〔0. 002%(供注射、血液透析用)或0.02%(供口服用)]。
硫酸盐取本品3.Og(供注射、血液透析用)或0.50g(供口服用),加水溶解使成40ml,滴加盐酸使成微酸性后,置水浴中加热以除尽二氧化碳,放冷,依法检査(附录W B),与标准硫酸钾溶液1. 5ml制成的对照液比较,不得更浓〔0. 005%(供注射、血液透析用)或0.03% (供口服用)]。
铵盐取本品l.Og,加氢氧化钠试液10ml,加热,发生的蒸气遇湿润的红色石蕊试纸不得变蓝色。
干燥失重取本品4.0g,置硅胶干燥器中干燥4小时,减失重量不得过0.2 5 %(附录VIII L)。
铝盐取本品l.Og(供血液透析用)两份,分别置100ml聚乙烯量瓶中,小心加人硝酸4ml,超声处理30分钟使溶解,一份用水稀释至刻度,摇匀,作为供试品溶液;另一份中加标准铝溶液〔精密量取铝单元素标准溶液适量,用水定量稀释制成每lml中含铝(Al)lug的溶液〕2. 0ml,用水稀释至刻度,摇匀,作为对照品溶液。

碳酸氢钠质量标准(原料)TansuanqingnaSodium BicarbonateNAHCO3 84.01 本品含NaHC03应为99.5%-100.5%(供注射、血液透析用),或不得少于99.0%(供口服用)【性状】本品为白色结晶性粉末;无臭,味咸;在潮湿空气中即缓缓分解;水溶液放置稍久,或振摇,或加热,碱性即增强。
本品在水中溶解,在乙醇中不溶。
【鉴别】本品的水溶液显钠盐与碳酸氢盐的鉴别反应(附录111)。
【检査】碱度取本品0.20g,加水20ml使溶解,依法测定(附录VI H),PH值应不髙于8.6。
溶液的澄清度取本品].1.Og,加水20ml溶解后,溶液应澄清(供注射、血液透析用);或与2号浊度标准液(附录IX B)比较,不得更浓(供口服用)。
氯化物取本品1.5g(供注射、血液透析用)或0.15g(供口服用),加水溶解使成25ml,滴加硝酸使成微酸性后,置水浴中加热除尽二氧化碳,放冷,依法检査(附录W A),与标准氯化钠溶液3.0ml制成的对照液比较,不得更浓〔0. 002%(供注射、血液透析用)或0.02%(供口服用)]。
硫酸盐取本品3.Og(供注射、血液透析用)或0.50g(供口服用),加水溶解使成40ml,滴加盐酸使成微酸性后,置水浴中加热以除尽二氧化碳,放冷,依法检査(附录W B),与标准硫酸钾溶液1. 5ml制成的对照液比较,不得更浓〔0. 005%(供注射、血液透析用)或0.03% (供口服用)]。
铵盐取本品l.Og,加氢氧化钠试液10ml,加热,发生的蒸气遇湿润的红色石蕊试纸不得变蓝色。
干燥失重取本品4.0g,置硅胶干燥器中干燥4小时,减失重量不得过0.2 5 %(附录VIII L)。
铝盐取本品l.Og(供血液透析用)两份,分别置100ml聚乙烯量瓶中,小心加人硝酸4ml,超声处理30分钟使溶解,一份用水稀释至刻度,摇匀,作为供试品溶液;另一份中加标准铝溶液〔精密量取铝单元素标准溶液适量,用水定量稀释制成每lml中含铝(Al)lug的溶液〕2. 0ml,用水稀释至刻度,摇匀,作为对照品溶液。
武汉纽科源生物科技有限公司GMP管理文件碳酸氢钠片生产工艺规程目录1 概述2 处方及依据3 生产工艺流程及环境区域划分4 生产工艺的操作要求5 本产品工艺过程中所需SOP名称及要求6 原辅材料、半成品和成品的质量标准和贮存注意事项7 半成品检查方法及控制8 需要验证的关键工序及其工艺验证的具体要求9 包装袋、标签、包装箱的质量标准和检验方法及储存10 物料平衡及技术经济指标计算11 设备一览表及主要设备生产能力12 生产技术安全及劳动保护13 劳动组织与岗位定员14 综合利用和环境保护附件1常用理化常数、换算表附件2 附页(供登记批准日期、文号等内容用)一、目的:建立碳酸氢钠片生产工艺流程,用于该产品的生产指导。
二、适用范围:适用于碳酸氢钠片产品的生产和管理。
三、责任者:生产管理人员,各生产车间。
四、内容:1 概述1.1 产品名称【通用名】:碳酸氢钠片147【英文名】:Sodium Bicarbonate Tablets【汉语拼音】: Tansuanqingna Pian1.2 【性状】:本品为白色片1.3 【作用与用途】:酸碱平衡调节药。
用于酸血症,调节酸碱平衡;内服治疗胃肠卡他;碱化尿液。
1.4 【用法与用量】:内服:一次量,马15~60g,牛30~100g,羊5~10g,猪2~5g,犬0.5~2g。
1.5 【含量规格】:0.3g1.6 【包装规格】:0.3g/片×100片/袋×20袋/中包×10中包/箱1.7 【有效期】:二年1.8 【贮藏】:密封,干燥处保存2 处方和依据碳酸氢钠50kg淀粉5kg硬脂酸镁0.15kg10%淀粉浆适量处方依据:《中国兽药典》2010年版一部3 生产工艺流程及环境区域划分3.1工艺流程图:武汉纽科源生物科技有限公司GMP管理文件3.2 环境区域划分:本品生产在30万洁净生产区域进行。
3.2.1 生产控制区:3.2.1.1 主要生产区,如原辅料处理至分装工序,均应在30万级的洁净环境下进行。
3.2.1.2车间内必须装备有效的除尘设备,该区域环境温度18℃~26℃,相对湿度30%~65%。
3.2.1.3该区域包括:原辅料暂存室、烘干室、粉碎过筛室、称量室、混合室、内包室及其他辅助功能房间。
3.2.1.3 进入该区的人员,必须进行更鞋、更衣、洗手、整装,头发全部包在帽子里,直接接触药品工序的操作员要戴口罩、手套。
作业员必须穿戴只供本区使用的工作服,操作人员必须身体健康有健康证,在工作期间,每年体检一次,患有传染病、隐性传染病、精神病及皮肤病患者立即调离工作岗位,不得直接从事兽药生产。
3.2.2.1人净程序:人→更鞋→一更(脱外衣、洗手)→缓冲间→进入一般生产区→更鞋→二更(一般区工衣、洗手)→缓冲间→进入生产区3.2.2.2人净标准3.2.2.3工作服标准3.3.2. 非生产控制区:3.3.2.1 该区域包括外包室、拆包室等。
3.3.2.2 仓储区域包括:原辅料区、包装材料区、成品区、待检区、不合格品区等。
其条件参照《仓库管理制度》。
3.3.3 生产控制区及非生产控制区域环境卫生,应达到该区域要求。
见《30万级生产区卫生管理制度》。
4 生产工艺的操作要求:4.1 领料备料4.1.1 各物料必须经质量部检验合格后方可使用。
原辅料生产商的变更应通过小样试验,必要时须通过验证。
4.1.2、根据生产指令单和领料单,从仓库领取原、辅料。
4.1.3、领料到生产线后,原辅料经拆外包装后通过传递窗进入相应的暂存室,外包装材料进入149外包材贮存室,碳酸氢钠等原辅料通过传递窗进入暂存室,并核对品名、规格、数量、批号,检查外观符合要求,填写领料记录。
4.2、粉碎、过筛4.2.1、粉碎机开机前要对各部件进行检查,注意检查筛网有无破损。
把布袋扎紧在粉碎机出粉口处。
开机空转1-2分钟后,再投放物料,进行粉碎过筛,筛网目数80目。
4.2.2、粉碎、过筛完毕,将细度合格粉末与不合格品或异物分别置于相应的洁净容器中,计量,计算物料平衡98.0~99.50%,贴上明显状态标志,移交下一工序。
4.2.3、清场并整理好原始记录。
工序状态卡的袋中,用于贴在下一批生产记录后。
4. 3称量配料:4. 3.1 生产前检查:按岗位规程检查,合格后方可生产。
4. 3.2 领料:按批生产指令和《物料领发岗位规程》领取本批生产所需原、辅料。
4. 3.3 称量:按生产指令称量,称量时有一人称量,有一人复核,及时记录,称量后,将物料做好标识,标明品名、规格、批号、数量、生产日期等。
称量好的原料如不立即投料应避光。
不可用手直接接触物料。
4. 3.4 清场:按《清场管理程序》对设备、操作间和工器具进行清洁并及时填写清场记录,清场完毕后由QA检查员检查,检查合格后QA人员发清场合格证正、副本,正本贴于本批,副本放入操作间门口工序状态卡的袋中,用于贴在下一批生产记录后。
4. 4制粒:4.4.1制软材4.4.1.1操作前应核对各原辅料品名、批号、数量。
4.4.1.2配浆(配粘合剂):用不锈钢桶装准确称量的工艺用水,开启电磁炉加热至沸腾,将已浆,放凉,备用,共制得约6kg的淀粉浆。
应注意安全,设备运转时不得将手及其它硬物伸入设备中;应注意烫伤。
4.4.1.3制软材,把准确称量好的淀粉和碳酸氢钠加入CH-200槽型混合机中混合,预混15分钟,加入粘合剂,搅拌2~3分钟。
即得。
一般情况下,判断软材以用手紧握能成团而不粘手,用手指轻压能散开为度,即所说的“握之成团,按之即散”。
4.4.2制湿颗粒4.4.2.1将制好的软材放入摇摆式颗粒机中制湿颗粒,筛网目数为12目。
4.4.2.2制好的湿颗粒装于不锈钢烘盘内,立即移交到干燥岗位。
4.4.3制粒完成后,应清洗槽型混合机、摇摆式颗粒机内残留物,保持设备清洁。
武汉纽科源生物科技有限公司GMP管理文件4.4.4清场,换好状态标志,并整理好原始记录。
4.5干燥4.5.1对清场效果进行确认后,换好状态标志,将要干燥的颗粒均匀撒布于烘盘上,每烘盘以1.5-2cm厚度为宜,上料时从顶上装盘依次向下防止异物掉入药料内。
4.5..2每车烘盘全部装好后,立即送进热风循环烘箱进行干燥,温度为50~60℃,时间为3~5小时。
干燥过程中按规定翻料,严格控制干燥温度,防止颗粒融熔、变质。
在烘箱内取样检查水分是否符合内控质量标准(2.0%颗粒的水分应≤6.0%),如不符合标准,按上法继续烘干直至符合内控标准。
4.5.3烘干完毕,将烘干颗粒置于洁净容器中,计量、贴上明显状态标志。
4.5.4清场并整理好原始记录。
4.6、整粒4.6.1、整粒前应核对物料标签的品名、规格、数量与内容物相符。
4.6.2、开机前先对各部件进行检查,注意检查筛网有无破损。
再开机空转1-2分钟,检查设备运行情况。
4.6.3、运行正常后,使用YK-160摇摆颗粒机进行整粒,筛网目数10目。
计算整粒后合格产品收率,收率应在95.0-100.0%,标明品名、批号、数量、操作者姓名、日期,移交下一工序。
4.6.4、整粒后应立即清洗摇摆颗粒机内残留物,保持设备清洁。
4.6.5、清场,换好状态标志,整理好原始记录。
4.7、总混4.7.1、核对整粒岗位移交来的颗粒的品名、批号、数量。
4.7.2、检查各准备工作无误后,将领来的颗粒、硬脂酸镁进行混合,每次混合15分钟。
4.7.3、混合完毕,目检物料均匀度符合要求后,将混合好的半成品装入清洁的容器,计量、计算物料平衡99.0~100.0%。
容器贴上标有品名、批号、数量、生产日期、操作者姓名等内容的标签,移交中间站。
4.7.4、填写请验单。
请质量部取样人员取样检测。
4.7.5、清场并整理好原始记录。
4.8、压片理论片重(g/片)=含量规格(g/片)/主药在总混料物中含量(%)4.8.1核对总混岗位移交来的颗粒的品名、批号、数量。
1514.8.2将总混料加入ZP35D旋转式压片机的料斗内,按压片机标准操作过程开机试压,调节片重、硬度、厚度、压力,并检查片重、硬度、厚度、崩解度、脆碎度、外观。
符合要求后才能进行压片,并定时抽样检查片重(15分钟一次),及时做好生产记录。
发现片重差异超限时,将超限部分药片单独存放,由QA进行处理。
4.8.3压片结束后,将压好的半成品装入清洁的容器,计量、计算物料平衡95.0~100.0%。
容器贴上标有品名、批号、数量、生产日期、操作者姓名等内容的标签,移交中间站。
4.8.4清场并整理好原始记录。
4.9、分装、封口,按每袋100片装入袋中,封口。
4.9.5分装完毕,移交到下一工序,计算物料平衡98.0~99.5%。
4.9.6清场并整理好原始记录。
4.10包装4.10.1按批包装指令领取包装材料,操作前应核对半成品的名称、规格、批号及数量应与所领用的包装材料、标签全部相符,调整打码机钢字按指令打印批号。
4.10.2包装过程中时要注意检查数量、合格证等,并核对品名、规格、批号、数量、生产日期、有效期。
合格证(装箱单)必须印有产品的批号、生产日期、装箱员工号、质检员工号等。
装好箱后封箱。
4.10.3产品装箱后,要及时入库保存,入库时要将产品先存放在仓库待验区,包装负责人要及时填写寄库单。
产品经质保部抽样检验合格后,方可出库。
4.10.4包装结束,应准确统计标签的领用数、实用数及剩余数,计算包装物料平衡。
并按(报废材料处理规定)处理剩余标签和报废标签;以及计算成品率,限度为95.0%~100.0%。
4.10.5必须在标签上注明生产日期、生产批号、有效期。
4.10.6不合格标签等包装材料按规定的程序处理。
4.10.7包装结束后,包装品入库待验,生产线组长填写成品请验单,检验合格后入库核对包装品的品名、规格、批号、数量。
4.10.8清场并整理好原始记录。
5本产品工艺过程中所需SOP名称武汉纽科源生物科技有限公司GMP管理文件1536、原辅材料、半成品和成品质量标准和技术参数和贮存注意事项6.1碳酸氢钠原料质量标准见《碳酸氢钠原料质量标准》6.2硬脂酸镁质量标准见《硬脂酸镁辅料质量标准》6.3淀粉的质量标准见《淀粉辅料质量标准》6.4碳酸氢钠颗粒标准见《碳酸氢钠颗粒质量标准》6.5碳酸氢钠片质量标准见《碳酸氢钠片内控质量标准》6.6中间产品质量标准和技术参数:6.7贮存注意事项:密封,干燥处保存7.半成品检查方法及控制7.1半成品检查方法参见《碳酸氢钠片检验操作规程》。
武汉纽科源生物科技有限公司GMP管理文件7.2半成品的控制1559 包装袋、标签、包装箱的质量标准和检验方法及储存9.1 包装袋的质量标准和检验方法: 包装袋的质量标准及检验方法见 《塑铝复合袋质量标准和检验操作规程》9.2 标签的质量标准和检验方法: 标签的质量标准及检验方法见 《标签、合格证质量标准及检验操作规程》9.3 包装箱的质量标准和检验方法:包装箱的质量标准及检验方法见 《纸箱质量标准及检验操作规程》10 物料平衡及技术经济指标计算10.1 物料平衡:10.2 成品率:95.0—100.0%成品:指生产过程终结并经检验合格的产品。