山东大学无机化学
- 格式:docx
- 大小:201.81 KB
- 文档页数:17

无机化学排名学校名称等级排名学校名称等级排名学校名称等级1南京大学A+7山东大学A13郑州大学A2吉林大学A+8东北师范大学A14清华大学A3南开大学A+9兰州大学A15武汉大学A4北京大学A+10复旦大学A16同济大学A5中国科学技术大学A11厦门大学A17苏州大学A6中山大学A12浙江大学AB+等(26个):北京师范大学、黑龙江大学、福州大学、湖南大学、北京理工大学、四川大学、中南大学、北京化工大学、华中科技大学、哈尔滨工业大学、安徽大学、长春理工大学、西北大学、天津大学、华东理工大学、山西大学、上海交通大学、宁波大学、上海大学、山西师范大学、大连理工大学、辽宁师范大学、辽宁大学、暨南大学、陕西师范大学、河南大学B等(25个):广西师范大学、河南师范大学、青岛科技大学、西北师范大学、河北大学、华东师范大学、华南理工大学、新疆大学、南昌大学、武汉理工大学、汕头大学、河北师范大学、曲阜师范大学、哈尔滨师范大学、安庆师范学院、安徽师范大学、内蒙古大学、华中师范大学、贵州大学、湖北大学、中北大学、沈阳化工学院、云南师范大学、江苏大学、西南大学The furthest distance in the worldIs not between life and deathBut when I stand in front of youYet you don't know thatI love you.The furthest distance in the worldIs not when I stand in front of youYet you can't see my loveBut when undoubtedly knowing the love from bothYet cannot be together.The furthest distance in the worldIs not being apart while being in loveBut when I plainly cannot resist the yearningYet pretending you have never been in my heart.The furthest distance in the worldIs not struggling against the tidesBut using one's indifferent heartTo dig an uncrossable riverFor the one who loves you.倚窗远眺,目光目光尽处必有一座山,那影影绰绰的黛绿色的影,是春天的颜色。

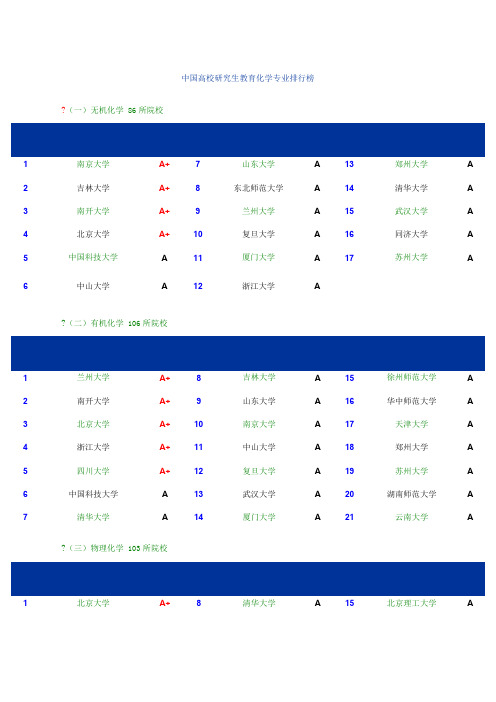
中国高校研究生教育化学专业排行榜?(一)无机化学 86所院校1南京大学A+7山东大学A13郑州大学A 2吉林大学A+8东北师范大学A14清华大学A 3南开大学A+9兰州大学A15武汉大学A 4北京大学A+10复旦大学A16同济大学A 5中国科技大学A11厦门大学A17苏州大学A 6中山大学A12浙江大学A?(二)有机化学 106所院校1兰州大学A+8吉林大学A15徐州师范大学A 2南开大学A+9山东大学A16华中师范大学A 3北京大学A+10南京大学A17天津大学A 4浙江大学A+11中山大学A18郑州大学A 5四川大学A+12复旦大学A19苏州大学A 6中国科技大学A13武汉大学A20湖南师范大学A 7清华大学A14厦门大学A21云南大学A ?(三)物理化学 103所院校1北京大学A+8清华大学A15北京理工大学A2吉林大学A+9南京大学A16福州大学A 3中国科技大学A+10大连理工大学A17华东师范大学A 4复旦大学A+11武汉大学A18天津大学A 5浙江大学A+12北京师范大学A19中山大学A 6厦门大学A13山东大学A20湖南大学A 7南开大学A14辽宁师范大学A?(四)分析化学 97所院校1武汉大学A+8西南大学A15山东大学A 2北京大学A+9东北大学A16西北师范大学A 3厦门大学A+10中国科技大学A17四川大学A 4南京大学A+11兰州大学A18陕西师范大学A 5湖南大学A12南开大学A19中南大学A 6浙江大学A13华东师范大学A7吉林大学A14复旦大学A?(五)高分子化学与物理 73所院校1吉林大学A+6南京大学A11中国科技大学A 2复旦大学A+7浙江大学A12北京化工大学A 3南开大学A+8四川大学A13清华大学A 4北京大学A9上海交通大学A14武汉大学A化学专业A+级中国科学院化学研究所(1)上海有机化学研究所;(2)北京化学研究所;(3)大连化学物理研究所;(4)长春应用化学研究所;(5)福建物质结构研究所——————————————————————————————————————————————————————————中国高校研究生教育化工专业排行榜(一)化学工程 55所院校1天津大学A+5北京化工大学A9中国石油大学A 2清华大学A+6大连理工大学A10四川大学A 3华东理工大学A7华南理工大学A11中南大学A 4浙江大学A8南京工业大学A(二)化学工艺 97所院校1中国石油大学A+8浙江大学A15湖南大学A 2华东理工大学A+9清华大学A16中南大学A 3北京化工大学A+10四川大学A17郑州大学A 4太原理工大学A+11南京工业大学A18西北大学A 5天津大学A12广西大学A19武汉科技大学A 6大连理工大学A13河北工业大学A—————————————————————————————————————————下面是各个专业研究生的考试科目070301无机化学专业研究生01配合物化学02无机材料化学03无机分子设计与组装04能源与环境化学05生物无机化学①101政治(含法律硕士)②201英语(含法律硕士)③730有机化学④912无机化学070302◢分析化学专业研究生01环境与工业过程监测02波谱分析(含电分析)03化学计量学与智能分析仪器04生化、医药检测新技术05现代光分析化学及联用技术06植物分析分离新技术①101政治(含法律硕士)②201英语(含法律硕士)③730有机化学④912无机化学070303有机化学专业研究生01功能高分子02医药原料及中间体合成03药用植物活性成分提取与分离04不对称合成与手性拆分05有机合成新方法研究06 应用电化学①101政治(含法律硕士)②201英语(含法律硕士)③730有机化学④912无机化学070304物理化学专业研究生01材料物理化学02热化学与热电化学03物质结构与性能04界面与催化05应用量子化学06应用电化学①101政治(含法律硕士)②201英语(含法律硕士)③730有机化学④912无机化学070305高分子化学与物理专业研究生01功能高分子(生物医用高分子、光电信息高分子、分离用高分子材料、高分子试剂和催化剂)02高分子的分子设计与合成03高分子凝聚态结构与性能04高分子复合材料05特种涂料与粘结剂①101政治(含法律硕士)②201英语(含法律硕士)③730有机化学④912无机化学080601◢冶金物理化学专业研究生01冶金热力学与动力学02应用电化学(含热电化学、光催化电化学)03材料物理化学(光电转换材料、能源材料、催化材料、纳米材料、功能高分子材料、无机非金属材料、超临界材料)04环境物理化学05冶金过程模拟与模型①101政治(含法律硕士)②201英语(含法律硕士)③301数学一④912无机化学081701◢化学工程专业研究生01催化反应工程02化工分离工程03生化分离工程04化工过程模拟优化05资源再生工程①101政治(含法律硕士)②201英语(含法律硕士)③302数学二④916化工原理081702◢化学工艺专业研究生01化工冶金02分离科学与工艺03精细化工04环境化工05化工新材料①101政治(含法律硕士)②201英语(含法律硕士)③302数学二④916化工原理081703◢生物化工专业研究生01药剂成型技术02天然药物活性成分分离技术03药物分子设计与构效关系04酶工程与生物转化05细胞工程06生物电化学①101政治(含法律硕士)②201英语(含法律硕士)③302数学二④910生物化学(C)081704◢应用化学专业研究生01精细化工新产品、新技术02信息功能材料(含生物医用材料、分子与固体电子材料、纳米材料等) 03应用电化学(化学电源及其新材料、电化学合成等)04能源材料化学05分子生物电化学06药物合成与构效分析07功能高分子材料①101政治(含法律硕士)②201英语(含法律硕士)③302数学二④912无机化学081705◢工业催化专业研究生01催化材料设计与制备02催化反应工程03相转移催化技术04酶制备与酶催化技术05电催化技术06电池催化材料①101政治(含法律硕士)②201英语(含法律硕士)(含法律硕士)③302数学二④916化工原理081720◢★制药工程专业研究生01药物反应工程02药物分离工程03药物制剂新技术04中药复方筛选与优化05制药过程在线检测与控制技术①101政治(含法律硕士)②201英语(含法律硕士)③302数学二④910生物化学(C)。
![中级无机化学[第五章原子簇化合物] 山东大学期末考试知识点复习](https://img.taocdn.com/s1/m/9ac8ff1210a6f524ccbf8528.png)

无机化学(86)
排名学校名称
等
级排
名
学校名称
等
级
排
名
学校名称等级
1南京大学A+7山东大学A13郑州大学A
2吉林大学A+8东北师范大学A14清华大学A
3南开大学A+9兰州大学A15武汉大学A
4北京大学A+10复旦大学A16同济大学A
5中国科学技术大学A11厦门大学A17苏州大学A
6中山大学A12浙江大学A
B+等(26个):北京师范大学、黑龙江大学、福州大学、湖南大学、北京理工大学、四川大学、中南大学、北京化工大学、华中科技大学、哈尔滨工业大学、安徽大学、长春理工大学、西北大学、天津大学、华东理工大学、山西大学、上海交通大学、宁波大学、上海大学、山西师范大学、大连理工大学、辽宁师范大学、辽宁大学、暨南大学、陕西师范大学、河南大学
B等(25个):广西师范大学、河南师范大学、青岛科技大学、西北师范大学、河北大学、华东师范大学、华南理工大学、新疆大学、南昌大学、武汉理工大学、汕头大学、河北师范大学、曲阜师范大学、哈尔滨师范大学、安庆师范学院、安徽师范大学、内蒙古大学、华中师范大学、贵州大学、湖北大学、中北大学、沈阳化工学院、云南师范大学、江苏大学、西南大学
在报考研究生考试前要全方位的了解你所要报考的专业还有最重要的择校问题,对于跨考的同学来说,报考学校的信息是重中之重,一定要找专业的辅导机构来帮助你完成考前的信息搜集,备考的复习计划,以及考后的复试准备等,如果需要调剂这些机构也可以帮你了解到最全的信息,像北京的爱!考等!!。



若在几十年前,我们的父辈们或许还可以告诉我们,未来从事怎样的职业,会有很好的发展,不至于失业。
而如今,他们大抵再也不能如此讲话了,只因这个世界变化的如此之快,在这变化面前,他们大概比我们还要慌乱,毕竟他们是从传统的时代走来的,这个更新换代如此迅速的世界只会让他们措手不及。
但是,虽然如此,他们却可以告诉我们一条永远也不会过时的生存法则,那就是掌握不断学习的能力。
所以,经过各种分析考量我终于选择了考研这条路,当然,这是只是,千万条路中的一条。
只不过我认为,这条路可操作性比较强,也更符合我们当下国情。
幸运的是,我如愿以偿,考到自己希望的学校。
一年的努力奋斗,让自己从此走上了截然不同的人生道路。
秋冬轮回,又是一年春风吹暖。
在看到录取名单之后,我终于按捺不住发了我一条朋友圈,庆祝考研胜利。
当时收到了很多平时不太联系的同学,发来的询问信息,这也促使我想将我的备考经验写下来,希望真的可以帮助接下来备考的学弟学妹们!因为想要讲的话太多,所以这篇文章会比较长,希望各位能够一点点看完。
或许会从我的经验教训中找到自己的方向以及方法来面对考研。
在结尾处会奉上我的学习资料供大家下载。
山东大学化学的初试科目为:(101)思想政治理论(201)英语一(628)理论化学(835)合成化学参考书目为:1、《物理化学简明教程》(第四版),印永嘉等主编,高等教育出版社2007版2、《无机化学》(第一版),宋其圣等主编,化学工业出版社2008年版;3、《分析化学》(第四版),武汉大学主编,高等教育出版社4、《精编有机化学教程》(第二版),郝爱友、孙昌俊主编,山东大学出版社2009年版先说说英语复习心得一.词汇词汇的复习流程其实都比较熟悉了,就是反复记忆。
考研要求掌握5500的词汇量,这是一个比较大的工,我建议考研词汇复习的参考书至少要有两本,一本是比较流行的按乱序编排的书,另一本是按考试出现频率编排的书,也就是所谓的分级词汇或分频词汇,我使用的是木糖的单词和真题,很精练,适合后期重点巩固使用,工作量也不是很大。
![中级无机化学[第七章元素与元素性质的周期性]-山东大学期末考试知识点复习](https://img.taocdn.com/s1/m/a18e231311a6f524ccbff121dd36a32d7375c721.png)
第七章元素与元素性质的周期性1.周期表与元素周期表的分区:按原子最后一个电子占据的轨道,周期表中元素可分为5个区。
s区的价电子构型为ns1~2,p区的价电子构型为ns2np1~6,d区的价电子构型为(n-1)d1~9ns1~2,ds区的价电子构型为(n—1)d10ns1~2,f区的价电子构型为(n —2)f0~14(n—1)d0~2ns2。
构造原理:基态多电子原子的电子填充原子轨道的一般次序为1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f→5d→6p→7s→5f→6d→7p 构造原理的前提条件是连续轨道间具有较大的能级差,而电子间的排斥作用相对较小。
对于d区元素与f区元素,由于价轨道间能级差较小,当电子间排斥作用超过轨道间能级差时,原子的价电子构型就会出现提前到达全满、半满的不符合构造原理的特殊构型。
通常,亚层轨道为全满或半满时比较稳定。
2.原子性质的周期性(1)原子半径一般规律:同一族元素,从上到下原子半径依次增大;同一周期主族元素,从左到右原子半径依次减小.镧系收缩:从镧到镥,原子半径和三价离子半径逐渐减小。
镧系收缩造成镧系后第三系列过渡元素的原子半径比一般的增大幅度小,与第二系列过渡同一族元素的原子半径接近.d电子也具有较差的屏蔽效应,造成d区元素半径收缩.原子半径存在不同的类型,主要有金属半径、离子半径、共价半径、van der Waals半径,使用时需要注意。
(2)电离能元素第一电离能的一般规律:同一族元素,从上到下逐渐减小;同一周期元素,从左到右大体上依次增大。
元素第一电离能最小的元素为周期表左下角的Cs,元素第一电离能最大的元素为周期表右上角的He.该规律一般可用的变化规律来解释。
原子有效核电荷Zeff(3)电子亲和能电子亲和能的周期性变化比较复杂,变化趋势不很清晰。
粗略的规律为:同一周期元素,从左到右原子电子亲和能依次增大,这可用原子有效核电荷Z的变化规律来解释。

无机化学一、专业介绍1、概述:无机化学是化学下属的二级学科,是以实验为基础的一门基础性学科,是研究无机物质的组成、性质、结构和反应的科学,是化学中最古老的分支学科。
近年来,无机化学的研究与发展越来越受到化学界的重视,现已从最早的理论性研究逐步地进入到人类社会的现代化建设中。
无机化学是我国最早设置的化学专业之一。
2、研究方向:无机化学的研究方向主要有01无机合成化学02能源材料化学03无机纳米材料04化学电源05功能性配合物化学06生物无机化学(注:各大院校的研究方向有所不同,以南开大学为例)3、培养目标:本专业硕士学位获得者应具有较深厚的近代无机化学和结构化学等基础理论知识;熟悉并掌握近代无机合成技术以及对化合物进行表征的常用近代物理研究方法、现代化学实验技术;了解相关领域在国内外的现状和发展趋势,能够适应我国经济、科技、教育发展需要;具有较好的实验技能和总结归纳分析问题的能力,能独立进行科研工作;有严谨的学风;至少掌握一门外国语,具有较熟练的阅读能力以及一定的写作和听说能力。
毕业后可胜任高校、科研院所和企业单位的教育、科研和应用开发或管理工作。
4、研究生入学考试科目:①101思想政治理论②201英语一③708综合化学④820无机化学(注:各大院校的考试科目有所不同,以南开大学为例)5、相关专业与无机化学专业相关的二级学科有:分析化学、有机化学、物理化学、高分子化学与物理二、专业素质要求及就业无机化学是化学科学中发展最早的一个分支学科。
它承担着研究所有元素的单质和化合物(碳氢化合物及衍生物除外)的组成、结构、性质和反应的重大任务。
当前无机化学的发展有两个明显趋势,即在广度上的拓宽和深度上的推进。
它与现代文明的三大支柱:能源、信息和材料紧密相联。
随着各学科的相互渗透及其自身的新成就,无机化学学科已发展到一个新阶段,在新材料的制备及应用上,已具有了相当重要的战略地位,具有广阔的发展前景,同步于材料科学、生命科学以及信息、能源的发展,是各类交叉学科的源始学科,特别是材料科学的发展强烈地依赖于无机化学。

第一学期无机化学试题一.名词解释(每个2分,共30分)理想气体;过热现象;钻穿效应;状态函数;盖斯定律;活化能;盐类水解;溶液;反应级数;氧化数;电负性;电离能;化学键;晶格能;镧系收缩。
二.问答题(每题5分,共40分)1.非电解质稀溶液的依数性有哪些?用其中之一,设计一最合理的实验测定葡萄糖的莫尔质量。
2.试判断下列过程熵变的正负号(1)溶解少量食盐于水中;(2)水蒸气和炽热的碳反应生成CO和H2;(3)冰熔化变为水;(4)石灰水吸收CO2;(5)石灰石高温分解。
3.解释下列事实:(1)AgCl在纯水中的溶解度比在盐酸中的溶解度大;(2)BaSO4在硝酸中的溶解度比在纯水中的溶解度大;(3)Ag3PO4在磷酸中的溶解度比在纯水中的大;(4)PbS在盐酸中的溶解度比在纯水中的大;(5)Ag2S易溶于硝酸但难溶于硫酸;4.根据酸碱质子理论,按由强到弱的顺序排列下列各碱:NO2-、SO42-、HCOO-、HSO4-、Ac-、CO32-、S2-、ClO4-。
根据酸碱电子理论,按由强到弱的顺序排列下列各酸:Li+、Na+、K+、Be2+、Mg2+、Al3+、B3+、Fe2+。
5.在原子的量子力学模型中,电子的运动状态要用几个量子数来描述?简要说明各量子数的物理含义、取值范围和相互间的关系。
6.试判断满足下列条件的元素有哪些?写出它们的电子排布式、元素符号和中文名称。
(1) 有6个量子数为n=3、l=2的电子,有2个n=4、l=0的电子;(2) 第五周期的稀有气体元素;(3) 第四周期的第六个过渡元素;(4) 电负性最大的元素;(5) 基态4p 轨道半充满的元素。
7.根据共价键理论,说明下列分子或离子的成键情况和空间构型:H 2O ;CO 2;PCl 4+;SO 3;NO 2-。
8.根据分子轨道理论,判断下列分子或离子的磁性大小和稳定性高低:CO ;O 2;O 22-。
三.计算题(每题10分,共30分)1.向含有Cd 2+和Fe 2+浓度均为0.020 mol ·dm -3的溶液中通入H 2S 达饱和,欲使两种离子完全分离,则溶液的pH 应控制在什么范围?已知K sp ︒(CdS)=8.0×10-27,K sp ︒(FeS)=4.0×10-19,常温常压下,饱和H 2S 溶液的浓度为0.1 mol ·dm -3,H 2S 的电离常数为K a1︒=1.3×10-7,K a2︒=7.1×10-15。

无机化学试题一.写出有关的化学反应方程式并配平(20分)。
1.用氢碘酸处理CuO;2.朱砂溶于王水;3.向磷与溴的混合物中滴加水;4.五硫化二锑溶于烧碱溶液;5.光气与氨气反应;6.单质磷溶于热烧碱溶液;7.氯气通入含有氢氧化铋的烧碱溶液;8.砷化氢通入硝酸银溶液;9.向磷酸二氢钠溶液中滴加硝酸银溶液;10.用烧热的铅除去酒中含有的醋酸。
二.述下列制备路线,并写出有关的反应方程式(30分)。
1.目前工业上主要采用什么方法生产氢氟酸、盐酸和氢溴酸?如果用H2和Br2直接燃烧法生产HBr而又不降低HBr的产率,实际生产中应采取什么措施?2.以硼镁矿为主要原料制备乙硼烷。
3.以铬铁矿为主要原料制备铬黄。
三.回答下列问题(40分)。
1.向Hg2+溶液中加入KI溶液时生成红色HgI2沉淀,继续加入过量的KI溶液,HgI2沉淀溶解得无色的HgI42-配离子溶液。
请说明HgI2有色而HgI42-无色的原因。
2.什么是自旋-禁阻跃迁?为什么Mn(H2O)62+配离子几乎是无色的?3.一些顺式铂的配合物可以作为活性抗癌药剂,如cis-PtCl4(NH3)2、cis-PtCl2(NH3)2、cis-PtCl2(en)等。
实验测得它们都是反磁性物质,试用杂化轨道理论说明它们的成键情况,指出它们是内轨型配合物还是外轨型配合物。
4.KClO3固态受热,在360℃时出现一吸热过程,500℃时出现一放热过程,580℃时再次放热并显著失重,770℃时又发生一吸热过程。
请加以解释。
5.常见的金属硫化物中,哪些易溶于水?哪些可溶于稀盐酸?哪些可溶于浓盐酸?哪些可溶于硝酸溶液?哪些可溶于王水?试用6种试剂,将下列6种固体从混合物中逐一溶解,每种试剂只能溶解一种物质,并说明溶解次序。
BaCO3,AgCl,KNO3,SnS2,CuS,PbSO4。
6.写出下列物质主要成分的化学式:毒重石,孔雀石,绿柱石,萤石,天青石。
7.分析说明NH3、N2H4、NH2OH、N3H的酸碱性变化规律。

山东大学考研参考书目山东大学2013年起不再提供参考书目,请参照2011年。
山东大学历史文化学院2012年硕士生招生书目661考古综合:《考古学通论》,蔡凤书编,山东大学出版社1983年版;《考古学理论、方法与技术》,栾丰实、方辉编,文物出版社2002年版;《新中国的考古发现与研究》,中国社会科学院考古研究所编,文物出版社1985年版。
历史学基础:不指定参考书目348文博综合:以该专业学位教指委拟定的考试大纲(参见我校招生网页)为准。
840管理学:《管理学——原理与方法》(第四版),周三多主编,复旦大学出版社;《管理学》(第一版),徐向艺主编,山东人民出版社2005年版。
639文书学:《现代文书学》,韩英主编,青岛出版社2003年版。
874档案管理学:《档案管理学》(修订本),邓绍兴等主编,中国人民大学出版社1997年版;《档案学概论》,冯惠玲等主编,中国人民大学出版社2001版。
山东大学外国语学院2012年硕士招生参考书目领先考研可能是最全的考研教材电子书屋621实践英语:《大学英汉翻译教程》,王治奎编,山东大学出版社1995年版;《大学汉英翻译教程》,王治奎编,山东大学出版社1997年版;《汉英翻译基础》,陈宏薇主编,上海外语教育出版社1998年版。
817专业英语:《简明英语语言学教程》(新版),戴炜栋等编著,上海外语教育出版社;《英国文学简史》,刘炳善编,河南大学出版社2000年版;《英国文学选读》(1-2册),杨岂深编,上海译文出版社1998年版;《美国文学简史》,常耀信著,南开大学出版社1999年版;《美国文学名著精选》,钱青主编,商务印书馆1994年版。
622实践俄语:《大学俄语》(高级部分),北京外国语大学俄语学院编著,外语教学与研究出版社;《实用俄汉汉俄翻译》,张永全主编,山东大学出版社;《现代俄语语法教程》(词法、句法),钱晓蕙、袁妮主编,中国人民大学出版社;《现代俄语语法》,周祖礼、陈洁编著,上海外语教育出版社。

山东大学材料科学与工程学院材料工程专业硕士学位研究生培养方案(2009年9月开始执行).一、培养目标材料科学与工程学科专业硕士学位培养德、智、体全面发展的高层次应用研究型或工程技术型人才。
具有高的政治思想觉悟、良好的道德品质修养,遵纪守法,学风严谨务实。
掌握本学科坚实的理论基础和系统的专门知识,具有从事应用基础研究或专门技术开发的综合能力。
较熟练掌握一门外语。
具有健康的体魄和心理素质。
为高等院校和科研院所培养富有潜质的应用研究型人才、或为高新技术企业输送高质量的技术开发型人才。
二、培养方式作为工学硕士和工程硕士研究生之间的重要补充,专业学位硕士生培养遵循“扎实的理论基础;突出的专业技能”的原则,按材料科学与工程学科一级学科培养专业学位硕士研究生。
充分利用校内外优质教育平台和资源,提倡研究生进行“三种经历”、实行双导师合作培养。
专业硕士学位研究生的培养工作,在课程设置上与工学硕士生相同,以脱产培养为主;在论文课题阶段,强调研究生的专业技能、研发能力的培养:(1)鼓励参与大中型企业重大实际课题,采用联合培养方式,并聘请企业高级工程师任兼职导师,参与工程硕士研究生培养全过程;(2)在校内导师的指导下进行应用基础类或实际应用技术类课题的研究,达到同样的专业技能和研发能力的培养要求。
三、研究方向1.金属材料及工程研究金属材料成分—合成/制备—组织—性能间的关系、以及先进热处理工艺、表面强化技术等。
2. 无机非金属材料及工程研究无机非金属材料成分—合成/制备—组织—性能间的关系、以及先进陶瓷成型工艺、热压烧结和微波烧结的技术。
3.高分子材料及工程研究高分子材料成分—合成/制备—组织—性能间的关系、以及先进聚合工艺和成形技术。
4.材料加工工程研究材料塑性成形(锻压)与轧制(压力加工)、铸造、焊接等加工工艺;材料加工过程的计算机模拟和仿真;材料加工设备及自动化。
5.材料物理化学研究功能材料的化学合成原理及工艺、材料的物理性质及表征、以及服役环境下材料无理及化学行为。

山东大学《无机化学》课后习题答案第二章物质的状态习题2.1 什么是理想气体?实际气体在什么条件下可用理想气体模型处理?2.2 为什么家用加湿器都是在冬天使用,而不在夏天使用?2.3 常温常压下,以气体形式存在的单质、以液体形式存在的金属和以液体形式存在的非金属单质各有哪些?2.4 平均动能相同而密度不同的两种气体,温度是否相同?压力是否相同?为什么?2.5 同温同压下,N2和O2分子的平均速度是否相同?平均动能是否相同?2.6试验测得683K、100kPa时气态单质磷的密度是2.64g·dm-3。
求单质磷的分子量。
2.71868年Soret用气体扩散法测定了臭氧的分子式。
测定结果显示,臭氧对氯气的扩散速度之比为1.193。
试推算臭氧的分子量和分子式。
2.8常压298K时,一敞口烧瓶盛满某种气体,若通过加热使其中的气体逸出二分之一,则所需温度为多少?2.9氟化氙的通式为XeF x(x=2、4、6…),在353K、1.56×104Pa时,实验测得某气态氟化氙的密度为0.899g·dm-3。
试确定该氟化氙的分子式。
仅供学习交流温度为300K、压强为3.0×1.01×105Pa时,某容器含,每升空气中水汽的质量。
(2)323K、空气的相对湿度为80%时,每升空气中水汽的质量。
已知303K时,水的饱和蒸气压为4.23×103Pa;323K时,水的饱和蒸气压为1.23×104Pa。
2.10在303K,1.01×105Pa时由排水集气法收集到氧气1.00dm3。
问有多少克氯酸钾按下式分解?2KClO3 === 2KCl + 3O2已知303K时水的饱和蒸气压为4.23×103Pa。
2.11 298K,1.23×105Pa气压下,在体积为0.50dm3的烧瓶中充满NO和O2气。
下列反应进行一段时间后,瓶内总压变为8.3×104Pa,求生成NO2的质量。

2013山东大学生命科学学院生物化学真题回忆一名词解释12个每个2分差向异构体丝氨酸蛋白酶酶的活性部位双向电泳糖异生前手性酮体一碳单位错配修复冈崎片段氨酰-tRNA合成酶三、简答题(一个四分~)1.某种酶纯化后的活力单位比粗提取的活力单位还要高,为什么?2.A蛋白分子量是60KD,用尿素处理后检测到30KD的条带,用尿素和巯基乙醇处理后检测到15KD的条带,请分析一下这个蛋白的结构。
3.有一个六肽,组成是2R A S V Y. N端检测到N末端是A,用胰蛋白酶处理后得到A (V R)(R S Y) .羧肽酶A处理后没有得到任何氨基酸。
糜蛋白酶处理后得到(A R V Y)(R S)括号里的都不确定顺序。
请说出六肽的顺序组成。
4.砷酸能否抑制葡萄糖氧化降解代谢。
5.比较丙酮酸脱氢酶系和a-酮戊二酸脱氢酶系反应异同。
6.氨基酸降解的主要步骤,利用氨基酸降解产能存在什么问题?7.说出下列情况下Tm值曲线的变化(1)降低溶液离子浓度(2)加入少量乙醇8.大肠杆菌中合成的DNA是一段一段的,但是尿嘧啶糖基化酶缺陷的大肠杆菌中只有一半是一段一段的,为什么?9.在T7噬菌体的mRNA转录体中,有一段5'-ACGAGGUAA-3' 中的G全部突变成A,会有什么后果?10.DNA中的密码子由ATA突变成了ATG,对多肽链产物有什么影响?(题后附密码子字典)四、论述题(一个八分)1.设计一个实验检测肽链中的二硫键,肽链中有三个Cys。
2.给出了一个血红蛋白和氧的图像,侧标是英文的。
标准情况下图像是第三条,在下列情况下,图像是哪一条。
左边有两条右边有一条BPG 浓度升高 CO2浓度升高 PH降低四级结构遭到破坏3.HbF 和HbA的题,给了一个材料,(1)HbA和HbF哪个与氧的亲和力更高(2)请解释一下为什么胎儿和孕妇有不同的血红蛋白(3)从BPG的角度解释一下这种情况可能是怎么造成的?4.嘌呤碱基和芳香族氨基酸侧链生物降解的共同点5.三大类营养物质共同的好氧代谢途径6.PCR反应中,(1)检验沉淀中放射性来推测单体掺入量时,用dNTP32在a位P标记的化学基础是什么?(2)如果加的时候漏加了一种dNTP会有什么后果?(3)如果不是在a位P上标记而是在其它位点上标记,有什么后果?7.能够与tRNA相互作用的组分,写出五种以上。

《无机及分析化学》(第四版)教材的编写体会摘要:“无机及分析化学”是为实现课程结构和教学内容整合、优化而由原无机化学和分析化学两大基础课程合并而成的一门基础理论课程。
它又是近化学类专业一门重要的基础课程,是建立相关技术人才整体知识结构、能力结构的重要组成部分。
陈荣三教授主编的《无机及分析化学》是我国最早正式出版的教材,2006年该书的第四版作为普通高等教育“十五”国家级规划教材正式出版。
本文对该书第四版的编写进行了简要介绍。
为适应当前教学改革的形势,编者在修订中遵循“加强基础,趋向前沿,反映现代,注意交叉”的现代课程建设理念,力求与生产实践密切结合。
关键词:无机及分析化学;教材;编写;课程建设;教学对于近化学专业如生命科学、材料、环境、农学、医学及药学等专业的学生而言,学习无机及分析化学课程对他们学习基础知识和专业知识都是不可或缺的。
将无机化学和分析化学两门课程合并为无机及分析化学一门课,经过二十多年的探索和实践已逐渐得到教育界的广泛认可。
由南京大学陈荣三教授主编的《无机及分析化学》是我国最早正式出版的教材,2006年本书的第四版作为普通高等教育“十五”国家级规划教材正式出版。
本文对该教材第四版的编写进行简要介绍,提出一些肤浅的体会和大家交流,以期起到抛砖引玉的作用。
一、《无机及分析化学》教材编写的回顾由陈荣三教授主编、黄孟健教授等人参编的《无机及分析化学》一书,从1975年由南京大学自编讲义,到1978年人民教育出版社作为全国高等学校生物系通用教材正式出版至今已有三十年的历史了,这是1977年恢复高考后国内第一本《无机及分析化学》教材,最初主要供生物系及农医等院校相近专业使用。
它首次将四大滴定融入四大平衡中讲授。
由于生物及相关学科发展的需要,以及全国读者对这本书的厚爱,在教育部有关部门和高等教育出版社的大力支持下,全国许多综合大学和师范院校,如北京大学、南开大学、复旦大学、厦门大学、兰州大学、四川大学、武汉大学、山东大学、暨南大学、西北大学、华东师范大学、南京师范大学、华中师范大学、福建师范大学、河北师范大学等数十所高校任课教师成立了“全国高校‘无机及分析化学’课程建设与教学研讨会”。

Univ. Chem. 2019, 34 (11), 61−67 61收稿:2019-04-11;录用:2019-04-23;网络发表:2019-04-26*通讯作者,Email: xinyongl@基金资助:山东大学2019年教育教学改革研究项目(2019Y278);2017年山东大学齐鲁医学部本科教学改革与研究项目(qlyxjy-201743);山东大学药学院2016年及2017度青年教师教研课题项目•教育专题• doi: 10.3866/PKU.DXHX201904016 药学专业无机化学“课程思政”教学初探展鹏1,蒋小飞2,王艺铭1,兰共德1,刘新泳1,*1山东大学药学院药物化学研究所,化学生物学教育部重点实验室,济南 2500122贵州师范学院化学与材料学院,贵阳 550088摘要:课程思政教学理念有利于发挥高校“立德树人”的根本任务与教师“教书育人”的首要职责。
本文通过多个视角梳理无机化学课程所蕴含的思政教育元素,将之融入课堂教学,以实现专业知识教育与思政教育的有机统一。
关键词:教学方法;课程思政;案例教学中图分类号:G64;O6Application of “Course Ideology and Politics” Education in Teaching Inorganic Chemistry for Pharmacy MajorZHAN Peng 1, JIANG Xiaofei 2, WANG Yiming 1, LAN Gongde 1, LIU Xinyong 1,*1 Key Laboratory of Chemical Biology (Ministry of Education), Department of Medicinal Chemistry, School of Pharmaceutical Sciences, Shandong University, Jinan 250012, P. R. China.2 College of Chemistry and Materials, Guizhou Normal University, Guiyang 550088, P. R. China.Abstract: The concept of "course ideology and politics" in curriculum is extremely beneficial to classroom teaching. This paper combs the elements of ideological and political education contained in inorganic chemistry curriculum from multiple perspectives, and integrates them into classroom teaching so as to achieve the effective integration of professional and ideological and political education.Key Words: Teaching method; Course ideology and politics; Case teaching1 引言课程思政是一种新颖的教学理念,思政教育融入各类课程教学,强化思想理论教育与价值引领,充分挖掘各学科蕴含的思想政治教育资源,探索多元的德育教育途径,从而完成立德树人的根本任务[1,2]。
2003-2004第二学期无机化学试题1答案及评分细则一.写出有关的化学反应方程式并配平(20分)。
每题2分,仅仅写出反应物及产物的化学式而未配平,则得1分;化学式写错不得分。
1.用氢碘酸处理CuO;2HI +CuO=CuI +H2O2.朱砂溶于王水;3HgS +2HNO3+ 12HCl =3H2[HgCl]4+2NO+4H2O+ 3S3.向磷与溴的混合物中滴加水;2P+ 3Br2 + 6H2O2H3PO3+ 6HBr↑4.五硫化二锑溶于烧碱溶液;Sb2S5+8NaOH=Na3SbO4+Na3SbS4+4H2O+Na2S5.光气与氨气反应;4NH3 + COCl2=CO(NH2)2+ 2NH4Cl6.单质磷溶于热烧碱溶液;P4+ 3NaOH + 3H2O= PH3 +3NaH2PO27.氯气通入含有氢氧化铋的烧碱溶液;Cl2+ Bi(OH)3+3NaOH =NaBiO3 +2NaCl+ 3H2O8.砷化氢通入硝酸银溶液;2AsH3+12AgNO3 + 3H2O=As2O3+ 12HNO3+12Ag↓9.向磷酸二氢钠溶液中滴加硝酸银溶液;H2PO4- +3Ag+ = Ag3PO4↓+2H+10.用烧热的铅除去酒中含有的醋酸。
Pb+2HAc=Pb(Ac)2+ H2二.简下列制备路线,并写出有关的反应方程式(30分),每题10分。
1.目前工业上主要采用什么方法生产氢氟酸、盐酸和氢溴酸?如果用H2和Br2直接燃烧法生产HBr而又不降低H Br的产率,实际生产中应采取什么措施?答:氢氟酸主要是通过氟化钙与浓硫酸反应制得:CaF2 + H2SO4 = 2HF+ CaSO4盐酸主要是通过氢气和氯气在光照下反应生成HCl,然后用水吸收:Cl2+ H2光照2HCl氢溴酸主要是通过单质溴和白磷在加热条件下加入水生成HBr,在用水吸收得到:2P+ 3Br2 + 6H2O ∆2H3PO3+ 6HBr↑直接燃烧法由氢气和溴蒸气合成HBr,主要存在的问题是HBr在高温下容易分解,产率较低,而降低温度虽然能提高HBr的产率,但是反应速率太低,无法实现实际上生产。
解决这一矛盾的关键就是寻找、合成专用的催化剂,催化剂的作用就是在较低温度下提高氢气和溴蒸气的反应速率,目前,用于该反应的专用催化剂已经投入实际生产。
2.以硼镁矿为主要原料制备乙硼烷。
①用烧碱溶液浸取硼镁矿Mg2B2O5⋅H2O+ 2 NaOH = 2NaBO2 + 2Mg(OH)2↓②过滤除去Mg(OH)2和其他难溶杂质,然后向滤液中通入CO2调节溶液pH使AlO2-、CrO2-等沉淀为氢氧化物:4NaBO2 + CO2+10H2O = Na2B4O7⋅10H2O +Na2CO3③过滤并将滤液浓缩重结晶得到硼砂,后用H2SO4处理使硼砂转化为难溶于水的硼酸:Na2B4O7 + H2SO4 + 5H2O=4H3BO3↓+Na2SO4④过滤、洗涤、晾干硼酸晶体,加热分解得到B2O32H3BO3∆===B2O3 +3H2O⑤在高压及三氯化铝催化下,用铝和氢气还原B2O3制得乙硼烷B2O3+ 2Al+ 3H2−−→−32Cl Al B2H6+Al2O33.以铬铁矿为主要原料制备铬黄。
(1)高温煅烧4Fe(CrO2)2+ 8Na2CO3+7O2==8Na2CrO4 +2Fe2O3 + 8CO2加入纯碱和白云石使SiO2变为CaSiO3、Al2O3变为NaAlO2。
(2) 水浸、过滤、除渣,滤液用酸调PH =7~8Al(OH)4-+H+=A(OH)3(3)过滤除区Al(OH)3,滤液中加入PbCl2溶液,反应得到铬黄Na2CrO4+ PbCl2=PbCrO4↓+2NaCl 过滤、洗涤、干燥、研磨即可得到黄色颜料铬黄。
三.回答下列问题(40分),每题5分。
1.向Hg2+溶液中加入KI溶液时生成红色HgI2沉淀,继续加入过量的KI溶液,HgI2沉淀溶解得无色的HgI42-配离子溶液。
请说明HgI2有色而HgI42-无色的原因。
答:HgI2产生颜色的原因是Hg2+离子半径较大,具有较强的极化作用和变形性,I-离子同样半径较大变形性较大,因此HgI2中正负离子的相互极化作用很强,导致化学键由离子键向共价键转化,电荷迁移明显,吸收的能量处在可见光范围,当可见光照射时,吸收红色光的互补光,从而显红色。
在HgI42-中中心离子Hg2+的价层电子构型为d10,属于全充满构型,因此中心离子不存在电子的d-d跃迁,基本上不吸收可见光,所以为HgI42-无色。
2.什么是自旋-禁阻跃迁?为什么Mn(H2O)62+配离子几乎是无色的?答:对于d5构型的中心离子来讲,当中心离子与弱场配体形成配合物时,5个价层d电子均匀地分布在每一个d轨道中,自选方向相同,这种状态是一种非常稳定的状态(类似于基态原子d轨道的半充满状态),假如处于低能态轨道的d电子吸收可见光跃迁至高能态轨道,就不可避免地克服电子间的排斥作用在同一轨道中配对,而且电子的自选方向要发生翻转,从理论上讲这种跃迁是自选禁阻的,发生的几率非常低,因此d5构型的中心离子形成的弱场配合物几乎都是无色的。
例如Mn2+与H2O、Cl-等弱场配体形成的配合物基本都是无色的。
这种现象就称之为自旋禁阻。
3.一些顺式铂的配合物可以作为活性抗癌药剂,如cis-PtCl4(NH3)2、cis-PtCl2(NH3)2、cis-PtCl2(en)等。
实验测得它们都是反磁性物质,试用杂化轨道理论说明它们的成键情况,指出它们是内轨型配合物还是外轨型配合物。
答:既然它们都是反磁性物质,说明在其原子中均不存在成单电子,Pt2+离子的价层电子构型为d8,Pt4+离子的价层电子构型为d6,既然各自的配合物均显示反磁性,证明它们都是内轨型配合物。
在cis-PtCl4(NH3)2中中心离子采取d2sp3杂化,Pt4+的6个杂化轨道分别与4个Cl-离子3p轨道和2个NH3分子的sp3杂化轨道重叠形成6个σ键,分子构型为八面体。
在cis-PtCl2(NH3)2、cis-PtCl2(en)中中心离子都是采取dsp2杂化,Pt2+的4个杂化轨道分别与2个Cl-离子3p轨道和2个N原子的sp3杂化轨道重叠形成4个σ键,分子构型为平面四边形。
4.KClO3固态受热,在360℃时出现一吸热过程,500℃时出现一放热过程,580℃时再次放热并显著失重,770℃时又发生一吸热过程。
请加以解释。
在360℃时KClO3熔化吸收热量,表现出吸热过程;500℃时KClO3分解转分化成KCl和KClO4,由于KCl和KClO4键能大、稳定性高,因此表现出放热现象;580℃时KClO4分解生成KCl和O2,再次放热并显著失重;770℃时KCl熔化表现出吸热现象。
5.常见的金属硫化物中,哪些易溶于水?哪些可溶于稀盐酸?哪些可溶于浓盐酸?哪些可溶于硝酸溶液?哪些可溶于王水?答:常见硫化物中,易溶于水的有:Na2S、K2S、(NH4)2S、BaS等;难溶于水,但可溶于稀盐酸的有:FeS、ZnS、MnS等;难溶于稀盐酸,但可溶于浓盐酸的有:SnS、CdS、CoS、NiS、PbS等;难溶于盐酸,但可溶于硝酸的有:Ag2S、CuS、AS2S5、Sb2S5等;难溶于硝酸,但可溶于王水的有:HgS。
试用6种试剂,将下列6种固体从混合物中逐一溶解,每种试剂只能溶解一种物质,并说明溶解次序。
BaCO3,AgCl,KNO3,SnS2,CuS,PbSO4。
答:水溶解KNO3;氨水溶解AgCl:盐酸溶解BaCO3:醋酸溶解PbSO4:硫化钠溶解SnS2;硝酸溶解CuS。
6.写出下列物质主要成分的化学式:毒重石,孔雀石,绿柱石,萤石,天青石。
毒重石BaCO3;孔雀石CuCO3Cu(OH)2;绿柱石3BeO·Al2O3·6H2O;萤石CaF2;天青石SrSO4。
7.分析说明NH3、N2H4、NH2OH、N3H的酸碱性变化规律。
答:由NH3→N2H4→NH2OH→N3H,氨分子NH3中的氢原子逐渐被吸电子作用更强的―NH2、―OH、―N2基团取代,原NH3中N原子上孤电子对的电子云密度逐渐减小,因此碱性逐渐降低,到叠氮酸N3H已经表现出明显的酸性。
8.设计实验方案分离下列离子:Al3+、Cr3+、Fe3+、Zn2+、Hg2+。
答:Al3+、Cr3+、Fe3+、Zn2+、Hg2+↓NaOH(过量)S:Fe(OH)3+HgO↓Al(OH)4-、Cr(OH)63-、Zn(OH)42-↓HCl+ H2S ↓HClAl(OH)3、Cr(OH)3、Zn(OH)2P:S:↓NH3·H2OHgS +S Fe2+A l(OH)3、Cr(OH)3 Z n(NH 3)42+↓Na OH + Cl 2Al(OH)3↓ C rO 42-四.计算题(10分)。
向0.010mol ·dm -3ZnCl 2溶液通H 2S 至饱和,当溶液的pH =1.0时刚好有Zn S沉淀产生。
若在此Zn Cl 2溶液中事先加入1.0mol ·d m-3KCN,再通入H 2S 至饱和,求在多大pH 时会有Zn S沉淀产生?已知K 稳[Zn(CN)42-]=5.0×1016;H 2S 的电离常数:K a 1=1.0×10-8,K a2=1.0×10-15;HC N 电离常数:Ka =6.0×10-10。
答:pH=1.0,[H +]=0.10mol·dm -3,[Zn 2+]=0.010 mol·dm-3ﻫS]H []H []S H [01.0]][S Zn [)ZnS (221222122K K K K K sp =⨯==+-+ﻫ加入KCN 后,设[Zn2+]=x mol·dm -3则ﻫZn 2+ + 4C N- === Zn(CN)42-平衡浓度/ mo l·dm -3 x 1.0-4(0.01-x) 0.01-x4)]01.0(40.1[01.0x x x K s ---= ﻫ 得到191035.2-⨯=x ,即[Zn2+]191035.2-⨯= mol·d m-3ﻫ22211922]H []S H [1035.2]][S [Zn ZnS)(+--+⨯⨯==K K K sp222119221]H []S H [1035.2]S H [+-⨯⨯=K K K K可得[H +]=4.85⨯10-10 mol·dm -3,pH=9.31。
——完——2003-2004第二学期无机化学试题2答案及评分细则一.写出有关的化学反应方程式并配平(20分)。
每题2分,仅仅写出反应物及产物的化学式而未配平,则得1分;化学式写错不得分。