电化学-1电化学基本概念导电机理迁移数电导率讲解
- 格式:ppt
- 大小:1.38 MB
- 文档页数:64


电化学知识点总结一、电化学基础1. 电化学的基本概念电化学是研究电化学反应的科学,它涉及到电流和电势的关系,以及在电化学反应中的能量转换和催化作用。
电化学反应通常发生在电极上,电化学反应的方向与电流的流动方向相反。
2. 电化学的基本原理电化学的基本原理包括电极反应、电解、电荷传递和能量转换等。
在电池中,通过氧化还原反应产生的电能被转化为化学能,进而转化为电能,从而产生电流。
3. 电化学的基本参数电化学的基本参数包括电压、电流、电解、电极电势、电导率、离子迁移速率等。
这些参数是电化学研究的基础,也是电化学应用的基本原理。
二、电化学反应1. 电化学反应的基本类型电化学反应包括氧化还原反应、电解反应、电化学合成反应等。
氧化还原反应是电化学反应中最常见的一种,它涉及到电子的转移,产生电压和电流。
电解反应是电化学反应中电流通过电解质溶液时发生的反应,通常涉及到离子的迁移和溶液中的化学反应。
电化学合成反应是指利用电能进行化学合成反应,通常包括电极合成和电解合成两种方式。
2. 电化学反应的热力学和动力学电化学反应的热力学和动力学是电化学研究的重要内容。
热力学研究电化学反应的热能转化和热能产生的条件,动力学研究电化学反应的速率和电化学动力学理论。
三、电化学动力学1. 电化学反应速率电化学反应速率是指单位时间内电化学反应所产生的物质的变化量。
电化学反应速率与电流和电压密切相关,它是电化学反应动力学研究的关键之一。
2. 催化作用催化作用是指通过催化剂来提高电化学反应速率的现象。
催化剂可以降低反应的活化能,提高反应速率,通常在电化学反应中有着重要的应用。
3. 双电层理论双电层是电极表面和电解质溶液之间的一个电荷层,它对电化学反应速率有着重要的影响。
双电层理论是电化学研究的重要理论之一,它涉及到电极和电解质溶液中的电位差和电荷分布。
4. 交换电流交换电流是指在电化学反应中与电流方向相反的电流,它是电化学反应速率的一个重要参数,也是电化学动力学研究的重要内容。

电化学原理第一章 绪论两类导体: 第一类导体:凡是依靠物体内部自由电子的定向运动而导电的物体,即载流子为自由电子(或空穴)的导体,叫做电子导体,也称第一类导体。
第二类导体:凡是依靠物体内的离子运动而导电的导体叫做离子导体,也称第二类导体。
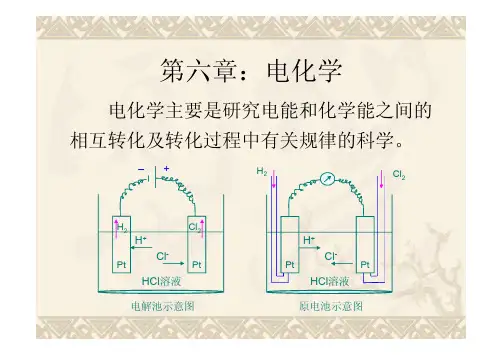
三个电化学体系:原电池:由外电源提供电能,使电流通过电极,在电极上发生电极反应的装置。
电解池:将电能转化为化学能的电化学体系叫电解电池或电解池。
腐蚀电池:只能导致金属材料破坏而不能对外界做有用功的短路原电池。
阳极:发生氧化反应的电极 原电池(-)电解池(+) 阴极:发生还原反应的电极 原电池(+)电解池(-) 电解质分类:定义:溶于溶剂或熔化时形成离子,从而具有导电能力的物质。
分类:1.弱电解质与强电解质—根据电离程度2.缔合式与非缔合式—根据离子在溶液中存在的形态3.可能电解质与真实电解质—根据键合类型 水化数:水化膜中包含的水分子数。
水化膜:离子与水分子相互作用改变了定向取向的水分子性质,受这种相互作用的水分子层称为水化膜。
可分为原水化膜与二级水化膜。
活度与活度系数: 活度:即“有效浓度”。
活度系数:活度与浓度的比值,反映了粒子间相互作用所引起的真实溶液与理想溶液的偏差。
规定:活度等于1的状态为标准态。
对于固态、液态物质和溶剂,这一标准态就是它们的纯物质状态,即规定纯物质的活度等于1。
离子强度I :离子强度定律:在稀溶液范围内,电解质活度与离子强度之间的关系为: 注:上式当溶液浓度小于0.01mol ·dm-3 时才有效。
电导:量度导体导电能力大小的物理量,其值为电阻的倒数。
符号为G ,单位为S ( 1S =1/Ω)。
影响溶液电导的主要因素:(1)离子数量;(2)离子运动速度。
当量电导(率):在两个相距为单位长度的平行板电极之间,放置含有1 克当量电解质的溶液时,溶液所具有的电导称为当量电导,单位为Ω-1 ·cm2·eq-1。


电化学原理知识点————————————————————————————————作者:————————————————————————————————日期:电化学原理第一章 绪论两类导体: 第一类导体:凡是依靠物体内部自由电子的定向运动而导电的物体,即载流子为自由电子(或空穴)的导体,叫做电子导体,也称第一类导体。
第二类导体:凡是依靠物体内的离子运动而导电的导体叫做离子导体,也称第二类导体。
三个电化学体系:原电池:由外电源提供电能,使电流通过电极,在电极上发生电极反应的装置。
电解池:将电能转化为化学能的电化学体系叫电解电池或电解池。
腐蚀电池:只能导致金属材料破坏而不能对外界做有用功的短路原电池。
阳极:发生氧化反应的电极 原电池(-)电解池(+) 阴极:发生还原反应的电极 原电池(+)电解池(-) 电解质分类:定义:溶于溶剂或熔化时形成离子,从而具有导电能力的物质。
分类:1.弱电解质与强电解质—根据电离程度2.缔合式与非缔合式—根据离子在溶液中存在的形态3.可能电解质与真实电解质—根据键合类型 水化数:水化膜中包含的水分子数。
水化膜:离子与水分子相互作用改变了定向取向的水分子性质,受这种相互作用的水分子层称为水化膜。
可分为原水化膜与二级水化膜。
活度与活度系数: 活度:即“有效浓度”。
活度系数:活度与浓度的比值,反映了粒子间相互作用所引起的真实溶液与理想溶液的偏差。
规定:活度等于1的状态为标准态。
对于固态、液态物质和溶剂,这一标准态就是它们的纯物质状态,即规定纯物质的活度等于1。
离子强度I :离子强度定律:在稀溶液范围内,电解质活度与离子强度之间的关系为: 注:上式当溶液浓度小于0.01mol ·dm-3 时才有效。
电导:量度导体导电能力大小的物理量,其值为电阻的倒数。
符号为G ,单位为S ( 1S =1/Ω)。
影响溶液电导的主要因素:(1)离子数量;(2)离子运动速度。



电化学原理知识点 Document number:WTWYT-WYWY-BTGTT-YTTYU-2018GT电化学原理第一章绪论两类导体:第一类导体:凡是依靠物体内部自由电子的定向运动而导电的物体,即载流子为自由电子(或空穴)的导体,叫做电子导体,也称第一类导体。
第二类导体:凡是依靠物体内的离子运动而导电的导体叫做离子导体,也称第二类导体。
三个电化学体系:原电池:由外电源提供电能,使电流通过电极,在电极上发生电极反应的装置。
电解池:将电能转化为化学能的电化学体系叫电解电池或电解池。
腐蚀电池:只能导致金属材料破坏而不能对外界做有用功的短路原电池。
阳极:发生氧化反应的电极原电池(-)电解池(+)阴极:发生还原反应的电极原电池(+)电解池(-)电解质分类:定义:溶于溶剂或熔化时形成离子,从而具有导电能力的物质。
分类:1.弱电解质与强电解质—根据电离程度2.缔合式与非缔合式—根据离子在溶液中存在的形态3.可能电解质与真实电解质—根据键合类型水化数:水化膜中包含的水分子数。
水化膜:离子与水分子相互作用改变了定向取向的水分子性质,受这种相互作用的水分子层称为水化膜。
可分为原水化膜与二级水化膜。
活度与活度系数: 活度:即“有效浓度”。
活度系数:活度与浓度的比值,反映了粒子间相互作用所引起的真实溶液与理想溶液的偏差。
规定:活度等于1的状态为标准态。
对于固态、液态物质和溶剂,这一标准态就是它们的纯物质状态,即规定纯物质的活度等于1。
离子强度I : 离子强度定律:在稀溶液范围内,电解质活度与离子强度之间的关系为: 注:上式当溶液浓度小于·dm-3 时才有效。
电导:量度导体导电能力大小的物理量,其值为电阻的倒数。
符号为G ,单位为S( 1S =1/Ω)。
影响溶液电导的主要因素:(1)离子数量;(2)离子运动速度。
当量电导(率):在两个相距为单位长度的平行板电极之间,放置含有1 克当量电解质的溶液时,溶液所具有的电导称为当量电导,单位为Ω-1 ·cm2·eq-1。

电化学基本概念【电导】描述物体导电性能的物理量,其值是电阻的倒数,单位是“西门子”,用S表示。
某物体的电阻愈小它的电导就愈大。
【电导率】又称比电导。
可用来衡量和比较物体的导电性能。
当物体的长度为1厘米,截面积为1平方厘米时的电导,为该物体的电导率。
对电解质溶液来说,当两电极面积各为1平方厘米,电极相距1厘米时为溶液的电导。
电解质溶液的电导率与电解质的种类、溶液的浓度及温度等有关。
【离子淌度】又称离子迁移率。
某种离子在一定的溶剂中,当电位梯度为每米1伏特时的迁移速率称为此种离子的淌度,单位是米2·秒-1·伏特-1。
离子淌度是代表离子迁移速率特征的物理量。
【离子迁移率】见离子淌度条。
【离子强度】在电解质溶液中离子之间平均静电相互作用的一种量度,常用I表示,其定义式如下:上式的含义是:某电解质溶液的离子强度等于每种离子的质量摩尔浓度mi与其价数Zi平方的乘积之和的一半。
【双电层】在两种不同物体的接触界面上,正负电荷分别排列成的一种面层,例如在金属和电解质溶液相接触的界面上,金属表面电荷层与液溶中的相反电荷的离子层就构成双电层,由于溶液中的离子的热运动,溶液中的一层又分为紧密层和扩散层。
【可逆电池】热力学意义上的可逆电池必须具备两个条件,即可逆电池在充电和放电时不仅物质的转变是可逆的,而且能量的转变也是可逆的。
如果把放电时放出的电能全部储存起来并用它对电池充电,则能恰好使电池内化学反应体系及外界环境全部恢复原状。
一般意义的可逆电池就是指由于放电而被消耗的物质,可以通过充电使之再生的电池,此电池的充电反应恰好是放电反应的逆过程,如常用的铅蓄电池。
【可逆电极】构成可逆电池的电极。
主要有以下三种类型:(1)金属电极、氢电极、氧电极、卤素电极。
金属电极是将金属浸在含有该种金属离子的溶液中构成,以符号M|M2+表示;氢电极、氧电极、氯电极,分别是将被H2、O2、Cl2的气流冲击着的铂片浸入含有H+、OH-、Cl-的溶液中构成,分别用符号(Pt)H2|H+或(Pt)H2|OH-、(Pt)O2|OH-或(Pt)O2|H2O,H+以及(Pt)Cl2|Cl-表示。

材料电化学基础知识点总结一、电化学基础概念电化学是研究电能与化学变化之间相互转化的学科,它是电学和化学的交叉学科。
在电化学中,研究的两个基本方向是电生化学和化学电子学。
1. 电生化学电生化学是研究电场对化学反应速率的影响以及电能转化为化学能的过程。
电生化学是一种通过外加电场来改变化学反应速率的手段,利用外加电场可以调控电化学反应的速率,进而控制电化学反应的过程和产物的选择性。
2. 化学电子学化学电子学是研究化学物质中电子的产生、转移和传递过程以及在这些过程中的电能转化为化学能的过程。
化学电子学研究的主要对象是电子输运和电子转移,即电子在化学反应中的迁移和转移过程。
在电化学中,常用的基本概念包括电位、电流、电解质、电极反应等。
二、电化学反应电化学反应是在外加电压或电场的作用下,在电解质溶液中或者在电极表面发生的化学反应。
电化学反应主要包括两种类型:电解反应和电极反应。
1. 电解反应电解反应是指在外加电压或电场的作用下,将化学反应进行向某一方向的强制进行。
电解反应发生在电解质溶液中,产生电势差,并可导致电解质溶液中发生氧化还原反应。
2. 电极反应电极反应是指电解质溶液中电极上发生的氧化还原反应,包括氧化反应和还原反应。
在电极反应中,外加电压或电场会导致电子在电解质溶液和电解质溶液之间转移,从而产生电流和电势差。
在电化学反应中,有几个重要的概念需要了解:(1)电极势和电动势电极势是指电极表面发生氧化还原反应时的电势。
而电动势是电化学反应全过程中某种能量转化的大小,也是电化学反应的推动力。
(2)过电位过电位是指在电化学反应中,当电极势高于或低于理论电解反应电势的现象。
过电位是电化学反应进行的一个重要参数,也是电化学反应过程中的热力学和动力学参数。
(3)电极极化电极极化是指外加电压或电场作用下,导致电解质溶液中电极发生电位变化的现象。
电极极化可能是由于金属电极的活性变化,导致电解质溶液中的电极反应速率变化。
电化学知识点电化学是研究电与化学之间相互作用的科学领域。
它既涉及物理学中的电学,又包括化学学科中的电化学反应。
电化学的研究对于理解和应用电池、电解、腐蚀等过程具有重要意义。
本文将介绍电化学中的一些基本概念和实践应用。
1. 电化学基础电化学中的两个重要概念是电位和电流。
电位是指物体上的电势差,它描述了正电荷和负电荷之间的相对能量差异。
电路中,当电流通过导体时,就像水流动一样,在形成的闭合回路中,电荷会从一个电极流向另一个电极。
这种电流是电化学反应的结果。
2. 电池和蓄电池电池是将化学能转化为电能的装置,它由两个或多个半电池组成。
半电池是一个化学反应产生电流的半截。
蓄电池则是能够重复充放电的电池,它可以在外部电源未连接时储存能量。
蓄电池的工作原理是将化学反应的产物吸附到电极上,然后再通过反向反应释放能量。
3. 电解和电沉积电解是电化学过程中将化学物质分解为离子的过程。
通过将电流通过液体或熔融的盐,可将阴阳离子分离出来。
而电沉积是指通过电流将离子沉积到一个电极上的过程。
这种过程常用于电镀,可以制备出金属薄膜或改变物体的表面性质。
4. 电化学传感器电化学传感器是利用电化学原理来测量、检测化学物质浓度或气体浓度的传感器。
例如,氧气传感器可通过电反应测量氧气浓度,用于监测空气中的氧含量。
另外,pH传感器可以测量溶液中的酸碱度,用于环境监测和实验室分析。
5. 电化学腐蚀电化学腐蚀是金属或合金遭受化学或电化学反应而受到损害的过程。
当金属与电解质接触时,会发生氧化还原反应,导致金属表面的物质流失。
腐蚀不仅使金属失去外观,还可能降低其机械性能和耐用性。
电化学腐蚀的研究有助于开发新的材料和防腐蚀措施。
6. 超级电容器超级电容器是一种能够高效储存电能的装置。
它与传统电池不同,不通过化学反应来储存能量,而是通过电荷在电极表面的吸附和释放来实现。
超级电容器具有高功率密度、长循环寿命和快速充放电等优点,因此被广泛应用于电子设备、电动车等领域。
·鉴于编者的水平极其有限,错误疏漏在所难免,敬请批评指正电化学基本概念1. 导体(Conductor):能导电的物质称为导体。
有些导体依靠其中的电子传递电流,称为电子导体或第一类导体(如金属,石墨,PbO2、Fe3O4等金属氧化物);有些导体靠离子的移动来实现其导电任务,称为离子导体或第二类导体(如电解质溶液,熔融电解质,固体电解质)。
一般来说,离子导体的导电能力比电子导体小得多。
2. 电极反应(Electrode Reaction):电子导体能够独立地完成导电任务;而要想让离子导体导电,必须有电子导体与之相连接。
但流经两类导体的电荷载体不一样,为了使电流持续不断地通过离子导体,在两类导体界面上必然会有得电子或失电子的反应发生。
这种在两类导体界面界进行的有电子得失的化学反应称为电极反应或电化学反应。
★自发电池 / 电解池3. 阴极(Cathode):电流通过两类导体界面时,使正电荷从电极进入溶液(发生还原反应)的电极。
4. 阳极(Anode):电流通过两类导体界面时,使正电荷从溶液进入电极(发生氧化反应)的电极。
5. 法拉第(Faraday):一摩尔电子的电量。
摩尔常数N A =6.02×1023;每个电子的电量 e 0 = 1.602×10-19库仑(Coulomb);一库仑为一安培·秒(Ampere-second);所以:1法拉第 = 6.02×1023×1.602×10-19≈96500库仑1法拉第 = 6.02×1023×1.602×10-19÷3600≈26.8安时(Ampere-hour)6. 法拉第定律(Faraday Law):在整个电路中各处的电流是相等的,因此电极上通过的电量与电极反应的反应物和反应产物之间有如下的精确关系:若反应为M z + + z e- = M,则生成1摩尔 M 所需的电量为 z 法拉第。