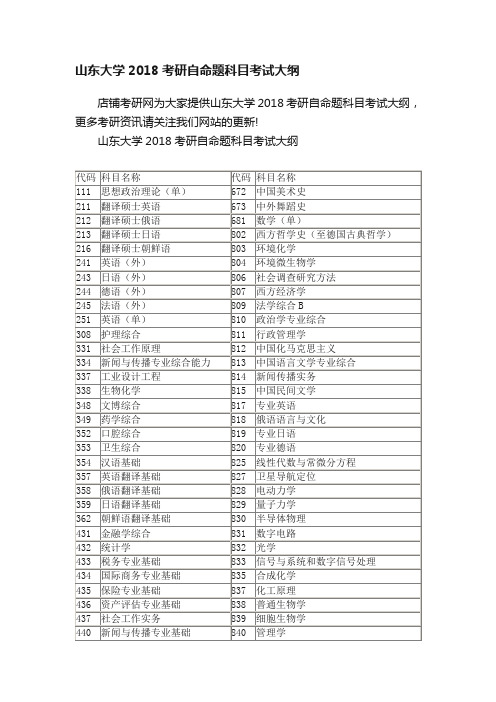
山东大学2018年《629-生物化学(生)》考研大纲_山东大学考研网
- 格式:pdf
- 大小:103.83 KB
- 文档页数:6


629-生物化学(生)一、考试性质生物化学入学考试是为我校生命科学学科招收硕士研究生而进行的水平考试。
通过该门课程的考试以真实反映考生对生物化学基本概念和基本理论的掌握程度以及综合运用所学的知识分析相关问题和解决问题的能力与水平,可以作为我校选拨硕士研究生的重要依据。
二、考试要求生物化学考试旨在考查考生对生物化学基本知识、基本理论的掌握程度,并在考察考生基础理论知识掌握的基础上,注重考查考生运用生物化学基础知识分析问题、解决问题的能力。
三、考试形式与试卷结构1. 考试方式:闭卷,笔试2. 考试时间:180分钟3. 题型主要包括名词解释、判断题、简答题、计算及分析性问答题四、考试内容考试内容将涉及生物化学的如下内容:(1)生物分子的结构、组成、性质和功能;(2)生物分子特别是生物大分子的分离与分析方法;(3)生物体内的能量转化、利用和调节;(4)生物大分子的分解与合成代谢;(5)生物信息分子的复制、转录、表达和调节等基本理论。
并考查学生运用上述知识的综合和分析能力。
各部分的基本内容如下:(一)糖生物化学1. 单糖2. 单糖的结构、性质、构象与构型、变旋3. 寡糖4. 多糖(二)脂类生物化学1. 甘油三酯2. 结构与性质,甘油三脂的皂化值(价)、酸值(价)、碘值(价)、乙酰化值(价)磷脂3. 分类、性质与功能4. 结合酯5. 固醇类化合物(三)蛋白质化学1. 蛋白质的重要功能及元素组成2. 蛋白质的重要功能;3. 蛋白质的元素组成4. 氨基酸5. 氨基酸的结构特点及分类;6. 必需氨基酸;7. 蛋白质的稀有氨基酸8. 非蛋白质氨基酸;9. 氨基酸的性质10. 肽11. 肽键及肽链;12. 肽的命名及结构;13. 天然存在的活性寡肽14. 蛋白质的分子结构15. 蛋白质的一级结构;16. 蛋白质的二级结构17. 超二级结构及结构域18. 蛋白质的三级结构19. 蛋白质的四级结构20. 蛋白质结构与功能的关系21. 蛋白质一级结构与功能的关系22. 蛋白质的空间结构与功能的关系23. 蛋白质的重要性质24. 蛋白质的两性性质和等电点;25. 蛋白质的胶体性质与蛋白质的沉淀26. 蛋白质的变性与复性;27. 蛋白质的颜色反应28. 蛋白质的分类29. 蛋白质的分离提纯及分子量测定30. 蛋白质分离纯化31. 蛋白质分子质量的测定(四)核酸化学1. 核酸的种类与分布2. 核酸的化学组成3. 脱氧核糖核酸4. DNA的碱基组成;5. DNA的一级结构;6. DNA的空间结构;7. DNA的三级结构8. 核糖核酸9. RNA的结构10. 核酸的理化性质11. 一般物理性质;12. 核酸的紫外吸收;13. 核酸的沉降特性;14. 核酸的两性解离及凝胶电泳;15. 核酸的变性与复性(五)酶学1. 酶学概论2. 酶的概念;3. 酶的催化特点;4. 酶的组成;5. 酶的底物专一性6. 酶的命名与分类7. 影响酶促反应速度的因素8. 酶促反应速度的测定;9. 底物浓度对酶促反应速度的影响10. 酶浓度对酶促反应速度的影响;11. 温度对酶反应速度的影响12. pH对酶促反应速度的影响;13. 激活剂对酶促反应速度的影响14. 抑制剂对酶促反应速度的影响15. 酶的作用机理16. 酶的活性中心;17. 酶与底物分子的结合18. 影响酶催化效率的因素19. 别构酶和同工酶及诱导酶(六)维生素与激素1. 维生素的概念与分类;2. 水溶性维生素3. 水溶性维生素与辅酶的关系4. 脂溶性维生素5. 激素6. 激素的概念与分类(七)代谢总论1. 代谢概述2. 代谢中的化学反应机制与代谢类型3. 代谢的研究方法(八)糖类代谢1. 糖的酶促降解2. 糖酵解及调控3. 糖酵解的过程;4. 糖酵解产生的ATP与生物学意义5. 丙酮酸的去路;6. 糖酵解的调控7. 三羧酸循环8. 丙酮酸的氧化脱羧;9. 三羧酸循环的反应过程;10. 三羧酸循环中能量计算;11. 三羧酸循环的生物学意义12. 草酰乙酸的回补反应;13. 三羧酸循环的调控14. 磷酸戊糖途径15. 磷酸戊糖途径的过程;16. 磷酸戊糖途径的生物学意义;17. 磷酸戊糖途径的调控18. 糖的生物合成19. 碳的固定与卡尔文循环20. 葡萄糖的异生作用;21. 糖原与淀粉的合成;(九)生物氧化与氧化磷酸化1. 生物氧化概述2. 电子传递链3. 电子传递链的组成及其功能;4. 电子传递链及其传递体的排列顺序5. 电子传递体复合物的组成;6. 电子传递抑制剂7. 氧化磷酸化作用8. 氧化磷酸化的概念9. 氧化磷酸化的作用机理10. 氧化磷酸化的解偶联剂和抑制剂(十)脂类代谢1. 脂肪的生物降解2. 脂肪的酶促降解3. 甘油的降解及转化4. 脂肪酸的氧化分解5. 脂肪的生物合成6. 甘油的生物合成7. 饱和脂肪酸的从头合成8. 不饱和脂肪酸的合成9. 三酰基甘油的生物合成10. 甘油磷脂的降解与生物合成11. 甘油磷脂的降解;12. 甘油磷脂的生物合成(十一)蛋白质降解和氨基酸代谢1. 蛋白质的酶促降解2. 氨基酸的降解与转化3. 脱氨基作用;4. 脱羧基作用;5. 氨基酸分解产物的去向,尿素循环6. 氨基酸分解与一碳单位代谢7. 氨基酸的生物合成(十二)核酸降解和核苷酸代谢1. 核酸的酶促降解2. 核苷酸的酶促降解3. 核苷酸的降解;4. 嘌呤的降解;5. 嘧啶的降解6. 核苷酸的生物合成7. 核苷酸的补救合成8. 嘌呤核苷酸的从头生物合成;9. 嘧啶核苷酸的从头生物合成;10. 脱氧核糖核苷酸的生物合成;11. 核苷三磷酸的生物合成(十三)核酸的生物合成1. DNA的生物合成2. 半保留复制;3. 逆转录;4. DNA的损伤与修复5. RNA的生物合成6. DNA的转录;7. 转录后加工;8. RNA的复制(十四)蛋白质的生物合成1. 蛋白质合成体系的重要组分2. mRNA与遗传密码;3. tRNA;4. rRNA与核糖体;5. 辅助因子;6. 蛋白质的生物合成过程7. 氨基酸的活化;8. 肽链合成的起始;9. 肽链的延伸;10. 肽链合成的终止与释放11. 多核糖体;12. 真核细胞蛋白质的生物合成13. 肽链合成后的加工、折叠与转运(十五)代谢的调节1. 代谢途径的相互联系2. 糖类代谢与脂类代谢的相互联系3. 糖类代谢与蛋白质代谢的相互联系4. 脂类代谢与蛋白质代谢的相互联系5. 核酸代谢与糖类、脂类和蛋白质代谢的相互联系6. 代谢的调节;7. 酶水平的调节;8. 细胞区域化的调节;9. 能荷对代谢的调节10. 基因表达的调控(十六)综合性内容1. 经典性生物化学实验及其意义;2. 生活中的生物化学;3. 现代生物化学前沿问题的见解与分析;4. 生物化学实验现象的分析。

642-生物化学(医)一、考试目的生物化学是生物化学与分子生物学专业及其它相关专业硕士研究生的入学考试科目之一。
生物化学研究生入学考试是为所招收与生物化学有关专业硕士研究生而实施的具有选拔功能的水平考试。
二、考试要求生物化学与分子生物学是生命科学的基础理论课,要求学生比较系统地理解和掌握生物化学的基本概念和基本理论;掌握各类生化物质的结构、性质、功能及其合成代谢和分解代谢的基本途径和调控方法;理解基因表达、调控和基因工程的基本理论;能综合运用所学的知识分析问题和解决问题。
要求考生能站在学科的前沿,把握学科的进展,灵活运用所学的生物化学知识从分子水平认识和解释生命过程中所发生的现象。
三、考试内容(一)蛋白质的结构与功能1.掌握蛋白质的基本组成单位,20种L-α-氨基酸,熟悉氨基酸的通式与结构特点。
掌握氨基酸的两性解离和紫外吸收性质。
掌握肽键及多肽链的连接方式,了解生物活性肽。
2.掌握蛋白质的分子结构,包括肽单元及一级、二级结构,(α-螺旋、β-折叠、β-转角、无规卷曲),三级、四级结构概念和维持键。
掌握模序、结构域、分子伴侣概念。
3.熟悉蛋白质各级结构与功能关系,熟悉血红蛋白的分子结构。
血红蛋白空间结构与运氧功能关系。
掌握协同效应、别构效应的概念。
4.掌握蛋白质两性电离、亲水胶体、变性、紫外吸收等性质及相关概念,熟悉蛋白质分离纯化方法和依据的性质。
了解多肽链氨基酸测序的原理。
5.熟悉蛋白质组学的概念及研究方法。
(二)核酸的结构与功能1.掌握核苷酸分子组成及结构,DNA、RNA组成的异同。
2.掌握核酸(DNA、RNA)的一级结构,连接键。
3.掌握DNA双螺旋结构模式的要点,DNA的超螺旋结构和功能。
4.掌握tRNA、mRNA、rRNA的组成、结构特点和功能。
5.熟悉以下概念:融解温度、增色效应、DNA变性和复性、核酸分子杂交、探针技术。
(三)酶1.掌握酶的概念;酶的专一性及分类;酶的催化机制。
掌握结合酶、辅酶与辅基的概念;熟悉结合酶中辅酶、金属离子的作用。

研究生《生物化学》考试大纲一、考试总体要求考查目标生物化学是生命科学的重要基础学科和前沿学科,在现代生物学中具有十分重要的地位和作用。
《生物化学》考试在重点考查生物化学的基础知识、基本理论的基础上,注重考查理论联系实际和综合分析能力。
正确地理解和掌握生物化学有关的基本概念、理论、假说、规律和论断;运用掌握的基础理论知识和原理分析和解决生物学的基本问题。
要求考生:①系统准确地掌握生物化学的基本概念、基础知识和基本理论;②比较全面了解生物化学的常用技术的原理、方法和应用范围;③能运用生化技术和知识分析生物学基本问题。
同时考生应了解生物化学及相关领域的重大研究进展。
考查内容(一)蛋白质的结构与功能1、蛋白质的化学组成;2、氨基酸的分类及简写符号;3、氨基酸的理化性质及化学反应;4、氨基酸的分析分离方法;5、肽的结构、性质与生物活性肽;6、蛋白质分子结构:一级、二级、高级结构的概念、主要化学键及形式,包括超二级结构、结构域等;7、蛋白质一级结构测定:多肽链N端和C端氨基酸残基测定的各种方法;蛋白酶、肽段的氨基酸序列测定方法;二硫键的断裂和多肽的分离,二硫键位置的确定,多肽的人工合成等;8、蛋白质的理化性质:包括蛋白质的两性解离和等电点、蛋白质分子的大小、紫外吸收和胶体性质、蛋白质的沉淀作用、蛋白质的变性作用、蛋白质的颜色反应等;9、蛋白质分离纯化和纯度鉴定方法与技术:包括蛋白质的分离纯化的一般原则、蛋白质的分离纯化的方法、蛋白质的分析测定等;10、蛋白质结构与功能的关系:包括一级结构和高级结构与功能的关系,如肌红蛋白、血红蛋白的结构和功能,血红蛋白分子病的机理。
(二)核酸的结构与功能1、核酸的基本化学组成、种类、分布和生物学功能;2、核苷酸的结构——组成、碱基分子式、稀有碱基等;3、DNA的分子结构:DNA的一、二、三级结构的概念和结构特点;核酸的早期研究和双螺旋结构模型的理论依据等;4、RNA的分子结构:包括RNA一级结构、高级结构,如tRNA的二、三级结构,真核生物mRNA 结构特点,tRNA及rRNA的结构、RNA的降解等;5、RNA 的分类及各类RNA的生物学功能,包括各种新发现的小RNA的功能;6、DNA测序方法及其过程;7、核酸及核苷酸的性质:包括溶解性、紫外吸收、核酸及其组分的两性性质;8、核酸的变性、复性与杂交;9、核酸及其组分的分离纯化:包括分离核酸的一般原则、DNA的分离纯化、RNA的分离纯化、核酸组分的分离纯化、核酸及其组分含量的测定、核酸纯度的测定、核苷酸的分离分析鉴定等;10、核酸研究的常用技术和方法:包括核酸凝胶电泳技术、核酸分子印迹与杂交技术、PCR技术等。


2018年硕士研究生入学考试自命题科目考试大纲考试科目代码:[801]考试科目名称:生物化学(学术)一、考核目标试题测试考生是否具备研究生入学的基本条件,选拔优秀研究生;主要测试考生对本学科的基础理论、基本知识和基本技能的掌握程度,考查考生分析问题及解决问题的能力。
二、试卷结构(一)考试时间:180分钟,满分:150分(二)题型结构1、单项选择题:70小题,每小题1分,共70分2、是非题(判断题):20小题,每小题1分,共20分3、多项选择题:30小题,每小题2分,共60分三、考试内容(一)蛋白质的结构与功能氨基酸的结构、性质及分类;蛋白质的基本组成、肽键及多肽链的连接方式;生物活性肽;蛋白质的各级结构;蛋白质的两性解离及变性等;蛋白质结构与功能关系。
分离、纯化蛋白质的一般原理和方法。
(二)核酸的结构与功能核苷酸(包括DNA和RNA)的基本组成及分类;核酸一级结构、DNA双螺旋结构模型、核小体的结构;三种RNA的结构特点与功能;核酸的变性、复性及杂交;DNA的超螺旋结构;其它小分子RNA。
(三)酶酶、核酶的概念;酶的专一性及分类;酶活性中心和必需基团;米氏方程及意义;酶促反应动力学;关键酶、变构酶、同工酶;酶原激活及意义;酶与医学的关系。
(四)维生素常见维生素的活性形式及作用;维生素缺乏导致的疾病。
(五)生物氧化电子传递链的组成、排列顺序;电子传递链分类;底物水平磷酸化与氧化磷酸化及影响氧化磷酸化的因素;ATP合酶结构、ATP合成偶联部位及机理;NADH转运的两种穿梭机制;P/O比值;过氧化物酶、SOD 和加单氧酶。
(六)糖代谢糖酵解的反应过程、关键酶、调节及生理意义;有氧氧化的反应过程、关键酶、调节及生理意义;磷酸戊糖途径的反应过程、关键酶及其生理意义;糖异生的反应过程、关键酶、调节及乳酸循环;糖原合成与分解的基本反应过程、关键酶及其调节;血糖的来源去路以及激素对血糖的调节机理。
(七)脂代谢脂类的生理功能、脂类的消化和吸收、胆汁酸盐及辅脂酶的作用;三酰甘油合成过程、脂肪动员的概念、限速酶及其调节;甘油代谢及脂肪酸β-氧化的反应过程、关键酶及能量生成;脂肪合成过程;酮体的合成、利用及生理意义;脂肪酸合成的原料、关键酶、调节以及必需脂肪酸;胆固醇合成代谢的原料、关键酶及调节;磷脂的分类;血浆脂蛋白分类及组成、载脂蛋白生理功能;四种脂蛋白的代谢概况;高脂蛋白血症的分型及血脂异常。

山大2018年招生硕士学位研究生入学考试《生物化学》试题一、是非题(15分)1、所有单糖都具有还原性。
2、疏水性蛋白的折叠伴随着多肽的熵增,因此在溶液中蛋白质可自发折叠。
3、蛋白质是两性电解质,核酸不是两性电解质。
4、由于DNA的两条链互补,所以两条链的(G+C)百分含量是相同的。
5、酶原激活是酶蛋白构象发生变化的结果。
6、脂肪酸合成与降解都是由多酶体系催化完成的。
7、电子传递抑制剂和解偶联剂,都可阻止电子传递。
8、氨基酸分解过程中,都是先转换成“一碳单位”再进行分解的。
9、转氨酶的作用机制是典型的依次反应机制。
10油脂的皂化值越大,表明组成油脂的脂肪酸碳链越长。
11天然活性蛋白通常比变性蛋白具有抵抗蛋白水解酶的作用。
12CNBr能使Gly-Met-Pro三肽断裂。
13一种能阻止RNA合成的抑制剂通常会立即影响DNA的合成。
14遗传密码的简并性是指一些密码适用于一种以上的氨基酸。
15RNA聚合酶通过终止因子识别终止密码结束转录过程。
二、填空题1、维系蛋白质二级结构的作用力主要是(),维系三级结构的作用力主要是()。
2、酶被底物饱和时,,酶促反应速度与酶的浓度成()比,与底物浓度()。
3、参与磷脂合成的核苷酸是( ),参与多糖合成的核苷酸是()。
4、高等动物的DNA合成是在()水平上进行的,而在原核生物E.coli等外,主要是在()水平上进行的。
5、Asp和Glu是生糖氨基酸,因为它们在转氨脱氨后,分别产生()和()。
6、在膜蛋白中,蛋白质折叠可能的方式是()侧链在外侧,而()侧链彼此相互作用而中和。
7、Southern blotting,Northern blotting和Western blotting分别用于分析()、()、()8、糖酵解中生成的NADH可以通过()系统和()系统通过线粒体内膜进入呼吸链。
9、生物氧化中CO2的生成包括()、()。
10、在一个DNA的复制叉中,一条链是连续合成的,称为(),另一条链的合成是不连续的,称为()。

山东大学招收硕士学位研究生入学考试《生物化学》试题B卷一、名词解释:(每题2 分,共计32 分)回补反应波尔效应受控比糖异生作用丙酮酸羧化支路嘌呤核苷酸循环固定化酶盐溶作用多酶体系皂化值C 值悖理半不连续DNA 复制魔斑减色效应复制子二、判断题(每题1 分,共计30 分)()1.同一种单糖的α-D-型和β-D-型是一对异头物。
()2.存在于动物皮下的胆固醇在日光或紫外光线作用下可生成VD3。
()3.促进蛋白质产生折叠的主要作用力是疏水作用力。
()4.利用还原剂和氧化剂均可拆开二硫键。
()5.加入足够的底物,即使存在非竞争性抑制剂,酶促反应也能达到正常的Vmax。
()6.变构酶的变构中心可与底物结合发挥其催化作用。
()7.Km 值是酶的一个特征性常数,对于一种酶是一个固定值。
()8.维生素K 是与血液凝固有关的一种脂溶性维生素。
()9.胰岛素的作用之一是可以促进细胞的糖异生作用。
()10.凝胶过滤中,分子小的分子首先被洗脱。
()11.每种生物的DNA 都有其特定的碱基组成,但各来源的双链DNA 碱基组成的摩尔比的规律即(A+G)/(T+C)=1是相同的。
()12.若DNA 双螺旋中两条链是反平行关系的,则一条链上的AG 顺序应相当于另一条链上的CT 核苷酸频率相等。
()13.DNA 的热变性是指当T 增到一定值时DNA 的双螺旋结构解开,氢键断裂,此过程是爆发式的。
()14.ATP 是GMP 合成的反应物,GTP 是AMP 合成的反应物,因此这两种三磷酸盐中任何一种缺乏时,都会减少另一种的合成。
()15.在实际工作中,常用二苯胺来测定RNA 含量,用苔黑粉测定DNA 含量。
()16.由次黄嘌呤核苷酸合成腺苷酸的过程中,Asp 提供氨基后,C 骨架转变成延胡索酸。
()17.转录虽无校正系统,但转录过程具有较高的忠实性。
()18.Q 因子的功能增加RNA 合成效率。
( )19.原核生物蛋白质生物合成中肽链延长所需的能量的直接来源是ATP.( )20.1961 年,Monod 和Jacob 提出来原核生物基因调控的操纵子模型。

649-药学专业综合
注意:有机化学为必答部分,分析化学和生物化学任选其中一科作答。
有机化学部分
一、考试目的
《有机化学》是从事药学及相关专业研究人员的必备知识。
《有机化学》考试力求科学、公平、准确、规范地测评考生的有机基础和综合能力,以利于选拔具有发展潜力的优秀人才入学。
二、考试要求
测试考生对于有机化学的基本概念、基本理论、基础知识的掌握情况以及综合运用分析和解决有机化学问题的能力。
三、考试内容
1.有机化学概述
1)有机化合物的特点
2)结构理论、共价键的参数及断裂方式、酸碱理论
3)光谱法测定有机化合物的结构
4)各类化合物的命名
2.烷烃
1)同系列、同分异构现象、结构和构象
2)化学性质(卤代反应和卤代反应机理)
3.环烷烃
1)同分异构、稳定性、结构和构象(环己烷的构象)
2)化学性质(卤代反应、加成反应)
4.立体化学基础
1)对映异构
分子的对称性和手性,对映异构体和构型的表示方法,外消旋体、内消旋体和非对映异构体的概念,构象异构和构型异构。
2)对映异构的合成及化学
手性中心的产生,外消旋体的拆分及烷烃卤代反应的立体化学。
5.烯烃
1)同分异构及构型的表示
2)化学性质
1。

山东大学2010研究生入学考试生物化学真题一、名词解释前手性逆转录酶克立氏循环乙醛酸循环糖异生酶的活性部位切除修复魔斑二、简答1.羊毛用热水洗收缩和丝绸热水洗不收缩的原因2.ATP高能磷酸键的结构基础3.Hb突变后的影响4.Hb分开后不具协同性的原因5.磷脂合成后的共性6.生物大分子代谢的三个阶段7.GTP\ATP\UTP参与生物合成概述8.考查逆转录酶9.计算Keq10.分子生物学的中心法则三、问答1.九肽等电点的计算2.嘌呤和芳香族氨基酸合成的共性3.α螺旋参数的计算4.经典实验5.在大肠杆菌中,所有新合成的DNA看起来都是一段一段的,这种观察结果可能被阐述为DNA的复制前导链和随后链都是不连续复制的,然而在尿嘧啶N-糖基化酶缺陷的大肠杆陆中只有约一半的新和成的DNA是一段一段的,为什么?6.有一种多肽,其侧链上羧基30个(Pk=4.3)、ε-氨基15个(Pk=10),咪睉基有10个(Pk=7),α-羧基Pk=3.5,N-末端氨基Pk=9.5,计算此多肽的PI山东大学2011研究生入学考试生物化学真题名词解释别构酶差向异构酶丝氨酸蛋白酶反竞争性抑制合成酶、合酶凝胶过滤层析乙醛酸循环 Q循环 EMP ω氧化半不连续复制冈崎片段阻遏蛋白外显子中心法则判断透明质酸2.糖苷的结构组成3.胶原蛋白的结构4.血红蛋白的协同效应5.蛋白质的Mr与消光系数的关系-------------------30不记得了简答羊毛用热水洗缩水,丝绸不缩水的原因α螺旋参数计算HMP的意义内含子有无功能,其意义是什么葡萄糖生成的条件别嘌呤醇治疗痛风的原理氨基酸脱氨基的几种方式TCA调节酶丙酮酸脱氢酶复合体如何起总用脂肪酸氧化和载体细胞内核酸的类型、结构、功能DNA复制方向、原料、引物作用、类型DNA双螺旋的依据,为什么适合做遗传物质论述与计算经典填表组蛋白与DNA结合紧密的原因,蛋白质的四级结构EMP的1\3\10步反应的共性,氧化反应?等电点的计算题嘌呤降解与芳香族氨基酸降解的共性PCR实验的原理,各物质的作用,有无引物的区别,退火温度高或低的后果用3H标记DNA 以显示其合成过程,变化。

2018年山东大学理论化学考研大纲硕士研究生入学考试大纲第一篇:2018年山东大学理论化学考研大纲硕士研究生入学考试大纲628理论化学考试大纲一、考试目的:《理论化学》是2014年化学专业硕士研究生入学统一考试的科目之一。
《理论化学》考试要力求反映化学专业硕士学位的特点,科学、公平、准确、规范地测评考生的专业基础素质和综合能力,以利于选拔具有发展潜力的优秀人才入学,为国家科技发展和经济腾飞培养综合素质高、复合型的化学专业人才。
二、考试要求:考生应掌握本科目的基本概念和基础知识,具备对基本概念与基础知识的理解与综合运用能力。
三、考试形式和试卷结构:《理论化学》试卷满分150分。
其中,物理化学(含结构化学)合计100分为必答,另外50分可选择无机化学(50分)或分析化学(含化学分析及仪器分析)(50分)作答。
答题方式为闭卷、笔试。
答题时允许使用计算器。
四、考试内容:物理化学(含结构化学)(100分)该科目大纲共计十九章,其中第一至第十章考题占75分,第十一至第十九章(结构化学部分)考题占25分。
第一章热力学第一定律 1.热力学概论1.1 热力学的目的、内容和方法1.2 热力学基本概念:体系与环境,体系的性质;热力学平衡态和状态函数 2.热力学第一定律2.1 热和功 2.2 热力学能2.3 热力学第一定律的表述与数学表达式3.体积功与可逆过程3.1 等温过程的体积功 3.2 可逆过程与最大功 4.焓与热容4.1 焓的定义4.2 焓变与等压热的关系 4.3 等压热容和等容热容5.热力学第一定律对理想气体的应用 5.1 理想气体的热力学能和焓 5.2 理想气体的Cp与Cv之差 5.3 理想气体的绝热过程6.热力学第一定律对实际气体的应用6.1 节流膨胀与焦耳-汤姆逊效应 7.热力学第一定律对相变过程的应用 8.化学热力学8.1 化学反应热效应等压热效应与等容热效应;反应进度;8.2 赫斯定律与常温下反应热效应的计算:赫斯定律;标准摩尔生成焓与标准摩尔燃烧焓8.3 标准反应焓变与温度的关系—基尔霍夫定律第二章热力学第二定律 1.自发过程的共同特征 2.热力学第二定律 3.卡诺定理 3.1 卡诺循环 3.2 卡诺定理4.过程的热温商与熵函数4.1 可逆过程的热温商与熵函数的概念 4.2 不可逆过程的热温商与体系的熵变 5.过程方向和限度的判据5.1 克劳修斯不等式 5.2 熵增加原理6.△S的计算6.1 简单状态变化过程△S的计算6.2 相变过程△S 的计算7.热力学第二定律的本质与熵的统计意义 7.1 热力学第二定律的本质7.2 熵和热力学概率—玻兹曼公式8.热力学第三定律与规定熵8.1 热力学第三定律 8.2 规定熵8.3 化学反应过程熵变的计算 9.亥姆霍兹自由能与吉布斯自由能9.1 亥姆霍兹自由能及△A判据 9.2 吉布斯自由能及△G判据 10.过程△G的计算与应用 10.1 理想气体等温过程△G的计算 10.2 纯物质相变过程△G的计算 11.热力学关系式11.1 四个热力学基本关系式11.2 对应系数关系式与麦克斯韦关系式第三章化学势 1.溶液组成的表示法 2.偏摩尔量与化学势2.1 偏摩尔量的定义和集合公式2.2 化学势的定义及其与温度、压力的关系 3.稀溶液中两个经验定律3.1 拉乌尔定律 3.2 亨利定律4.混合气体中各组分的化学势 4.1 理想气体的化学势 4.2 非理想气体的化学势5.理想溶液的定义、通性及各组分的化学势5.1 理想溶液的定义及各组分的化学势5.2 理想溶液的通性 6.稀溶液中各组分的化学势 7.稀溶液的依数性 7.1 蒸汽压下降7.2 凝固点下降和沸点上升 7.3 渗透压8.非理想溶液中各组分的化学势与活度的概念第四章化学平衡1.化学反应的等温方程式与标准平衡常数 1.1 化学反应的等温方程式 1.2 标准平衡常数 2.平衡常数的表达式2.1 气相反应的平衡常数的表达式 3.复相化学平衡3.1 平衡常数的表达式 3.2 解离压力4.平衡常数的测定与平衡转化率的计算5.标准生成吉布斯自由能 5.1 标准生成吉布斯自由能5.2 反应的标准吉布斯自由能改变的计算 6.温度、压力及惰性气体对化学平衡的影响6.1 温度对平衡常数影响—标准平衡常数与温度的关系6.2 压力对化学平衡的影响 6.3 惰性气体对化学平衡的影响 7.同时平衡与反应的耦合第五章多相平衡1.多相体系平衡的一般条件 2.克拉贝龙方程 3.相律3.1 独立组分数、自由度 3.2 相律4.单组分体系的相图—水的相图 5.二组分体系的相图及其应用5.1 双液系:理想和非理想完全互溶双液系;杠杆规则与蒸馏原理;部分互溶和不互溶双液系5.2简单低共溶混合物体系5.3形成化合物体系:稳定化合物;不稳定化合物 5.4 完全互溶和部分互溶双液系的相图 6.三组分体系的相图及其应用6.1 等边三角形坐标表示法 6.2 部分互溶的三液体体系 6.3 二盐一水体系第六章统计热力学初步(非必考内容)第七章电化学(一)电解质溶液1、离子的迁移(1)电解质溶液的导电机理、法拉第定律(2)离子的迁移和离子迁移数的概念2、电解质溶液的电导(1)电导、电导率和摩尔电导率(2)电导测定的仪器及方法(3)电导率和摩尔电导率随浓度的变化规律(4)离子独立移动定律及离子摩尔电导率3、电导测定的应用(1)求算弱电解质的电离度及电离平衡常数(2)求算微溶盐的溶解度和溶度积(3)电导滴定4、强电解质的活度和活度系数(1)溶液中离子的活度和活度系数、离子平均活度、离子平均活度系数、离子平均质量摩尔浓度(2)离子强度5、强电解质溶液理论(基本了解)(1)离子氛模型及德拜-尤格尔公式(2)不对称离子氛模型及德拜-尤格尔-盎萨格电导公式(二)可逆电池电动势6、可逆电池(1)可逆电池必须具备的条件(2)可逆电极的种类及电极反应(3)电池电动势的测定(方法原理、所用主要仪器)(4)电池表示式(电池组成及结构的书写惯例)(5)电池表示式与电池反应的―互译‖7、可逆电池热力学(1)可逆电池电动势与浓度的关系A.能斯特(Nernst)公式及其中各参数的意义B.电池标准电动势的测定和求算(2)电池电动势E及其温度系数与电池反应热力学量的关系(3)离子的热力学量8、电极电势(1)电池电动势产生的机理A.电极–溶液界面电势差B.溶液–溶液界面电势差、盐桥(构成及作用)C.电池电动势的产生(2)电极电势A.标准氢电极(构成及规定)B.任意电极电势数值和符号的确定C.电极电势的能斯特(Nernst)公式D.参比电极(种类及作用)9、由电极电势计算电池电动势(1)单液化学电池(2)双液化学电池(3)单液浓差电池(4)双液浓差电池(5)双联浓差电池10、电极电势及电池电动势的应用(1)判断反应趋势(2)求化学反应的平衡常数(3)求微溶盐活度积(4)求离子平均活度系数(5)pH值的测定(6)电势滴定(三)不可逆电极过程11、电极的极化(1)不可逆电极电势(2)电极极化的原因(浓差极化、活化极化)(3)过电势(概念、测量方法及仪器)12、电解时的电极反应(1)阴极反应(2)阳极反应13、金属的腐蚀与防护(1)金属腐蚀现象及原理(2)金属腐蚀的防护措施14、化学电源(1)化学电源定义及种类(2)常用化学电源(锌锰干电池、铅酸蓄电池等)(3)高能电池(锂离子电池、燃料电池等)第八章表面现象与分散系统(一)表面现象1、表面吉布斯函数、表面张力(物理意义)2、纯液体的表面现象(1)附加压力(2)曲率对蒸气压的影响(3)液体的润湿与铺展(4)毛细管现象3、气体在固体表面上的吸附(1)气固吸附(定义、作用)A.气固吸附的类型(物理吸附与化学吸附的比较)B.吸附平衡与吸附量C.吸附曲线的种类及特征(2)朗格缪尔(Langmuir)单分子层吸附等温式A.朗格缪尔气固吸附理论(基本假设、吸附公式推导及应用)(3)BET多分子层吸附等温式(4)其它吸附等温式4、溶液的表面吸附(1)溶液表面的吸附现象A.正吸附、负吸附B.表面活性剂(定义、结构特征)(2)吉布斯吸附公式(3)表面活性剂的吸附层结构(4)表面膜5、表面活性剂及其作用(1)表面活性剂的分类(2)胶束和临界胶束浓度(3)表面活性剂的作用(作用类型、原理及与表面活性剂结构特征的关系)(二)分散系统6、分散系统的分类7、溶胶的光学及力学性质(1)光学性质–丁达尔效应(现象、应用)(2)力学性质–布朗运动(扩散、沉降与沉降平衡)8、溶胶的电性质(1)电动现象(电泳、电渗)(2)溶胶粒子带电的原因(3)溶胶粒子的双电层(4)溶胶粒子的结构(书写或示意图表达)9、溶胶的聚沉和絮凝(1)外加电解质对溶胶聚沉的影响(2)溶胶的相互聚沉(3)大分子化合物对溶胶稳定性的影响10、溶胶的制备与净化方法11、高分子溶液(简单了解)第九章化学动力学基本原理1、化学动力学概论(1)化学动力学的任务及目的(2)化学动力学发展简史(3)反应机理的概念(总反应、基元反应、简单反应、复合反应、反应分子数的概念以及它们之间的关系)2、反应速率和速率方程(1)反应速率的表示方法(2)反应速率的实验测定(化学法和物理法的原理及优缺点)(3)反应速率的经验表达式(4)反应级数的概念(5)质量作用定律及其适用范围(反应级数与反应分子数的关系)(6)速率常数(其单位与反应级数的关系)3、简单级数反应的动力学规律(1)简单级数反应的定义,简单反应与简单级数反应之间的关系(2)一级反应、二级反应、三级反应、零级反应(对应的速率公式及其特点、半衰期公式及特征)4、反应级数的测定(1)积分法(2)微分法(3)过量浓度法(孤立法)5、温度对反应速率的影响(1)阿仑尼乌斯(Arrhenius)经验公式(2)活化能的概念及其实验测定A.活化分子与活化能B.活化能的求算方法(3)阿仑尼乌斯公式的一些应用6、简单碰撞理论(1)简单碰撞理论的基本假设(2)碰撞数、有效碰撞分数的物理意义(3)简单碰撞理论的成功与失败7、过渡态理论(1)势能面的概念及物理意义(2)反应途径、过渡态理论中的活化能(3)过渡态理论的成功与失败8、单分子反应理论(简单了解)第十章复合反应动力学1、典型复合反应动力学(速率公式及动力学特征)(1)对峙反应(可逆反应)(2)平行反应(竞争反应)(3)连串反应(连续反应)2、复合反应近似处理方法(1)稳态近似法(中间产物非常活泼且浓度极低)(2)平衡态近似法3、链反应(1)链反应的三个步骤(2)直链反应(3)支链反应4、反应机理的探索和确定(稳态近似法和平衡态近似法的应用)5、催化反应(1)催化反应的基本原理(催化剂的作用)(2)不同类型的催化反应(均向催化反应、复相催化反应、酶催化反应)6、光化学概要(1)光化学定律、量子效率和能量转换效率、光化学反应(2)光化学与热反应的比较7、快速反应及其研究技术(简单了解)第十一章量子力学基础1、微观粒子的运动特征(1)黑体辐射和能量量子化(2)光电效应和光的波粒二象性(3)原子结构模型及氢原子光谱(4)实物微粒的二象性(5)不确定关系2、量子力学基本假设(1)状态的描述(2)力学量的描述(3)状态方程(4)测量问题(5)态叠加原理3.Schrodinger方程和一维势箱中的粒子4.三维势箱中的粒子第十二章原子结构1、单电子原子的 Schrodinger方程2、单电子原子的 Schrodinger方程的解(1)坐标变换(2)分离变量(3)Φ方程、R方程和Θ方程(4)单电子原子波函数(5)量子数的物理意义(6)波函数和电子云的图形3、电子自旋和Pauli原理4、多电子原子Schrodinger方程及其解5、屏蔽效应和原子轨道能级第十三章原子光谱1、氢原子光谱的精细结构(1)相对论效应(2)电子自旋效应(3)选择定则(4)塞曼效应2、多电子原子的角动量和光谱项符号3、由电子组态求光谱项(1)不等价电子的光谱项(2)等价电子的光谱项4、多电子原子光谱第十四章分子的对称性1、对称操作和对称元素2、对称类型—点群3、分子的对称性及极性4、分子的对称性及旋光性第十五章分子轨道理论1、氢分子离子H2+的结构(1)氢分子离子H2+的Schrodinger方程(2)氢分子离子H2+的Schrodinger方程的解(3)关于积分Sab, Haa和Hab(4)结果的讨论2、分子轨道理论大意3、原子轨道的线性组合和成键三原则4、双原子分子(1)同核双原子分子(2)异核双原子分子5、双原子分子的光谱项6、简单分子轨道(HMO)方法和共轭分子结构7、电荷密度、键级、自由价、分子图和化学活性8、分子轨道对称性守恒原理第十六章价键理论1、海特勒-伦敦法解H2分子2、价键理论大意3、价键理论对一些简单分子的应用4、杂化轨道理论(1)s-p杂化(2)s-p-d等性杂化轨道的简单讨论5、定域分子轨道和离域分子轨道-甲烷第十七章分子光谱1、分子光谱的产生2、跃迁矩3、双原子分子的转动光谱4、双原子分子的振动光谱5、线性AB2(D∝h)型三原子的简正振动6、红外光谱7、拉曼光谱8、核磁共振9、光电子能谱第十八章晶体结构(了解)第十九章 X射线结构分析(了解)无机化学(50分)(一)基本原理1.物质状态:气体、液体、固体(晶体和无定形固体)的基本性质及其变化规律;溶液的组成、浓度、性质;非电解质稀溶液的依数性。

山东大学2014年考研真题(629生物化学)更多真题尽在公主号【生一考研】一、名词解释(共12题,每题2分)1.盐析作用2.超二级结构3.非竞争性抑制作用4.核酶5.必需脂防酸6.Cori 循环7.酮体8.ω氧化9.魔斑10.滚环复制11.增色效应12.限制酶图谱二、是非判断(共30题,每题1分)1.疏水蛋白的折叠是自发进行的,因此该过程必定伴随多肽链熵值的增加。
2.二硫键对蛋白质构象的稳定其重要作用,但是对构象的形成却并不起推动作用。
3.乳糖具有还原性、能成脉,有变旋现象。
用酸或酶水解产生1分子D-半乳糖和1分子D-葡萄糖。
4.当某一氨基酸晶体溶于pH7.0的水中后,所得溶液的pH为8.0,则此氨基酸的等电点必定大于8.0。
5.不同构象的同种蛋白质可通过适当的方法进行分离。
6.抑制剂存在时,酶的活力将达不到最大反应速度Vmax。
7.所有的蛋白质都具有一、二、三、四级结构。
8.最适温度不是酶的特征常数。
9.胶原蛋白是由三条右旋螺旋形成的左旋超螺旋。
10.别构酶的异位效应的特点是异位抑制而不是表现出异位激活。
11.所有来自HMP 途径的还原能(NADPH+H+)都是该循环途径的前三步反应产生的12.糖原合成中,葡萄糖的活性形式是UTPG。
13.AMP是1.6-P2-果糖磷酸酯酶的变构抑制剂。
14.所有脂酸通过β-氧化降解可全部生成乙酰CoA。
15.在胞浆中脂肪酸合成的限速因素是由乙酰CoA羧化酶所催化的一步反应。
16.黄素脱氢酶与黄素氧化酶,两者与电子受体的反应能力是相同的。
17.从甘氨酸转变成丝氨酸时,所转移的甲基来自S-腺苷蛋氨酸。
18.嘧啶核苷酸合成途径的第一个酶是天冬氨酸转氨甲酰基酶,该酶受其终产物CTP的反馈抑制。
19.TCA循环是糖,脂,蛋白三大物质氧化产能的最终共同通路。
20.β位被甲基封锁的脂肪酸(如植烷酸),经α-氧化后即可按β-氧化途径降解。
21.某些碱基存在有酮式和烯醇式两种互变体,但两者在形成氢键能力方面无多大差异。
山东大学2018年《629-生物化学(生)》考研大纲
一、考试性质
生物化学入学考试是为我校生命科学学科招收硕士研究生而进行的水平考试。
通过该门课程的考试以真实反映考生对生物化学基本概念和基本理论的掌握程度以及综合运用所学的知识分析相关问题和解决问题的能力与水平,可以作为我校选拨硕士研究生的重要依据。
二、考试要求
生物化学考试旨在考查考生对生物化学基本知识、基本理论的掌握程度,并在考察考生基础理论知识掌握的基础上,注重考查考生运用生物化学基础知识分析问题、解决问题的能力。
三、考试形式与试卷结构
1.考试方式:闭卷,笔试
2.考试时间:180分钟
3.题型
主要包括名词解释、判断题、简答题、计算及分析性问答题
四、考试内容
考试内容将涉及生物化学的如下内容:(1)生物分子的结构、组成、性质和功能;(2)生物分子特别是生物大分子的分离与分析方法;(3)生物体内的能量转化、利用和调节;(4)生物大分子的分解与合成代谢;(5)生物信息分子的复制、转录、表达和调节等基本理论。
并考查学生运用上述知识的综合和分析能力。
各部分的基本内容如下:
(一)糖生物化学
1.单糖
2.单糖的结构、性质、构象与构型、变旋
3.寡糖
4.多糖
(二)脂类生物化学
1.甘油三酯
2.结构与性质,甘油三脂的皂化值(价)、酸值(价)、碘值(价)、乙酰化值(价)磷脂
3.分类、性质与功能
4.结合酯
5.固醇类化合物
(三)蛋白质化学
1.蛋白质的重要功能及元素组成
2.蛋白质的重要功能;
3.蛋白质的元素组成
4.氨基酸
5.氨基酸的结构特点及分类;
6.必需氨基酸;
7.蛋白质的稀有氨基酸
8.非蛋白质氨基酸;
9.氨基酸的性质
10.肽
11.肽键及肽链;
12.肽的命名及结构;
13.天然存在的活性寡肽
14.蛋白质的分子结构
15.蛋白质的一级结构;
16.蛋白质的二级结构
17.超二级结构及结构域
18.蛋白质的三级结构
19.蛋白质的四级结构
20.蛋白质结构与功能的关系
21.蛋白质一级结构与功能的关系
22.蛋白质的空间结构与功能的关系
23.蛋白质的重要性质
24.蛋白质的两性性质和等电点;
25.蛋白质的胶体性质与蛋白质的沉淀
26.蛋白质的变性与复性;
27.蛋白质的颜色反应
28.蛋白质的分类
29.蛋白质的分离提纯及分子量测定
30.蛋白质分离纯化
31.蛋白质分子质量的测定
(四)核酸化学
1.核酸的种类与分布
2.核酸的化学组成
3.脱氧核糖核酸
4.DNA的碱基组成;
5.DNA的一级结构;
6.DNA的空间结构;
7.DNA的三级结构
8.核糖核酸
9.RNA的结构
10.核酸的理化性质
11.一般物理性质;
12.核酸的紫外吸收;
13.核酸的沉降特性;
14.核酸的两性解离及凝胶电泳;
15.核酸的变性与复性
(五)酶学
1.酶学概论
2.酶的概念;
3.酶的催化特点;
4.酶的组成;
5.酶的底物专一性
6.酶的命名与分类
7.影响酶促反应速度的因素
8.酶促反应速度的测定;
9.底物浓度对酶促反应速度的影响
10.酶浓度对酶促反应速度的影响;
11.温度对酶反应速度的影响
12.pH对酶促反应速度的影响;
13.激活剂对酶促反应速度的影响
14.抑制剂对酶促反应速度的影响
15.酶的作用机理
16.酶的活性中心;
17.酶与底物分子的结合
18.影响酶催化效率的因素
19.别构酶和同工酶及诱导酶
(六)维生素与激素
1.维生素的概念与分类;
2.水溶性维生素
3.水溶性维生素与辅酶的关系
4.脂溶性维生素
5.激素
6.激素的概念与分类
(七)代谢总论
1.代谢概述
2.代谢中的化学反应机制与代谢类型
3.代谢的研究方法
(八)糖类代谢
1.糖的酶促降解
2.糖酵解及调控
3.糖酵解的过程;
4.糖酵解产生的ATP与生物学意义
5.丙酮酸的去路;
6.糖酵解的调控
7.三羧酸循环
8.丙酮酸的氧化脱羧;
9.三羧酸循环的反应过程;
10.三羧酸循环中能量计算;
11.三羧酸循环的生物学意义
12.草酰乙酸的回补反应;
13.三羧酸循环的调控
14.磷酸戊糖途径
15.磷酸戊糖途径的过程;
16.磷酸戊糖途径的生物学意义;
17.磷酸戊糖途径的调控
18.糖的生物合成
19.碳的固定与卡尔文循环
20.葡萄糖的异生作用;
21.糖原与淀粉的合成;
(九)生物氧化与氧化磷酸化
1.生物氧化概述
2.电子传递链
3.电子传递链的组成及其功能;
4.电子传递链及其传递体的排列顺序
5.电子传递体复合物的组成;
6.电子传递抑制剂
7.氧化磷酸化作用
8.氧化磷酸化的概念
9.氧化磷酸化的作用机理
10.氧化磷酸化的解偶联剂和抑制剂(十)脂类代谢
1.脂肪的生物降解
2.脂肪的酶促降解
3.甘油的降解及转化
4.脂肪酸的氧化分解
5.脂肪的生物合成
6.甘油的生物合成
7.饱和脂肪酸的从头合成
8.不饱和脂肪酸的合成
9.三酰基甘油的生物合成
10.甘油磷脂的降解与生物合成
11.甘油磷脂的降解;
12.甘油磷脂的生物合成
(十一)蛋白质降解和氨基酸代谢
1.蛋白质的酶促降解
2.氨基酸的降解与转化
3.脱氨基作用;
4.脱羧基作用;
5.氨基酸分解产物的去向,尿素循环
6.氨基酸分解与一碳单位代谢
7.氨基酸的生物合成
(十二)核酸降解和核苷酸代谢
1.核酸的酶促降解
2.核苷酸的酶促降解
3.核苷酸的降解;
4.嘌呤的降解;
5.嘧啶的降解
6.核苷酸的生物合成
7.核苷酸的补救合成
8.嘌呤核苷酸的从头生物合成;
9.嘧啶核苷酸的从头生物合成;
10.脱氧核糖核苷酸的生物合成;
11.核苷三磷酸的生物合成
(十三)核酸的生物合成
1.DNA的生物合成
2.半保留复制;
3.逆转录;
4.DNA的损伤与修复
5.RNA的生物合成
6.DNA的转录;
7.转录后加工;
8.RNA的复制
(十四)蛋白质的生物合成
1.蛋白质合成体系的重要组分
2.mRNA与遗传密码;
3.tRNA;
4.rRNA与核糖体;
5.辅助因子;
6.蛋白质的生物合成过程
7.氨基酸的活化;
8.肽链合成的起始;
9.肽链的延伸;
10.肽链合成的终止与释放
11.多核糖体;
12.真核细胞蛋白质的生物合成
13.肽链合成后的加工、折叠与转运
(十五)代谢的调节
1.代谢途径的相互联系
2.糖类代谢与脂类代谢的相互联系
3.糖类代谢与蛋白质代谢的相互联系
4.脂类代谢与蛋白质代谢的相互联系
5.核酸代谢与糖类、脂类和蛋白质代谢的相互联系
6.代谢的调节;
7.酶水平的调节;
8.细胞区域化的调节;
9.能荷对代谢的调节
10.基因表达的调控
(十六)综合性内容
1.经典性生物化学实验及其意义;
2.生活中的生物化学;
3.现代生物化学前沿问题的见解与分析;
4.生物化学实验现象的分析
文章来源:文彦考研。